Los efectos de la variación del tamaño de las suturas en la sutura de la pared abdominal canina
Reacción biomecánica y tisular: los efectos de la variación del tamaño de las suturas en la sutura de la pared abdominal canina
 Shuai Li
Shuai Li  Yizhe Guo Xingkai Zhao
Yizhe Guo Xingkai Zhao 
 Dong Lang
Dong Lang  Zhenlei Zhou*
Zhenlei Zhou*- Facultad de Medicina Veterinaria, Universidad Agrícola de Nanjing, Nanjing, China
Objetivo: Las suturas de mayor diámetro pueden proporcionar suficiente resistencia a la tracción a las incisiones quirúrgicas, pero pueden exacerbar la respuesta inflamatoria causada por la cantidad de material extraño implantado. Este experimento tiene como objetivo investigar las diferencias en la estabilidad biomecánica y la reactividad tisular después de suturar incisiones abdominales de la línea media canina con diferentes tamaños de sutura.
Método: Evaluación de las diferencias biomecánicas entre las suturas USP 2-0, 3-0 y 4-0 PGA mediante ensayos de tracción uniaxial en la piel de la línea media canina ex vivo y los tejidos musculares fasciales utilizando una técnica continua simple o interrumpida simple. Se midieron los niveles de expresión de ARNm y proteínas de los factores inflamatorios mediante RT-PCR y ELISA. La reactividad tisular se evaluó mediante un sistema de puntuación semicuantitativo.
Resultado: Para las cepas por debajo del 30% en la piel y por debajo del 50% en el músculo, no hubo diferencias significativas entre los grupos. Los resultados de las pruebas biomecánicas de la piel mostraron que el grupo de sutura USP 4-0 PGA demostró una resistencia máxima a la tracción significativamente menor en comparación con los grupos de sutura USP 2-0 PGA o USP 3-0 PGA. Sin embargo, siguió siendo capaz de proporcionar al menos 56,3 N (1,03 MPa) de resistencia a la tracción para incisiones en la piel canina, coincidiendo con los requisitos de resistencia a la tracción de las incisiones quirúrgicas generales de la pared abdominal canina. Además, no se observaron diferencias estadísticamente significativas en la resistencia máxima a la tracción entre los diferentes tamaños de suturas según los datos de las pruebas biomecánicas en el músculo. Las suturas de mayor diámetro condujeron a un aumento de los niveles de factores inflamatorios (IL-1β, IL-6, TNF-ɑ) y de la reactividad tisular. Las suturas interrumpidas simples causaron niveles más altos de factores inflamatorios en el tejido muscular en comparación con las suturas continuas simples.
Conclusión: Las suturas USP 4-0 PGA proporcionan suficiente estabilidad biomecánica para suturar la piel abdominal canina y la línea alba. El tamaño de la sutura influye significativamente en la reactividad tisular después de la sutura, ya que las suturas de menor calibre reducen la respuesta inflamatoria tisular temprana. Por lo tanto, la sutura USP 4-0 PGA tiene más ventajas que la sutura de incisiones quirúrgicas abdominales caninas.
1. Introducción
Aunque la cirugía laparoscópica se ha aplicado cada vez más en los últimos años, la cirugía abierta sigue siendo la opción principal en muchas cirugías complejas que requieren un campo de visión más amplio en la clínica de pequeños animales. El enfoque más común para la cirugía abierta implica una incisión en la línea media del abdomen, que implica el corte y la sutura de la piel y la línea alba. La mala cicatrización postoperatoria de las heridas es una complicación común después de los procedimientos quirúrgicos, que se manifiesta como hernia incisional, dehiscencia de la herida y cicatrización hipertrófica (1). Estas complicaciones no solo se traducen en un aumento de los gastos de atención y tratamiento postoperatorio, sino que también representan amenazas significativas para la vida y la salud de los pacientes postoperatorios, independientemente de si se trata de una hernia incisional o de la dehiscencia de la herida, que se asocian con altas tasas de morbilidad y mortalidad (2, 3).
La cicatrización subóptima de las heridas quirúrgicas está influenciada por múltiples factores, como la técnica de sutura (4), la infección (5), la inflamación (6), la anemia (7), la diabetes (8) y la obesidad (9). La cicatrización de tejidos abarca una serie de eventos biológicos interconectados, como la coagulación, la inflamación, la proliferación y la remodelación (10). La inflamación desempeña un papel fundamental en el proceso de cicatrización de heridas, sirviendo como un componente necesario para la hemostasia y el reclutamiento de células inmunitarias inespecíficas. Protege el organismo contra la invasión patógena y facilita la eliminación del tejido necrótico (11). Sin embargo, numerosos estudios han indicado que la inflamación excesiva puede provocar daños en los tejidos, lo que provoca un retraso en la cicatrización (12, 13) y la formación de cicatrices (14, 15). La administración de agentes antiinflamatorios ha demostrado un potencial significativo para reducir los niveles de inflamación de las heridas y promover la cicatrización (16, 17). Los estudios de Dovi et al. (18) demostraron que la depleción de neutrófilos acelera la cicatrización de heridas dérmicas de espesor completo. Además, los ratones knockout PU-1 (que carecían de macrófagos y neutrófilos funcionales) mostraron cicatrices mínimas después de la cicatrización de heridas (19), lo que indica que los neutrófilos y macrófagos pueden no ser indispensables para la cicatrización de heridas, y su ausencia podría facilitar la cicatrización sin cicatrices. En particular, el tejido fetal exhibe una rápida curación sin cicatrices, lo que podría atribuirse a niveles considerablemente más bajos de inflamación en comparación con el tejido adulto (20, 21). Además, los tejidos conocidos por su menor propensión a la formación de cicatrices, como la mucosa oral y la córnea, muestran una disminución de la acumulación de células polimorfonucleares y la expresión de mediadores inflamatorios durante la fase de cicatrización de la herida (22, 23). Por lo tanto, atenuar la respuesta inflamatoria en el sitio de la herida, particularmente prevenir la aparición de inflamación adicional, juega un papel crucial para evitar resultados subóptimos de cicatrización de heridas.
La sutura de las incisiones quirúrgicas es necesaria, ya que el uso de hilos quirúrgicos proporciona un soporte mecánico adecuado, acercando los bordes de la incisión. Esto, a su vez, acorta la fase inflamatoria y reduce la formación de cicatrices durante el proceso de curación. Sin embargo, existe una paradoja: todos los materiales de sutura son materiales extraños que pueden provocar una respuesta inmunitaria local en los tejidos circundantes. En consecuencia, la inflamación adicional causada por las suturas puede prolongar potencialmente la etapa inflamatoria y el tiempo de cicatrización de la herida, lo que conduce a resultados adversos como la dehiscencia de la herida y la cicatrización hipertrófica (24). En la actualidad, existe un enfoque generalizado en las diferencias de reactividad tisular causadas por los materiales de sutura, que van desde el polipropileno relativamente inerte hasta el catgut altamente inflamatorio (25). Sin embargo, la escasa literatura ha abordado el impacto de las diferencias en el diámetro de la sutura en la respuesta inflamatoria resultante del volumen de material de sutura implantado.
Los cirujanos suelen seleccionar las suturas en función de su experiencia, pero las investigaciones indican que, en la mayoría de los casos, los cirujanos pueden sobrestimar los requisitos de tensión de los tejidos que se van a suturar, lo que resulta en el uso de agujas e hilos de sutura de mayor tamaño (26, 27). Los estudios han demostrado que el uso clínico de suturas USP 2-0 puede proporcionar suficiente estabilidad, lo que resulta en una incidencia del 0% de hernia incisional en 356 casos humanos de cierre de la línea media abdominal (28). Al seleccionar agujas e hilos de sutura, se debe elegir el tamaño más pequeño que logre el propósito previsto de sutura para minimizar el trauma tisular y la implantación de materiales extraños. Sin embargo, las suturas de menor tamaño implican una menor resistencia a la tracción, lo que requiere que los cirujanos logren un equilibrio entre la tensión de la sutura y la implantación de materiales extraños (29). Se necesita más investigación para investigar las especificaciones óptimas de las agujas e hilos de sutura para los profesionales quirúrgicos y para determinar si los diferentes tamaños de sutura dan lugar a diferencias significativas en la biomecánica tisular y la reactividad tisular después del cierre tisular. Este estudio se centra en la clínica de animales de compañía y tiene como objetivo explorar las variaciones en la biomecánica tisular y la reactividad tisular después del cierre de la incisión abdominal canina utilizando hilos de sutura USP 2-0, 3-0 y 4-0 de uso común. Nuestra hipótesis es que las agujas e hilos de sutura más pequeños pueden dar lugar a reacciones tisulares más bajas al tiempo que proporcionan suficiente estabilidad mecánica. Por lo tanto, las agujas de sutura más pequeñas y los hilos para el cierre de la pared abdominal representan una opción de sutura quirúrgica más prometedora.
2. Método
2.1. Estudio biomecánico
Para las pruebas biomecánicas, se prepararon 14 muestras de músculos y piel de la fascia abdominal canina. Se recolectaron y congelaron durante un período de varios meses de perros que pesaban entre 5 y 15 kg. Dentro de las 12 h posteriores al inicio del proceso de descongelación, las muestras se dividieron y midieron a temperatura ambiente. Las muestras originales se cortaron en bloques de tejido de 3 × 10 cm, con 3 cm paralelos a la línea media del abdomen y 5 cm a cada lado de la línea media. Para evitar que se sequen, las muestras de prueba se cubrieron con paños humedecidos. Antes de realizar las pruebas biomecánicas, los bloques de tejido se sometieron a incisiones a lo largo de la línea media del abdomen, luego la incisión se opuso aleatoriamente solo con (a) patrón de sutura interrumpida simple con sutura USP 2-0, (b) patrón de sutura continua simple con sutura USP 2-0, (c) patrón de sutura interrumpida simple con sutura USP 3-0, (d) patrón de sutura continua simple con sutura USP 3-0, (e) patrón de sutura interrumpida simple con sutura USP 4-0, (f) patrón de sutura continua simple con sutura USP 4-0. Cada tratamiento combinado de sutura se realizó cuatro veces. Todas las incisiones fueron creadas y suturadas por el mismo veterinario. La técnica de sutura utilizó una sutura pequeña (3-5 mm) con una relación entre la longitud de la sutura y la longitud de la incisión (SL:WL) de 4:1. Las muestras del grupo control no se sometieron a incisión y sutura en la línea media antes de la prueba biomecánica.
Los experimentos biomecánicos utilizaron una máquina de ensayos mecánicos LLOYD LR10K plus equipada con una célula de carga de 1.000 N. Las muestras de prueba se aseguraron al probador de tracción siguiendo la representación en la Figura 1B. En su posición inicial, las muestras se mantuvieron en su extensión natural, sin la adición de tensión adicional. El espesor de la muestra, la longitud de sujeción y el ancho se midieron utilizando un calibrador vernier. El software de medición aplicó una tensión de precarga de 0,1 N/mm y registró los valores de tensión correspondientes al 10%, 20%, 30%, 40% y 50% de deformación, junto con los valores de tensión y deformación a la fuerza máxima de tracción. El proceso de estiramiento implicó documentar los tipos de puntos finales, abarcando la rotura de la sutura, la ruptura de los tejidos suturados y otros casos de desgarro del tejido.
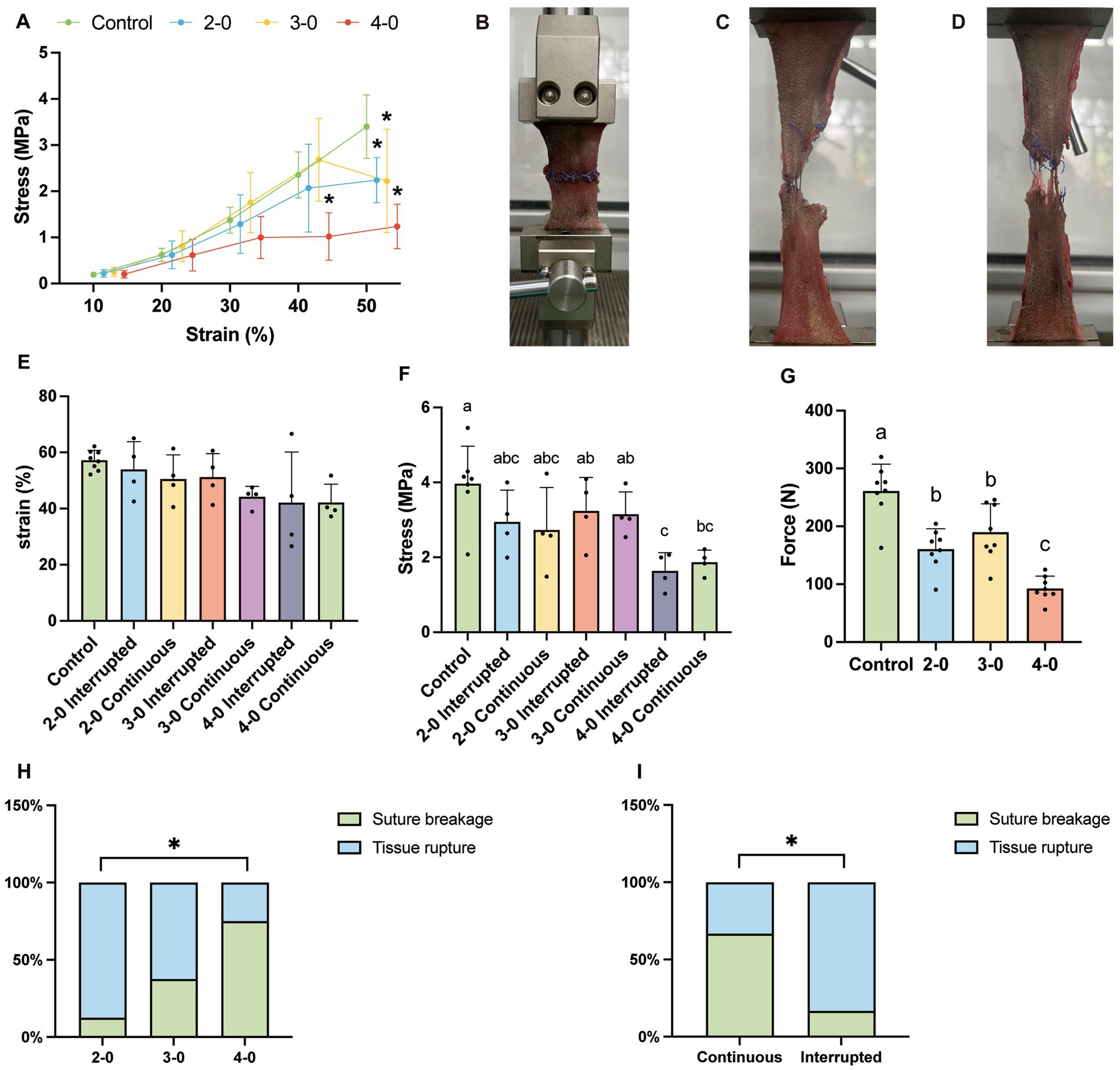 Figura 1. Ensayo de tracción uniaxial de tejido cutáneo canino in vitro. 2-0, 3-0 y 4-0 se refieren a USP 2-0 PGA, USP 3-0 PGA y USP 4-0 PGA, respectivamente. «Interrumpida» denota suturas interrumpidas simples. «Continuo» representa suturas continuas simples. Todas las abreviaturas son las mismas que se indican a continuación. (A) Curva tensión-deformación. p < 0,05 (grupos experimentales vs. grupo control). (B) El estado inicial de la piel fijada al probador de tracción. (C) Rotura de suturas bajo alta tensión. (D) Ruptura de tejido en el sitio de suturas de piel bajo alta tensión. (E) Tensión del tejido a la máxima resistencia a la tracción de la piel. (F) Valor de tensión a la máxima resistencia a la tracción de la piel. (G) Máxima resistencia a la tracción de la piel. Dos grupos sin letras iguales indican que existen diferencias significativas, p < 0,05. (H) El criterio de valoración del fracaso de la sutura con agujas e hilos de sutura de diferentes tamaños (prueba exacta de Fisher, p < 0,05). (I) El criterio de valoración del fracaso de la sutura con diferentes métodos de sutura (prueba exacta de Fisher, p < 0,05).***
Figura 1. Ensayo de tracción uniaxial de tejido cutáneo canino in vitro. 2-0, 3-0 y 4-0 se refieren a USP 2-0 PGA, USP 3-0 PGA y USP 4-0 PGA, respectivamente. «Interrumpida» denota suturas interrumpidas simples. «Continuo» representa suturas continuas simples. Todas las abreviaturas son las mismas que se indican a continuación. (A) Curva tensión-deformación. p < 0,05 (grupos experimentales vs. grupo control). (B) El estado inicial de la piel fijada al probador de tracción. (C) Rotura de suturas bajo alta tensión. (D) Ruptura de tejido en el sitio de suturas de piel bajo alta tensión. (E) Tensión del tejido a la máxima resistencia a la tracción de la piel. (F) Valor de tensión a la máxima resistencia a la tracción de la piel. (G) Máxima resistencia a la tracción de la piel. Dos grupos sin letras iguales indican que existen diferencias significativas, p < 0,05. (H) El criterio de valoración del fracaso de la sutura con agujas e hilos de sutura de diferentes tamaños (prueba exacta de Fisher, p < 0,05). (I) El criterio de valoración del fracaso de la sutura con diferentes métodos de sutura (prueba exacta de Fisher, p < 0,05).***
2.2. Animales
En este experimento participaron un total de 27 beagles adultos con un peso medio de 13,4 ± 1,48 kg. Todos los experimentos con animales se llevaron a cabo en el Centro de Animales Experimentales de la Universidad Agrícola de Nanjing. El Comité de Ética Animal de la Universidad Agrícola de Nanjing aprobó el experimento (número de aprobación: NJAU No. 20230123014), asegurando el cumplimiento de todas las regulaciones éticas relevantes para la experimentación e investigación con animales. Se proporcionó un período preexperimental de 2 semanas para permitir que los animales se aclimataran al medio ambiente. Los animales fueron alojados individualmente en jaulas bajo un ciclo de 12 h de luz/12 h de oscuridad dentro de la instalación de animales. Cada perro experimental recibió una dieta comercial completa y el acceso a agua potable estuvo disponible en todo momento. Los cuidadores monitorearon la salud general y la actividad de los perros a diario. A lo largo del experimento, no ocurrieron eventos inesperados que comprometieran la seguridad y el bienestar de los perros. En los criterios de valoración designados, los perros fueron sacrificados mediante inyección intravenosa de 200 mg/kg de solución sódica de pentobarbital de acuerdo con las Directrices AVMA para la eutanasia de animales de 2020 (30).
2.3. Protocolo animal
Para investigar si existen diferencias significativas en las reacciones tisulares después de suturar incisiones quirúrgicas de la pared abdominal canina con diferentes tamaños de sutura, se seleccionaron tres tipos de suturas (USP 2-0, 3-0 y 4-0 PGA) producidas por China HaiDiKe Company para el experimento. Las incisiones en perros se cerraron aleatoriamente solo con (a) patrón de sutura interrumpida simple con sutura USP 2-0, (b) patrón de sutura continua simple con sutura USP 2-0, (c) patrón de sutura interrumpida simple con sutura USP 3-0, (d) patrón de sutura continua simple con sutura USP 3-0, (e) patrón de sutura interrumpida simple con sutura USP 4-0, (f) patrón de sutura continua simple con sutura USP 4-0. Cada tratamiento combinado de sutura se realizó cuatro veces.
La analgesia preoperatoria y la sedación se manejaron mediante inyección subcutánea de meloxicam (0,2 mg/kg), inyección intramuscular de bupropión (0,2 mg/kg) y dexmedetomidina (15 mcg/kg). Se inyectó propofol (5 mg/kg) por vía intravenosa para inducir la anestesia en perros. Se estableció el acceso a la vía aérea y se mantuvo la anestesia con isoflurano. La anestesia local se realizó mediante inyección subcutánea de lidocaína al 0,5% en el sitio quirúrgico. Después de la anestesia, se emplearon técnicas estériles y se realizaron tres incisiones intermitentes con una longitud de 3 cm a lo largo de la línea media del abdomen, comenzando 3 cm después de la apófisis xifoides, con un espaciamiento de 1-2 cm entre cada par de incisiones. Se aseguró que cada incisión entrara en la cavidad abdominal después de diseccionar la línea alba. Estas incisiones intermitentes tenían como objetivo evitar la interferencia mutua de la inflamación causada por diferentes materiales de sutura en diferentes incisiones después del cierre. Las tres incisiones de cada animal de experimentación fueron suturadas por el mismo cirujano mediante sutura simple interrumpida o simple continua. La sutura siguió una técnica de puntada pequeña (3-5 mm) con un SL:WL de 4:1. Se alternaron diferentes especificaciones de sutura entre diferentes animales para incisiones en diferentes lugares para minimizar el impacto de la posición de la herida en la cicatrización. El meloxicam (0,1 mg/kg) se inyectó por vía subcutánea diariamente durante 5 días consecutivos después de la cirugía.
Durante el experimento, los animales de experimentación fueron observados diariamente en busca de signos de dehiscencia de la herida, hernia incisional, infección de la herida y la apariencia de la piel después de la sutura. Las muestras de piel se recogieron a los 1 día, 7 días y 14 días después de la sutura. Las muestras de Linea alba se recolectaron a 1 día, 7 días y 3 meses después de la sutura. Cada muestra se dividió en alícuotas y se almacenó en tubos de congelación y fijadores tisulares para la detección de los niveles de expresión del factor inflamatorio y la evaluación histológica, respectivamente.
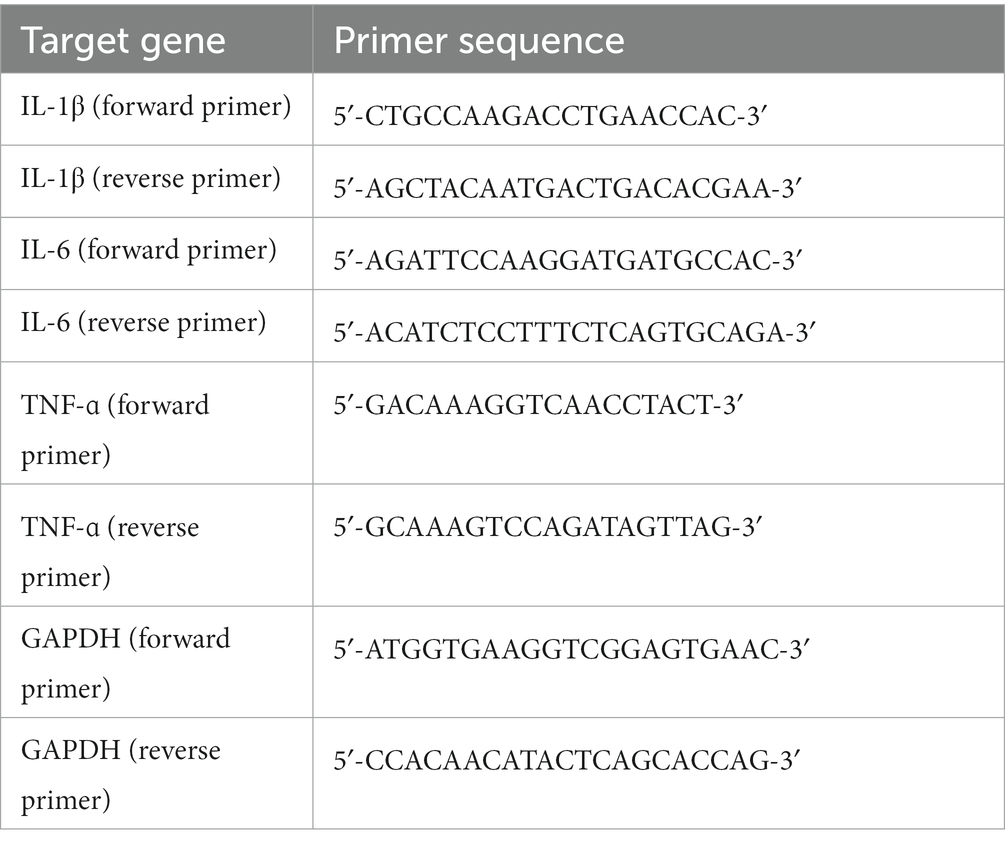
2.4. Extracción de ARNm total y RT-PCR cuantitativa
Las muestras fueron colectadas e inmediatamente congeladas en nitrógeno líquido y homogeneizadas en el reactivo TRIzol (Angle Gene) para obtener ARNm. El ARN se extrajo y purificó de las heridas de la pared abdominal utilizando cloroformo, isopropanol y etanol. La pureza y la cantidad de ARN se evaluaron mediante el sistema NANODROP ONE (Thermo). De acuerdo con el protocolo del fabricante, el ARN total (100 μg) se transcribió inversamente en ADNc utilizando un kit de enzimas de transcripción inversa (TransGen Biotech). Mediante el uso del kit de RT&qPCR PerfectStart Uni (TransGen Biotech) y el sistema de PCR en tiempo real 7300, se analizó la absorbancia del ADNc resultante mediante qPCR. Las secuencias de cebadores para la PCR cuantitativa de fluorescencia en tiempo real se diseñaron utilizando el software PrimerBLAST (NCBI), y sus secuencias se muestran en la Tabla 1. Se realizó un análisis comparativo de Ct (∆∆Ct) de la expresión de ARNm de los tejidos con normalización basada en la expresión media del ARNm de referencia de GAPDH en los tejidos.
2.5. Ensayo de inmunoabsorción ligado a enzimas
Las muestras de tejido para el análisis del contenido de proteínas se congelaron rápidamente en nitrógeno líquido inmediatamente después de la cosecha. Los tejidos congelados se molieron hasta convertirlos en polvo bajo enfriamiento con nitrógeno líquido. Se añadió una cantidad adecuada de PBS al polvo de tejido y se homogeneizó completamente. Después de la homogeneización, la suspensión se centrifugó (20 min, 3.000 rpm) y el sobrenadante se transfirió a un nuevo tubo. La concentración de proteínas se determinó mediante el ensayo de proteínas de Bradford (BioRad). La concentración de IL-1β se midió utilizando el kit ELISA (Angle Gene) de IL-1β Canine. La concentración de IL-6 se midió utilizando el kit ELISA (Angle Gene) de IL-6 canino. La concentración de TNF-α se midió utilizando el kit ELISA (Angle Gene) de TNF-α Canino. Para la detección se utilizó una cantidad total de proteína de 10 μg por pocillo, siguiendo el protocolo del fabricante. La normalización se realizó para cada concentración de proteína.
2.6. Histología
Después del muestreo, las muestras destinadas al examen histológico se fijaron en paraformaldehído al 4%, se incluyeron en parafina y se seccionaron con un espesor de 4 mm. Las secciones se tiñeron con hematoxilina y eosina (H&E) y luego se deshidrataron y cubrieron. El estado general de las secciones y la posición de las suturas se observaron utilizando un microscopio óptico (LEICA DM500) con un aumento de 100×. Las fotografías fueron tomadas por un patólogo que desconocía los grupos experimentales en cuatro ubicaciones diferentes (superior, inferior, izquierda y derecha) alrededor de los orificios de sutura en cada portaobjetos utilizando un aumento de 400×. De acuerdo con las disposiciones pertinentes de ISO10993, se evaluó el grado de inflamación y la reactividad tisular. La puntuación del grado de inflamación incluyó recuentos de células polimorfonucleares, linfocitos, células plasmáticas, macrófagos y células gigantes, así como el grado de necrosis. La puntuación de reactividad tisular se calculó sumando la puntuación de inflamación (multiplicada por 2), la puntuación de neovascularización, la puntuación de fibrosis y la puntuación de infiltración de grasa. Los recuentos celulares se puntuaron en función del número de células por campo de alta potencia con un aumento de 400×: ausente (0), 1-5/HPF (1), 5-10/HPF (2), infiltración severa (3) y campo completo (4). Las puntuaciones de necrosis, neovascularización, fibrosis e infiltración de grasa se clasificaron como ausentes (0), leves (1), moderadas (2), moderadas a graves (3) y graves (4).
2.7. Análisis estadístico
Los datos se presentaron como media ± DE. Se utilizó la prueba exacta de Fisher para analizar las diferencias en las tasas de ocurrencia de los criterios de valoración biomecánicos. Para el resto de los datos se utilizó la prueba U de Mann-Whitney y la prueba de Wilcoxon del método escalonado. La significación estadística se definió como p < 0,05. En las figuras, dos grupos sin letras iguales indican que tienen diferencias significativas. Todos los análisis estadísticos mencionados anteriormente se realizaron con el programa SPSS (versión 26.0.0.2, IBM) y las cifras se generaron con el programa GraphPad Prism 9 (versión 9.5.1).
3. Resultado
3.1. Resultados de los ensayos biomecánicos
Las pruebas biomecánicas de la piel no mostraron diferencias significativas de estrés entre los grupos experimental y control por debajo del 30% de deformación. Sin embargo, con una deformación del 40%, el grupo de sutura USP 4-0 PGA mostró un estrés significativamente menor en comparación con los otros grupos experimentales y el grupo control, lo que indica una falla en el soporte de la sutura en el tejido. Las suturas USP 3-0 y 2-0 perdieron su soporte efectivo a una deformación del 50% (Figura 1A), lo que sugiere un fracaso de sutura en suturas de pequeño diámetro con baja deformación tisular. Pero es importante tener en cuenta que una deformación de la pared abdominal del 30% es poco frecuente en la práctica clínica. La deformación en el grupo de sutura USP 4-0 fue menor a la tensión máxima, pero no se observaron diferencias significativas, ni entre suturas interrumpidas y continuas (Figura 1E). Además, la piel suturada USP 4-0 tuvo una resistencia máxima a la tracción significativamente menor, con un valor medio de 92,5 N (Figura 1G). Sin embargo, independientemente del diámetro de la sutura, no se encontraron diferencias significativas en la tensión máxima entre las suturas continuas e interrumpidas (Figura 1F), lo que sugiere capacidades similares de soporte tisular. La prueba de tracción después de la sutura identificó dos criterios de valoración: rotura de la sutura (Figura 1C) y ruptura del tejido en el sitio de la sutura (Figura 1D). Las suturas de mayor diámetro provocaron desgarros de tejido bajo alta tensión, mientras que las suturas de menor diámetro fueron propensas a la rotura de la sutura (Figura 1H). Curiosamente, en condiciones de alta tensión, las suturas continuas tenían una mayor probabilidad de rotura de la sutura, mientras que las suturas interrumpidas daban lugar a una mayor rotura del tejido (Figura 1I).
La prueba biomecánica muscular no mostró diferencias significativas de estrés entre los grupos experimental y control por debajo del 50% de deformación (Figura 2A). La resistencia máxima a la tracción (Figura 2G), la tensión correspondiente (Figura 2F) y la tensión (Figura 2E) durante el alargamiento muscular también fueron similares entre los grupos. Al igual que en el tejido cutáneo, las pruebas de elongación muscular revelaron rotura de la sutura (Figura 2C) y ruptura del tejido en el sitio de la sutura (Figura 2D). Sin embargo, a diferencia del tejido cutáneo, la mitad de las pruebas musculares dieron lugar a un desgarro fascial no suturado (Figura 2B). Independientemente del diámetro de la sutura y de la técnica, no hubo diferencias significativas en las tasas de ocurrencia de los criterios de valoración de las pruebas (Figuras 2H,I). Estos hallazgos sugieren que no hay diferencias significativas en las propiedades mecánicas de la pared abdominal después de la sutura de la línea alba canina con suturas USP 2-0, 3-0 y 4-0 PGA. La pared abdominal suturada exhibió propiedades mecánicas similares a las de la pared intacta en condiciones de tensión extrema.
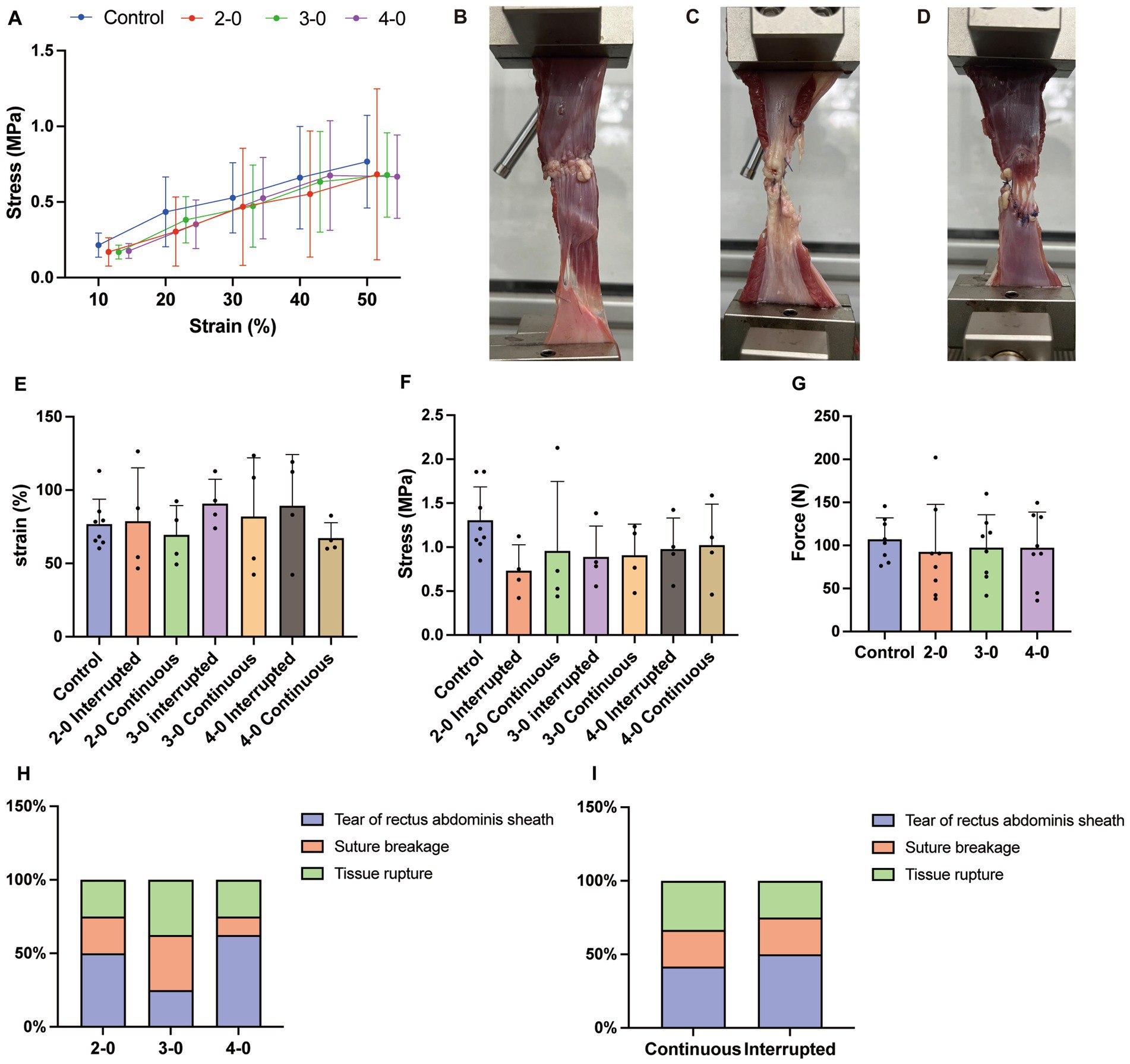 Figura 2. Ensayo de tracción uniaxial de la fascia canina y el tejido muscular in vitro. (A) Curva tensión-deformación. (B) Rotura de la vaina del recto abdominal bajo alta tensión (C) Rotura de sutura. (D) Ruptura de tejido en el sitio de sutura. (E) Deformación a la máxima resistencia a la tracción. (F) Valor de tensión a la máxima resistencia a la tracción. (G) Máxima resistencia a la tracción. (H) El punto final de falla de sutura con diferentes tamaños de agujas e hilos suturados línea alba (prueba exacta de Fisher). (I) El criterio de valoración del fallo de sutura con diferentes métodos de sutura suturó la línea alba (prueba exacta de Fisher).
Figura 2. Ensayo de tracción uniaxial de la fascia canina y el tejido muscular in vitro. (A) Curva tensión-deformación. (B) Rotura de la vaina del recto abdominal bajo alta tensión (C) Rotura de sutura. (D) Ruptura de tejido en el sitio de sutura. (E) Deformación a la máxima resistencia a la tracción. (F) Valor de tensión a la máxima resistencia a la tracción. (G) Máxima resistencia a la tracción. (H) El punto final de falla de sutura con diferentes tamaños de agujas e hilos suturados línea alba (prueba exacta de Fisher). (I) El criterio de valoración del fallo de sutura con diferentes métodos de sutura suturó la línea alba (prueba exacta de Fisher).
3.2. Observación del aspecto de la incisión cutánea después de la sutura
Ningún animal mostró signos de infección, dehiscencia de la herida o hernia incisional durante todo el experimento. La figura 3A muestra el aspecto postoperatorio de la incisión cutánea. Se observó enrojecimiento y exudación leves en las incisiones durante la semana inicial, independientemente del diámetro de la sutura. Sin embargo, entre 1 y 2 semanas después del cierre, los grupos de sutura USP 2-0 y 3-0 tuvieron una mayor incidencia de enrojecimiento y formación de costras, mientras que el grupo USP 4-0 tuvo un enrojecimiento más leve y una formación de costras menos frecuente.
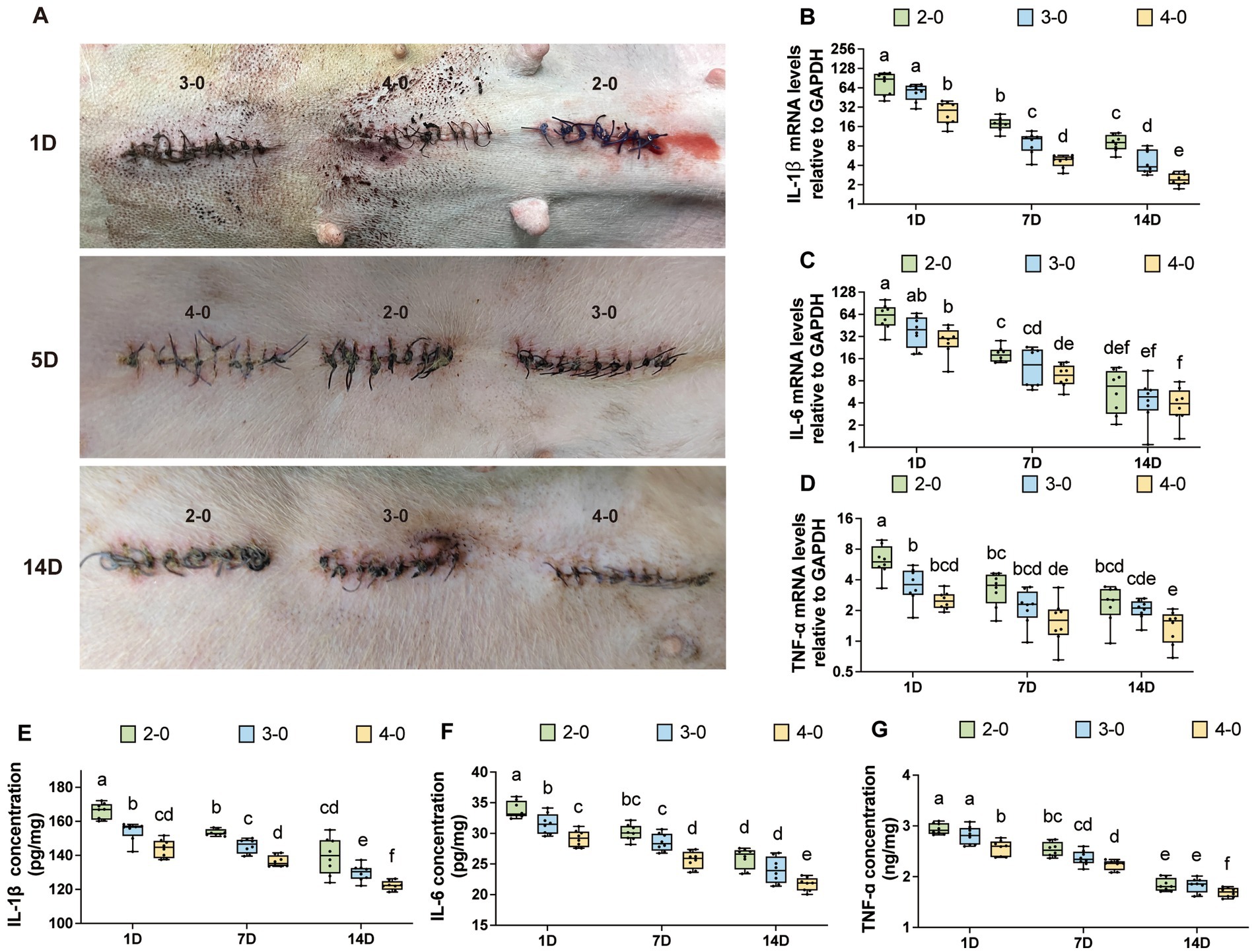 Figura 3. Evaluación de citoquinas inflamatorias después de la sutura cutánea canina. (A) La apariencia de la incisión en la piel después de la sutura, con diferentes filas que representan 1, 5 y 14 días después de la sutura, y el calibre de sutura USP indicado encima de cada incisión. Niveles de expresión de ARNm (B-D) de IL-1β, IL-6 y TNF-α después de la sutura cutánea (USP 2-0 PGA vs. USP 3-0 PGA vs. USP 4-0 PGA). (E–G) Niveles de expresión proteica de IL-1β, IL-6 y TNF-α después de la sutura cutánea (USP 2-0 PGA vs. USP 3-0 PGA vs. USP 4-0 PGA).
Figura 3. Evaluación de citoquinas inflamatorias después de la sutura cutánea canina. (A) La apariencia de la incisión en la piel después de la sutura, con diferentes filas que representan 1, 5 y 14 días después de la sutura, y el calibre de sutura USP indicado encima de cada incisión. Niveles de expresión de ARNm (B-D) de IL-1β, IL-6 y TNF-α después de la sutura cutánea (USP 2-0 PGA vs. USP 3-0 PGA vs. USP 4-0 PGA). (E–G) Niveles de expresión proteica de IL-1β, IL-6 y TNF-α después de la sutura cutánea (USP 2-0 PGA vs. USP 3-0 PGA vs. USP 4-0 PGA).
3.3. Las suturas de pequeño diámetro reducen significativamente la reactividad del tejido cutáneo después de la sutura
Los niveles de expresión de ARNm de IL-1β e IL-6 disminuyeron gradualmente después de la sutura, pero se mantuvieron significativamente más altos que los del grupo de control (Figuras suplementarias S1A,B). La expresión del ARNm de TNF-α no mostró diferencias significativas a los 7 y 14 días después de la sutura (Figura suplementaria S1C). Las figuras 3B-D muestran las variaciones en los niveles de ARNm entre los diferentes grupos de diámetros de sutura. A excepción de la expresión de IL-6 a los 14 días, que no tuvo diferencias significativas entre los grupos USP 2-0 y 4-0, los niveles de factores inflamatorios fueron consistentemente más altos en el grupo USP 2-0 en otros momentos. Además, la expresión de ARNm de IL-1β en el grupo USP 2-0 a los 14 días se mantuvo significativamente más alta que en el grupo USP 4-0 a los 7 días. El grupo USP 3-0 tuvo menor expresión de IL-1β que USP 2-0 y mayor que USP 4-0 a los 14 días. Los métodos de sutura no afectaron significativamente la expresión del factor inflamatorio (Figuras Suplementarias S1D-F), ya que las suturas interrumpidas simples colocan los nudos fuera de la piel.
Los niveles de expresión proteica de IL-1β, IL-6 y TNF-α en la piel siguieron un patrón comparable al de la expresión del ARNm. Con el tiempo, los niveles de citoquinas inflamatorias disminuyeron gradualmente, pero se mantuvieron significativamente más altos que en el grupo de control (Figuras suplementarias S2A-C). En cada momento después de la sutura, el grupo de sutura USP 4-0 PGA mostró niveles significativamente más bajos de expresión proteica de IL-1β, IL-6 y TNF-α en comparación con el grupo de sutura USP 2-0 PGA (Figuras 3E-G). Además, tanto la sutura continua simple como la sutura interrumpida simple no tuvieron un impacto significativo en los niveles de expresión proteica de estas citocinas inflamatorias en ningún momento después de la sutura cutánea (Figuras suplementarias S2D-F).
Con un aumento del 100×, se observó el intenso infiltrado inflamatorio de color púrpura alrededor de los orificios más grandes de la aguja de sutura en el primer día después de la cirugía. Con un aumento de 400×, se veían numerosas células polimorfonucleares. En el 7º día después de la cirugía, el área de tinción profunda alrededor de los orificios de sutura en el grupo USP 4-0 fue relativamente más pequeña. La infiltración de células polimorfonucleares disminuyó, pero la infiltración severa permaneció en el grupo USP 2-0. En este punto, se observó un aumento de macrófagos y células gigantes. Se observó una leve neovascularización en el tejido cutáneo. Después de 14 días, el grupo USP 2-0 mostró una prominente formación de cápsulas fibrosas alrededor de los orificios de sutura (Figuras 4A, B). Todos los grupos presentaron una infiltración celular polimorfonuclear de leve a moderada, con macrófagos predominantemente alrededor de los orificios de sutura. Las puntuaciones de inflamación y reactividad tisular disminuyeron con el tiempo, con puntuaciones significativamente más altas en el grupo USP 2-0 en comparación con el grupo USP 4-0 (Figuras 4C, D).
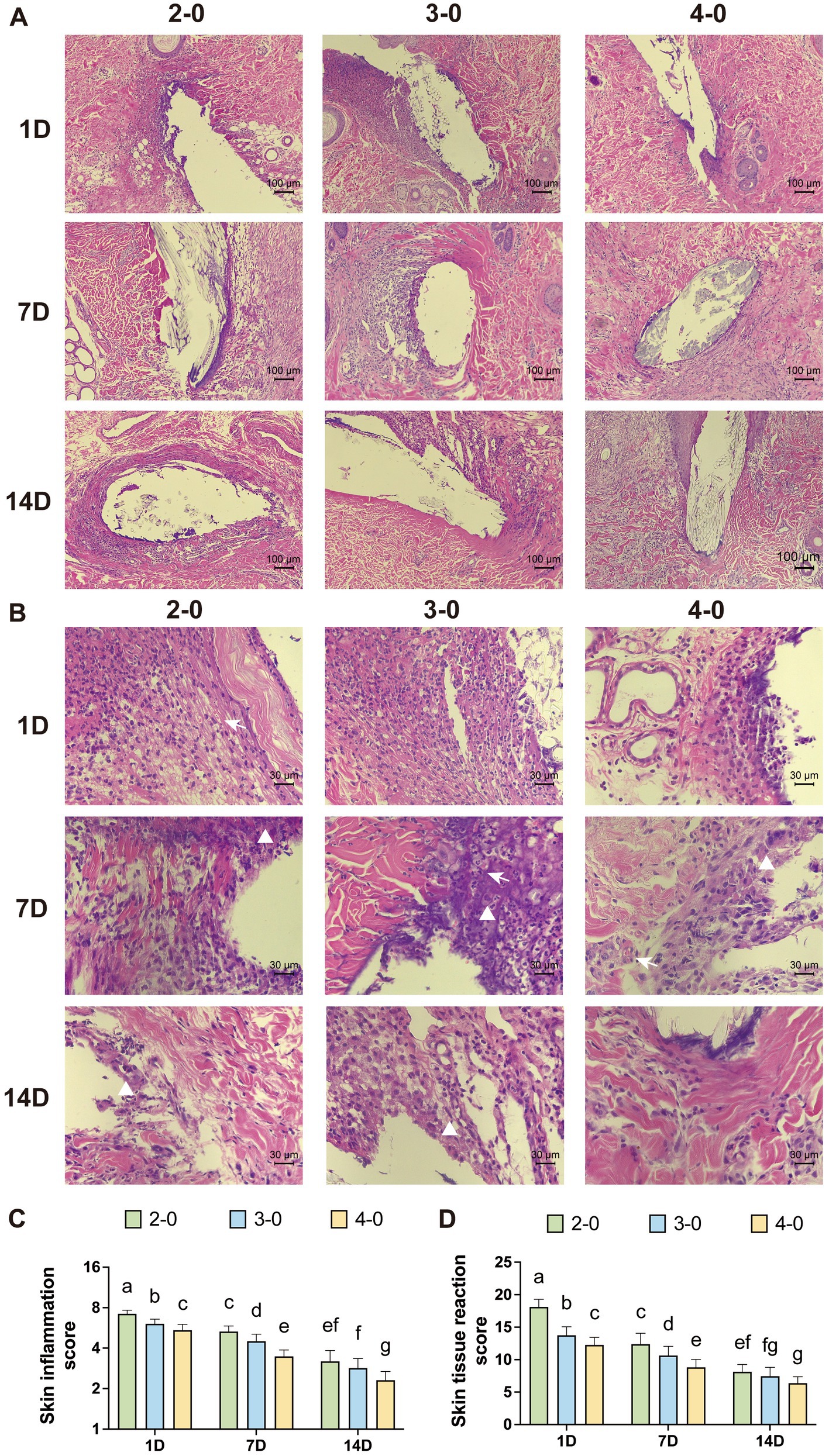 Figura 4. Evaluación histopatológica posterior a la sutura cutánea canina. (A) Secciones representativas teñidas con H&E después de suturar la piel (aumento del 100×). (B) Secciones representativas teñidas con H&E después de suturar la piel (aumento de 400×). Diferentes filas que representan 1, 7 y 14 días después de la sutura, y diferentes columnas que representan el calibre de sutura utilizado: USP 2-0, 3-0 y 4-0 PGA. Los triángulos blancos marcan la infiltración de macrófagos. Las flechas blancas marcan la neovascularización. (C) Puntuación de inflamación alrededor de los hilos de sutura. (D) Puntuaciones de reactividad tisular alrededor de los hilos de sutura. Dos grupos sin letras iguales indican que existen diferencias significativas, p < 0,05.
Figura 4. Evaluación histopatológica posterior a la sutura cutánea canina. (A) Secciones representativas teñidas con H&E después de suturar la piel (aumento del 100×). (B) Secciones representativas teñidas con H&E después de suturar la piel (aumento de 400×). Diferentes filas que representan 1, 7 y 14 días después de la sutura, y diferentes columnas que representan el calibre de sutura utilizado: USP 2-0, 3-0 y 4-0 PGA. Los triángulos blancos marcan la infiltración de macrófagos. Las flechas blancas marcan la neovascularización. (C) Puntuación de inflamación alrededor de los hilos de sutura. (D) Puntuaciones de reactividad tisular alrededor de los hilos de sutura. Dos grupos sin letras iguales indican que existen diferencias significativas, p < 0,05.
3.4. Las suturas de pequeño diámetro reducen significativamente la reactividad del tejido muscular fascial después de la sutura
Tres meses después de las suturas de línea alba, se observó una absorción completa de la sutura y el examen de la cicatriz no reveló diferencias significativas en los niveles de expresión de ARNm de IL-1β, IL-6 y TNF-α en comparación con el grupo de control (Figuras suplementarias S3A-C). Las figuras 5A-C ilustran las variaciones en los niveles de ARNm entre los grupos experimentales. A los 3 meses, no se observaron diferencias significativas entre los grupos de línea de sutura. Sin embargo, en el día 1 y el día 7 postoperatorios, las suturas USP 2-0 mostraron niveles de expresión de ARNm significativamente más altos de IL-1β, IL-6 y TNF-α en comparación con las suturas USP 4-0. A diferencia de la sutura cutánea, la sutura simple interrumpida exhibió niveles más altos de expresión de ARNm de IL-1β en comparación con la sutura continua simple a los 7 días después del cierre de la línea alba (Figura 5D).
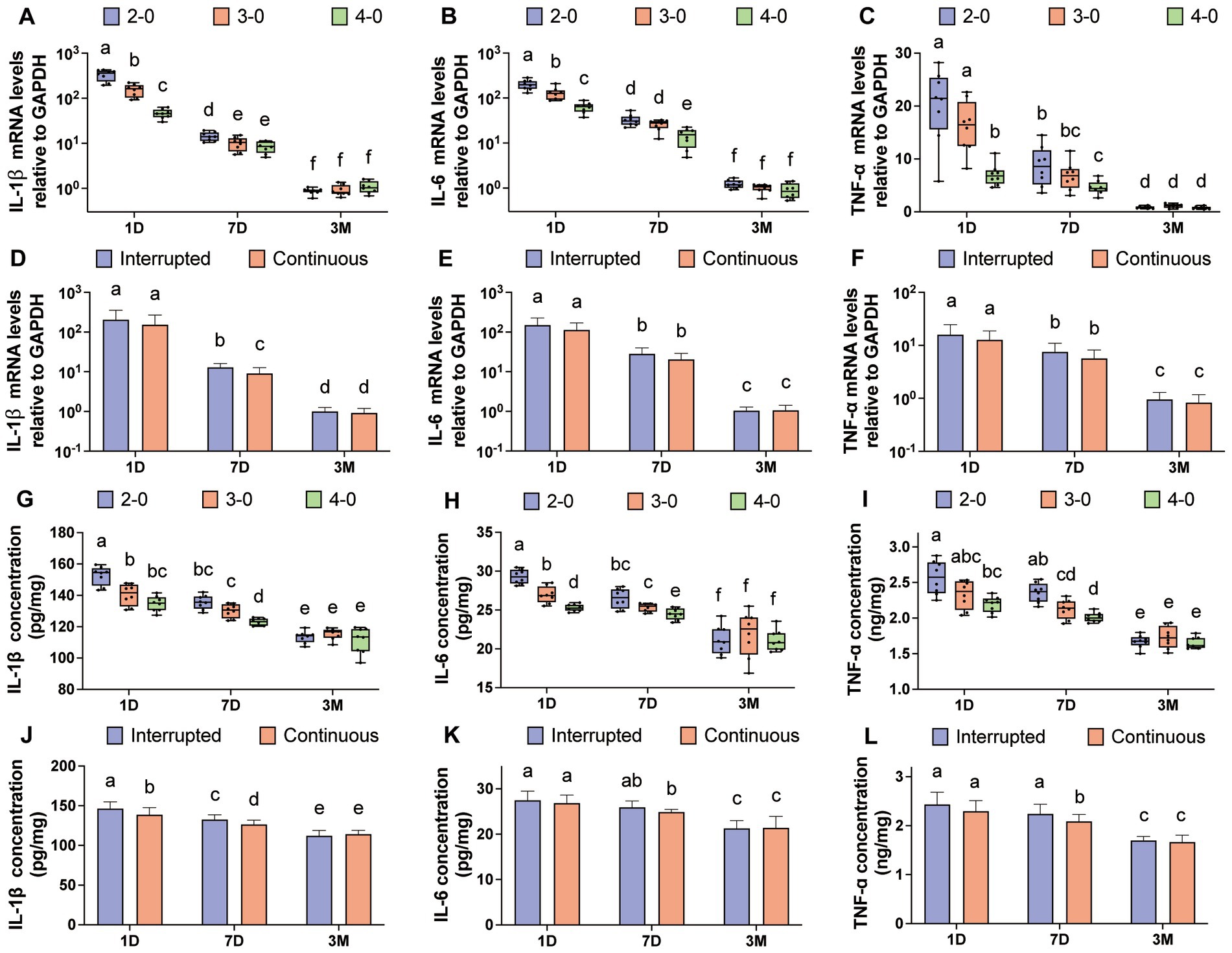 Figura 5. Evaluación de citoquinas inflamatorias después de la sutura de línea alba canina. Niveles de expresión de ARNm (A-C) de IL-1β, IL-6 y TNF-α en la fascia y el tejido muscular (USP 2-0 PGA vs. USP 3-0 PGA vs. USP 4-0 PGA). Niveles de expresión de ARNm (D-F) de IL-1β, IL-6 y TNF-α en la fascia y el tejido muscular (suturas interrumpidas simples vs. suturas continuas simples). (G-I) Niveles de expresión proteica de IL-1β, IL-6 y TNF-α en la fascia y el tejido muscular (USP 2-0 PGA vs. USP 3-0 PGA vs. USP 4-0 PGA). (J-L) Niveles de expresión proteica de IL-1β, IL-6 y TNF-α en la fascia y el tejido muscular (suturas interrumpidas simples vs. suturas continuas simples).
Figura 5. Evaluación de citoquinas inflamatorias después de la sutura de línea alba canina. Niveles de expresión de ARNm (A-C) de IL-1β, IL-6 y TNF-α en la fascia y el tejido muscular (USP 2-0 PGA vs. USP 3-0 PGA vs. USP 4-0 PGA). Niveles de expresión de ARNm (D-F) de IL-1β, IL-6 y TNF-α en la fascia y el tejido muscular (suturas interrumpidas simples vs. suturas continuas simples). (G-I) Niveles de expresión proteica de IL-1β, IL-6 y TNF-α en la fascia y el tejido muscular (USP 2-0 PGA vs. USP 3-0 PGA vs. USP 4-0 PGA). (J-L) Niveles de expresión proteica de IL-1β, IL-6 y TNF-α en la fascia y el tejido muscular (suturas interrumpidas simples vs. suturas continuas simples).
Tres meses después de la sutura, no se encontraron diferencias significativas en los niveles de expresión de proteínas en comparación con el grupo control (Figuras suplementarias S3D-F). En el día 1 y el día 7 del postoperatorio, el grupo de sutura USP 4-0 PGA mostró niveles significativamente más bajos de expresión proteica de IL-1β, IL-6 y TNF-α en comparación con el grupo de sutura USP 2-0 PGA (Figuras 5G-I). La sutura continua simple resultó en una menor expresión de la proteína IL-1β el primer día después de la sutura (Figura 5J). Sin embargo, a los 7 días, la simple sutura interrumpida condujo a niveles más altos de expresión de proteínas IL-1β y TNF-α (Figuras 5J,L).
Con un aumento del 100×, las secciones del tejido muscular de la fascia teñidas con HE mostraron infiltrados inflamatorios de color púrpura oscuro pronunciados que rodeaban los orificios más grandes de la aguja de sutura el primer día después de la operación. Con un aumento de 400×, se observaron numerosas células polimorfonucleares y linfocitos infiltrándose en el campo de visión. El tejido muscular mostró tejido necrótico, neovascularización y efectos variables de diferentes diámetros de sutura en el tejido circundante en el séptimo día. A los 3 meses no se observaron diferencias significativas entre los grupos de sutura en los cortes de tejido (Figuras 6A,B). Las puntuaciones de reacción inflamatoria y tisular disminuyeron con el tiempo, con puntuaciones significativamente más altas para el grupo de sutura USP 2-0 en comparación con el grupo de sutura USP 4-0 (Figuras 6C, D). No se observaron diferencias significativas en la fibrosis del tejido muscular de la fascia causada por diferentes diámetros de sutura durante la fase temprana posterior a la sutura.
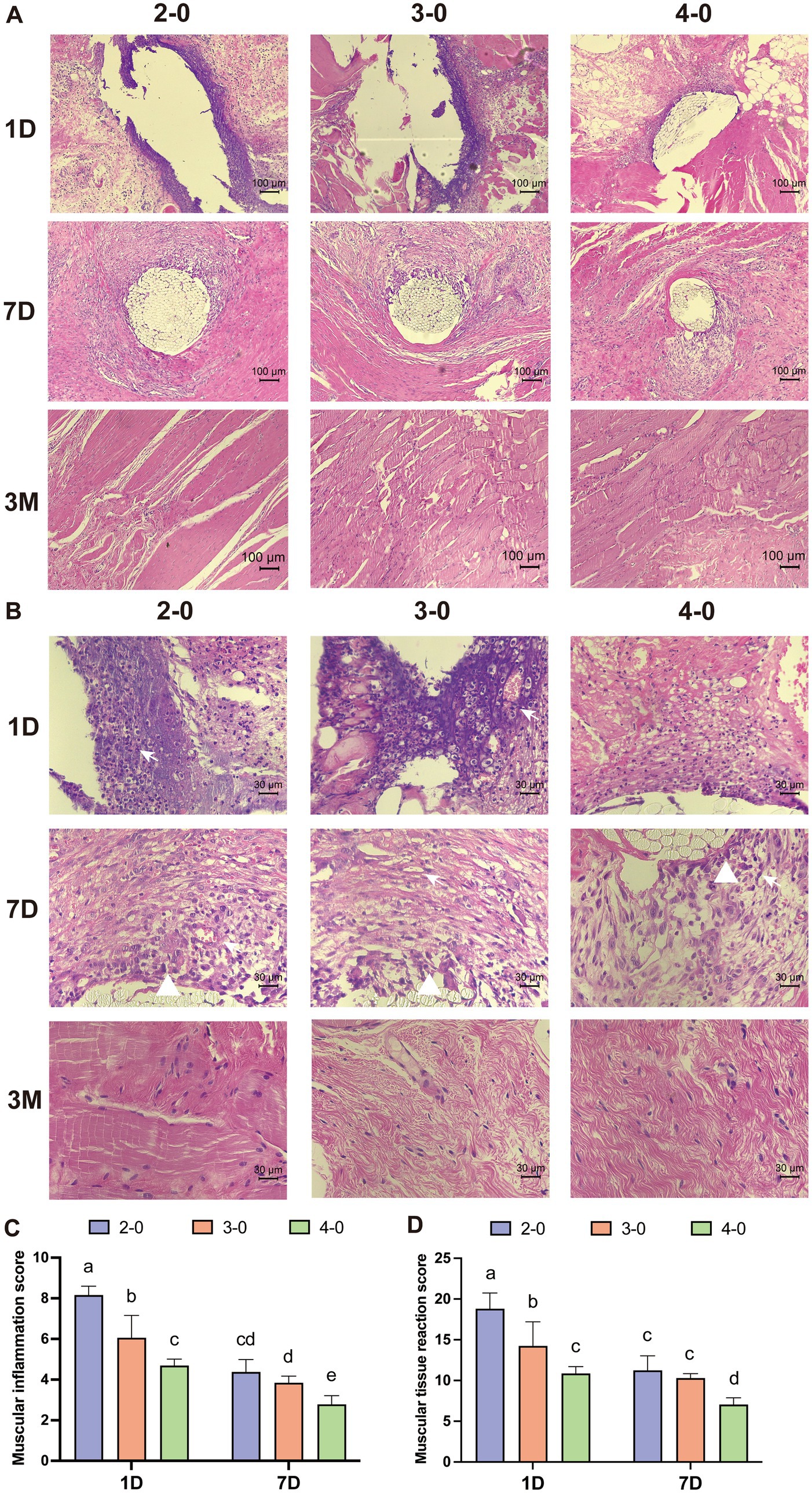 Figura 6. Evaluación histopatológica tras la sutura canina de la línea alba. (A) Secciones representativas teñidas con H&E después de suturar la línea alba (aumento del 100×). (B) Secciones representativas teñidas con H&E después de suturar la línea alba (aumento de 400×). Diferentes filas que representan 1, 7 y 14 días después de la sutura, y diferentes columnas que representan los hilos de sutura utilizados: USP 2-0, 3-0 y 4-0 PGA. Los triángulos blancos marcan la infiltración de macrófagos. Las flechas blancas marcan la neovascularización. (C) Puntuación de inflamación alrededor de los hilos de sutura. (D) Puntuaciones de reactividad tisular en el tejido circundante. Dos grupos sin letras iguales indican que existen diferencias significativas, p < 0,05.
Figura 6. Evaluación histopatológica tras la sutura canina de la línea alba. (A) Secciones representativas teñidas con H&E después de suturar la línea alba (aumento del 100×). (B) Secciones representativas teñidas con H&E después de suturar la línea alba (aumento de 400×). Diferentes filas que representan 1, 7 y 14 días después de la sutura, y diferentes columnas que representan los hilos de sutura utilizados: USP 2-0, 3-0 y 4-0 PGA. Los triángulos blancos marcan la infiltración de macrófagos. Las flechas blancas marcan la neovascularización. (C) Puntuación de inflamación alrededor de los hilos de sutura. (D) Puntuaciones de reactividad tisular en el tejido circundante. Dos grupos sin letras iguales indican que existen diferencias significativas, p < 0,05.
4. Discusión
La cicatrización normal de las heridas es la base de una cirugía exitosa. Sin embargo, la mala cicatrización de la pared abdominal sigue siendo una complicación común de la cirugía abdominal. Según las estadísticas, la incidencia de hernia incisional postoperatoria en humanos es del 12,8% (2), y la incidencia de dehiscencia de la herida alcanza el 5,5% (3). Aunque no se ha realizado una investigación estadística explícita, el retraso en la cicatrización de las heridas y la mala cicatrización son complicaciones postoperatorias comúnmente observadas en la práctica clínica veterinaria. Múltiples estudios de investigación han publicado guías con respecto a la sutura de la pared abdominal, que recomiendan suturas continuas (31), intervalos de puntada cerrados (28), SL:WL mayores de 4 (32) y el uso de suturas antimicrobianas (33). La sutura tiene como objetivo mantener un cierto nivel de tensión en la herida mediante suturas, facilitando la aproximación al borde de la herida y acelerando la cicatrización. Sin embargo, existe la paradoja de que las suturas en sí mismas, como materiales extraños, pueden empeorar la respuesta inflamatoria en la herida, lo que lleva a una mala cicatrización (24). Actualmente, varios estudios se centran en el desarrollo de nuevos materiales de sutura o en el recubrimiento de suturas existentes con nuevos materiales para reducir la reactividad tisular tras la implantación de la sutura. La investigación preliminar ha encontrado que los cirujanos generalmente pueden sobrestimar la tensión requerida para la sutura de tejido, lo que indica que las suturas más pequeñas con menor resistencia a la tracción también pueden cumplir con los requisitos de tensión después de la sutura y causar menos reacción tisular.
La tensión insuficiente de la sutura es bien conocida como una de las principales causas de fracaso de la sutura (34). Debido a la incertidumbre con respecto a los requisitos de tensión en el sitio de sutura, muchos cirujanos tienden a usar suturas de mayor calibre con alta resistencia a la tracción para el cierre de la herida. Sin embargo, un estudio previo sobre la tensión de la pared abdominal canina en 59 cirugías clínicas reveló que la tensión media en el punto medio de las incisiones musculares era de solo 1,51 N, con una tensión máxima de solo 4,23 N, mientras que la tensión mediana para las incisiones en la piel era de solo 0,67 N (27). Estos hallazgos indican que la tensión real requerida por los tejidos durante la sutura quirúrgica puede ser significativamente menor de lo previsto por los cirujanos. Una sola sutura USP 4-0 PGA tiene una resistencia a la tracción de al menos 12 N, lo que indica la necesidad de optimizar la selección del material de sutura para el cierre de la pared abdominal en cirugía canina. En este estudio, aunque la resistencia máxima a la tracción de las suturas USP 4-0 PGA para el cierre de la piel canina fue significativamente menor que la de otros grupos, su valor mínimo superó con creces los requisitos de tensión de cierre de la piel medidos en experimentos anteriores. En el experimento de cierre de la línea alba, no hubo diferencias significativas en la resistencia máxima a la tracción o la tensión máxima entre los grupos, y en casi la mitad de los grupos de prueba, el punto final de la prueba de tracción fue el desgarro de la fascia del músculo recto abdominal en lugar de la ruptura en el sitio de sutura. Nuestros datos sugieren que incluso cuando se utilizan suturas USP 4-0 PGA para la línea abla, sus propiedades mecánicas son muy similares a las del área intacta de la línea abla. La presión intraabdominal es un componente importante de la tensión de la pared abdominal, y los estudios han demostrado una correlación positiva lineal entre la presión intraabdominal y la tensión de la pared abdominal (35). Por lo general, la presión intraabdominal en los seres humanos no supera los 11 kPa (36, 37), y otras investigaciones indican que bajo la carga fisiológica máxima, la tensión en la región de la línea alba es de aproximadamente 7%-12% (38). En este modelo experimental, no se observaron diferencias significativas entre los grupos en términos de tensión cutánea por debajo del 30% y tensión muscular por debajo del 50%, lo que sugiere que, en condiciones fisiológicas, las suturas USP 2-0, 3-0 y 4-0 PGA son capaces de proporcionar suficiente soporte para la incisión después de suturar la pared abdominal canina.
El hecho objetivo es que las suturas más finas tienen una menor resistencia a la tracción, por lo que algunos cirujanos creen que el uso de suturas más finas como USP 4-0 para el cierre de heridas puede provocar la rotura de la sutura. Con base en los hallazgos de este estudio, en el cierre rutinario de heridas quirúrgicas de baja tensión en perros, la rotura de las suturas USP 4-0 puede deberse a una tensión adicional inapropiada aplicada por el cirujano durante la sutura y el anudado. La evaluación inexacta de la tensión tisular por parte de los cirujanos no solo puede causar roturas innecesarias de suturas, sino que también puede provocar un cierre de alta tensión. El cierre de alta tensión puede conducir a un suministro de sangre comprometido (39) y a una distribución interrumpida del colágeno (40) en el sitio de sutura, lo que aumenta la incidencia de complicaciones postoperatorias (41). Los cirujanos deben minimizar la tensión adicional mientras se aseguran de alinear los bordes de la incisión. Para las incisiones quirúrgicas caninas sin signos de alta tensión, como una separación significativa de los márgenes, el uso de suturas USP 4-0 más finas para el cierre de la pared abdominal puede mantener la estabilidad de la incisión. Es posible que no sea necesaria la alta resistencia a la tracción proporcionada por suturas de mayor diámetro como USP 2-0.
La inflamación es una etapa vital en el proceso de curación, esencial para la hemostasia y el inicio de respuestas inmunitarias inespecíficas (42). La inflamación excesiva impide la cicatrización normal, lo que lleva a un retraso en la cicatrización y a una formación excesiva de cicatrices (42). En este trabajo, las suturas de mayor diámetro mostraron consistentemente niveles más altos de factores inflamatorios y reacciones tisulares en varios puntos temporales. Incluso todos los tamaños de sutura se degradaron completamente en el músculo después de 3 meses de sutura, y no se observaron diferencias significativas en los niveles de expresión de los factores inflamatorios y las puntuaciones histológicas tisulares. Sin embargo, no se puede ignorar el impacto de los diferentes tamaños de sutura en el tejido postoperatorio temprano. De hecho, la inflamación desempeña un papel crucial en la prevención temprana de infecciones en las heridas, mientras que la supresión rápida de las células inflamatorias y la regulación negativa de las citocinas proinflamatorias promueven la reparación temprana de los tejidos y la posterior remodelación de los tejidos, acelerando la cicatrización de las heridas, especialmente en heridas no infecciosas como las incisiones quirúrgicas (42). La depleción de neutrófilos (18) o los ratones knockout de macrófagos (19) en realidad exhibieron una curación acelerada y una reducción de las cicatrices debido a la ausencia de estas células inflamatorias. Sustancias como la curcumina (43) y la proteína de suero (44) mejoran la cicatrización de heridas al reducir la expresión de citoquinas proinflamatorias como IL-1β, IL-6 y TNF-α durante el proceso de cicatrización de heridas cutáneas. Yaman et al. (45) demostraron que el agente antiinflamatorio resveratrol administrado por vía oral en ratas disminuyó los niveles de inflamación de la pared abdominal y aumentó la resistencia a la tracción de la pared abdominal. En el presente estudio, el nivel de inflamación después del cierre tisular con suturas USP 4-0 PGA fue significativamente menor que el de las suturas USP 2-0 PGA, lo que indica que la diferencia en el diámetro de la sutura que causa variación en la implantación de materiales extraños puede alterar significativamente el grado de respuesta inflamatoria tisular. Por lo tanto, la selección de suturas más finas como USP 4-0 PGA para el cierre del abdomen canino puede ser beneficiosa para la cicatrización de los tejidos mientras se mantiene suficiente resistencia a la tracción.
El nudo de sutura es una parte integral de un cierre completo y, como material extraño adicional aparte del asa de sutura, también se espera que provoque las respuestas inflamatorias correspondientes. Los resultados de este experimento demuestran que, durante la sutura de la línea alba, las suturas interrumpidas pueden inducir una mayor expresión de factores inflamatorios en comparación con las suturas continuas. Sin embargo, su impacto en la inflamación de los tejidos es relativamente más débil en comparación con la elección del tamaño de la sutura. Este hallazgo es similar al estudio de Van et al., quienes encontraron que el tamaño y el material de la sutura son factores independientes que influyen en la reactividad tisular, mientras que el nudo de sutura tiene un efecto mínimo sobre la respuesta tisular (46). En este estudio, no hubo diferencias significativas en las propiedades mecánicas del tejido de la pared abdominal canina entre suturas continuas e interrumpidas en condiciones ex vivo. Sin embargo, por otro lado, en ratones a los 14 días postoperatorios, las suturas continuas exhibieron una resistencia mecánica de la pared abdominal significativamente mayor en comparación con las suturas interrumpidas, siempre que la relación entre la longitud de la sutura y la longitud de la herida fuera superior a 4 (47). Además, las suturas continuas requirieron menos tiempo para completarse (48). Por lo tanto, las suturas continuas pueden tener ventajas sobre las suturas interrumpidas en el cierre de la pared abdominal.
Sin embargo, existen ciertas limitaciones en nuestro estudio. En primer lugar, aunque hemos identificado las ventajas de suturar con hilos de pequeño diámetro, el tamaño de la muestra se limitó a animales de experimentación, y se requiere una mayor validación a través de ensayos clínicos a mayor escala. En segundo lugar, la prueba de deformación tisular ex vivo realizada en este estudio empleó un método de prueba uniaxial, que impuso solo pretensión transversal en el tejido antes de la prueba. Sin embargo, en realidad, el tejido de la pared abdominal también está influenciado por el estrés longitudinal, lo que resulta en diferencias potenciales entre las propiedades mecánicas del tejido medidas en este experimento y las condiciones in vivo.
En conclusión, este estudio confirma que las suturas USP 4-0 PGA son adecuadas para suturar la pared abdominal canina en general, incluyendo la línea alba y la piel, a la vez que satisfacen los requerimientos de tensión. Además, la reducción del diámetro de la sutura disminuye significativamente la reactividad del tejido, independientemente de si se trata de la línea alba o del tejido cutáneo. La sutura de la pared abdominal canina con suturas USP 4-0 PGA exhibe una reactividad tisular mínima y proporciona suficiente estabilidad mecánica tisular postoperatoria. Los cirujanos deben seleccionar el tamaño de sutura más pequeño que cumpla con los requisitos de tensión al suturar incisiones en la pared abdominal, con el objetivo de minimizar la inflamación y el trauma tisular adicionales.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue aprobado por el Comité de Ética Animal de la Universidad Agrícola de Nanjing. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
SL: Curación de datos, visualización, redacción – borrador original. YG: Curación de datos, redacción, revisión y edición. XZ: Análisis formal, Redacción – revisión y edición. DL: Investigación, Escritura – Revisión y Edición. ZZ: Conceptualización, Recursos, Escritura – revisión y edición.
Financiación
Esta investigación contó con el apoyo del Programa de Desarrollo de Tecnología Aplicada a la Agricultura de Shanghái, China (2022-02-08-00-12-F01185).
Reconocimientos
Los autores agradecen a M. S. Gu Songlian por su cuidadoso cuidado de los animales de experimentación y a Gao Hang por su orientación en el diseño experimental.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1254998/full#supplementary-material
FIGURA COMPLEMENTARIA S1 | Los niveles de expresión de ARNm de los factores inflamatorios después de la sutura de la piel canina. Los niveles de expresión de ARNm (A-C) de IL-1β, IL-6 y TNF-α a los 1, 7 y 14 días después de la sutura. Niveles de expresión de ARNm (D-F) de IL-1β, IL-6 y TNF-α después de la sutura de piel canina, comparando suturas interrumpidas simples y suturas continuas simples.
FIGURA COMPLEMENTARIA S2 | Los niveles de expresión proteica de los factores inflamatorios después de la sutura de la piel canina. (De la A a la C) Los niveles de expresión proteica de IL-1β, IL-6 y TNF-α a los 1, 7 y 14 días después de la sutura. (D-F) Niveles de expresión proteica de IL-1β, IL-6 y TNF-α después de la sutura cutánea, comparando suturas interrumpidas simples y suturas continuas simples.
FIGURA COMPLEMENTARIA S3 | Los niveles de expresión de los factores inflamatorios en la fascia y el tejido muscular después de la sutura de la línea alba canina. Los niveles de expresión de ARNm (A-C) de IL-1β, IL-6 y TNF-α en la fascia y el tejido muscular a 1 día, 7 días y 3 meses después de la sutura de la línea alba. (D-F) Los niveles de expresión proteica de IL-1β, IL-6 y TNF-α en la fascia y el tejido muscular a 1 día, 7 días y 3 meses después de la sutura de la línea alba.
Referencias
1. Frassini, S, Cobianchi, L, Fugazzola, P, Biffl, WL, Coccolini, F, Damaskos, D, et al. ECLAPTE: cierre efectivo de LAParoTomy en emergencia: pautas de la Sociedad Mundial de Cirugía de Emergencia de 2023 para el cierre de la laparotomía en entornos de emergencia. World J Emerg Surg. (2023) 18:42. DOI: 10.1186/s13017-023-00511-W
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Bosanquet, DC, Ansell, J, Abdelrahman, T, Cornish, J, Harries, R, Stimpson, A, et al. Revisión sistemática y metarregresión de los factores que afectan a las tasas de hernia incisional de la línea media: análisis de 14.618 pacientes. PLoS Uno. (2015) 10:e0138745. doi: 10.1371/journal.pone.0138745
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Denys, A, Monbailliu, T, Allaeys, M, Berrevoet, F, y van Ramshorst, GH. Manejo de la dehiscencia de la herida abdominal: actualización de la literatura y metaanálisis. Hernia. (2021) 25:449–62. doi: 10.1007/s10029-020-02294-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Mingoli, A, Puggioni, A, Sgarzini, G, Luciani, G, Corzani, F, Ciccarone, F, et al. Incidencia de hernia incisional después de cirugía abdominal de emergencia. Ital J Gastroenterol Hepatol. (1999) 31:449–53.
5. Ekanem, E, Ngene, NC, Moodley, J y Konje, J. Prevención de la infección del sitio quirúrgico y la sepsis en mujeres obesas embarazadas. Mejor Pract Res Clin Obstet Gynaecol. (2023) 91:102406. doi: 10.1016/j.bpobgyn.2023.102406
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Yassien, Rhode Island, y El-ghazouly, DE. El papel de la hesperidina en la cicatrización de una herida incisa en ratas albinas adultas adultas inducidas experimentalmente. Estudio histológico e inmunohistoquímico. Egipto J Histol. (2021) 144–62. doi: 10.21608/ejh.2020.26334.1263
7. Nithya, DJ. Efecto del estado nutricional y la anemia en el proceso de cicatrización de heridas de pacientes post cesárea. Int J Salud Sci. (2023) 1:5–8. doi: 10.59585/ijhs.v1i1.43
8. Dasari, N, Jiang, A, Skochdopole, A, Chung, J, Reece, EM, Vorstenbosch, J, et al. Actualizaciones en la cicatrización de heridas diabéticas, inflamación y cicatrices. Cirugía Semin Plast Surg. (2021) 35:153–8. doi: 10.1055/s-0041-1731460
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Reilly, MJ, Larsen, NK, Agrawal, S, Thankam, FG, Agrawal, DK, y Fitzgibbons, RJ. Condiciones seleccionadas asociadas con una mayor incidencia de hernia incisional: una revisión de la biología molecular. Am J Surg. (2021) 221:942–9. doi: 10.1016/j.amjsurg.2020.09.004
10. Landén, NX, Li, D y Ståhle, M. Transición de la inflamación a la proliferación: un paso crítico durante la cicatrización de heridas. Cell Mol Life Sci. (2016) 73:3861–85. doi: 10.1007/s00018-016-2268-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Reinke, JM, y Sorg, H. Reparación y regeneración de heridas. Eur Surg Res. (2012) 49:35–43. doi: 10.1159/000339613
12. Mustoe, TA, O’Shaughnessy, K y Kloeters, O. Patogénesis de heridas crónicas y estrategias de tratamiento actuales: una hipótesis unificadora. Plast Reconstr Surg. (2006) 117:35S–41S. doi: 10.1097/01.prs.0000225431.63010.1b
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Qian, de izquierda a derecha, Fourcaudot, AB, Yamane, K, You, T, Chan, RK y Leung, KP. La inflamación exacerbada y prolongada perjudica la cicatrización de las heridas y aumenta las cicatrices. Regeneración reparadora de heridas. (2016) 24:26–34. doi: 10.1111/wrr.12381
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Reish, RG y Eriksson, E. Tratamientos con cicatrices: estudios preclínicos y clínicos. J Am Coll Surg. (2008) 206:719–30. doi: 10.1016/j.jamcollsurg.2007.11.022
15. Xue, M, y Jackson, CJ. Reorganización de la matriz extracelular durante la cicatrización de heridas y su impacto en la cicatrización anormal. Cuidado de heridas. (2015) 4:119–36. doi: 10.1089/wound.2013.0485
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Andrgie, AT, Darge, HF, Mekonnen, TW, Birhan, YS, Hanurry, EY, Chou, H-Y, et al. Hidrogel termosensible modificado con heparina cargado de ibuprofeno para inhibir la inflamación excesiva y promover la cicatrización de heridas. Polímeros. (2020) 12:2619. doi: 10.3390/polym12112619
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Huang, C, Dong, L, Zhao, B, Lu, Y, Huang, S, Yuan, Z, et al. Apósitos antiinflamatorios de hidrogel y cicatrización de heridas cutáneas. Clin Transl Med. (2022) 12:E1094. DOI: 10.1002/CTM2.1094
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Dovi, JV, He, L-K, y DiPietro, LA. Cierre acelerado de heridas en ratones con depleción de neutrófilos. J Leukoc Biol. (2003) 73:448–55. doi: 10.1189/jlb.0802406
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Martin, P, D’Souza, D, Martin, J, Grose, R, Cooper, L, Maki, R, et al. Cicatrización de heridas en el ratón nulo PU.1: la reparación tisular no depende de las células inflamatorias. Curr Biol. (2003) 13:1122–8. doi: 10.1016/S0960-9822(03)00396-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Coolen, NA, Schouten, KCWM, Boekema, BKHL, Middelkoop, E, y Ulrich, MMW. Cicatrización de heridas en un modelo fetal, adulto y de tejido cicatricial: un estudio comparativo. Regeneración reparadora de heridas. (2010) 18:291–301. doi: 10.1111/j.1524-475X.2010.00585.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Leung, A, Crombleholme, TM y Keswani, SG. Cicatrización de heridas fetales: implicaciones para la formación mínima de cicatrices. Curr Opin Pediatr. (2012) 24:371–8. doi: 10.1097/MOP.0b013e3283535790
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Streilein, Testigo de Jehová. Privilegio inmunológico ocular: el ojo tiene una visión oscura pero práctica de la inmunidad y la inflamación. J Leukoc Biol. (2003) 74:179–85. doi: 10.1189/jlb.1102574
23. Szpaderska, AM, Zuckerman, JD, y DiPietro, LA. Respuestas diferenciales a la lesión en heridas de la mucosa oral y cutáneas. J Dent Res. (2003) 82:621–6. doi: 10.1177/154405910308200810
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Rosique, RG, Rosique, MJ, y Farina Junior, JA. Frenar la inflamación en la cicatrización de heridas cutáneas: una revisión. Int J Inflamm. (2015) 2015:E316235:1–9. doi: 10.1155/2015/316235
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. de la Harpe, KM, Kondiah, PPD, Marimuthu, T, y Choonara, YE. Avances en polímeros a base de carbohidratos para el diseño de materiales de sutura: una revisión. Carbohydr Polym. (2021) 261:117860. doi: 10.1016/j.carbpol.2021.117860
26. Israelsson, LA, y Millbourn, D. Cierre de incisiones abdominales en la línea media. Arco de Langenbeck Surg. (2012) 397:1201–7. doi: 10.1007/s00423-012-1019-4
27. Li, S, Zhao, X, Deng, Y, Zhao, Y, Liu, Y, Wang, D, et al. Factores que afectan a la tensión incisional abdominal en cirugía de perros y gatos. Res Vet Sci. (2023) 156:88–94. doi: 10.1016/j.rvsc.2022.11.014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Millbourn, D, Cengiz, Y, e Israelsson, LA. Efecto de la longitud de la sutura en las complicaciones de la herida después del cierre de las incisiones de la línea media: un ensayo controlado aleatorizado. Cirugía de arco. (2009) 144:1056–9. doi: 10.1001/archsurg.2009.189
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Byrne, M, y Aly, A. La sutura quirúrgica. Aesthet Surg J. (2019) 39:S67–72. doi: 10.1093/asj/sjz036
30. Underwood, W, y Anthony, R. Directrices de AVMA para la eutanasia de animales: edición de 2020 (2013). Asociación Americana de Medicina Veterinaria, Schaumburg, IL: 2020-2021.
31. Diener, MK, Voss, S, Jensen, K, Büchler, MW y Seiler, CM. Cierre electivo de laparotomía de línea media: la revisión sistemática y el metaanálisis de INLINE. Ann Surg. (2010) 251:843–56. doi: 10.1097/SLA.0b013e3181d973e4
32. Jenkins, NPT. La herida abdominal reventada: un abordaje mecánico. Hno. J Surg. (1976) 63:873–6. doi: 10.1002/bjs.1800631110
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Wang, ZX, Jiang, CP, Cao, Y y Ding, YT. Revisión sistemática y metaanálisis de suturas recubiertas de triclosán para la prevención de la infección del sitio quirúrgico. Hno. J Surg. (2013) 100:465–73. doi: 10.1002/bjs.9062
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Schachtrupp, A, Wetter, O y Höer, J. Influencia de la presión intraabdominal elevada en la dinámica de la tensión de sutura en un modelo porcino. J Surg Res. (2019) 233:207–12. doi: 10.1016/j.jss.2018.07.043
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Novak, J, Jacisko, J, Busch, A, Cerny, P, Stribrny, M, Kovari, M, et al. La presión intraabdominal se correlaciona con la tensión de la pared abdominal durante las pruebas de evaluación clínica. Clin Biomech. (2021) 88:105426. doi: 10.1016/j.clinbiomech.2021.105426
36. Cresswell, AG, Grundström, H, y Thorstensson, A. Observaciones sobre la presión intraabdominal y los patrones de actividad intramuscular abdominal en el hombre. (1992) 144:409–18. doi: 10.1111/j.1748-1716.1992.tb09314.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. De Keulenaer, BL, De Waele, JJ, Powell, B, y Malbrain, MLNG. ¿Qué es la presión intraabdominal normal y cómo se ve afectada por la posición, la masa corporal y la presión positiva al final de la espiración? Medicina de Cuidados Intensivos. (2009) 35:969–76. doi: 10.1007/s00134-009-1445-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Förstemann, T, Trzewik, J, Holste, J, Batke, B, Konerding, MA, Wolloscheck, T, et al. Fuerzas y deformaciones de la pared abdominal: una aproximación mecánica y geométrica a la línea alba. J Biomech. (2011) 44:600–6. doi: 10.1016/j.jbiomech.2010.11.021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Högström, H, Haglund, U y Zederfeldt, B. La tensión conduce a un aumento de la acumulación de neutrófilos y a una disminución de la resistencia de la herida de laparotomía. Cirugía. (1990) 107:215–9.
40. Höer, J, Junge, K, Schachtrupp, A, Klinge, U y Schumpelick, V. Influencia de la técnica de cierre de laparotomía en la síntesis de colágeno en la región incisional. Hernia. (2002) 6:93–8. doi: 10.1007/s10029-002-0070-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Zhou, J, Zhao, H, Pan, K y Xu, Q. Reconocimiento y tratamiento actuales de la hipertensión intraabdominal y el síndrome compartimental abdominal entre los médicos de cuidados intensivos chinos terciarios. J Zhejiang Univ Sci B. (2011) 12:156–62. doi: 10.1631/jzus. B1000185
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Kasuya, A, y Tokura, Y. Intentos de acelerar la cicatrización de heridas. J Dermatol Sci. (2014) 76:169–72. doi: 10.1016/j.jdermsci.2014.11.001
43. Kant, V, Gopal, A, Pathak, NN, Kumar, P, Tandan, SK y Kumar, D. El potencial antioxidante y antiinflamatorio de la curcumina aceleró la cicatrización de heridas cutáneas en ratas diabéticas inducidas por estreptozotocina. Int Immunopharmacol. (2014) 20:322–30. doi: 10.1016/j.intimp.2014.03.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Abdel-Salam, BKA-H. Efecto modulador de las proteínas de suero de leche en algunas citoquinas implicadas en la cicatrización de heridas en ratas albinas diabéticas macho. Inflamación. (2014) 37:1616–22. doi: 10.1007/s10753-014-9888-z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Yaman, I, Derici, H, Kara, C, Kamer, E, Diniz, G, Ortac, R, et al. Efectos del resveratrol en la cicatrización de heridas incisionales en ratas. Surg hoy. (2013) 43:1433–8. doi: 10.1007/s00595-012-0455-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. van RE, BR, Almirante, C, Smit, I, y Trimbos, JB. Reacción tisular y nudos quirúrgicos: el efecto del tamaño de la sutura, la configuración del nudo y el volumen del nudo. Obstet Gynecol. (1989) 74:64–8.
47. Höer, J, Klinge, U, Schachtrupp, A, Töns, C y Schumpelick, V. Influencia de la técnica de sutura en la cicatrización de heridas de laparotomía: un estudio experimental en ratas. Arco de Langenbeck Surg. (2001) 386:218–23. doi: 10.1007/s004230000196
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Seiler, CM, Bruckner, T, Diener, MK, Papyan, A, Golcher, H, Seidlmayer, C, et al. Suturas interrumpidas o continuas de absorción lenta para el cierre de incisiones abdominales electivas primarias de la línea media: un ensayo aleatorizado multicéntrico (INSECT: ISRCTN24023541). Ann Surg. (2009) 249:576–82. doi: 10.1097/SLA.0b013e31819ec6c8
Palabras clave: tamaño de la sutura, pared abdominal, biomecánica, inflamación, reacción tisular, canino.
Cita: Li S, Guo Y, Zhao X, Lang D y Zhou Z (2023) Reacción biomecánica y tisular: los efectos de la variación del tamaño de las suturas en la sutura de la pared abdominal canina. Frente. Vet. Sci. 10:1254998. doi: 10.3389/fvets.2023.1254998
Recibido: 08 de julio de 2023; Aceptado: 27 de octubre de 2023;
Publicado: 10 noviembre 2023.
Editado por:
Sha Jiang, Universidad del Suroeste, China
Revisado por:
Luying Cui, Universidad de Yangzhou, China Na Sun, Universidad Agrícola de Shanxi, China Jiasan Zheng, Universidad Agrícola de Heilongjiang Bayi, China
Derechos de autor © 2023 Li, Guo, Zhao, Lang y Zhou. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Zhenlei Zhou, zhouzl@njau.edu.cn
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía