Hiperplasia interdigital asociada a dermatitis digital contagiosa ovina en dos ovejas
Primera descripción de la hiperplasia interdigital asociada a dermatitis digital contagiosa ovina en dos ovejas
 Maher Alsaaod1*
Maher Alsaaod1*  Robin Michael Schmid1
Robin Michael Schmid1  Nathalie Zwahlen1
Nathalie Zwahlen1  Sara Soto2
Sara Soto2  Nicole Wildi3
Nicole Wildi3  Torsten Seuberlich3
Torsten Seuberlich3  Adrian teiner1
Adrian teiner1- 1Clínica para Rumiantes, Departamento de Ciencias Veterinarias Clínicas, Facultad Vetsuisse, Universidad de Berna, Berna, Suiza
- 2Departamento de Enfermedades Infecciosas y Patobiología, Facultad de Veterinaria, Instituto de Patología Animal, Universidad de Berna, Berna, Suiza
- 3División de Ciencias Neurológicas, Facultad Vetsuisse Berna, Universidad de Berna, Berna, Suiza
La hiperplasia interdigital (IH) es un pliegue de tejido fibroso que sobresale en el espacio interdigital y que rara vez ocurre en las ovejas. Se han notificado casos de hiperplasia interdigital secundaria infectada con treponemas de dermatitis digital bovina (TDC) en bovinos en el curso de la creciente propagación de las lesiones clásicas de la DBC. En este reporte, describimos las lesiones interdigitales proliferativas/ulcerativas asociadas con treponemas de dermatitis digital ovina contagiosa (CODD) y calificadas clínicamente como (IH+CODD), que ocurren tanto en las extremidades posteriores de un carnero como en la extremidad posterior izquierda de una oveja. Ambos casos presentaron hiperplasia epidérmica, paraqueratosis y áreas focal-extensas de necrosis epidérmica con numerosos neutrófilos infiltrantes. Treponema La PCR y la hibridación fluorescente in situ (FISH) fueron positivas para el filotipo 1 de Treponema (PT1). Además, en la biopsia por PCR se detectaron Dichelobacter (D.) nodosus y Porphyromonas (P.) levii. En tres ovejas de sacrificio, sin lesiones en las garras, que se mantuvieron junto con las dos ovejas afectadas, no se detectó Treponema spp. ni con PCR ni con FISH; las PCR para D. nodosus y P. levii también fueron negativas. La curación clínica completa se produjo en la oveja dentro de las 6 semanas después de tres aplicaciones locales de un aerosol de clortetraciclina en intervalos de 2 semanas. Este informe es la primera descripción de IH+CODD en ovejas, como se demuestra mediante una combinación de análisis histopatológicos y moleculares.
Introducción
La hiperplasia interdigital (IH; fibroma interdigital; maíz en bovinos) es el crecimiento de pliegues cutáneos de la unión de la piel y el cuerno en una o ambas garras y la formación de piel interdigital hiperplásica de tamaño variable localizada dentro de la hendidura interdigital (1-3). El HI puede tener una disposición hereditaria en ovinos y bovinos, y los factores predisponentes en el ganado bovino pueden incluir estiramiento de las inserciones de los ligamentos interdigitales distales, pezuñas de forma anormal, sobrepeso de los animales, podredumbre bovina o pisos resbaladizos (1, 4–6). El HI se diagnostica con mayor frecuencia en bovinos adultos y ocasionalmente ocurre en ovejas y cabras (2, 7). El grado de cojera depende del tamaño de la lesión y de la presencia de infección del tejido digital. Se ha notificado que la dermatitis interdigital ovina (OID, escaldadura del pie) y la dermatitis digital bovina (TDC) se producen simultáneamente con el HI en ovinos (3) y bovinos (6, 8), respectivamente. La OID es causada por Fusobacterium necrophorum (F. necrophorum) y a menudo se desarrolla a ambos lados del IH, causando más dolor y cojera (3).
En bovinos, varios estudios abordaron la asociación entre el TDC y el HI (9, 10). Desde la amplia diseminación de las lesiones clásicas de BDD en la población bovina, las sobreinfecciones de lesiones de HI con Treponema spp. asociado a BDD (IH+BDD) han aumentado (11). Las especies de Treponema, implicadas en la TDC, pertenecen principalmente a los filogrupos Treponema medium, Treponema phagedenis y Treponema pedis (12, 13). Estos tres filogrupos son también los principales agentes etiológicos de la dermatitis digital ovina contagiosa (CODD) (14-16). También se han aislado otras bacterias asociadas a la cojera de las lesiones de TOC; en particular, Dichelobacter nodosus (D. nodosus) y F. necrophorum (14, 17). D. nodosus es el principal agente etiológico de la podredumbre ovina y se considera un factor de riesgo para la enfermedad de Alzheimer (14, 18).
Este es el primer reporte de IH+CODD en ovejas, y tuvo como objetivo describir los hallazgos clínicos, histopatológicos y moleculares en dos casos clínicos de IH+CODD.
Presentación del caso
En enero y febrero de 2022, un carnero (Texel, 5 años y 9 meses) y una oveja (cruza, 6 años y 10 meses) fueron inspeccionados clínicamente en el curso del control clínico de la podredumbre del pie. Ambas ovejas fueron fijadas en una manga de garras y todas las extremidades fueron puntuadas para la podredumbre de acuerdo con el Servicio Sanitario Suizo para Pequeños Rumiantes, adaptado de Egerton y Roberts (19), utilizando una escala de 0 (clínicamente sano) a 5 (pérdida completa de la cápsula del cuerno). Todas las extremidades del carnero se puntuaron como 2 (dermatitis interdigital extensa con afectación del cuerno axial), excepto la extremidad anterior izquierda que se puntuó como 3 (dermatitis interdigital grave y subrretorno del cuerno del talón y la planta del pie). Ambas extremidades traseras de la oveja fueron puntuadas como 3. Además, durante el examen se observaron lesiones ulcerativas en el área de la banda coronaria dorso-axial de ambas garras de la extremidad anterior izquierda de la oveja, que se puntuaron como CODD grado 1 según Angell et al. (20). La cojera se puntuó de acuerdo con Angell et al. (21), donde 0 = sano y 3 = cojera grave.
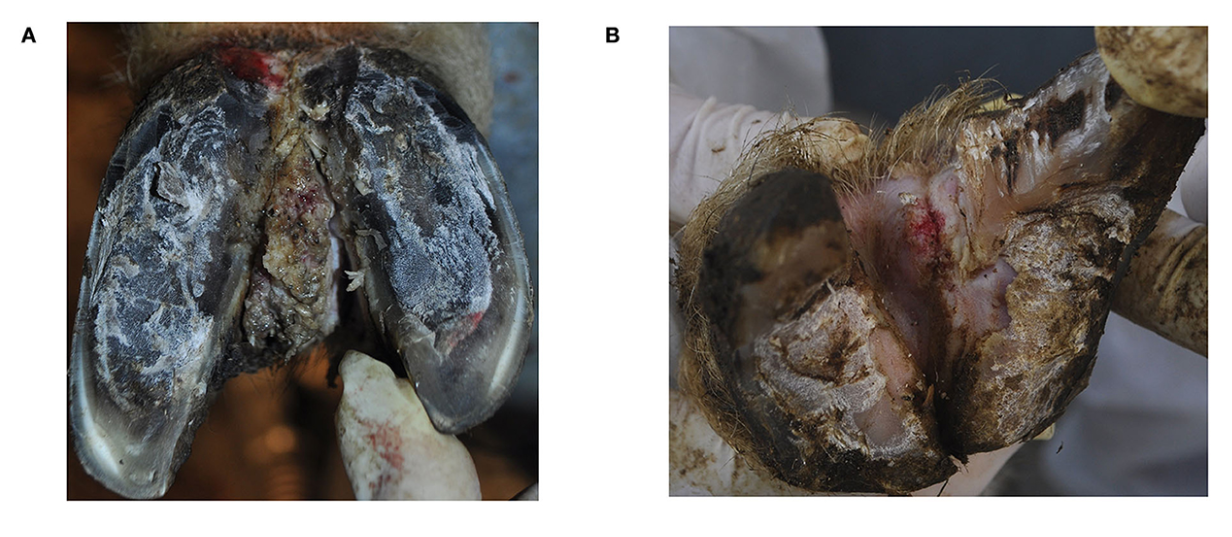
Tanto las extremidades posteriores del carnero como la extremidad posterior izquierda de la oveja mostraron adicionalmente HI con lesiones proliferativas y ulcerativas y fueron diagnosticadas clínicamente de acuerdo con Fiedler et al. (6), Alsaaod et al. (8) y el Comité Internacional para el Registro de Animales ICAR en bovinos como IH+BDD (Figuras 1A, B).
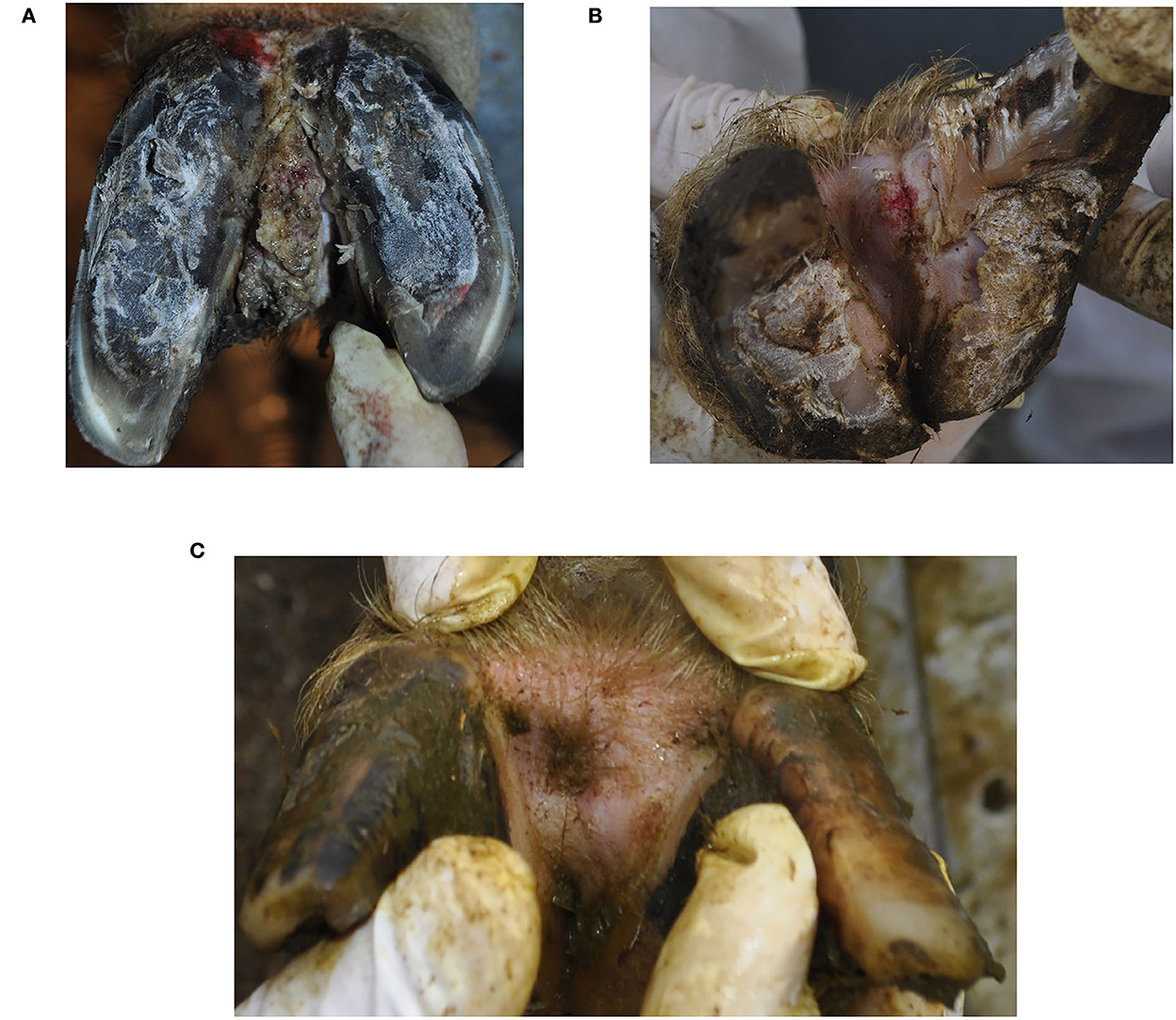 Figura 1. Aspecto clínico de la hiperplasia interdigital asociada a treponemas de dermatitis digital ovina contagiosa en un carnero (A), oveja (B) y tras la cicatrización clínica en la oveja (C). La oveja (B) también mostró signos de podredumbre (puntuación 3).
Figura 1. Aspecto clínico de la hiperplasia interdigital asociada a treponemas de dermatitis digital ovina contagiosa en un carnero (A), oveja (B) y tras la cicatrización clínica en la oveja (C). La oveja (B) también mostró signos de podredumbre (puntuación 3).
Después de la desinfección de la piel con cloro activo (AquaJet Anolyte, Reichenburg SZ, Suiza), se administró una anestesia locorregional interdigital a nivel de la falange distal 1 con lidocaína al 2% (Streuli Tiergesundheit AG, Uznach, Suiza). Después de 10 min, se recogió una biopsia del centro de la lesión con un punzón de biopsia estéril (4 mm de diámetro con una profundidad máxima de 7 mm) y se transfirió directamente a una placa de Petri estéril.®
Después de la toma de muestras de biopsia, se aplicó clortetraciclina (Cyclospray, Dr. E. Graeub AG, Berna, Suiza) por vía tópica a las lesiones sin vendaje. El propietario decidió sacrificar el carnero, y la oveja fue tratada tres veces a intervalos de 2 semanas con controles regulares de las regiones afectadas durante un período de 2 meses. La curación clínica de la lesión CODD se produjo a las 2 semanas y la de IH+CODD a las 6 semanas (Figura 1C).
Tres ovejas de sacrificio, que se mantuvieron junto con las dos ovejas afectadas, pero que no mostraron ningún signo clínico de CODD o IH, sirvieron como controles negativos. Se tomaron dos biopsias post-mortem de cada oveja control, una de la corona y otra de la piel de la hendidura interdigital, y también se transfirieron directamente a una placa de Petri estéril. Las muestras de control se agruparon a nivel animal para el cribado por PCR y se evaluaron por separado mediante histopatología teniendo en cuenta las lesiones histopatológicas más graves.
Se llevaron a cabo inspecciones clínicas periódicas de las patas de ambas ovejas en el marco de un programa continuo de control de la podredumbre de las patas (licencia de experimentación animal no. SZ-34020).
Análisis histopatológicos y biológicos moleculares
Cada biopsia individual fue seccionada longitudinalmente. La mitad de cada biopsia se utilizó para el cribado por PCR y la segunda mitad se fijó en formol tamponado neutro al 10% durante 24 h. A continuación, estas muestras se incrustaron en parafina, se cortaron en secciones de 4 μm y se montaron en portaobjetos de vidrio. Las secciones de tejido se tiñeron con hematoxilina y eosina (H&E), así como con tinción de plata (Warthin-Starry) para una mejor identificación de las espiroquetas y se examinaron microscópicamente.
El ADN se extrajo de las alícuotas de la biopsia utilizando un kit comercial de sangre y tejidos DNeasy (Qiagen, Hilden, Alemania) de acuerdo con las instrucciones del fabricante. La calidad compatible con la PCR de los aislados de ADN se confirmó mediante PCR estándar de β-actina como se describió anteriormente (22). Posteriormente, los extractos de ADN se examinaron para detectar la presencia de ADN treponémico utilizando PCR de treponema total (TT-PCR) y ensayos de PCR específicos anidados para T. medium, T. phagedenis y T. pedis, y se realizaron de acuerdo con Moe et al. (23) y Evans et al. (24), respectivamente. Todas las pruebas de PCR se realizaron con el GoTaq Green Master Mix (Promega, Suiza). Todos los productos de PCR se separaron mediante electroforesis en gel de agarosa al 1,5%, con excepción de la PCR de P. levii con un 2%.®
A continuación, las alícuotas de amplicón con resultados positivos de TT-PCR y PCR anidada (T. phagedenis) se purificaron en gel utilizando NucleoSpin Gel y PCR Clean-up Kit (Marcherey-Nagel) de acuerdo con las instrucciones del fabricante y se sometieron a secuenciación Sanger (Eurofins Genomics) utilizando los mismos pares de cebadores que para la reacción de PCR. La alineación de las secuencias directa e inversa y la identificación de cepas similares se realizaron utilizando el servidor web NCBI BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi). Para encontrar la cepa más similar, solo se utilizó la parte de la secuencia, coincidiendo en la alineación.
Se realizaron PCR para D. nodosus y F. necrophorum según Sullivan et al. (17). Los cebadores para la PCR de P. levii se diseñaron con Primer Blast (NCBI). La secuencia del cebador directo (F-Primer 677) fue 5′-AAGGCAGCTTACAAAAGTA-3′ y la del cebador inverso (R-Primer 812) fue 5′-TTTCGCTTGAGAGCATACAT-3′. Los parámetros de PCR de P. levii fueron los siguientes: 5 min a 95°C, 35 ciclos (1 min, 95°C; 1 min, 54°C; 2 min, 72°C) y 5 min a 72°C. Todos los cebadores se dirigen al gen 16S rRNA, con la excepción de la manguera para F. necrophorum, que leucotoxina (lktA).
Los resultados positivos de la PCR de D. nodosus se analizaron posteriormente mediante PCR cuantitativa (qPCR) según Stauble et al. (25) con un valor de umbral de ciclo (Ct) de < 40 calificado como positivo. Esta qPCR distinguió entre los genes de la proteasa aprV2 y aprB2, lo que permitió la detección y diferenciación directa de cepas virulentas y benignas de D. nodosus, respectivamente.
Para la hibridación fluorescente in situ (FISH), se prepararon e hibridaron secciones seriadas de 4 μm como lo describieron previamente Rasmussen et al. (26). Las sondas de oligonucleótidos incluyeron sondas específicas para el género Treponema y el filotipo 1 de Treponema (PT1). Ambas sondas fueron marcadas con 5′ con el derivado de isotiocianato Cy3 (Eurofins Genomics, Ebersberg, Alemania). La señal de hibridación se puntuó de 0 a 3 según Klitgaard et al. (27): 0 = sin hibridación, 1 = hibridación escasa, 2 = hibridación moderada y 3 = hibridación fuerte.
Resultados
El examen clínico reveló un HI grande y bilateral con lesiones proliferativas crónicas del tejido que cubría todo el HI en el carnero, mientras que un HI pequeño con una lesión ulcerosa aguda en la parte superior estaba presente en la oveja (Figuras 1A, B). Ambas ovejas mostraron pasos desiguales y fueron puntuadas como levemente cojas (puntuación = 1), ya que las extremidades afectadas no eran claramente identificables en la locomoción (puntuación = 1).
Los hallazgos histopatológicos fueron similares en las muestras de oveja y carnero (Figuras 2A, B). La epidermis era marcadamente hiperplásica y parcialmente hiperqueratósica (principalmente paraqueratosis) con áreas focal-extensas de necrosis epidérmica con presencia de numerosos neutrófilos. En la epidermis cercana, parte de los queratinocitos mostraban una degeneración celular prominente. En la superficie de la muestra se observaron colonias bacterianas de forma variable. Numerosos linfocitos y células plasmáticas, así como algunos neutrófilos y raramente eosinófilos se infiltraron en la dermis. En ambos casos, se observaron bacterias de forma helicoidal compatibles con espiroquetas en las áreas necróticas de la superficie epidérmica y entre los queratinocitos, visibles con la tinción Warthin-Starry (Figura 2C). En las muestras de los animales control, solo se observó hiperplasia epidérmica leve a moderada e inflamación dérmica linfoplasmocítica leve.
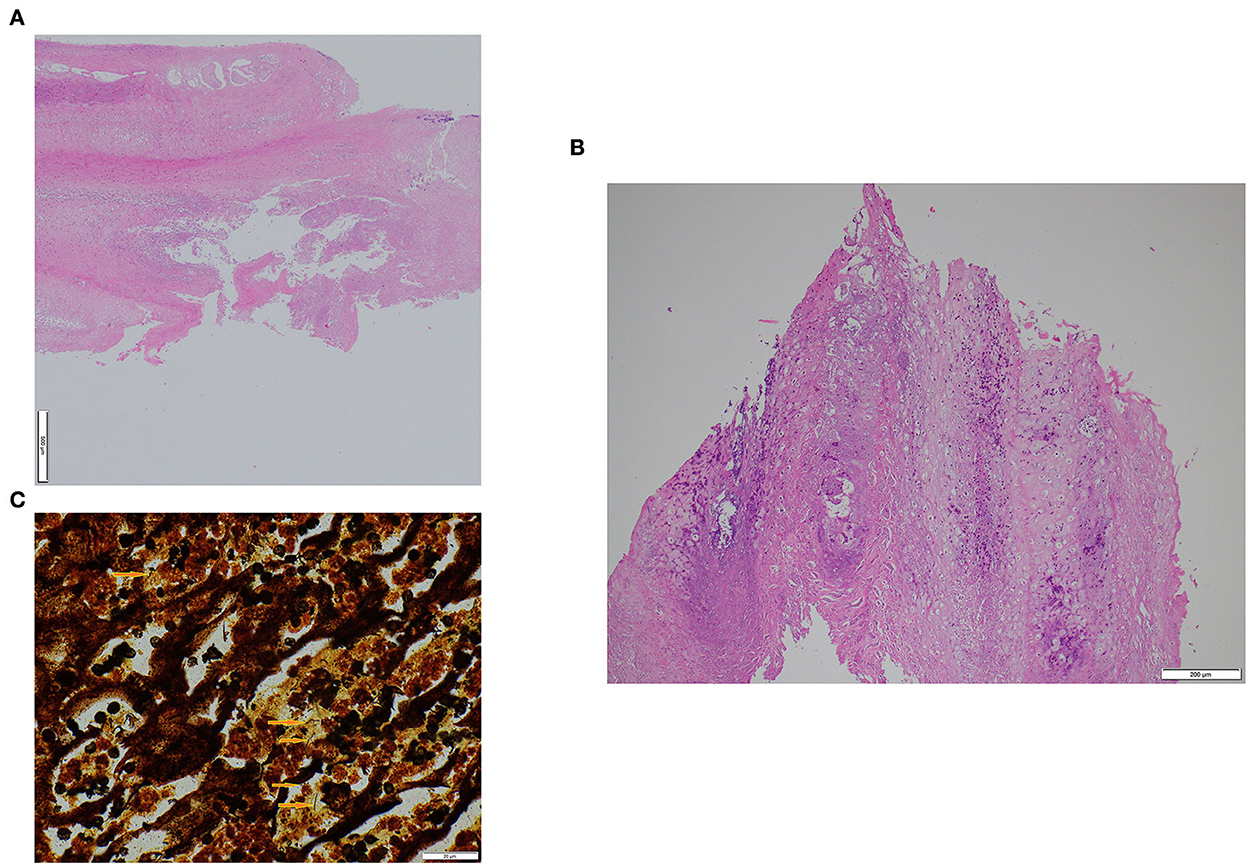 Figura 2. Aspecto histológico de la hiperplasia interdigital asociada a treponemas de dermatitis digital ovina contagiosa en un carnero (A) y una oveja (B). Tinción Warthin-Starry que muestra bacterias de forma helicoidal (flechas) compatibles con espiroquetas en el carnero (C). Aumento (100×).
Figura 2. Aspecto histológico de la hiperplasia interdigital asociada a treponemas de dermatitis digital ovina contagiosa en un carnero (A) y una oveja (B). Tinción Warthin-Starry que muestra bacterias de forma helicoidal (flechas) compatibles con espiroquetas en el carnero (C). Aumento (100×).
Las muestras de ADN de las dos biopsias procedentes del carnero y de la oveja dieron positivo en la TT-PCR y en la PCR anidada para T. phagedenis (T. medium y T. pedis no fueron detectables). Las secuencias de nucleótidos obtenidas de los dos productos de PCR de cada biopsia procedentes del carnero y la oveja, respectivamente, mostraron una identidad del 100 y el 95,29% para Treponema PT1 (número de acceso AM942445.1) para el producto TT-PCR y del 95,92 y 97,27% para Treponema PT1 (número de acceso AM942445.1) para el producto de PCR anidado.
Además de Treponema PT1, en ambas biopsias se detectaron D. nodosus y P. levii; mientras que la PCR para F. nechrophorum se mantuvo negativa. La posterior qPCR para D. nodosus fue positiva para la cepa virulenta de D. nodosus (valores de Ct = 24,5 y 24 para dos biopsias originadas en el carnero y la oveja, respectivamente).
Las muestras de las biopsias control de las tres ovejas clínicamente sanas fueron negativas para Treponema spp. (TT-PCR y PCR anidada), D. nodosus, F. necrophorum y P. levii.
Mediante FISH, la sonda general de oligonucleótidos para Treponema spp. reveló una infiltración epidérmica treponémica severa y extensa (puntuación 3) en ambas biopsias de carnero y oveja afectados (Figuras 3A, B). El análisis adicional de FISH con la sonda de oligonucleótidos específicos de Treponema PT1 reveló una fuerte hibridación (puntuación 3) (Figuras 3C, D), nuevamente en ambas biopsias de carnero y oveja afectados. Todas las biopsias procedentes de tres ovejas control fueron negativas para Treponema spp por FISH.
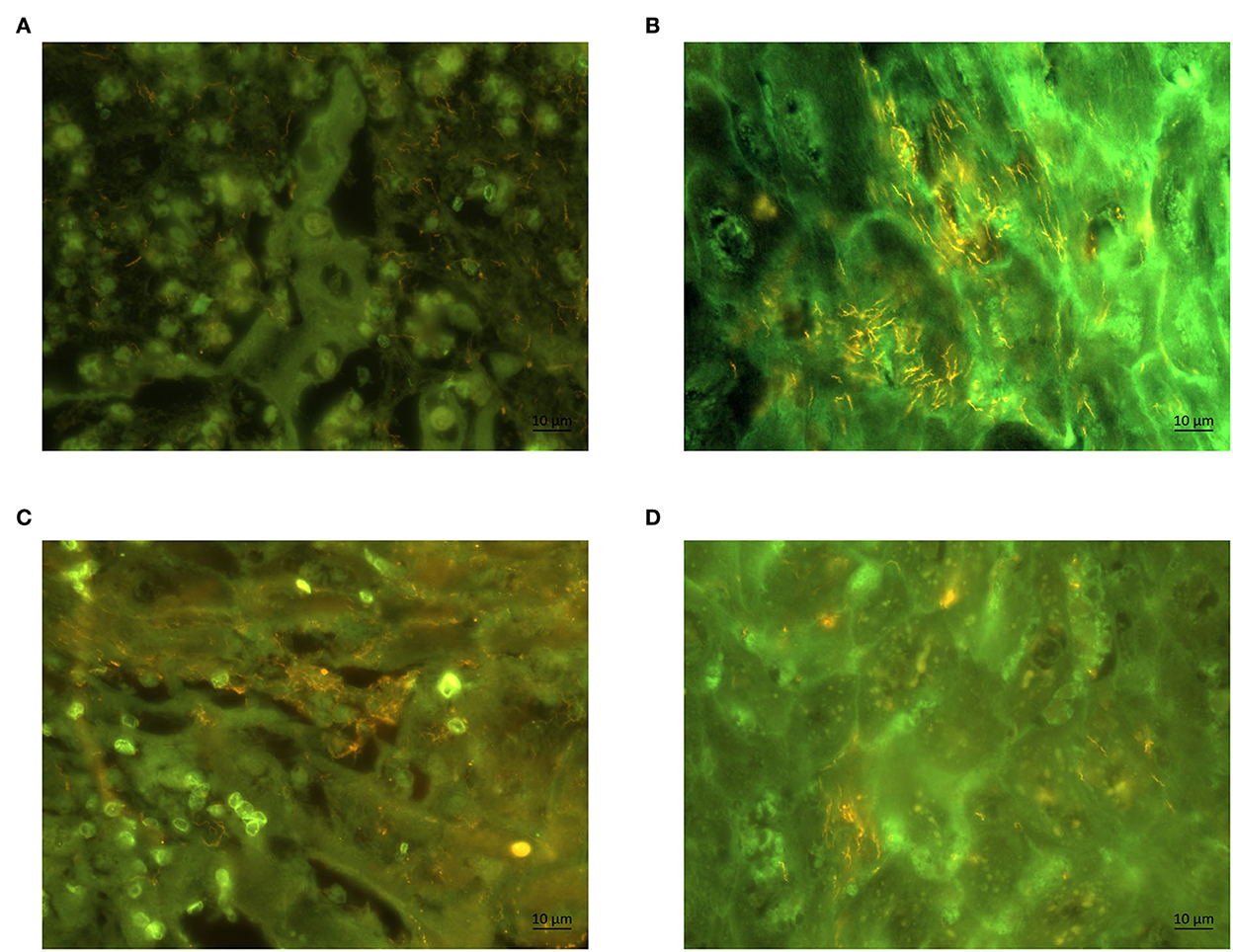 Figura 3. Hibridación fluorescente in situ de biopsias de un carnero (A) y una oveja (B) con sondas para el género Treponema (marcado con Cy3). Sección de la misma biopsia hibridada con sonda de oligonucleótidos específicos de especie (marcada con Cy3) para el filotipo PT1 de Treponema en un carnero (C) y una oveja (D). Los organismos de Treponema aparecen de color amarillo; aumento (60×).
Figura 3. Hibridación fluorescente in situ de biopsias de un carnero (A) y una oveja (B) con sondas para el género Treponema (marcado con Cy3). Sección de la misma biopsia hibridada con sonda de oligonucleótidos específicos de especie (marcada con Cy3) para el filotipo PT1 de Treponema en un carnero (C) y una oveja (D). Los organismos de Treponema aparecen de color amarillo; aumento (60×).
Discusión
De acuerdo con el mejor conocimiento de los autores, este es el primer informe que describe el HI asociado con CODD en ovejas. Se encontraron Treponema spp. en las lesiones proliferativas/ulcerativas de las muestras de tejido interdigital hiperplásico, lo que se confirmó mediante análisis histopatológicos y moleculares. Por el contrario, ni la PCR ni la FISH permitieron detectar Treponema spp. en los animales control.
La OID (escaldadura del pie) es causada por F. necrophorum (3) y su ausencia en ambos casos excluyó la etiología de la OID en nuestro informe. Ambas ovejas se vieron afectadas por la podredumbre del pie ovino causada por D. nodosus. La podredumbre del pie se considera un factor de riesgo para la enfermedad crónica (14, 28). Varios estudios han investigado la asociación de Treponema spp. con lesiones de CODD (14-16) y han planteado la hipótesis de que la CODD se derivaba de lesiones de BDD y puede haber cruzado la barrera de especies, principalmente por el copastoreo con el ganado (29). La CODD es una enfermedad infecciosa progresiva del pie, que se presenta como erosión/ulceración en la banda coronaria y termina en la avulsión de toda la cápsula del casco (20). Se desconocen las vías de infección y transmisión de Treponema spp. en ambos casos descritos, ya que en esta finca no se practicaba el copastoreo. Se sospecha la introducción de treponemas CODD por compra de portadores.
La hiperqueratosis paraqueratósica y la colonización espiroquetal en las áreas necróticas de la superficie epidérmica y entre los queratinocitos fueron las características histopatológicas más destacadas en ambos casos. Estos hallazgos son consistentes con las características histológicas típicas de la TDC (30, 31).
La PCR anidada para las especies de Treponema según Evans et al. (24) fue positiva para T. phagedenis con bandas del tamaño respectivo (400 pb) y negativa para T. medium y T. pedis. El análisis de la secuencia de ambos productos de PCR (T. phagedenis) de dos biopsias mostró que no eran específicos de la especie. De hecho, coincidieron con secuencias derivadas del Treponema PT1 aún no cultivado. Esto indica que especies de Treponema distintas de T. phagedenis están presentes en ambos casos de biopsia de IH+CODD y que la PCR anidada aplicada no es lo suficientemente específica para Treponema spp. en ovejas. Observaciones similares se encontraron mediante la secuenciación de las lesiones DD asociadas a Treponema spp., positivas para T. phagedenis de bisonte europeo en cautiverio (32). El gen 16S rRNA utilizado como diana está altamente conservado y presente en todas las bacterias. Esto podría explicar este fenómeno.
Treponema PT1 es el Treponema spp. más prevalente en las lesiones de TDC (95%), invadiendo profundamente el estrato espinoso (27). Dado que las muestras de la biopsia de control dieron negativo para las bacterias asociadas a la infección del pie conocidas, se sugiere que Treponema spp. está involucrado como patógeno bacteriano primario en las lesiones IH+CODD descritas. P. levii es un patógeno oportunista bien conocido y ya se ha aislado de lesiones de DI y BDD en bovinos (33, 34). En un estudio anterior, se demostró el papel de P. levii en la influencia de los procesos metabólicos globales de la microbiota BDD (35).
La HI se caracteriza por un pliegue de tejido fibroso que sobresale en el espacio interdigital. Representa una enfermedad poco común de los pies en las ovejas. Algo menos del 1% de los corderos suecos de sacrificio mostraron IH en el estudio de prevalencia de podredumbre del pie realizado por König et al. (7). El HI puede ser hereditario; Los carneros particularmente afectados no deben ser criados (3). En nuestro informe, solo la oveja con las lesiones menos graves fue tratada con la administración tópica de clortetraciclina. El tratamiento con clortetraciclina reveló ser eficaz para tratar el CODD (36). Las lesiones grandes de HI que causan cojera crónica pueden extirparse quirúrgicamente bajo anestesia local (37) o pueden tratarse con ácido salicílico como se realiza con éxito en el ganado bovino (8).
Conclusión
Este reporte es la primera descripción de lesiones IH+CODD en ovejas caracterizadas por la presencia de Treponema spp. en el tejido proliferativo y ulcerativo que cubre las lesiones IH. Se confirmó mediante análisis clínicos, histopatológicos y de biología molecular. Se identificaron treponema (PT1), D. nodosus y P. levii y cambios histológicos típicos que incluyen hiperqueratosis paraqueratósica y colonización espiroqueta. El IH+CODD debe considerarse para el diagnóstico diferencial de las lesiones interdigitales en ovejas.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
El estudio en animales fue revisado y aprobado por la licencia de experimentación animal no. SZ-34020. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
MA se encargó de la recopilación de datos, los análisis moleculares y la redacción del primer borrador del manuscrito. RS y Nueva Zelanda apoyaron la recopilación de datos. SS realizó los análisis histológicos. NW y TS apoyaron los análisis de los datos. AS editó el manuscrito y supervisó el estudio. Todos los autores contribuyeron al manuscrito y aprobaron la versión final.
Financiación
Este trabajo contó con el apoyo de la Beca Heard Health Management Iniciator del Instituto de Patología Animal y Clínica para Rumiantes, Facultad Vetsuisse, Universidad de Berna, Suiza.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Greenough. Hiperplasia interdigital en bovinos (callos). Manual Veterinario MSD. Rahway, Nueva Jersey (2015). Disponible en línea en: https://www.msdvetmanual.com/musculoskeletal-system/lameness-in-cattle/interdigital-hyperplasia-in-cattle
2. Phythian CJ, Cripps PJ, Grove-White D, Michalopoulou E, Duncan JS. Acuerdo interobservador para el examen clínico de las lesiones de las patas de las ovejas. Revista Veterinaria. (2016) 216:189–95. doi: 10.1016/j.tvjl.2016.08.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Invierno A. Cojera en ovejas 1. Diagnóstico en la práctica. (2004) 26:58–63. doi: 10.1136/inpract.26.2.58
4. van der Spek D, van Arendonk JAM, Bovenhuis H. Relaciones genéticas entre los rasgos de salud de las garras de las vacas lecheras en diferentes paridades, etapas de lactancia y rebaños con diferentes frecuencias de trastornos de las garras. J Lácteos Sci. (2015) 98:6564–71. doi: 10.3168/jds.2015-9561
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Desrochers A, Anderson DE, Jean GS. Enfermedades quirúrgicas y técnicas del dedo. Veterinario Clin North Am Food Animal Pract. (2008) 24:535–50. doi: 10.1016/j.cvfa.2008.07.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Fiedler A, Maierl J, Nuss K. Erkrankungen der klauen und zehen des rindes. Deutschland Georg Thieme Verlag KG. (2019) 3:1627. doi: 10.1055/b-006-161627
7. König U, Nyman AKJ, de Verdier K. Prevalencia de la podredumbre en los corderos de sacrificio suecos. Acta Veterinaria Scandinavica. (2011) 53:27. doi: 10.1186/1751-0147-53-27
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Alsaaod M, Plüss J, Studer E, Steiner A. Nicht-antibiotische Behandlung von Dermatitis digitalis infizierter Hyperplasia interdigitalis beim Milchvieh. Schweizer Archiv für Tierheilkunde. (2021) 12:17236. doi: 10.17236/sat00333
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Holzhauer M, Hardenberg C, Bartels CJ, Frankena K. Prevalencia de dermatitis digital a nivel de rebaño y vaca en los Países Bajos y factores de riesgo asociados. J Lácteos Sci. (2006) 89:580–8. doi: 10.3168/jds. S0022-0302(06)72121-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Solano L, Barkema HW, Mason S, Pajor EA, LeBlanc SJ, Orsel K. Prevalencia y distribución de lesiones en las patas en el ganado lechero en Alberta, Canadá. J Lácteos Sci. (2016) 99:6828–41. doi: 10.3168/jds.2016-10941
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Kofler. Nicht-heilende Klauenhorndefekte heilen – Therapie einer neuen Form der Mortellaro-Krankheit. en Klauentierpraxis. Österreich: Österreichische Buiatrische Gesellschaft (2016), pp. 57-65.
12. Evans NJ, Brown JM, Demirkan I, Murray RD, Vink WD, Blowey RW, et al. Tres grupos únicos de espiroquetas aisladas de lesiones de dermatitis digital en bovinos del Reino Unido. Microbiol veterinario. (2008) 130:141–50. doi: 10.1016/j.vetmic.2007.12.019
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Alsaaod M, Locher I, Jores J, Grimm P, Brodard I, Steiner A, et al. Detección de especies específicas de Treponema y Dichelobacter nodosus a partir de lesiones de dermatitis digital (enfermedad de Mortellaro) en bovinos suizos. Schweiz Arch Tierheilkd. (2019) 161:207–15. doi: 10.17236/sat00201
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Staton GJ, Angell JW, Grove-White D, Clegg SR, Carter SD, Evans NJ, Duncan JS. Dermatitis digital ovina contagiosa. Una nueva etiología bacteriana y patogénesis de la lesión. Front Vet Sci. (2021) 8:2461. doi: 10.3389/fvets.2021.722461
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Angell JW, Crosby-Durrani HE, Duncan JS, Carter SD, Blundell R. Caracterización histopatológica de las lesiones de la dermatitis digital ovina contagiosa e inmunomarcaje de organismos similares al treponema. J Comp Pathol. (2015) 153:212–26. doi: 10.1016/j.jcpa.2015.10.178
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Tegtmeyer PC, Staton GJ, Evans NJ, Rohde J, Punsmann TM, Ganter M. Primeros casos de dermatitis digital ovina contagiosa en Alemania. Acta Vet Scand. (2020) 62:46. doi: 10.1186/s13028-020-00544-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Sullivan LE, Clegg SR, Angell JW, Newbrook K, Blowey RW, Carter SD, et al. Asociación de alto nivel de dermatitis digital bovina Treponema spp. con lesiones contagiosas de dermatitis digital ovina y presencia de Fusobacterium necrophorum y Dichelobacter nodosus. J Clin Microbiol. (2015) 53:1628–38. doi: 10.1128/JCM.00180-15
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Zanolari P, Durr S, Jores J, Steiner A, Kuhnert P. Podredumbre ovina. Una revisión de los conocimientos actuales. Veterinario J. (2021) 271. doi: 10.1016/j.tvjl.2021.105647
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Egerton JR, Roberts DS. Vacunación contra la podredumbre del pie de los ovinos. J Comparat Pathol. (1971) 81:179. doi: 10.1016/0021-9975(71)90091-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Angell JW, Blundell R, Grove-White DH, Duncan JS. Características clínicas y radiográficas de la dermatitis digital contagiosa ovina y un novedoso sistema de clasificación de lesiones. Rec. Veterinario (2015) 176:544. doi: 10.1136/vr.102978
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Angell JW, Cripps PJ, Grove-White DH, Duncan JS, A. Herramienta práctica para la puntuación de la locomoción en ovejas. fiabilidad cuando es utilizado por veterinarios y ganaderos de ovejas. Rec. Veterinario (2015) 176:521. doi: 10.1136/vr.102882
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Brandt S, Haralambus R, Schoster A, Kirnbauer R, Stanek C. Las células mononucleares de sangre periférica representan un reservorio de ADN del virus del papiloma bovino en equinos afectados por sarcoides. J General Virol. (2008) 89:1390–5. doi: 10.1099/vir.0.83568-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Moe KK, Yano T, Kuwano A, Sasaki S, Misawa N. Detección de treponemas en lesiones de cancro de caballos mediante análisis de secuenciación clonal de ARNr 16S. J Vet Med Sci. (2010) 72:235–9. doi: 10.1292/jvms.09-0404
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Evans NJ, Brown JM, Demirkan I, Singh P, Getty B, Timofte D, et al. Asociación de treponemas únicos y aislados con lesiones de dermatitis digital bovina. J Clin Microbiol. (2009) 47:689–96. doi: 10.1128/JCM.01914-08
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Stauble A, Steiner A, Frey J, Kuhnert P. Detección y discriminación simultáneas de dichelobacter nodosus virulento y benigno en ovejas de rebaños afectados por pudrición de las patas y en rebaños clínicamente sanos mediante PCR competitiva en tiempo real. J Clin Microbiol. (2014) 52:1228–31. doi: 10.1128/JCM.03485-13
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Rasmussen M, Capion N, Klitgaard K, Rogdo T, Fjeldaas T, Boye M, et al. Dermatitis digital bovina. posible consorcio patógeno formado por Dichelobacter nodosus y múltiples especies de Treponema. Microbiol veterinario. (2012) 160:151–61. doi: 10.1016/j.vetmic.2012.05.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Klitgaard K, Boye M, Capion N, Jensen TK. Evidencia de múltiples filotipos de Treponema involucrados en la dermatitis digital bovina como se muestra en el análisis del gen 16S rRNA y la hibridación fluorescente in situ. J Clin Microbiol. (2008) 46:3012–20. doi: 10.1128/JCM.00670-08
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Angell JW, Grove-White DH, Duncan JS. Factores a nivel de ovino y granja asociados con la dermatitis digital ovina contagiosa. Estudio longitudinal transversal repetido de ovejas en seis explotaciones. Prev Vet Med. (2015) 122:107–20. doi: 10.1016/j.prevetmed.2015.09.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Dhawi A, Hart CA, Demirkan I, Davies IH, Carter SD. Dermatitis digital bovina y podredumbre virulenta grave del pie ovino. Patogenia espiroquetal común. Veterinario J. (2005) 169:232–41. doi: 10.1016/j.tvjl.2004.01.029
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Berry SL, Read DH, Famula TR, Mongini A, Dopfer D. Observaciones a largo plazo sobre la dinámica de las lesiones de dermatitis digital bovina en una lechería de California después del tratamiento tópico con lincomicina HCl. Vet J. (2012) 193:654–8. doi: 10.1016/j.tvjl.2012.06.048
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Léase DH, Walker RL. Dermatitis digital papilomatosa (verrugas de los pies) en ganado lechero de California. Hallazgos clínicos y anatomopatológicos macroscópicos. J Vet Diagn Invest. (1998) 10:67–76. doi: 10.1177/104063879801000112
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Hoby S, Jensen TK, Brodard I, Gurtner C, Eicher R, Steiner A, et al. Detección de treponemas en lesiones de dermatitis digital de bisonte europeo cautivo (Bison bonasus). PLoS UNO. (2021) 16:e0255921. doi: 10.1371/journal.pone.0255921
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Bay V, Griffiths B, Carter S, Evans NJ, Lenzi L, Bicalho RC, et al. La secuenciación del amplicón del ARNr 16S revela una naturaleza polimicrobiana de lesiones complicadas de disrupción del cuerno de la garra y flemón interdigital en el ganado lechero. Informes de Ciencia. (2018) 8:3993. doi: 10.1038/s41598-018-33993-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Moe KK, Yano T, Misumi K, Kubota C, Nibe K, Yamazaki W, et al. Detección de anticuerpos contra especies similares a Fusobacterium necrophorum y Porphyromonas levii en bovinos lecheros con dermatitis digital papilomatosa. Microbiol Immunol. (2010) 54:338–46. doi: 10.1111/j.1348-0421.2010.00220.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Caddey B, Orsel K, Naushad S, Derakhshani H, De Buck J. Identificación y cuantificación de la microbiota asociada a la dermatitis digital bovina en todas las etapas de la lesión en el ganado vacuno de engorde. Msistemas. (2021) 6:21. doi: 10.1128/mSystems.00708-21
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Bernhard M, Frosth S, König U. Primer informe sobre brotes de dermatitis digital ovina contagiosa en Suecia. Acta Vet Scand. (2021) 63:29. doi: 10.1186/s13028-021-00595-x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: hiperplasia interdigital, ovino, dermatitis digital ovina contagiosa (CODD), Treponema spp., cojera
Cita: Alsaaod M, Schmid RM, Zwahlen N, Soto S, Wildi N, Seuberlich T y Steiner A (2023) Primera descripción de la hiperplasia interdigital asociada a dermatitis digital ovina contagiosa en dos ovejas. Frente. Vet. Sci. 9:1028880. doi: 10.3389/fvets.2022.1028880
Recibido: 26 de agosto de 2022; Aceptado: 12 de diciembre de 2022;
Publicado: 05 Enero 2023.
Editado por:
Mohamed Zeineldin, Servicio de Inspección de Sanidad Animal y Vegetal (USDA), Estados Unidos
Revisado por:
Siti Zubaidah Ramanoon, Universiti Putra Malaysia, Malasia
Pavol Mudron, Universidad de Medicina Veterinaria y Farmacia de Košice, Eslovaquia
Derechos de autor © 2023 Alsaaod, Schmid, Zwahlen, Soto, Wildi, Seuberlich y Steiner. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Maher Alsaaod,  maher.alsaaod@vetsuisse.unibe.ch
maher.alsaaod@vetsuisse.unibe.ch
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía