Los gatos sanos toleran la alimentación diaria a largo plazo con cannabidiol
 Los gatos sanos toleran la alimentación diaria a largo plazo con cannabidiol
Los gatos sanos toleran la alimentación diaria a largo plazo con cannabidiol
 Jennifer C. Coltherd*
Jennifer C. Coltherd*  Robyn Bednall
Robyn Bednall  Anne Marie Bakke
Anne Marie Bakke  Zack Ellerby
Zack Ellerby  Cristóbal Newman
Cristóbal Newman  Phillip Watson
Phillip Watson  Darren W. Logan
Darren W. Logan  Lucy J. Holcombe*
Lucy J. Holcombe*- WALTHAM Petcare Science Institute, Waltham-on-the-Wolds, Melton Mowbray, Reino Unido
Los productos que contienen cannabidiol (CBD) están ampliamente disponibles comercialmente para los animales de compañía, lo que refleja la popularidad en el uso humano. Aunque los datos sobre la seguridad y la eficacia de la suplementación oral a largo plazo están aumentando en perros, sigue faltando evidencia en gatos. El propósito de estos estudios era abordar las lagunas en el conocimiento sobre la idoneidad y tolerancia a largo plazo de un destilado de CBD sin tetrahidrocannabinol (THC) en gatos clínicamente sanos. Los estudios fueron aleatorizados, ciegos y controlados con placebo. El primer estudio suplementó a los gatos con un aceite placebo (n = 10) o con 4 mg/kg de peso corporal (PC) de CBD en aceite placebo (n = 9) diariamente, con una comida, durante 4 semanas. La concentración de CBD en plasma se midió durante 4 h en d0 (primera dosis) y nuevamente en d14 (después de 2 semanas de dosificación diaria). El segundo estudio suplementó a los gatos diariamente con aceite placebo (n = 10) o 4 mg/kg de CBD corporal en aceite placebo (n = 10) durante un período de 26 semanas. Se realizó un conjunto completo de medidas de salud fisiológica a lo largo del estudio al inicio (semana 0) y después de 4, 10, 18 y 26 semanas de alimentación, seguido de una muestra de lavado de 4 semanas (semana 30). Los datos de la evolución temporal del CBD plasmático postprandial, tanto en d0 como en d14, mostraron una concentración máxima de CBD plasmático a las 2 h después de la dosis. Este pico fue de 251 (IC 95%: 108,7, 393,4) y 431 (IC 95%, 288,7, 573,4) ng/mL de CBD a d0 y d14, respectivamente, y la concentración de área bajo la curva fue mayor en 91,5 (IC 95%, 33,1, 149,9) ng-h/mL después de 2 semanas de suplementación (p = 0,002). Mientras que en el primer estudio el grupo de CBD mostró un aumento de la alanina aminotransferasa (ALT; 68,7 (IC del 95%, 43,23, 109,2) U/L) en la semana 4 en comparación con el grupo de control con placebo [aumento de 1,44 veces (IC del 95%, 0,813, 2,54)], se encontró equivalencia estadística (en límites de 2 veces) para la ALT a lo largo de la duración del segundo estudio a largo plazo. Todos los demás datos bioquímicos y hematológicos no mostraron diferencias clínicamente significativas entre los grupos de suplementos. Los datos presentados aquí sugieren que un destilado de CBD sin THC alimentado con una dosis de 4 mg/kg de peso corporal fue absorbido por el plasma y bien tolerado por gatos sanos cuando se suplementó durante un período de 26 semanas.
1 Introducción
El cannabis sativa, también conocido como cáñamo, contiene cientos de fitocompuestos, como el cannabidiol (CBD), el tetrahidrocannabinol (THC), el ácido cannabidiólico (CBDA), el ácido cannabigerólico (CBGA) y la cannabivarina (CBDV), por nombrar algunos. Estos compuestos difieren en sus propiedades químicas e impactos fisiológicos. El CBD es el componente principal y no psicotrópico de C. sativa, y ha recibido un gran interés en los últimos años debido a su potencial para efectos antiinflamatorios, antioxidantes, neuroprotectores y ansiolíticos (3). Como tal, se ha convertido en un candidato prometedor en muchas áreas terapéuticas, como el tratamiento del dolor en la osteoartritis, la epilepsia, la enfermedad de Alzheimer, la esclerosis múltiple y la ansiedad en humanos (3), beneficios que pueden trasladarse a los animales (4). El CBD, por lo tanto, muestra eficacia para una amplia variedad de afecciones que actúan a través de numerosas vías relacionadas con el sistema endocannabinoide (5), y estas han sido etiquetadas colectivamente como endocannabinoidoma (6), lo que indica que hay varios modos de acción potenciales. Estos incluyen, entre otros, los receptores cannabinoides acoplados a proteínas G tipo 1 y 2 (CB1 y CB2), el canal vaniloide transitorio tipo 1 (TRPV1), el receptor acoplado a proteínas G 55 (GPR55) o 119 (GPR119) y los receptores activados por proliferadores de peroxisomas (PPAR)α y γ (5). También hay efectos prometedores del CBD en el tratamiento de trastornos del neurodesarrollo como la esquizofrenia directa e indirectamente a través de los receptores de dopamina (7). El THC, un componente psicoactivo de C. sativa, se encuentra en pequeñas cantidades (menos del 0,3%) en los extractos de cáñamo (3). Cuando está presente en combinación con el CBD durante los ensayos con animales de compañía, se cree que el THC conduce a la observación de eventos adversos dependientes de la dosis más graves (8).
Hasta la fecha, ningún organismo regulador ha considerado que la literatura actual sobre seguridad y eficacia en torno al CBD sea suficiente para las mascotas (9). A pesar de esto, el uso de productos de CBD en mascotas ha aumentado a medida que han ganado terreno en el mercado humano (10). Publicaciones recientes han demostrado que 4 mg de CBD/kg de peso corporal al día administrados durante un período de 6 meses en perros son bien tolerados (11) y que una sola dosis de 4 mg/kg de peso corporal reduce la ansiedad durante un viaje en coche o una prueba de separación (12). Otro estudio que evaluó el efecto de la suplementación a largo plazo de una dosis rica en CBD en beagles encontró que generalmente era bien tolerada (13). Sin embargo, debido a la mayor frecuencia de puntuaciones fecales anormales y a una mayor fosfatasa alcalina (ALP), los autores aconsejaron precaución adicional con una dosis diaria de 10 mg/kg de peso corporal en comparación con 5 mg/kg de peso corporal (13). Por el contrario, existe muy poca información sobre la seguridad del CBD para los gatos, y no existe literatura actual sobre su eficacia en el tratamiento de trastornos.
En un estudio de tolerancia al CBD felino, ocho gatos fueron alimentados con cápsulas que contenían 2 mg/kg de CBD en aceite de pescado (mezcla 50:50 de CBD y CBDA) dos veces al día durante 12 semanas (14). Se encontró que todos los datos bioquímicos estaban dentro de los rangos normales, con la excepción de un gato que tenía niveles elevados de alanina aminotransferasa (ALT) durante el tratamiento, y no se proporcionó más información sobre la salud del gato. Los autores advirtieron fuertemente que la falta de un grupo de control limitaba la capacidad de saber si alguno de estos efectos se debía a la dosis de CBD, al aceite portador u otros factores ambientales (14). Los datos farmacocinéticos del mismo manuscrito establecieron que el CBD podía detectarse en suero durante un máximo de 8 h. En otro estudio publicado recientemente, la farmacocinética del CBD mostró un valor máximo medio de CBD de 282 mg/ml a las 2 h después de una dosis de CBD de 1,37 mg/kg (15). A estos gatos se les administró dos veces al día una pasta compuesta principalmente de CBD y CBDA (6,4 mg/g y 5,3 mg/g, respectivamente), con THC, THCA, CBG y CBGA incluidos en cantidades 25 veces menores, y las comidas se alimentaron 1 h después de la dosis (15). Al comparar perros y gatos, los datos sugieren que el CBD tiene una menor biodisponibilidad en los gatos en comparación con los perros, pero con una vida media similar (16). Aunque se sabe que los alimentos aumentan la biodisponibilidad del CBD en humanos (17), no se han realizado investigaciones postprandiales del destilado de CBD administrado en dosis bajas al mismo tiempo que una comida en gatos para comprender si este hallazgo es traducible. El fármaco anticonvulsivo Epidiolex, que contiene CBD, cuando se administró a gatos en ayunas y alimentados en un estudio de diseño cruzado a una dosis de 5 mg/kg de peso corporal, identificó un área más alta bajo la curva y una concentración máxima de CBD en el plasma de los gatos alimentados (18).®
Aquí, describimos los hallazgos de un estudio de tolerancia de 6 meses de una dosis diaria única de 4 mg/kg de un destilado de CBD libre de THC y un estudio adicional de cuatro semanas de curso de CBD plasmático postprandial en gatos adultos sanos.
2 Materiales y métodos
2.1 Animales y cría
Dos estudios fueron revisados y aprobados por el Organismo de Revisión Ética y Bienestar Animal de Waltham y se llevaron a cabo bajo la autoridad de la Ley de Animales (Procedimientos Científicos) de 1986. Para garantizar la idoneidad para el estudio, los gatos se sometieron a una evaluación de salud previa al estudio, que incluyó un examen físico por parte de un cirujano veterinario registrado y análisis hematológico, bioquímico del plasma y de orina para confirmar la ausencia de afecciones subyacentes. Los gatos fueron alojados en el Instituto de Ciencias del Cuidado de Mascotas de Waltham, agrupados en salas sociales bajo condiciones de cría rutinarias y fueron ampliamente entrenados y habituados a todos los procedimientos. Se observaron gatos dentro de estas salas sociales para la recolección de heces y orina capturada libremente. Para todas las muestras de sangre, los gatos recibieron anestesia local tópica (1 ml de crema EMLA™ al 5%; AstraZeneca) antes de la extracción de sangre yugular o cefálica. Cuando se obtuvo una muestra cefálica, se colocó un catéter de 22G, que permaneció en su lugar durante todo el período de muestreo. El día de la toma de muestras, se permitió que los gatos regresaran a sus salas sociales y se les monitoreó de cerca para detectar cualquier problema de bienestar (es decir, sacar el catéter o rascarse el área yugular). La salud de los gatos se monitorizó a través de revisiones semanales (estudio uno: curso de tiempo de CBD plasmático postprandial) y quincenal (estudio dos: prueba de tolerancia) de salud física y bioquímica, hematología y revisiones de datos de análisis de orina con cirujanos veterinarios que estaban ciegos a los grupos. A lo largo del estudio, se ofrecieron dietas comerciales de un solo lote (Royal Canin Instinctive wet y Royal Canin Fit-32 dry format) en las cantidades necesarias para mantener un peso corporal (PC) y una puntuación de condición corporal (BCS) ideales, evaluadas de acuerdo con una escala de 9 puntos. Estos se utilizaron para calcular el MER individual (19). Las dietas se sometieron a análisis de nutrientes (Eurofins, Reino Unido), y ambas fueron confirmadas como completas y equilibradas de acuerdo con los requisitos mínimos establecidos por la Asociación Americana de Funcionarios de Control de Alimentos (AAFCO). El agua estaba disponible ad libitum.®®
Estudio uno, para el curso temporal del CBD plasmático postprandial: 19 gatos adultos sanos participaron en un estudio de 4 semanas (8 gatas y 11 gatos machos, con edades comprendidas entre 1,4 y 10,1 años y un peso entre 3,42 kg y 5,58 kg).
Segundo estudio, para evaluar la tolerancia a largo plazo: 20 gatos adultos sanos participaron en un estudio de 26 semanas (6 gatas y 14 gatos machos, con edades comprendidas entre 2,1 y 10,8 años y un peso entre 3,39 kg y 5,77 kg). Dieciséis de estos 20 gatos habían participado previamente en el estudio de perfil farmacocinético, con un lavado de 9 semanas entre estudios.
2.2 Descripción y dosificación del CBD
El destilado derivado del cáñamo y el aceite placebo se adquirieron de Kazmira LLC (Colorado, Estados Unidos). El aceite de CBD fue analizado por un laboratorio externo para un análisis de espectro completo del contenido de cannabinoides (incluidos el CBD y el THC), los posibles contaminantes y la potencia (Botanacor Laboratories, Colorado, Estados Unidos). El contenido de THC estaba por debajo del límite de detección analítica (<0,02 mg/mL), y no se detectaron otros cannabinoides, excepto trazas (estimadas en 0,17 mg/mL) de cannabidivarina, por debajo del límite de cuantificación (0,32 mg/mL). El destilado se diluyó con un aceite de girasol de grado alimenticio y se aromatizó con una mezcla de sabor natural tipo pollo asado al 1% (Apex Flavors, Inc. Maryland, Estados Unidos) para proporcionar CBD a una concentración final de 43,76 mg/ml. El aceite placebo fue el aceite de girasol de grado alimenticio con 1% de pollo asado, mezcla de sabores naturales (Apex Flavors, Inc. Maryland, Estados Unidos). A cada gato se le proporcionó 8 g de «bolo» de un alimento paté comercial (Purina Gourmet Gold) con el suplemento incorporado para proporcionar una dosis de 4 mg/kg de peso corporal (la cantidad de aceite placebo se calculó como si fuera la concentración del aceite de CBD). El bolo se ofreció una vez al día, antes de la comida de la mañana, y el consumo fue registrado y monitoreado.®
2.3 Diseño del estudio
Ambos estudios fueron ciegos. Los gatos fueron aleatorizados y equilibrados en dos grupos de tratamiento paralelos: CBD y placebo. Al equilibrar los grupos, se consideraron la edad, el sexo y la ubicación de la vivienda. A continuación, los gatos se dividieron en dos escalonados para facilitar la logística (10 gatos por grupo escalonado, 4-6 gatos en cada grupo de tratamiento), con un intervalo de 1 semana entre los grupos escalonados para el inicio del ensayo y la recogida de muestras. Para dosificar con precisión el CBD, los gatos se pesaron semanalmente.
Los gatos fueron alimentados con un régimen de alimentación de alimentos húmedos y secos durante 4 semanas antes de que se recolectara una muestra de sangre de referencia para cada estudio, y este patrón de alimentación se continuó durante la duración del estudio.
2.3.1 Primer estudio: evolución temporal del CBD en plasma postprandial
Tras la recogida de una muestra de sangre en ayunas durante la noche (>14 h) (máx. 4,1 ml) el día 0 (primera dosis de CBD) y el día 14 (después de 2 semanas de suplementación diaria), los gatos recibieron una dosis oral de su aceite de CBD o placebo, mezclado con 1 ml de tentempié cremoso Sheba (ahora llamado Dreamies Creamy) de una jeringa sin aguja. Estos se consumieron voluntariamente y se administró la dosis completa antes de que se recogieran el resto de las muestras para determinar las concentraciones de CBD en el plasma a 1 h, 2 h y 4 h después de la dosis de CBD y la comida de la mañana. El resto de los días, a los gatos se les ofreció el bolo de paté con suplemento. También se recogieron muestras en ayunas en la semana 4 sin más muestreo postprandial.®®
2.3.2 Segundo estudio: prueba de tolerancia a largo plazo
Se recogieron muestras de sangre en ayunas durante la noche (>14 h) (máx. 4,8 ml) en las semanas 0, 4, 10, 18 y 26. Se recogió una muestra de sangre adicional (semana 30) 4 semanas después de suspender la suplementación. Se recolectó una muestra de sangre para un chequeo de salud veterinario en la semana 2, y esto no se analizó como parte del conjunto de datos del ensayo. Por razones logísticas, se recogieron muestras de heces y orina entre 3 y 9 días después de la toma de muestras de sangre (en las semanas 0, 10, 18 y 26) para análisis de orina (solo orina) y análisis de CBD.
2.4 Medidas y análisis
2.4.1 Mediciones basadas en sangre
La sangre tratada con heparina de litio se centrifugó a 2.000 g, y el plasma resultante se utilizó para la determinación de los parámetros bioquímicos estándar: proteína total, albúmina, fosfato inorgánico, fosfatasa alcalina (ALP), alanina aminotransferasa (ALT), aspartato aminotransferasa (AST), calcio, colesterol, urea, creatinina, triglicéridos, magnesio, sodio, potasio, cloruro y glucosa, utilizando un analizador AU480 (Beckman Coulter, Estados Unidos). Se recolectó sangre tratada con EDTA para la medición de parámetros hematológicos estándar utilizando un analizador de hematología automatizado diferencial de tres partes (IDEXX ProCyte Dx, Buckinghamshire, Reino Unido). Los parámetros medidos fueron el recuento total de leucocitos, el recuento diferenciado de leucocitos en número y porcentaje (neutrófilos, eosinófilos, basófilos, linfocitos y monocitos), el recuento total de eritrocitos, la concentración de hemoglobina, el hematocrito, el volumen corpuscular medio, la hemoglobina corpuscular media, la concentración media de hemoglobina corpuscular, el ancho de distribución de los eritrocitos, el recuento de plaquetas y el volumen medio de plaquetas. También se recolectó sangre tratada con EDTA para la cuantificación del CBD. La sangre sérica activada por coágulos se centrifugó y almacenó a 4 °C antes del análisis por IDEXX Laboratories (Reino Unido), y se midió la bilirrubina total, la gamma-glutamil transferasa (GGT) y los ácidos biliares en ayunas utilizando un analizador de química clínica AU5800 (Beckman Coulter; Estados Unidos). Además, al inicio y a las 26 y 30 semanas, se utilizó sangre sérica activada por coágulos para evaluar los marcadores de recambio óseo: fosfatasa alcalina específica del hueso (BALP) y enlaces cruzados de telopéptido carboxiterminal (CTx) utilizando el kit ELISA MicroVue™ BALP (Quidel, Estados Unidos) y el kit SERUM CrossLaps CTX-I ELISA (Immunodiagnostic Systems Limited; Reino Unido), respectivamente. Ambos ensayos se realizaron de acuerdo con las instrucciones del fabricante en un lector de placas Synergy HT (Agilent Technologies, Estados Unidos) y tienen límites de sensibilidad de 0,7 U/L para BALP y 0,02 ng/mL CTX. Los rangos de referencia, cuando se muestran, se refieren a los publicados por Antech Diagnostic Laboratories para el análisis bioquímico y IDEXX Laboratories (Reino Unido) para obtener datos completos de hemograma y panel hepático (bilirrubina, GGT y ácidos biliares).®®
2.4.2 Análisis de orina
La orina se recolectó (volumen total mínimo de 3 mL) utilizando un método de captura libre con un uripet (Fisher Scientific; Reino Unido), 1 semana después de los puntos temporales de la muestra de sangre, es decir, en las semanas 1, 11, 19 y 27. La gravedad específica de la orina se midió con un refractómetro (J.A.K. Marketing Ltd., Reino Unido), y se analizaron la glucosa, la bilirrubina, la cetona, la gravedad específica, la sangre, el pH, las proteínas, el urobilinógeno, el nitrito y los leucocitos utilizando el analizador Status Plus con tiras reactivas de orina Multistix 10SG (Siemens Healthcare Limited; Reino Unido). También se procesó una alícuota de orina para la cuantificación del CBD.®
2.5 Recogida de heces
Se recogió una única muestra fecal fresca junto con orina en las semanas 1, 11, 19 y 27, se obtuvo una muestra central y se cuantificaron los niveles de CBD.
2.6 Extracción de CBD y análisis por espectrometría de masas
La extracción y el análisis del CBD en muestras se adaptaron del método utilizado por Vaughn et al. (20), totalmente validado internamente (11). En resumen, para las muestras de orina, el patrón interno (300 μL de 40 ng/mL, CBD-d3) se alícuota en 100 μL de orina felina y se agitó en vórtice durante 5 s. Las muestras se centrifugaron (13.201 g durante 5 min) y 325 μL del sobrenadante se alícuota en un vial de vidrio ámbar etiquetado que contenía 650 μL de ácido fórmico al 0,1% en agua. La muestra fue sometida nuevamente a vórtice (5 s) y analizada como se describe. Para las muestras fecales felinas, el patrón interno (750 μL de 300 ng/mL, CBD-d3) se alícuota en tubos de microfuga que contenían 0,25 g (±0,01 g) de heces y se agitó en vórtice durante 30 min. Las muestras se centrifugaron (2.292 g durante 10 min) y 390 μL del sobrenadante se alícuota en un tubo nuevo que contenía 780 μL de ácido fórmico al 0,1% en agua y se agitaron en vórtice (5 s) y se centrifugaron por segunda vez (17.968 g durante 10 min). El sobrenadante se alícuota a un frasco de vidrio ámbar marcado, se volvió a vortexizar (5 s) y se analizó como se describe. Para el plasma, el patrón interno (60 μL de 40 ng/mL, CBD-d3) se alícuota en 20 μL de plasma felino y se agitó en vórtice durante 5 s. Las muestras se centrifugaron (13.201 g durante 5 min) y 65 μL del sobrenadante se alícuota en un vial de vidrio ámbar marcado que contenía 130 μL de ácido fórmico al 0,1% en agua. La muestra fue sometida nuevamente a vórtice (5 s) y analizada como se describe.
Para el análisis se utilizó un cromatógrafo de líquidos acoplado a un espectrómetro de masas de triple cuadrupolo (Agilent 6460C LC-QQQ-MS, Agilent, Estados Unidos). Se utilizó una columna Kinetex de fenil-hexilo 100A, 50 × 2,1 mm de 2,6 μm junto con un protector de columna de fenilo de cromatografía líquida de ultra alta resolución (UHPLC) de cartucho X3 SecurityGuard ULTRA (Phenomenex, Cheshire, Reino Unido). La fase móvil se administró a un caudal de 0,4 mL/min, y los parámetros de gradiente fueron los siguientes (el disolvente A fue 0,1% de ácido fórmico en agua de ultra alta calidad (UHQ) y el disolvente B fue 0,1% de ácido fórmico en acetonitrilo): 0 min: 30% B, 5,3 min: 95% B, 6,3 min: 70% B. Las condiciones de escaneo estaban en modo de monitoreo de reacción múltiple (MRM). Los materiales de referencia certificados Cannabidiol (CBD) y Cannabidiol-D3 (CBD-d3, utilizado como patrón interno) se obtuvieron de Fisher (Loughborough, Reino Unido). Las muestras se analizaron con un conjunto de 10 estándares de linealidad entre 0,25 y 2.000 ng/mL de CBD, cada uno preparado con CBD-d3 hasta una concentración final de 10 ng/mL.
2.7 Análisis estadístico
2.7.1 Análisis de potencia
El tamaño de la muestra para este estudio se determinó a través de un análisis de potencia a priori por simulación, para la medida primaria de ALT. Se utilizaron mediciones de ALT de gatos adultos a partir de conjuntos de datos históricos para estimar los componentes de varianza dentro y entre gatos. Utilizando estos componentes de varianza, se simularon conjuntos de datos en el diseño descrito para el estudio de tolerancia (paralelo con 2 tratamientos, 6 puntos de tiempo incluyendo la línea de base) para un rango de números de gatos. Para cada tamaño de cohorte, se simularon 1.000 conjuntos de datos, y se aplicaron a cada uno el análisis y las comparaciones planificadas que se describen a continuación. La potencia se calculó como el porcentaje de los 1.000 conjuntos de datos en los que se podía declarar la equivalencia en límites de 2 veces, utilizando un nivel de significación del 5%, dado que no se había inducido ninguna diferencia entre los grupos de tratamiento o los puntos temporales.
El tamaño estimado de la muestra requerido para alcanzar una potencia del 80% fue de 12 gatos (6 por grupo de tratamiento). Dada la naturaleza del estudio y el potencial de fatiga del estudio, el tamaño total de la muestra se infló a 20 gatos (10 por grupo de tratamiento). Esta alimentación se utilizó tanto para el estudio 1 como para el estudio 2.
2.7.2 Alanina aminotransferasa
Para ALT, se ajustó un modelo lineal mixto a la concentración log10, con el grupo de tratamiento, el punto de tiempo (es decir, semanas en el ensayo) y su interacción como efectos fijos categóricos, y un intercepto aleatorio para el animal. Dentro de cada grupo de tratamiento, se probaron comparaciones entre el inicio y cada punto de tiempo subsiguiente, y en cada punto de tiempo, también se probó una comparación entre los grupos de tratamiento. Todas las comparaciones se probaron para determinar la equivalencia en límites de 2 veces utilizando dos pruebas unilaterales (TOST) a un nivel de significación del 5%, ajustadas por la tasa de error por familia (FWER; utilizando el método de «un solo paso» del paquete R «multcomp» implementado a través de la función glht). Obsérvese que el ajuste de FWER se realizó de acuerdo con el número de contrastes realizados, donde los contrastes se definen como cada par de TOST, debido al requisito de que ambas pruebas fueran significativas para inferir equivalencia. Se informan valores p significativos para las pruebas, junto con las estimaciones de la diferencia (es decir, cambios en el pliegue) con intervalos de confianza del 95% en cada caso. También se proporcionan estimaciones retrotransformadas de la media y de los intervalos de confianza del 95% corregidos por FWE para cada tratamiento/punto temporal.
2.7.3 Medidas secundarias
Para las medidas secundarias, excluyendo aquellas con muestras insuficientes (LIH, GGT, PDW, P_LCR) o con variabilidad muestral insuficiente (BCS), los modelos mixtos lineales se ajustaron con las mismas estructuras de efectos fijos y aleatorios que para ALT. Los supuestos de normalidad se evaluaron mediante la inspección visual de los residuos y, si se consideraba que se violaba este supuesto, la variable de respuesta se transformó log10. Se probaron comparaciones planificadas por pares entre los grupos en cada punto temporal y entre la línea de base y cada punto temporal posterior para cada grupo en busca de diferencias a un nivel de significación del 5%, con corrección de multiplicidad (FWE, ‘single-step’) aplicada dentro de los modelos, pero no entre ellos. Se reportan valores p significativos junto con las correspondientes estimaciones de diferencias e intervalos de confianza del 95% en cada caso. También se proporcionan estimaciones de la media y de los intervalos de confianza del 95% para cada tratamiento/punto temporal. El CBD en ayunas en plasma, para el grupo de CBD de las semanas 2 a 26, se modeló con un único efecto fijo categórico de punto de tiempo, una intersección aleatoria para el animal, más la incorporación de pesos de varianza por punto de tiempo, debido a las diferencias anticipadas en la variabilidad del CBD plasmático a lo largo del tiempo. Se imputaron todos los valores por debajo del nivel de detalle. Se informan las medias y los intervalos de confianza ajustados del 95% para los datos modelados, junto con los datos brutos para todos los grupos y puntos temporales. No se informan contrastes por pares.
2.7.4 Concentraciones de CBD en el plasma sanguíneo y el AUC
Se analizaron tanto las concentraciones de CBD en el plasma sanguíneo (en cada punto temporal) como el área bajo la curva (AUC calculado por hora y durante las 4 h posteriores a la ingestión) como variables de resultado adicionales. El AUC se calculó utilizando un método trapezoidal lineal a través de un código personalizado implementado en R.
çDebido a que las mediciones para el grupo placebo estaban unánimemente por debajo de la LOD, los datos de este grupo se excluyeron de estos análisis. Para el AUC, se ajustó un modelo mixto lineal a los datos solo para el grupo de tratamiento con CBD, sin transformar, con el punto de tiempo (es decir, semanas 0 vs. 2) como único efecto fijo, y una intersección aleatoria para el animal. Para la concentración de CBD crudo, se volvió a ajustar un modelo mixto lineal a los datos del grupo de tratamiento con CBD, sin transformar, con el punto de tiempo (es decir, la semana 0 frente a 2), la hora (0 frente a 1 frente a 2 frente a 4, codificados categóricamente) y su interacción bidireccional como efectos fijos, más una intercepción aleatoria para el animal. Para el modelo de CBD crudo, se aplicó una ponderación de la varianza (utilizando el paquete R ‘nlme’) debido a la heterocedasticidad entre los puntos de tiempo (es decir, la varianza fue mucho menor en la hora 0). Se informan comparaciones por pares entre los puntos de tiempo y se trazan los IC del 95% corregidos por FWE para la comparación visual con el LOD (12,0).
2.7.5 Software y paquetes estadísticos
Todos los análisis se realizaron en R versión 4.2.2 (2022-10-31), R Foundation for Statistical Computing (21). Los paquetes necesarios para el análisis fueron lme4 (22), nlme (23) y multcomp (24).
3 Resultados
3.1 Estudio del curso de tiempo de CBD en plasma postprandial
3.1.1 Observaciones del estudio
A las 4 semanas, se observó que tres gatos tenían respuestas inusuales. Un gato tenía sangre en la orina sin otros signos de enfermedad, un gato tenía ALT y AST altas asintomáticas, y el tercer gato tenía inapetencia, pirexia y ALT y AST altas. Ambos gatos que mostraron un aumento de ALT y AST estaban en el grupo de CBD y posteriormente se eliminaron de la consideración para el estudio a largo plazo. La consulta veterinaria determinó la presencia de infección en el gato piréxico. Debido a la identificación de una causa probable no relacionada con el tratamiento para las respuestas elevadas de este individuo, sus datos se eliminaron del estudio antes del análisis estadístico. En el análisis se incluyeron los datos registrados de los otros dos gatos.
3.1.2 Peso corporal e ingesta de alimentos
Todos los gatos que completaron el estudio se mantuvieron dentro del 6% de su peso inicial. La dosificación del suplemento en una pequeña cantidad de alimento paté fue generalmente aceptada por los gatos. Cinco gatos en total no consumieron el bolo completo en todas las ocasiones ofrecidas. Dos gatos rechazaron el bolo completo de paté de 8 g (que contenía el suplemento): uno en el grupo de CBD en una ocasión y el otro en el grupo de placebo en 2 días no consecutivos. Hubo 15 rechazos parciales que involucraron 5 g de bolo de paté o menos durante el estudio, divididos entre cinco gatos (tres en el grupo de placebo y dos en el grupo de CBD). Los tres gatos en el grupo de placebo representaron 13 de los rechazos parciales.
3.1.3 Evolución temporal del CBD plasmático postprandial después de la primera dosis y después de 2 semanas de administración
En d0 (semana 0) y semana 2, la concentración máxima media de CBD en el plasma se produjo 2 h después de la administración (p < 0,001; Figura 1A). La concentración media de CBD en ayunas (hora 0) fue mayor en la semana 2 que en la d0 (p < 0,001; Figura 2A), que muestra que el CBD permanece detectable en el plasma hasta 24 horas después de la dosificación. Aunque no hubo diferencias significativas postprandialmente (h 1, 2 y 4) entre las concentraciones de la semana 2 y d0 (p ≥ 0,12, Figura 2A), los datos del área bajo la curva, recogidos durante el período de muestra de 4 h, fueron significativamente mayores en la semana 2 (246,9 ng-h/mL, IC 95%: 188,4, 305,5) que en la primera dosis (155,4 ng-h/mL, IC 95%: 96,9, 214,0, p = 0,002, Figura 2B). Durante todo el curso de 4 h, los datos de AUC fueron de 621,7 (IC del 95%: 387,5, 855,9) y 987,7 ng/ml (IC del 95%: 753,5, 1222,0) para la primera dosis y en la semana 2, respectivamente. En la semana 4, la concentración media de CBD en ayunas fue de 16,32 (rango de 10,8 a 28,03) ng/ml (datos no mostrados).
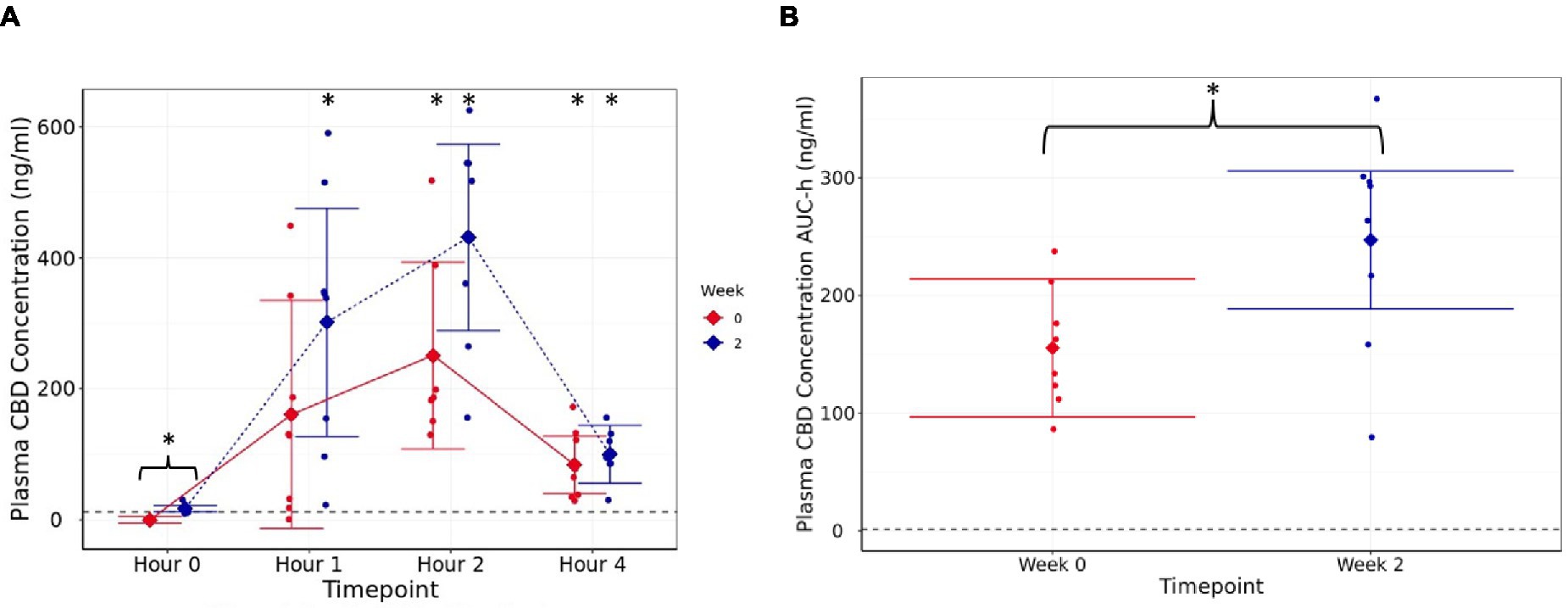 Figura 1. Concentración plasmática de CBD (ng/mL) (A) media estimada con intervalos de confianza del 95%, en h 0 (línea de base en ayunas), h 1, 2 y 4 medidas en la semana 0 (d0, primer suplemento de 4 mg/kg de peso corporal, línea sólida) y en la semana 2 (después de 14 días de suplementación diaria a 4 mg/kg de peso corporal, línea punteada), (B) área bajo la curva (por hora) durante el período farmacocinético de 4 h para cada punto de tiempo (semanas). La línea discontinua muestra el límite de detección. * muestra diferencia entre el punto de tiempo posterior a la dosis, y h 0 es estadísticamente significativo. La presencia de un «}» indica además que la diferencia es entre la semana 0 y la semana 2.
Figura 1. Concentración plasmática de CBD (ng/mL) (A) media estimada con intervalos de confianza del 95%, en h 0 (línea de base en ayunas), h 1, 2 y 4 medidas en la semana 0 (d0, primer suplemento de 4 mg/kg de peso corporal, línea sólida) y en la semana 2 (después de 14 días de suplementación diaria a 4 mg/kg de peso corporal, línea punteada), (B) área bajo la curva (por hora) durante el período farmacocinético de 4 h para cada punto de tiempo (semanas). La línea discontinua muestra el límite de detección. * muestra diferencia entre el punto de tiempo posterior a la dosis, y h 0 es estadísticamente significativo. La presencia de un «}» indica además que la diferencia es entre la semana 0 y la semana 2.
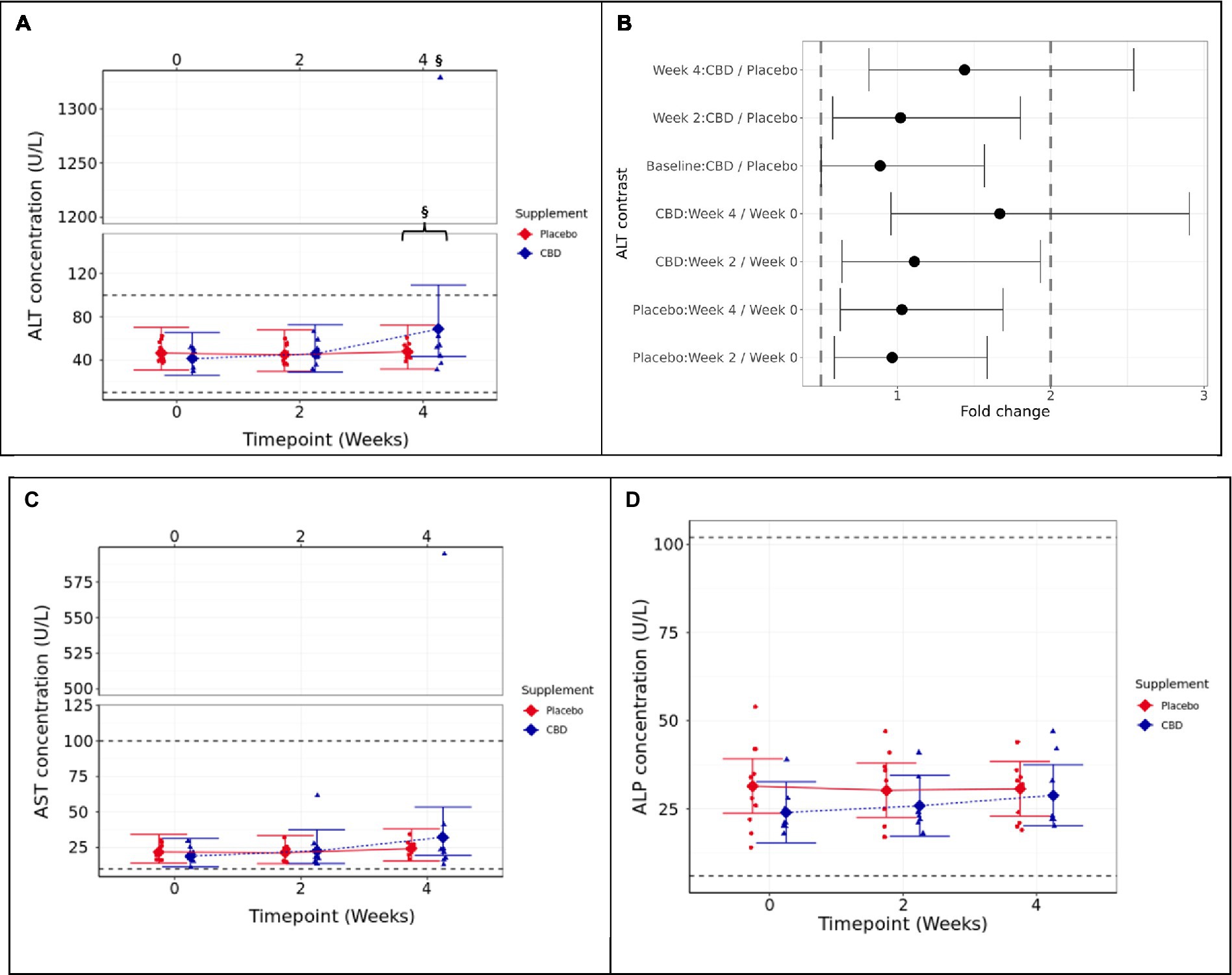 Figura 2. Medias e intervalos de confianza (IC) del 95% para las mediciones plasmáticas en ayunas durante el estudio de 4 semanas (A) ALT (U/L), (B) dos pruebas unilaterales (TOST) gráfico de contraste de cambio de pliegue, (C) AST (U/L) y (D) ALP (U/L). § indica que no se admite la equivalencia entre el punto de tiempo y la semana 0 (p ≥ 0,05). La presencia de un «}» indica además la no equivalencia entre los grupos de tratamiento con CBD y placebo. Los rangos de referencia se incluyen como líneas horizontales discontinuas a lo largo de la figura. Los umbrales TOST se muestran con líneas verticales discontinuas. La equivalencia estadística está indicada por IC que se encuentran completamente dentro de estos límites (cierto para todos los contrastes excepto para la semana 4: CBD vs. placebo, y CBD: semana 4 vs. 0). La diferencia estadística se indica mediante IC que caen completamente a la izquierda o a la derecha del cambio de 1 pupl. Parámetros de salud hepática.
Figura 2. Medias e intervalos de confianza (IC) del 95% para las mediciones plasmáticas en ayunas durante el estudio de 4 semanas (A) ALT (U/L), (B) dos pruebas unilaterales (TOST) gráfico de contraste de cambio de pliegue, (C) AST (U/L) y (D) ALP (U/L). § indica que no se admite la equivalencia entre el punto de tiempo y la semana 0 (p ≥ 0,05). La presencia de un «}» indica además la no equivalencia entre los grupos de tratamiento con CBD y placebo. Los rangos de referencia se incluyen como líneas horizontales discontinuas a lo largo de la figura. Los umbrales TOST se muestran con líneas verticales discontinuas. La equivalencia estadística está indicada por IC que se encuentran completamente dentro de estos límites (cierto para todos los contrastes excepto para la semana 4: CBD vs. placebo, y CBD: semana 4 vs. 0). La diferencia estadística se indica mediante IC que caen completamente a la izquierda o a la derecha del cambio de 1 pupl. Parámetros de salud hepática.
3.1.4 Parámetros de salud hepática
Para el grupo de tratamiento con CBD, dos pruebas unilaterales (TOST) no lograron verificar que la concentración media de ALT de la semana 4 estuviera por debajo del límite superior de 2 veces en comparación con la semana 0 o el grupo de control con placebo (p ≥ 0,388; Figuras 3A, B). Los resultados indican que los gatos en el grupo de tratamiento con CBD tenían una mayor concentración media de ALT en la semana 4 (cambio de 1,667 veces) en comparación con la semana 0 y también en comparación con los gatos de control con placebo (cambio de 1,438 veces).
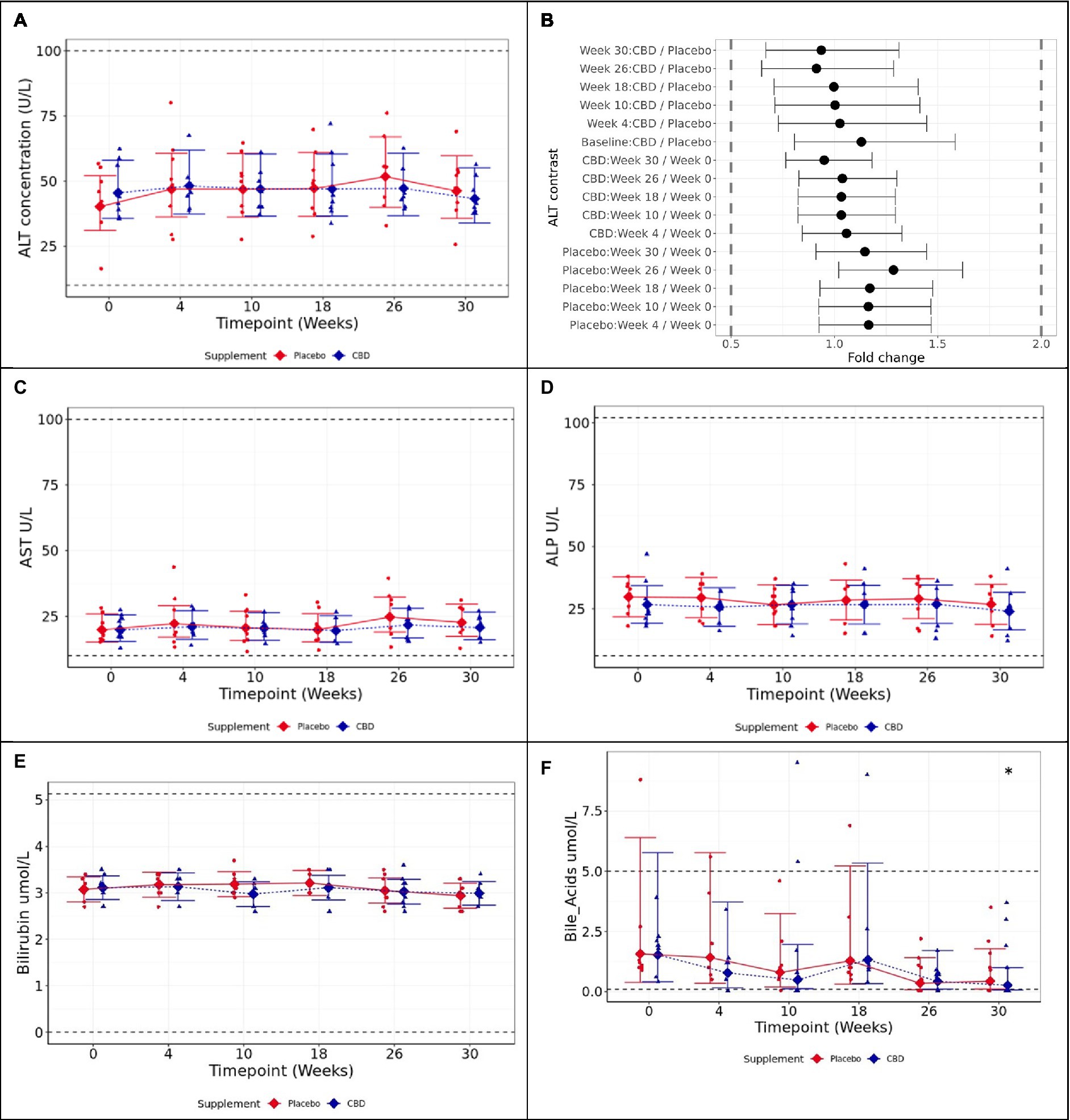 Figura 3. Medias e intervalos de confianza (IC) del 95% en las mediciones plasmáticas en ayunas durante el estudio (A) ALT (U/L), (B) dos pruebas unilaterales (TOST) gráfico de contraste de cambio de pliegue, (C) AST (U/L), (D) ALP (U/L), (E) bilirrubina (μmol/L) y (F) ácidos biliares (μmol/L). * muestra diferencia entre el punto de tiempo, y la semana 0 es estadísticamente significativa (p < 0,05). Los rangos de referencia se incluyen como líneas horizontales discontinuas a lo largo de la figura. Los umbrales TOST se muestran con líneas verticales discontinuas. La equivalencia estadística se indica mediante IC que se encuentran completamente dentro de estos límites (es cierto para todos los contrastes). La diferencia estadística se indica mediante IC que caen completamente a la izquierda o a la derecha del cambio de 1 pupl.
Figura 3. Medias e intervalos de confianza (IC) del 95% en las mediciones plasmáticas en ayunas durante el estudio (A) ALT (U/L), (B) dos pruebas unilaterales (TOST) gráfico de contraste de cambio de pliegue, (C) AST (U/L), (D) ALP (U/L), (E) bilirrubina (μmol/L) y (F) ácidos biliares (μmol/L). * muestra diferencia entre el punto de tiempo, y la semana 0 es estadísticamente significativa (p < 0,05). Los rangos de referencia se incluyen como líneas horizontales discontinuas a lo largo de la figura. Los umbrales TOST se muestran con líneas verticales discontinuas. La equivalencia estadística se indica mediante IC que se encuentran completamente dentro de estos límites (es cierto para todos los contrastes). La diferencia estadística se indica mediante IC que caen completamente a la izquierda o a la derecha del cambio de 1 pupl.
La aspartato aminotransferasa (AST) siguió una tendencia similar a los datos de ALT, y el gato tratado con CBD que mostró una ALT extremadamente alta también tuvo un valor alto de AST. Sin embargo, esto no resultó en una diferencia significativa entre los grupos en la semana 4 (p = 0,81), ni entre la semana 4 y el inicio (p = 0,112; Figura 3C). También se encontró que la fosfatasa alcalina (ALP) no difiere significativamente entre los grupos de tratamiento (p ≥ 0,447) o a lo largo del tiempo (p ≥ 0,062; Figura 3D). La bilirrubina y los ácidos biliares en ayunas no fueron significativamente diferentes entre los grupos (datos suplementarios S1).
3.2 Estudio de tolerancia a largo plazo
3.2.1 Observaciones y/o bajas del estudio
Tres gatos en total fueron retirados del ensayo en la semana 10: uno por un comportamiento consistentemente deficiente durante el muestreo (a partir de la semana 4), uno por ALT alta (a partir de la semana 4) y otro por inapetencia, ácidos biliares en ayunas altos y ALT alta (semana 10). La consulta veterinaria determinó la presencia de infección en los dos gatos retirados del ensayo para la ALT alta: uno era del grupo placebo y el otro del grupo CBD. Los datos de estos tres gatos estaban incompletos y, por lo tanto, se excluyeron del análisis estadístico.
3.2.2 Peso corporal e ingesta de alimentos
Todos los gatos que completaron el estudio se mantuvieron dentro del 11% de su peso inicial. La tasa de rechazo del bolo fue inferior al 1,5% del total de ofertas durante la duración del estudio. Un gato del grupo de CBD rechazó por completo el bolo en una ocasión. Además, cinco gatos tuvieron rechazos parciales del bolo: dos en el grupo placebo (1 rechazo parcial cada uno) y tres gatos del grupo CBD. Dos de los gatos del grupo de CBD se negaron parcialmente en 15 y 7 ocasiones, respectivamente, y el otro gato se negó parcialmente en 1 ocasión.
3.2.3 Parámetros de salud hepática
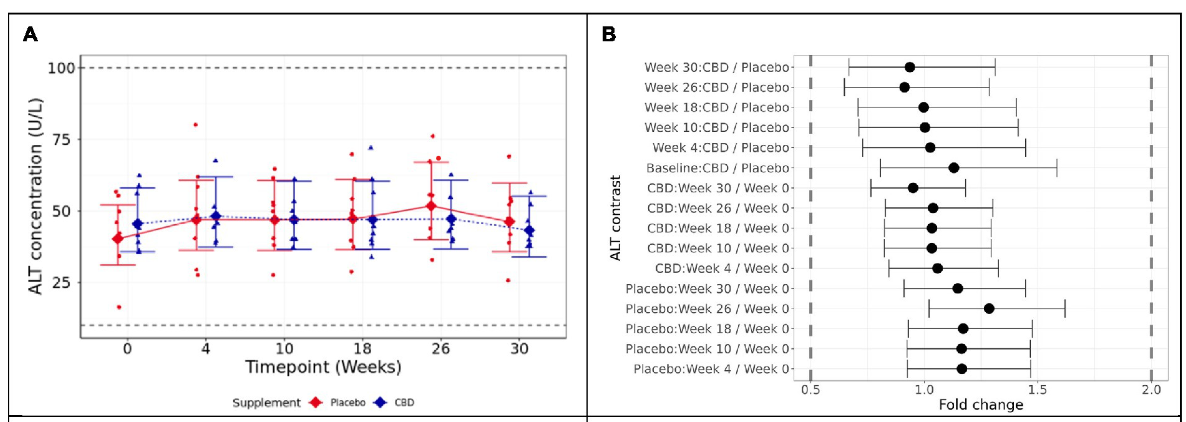
Se encontró que los valores medios de ALT, la medida principal del estudio, eran estadísticamente equivalentes en límites de 2 veces para cada contraste por pares probado, tanto entre los grupos de placebo y CBD durante la fase suplementada de 26 semanas (p < 0,001), como en comparación con la línea de base de la semana 0 respectiva para cada grupo (p < 0,001; Figuras 4A y B). Se encontró que la AST aumentó significativamente en la semana 26 en comparación con el valor basal en los gatos del grupo placebo, aunque todos los valores se mantuvieron dentro del rango de referencia fisiológico (p = 0,02; Figura 4C). La FA no difirió significativamente a lo largo del tiempo dentro de ninguno de los grupos, ni entre los grupos en ningún momento (p ≥ 0,89; Figura 4D).
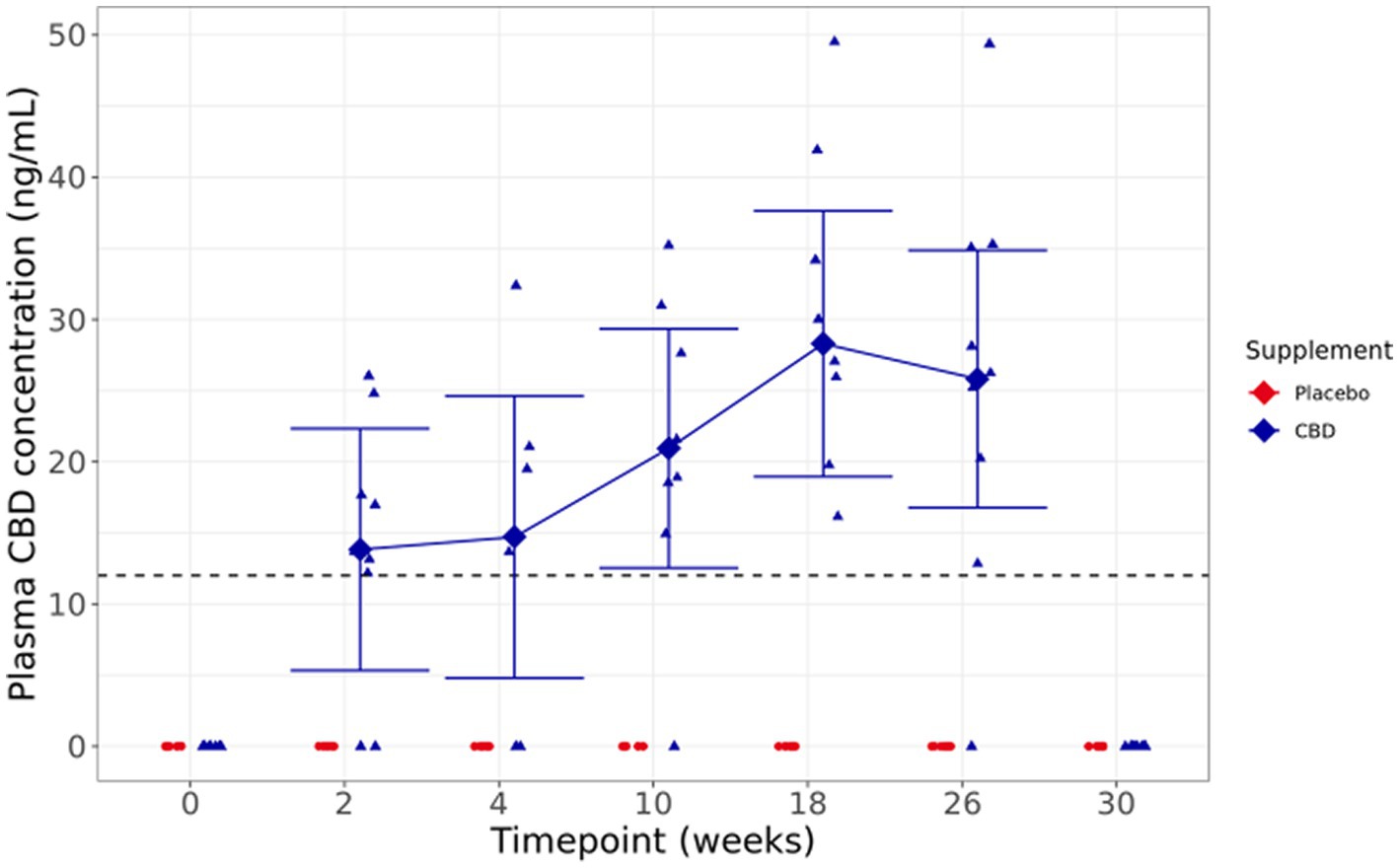 Figura 4. Las medias y los intervalos de confianza del 95% ajustados dentro del modelo para la concentración plasmática de CBD en ayunas (ng/ml) durante la duración del estudio. Los puntos de datos sin procesar se trazan en el gráfico. La línea discontinua muestra el límite de detección.
Figura 4. Las medias y los intervalos de confianza del 95% ajustados dentro del modelo para la concentración plasmática de CBD en ayunas (ng/ml) durante la duración del estudio. Los puntos de datos sin procesar se trazan en el gráfico. La línea discontinua muestra el límite de detección.
La bilirrubina no difirió significativamente entre los grupos ni en el transcurso del estudio en ninguno de los grupos (p ≥ 0,725; Figura 4E). Los ácidos biliares en ayunas tampoco difirieron significativamente entre los grupos tratados con CBD y placebo en todo el estudio (p ≥ 0,997); sin embargo, los gatos con CBD mostraron una concentración de ácidos biliares significativamente reducida en la semana 30 (lavado) en comparación con el valor basal (p = 0,019; Figura 4F). Para otros datos bioquímicos, hematológicos, fosfatasa alcalina específica del hueso (BALP) y reticulación del telopéptido carboxiterminal (CTx), no hubo diferencias significativas de importancia clínica entre los grupos de tratamiento. Todas las medidas se mantuvieron dentro de los rangos normales de referencia, con la excepción del colesterol, la relación sodio:potasio, el volumen plaquetario medio (VPM) y el recuento de eosinófilos (Tablas suplementarias S2, S3).
3.2.4 Concentración de CBD
La inspección visual de los niveles plasmáticos de CBD en ayunas muestra un amplio rango de concentraciones, desde por debajo del límite de cuantificación hasta 49,52 ng/ml en todo el grupo suplementado, con una tendencia hacia el aumento de las concentraciones a lo largo de la duración del estudio. En el punto de lavado de las 30 semanas, 4 semanas después de que se completara la dosis, y no había niveles detectables de CBD en el plasma. Un gato no tenía concentraciones detectables de CBD en ningún momento de la muestra, a pesar del consumo completo del bolo el día anterior a cada muestreo (Figura 4).
Las concentraciones en orina estaban todas por debajo del límite de detección (datos no mostrados), mientras que las heces mostraron concentraciones de 45,51 a 481,24 μg/g cuando se analizó una concentración instantánea (datos no mostrados).
4 Discusión
El objetivo de estos estudios en gatos sanos era doble: en primer lugar, evaluar la evolución postprandial de las concentraciones plasmáticas de CBD durante las 4 horas siguientes a la ingestión de una dosis inicial, y también después de 2 semanas de suplementación diaria a 4 mg/kg de peso corporal; y en segundo lugar, demostrar tolerancia a la suplementación diaria de 4 mg/kg de peso corporal durante un período de 26 semanas.
La concentración media máxima de CBD en plasma se encontró a las 2 h después de la dosis tanto en d0 (251 ng/mL) como en la semana 2 (431 ng/mL), y las tasas de absorción y eliminación de CBD fueron mayores en la semana 2 en comparación con la primera dosis. Esta conclusión se dedujo del aumento significativo del AUC junto con la ausencia de diferencias entre las concentraciones plasmáticas de CBD postprandial. Este momento concuerda ampliamente con la literatura reciente (14, 15). Deabold et al. (14) administraron a seis gatos en ayunas 2 mg/kg de peso corporal de una mezcla 50:50 de CBD/CBDA en aceite de pescado y reportaron una concentración máxima de 43 ng/mL a las 2 h. Rozental et al. (25) también utilizaron un protocolo de ayuno para evaluar un aislado de CBD en aceite de girasol, observando una concentración máxima a las 2 h de 17,8 y 61,1 ng/mL para 2,5 y 5,0 mg/kg de peso corporal, respectivamente. Se encontró que la dosificación de Epidiolex a 5 mg/kg de peso corporal a gatos alimentados aumentó la concentración máxima (465,3 ng/mL) y el área bajo la curva (2650,0 h × ng/mL) en comparación con la dosificación en ayunas (269,0 ng/mL y 921,0 h × ng/mL, respectivamente) (18). En nuestro estudio, los datos de 2 h de 251 ng/mL (IC 95%: 108,7, 393,4) de gatos alimentados con una comida con su dosis de CBD son más similares a los informados por Wang et al. (15) para la primera dosis de su estudio a 282 ng/mL (±149,4), donde la comida se administró 1 h después de la oferta de pasta de CBD/CBDA. Observamos un AUC tras la primera dosis de 621,7 ng/ml (IC del 95%: 387,5, 855,9) durante nuestro curso de tiempo de 4 h en comparación con 908,5 ng/ml (±528,1) durante 24 h en la literatura (15), lo que indica que existe potencialmente una mayor presencia de CBD en el plasma después de una dosis de pasta de CBD/CBDA en comparación con el CBD en el aceite de girasol y que hay CBD circulante más allá de la marca de 4 h. Al comparar estos valores de AUC, debe tenerse en cuenta que los otros grupos han utilizado paquetes de software farmacocinéticos, probablemente empleando un método trapezoidal logarítmico lineal, mientras que nuestro análisis empleó un método trapezoidal lineal que puede sobrestimar el AUC (26). Dado el marco de tiempo comparativamente corto (4 h) de nuestro muestreo postprandial, cualquier impacto de esta sobreestimación debería ser limitado. Al comparar la literatura, es importante comprender las composiciones de los tratamientos que se utilizan, ya que se ha demostrado que la inclusión de varios fitocompuestos altera los efectos observados en comparación con los fitocompuestos individuales. Esta observación, denominada «efecto séquito» por varias publicaciones (27-29), describe el potencial de otros compuestos que se encuentran en el cáñamo, como el THC o el CBG, para interactuar y posiblemente aumentar la absorción de CBD (30). Tanto la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) como la Autoridad Europea de Seguridad Alimentaria (EFSA) han expresado su preocupación por las limitaciones de la literatura actual a la hora de interpretar la seguridad debido a las diferentes preparaciones y extractos, las diferentes concentraciones de CBD u otros cannabinoides, el pequeño tamaño de las muestras y la calidad de los datos (31, 32).®
Este es el primer estudio en gatos que informa datos sobre las concentraciones plasmáticas de CBD en ayunas utilizando una dosis uniforme durante un período de más de una semana y después de un período de lavado. Los datos fueron muy variables entre individuos, pero mostraron un aumento general de las concentraciones circulantes hasta la semana 18. Esta alta variabilidad entre gatos individuales se ha observado anteriormente en la literatura (14, 25). Una teoría reciente describe la grasa corporal como un factor contribuyente, lo que sugiere que con el aumento de BCS existe un mayor potencial para que el CBD se mantenga en el depósito dentro del cuerpo (25). Los datos de BCS no fueron lo suficientemente amplios como para evaluar esto. Además, debido a la naturaleza semicualitativa de esta medición y al potencial de sesgo del evaluador, la capacidad de confirmarlo a través de BCS es limitada y se deben considerar métodos alternativos para evaluar el contenido de grasa. En un estudio comparable realizado en perros se observaron tendencias similares en las concentraciones plasmáticas de CBD y, además, las vías de excreción, es decir, a través de las heces en lugar de la orina, también parecen ser consistentes (11).
Para evaluar si la alimentación diaria crónica de CBD era tolerada de forma segura por los gatos, ambos grupos se sometieron a exámenes veterinarios regulares, así como a una evaluación rutinaria de la hematología, la bioquímica clínica y el análisis de orina. Con la excepción del colesterol, la relación sodio:potasio, el volumen medio de plaquetas (VPM) y el recuento de eosinófilos, todas las medias de los grupos para los analitos bioquímicos y hematológicos se mantuvieron dentro de los rangos de referencia publicados durante el estudio de 26 semanas. Las diferencias entre los grupos o a lo largo del tiempo fueron transitorias y no se consideraron de importancia clínica durante las revisiones veterinarias semanales y quincenales.
En ambos estudios, tres gatos experimentaron ALT alta con inapetencia concurrente y/o letargo general. Posteriormente, a estos gatos se les diagnosticó, mediante ecografía abdominal, bioquímica sanguínea e información completa de hemograma, sospecha de colangitis ascendente (una inflamación de la vesícula biliar y el hígado). Un gato estaba en el grupo de placebo y dos en el grupo de CBD. Se desconoce si la incidencia de colangitis fue mayor en el grupo de CBD por coincidencia o si el suplemento (y/o la participación en el estudio) contribuyó a través de una presión adicional sobre el sistema hepático (y cualquier otro relacionado) y los procesos metabólicos en estos gatos. Sin embargo, la opinión clínica era que era poco probable que el CBD en sí mismo hubiera causado la infección directamente. La literatura sugiere que la prevalencia de colangitis en gatos en todo el mundo es común y se cita como la segunda enfermedad hepática más común (33) en las cuatro formas distintas de la afección: neutrofílica, linfocítica, destructiva y crónica (34). Se realizó un seguimiento del gato asintomático del primer estudio hasta la finalización del estudio, no se observaron más complicaciones y se produjo un retorno al rango normal de ALT y AST en un plazo de 3 semanas. Los cambios en las enzimas hepáticas observados en individuos específicos en los presentes estudios, considerados junto con la variabilidad de las mediciones plasmáticas de CBD, sugieren que es probable que haya diferencias individuales en la respuesta de los gatos a múltiples dosis de CBD. Se desconoce si existe una base genética para la susceptibilidad a la ALT alta (o hipertransaminasemia). A la hora de evaluar observaciones adversas como la hipertransaminasemia, se centran las posibles interacciones farmacológicas (35), sin embargo, durante estos estudios controlamos el acceso a cualquier medicamento potencial que pudiera interactuar con el CBD para minimizar este riesgo. Se sabe que los gatos tienen una baja capacidad de glucuronidación hepática, lo que reduce la capacidad de metabolismo y excreción de varios compuestos, incluidos los antiinflamatorios no esteroideos y el CBD (16, 36). Esto puede ser un factor que contribuya a las diferencias entre las respuestas de perros y gatos al CBD; sin embargo, el trabajo futuro para abordar la susceptibilidad individual podría explorar la metabolómica de la absorción y excreción de CBD.
En conclusión, el CBD sin THC alimentado a una dosis de 4 mg/kg de peso corporal se absorbió en plasma y fue bien tolerado cuando se suplementó durante 26 semanas en gatos. Sin embargo, se debe tener precaución y se deben realizar controles veterinarios si se conocen antecedentes de problemas hepáticos o en caso de sospecha de infección concurrente. También es necesario determinar la eficacia de las dosis de CBD para mejorar nuestra comprensión del CBD y su uso en gatos.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
El estudio en animales fue aprobado por el Organismo de Revisión Ética y Bienestar Animal de Waltham. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
JC: Conceptualización, Curación de datos, Supervisión, Redacción – borrador original. RB: Curación de datos, metodología, administración de proyectos, redacción, revisión y edición. AB: Conceptualización, Redacción – Revisión y Edición. ZE: Curación de datos, Análisis formal, Redacción – borrador original. CN: Análisis formal, Metodología, Redacción – borrador original. PW: Conceptualización, Supervisión, Redacción – Revisión y Edición. DL: Conceptualización, Supervisión, Redacción – revisión y edición. LH: Conceptualización, Supervisión, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. El estudio fue financiado por Mars Petcare.
Reconocimientos
Los autores reconocen la habilidad y la experiencia de los colegas del Instituto de Ciencias del Cuidado de Mascotas de Waltham en el cuidado y entrenamiento de los gatos y para el procesamiento y análisis de las muestras recogidas a lo largo del estudio, en particular, Daniel Waller por los cálculos de potencia y Kathleen Pinfold por validar el análisis de CBD en plasma felino. Los autores también agradecen a Craig Mosley y Stephen Cital por sus perspicaces discusiones.
Conflicto de intereses
JC, RB, AB, ZE, PW, DL y LH son empleados de Mars Petcare, un fabricante de alimentos para mascotas. CN era un empleado de Mars Petcare durante la finalización de las pruebas que se detallan aquí.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1324622/full#supplementary-material
CUADRO COMPLEMENTARIO S1 | Bioquímica, panel hepático, BAP y CTX: estimaciones medias e IC del 95%.
CUADRO COMPLEMENTARIO S2 | Hematología: estimaciones medias e IC del 95%.
COMPLEMENTARIO Figura S1 | Medias e intervalos de confianza (IC) del 95% en las mediciones plasmáticas en ayunas durante las 4 semanas de estudio: a) Concentración de bilirrubina (μmol/L) y b) Ácidos biliares (μmol/L). *Muestra que la diferencia entre el punto temporal y la semana 0 es estadísticamente significativa (p < 0,05). Los rangos de referencia se incluyen como líneas horizontales discontinuas a lo largo de la figura.
Referencias
1. Merkus, FWHM. Cannabivarina y Tetrahidrocannabivarina, dos nuevos componentes del hachís. Naturaleza. (1971) 232:579–80. doi: 10.1038/232579a0
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Nahler, G. Cannabidiol y contribuciones de los principales fitocompuestos del cáñamo al «efecto séquito»; posibles mecanismos. Alter Complement Integr Med. (2019) 5:1–16. doi: 10.24966/ACIM-7562/100066
4. De Briyne, N, Holmes, D, Sandler, I, Stiles, E, Szymanski, D, Moody, S, et al. Cannabis, aceites de cannabidiol y tetrahidrocannabinol: ¿qué necesitan saber los veterinarios? Animales. (2021) 11:892. doi: 10.3390/ani11030892
5. Schiano Moriello, A, Di Marzo, V, y Petrosino, S. Vínculos mutuos entre el endocannabinoidoma y el microbioma intestinal, con especial referencia a los animales de compañía: un punto de vista nutricional. Animales. (2022) 12:348. doi: 10.3390/ani12030348
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Arturo, IF, y Fabiana, P. Endocannabinoidoma En: Enciclopedia de las ciencias de la vida. Wiley: John Wiley & Sons, Ltd. (2018). doi: 10.1002/9780470015902.a0028301
7. Di Bartolomeo, M, Stark, T, Maurel, OM, Iannotti, FA, Kuchar, M, Ruda-Kucerova, J, et al. Diafonía entre la regulación transcripcional de la dopamina D2 y los receptores cannabinoides CB1 en esquizofrenia: análisis en pacientes y en ratas perinatales expuestas a Δ9-tetrahidrocannabinol. Pharmacol Res. (2021) 164:105357. doi: 10.1016/j.phrs.2020.105357
8. Yu, CHJ y Rupasinghe, VPH. Productos naturales para la salud a base de cannabidiol para animales de compañía: avances recientes en el manejo de la ansiedad, el dolor y la inflamación. Res Vet Sci. (2021) 140:38–46. doi: 10.1016/j.rvsc.2021.08.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Petcare, K. A. CBD: regulaciones e investigación. (2021). Disponible en: https://prohibitionpartners.com/2021/03/19/petcare-cbd-regulations-and-research/
10. Greb, A, y Puschner, B. Tratamientos cannabinoides como terapia complementaria para mascotas: lagunas en nuestro conocimiento. Toxicol Commun. (2018) 2:10–4. doi: 10.1080/24734306.2018.1434470
11. Bradley, S, Young, S, Bakke, AM, Holcombe, L, Waller, D, Hunt, A, et al. La alimentación diaria a largo plazo con cannabidiol es bien tolerada por perros sanos. Front Vet Sci. (2022) 9:457. doi: 10.3389/fvets.2022.977457
12. Hunt, ABG, Flint, HE, Logan, DW, y King, T. Una sola dosis de cannabidiol (CBD) influye positivamente en las medidas de estrés en los perros durante la separación y los viajes en coche. Front Vet Sci. (2023) 10:604. doi: 10.3389/fvets.2023.1112604
13. Corsato Alvarenga, I, Wilson, KM y McGrath, S. Tolerabilidad de la suplementación con cannabidiol a largo plazo en perros adultos sanos. J Veterinario Pasante Med. (2023) 27:1–10. doi: 10.1111/jvim.16949
14. Deabold, KA, Schwark, WS, Wolf, L, y Wakshlag, JJ. Farmacocinética de dosis única y evaluación preliminar de la seguridad con el uso de nutracéuticos de cáñamo ricos en CBD en perros y gatos sanos. Animales. (2019) 9:832. doi: 10.3390/ani9100832
15. Wang, T, Zakharov, A, Gómez, B, Lyubimov, A, Trottier, NL, Schwark, WS, et al. Evaluación farmacocinética en estado estacionario de cannabinoides séricos de 24 h y 1 semana en gatos utilizando una pasta de cáñamo rica en CBD/CBDA. Front Vet Sci. (2022) 9:895368. doi: 10.3389/fvets.2022.895368/full
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Schwark, WS, y Wakshlag, JJ. Una perspectiva de una sola salud sobre la farmacocinética y la biotransformación comparativa del cannabidiol y el ácido cannabidiólico en humanos y animales domésticos. Am J Vet Res. (2023) 84:1–9.
17. Perucca, E, y Bialer, M. Aspectos críticos que afectan a la biodisponibilidad oral y la eliminación metabólica del cannabidiol, y las implicaciones clínicas relacionadas. Fármacos para el SNC. (2020) 34:795–00. doi: 10.1007/s40263-020-00741-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Jukier, T, Cruz-Espíndola, C, Martin, D, y Boothe, DM. Disposición de una dosis oral única de un medicamento de cannabidiol en gatos sanos. Front Vet Sci. (2023) 10:1517. doi: 10.3389/fvets.2023.1181517/full
19. Bjornvad, CR, Nielsen, DH, Armstrong, PJ, McEvoy, F, Hoelmkjaer, KM, Jensen, KS, et al. Evaluación de un sistema de puntuación de la condición corporal de nueve puntos en gatos domésticos físicamente inactivos. Am J Vet Res. (2011) 72:433–7. doi: 10.2460/ajvr.72.4.433
20. Vaughn, D, Kulpa, J y Paulionis, L. Investigación preliminar de la seguridad del aumento de las dosis de cannabinoides en perros sanos. Front Vet Sci. (2020) 7:51. doi: 10.3389/fvets.2020.00051
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Equipo central de desarrollo de R. R: un lenguaje y un entorno para la computación estadística. Viena, Austria: The R Foundation for Statistical Computing (2017).
22. Bates, D, Mächler, M, Bolker, B y Walker, S. Ajuste de modelos lineales de efectos mixtos utilizando lme4 (2015) 67. doi: 10.18637/jss.v067.i01
23. Pinheiro, J, Bates, D, DebRoy, S, y Sarkar, D Equipo RC. Nlme: Modelos de efectos mixtos lineales y no lineales. (2018).
24. Hothorn, T, Bretz, F y Westfall, P. Inferencia simultánea en modelos paramétricos generales. Biometr J. (2008) 50:346–63. doi: 10.1002/bimj.200810425
25. Rozental, AJ, Gustafson, DL, Kusick, BR, Bartner, LR, Castro, SC y McGrath, S. Farmacocinética de la creciente administración de dosis única de cannabidiol a gatos. J Vet Pharmacol Ther [Internet]. (2023) 46:25–33. doi: 10.1111/jvp.13100
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Certara, TN (2011). Knowledge base. Cálculo del AUC (lineal y logarítmico). Disponible en: https://www.certara.com/knowledge-base/calculating-auc-linear-and-log-linear/
27. Worth, T. Desentrañando el efecto séquito. Naturaleza. (2019) 572:S12–3. doi: 10.1038/d41586-019-02528-1
28. Ferber, SG, Namdar, D, Hen-Shoval, D, Eger, G, Koltai, H, Shoval, G, et al. El «efecto séquito»: terpenos acoplados a cannabinoides para el tratamiento de trastornos del estado de ánimo y trastornos de ansiedad. Curr Neuropharmacol. (2019) 18:87–96. doi: 10.2174/1570159X17666190903103923
29. Anand, U, Pacchetti, B, Anand, P, y Sodergren, MH. Medicamentos a base de cannabis y dolor: una revisión de los posibles efectos sinérgicos y séquitos. Manejo del dolor. (2021) 11:395–03. doi: 10.2217/pmt-2020-0110
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Anderson, LL, Etchart, MG, Bahceci, D, Golembiewski, TA, y Arnold, JC. Los componentes del cannabis interactúan en la bomba de eflujo de fármacos BCRP para aumentar notablemente las concentraciones plasmáticas de ácido cannabidiólico. Sci Rep. (2021) 11:14948. doi: 10.1038/s41598-021-94212-6
31. Hahn, SM y Abernethy, A. Mejores datos para una mejor comprensión del uso y el perfil de seguridad de los productos de cannabidiol (CBD). Administración USF& D. (2021). Disponible en: https://www.fda.gov/news-events/fda-voices/better-data-better-understanding-use-and-safety-profile-cannabidiol-cbd-products
32. Comisión Técnica de Nutrición de la EFSA sobre alérgenos NF, F, Turck, D, Bohn, T, Castenmiller, J, De Henauw, S, et al. Declaración sobre la seguridad del cannabidiol como nuevo alimento: lagunas e incertidumbres en los datos. EFSA J. (2022) 20:e07322. doi: 10.2903/j.efsa.2022.7322
33. Griffin, S. Ecografía abdominal felina: ¿qué es normal? ¿Qué es anormal? Hígado J Feline Med Surg. (2019) 21:12–24. doi: 10.1177/1098612X18818666
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Assawarachan, SN, Yodsheewan, R, Maneesaay, P, Rattanapinyopituk, K, Chuchalermporn, P, Kongchun, A, et al. Colangiohepatitis linfocítica similar a un quiste felino en un gato: primer reporte de caso. Animales (Basilea). (2022) 12:3278. doi: 10.3390/ani12233278
35. Souza, JDR, Pacheco, JC, Rossi, GN, De-Paulo, BO, Zuardi, AW, Guimarães, FS, et al. Efectos adversos del cannabidiol oral: una revisión sistemática actualizada de ensayos controlados aleatorizados. Farmacia. (2022) 14:2598. doi: 10.3390/pharmaceutics14122598
Palabras clave: cannabidiol, gato, seguridad, CBD, cannabinoides, felino
Cita: Coltherd JC, Bednall R, Bakke AM, Ellerby Z, Newman C, Watson P, Logan DW y Holcombe LJ (2024) Los gatos sanos toleran la alimentación diaria a largo plazo con cannabidiol. Frente. Vet. Sci. 10:1324622. doi: 10.3389/fvets.2023.1324622
Recibido: 19 de octubre de 2023; Aceptado: 18 de diciembre de 2023;
Publicado: 24 enero 2024.
Editado por:
Robin Temmerman, Colegio Europeo de Farmacología y Toxicología Veterinaria (ECVPT), Bélgica
Revisado por:
Vincenzo Micale, Universidad de Catania, Italia
Joseph Wakshlag, Universidad de Cornell, Estados Unidos Wayne S. Schwark, Universidad de Cornell, Estados
Unidos
Derechos de autor © 2024 Coltherd, Bednall, Bakke, Ellerby, Newman, Watson, Logan y Holcombe. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Jennifer C. Coltherd, de jen.coltherd@effem.com; Lucy J. Holcombe, lucy.holcombe@effem.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

