Los marcadores de identificación fecal afectan a la microbiota fecal felina
Los marcadores de identificación fecal afectan a la microbiota fecal felina
- 1Departamento de Ciencias Clínicas Veterinarias, Facultad de Medicina Veterinaria, Programa de Investigación Hepatobiliar e Intestinal Comparada, Universidad Estatal de Ohio, Columbus, OH, Estados Unidos
- 2Departamento de Ciencias Clínicas Veterinarias, Facultad de Medicina Veterinaria, Universidad Estatal de Ohio, Columbus, OH, Estados Unidos
El diagnóstico fecal es un pilar de la medicina felina, y los marcadores de identificación fecal ayudan a distinguir a los individuos en un entorno multigato. Sin embargo, se desconoce el impacto de los marcadores de identificación en la microbiota fecal. Dado el mayor interés en el uso de los puntos finales de la microbiota para informar el diagnóstico y el tratamiento, el objetivo de este estudio fue examinar los efectos de las virutas de brillo y crayón suplementadas por vía oral en la microbiota fecal felina (secuenciación de amplín de la región V4 del gen 16S rRNA). Las muestras fecales se recogieron diariamente de seis gatos adultos que fueron aleatorizados para recibir suplementación oral con brillo o crayón durante dos semanas, con un lavado de dos semanas antes de recibir el segundo marcador. No se observaron efectos adversos en respuesta a la suplementación de marcadores en ningún gato, y ambos marcadores fueron fácilmente identificables en las heces. El análisis de microbiota reveló respuestas idiosincrásicas a los marcadores fecales, donde los cambios en la estructura de la comunidad en respuesta al brillo o el crayón no se podían discernir fácilmente. Dados estos hallazgos, no se recomienda administrar virutas de brillo o lápices de colores como marcador fecal cuando se utilizan los puntos finales del microbioma, sin embargo, su uso clínico con otros diagnósticos aún debe considerarse.
1. Introducción
Las afecciones gastrointestinales son una de las principales causas de los exámenes veterinarios en pacientes felinos (1). A medida que se expande el conocimiento clínico de las enfermedades gastrointestinales, el papel de la microbiota intestinal en la salud felina frente a la enfermedad se está investigando cada vez más (2–4). Se ha demostrado que la microbiota intestinal felina, que consiste en comunidades procariotas, eucariotas y virales, modula el metabolismo del huésped, la digestibilidad de los nutrientes, la función inmune y la susceptibilidad a las enfermedades crónicas e infecciosas (5, 6). Dado el creciente reconocimiento de la microbiota intestinal en la salud felina, los esfuerzos en curso han aprovechado la microbiota fecal para ayudar con el diagnóstico, el tratamiento y la comprensión médica de las enfermedades. En el intestino felino, la disbiosis, una interrupción en la composición y función de la microbiota, se ha relacionado con varias enfermedades felinas, como la diabetes mellitus, la enfermedad inflamatoria intestinal y la enfermedad renal crónica (7–9).
La recolección de muestras es una consideración clave en cualquier estudio de microbiota. Las muestras fecales se utilizan comúnmente para evaluar las comunidades microbianas intestinales debido a su facilidad de adquisición. Sin embargo, a diferencia de otras especies, la recolección fecal en gatos está limitada por las necesidades de cría (por ejemplo, alojamiento de grupo) y los comportamientos de eliminación de felinos (por ejemplo, preferencia por la privacidad, entornos exigentes, capacidad de ocultar sus heces, tiempo variable del día a día defecación y menor frecuencia de defecación) (10, 11). Estas diferencias crean un desafío en la identificación de las heces de un gato individual en hogares de varios gatos y en instalaciones de investigación de viviendas grupales. La administración oral de marcadores de identificación fecal, como virutas de crayón y purpurina, se ha utilizado de forma rutinaria para ayudar en la recolección fecal precisa, donde estudios anteriores apoyan su facilidad de administración, identificación y discriminación entre muestras fecales de gatos individuales (113-1). Sin embargo, se desconoce cómo estos marcadores fecales exógenos afectan a la estructura microbiana de la comunidad microbiana intestinal.
El objetivo de este estudio era determinar si los marcadores de identificación fecal administrados oralmente (afeitadas de brillo y lápices de colores) alteran la estructura de la comunidad microbiana fecal en gatos sanos. Planteamos la hipótesis de que la administración oral de virutas de crayón y/o brillo no alteraría la comunidad de microbiota fecal en gatos de investigación de razas saludables y adultas.
2. Materiales y métodos
2.1. Animales y vivienda
Seis gatos de investigación sanos, adultos, de crías a propósito (n = 3 machos castrados, n = 3 hembras ovariohisterectomizadas) se incluyeron en un estudio cruzado aleatorio (Figura 1). Todos los gatos fueron alojados en grupo en un centro de investigación durante varios meses antes del inicio del estudio. Los gatos se consideraron sanos mediante un examen físico realizado por dos especialistas en medicina interna veterinaria certificados por la junta y análisis de sangre completo (recuento sanguíneo completo, panel de bioquímica del suero, análisis de orina y flotación fecal). Se proporcionó acceso a alimentos y agua potable limpia ad libitum.
 Figura 1. Cronología experimental. Los gatos fueron asignados al azar a uno de los dos grupos, que recibirían administración oral de virutas de crayón durante M1 seguido de brillo durante M2(grupo CG, gatos 1-3; denotado en morado) o brillo seguido de administración de virutas de crayones (grupo GC, gatos 4-6, denotados en verde), con tres gatos en cada B, Línea de base; M1, Marcador 1; W1, Lavado 1; M2, Marcador 2; W2, Lavado 2.
Figura 1. Cronología experimental. Los gatos fueron asignados al azar a uno de los dos grupos, que recibirían administración oral de virutas de crayón durante M1 seguido de brillo durante M2(grupo CG, gatos 1-3; denotado en morado) o brillo seguido de administración de virutas de crayones (grupo GC, gatos 4-6, denotados en verde), con tres gatos en cada B, Línea de base; M1, Marcador 1; W1, Lavado 1; M2, Marcador 2; W2, Lavado 2.
Durante un período de aclimatación de tres semanas antes del inicio de este estudio, todos los gatos pasaron de su anterior dieta seca felina de laboratorio comercial (Lab Feline Diet #5003 dry formulation, Cincinnati Lab Supply Inc.) a la dieta enlatada de pollo y arroz Nestle Purina Pro Plan Complete Essentials. Esta transición se produjo para que cada marcador fecal pudiera mezclarse en la dieta para la administración oral diaria. Cada gato estaba comiendo completamente esta dieta enlatada durante 36 días antes del inicio de este estudio actual. Los gatos se alimentaban dos veces al día en función de sus necesidades de energía en reposo, donde se utilizaban pesos corporales semanales para ajustar la ingesta calórica diaria para mantener su peso. Todos los gatos se mantuvieron en la misma dieta enlatada durante el resto del estudio. El perfil de nutrientes de ambas dietas se proporciona en la Tabla Suplementaria 1. A lo largo del estudio, se registraron diariamente el marcador fecal de Nestlé Purina, la ingesta de calorías, las observaciones diarias y la presencia del marcador de identificación fecal. Una puntuación fecal ideal se definió como dos de cada siete. El sistema de puntuación fecal de Nestlé Purina utilizado en este estudio se resume en la Tabla Suplementaria 2 (14). El peso se monitoreó a través de evaluaciones semanales y se registró en el historial médico de cada animal. Todos los protocolos fueron aprobados por el Comité Institucional de Cuidado y Uso de los Animales de la Universidad Estatal de Ohio (2017A00000093-R1). Después de este estudio, todos los gatos permanecieron bajo el cuidado de los Servicios de Animales del Laboratorio Universitario y finalmente fueron adoptados en hogares propiedad de los clientes.
2.2. Administración de marcadores de identificación fecal y recolección fecal
La figura 1 muestra la línea de tiempo experimental sobre la cual los gatos recibieron cada uno de los dos marcadores fecales. Los gatos fueron aleatorizados en dos grupos (n = 3 por grupo) que recibieron administración oral de virutas de crayón seguida de brillo (denotado como grupo CG) o brillo seguido de la administración de virutas de crayón (denotada como grupo GC). La recolección de muestras fecales se realizó durante la noche cuando los gatos se alojaban individualmente en perreras de acuerdo con el protocolo de gestión estándar. Las muestras fecales se recogieron diariamente de cada gato durante un período de referencia de 3 días. Luego se administraron por vía oral a los grupos virutas de brillo o crayón mezcladas en sus alimentos enlatados durante 14 días (M1 = fase de marcador 1). Las virutas de crayón y el brillo administrados por vía oral no eran tóxicos e incluían lápices de colores a base de cera de parafina Crayola y brillo decorativo no tóxico comestible Bakell. La fase del marcador 1 fue seguida por un período de lavado de 14 días (W1 = Washout 1) en el que ningún gato recibió marcadores de identificación fecal oral. El cruce de grupo se realizó para la administración de afeitado de brillo o crayón durante 14 días (M2 = fase del marcador 2), seguido de otro lavado de 14 días (W2 = Washout 2). Inicialmente, a cada gato se le administró una porción de 2,5 ml (1/2 cucharadita) de virutas de brillo o crayón al día mezcladas en alimentos enlatados. La dosis se aumentó a 5 ml (1 cucharadita) el día 4 (fase M1) para mejorar la visualización en las heces y esta dosis más alta se mantuvo durante el resto de las fases marcadoras del estudio. Las muestras fecales naturalmente anuladas de gatos individuales se recogieron diariamente de las cajas de arena durante el período de estudio. El sustrato de la arena eran virutas de madera fina. Según los protocolos publicados anteriormente, las heces se recogían cada mañana de la defecación nocturna y tenían <12-14 h de antigüedad en el momento de la recogida (15). Las heces se aliparar (de 500 a 1000 gramos de alícuotas) en crioviales dentro de 1 hora de la recolección y congeladas a -80 °C para análisis futuro.
2.3. Extracción de ADN y secuenciación de amplicones
Las muestras fecales se sometieron a extracción y cuantificación de ADN en el Núcleo de Microbioma de la Universidad de Michigan. Un kit de MagAttract PowerMicrobiome (Qiagen, Germantown, MD, EE. UU.) extrajo ADN de cada muestra fecal siguiendo las instrucciones del fabricante. Un sistema de manejo de líquidos Eppendorf EpMotion (Eppendorf, Enfield, CT, EE. UU.) atilaron cada muestra durante la extracción de ADN. Después de la extracción, un kit fluorométrico Quant-iT PicoGr4een dsDNA Assay (ThermoFisher Scientific, Waltham, MA, EE. UU.) cuantificó 1 μL de cada muestra para su uso en la amplificación PCR del gen rRNA de 16s.
La región V4 del gen rRNA 16s se amplió a partir de cada muestra utilizando un enfoque de indexación dual (16). Los genes se amplificaron utilizando los cebadores 515f y 806r (17). La mezcla maestra de PCR contenía 2 μL 10x AccuPrime PCR Buffer II (ThermoFisher Scientific), 11,85 μL de agua doble destilada, 0,15 μL AccuPrime High Fidelity Taq Polymerasa (ThermoFisher Scientific), 1 μL de cada muestra de ADN y 5 μL de una solución Después de un 120 s inicial a 95 °C, se produjeron 30 ciclos de amplificación de PCR bajo los siguientes parámetros: desnaturalización a 95 °C durante 20 s, recocido a 55 °C durante 15 s, luego 72 °C durante 900 s. Los productos de PCR se incubaron a 4 °C hasta un análisis posterior. Se utilizó un E-Gel 96 con un 2 % de SYBR Safe DNA Gel Stain (ThermoFisher Scientific) para visualizar productos de PCR. Los reactivos de extracción estéril y la mezcla maestra sirvieron como controles de calidad negativos en todo el procesamiento y amplificación del ADN.
La normalización de las bibliotecas de Amplicon se realizó utilizando un kit de placa de normalización SequalPrep (tecnologías Life, Carlsbad, CA, EE. UU.) siguiendo los protocolos del fabricante para la elución secuencial. Un kit de cuantificación de la Biblioteca Kapa Biosystems para plataformas Illumina (Kapa Biosystems, Wilmington, MA, EE. UU.) determinó la concentración de las muestras agrupadas para que el tamaño final de la biblioteca consistiera en cantidades equimolares de cada muestra normalizadas a la concentración más baja de la muestra. Un kit de análisis de ADN de alta sensibilidad Agilent Bioanalyzer (Santa Clara, CA, EE. UU.) determinó los tamaños de amplicon en la biblioteca agrupada.
La secuencia de amplicon de extremo emparejado y de-novo se realizó en una plataforma Illumina MiSeq con un kit de reactivo MiSeq (Illumina, San Diego, CA, EE. UU.) utilizando química V2 con 500 ciclos para 2 bibliotecas nM o 4 nM de acuerdo con los protocolos del fabricante con ligeras modificaciones como se describió anteriormente (16). La concentración de carga final de la biblioteca fue de 5,5 nM con un pico de PhiX del 15 % (Illumina) para crear diversidad. Todos los reactivos de secuenciación de Illumina se prepararon de acuerdo con los protocolos de uso de Illumina para el sistema secuenciador personal MiSeq (16). Se agregaron imprimaciones de lectura 1, lectura personalizada 2 e índice al cartucho de reactivo de Illumina antes de la secuenciación. Se generaron archivos FASTQ para cada lectura de extremo emparejado. Los reactivos de extracción estériles y la mezcla maestra sirvieron como controles de calidad negativos en toda la secuenciación de muestras.
2.4. Análisis de microbiota fecal
El análisis de la secuencia de Amplicon (gen V4 16S rRNA) se realizó utilizando R Studio (Versión 2022.07.1, Build 554) (18). Después de la importación en R, cada lectura de extremo de par se ensamblaron en contigs, se recortaron, filtraron y se convirtieron en variantes de secuencia de amplicones (ASV) a través de la tubería DADA2 (19). Antes de la clasificación taxonómica, se eliminaron los ASV <250 pares de bases de longitud o >256 pares de bases de longitud junto con las secuencias de quimera. La taxonomía se asignó a los ASV utilizando la base de datos de secuencias rRNA Silva 16s (Versión 138.1) (20). Los recuentos brutos de ASV dentro de las tablas de taxonomía se normalizaron al porcentaje de abundancia relativa y los ASV que contribuyeron a < 1% del porcentaje de la abundancia relativa de la muestra se eliminaron del análisis posterior. Toda la clasificación taxonómica y la generación de tablas de taxonomía se realizaron utilizando el paquete Phyloseq (versión 1.40.0) en R studio (21). El material complementario 1 muestra, para cada secuencia, el número de lecturas y las puntuaciones de calidad media tanto antes como después del filtrado, el número de lecturas durante cada paso de procesamiento de la generación de DADA2 ASV, y el número de filos y familias para cada muestra antes y después del filtrado de aquellos con <1% por ciento de abundancia relativa.
El análisis de la diversidad alfa y beta se realizó utilizando los paquetes Phyloseq (Versión 1.40.0) y Vegan (Versión 2.6-2) en R studio (21, 22). Las métricas de diversidad alfa se calcularon para cada muestra utilizando las matrices de Shannon, Inverse Simpson y ASV observadas. Las métricas de diversidad alfa se visualizaron en GraphPad Prism (Versión 9.3.1 para MAC OS X, GraphPad Software, LLC, La Jolla, CA, EE. UU.). La diversidad beta se calculó utilizando un algoritmo de disimilitud Bray-Curtis, donde las muestras se visualizaron en el estudio R utilizando un enfoque de escala multidimensional no métrico (NMDS). Los valores de tensión NMDS <0,2 se consideraron aceptables (23). El gato 6 tenía un solo valor atípico (día 43 durante W2cuando se informó de vómitos de bolas de pelo) que se eliminó del gráfico individual de NMDS para permitir la visualización adecuada de los datos.
2.5. Análisis estadístico
Las heces diarias recogidas de cada gato individual se incluyeron en el análisis estadístico de los puntos finales clínicos (es decir, de peso y fecal) y del microbioma. Se utilizó un modelo lineal de efectos mixtos con una corrección de comparaciones múltiples Bonferroni para examinar el impacto del grupo de tratamiento (GC vs. CG) y la fase experimental (variables independientes) en el peso corporal (variable dependiente). Una prueba de Shapiro-Wilk confirmó que los pesos corporales se distribuían normalmente para los grupos de tratamiento GC (p = 0,63) y CG (p = 0,45). Se utilizó una prueba de Mann-Whitney con una corrección de Benjamini-Hochberg para evaluar el impacto del grupo de tratamiento y la fase experimental (variables independientes) en la puntuación fecal (variable dependiente). Una prueba de Shapiro-Wilk indicó que las puntuaciones fecales se distribuían normalmente dentro del grupo GC (p = 0,85) pero no dentro del grupo CG (p = 0,0116). Para cada matriz de diversidad alfa, una prueba de Mann-Whitney con una corrección de Benjamini-Hochberg comparó el orden del marcador de identificación fecal [es decir, brillo, luego crayón (grupo GC) vs. crayón y luego brillo (grupo CG)] en cada día de estudio. Un análisis de PERMANOVA por pares (análisis multivariable permutacional de la varianza) con una corrección Benjamini-Hochbergpost-hoc comparó la estructura de la comunidad microbiana entre todos los gatos y a través de fases experimentales para gatos individuales utilizando los paquetes Phyloseq y veganos en el estudio R. La abundancia diferencial de filos microbianos y familias se realizó para cada gato individual utilizando el paquete Deseq2 en el estudio R, donde los parámetros se establecieron a los siguientes: Test = Wald, FitType = Parametric, Cook’s Cutoff = FALSE (es decir, no aplicado al conjunto de datos) y corrección post-hoc de Benjamini-Hochberg (24). Las siguientes comparaciones se evaluaron utilizando Deseq2: línea de base vs. M1, línea de base vs. W1, línea de base vs. M2, línea de base vs. W2, M1 vs. W1, M1 vs. M2, M1 vs. W2, W1 vs. M2, W1 vs. W2 y M2 vs. W2. Para todos los análisis, la significación se definió como p < 0,05 después de la corrección post-hoc. Para el Cat 6, la muestra fecal del Día 43 se incluyó en todos los análisis estadísticos.
2.5.1. Disponibilidad de datos
Todas las secuencias incluidas en el presente análisis están disponibles públicamente a través del Archivo de Lectura de Secuencias de Información del Centro Nacional de Biotecnología (NCBI SRA) a través del siguiente número de identificación del Bioproyecto: PRJNA862255.
3. Resultados
3.1. Informe de peso corporal, puntuaciones fecales y eventos adversos
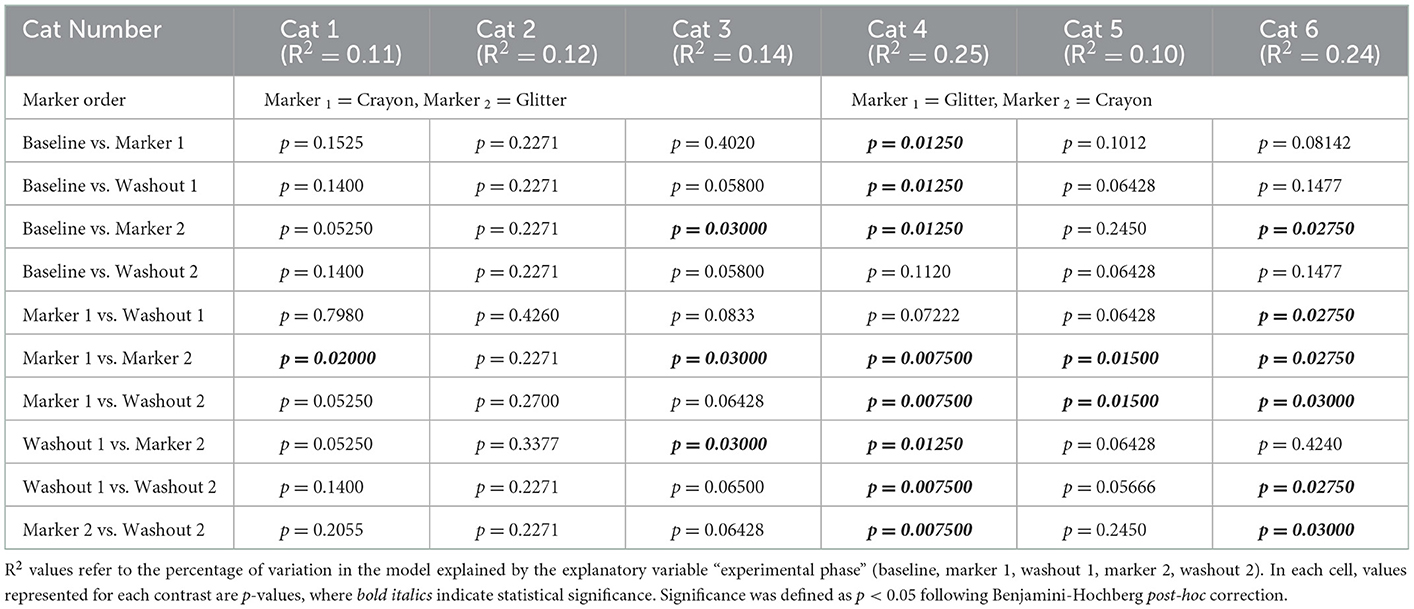
Todos los gatos consumieron sus necesidades de energía en reposo durante toda la duración del estudio. La figura 2 muestra el peso corporal de los gatos y las puntuaciones fecales a lo largo de la duración del estudio. Para todos los gatos, el peso corporal se mantuvo estable en cada fase experimental. El cambio medio porcentual en el peso corporal en cada grupo de gatos fue de +/- 3% desde el inicio a lo largo del estudio de 56 días (Figura 2A). Las puntuaciones fecales aumentaron durante el período de aclimatación de 3 semanas cuando la dieta se pasó de alimentos secos a alimentos enlatados (los datos no se muestran). Después de esta transición, las puntuaciones fecales se mantuvieron consistentemente más altas que la puntuación ideal de 2/7 durante el período de estudio de 56 días (Figura 2B). No hubo un cambio significativo en la puntuación fecal media entre los grupos durante las fases experimentales basal, M1, W1 y M2. Sin embargo, durante W2, el grupo CG experimentó un aumento estadísticamente significativo en la puntuación fecal en comparación con el grupo GC (p = 0,0282; Figura 2B). Las virutas de brillo y crayón eran fácilmente identificables en las heces de todos los gatos (Figura 2C). Durante las fases de lavado, las virutas de crayón fueron visibles en las heces de todos los gatos durante 1-2 días y el brillo fue visible durante 1 a 4 días después de que se eliminara cada marcador fecal de la comida enlatada.
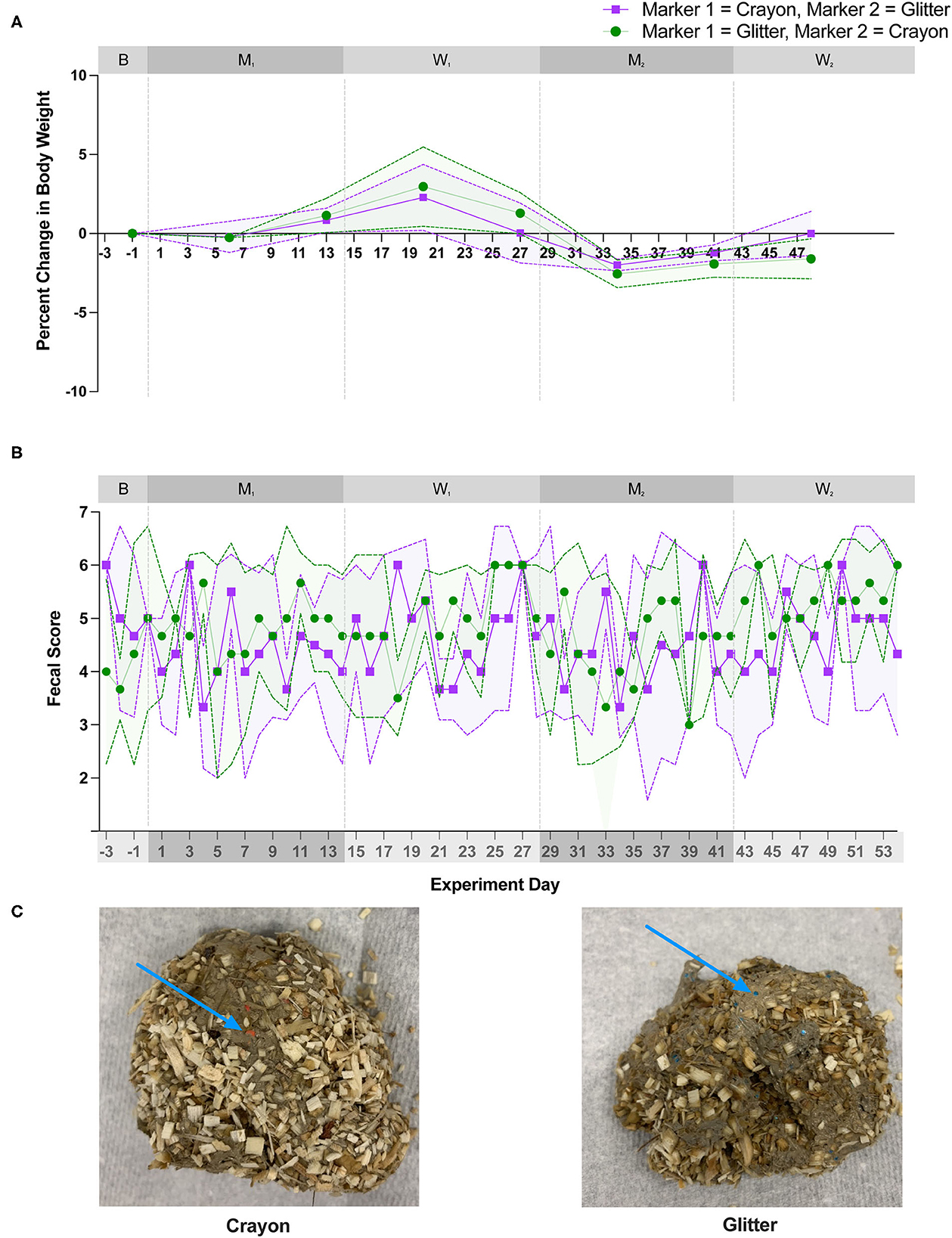 Figura 2. No hubo diferencias significativas en el peso o las puntuaciones fecales con la administración oral de marcadores de identificación fecal. (A) El porcentaje medio de cambio de peso corporal y desviación estándar y (B) puntuación fecal media y desviación estándar durante el experimento de 56 días. Los puntos representan el valor medio del grupo GC y del grupo CG en cada día que se midieron el peso y/o las puntuaciones fecales. Las líneas punteadas que bordean cada región sombreada representan la desviación estándar. La significación estadística se determinó utilizando un modelo de efecto mixto lineal para los cambios de peso corporal y una prueba de Mann-Whitney para los cambios en la puntuación fecal al comparar los grupos de tratamiento del orden de los marcadores [es decir, brillo, luego lápiz de colores (grupo GC) frente a lápiz y luego brillo (grupo CG) en cada fase experimental]. La importancia se definió como p <0,05 para ambos análisis después de la corrección de comparaciones múltiples de Bonferroni (pesos del cuerpo) y una corrección de Benjamini-Hochberg (puntuaciones fecales). (C) Las virutas de lápiz (rojo) y el brillo (azul) eran fácilmente visibles en las heces de gato (denotadas por una flecha azul).
Figura 2. No hubo diferencias significativas en el peso o las puntuaciones fecales con la administración oral de marcadores de identificación fecal. (A) El porcentaje medio de cambio de peso corporal y desviación estándar y (B) puntuación fecal media y desviación estándar durante el experimento de 56 días. Los puntos representan el valor medio del grupo GC y del grupo CG en cada día que se midieron el peso y/o las puntuaciones fecales. Las líneas punteadas que bordean cada región sombreada representan la desviación estándar. La significación estadística se determinó utilizando un modelo de efecto mixto lineal para los cambios de peso corporal y una prueba de Mann-Whitney para los cambios en la puntuación fecal al comparar los grupos de tratamiento del orden de los marcadores [es decir, brillo, luego lápiz de colores (grupo GC) frente a lápiz y luego brillo (grupo CG) en cada fase experimental]. La importancia se definió como p <0,05 para ambos análisis después de la corrección de comparaciones múltiples de Bonferroni (pesos del cuerpo) y una corrección de Benjamini-Hochberg (puntuaciones fecales). (C) Las virutas de lápiz (rojo) y el brillo (azul) eran fácilmente visibles en las heces de gato (denotadas por una flecha azul).
Dos gatos experimentaron vómitos durante el estudio. Cat 4 vomitó un total de cinco veces, una vez en el día 37 (M2) y cuatro veces durante la fase W2 (días 42, 43, 45 y 46). En todas las ocasiones, el vómito fue descrito como una bola de pelo. El gato 6 vomitó una vez el día 54 (W2), que también se describió como una bola de pelo. Durante este estudio no se observaron eventos adversos adicionales en ninguno de los gatos.
3.2. Métricas de diversidad alfa y beta
La diversidad alfa (Shannon Diversity Index, ASV observados e Inverse Simpson Diversity Index) no difirió significativamente entre los grupos de tratamiento durante ninguna fase experimental (Figura 3; p = 0,1000 a p < 0,9999). El análisis beta de la diversidad para todos los gatos reveló que las muestras fecales de gatos individuales se agrupaban más estrechamente con otras muestras fecales del mismo gato independientemente de la fase experimental (Figura 4; PERMANOVA, p < 0,0001 para todas las comparaciones de gatos).
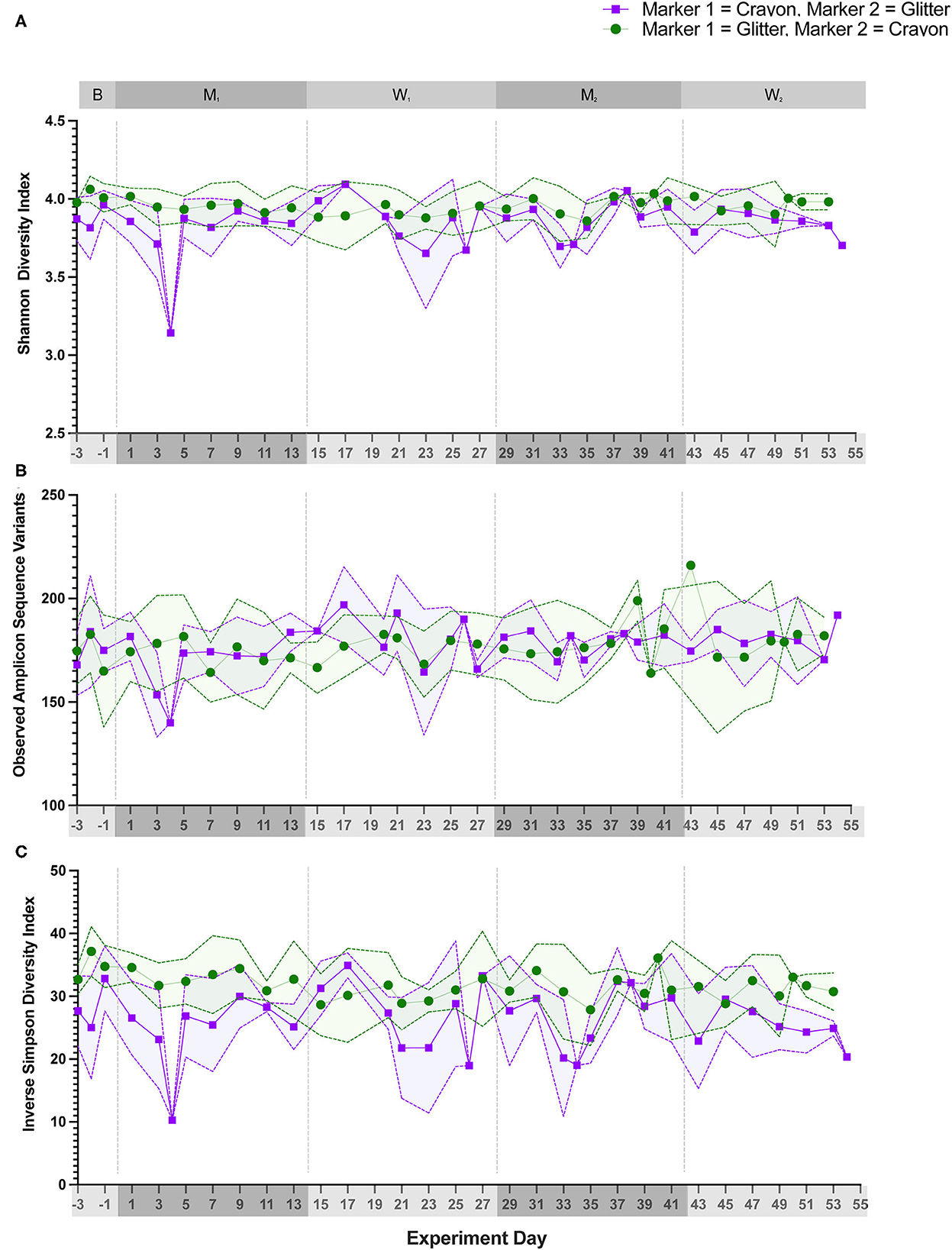 Figura 3. Las métricas de diversidad alfa no diferían significativamente entre los grupos de tratamiento durante cualquier día de estudio. Se calcularon tres métricas de diversidad alfa para cada muestra fecal. (A) Índice de diversidad de Shannon, (B) Número observado de variantes de secuenciación de Amplicon (ASV) y (C) Índice de diversidad de simpson inverso. La significación estadística se determinó utilizando una prueba de Mann-Whitney para comparar los grupos de tratamiento [es decir, brillo, luego lápiz de colores (grupo GC) frente a lápiz y luego brillo (grupo CG)] en cada día de estudio. La importancia se definió como p<0,05 para ambos análisis después de una corrección de Benjamini-Hochberg. Los puntos representan la puntuación media de cada día, y las líneas punteadas que bordean cada región sombreada representan la desviación estándar.
Figura 3. Las métricas de diversidad alfa no diferían significativamente entre los grupos de tratamiento durante cualquier día de estudio. Se calcularon tres métricas de diversidad alfa para cada muestra fecal. (A) Índice de diversidad de Shannon, (B) Número observado de variantes de secuenciación de Amplicon (ASV) y (C) Índice de diversidad de simpson inverso. La significación estadística se determinó utilizando una prueba de Mann-Whitney para comparar los grupos de tratamiento [es decir, brillo, luego lápiz de colores (grupo GC) frente a lápiz y luego brillo (grupo CG)] en cada día de estudio. La importancia se definió como p<0,05 para ambos análisis después de una corrección de Benjamini-Hochberg. Los puntos representan la puntuación media de cada día, y las líneas punteadas que bordean cada región sombreada representan la desviación estándar.
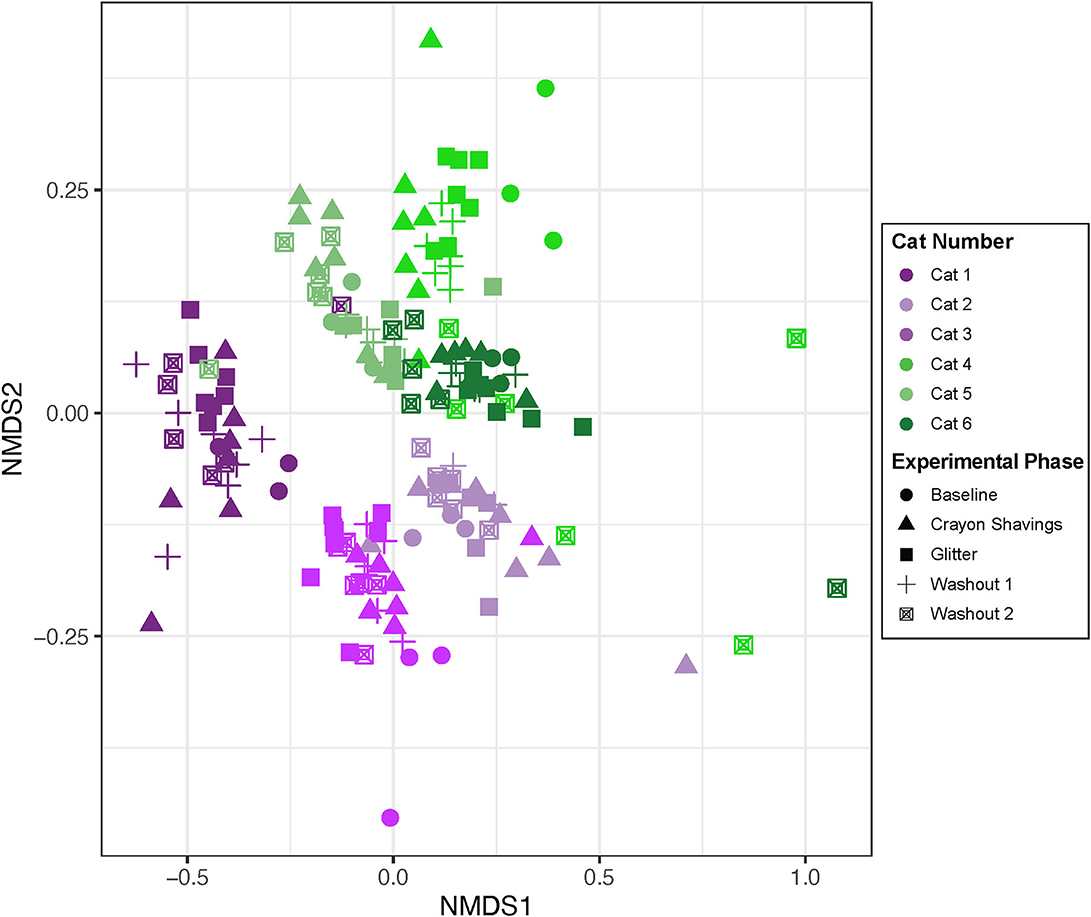 Figura 4. Las composiciones de microbiota de la muestra fecal se agrupan por gatos individuales. La ordenación NMDS se calculó con el algoritmo de disimilitud Bray-Curtis en ASV de muestras fecales. La importancia estadística de la estructura de la comunidad microbiana entre todos los gatos se determinó con un análisis PERMANOVA por pares con una corrección post-hoc de Benjamini-Hochberg. Cada punto representa una muestra fecal individual de un gato. El grupo CG se denota en morado (Cats 1, 2 y 3). El grupo GC se denota en verde (Cats 4, 5 y 6). La fase experimental está representada por un símbolo diferente como se indica en la leyenda.
Figura 4. Las composiciones de microbiota de la muestra fecal se agrupan por gatos individuales. La ordenación NMDS se calculó con el algoritmo de disimilitud Bray-Curtis en ASV de muestras fecales. La importancia estadística de la estructura de la comunidad microbiana entre todos los gatos se determinó con un análisis PERMANOVA por pares con una corrección post-hoc de Benjamini-Hochberg. Cada punto representa una muestra fecal individual de un gato. El grupo CG se denota en morado (Cats 1, 2 y 3). El grupo GC se denota en verde (Cats 4, 5 y 6). La fase experimental está representada por un símbolo diferente como se indica en la leyenda.
Dada la agrupación específica del gato observada, se generaron gráficos NMDS para gatos individuales, donde los colores de la parcela reflejan los grupos de orden de marcadores CG vs. GC (Figura 5). La tabla 1 muestra las comparaciones por pares de PERMANOVA para gatos individuales. A través de todas las comparaciones de cambios experimentales, se observaron cambios idiosincrásicos en las estructuras de la comunidad microbiana fecal. Cada gato respondió de manera diferencial al tratamiento independientemente del orden del marcador, de modo que no hubo una tendencia observable en los cambios de la comunidad microbiana a través de las fases experimentales para ninguna de las comparaciones por pares evaluadas.
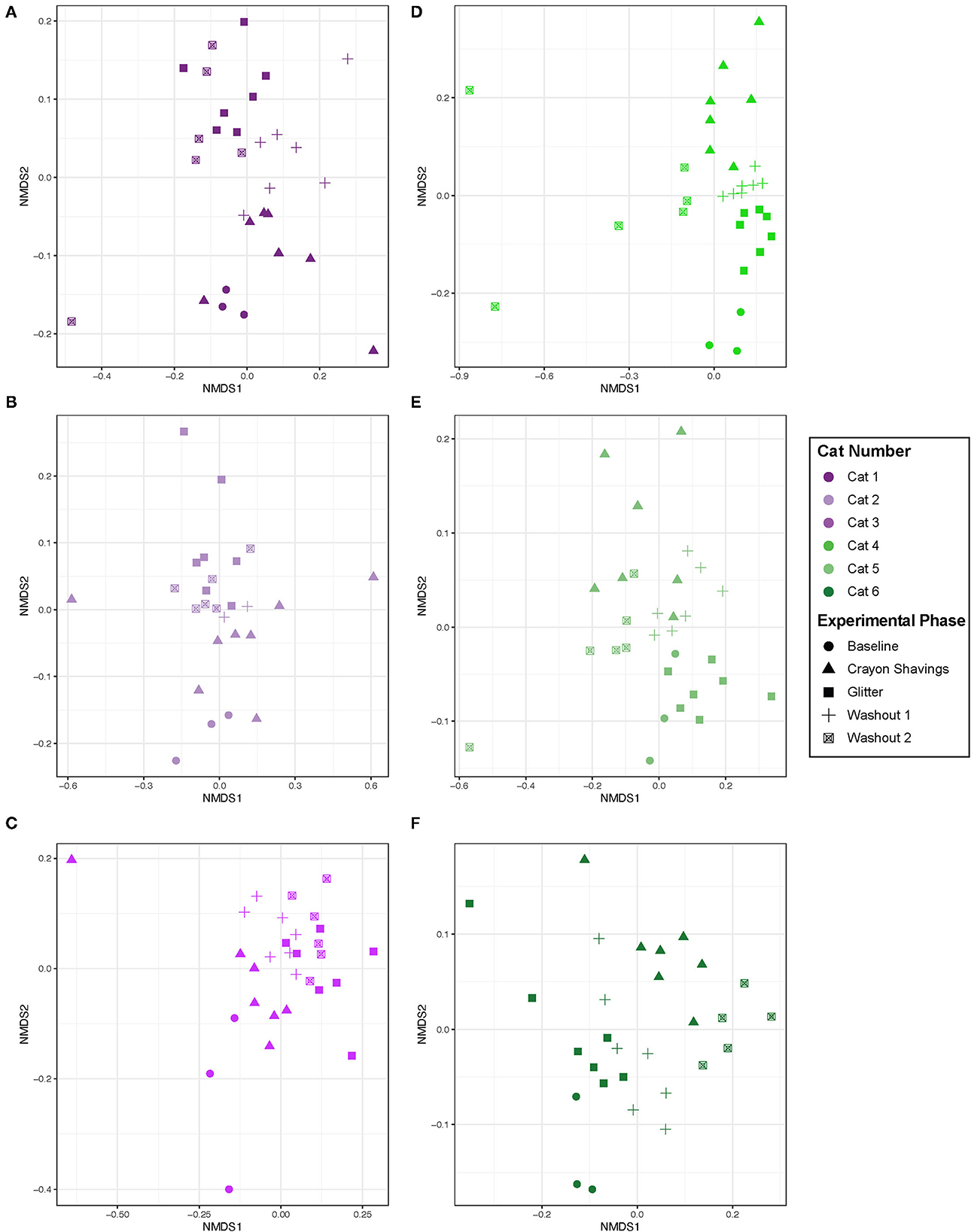 Figura 5. La estructura de la comunidad microbiana se alteró entre fases experimentales en un patrón idiosincrásico. La ordenación NMDS se calculó con el algoritmo de disimilitud Bray-Curtis en ASV de muestras fecales. La importancia estadística de la estructura de la comunidad microbiana en toda la fase experimental para cada gato se determinó con un análisis de PERMANOVA por pares con una corrección post-hoc de Benjamini-Hochberg. El gato 6 tenía un solo valor atípico (día 43 durante W2 cuando se informó de vómitos de bolas de pelo) que se eliminó del gráfico de NMDS para permitir una mejor visualización de los datos. Cada punto representa una muestra fecal individual de un gato. El grupo CG se denota en morado [Cats 1, 2 y 3; gráficos (A-C), respectivamente]. El grupo GC se denota en verde [Cats 4, 5 y 6; parcelas (D-F), respectivamente]. La fase experimental está representada por un símbolo diferente como se indica en la leyenda.
Figura 5. La estructura de la comunidad microbiana se alteró entre fases experimentales en un patrón idiosincrásico. La ordenación NMDS se calculó con el algoritmo de disimilitud Bray-Curtis en ASV de muestras fecales. La importancia estadística de la estructura de la comunidad microbiana en toda la fase experimental para cada gato se determinó con un análisis de PERMANOVA por pares con una corrección post-hoc de Benjamini-Hochberg. El gato 6 tenía un solo valor atípico (día 43 durante W2 cuando se informó de vómitos de bolas de pelo) que se eliminó del gráfico de NMDS para permitir una mejor visualización de los datos. Cada punto representa una muestra fecal individual de un gato. El grupo CG se denota en morado [Cats 1, 2 y 3; gráficos (A-C), respectivamente]. El grupo GC se denota en verde [Cats 4, 5 y 6; parcelas (D-F), respectivamente]. La fase experimental está representada por un símbolo diferente como se indica en la leyenda.
3.3. Abundancia relativa y abundancia diferencial a nivel filo y familiar
Las figuras 6, 7 muestran las abundancias relativas de filo microbiano y familias, respectivamente, para cada gato y día de estudio. El material suplementario 1 muestra el porcentaje de abundancia relativa de todos los filos y ASV familiares para cada muestra, y la Tabla Suplementaria 3 proporciona los cambios de pliegue log2 de los miembros de la familia diferencialmente abundantes para cada gato a través de diferentes fases experimentales. Se identificaron ocho filos en todos los gatos y fases de estudio. Entre estos filos, Firmicutes fue el más abundante, donde su porcentaje de abundancia osciló entre el 42,81 y el 69,44% en los gatos durante la línea de base, el 44,76 a 65,61% durante M1, del 45,35 al 68,66% durante W1, del 48,17 al 72,38 % M2, y del No se identificaron diferencias significativas en el porcentaje de abundancia de Firmicutes para ningún gato en ninguna de las fases del estudio. En dos gatos, el phylum Campylobacterota se redujo significativamente al comparar M1 vs. W1 (Cat 4, disminución del pliegue log2 −1,54, p = 0,045), M1 vs. M2 (Cat 4, disminución del pliegue log2 −2.34, p = 0,000033), Cat 5, Se observó una disminución aguda en Bacteriodota durante la fase de lavado 2 entre los días 41 y 43 para los gatos 4 y 6 (grupo GC). En el Cat 4, entre los días 41 y 43, el etiriodota disminuyó de 28,78 a un 1,75 % (imposición estándar del 21,65 % ± 4,85 %, al promediar todos los demás días de estudio). En el Cat 6, Bacteriodota disminuyó de 17,580 a 0,94 % (media de 25,43 ± 4,49 % de desviación estándar) durante este período de tiempo. Para ambos gatos, después de la caída aguda del día 43, ambos Bacteriodota aumentaron hacia sus niveles de abundancia anteriores (es decir, antes del episodio de vómitos de bolas de pelo) dentro de los 2 días posteriores al episodio (Figuras 6D–F). Sin embargo, como estos cambios ocurrieron a mediados del W2, no se detectaron como abundancias de filo diferencial en ninguna comparación de fase experimental (material suplementario 2).
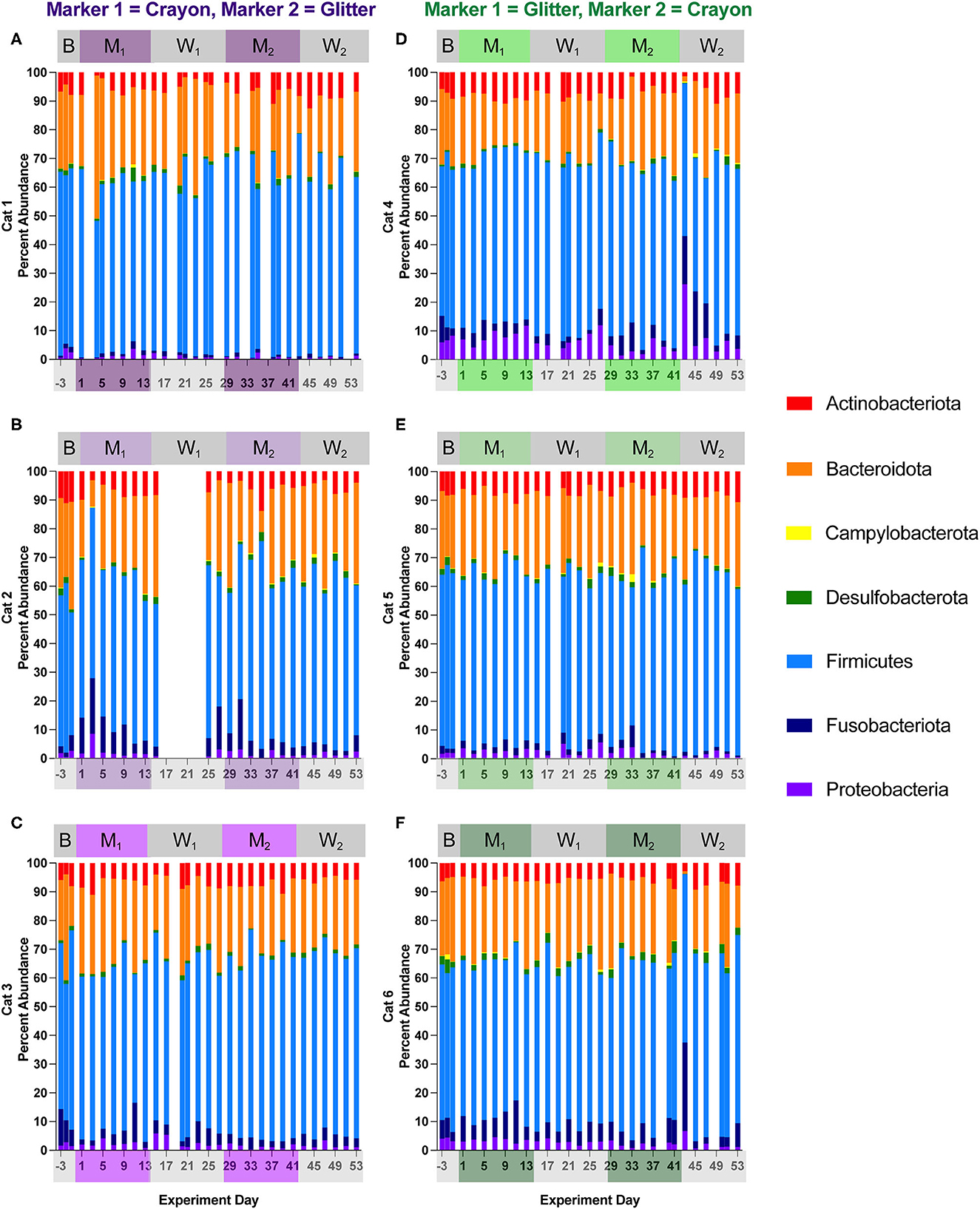 Figura 6. Los cambios dependientes del gato en las abundancias relativas de la fila se produjeron en todas las fases experimentales. La composición de la microbiota fecal se visualizó con gráficos de barras de la abundancia relativa del filo para cada gato (n = 3 por grupo de tratamiento). El grupo CG se denota en morado [Cats 1, 2 y 3; gráficos de barras (A-C), respectivamente]. El grupo GC se denota en verde [Cats 4, 5 y 6; parcelas de barras (D-F), respectivamente]. Los días sin datos indican que no se recogieron heces de la separación durante la noche.
Figura 6. Los cambios dependientes del gato en las abundancias relativas de la fila se produjeron en todas las fases experimentales. La composición de la microbiota fecal se visualizó con gráficos de barras de la abundancia relativa del filo para cada gato (n = 3 por grupo de tratamiento). El grupo CG se denota en morado [Cats 1, 2 y 3; gráficos de barras (A-C), respectivamente]. El grupo GC se denota en verde [Cats 4, 5 y 6; parcelas de barras (D-F), respectivamente]. Los días sin datos indican que no se recogieron heces de la separación durante la noche.
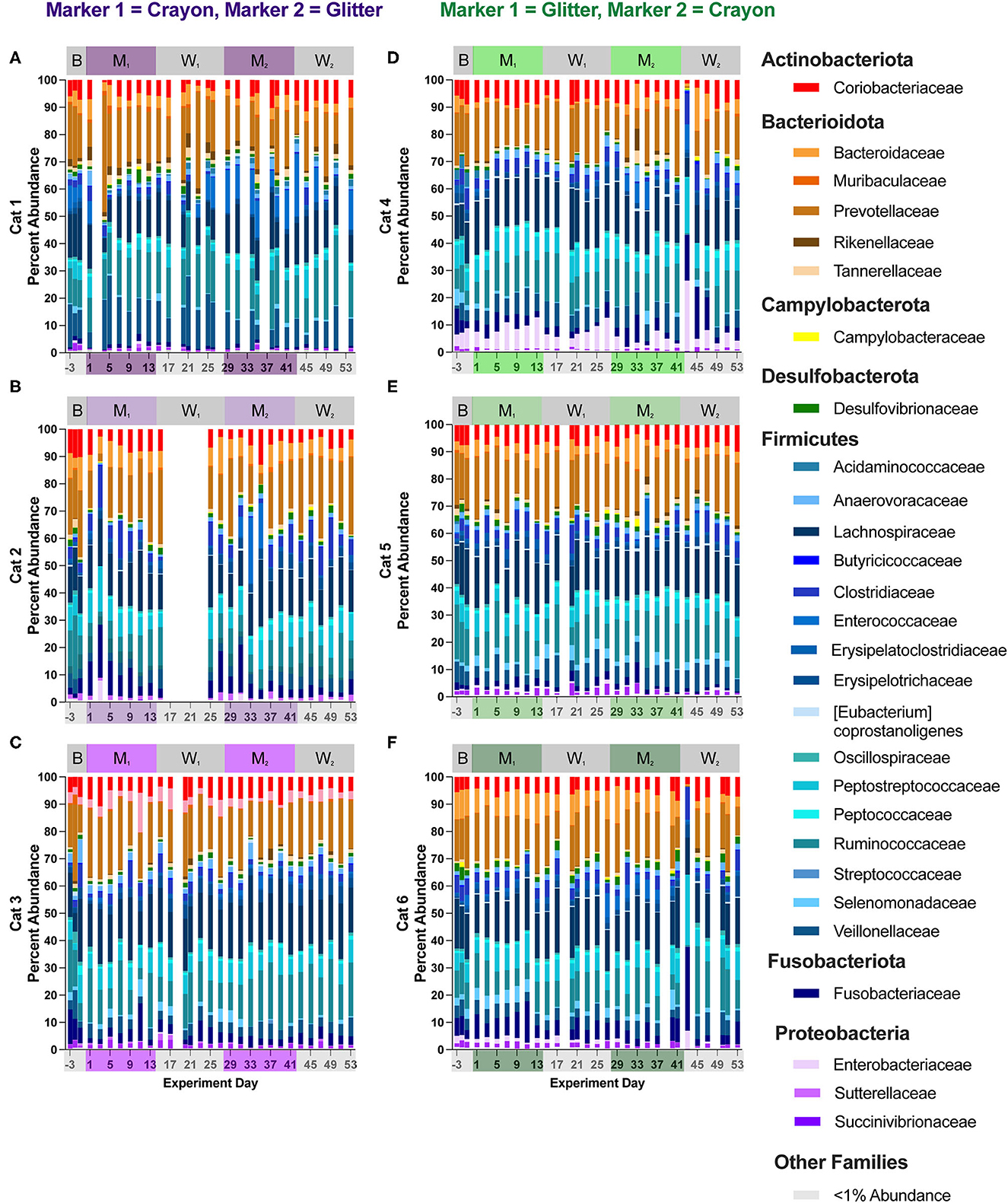 Figura 7. Los cambios dependientes de los gatos en las abundancias relativas de la familia se produjeron en todas las fases experimentales. La composición de la microbiota fecal se visualizó con parcelas de barras de la abundancia relativa de la familia para cada gato (n = 3 por grupo de tratamiento). El grupo CG se denota en morado [Cats 1, 2 y 3; gráficos de barras (A-C), respectivamente]. El grupo GC se denota en verde [Cats 4, 5 y 6; parcelas de barras (D-F), respectivamente]. Los días sin datos indican que no se recogieron heces de la separación durante la noche.
Figura 7. Los cambios dependientes de los gatos en las abundancias relativas de la familia se produjeron en todas las fases experimentales. La composición de la microbiota fecal se visualizó con parcelas de barras de la abundancia relativa de la familia para cada gato (n = 3 por grupo de tratamiento). El grupo CG se denota en morado [Cats 1, 2 y 3; gráficos de barras (A-C), respectivamente]. El grupo GC se denota en verde [Cats 4, 5 y 6; parcelas de barras (D-F), respectivamente]. Los días sin datos indican que no se recogieron heces de la separación durante la noche.
Se identificaron cincuenta y tres familias en todos los gatos y fases de estudio (material complementario 2). Los cambios en las familias agrupadas bajo el filo Firmicutes representaron la mayoría de las familias diferencialmente abundantes en cinco de los seis gatos (no se observaron diferencias en el gato 6). Estas familias diferencialmente abundantes incluían Acidaminococcaceae, Anaerovoracaceae, Clostridiaceae, Enterococcaceae, Erysipelatoclostridiaceae, Erysipelotrichaceae, Eubacteriaceae, Peptococcaceae y Streptococcaceae. Las alteraciones de las familias asociadas con el phylum Actinobacteriota estuvieron presentes en cuatro gatos en todas las fases experimentales e incluyeron Atopobiaeae, Eggerthellaceae y Bifidobacteriaceae. Para las familias asociadas a Firmicutes, no hubo patrones discernibles de aumentos o disminuciones para ningún gato y en ningún par de fases experimentales. Para las familias asociadas a Actinobacteriota, tres gatos (Cat 3, Cat 4, Cat 6) tuvieron alteraciones significativas en la familia Bifidobacteriaceae a lo largo de las fases experimentales. En el gato 3, esto incluyó una disminución de pliegues log2 de -7,20 al comparar la línea de base frente a M1 (p = 0,00021) y una disminución de pliegues de log2 de –7.05 al comparar la línea de base con M2 (p = 0,00034). En el Cat 4, se observó un aumento de Bifidobacteriaceae al comparar W1 con M2 (aumento de pliegues de la 2,32, p = 0,016). Para Cat 6, se observó un aumento de Bifidobacteriaceae cuando se comparó W1 con M2 (log2 de aumento de 2,12, p = 0,0088), al comparar M1 con M2 (log2 de aumento de 2,22, p = 0,0040) y para la línea base frente a M2 (log2 de aumento de 2,22, p = 0,0040) 2,46, p = 0,030).
En el gato 4 y el gato 6 se observaron cambios en las abundancias familiares entre los días 41 y 43 (episodio agudo de vómitos de bolas de pelo). Para el Cat 4, al comparar el día 41 con el día 43, estos cambios incluyeron aumentos en Peptostreptococcaceae de 5,49 a 20,14 %, (media de 16,48 ± 3,91% desviación estándar, al promediar todos los demás días de estudio), el aumento de Enterobacteriaceae de 1,57 al 25,91% (media de 5,43 En el Cat 6, al comparar los días 41 y 43, Fusobacteriaceae aumentó de 8,64 a 30,84% ( 6,04% promedio ± 2,78% de desviación estándar al promediar todos los demás días de estudio), Peptostreptococcaceae aumentó de 8,86 a 25,65 % (media 7,18 ± 1,82% de desviación estándar), y Prevotell Al igual que las tendencias observadas a nivel de filo, las abundancias relativas familiares volvieron a sus niveles anteriores en el día 45 hasta el final del estudio, y no hubo cambios en las abundancias diferenciales familiares se vieron afectados por este cambio agudo, como ocurrió en medio de la segunda fase de lavado, momento en el que los gatos ya no consumían ningún marcador (Figures 7D, F, Supplementary material 2).
4. Discusión
El objetivo de este estudio era determinar si los marcadores de identificación fecales administrados oralmente, purpurina y virutas de crayon alteraron la estructura de la comunidad microbiana fecal en gatos domésticos adultos sanos. Si bien el peso corporal, las puntuaciones fecales y el estado de salud se mantuvieron consistentes para todos los gatos a lo largo del estudio, los gatos demostraron cambios idiosincrásicos de la microbiota fecal durante la administración oral de virutas de brillo y de lápices de colores que eran independientes del orden de tratamiento del marcador. En consecuencia, el análisis posterior se centró en las diferencias en la composición de la comunidad microbiana fecal entre las fases experimentales de cada gato individual, donde cada gato sirvió como su propia comparación interna. Se han demostrado fenómenos similares en varios otros estudios felinos, incluso en gatos de diferentes edades y regiones intestinales, durante el uso de antibióticos, en presencia de un sinbiótico e independientemente de la técnica de muestreo (25-28).
La puntuación fecal y el peso corporal se evaluaron a lo largo del estudio dados sus impactos conocidos en la microbiota intestinal (29, 30). Los cambios de peso fueron mínimos para todos los gatos a lo largo del estudio, ya que fueron alimentados y consumidos sus necesidades calóricas de mantenimiento, lo que sugiere que las fluctuaciones de peso no fueron un factor principal de las alteraciones observadas en la comunidad microbiana observadas durante este estudio. Se han asociado cambios menores pero abruptos en la consistencia fecal con cambios de microbiota en gatos (29). Además, la consistencia de las heces es un aspecto importante de la salud felina, y algunos propietarios y profesionales pueden dudar en usar marcadores de identificación fecal si causan diarrea de forma inherente. Dado que las puntuaciones fecales fueron elevadas en la línea de base para todos los gatos (puntuación media de 4,5 para el grupo CG, puntuación media de 6 para el grupo GC), no se pueden inferir los efectos de las virutas de brillo o lápices de colores solo en la puntuación fecal. Las puntuaciones fecales se mantuvieron consistentemente altas a lo largo del estudio de 56 días y no aumentaron ni disminuyeron significativamente entre los grupos CG y GC durante ninguna de las fases experimentales (Figura 2B). Estos hallazgos sugieren que las altas puntuaciones fecales observadas para todos los gatos aquí pueden estar relacionadas con la transición a una dieta exclusivamente enlatada tres semanas antes del inicio del estudio frente a la adición de marcadores fecales (afeitado de brillo o virutas de crayón).
Se sabe que las alteraciones de la dieta, incluido el contenido de fibra, modulan la frecuencia de los movimientos intestinales y la consistencia fecal en los gatos (31, 32). En consecuencia, las modulaciones de la fibra dietética ofrecen una explicación para las puntuaciones fecales más altas identificadas en este estudio. El contenido de fibra disminuyó de 0,72 gramos/100 kcal en la formulación de alimentos secos a 0,15 gramos/100 kcal en la dieta enlatada (Tabla Complementaria 1). Un estudio anterior observó que los gatos tenían puntuaciones fecales más altas al hacer la transición a dietas que contenían pectinas o fructooligosacáridos, pero por lo demás no se notificaron otros problemas adversos para la salud (25). Otros estudios han informado de una disminución de la consistencia de las heces (es decir, menos formadas y con mayor humedad) cuando los gatos sanos se complementaron con una variedad de fibras que oscilaban entre el 3 y el 11 % sobre una base as-fed (33, 34), y es posible que se haya producido una respuesta similar en este estudio. Dentro de esta población de estudio clínicamente sana felina, no hay sospecha de una enteropatía sensible a los alimentos y/o a las fibras, ya que las puntuaciones fecales se normalizaron después de este estudio cuando los gatos fueron de nuevo a su dieta seca original baja en fibra. Esto proporciona evidencia de que el aumento de la consistencia fecal se vio afectado en gran medida por el cambio en la formulación dietética en esta población de gatos.
La diversidad alfa, que mide la diversidad de la comunidad microbiana de una muestra fecal individual, se ha observado anteriormente que fluctúa con cambios agudos y crónicos en el entorno gastrointestinal felino, incluso con el uso de antibióticos y en la enteropatía crónica (7, 27). La diversidad alfa no varió al comparar las puntuaciones medias del grupo CG con el grupo GC (Figura 3) en cualquier fase experimental. Estos hallazgos apoyan que la diversidad general dentro de las muestras fecales individuales no se vio afectada significativamente por la administración de afeitado de brillo o lápices de colores. Al evaluar la diversidad entre muestras (diversidad beta), las comunidades microbianas fecales fueron más similares dentro de los gatos individuales, de modo que cada gato tenía una composición distintiva del microbioma fecal (p < 0,0001 para todas las comparaciones de gatos) y no se observaron diferencias entre las fases experimentales o entre los grupos CG y GC (Figura 4).
Dada la respuesta idiosincrásica observada aquí, cada gato fue evaluado individualmente para los cambios en la comunidad microbiana fecal (Figura 5). Un gato (Cat 2) no demostró alteraciones significativas en la estructura de la comunidad microbiana fecal a lo largo del estudio. Sin embargo, en cinco de los seis gatos, se observaron diferencias significativas en la estructura de la comunidad microbiana fecal en diferentes fases experimentales, pero no fueron consistentes entre los gatos (Tabla 1). Los cambios en los marcadores temporales y fecales representaron estos cambios en la comunidad de la microbiota fecal. El gato 1, el gato 5 y el gato 6 demuestran cambios temporales, pero no marcadores, dependientes en la microbiota fecal en el transcurso de este estudio. Para estos gatos, no se observan cambios significativos en la microbiota fecal al comparar M1 con W1 y la línea de base, ni se observan cambios al comparar M2 con W2 y W1. Sin embargo, hay cambios significativos en la composición de la comunidad microbiana fecal al comparar fases experimentales no consecutivas, como M1 vs. M2. Las familias que contribuyeron a estos cambios temporales incluyeron el aumento de las Clostridiaceae en el Cat 1 (3,07 log2 de aumento del pliegue, p = 0,0001) y el Cat 5 (1,46 log2 de aumento del pliegue, p = 0,026) y la disminución de las Bifidobacteriaceae en el Cat 6 (−2.22 log2 Estas familias son naturalmente abundantes en la saludable microbiota fecal felina adulta (35). Los factores extrínsecos (es decir, controles de peso, exámenes físicos y cambios en el personal diario que maneja a cada gato) y/o la variación fisiológica normal que modula la microbiota intestinal pueden estar impulsando estos cambios temporales. Se ha demostrado que los factores estresantes ambientales agudos modulan la microbiota intestinal en personas y ratones (36–38). Sin embargo, ningún estudio en gatos ha explorado el impacto de los factores de estrés ambientales agudos en la microbiota intestinal. Además, la variación fisiológica normal en la microbiota intestinal felina está mal definida.
En contraste con las modulaciones dependientes del tiempo, los marcadores fecales modularon la microbiota en Cat 3 y Cat 4. Para estos gatos, se observaron modulaciones a la microbiota fecal a través de las fases experimentales que estaban directamente antes o después de la administración de marcadores fecales. En Cat 3, las diferencias significativas entre las comunidades microbianas fecales W1 y M2(administración de brillo) posteriores apoyan que la adición de brillo modulaba la microbiota fecal. En el cat 4, las diferencias significativas entre la línea de base y M1(administración de brillo) y entre W1 y M2 (administración de crayon) indican que ambos marcadores de identificación fecal modularon la microbiota fecal. La disminución de Acidaminococcaceae (−5,91 log2 fold, p = 0.014) y Streptococcaceae (−6.21 log2 fold, p = 0.030) en Cat 3 y Eggerthellaceae decreased (−1.97 log2 fold, p = 0.0000049) y Anaerovoracaceae (− Del mismo modo, se puede evaluar el impacto de las virutas orales de los crayones en el aumento de las bifidobacteriaceae fecales (aumento de los volúmenes 2,32, p = 0,016, Cat 4), dados los roles que desempeñan las bifidobacterias en la digestión, la salud del colon del huésped y la función inmune (Tabla complementaria 2) Además, la falta de diferencias entre las comunidades fecales M2 y W2 para Cat 3 demuestra que estos cambios impulsados por los marcadores fecales persistieron durante todo el período de lavado de 14 días. Por lo tanto, puede ser necesario un tiempo de lavado más largo si se utilizan estos marcadores junto con los análisis de microbiota fecal. Esto fue difícil de evaluar en Cat 6, que experimentó vómitos de bolas de pelo durante W2.
Junto con los impactos impulsados por marcadores de identificación temporal y fecal en la microbiota fecal felina, los cambios agudos en la composición de la microbiota fecal para los gatos 4 y 6, que se produjeron entre los días 41 y 43, coincidieron con el vómito de bolas de pelo. No hay estudios que evalúen los cambios en la microbiota fecal en gatos con vómitos agudos transitorios secundarios a bolas de pelo. Sin embargo, se sabe que otros trastornos gastrointestinales agudos, incluida la diarrea, alteran la estructura microbiana fecal de la comunidad en los gatos, donde se han observado aumentos en phyla Firmicutes y Proteobacterias (29). Aunque estos taxones no se vieron afectados por los vómitos en este estudio, la disminución aguda de phylumBacteriodota y la familia Prevotellaceae, así como el aumento de las familias Enterobacteriaceae, Peptostreptococcaceae y Fusobacteriaceae se pueden explorar en futuros estudios como firmas de microbiota asociadas con vómitos agudos felinos. Estos resultados enfatizan adicionalmente el impacto que la frecuencia de muestreo (es decir, el muestreo diario frente al muestreo semanal) tuvo en los resultados potenciales de este estudio. Por ejemplo, si el muestreo solo se había realizado en un día de cada fase experimental, el cambio agudo de la microbiota asociado con los vómitos puede haberse pasado por alto, o si se incluye, puede tener una interpretación sesgada de los cambios de composición fecal a lo largo del tiempo. Las fluctuaciones diarias de la microbiota sana, que se sabe que ocurren en las personas, aún no se han establecido para los gatos domésticos y probablemente sean contribuyentes adicionales a los cambios en la abundancia de la microbiota identificados a lo largo de las fases experimentales (27, 40).
Las limitaciones de este estudio incluyen un tamaño de muestra pequeño (n = 6 gatos) que puede no haber sido lo suficientemente alimentado como para superar las diferencias individuales de los gatos para identificar cambios en la microbiota en respuesta a cada marcador fecal y con el tiempo. No hay un estándar para calcular el poder para los estudios con análisis basados en secuencias de microbioma y metagenoma, ya que el cálculo de los tamaños de efecto a partir de un conjunto de datos de composición puede no reflejar con precisión la verdadera magnitud de la diferencia entre tratamientos y/o ser clínicamente relevante (41-43). Aproximadamente entre el 10 y el 25 % de la variación en la estructura de la comunidad microbiana entre las muestras se atribuyó a diferencias entre las fases experimentales, lo que sostiene que hay una contribución tanto de la fase experimental como del orden potencialmente marcador en la microbiota fecal. El impacto del tiempo en la microbiota fecal también puede servir como una variable de confusión aquí, incluidos los cambios a través de las fases experimentales secundarias al orden de los marcadores. Sin embargo, dado que solo uno de los seis gatos examinados (Cat 4, Tabla 1) mostró una diferencia entre los puntos de tiempo de referencia y washout 1, y ningún gato mostró una diferencia en la estructura de la comunidad al comparar la línea de base con el washout 2, no se prevé que el tiempo sea un factor impulsor en las diferencias reportadas aquí. A la luz de estas variables confusas, no está claro si las alteraciones en la filo microbiana y las familias que se observaron aquí estaban relacionadas exclusivamente con la administración de marcadores fecales de brillo y lápices de colores. Aunque este estudio no identificó ningún efecto clínico adverso en gatos que fuera directamente atribuible a las virutas de brillo o crayón, se desconocen los efectos a largo plazo de estos marcadores en la salud clínica. Sin embargo, no se prevén efectos adversos clínicos a largo plazo dada la falta general de eventos adversos notificados en otros estudios que evalúan el uso de marcadores fecales en gatos propiedad del cliente (11-13).
Además, no se establece el impacto de la frecuencia de muestreo en los cambios en la comunidad microbiana. Las diferencias entre los marcadores fecales para cada gato pueden reflejar, en parte, las fluctuaciones diarias normales en la abundancia microbiana frente a los cambios impulsados por el brillo o las virutas de lápices de colores. Establecer este efecto de la frecuencia de muestreo también puede ser importante antes de usar marcadores fecales en futuros estudios con parámetros de microbiota. El impacto de las virutas de brillo y lápices de colores en las muestras fecales utilizadas para calcular el índice de disbiosis felina, que utiliza qPCR para estimar la abundancia de varios miembros clave dentro de la microbiota fecal, debe evaluarse adicionalmente, ya que este índice cuantifica la abundancia de Bifidobacterias y otros géneros asociados con la filo y las familias diferencial Aunque la disbiosis se define con este índice para gatos con enteropatías crónicas (44), el índice no se ha validado para otras poblaciones de gatos, incluidos los gatos sanos que reciben marcadores de identificación fecal, ni se ha examinado para detectar cambios a lo largo del tiempo (por ejemplo, días a semanas) en una población de gatos domésticos.
Aunque los impactos de las virutas de brillo y crayón en la microbiota fecal felina merecen una mayor investigación, estos marcadores siguen sirviendo como herramientas útiles para distinguir las heces entre gatos individuales. En los hogares de varios gatos, las instalaciones de laboratorio y los refugios, las virutas de brillo y crayón pueden funcionar como un régimen oral asequible y bien tolerado que desaparece de las heces a los pocos días de su interrupción. Los escenarios clínicos en los que la administración oral de virutas de brillo y/o crayón puede ser útil incluyen diferenciar entre gatos para diagnósticos de rutina como flotadores fecales, identificar gatos con diarrea, evaluar las preferencias de la caja de arena y evaluar la defecación inadecuada fuera de la caja de arena.
5. Conclusiones
La administración oral de virutas de crayón y brillo se tolera bien en los gatos y se observa fácilmente en las heces, lo que apoya su uso en la práctica clínica. Sin embargo, las virutas de crayón y el brillo mostraron variaciones estadísticamente significativas en las estructuras de la comunidad microbiana fecal de los gatos individuales, incluidas las medidas en el índice de disbiosis felina, y por lo tanto deben usarse con precaución cuando el diagnóstico y/o la investigación incluyan los puntos finales de la microbiota hasta que el impacto de la frecuencia La investigación que investiga la frecuencia de muestreo fecal y la dinámica diaria de la comunidad microbiana felina tanto en las instalaciones de investigación como en entornos domésticos está justificada y podría ampliar la utilidad de estos marcadores de identificación fecal.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres del repositorio/de los repositorios y el(los) número(s) de acceso se pueden encontrar en el artículo/material complementario.
Declaración ética
El estudio sobre animales fue revisado y aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Estatal de Ohio (2017A00000093-R1).
Contribuciones del autor
Conceptualización: JW, AR, JH y VP. Adquisición de fondos: JW, AR, JH y JQ. Administración del proyecto: JW y AR. Colección de muestras: HK, MS y AR. Curación de datos: NN y HK. Análisis de microbioma, análisis de datos y visualización: NN y JW. Redacción: borrador original: NN y AW. Escritura: revisión y edición: JW, NN, AW, AR, VP y JQ. Todos los autores contribuyeron a este artículo y aprobaron la versión presentada.
Financiación
A los autores también les gustaría reconocer las siguientes fuentes de apoyo financiero: el Programa de Subvenciones de Investigación Residentes ACVIM (American College of Veterinary Internal Medicine), Buttons Fund for Feline Chronic Kidney Disease Research y el Popeye Feline Fund de la Universidad Estatal de Ohio.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1039931/full#supplementary-material
Referencias
1. Lund EM, Armstrong PJ, Kirk CA, Kolar LM, Klausner JS. Estado de salud y características de la población de perros y gatos examinados en consultorios veterinarios privados en los Estados Unidos. J Am Vet Med Assoc. (1999) 214:1336–41.
2. Lyu Y, Su C, Verbrugghe A, Van de Wiele T, Martinez-Caja AM, Hesta M. Pasado, presente y futuro de la investigación sobre la microbiota gastrointestinal en gatos. Microbiol frontal.(2020) 11:1661. doi: 10.3389/fmicb.2020.01661
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
3. Suchodolski JS. Micro microbiota intestinal de perros y gatos: un mundo más grande de lo que pensábamos. Vet Clin North Am Small Anim Pract. (2011) 41:261–72. doi: 10.1016/j.cvsm.2010.12.006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
4. Suchodolski JS. Análisis del microbioma intestinal en perros y gatos. Vet Clin Pathol. (2022) 50:6–17. doi: 10.1111/vcp.13031
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
5. Wernimont SM, Radosevich J, Jackson MI, Ephraim E, Badri DV, MacLeay JM, et al. Los efectos de la nutrición en el microbioma gastrointestinal de gatos y perros: impacto en la salud y la enfermedad. Microbiol frontal. (2020) 11:1266. doi: 10.3389/fmicb.2020.01266
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
6. Watson VE, Jacob ME, Bruno-Bárcena JM, Amirsultan S, Stauffer SH, Píqueras VO, et al. Influencia de la microbiota intestinal en la susceptibilidad a la enfermedad en gatitos con transporte inducido experimentalmente de Escherichia coli enteropatogénica atípica.Microbiol veterinario. (2019) 231:197–206. doi: 10.1016/j.vetmic.2019.03.020
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
7. Marsilio S, Pilla R, Sarawichitr B, Chow B, Hill SL, Ackermann MR, et al. Caracterización del microbioma fecal en gatos con enfermedad inflamatoria intestinal o linfoma alimentario de células pequeñas.Sci Rep. (2019) 9:19208. doi: 10.1038/s41598-019-55691-w
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
8. Summers SC, Quimby JM, Isaiah A, Suchodolski JS, Lunghofer PJ, Gustafson DL. El microbioma fecal y las concentraciones séricas de sulfato de inxila y sulfato de p-cresol en gatos con enfermedad renal crónica. J Vet Intern Med. (2019) 33:662–9. doi: 10.1111/jvim.15389
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
9. Bell ET, Suchodolski JS, Isaiah A, Fleeman LM, Cook AK, Steiner JM, et al. Micro microbiota fecal de gatos con diabetes mellitus tratada con insulina. PLoS ONE. (2014) 9:e108729. doi: 10.1371/journal.pone.0108729
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
10. Jones SE, Quimby JM, Summers SC, Adams SM, Caney SM, Rudinsky AJ. Encuesta de hábitos de defecación en gatos con enfermedades renales aparentemente sanos y crónicas. J Feline Med Surg. (2022) 24:131-41. doi: 10.1177/1098612X211012684
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
11. Neilson JC. Ensuciamiento de la casa felina: comportamientos de eliminación y marcado.Práctica de Clin Tech Small Anim. (2004) 19:216-24. doi: 10.1053/j.ctsap.2004.10.003
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
12. Griffin B. El uso de marcadores fecales para facilitar la recolección de muestras en gatos de grupo. Contemp Top Lab Anim Sci. (2002) 41:51–6.
13. Fazio JM, Freeman EW, Bauer E, Rockwood L, Brown JL, Hope K, et al. Monitoreo longitudinal de la función adrenocortical de la hormona fecal en gatos pesqueros alojados en zoológicos (Prionailurus viverrinus) durante las transferencias institucionales y las introducciones de cría.PLoS ONE. (2020) 15:e0230239. doi: 10.1371/journal.pone.0230239
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
14. Tabla de puntuación de Purina Fecal. Disponible en línea en: https://www.purinainstitute.com/centresquare/nutritional-and-clinical-assessment/purina-fecal-scoring-chart (consultado el 20 de diciembre de 2022).
15. Tal M, Verbrugghe A, Gomez DE, Chau C, Weese JS. El efecto del almacenamiento a temperatura ambiente en la microbiota fecal felina. BMC Vet Res. (2017) 13:256. doi: 10.1186/s12917-017-1188-z
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
16. Kozich, JJ, Westcott, SL, Nielson, BT, Highlander SK, Schloss PD. Desarrollo de una estrategia de secuenciación de doble índice y una tubería de curación para analizar los datos de secuencia de amplicon en la plataforma de secuenciación de ilumina MiSeq. Appl Environ Microbiol. (2013) 79:5112–20. doi: 10.1128/AEM.01043-13
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
17. Caporaso GJ, Lauber CL, Walters WA, Berg-Lyons D, Lozupone CA, Turnbaugh PJ, et al. Patrones globales de diversidad de ARNr 16S a una profundidad de millones de secuencias por muestra. Proc Nat Acad Sci. (2010) 108:4516-22. doi: 10.1073/pnas.1000080107
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
18. Computación R. R: Un lenguaje y un entorno para la computación estadística. Viena: Equipo principal de R. (2013).
19. Callahan BJ, McMurdie PJ, Rosen MJ, Han AW, Johnson AJA, Holmes SP. DADA2: Inferencia de muestra de alta resolución a partir de datos de amplicones de Illumina. Métodos Nat. (2016) 13:581–3. doi: 10.1038/nmeth.3869
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
20. Quast C, Pruesse E, Yilmaz P, Gerken J, Schweer T, Yarza P, et al. El proyecto de base de datos de genes de ARN ribosómico SILVA: procesamiento de datos mejorado y herramientas basadas en la web. Ácidos Nucleicos Res. (2012) 41:D590–6. doi: 10.1093/nar/gks1219
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
21. McMurdie PJ, Holmes S. phyloseq: un paquete r para el análisis interactivo reproducible y los gráficos de los datos del censo del microbioma. PLoS ONE. (2013) 8:e61217. doi: 10.1371/journal.pone.0061217
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
22. Oksanen J, Blanchet FG, Kindt R, Legendre P, Minchin PR, O’hara RB, et al. Vegano: Paquete de ecología comunitaria. (2018). github. Métodos de ordenación, análisis de la diversidad y otras funciones para ecologistas de la comunidad y la vegetación.
23. Clarke KR. Análisis multivariados no paramétricos de los cambios en la estructura de la comunidad. Aust J Ecol. (1993) 18:117–43. doi: 10.1111/j.1442-9993.1993.tb00438.x
24. Love MI, Huber W, Anders S. Estimación moderada del cambio de pliegue y la dispersión de los datos de ARN-seq con DESeq2. Genome Biol. (2014) 15:550. doi: 10.1186/s13059-014-0550-8
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
25. Barry KA, Middelbos IS, Boler BMV, Dowd SE, Suchodolski JS, Henrissat B, et al. Efectos de la fibra dietética en el metagenoma gastrointestinal felino. J Proteome Res. (2012) 11:5924–33. doi: 10.1021/pr3006809
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
26. Ritchie LE, Steiner JM, Suchodolski JS. Evaluación de la diversidad microbiana a lo largo del tracto intestinal felino utilizando el análisis del gen rRNA 16S. FEMS Microbiol Ecol. (2009) 66:590–8. doi: 10.1111/j.1574-6941.2008.00609.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
27. Stavroulaki EM, Suchodolski JS, Pilla R, Fosgate GT, Sung C-H, Lidbury JA, et al. Efectos a corto y largo plazo de la amoxicilina/ácido clavulánico o doxiciclina en el microbioma gastrointestinal de los gatos en crecimiento. PLoS ONE. (2021) 16:e0253031. doi: 10.1371/journal.pone.0253031
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
28. Rochus K, Janssens GP, Hesta M. Fibra dietética y la importancia de la microbiota intestinal en la nutrición felina: una revisión. Nutr Res Rev. (2014) 27:295-307. doi: 10.1017/S0954422414000213
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
29. Suchodolski JS, Foster ML, Sohail MU, Leutenegger C, Queen EV, Steiner JM, et al. El microbioma fecal en gatos con diarrea. PLoS ONE. (2015) 10:e0127378. doi: 10.1371/journal.pone.0127378
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
30. Fischer MM, Kessler AM, Kieffer DA, Knotts TA, Kim K, Wei A, et al. Efectos de la obesidad, la restricción de energía y la castración en la microbiota fecal de los gatos. Br J Nutr. (2017) 118:513-24 doi: 10.1017/S0007114517002379
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
31. Laflamme DP, Xu H, Cupp CJ, Kerr WW, Ramadan Z, Long GM. Evaluación de dietas terapéuticas enlatadas para el tratamiento de gatos con diarrea crónica natural. J Feline Med Surg. (2012) 14:669-77. doi: 10.1177/1098612X12446906
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
32. Guilford WG. Manejo nutricional de las enfermedades del tracto gastrointestinal de perros y gatos. J Nutr. (1994) 124:2663s−9s. doi: 10.1093/jn/124.suppl_12.2663S
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
33. Hesta M, Janssens GP, Debraekeleer J, De Wilde R. El efecto de la oligofructosa y la inulina en las características fecales y la digestibilidad de los nutrientes en gatos sanos. J Anim Physiol Anim Nutr. (2001) 85:135–41. doi: 10.1046/j.1439-0396.2001.00308.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
34. Barry KA, Wojcicki BJ, Middelbos IS, Vester BM, Swanson KS, Jr GCF. La celulosa dietética, los fructooligosacáridos y la pectina modifican los catabolitos de proteínas fecales y las poblaciones microbianas en gatos adultos. J Anim Sci. (2010) 88:2978–87. doi: 10.2527/jas.2009-2464
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
35. Alessandri G, Argentini C, Milani C, Turroni F, Ossiprandi MC, van Sinderen D, et al. Eche un vistazo a la comunidad intestinal bacteriana de los animales de compañía: una perspectiva canina y felina. Microb Biotechnol. (2020) 13:1708–32. doi: 10.1111/1751-7915.13656
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
36. Bailey MT, Dowd SE, Galley JD, Hufnagle AR, Allen RG, Lyte M. La exposición a un factor de estrés social altera la estructura de la microbiota intestinal: implicaciones para la inmunomodulación inducida por el factor de estrés. Comportamiento cerebral inmunológico.(2011) 25:397-407. doi: 10.1016/j.bbi.2010.10.023
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
37. Galley JD, Bailey MT. Impacto de la exposición al factor de estrés en la interacción entre la microbiota comensal y la inflamación del huésped. Microbios intestinales. (2014) 5:390–6. doi: 10.4161/gmic.28683
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
38. Hantsoo L, Zemel BS. El estrés entra en el vientre: el estrés en la primera infancia y el microbioma intestinal. Comportamiento Cerebral Res. (2021) 414:113474. doi: 10.1016/j.bbr.2021.113474
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
39. Alessandri G, Milani C, Mancabelli L, Longhi G, Anzalone R, Lugli GA, et al. Descifrando las poblaciones de bifidobacteri dentro de la microbiota intestinal canina y felina. Appl Environ Microbiol. (2020) 86:e02875–19. doi: 10.1128/AEM.02875-19
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
40. Vandeputte D, De Commer L, Tito RY, Kathagen G, Sabino J, Vermeire S, et al. Variabilidad temporal en los perfiles cuantitativos del microbioma intestinal humano e implicaciones para la investigación clínica. Nat Commun. (2021) 12:6740. doi: 10.1038/s41467-021-27098-7
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
41. Rosa PSL, Brooks JP, Deych E, Boone EL, Edwards DJ, Wang Q, et al. Pruebas de hipótesis y cálculos de potencia para datos de microbioma humano basados en taxonomía. PLoS ONE. (2012) 7:e52078. doi: 10.1371/journal.pone.0052078
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
42. Kelly BJ, Gross R, Bittinger K, Sherrill-Mix S, Lewis JD, Collman RG, et al. Estimación de potencia y tamaño de muestra para estudios de microbioma utilizando distancias por pares y PERMANOVA.Bioinformática. (2015) 31:2461–8. doi: 10.1093/bioinformática/btv183
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
43. Gloor GB, Macklaim JM, Pawlowsky-Glahn V, Egozcue JJ. Los conjuntos de datos de microbioma son de composición: y esto no es opcional. Microbiol frontal. (2017) 8:2224. doi: 10.3389/fmicb.2017.02224
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
44. Sung C-H, Marsilio S, Chow B, Zornow KA, Slovak JE, Pilla R, et al. Índice de disbiosis para evaluar la microbiota fecal en gatos sanos y gatos con enteropatías crónicas. J Feline Med Surg. (2022) 24:e1–e12. doi: 10.1177/1098612X221077876
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Palabras clave: ARNr 16S, microbiota fecal, microbiota felina, muestra fecal, medicina veterinaria, marcador fecal, secuenciación de amplicones
Cita: Nealon NJ, Wood A, Rudinsky AJ, Klein H, Salerno M, Parker VJ, Quimby JM, Howard J y Winston JA (2023) Los marcadores de identificación fecal afectan a la microbiota fecal felina. Frente. Veterinario. Ciencia. 10:1039931. doi: 10.3389/fvets.2023.1039931
Recibido: 08 de septiembre de 2022; Aceptado: 02 de enero de 2023;
Publicado: 08 de febrero de 2023.
Editado por:
Khalid Mehmood, Universidad Islamia de Bahawalpur, Pakistán
Revisado por:
Dennis E. Jewell, Universidad Estatal de Kansas, Estados Unidos
Chi-Hsuan Sung, Universidad de Texas A&M, Estados Unidos
Christopher McMullen, Feedlot Health Management Services Ltd, Canadá
Copyright © 2023 Nealon, Wood, Rudinsky, Klein, Salerno, Parker, Quimby, Howard y Winston.
*Correspondencia: Jenessa A. Winston, winston.210@osu.edu
winston.210@osu.edu
Descargo de responsabilidad: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía