Mycobacterium caprae: inoculación endobronquial vs. nebulización intranasal
Comparación del resultado patológico y la progresión de la enfermedad de dos modelos experimentales de desafío de Mycobacterium caprae en cabras: inoculación endobronquial vs. nebulización intranasal
 Cristian Melgarejo1,2
Cristian Melgarejo1,2  Alex Cobos1,2,3
Alex Cobos1,2,3  Carles Planas4
Carles Planas4  Jaume Fondevila2
Jaume Fondevila2  Maite Martín2
Maite Martín2  Zoraida Cervera2
Zoraida Cervera2  Guillermo Cantero1,2
Guillermo Cantero1,2  Xavier Moll4,5
Xavier Moll4,5  Yvonne Espada4,5
Yvonne Espada4,5  Mariano Domingo1,2,3
Mariano Domingo1,2,3  Enric Vidal1,2*†
Enric Vidal1,2*†  Bernat Pérezde Val1,2*†
Bernat Pérezde Val1,2*†- 1Unitat Mixta d’Investigació IRTA-UAB en Sanitat Animal, Centre de Recerca en Sanitat Animal, Campus de la Universitat Autònoma de Barcelona, Bellaterra, España
- 2IRTA, Programa de Sanitat Animal, Centre de Recerca en Sanitat Animal, Campus de la Universitat Autònoma de Barcelona, Bellaterra, España
- 3Departament de Sanitat i Anatomia Animals, Universitat Autònoma de Barcelona, Bellaterra, España
- 4Fundació Hospital Clínic Veterinari, Universitat Autònoma de Barcelona, Bellaterra, España
- 5Departament de Medicina y Cirugía Animals, Universitat Autònoma de Barcelona, Bellaterra, España
Fondo: Las cabras son huéspedes naturales de la tuberculosis (TB) y son un modelo animal válido para probar nuevas vacunas y tratamientos para controlar esta enfermedad. En este estudio, se evaluó un nuevo modelo experimental de TB en cabras basado en la nebulización intranasal de Mycobacterium caprae en comparación con la vía endobronquial de infección.
Métodos: Catorce animales fueron divididos en dos grupos de siete y desafiados a través de las rutas endobronquial (EB) e intranasal (IN), respectivamente. Los signos clínicos, la temperatura rectal, el peso corporal y las respuestas inmunológicas de las muestras de sangre fueron seguidos durante todo el experimento. Todas las cabras fueron sacrificadas a las 9 semanas después del desafío. Se realizó el examen patológico macroscópico, el análisis de las lesiones pulmonares mediante tomografía computarizada y la cuantificación de la carga bacteriana en los ganglios linfáticos pulmonares (RN) mediante qPCR.
Resultados: El grupo desafiado por IN mostró una progresión más lenta de la infección: signos clínicos retardados (reducción del aumento de peso corporal, pico de temperatura y aparición de otros signos de TB) y respuestas inmunológicas retardadas (respuesta máxima de IFN-γ y seroconversión). Al final del experimento, el grupo IN también mostró una gravedad y diseminación significativamente menores de las lesiones pulmonares, una menor carga de ADN micobacteriano y volumen de lesiones en la LN pulmonar, y una mayor afectación de la cavidad nasofaríngea y el volumen de las lesiones en la LN retrofaríngea.
Conclusión: Los resultados indicaron que el desafío IN con M. caprae indujo características patológicas de TB natural en los pulmones, LN respiratorio y órganos extrapulmonares, pero exagerando extremadamente las características patológicas de la TB nasofaríngea. Por otro lado, la vía EB sobredimensionó y aceleró la progresión de la lesión de TB pulmonar. Nuestros resultados resaltan la necesidad de refinar las rutas de inoculación en aras de reproducir fielmente la infección natural de TB al evaluar nuevas vacunas o tratamientos contra la enfermedad.
1. Introducción
La tuberculosis (TB) es una enfermedad infecciosa causada por micobacterias pertenecientes al complejo Mycobacterium tuberculosis (MTBC) que afecta a los seres humanos y a una amplia gama de animales domésticos y fauna silvestre. La TB en cabras domésticas es causada principalmente por Mycobacterium caprae, un miembro del MTBC (Aranaz et al., 2003). La enfermedad tiene un impacto económico como resultado de las pérdidas de producción (Seva et al., 2002; Daniel et al., 2009), y las cabras infectadas representan un riesgo de infección para otras especies animales (Napp et al., 2013; Cano-Terriza et al., 2018; Vidal et al., 2018) y humanos (Rodríguez et al., 2011).
La TB en cabras generalmente se transmite por vía aerogénea, y es común encontrar lesiones principalmente en el tracto respiratorio (Domingo et al., 2014). Las cabras desarrollan lesiones cavitarias caseosas-necrotizantes similares a las observadas en la TB humana (Pérez de Val et al., 2011; Sánchez et al., 2011), mientras que estas lesiones rara vez se desarrollan en el ganado (Buddle et al., 2016). Existen diferentes enfoques para controlar la tuberculosis del ganado, y la estrategia de prueba y sacrificio es la más ampliamente implementada, particularmente en el ganado. La vacunación contra la tuberculosis podría considerarse como un enfoque alternativo. Sin embargo, la vacunación del ganado contra la tuberculosis está actualmente prohibida en la UE (Directiva 78/52/CEE del Consejo) debido a la interferencia con las herramientas de diagnóstico de la tuberculosis utilizadas actualmente. El modelo caprino de TB ha demostrado ser adecuado para estudiar nuevas vacunas contra la TB para rumiantes y humanos y para una mejor comprensión de la patogénesis de la enfermedad (Ramírez et al., 2003; Pérez de Val et al., 2011, 2013; Wedlich et al., 2022).
En los diferentes estudios de TB con el modelo caprino, la infección se ha llevado a cabo típicamente por vía endobronquial (Pérez de Val et al., 2011, 2012, 2013; Arrieta-Villegas et al., 2018, 2020; Melgarejo et al., 2022), aerosolización intratraqueal (Gonzalez-Juarrero et al., 2013) e inyección transtorácica (Bezos et al., 2010, 2015), todos ellos induciendo principalmente lesiones de TB pulmonar. En particular, el enfoque endobronquial permite una progresión acelerada de la TB pulmonar, lo que es positivo en términos de reducción de la duración de los experimentos. Sin embargo, si la dosis infecciosa no está bien ajustada, se pueden producir lesiones pulmonares exageradamente grandes. Estas lesiones grandes no solo difieren de la presentación natural común de la enfermedad, sino que también podrían impedir una evaluación adecuada del efecto de la vacuna (Arrieta-Villegas et al., 2020). Un enfoque experimental completamente diferente es la infección «natural» por exposición de contacto directo a largo plazo de cabras experimentales con animales infectados en condiciones controladas (Bezos et al., 2017; Roy et al., 2018, 2019). La ventaja de este enfoque es que induce todas las características naturales de la infección, pero otros aspectos como la dosis de infección o el punto de tiempo de la infección permanecen sin control, y aumenta dramáticamente la duración del experimento. Hoy en día, se están desarrollando modelos experimentales in vitro/ex vivo e in silico para reemplazar o reducir los modelos animales en estudios preclínicos de vacunas candidatas contra la TB (Tanner et al., 2016; Català et al., 2020). Sin embargo, la optimización de estos enfoques requiere una comparación con modelos animales bien caracterizados que pueden usarse como «estándar de oro». En conjunto, una estandarización precisa de un modelo caprino de TB es fundamental para predecir la eficacia de las nuevas vacunas candidatas. Este estudio tuvo como objetivo evaluar y caracterizar la infección experimental de cabras con M. caprae por nebulización intranasal en comparación con la vía endobronquial. El razonamiento fue utilizar una vía de acceso más natural de micobacterias al tracto respiratorio que la ruta endobronquial para reproducir con mayor precisión el espectro de lesiones de TB caprina encontradas en casos de campo.
2. Materiales y métodos
2.1. Animales e infecciones experimentales
Para este estudio se eligieron catorce cabras pirenaicas hembras de 3 a 4 meses de edad, procedentes de un rebaño oficialmente indemne de tuberculosis, situado en el Pirineo catalán (España). Los animales de experimentación fueron trasladados a la instalación del IRTA-CReSA Bioseguridad Nivel 3 (BSL-3) (Cataluña, España), donde fueron ponderados y divididos aleatoriamente en dos grupos experimentales de siete animales cada uno, desafiados por las vías endobronquial (EB) e intranasal (IN), respectivamente. De acuerdo con el peso corporal, se aplicaron correcciones para asegurar una distribución homogénea entre los grupos, y luego, los animales fueron alojados en dos cajas experimentales con animales 4-3 y 3-4 de los grupos EB e IN en cada caja, respectivamente. Los animales fueron alimentados con heno, alfalfa, alimento y sal mineral y tuvieron acceso al agua ad libitum durante todo el experimento.
Después de 1 semana de aclimatación, los animales fueron sedados por vía intramuscular con maleato de acepromazina (0,05 mg/kg) y butorfanol (0,2 mg/kg) y posteriormente anestesiados con administración intravenosa de propofol (5 mg/kg) y midazolam (0,2 mg/kg). Posteriormente, los animales fueron desafiados con 0,5 ml de una cepa de campo de M. caprae (Balseiro et al., 2017) con una suspensión de 2 × 103 UFC/ml. Los animales del grupo EB fueron desafiados a través de la ruta endobronquial como se describió anteriormente (Pérez de Val et al., 2011).
Los animales del grupo IN fueron desafiados mediante el uso de un dispositivo adaptado a la jeringa para la pulverización atomizada (MADgic, Wolfe Tory Medical, Inc., Salt Lake City, EE. Este dispositivo consiste en una cánula flexible de 21,6 cm de largo y 4,82 mm de ancho con un nebulizador situado en su extremo que genera gotas de 30-100 μm de diámetro, según las instrucciones del fabricante. La cánula se insertó en la cavidad nasal ~ 10-15 cm dependiendo del tamaño del animal. Cada lado de la cavidad nasal recibió 0,5 ml de la misma cepa de M. caprae en una suspensión de 10®3 UFC/ml sin anestesia.
Después del desafío, todos los animales fueron monitoreados diariamente para detectar signos clínicos por un veterinario para evaluar si alguno de los animales alcanzó los criterios de punto final. La evaluación clínica incluyó una puntuación de 0 a 3 de cada uno de los siguientes cinco parámetros: condición corporal, estado / comportamiento mental, pérdida de peso, fiebre y presencia de signos respiratorios (0: ausencia de signos respiratorios; 1: disnea leve y / o tos ocasional; 2: disnea moderada y tos continua; y 3: disnea marcada, tos continua y / o secreción nasal grave). Cualquier puntuación global superior a 11 y/o la presencia de criterios cualitativos como postración, falta de movimiento o dificultad respiratoria grave dio lugar a la eutanasia. La temperatura rectal y el peso corporal se midieron cada semana. Se recogieron muestras de sangre heparinizadas en las semanas 0 (antes de la provocación), 3, 5, 7 y 9 (criterio de valoración) para ensayos inmunológicos.
2.2. Declaración ética
Todos los procedimientos con animales de experimentación realizados durante el estudio fueron aprobados por el Comité de Bienestar Animal de la Generalitat de Catalunya (Proyecto Ref. #10794), de acuerdo con la legislación de la Unión Europea para la protección de animales de experimentación (86/609/CEE, 91/628/CEE, 92/65/CEE y 90/425/CEE).
2.3. Antígenos y reactivos
M. bovis tuberculina (PPD-B, 2.500 UI/ml) se obtuvo de vacunas CZ (Porriño, España). Los antígenos recombinantes específicos de MTBC ESAT-6, CFP-10 y MPB83 se obtuvieron de Lionex (Braunschweig, Alemania) a una concentración de 500 μg/ml cada uno. ESAT-6 y CFP-10 se mezclaron 1: 1 en un cóctel antigénico (E / C). El complejo antigénico P22 se produjo por inmunopurificación de PPD-B (vacunas CZ) como se describió anteriormente (Infantes-Lorenzo et al., 2017) y fue suministrado por el Instituto de Investigación Carlos III (Madrid, España) a una concentración de 500 μg / ml.
2.4. Ensayo de liberación de IFN-γ en sangre total
Se recogieron aproximadamente 10 ml de sangre total en los puntos de tiempo antes mencionados de la vena yugular utilizando tubos heparinizados. Las muestras de sangre se mantuvieron a temperatura ambiente durante <1 h cuando se estimularon en placas de cultivo celular de 96 pocillos (Eppendorf, Hamburgo, Alemania) con PPD-B, P22 (excepto en la semana 7) y E/C a una concentración final de 20 μg/ml cada una. Se utilizó solución salina tamponada con fosfato como control no estimulado. Las muestras se incubaron a 37°C y 5% de CO2 durante 18 ± 2 h. Los sobrenadantes plasmáticos se recolectaron después de la centrifugación a 18 g durante 10 min, y el IFN-γ liberado se midió mediante ELISA (kit de IFN-g de ID Screen Rumiant, ID.vet, Grabels, Francia). Las densidades ópticas de las placas ELISA se leyeron a 450 nm (OD®450nm) utilizando un espectrofotómetro (Biotek Power Wave XS, Agilent, Santa Clara, USA). Las respuestas de IFN-γ específicas de antígeno se calcularon como OD®450nm del pozo estimulado por antígeno menos OD450nm del pozo no estimulado (ΔOD450nm).
2.5. Ensayos de detección de anticuerpos
Las muestras de plasma de todos los animales de experimentación se analizaron por duplicado para seguir las respuestas de anticuerpos contra MTBC después del desafío. Se utilizaron ELISA indirectos para detectar IgG total contra el antígeno MPB83 y el complejo antigénico P22, respectivamente. Los dos ELISA se realizaron como se describió anteriormente (Pérez de Val et al., 2017; Infantes-Lorenzo et al., 2019). Los niveles de MPB83-IgG se calcularon como OD450nm del pozo recubierto de antígeno menos OD450nm del pozo no recubierto (ΔOD450nm). Una muestra se consideró positiva cuando ΔOD450nm ≥ 0,05. Los niveles de P22-IgG se calcularon como porcentaje de ELISA (E%) = [OD media450nm del pocillo recubierto de antígeno/(2 × media de control negativo OD450nm)] × 100. Una muestra se consideró negativa cuando E% ≤ 100%, no concluyente cuando E% estaba entre 110 y 150%, y positiva (seroconversión) cuando E% ≥ 150%.
2.6. Necropsia, examen patológico y tomografía computarizada
En la semana 9 después de la provocación, todas las cabras fueron sedadas por vía intramuscular mediante una inyección de maleato de acepromazina (0,1 mg / kg) y butorfanol (0,2 mg / kg) y posteriormente sacrificadas con una sobredosis intravenosa de pentobarbital de sodio. En la necropsia, se midió el tamaño de las lesiones compatibles con TB en los ganglios linfáticos retrofaríngeos (derecho e izquierdo), mediastínicos (craneales y caudales) y traqueobronquiales (LN), y el volumen de las lesiones se dedujo utilizando la fórmula de volumen de la morfología geométrica 3D más similar (incluida esfera, cilindro o prisma), como se describió anteriormente (Balseiro et al., 2017). También se registraron otras lesiones visibles en tejidos extrapulmonares y se fijaron en formalina tamponada al 10% para ser confirmadas por histopatología y tinción de Ziehl-Neelsen para detectar bacilos resistentes a los ácidos. Los pulmones se fijaron mediante instilación de la vía aérea seguida de inmersión en formalina, como se describió anteriormente (Pérez de Val et al., 2011), y luego se escanearon mediante tomografía computarizada (TC) utilizando un escáner multidetector de 16 cortes (Brivo CT-385, General Electric Healthcare, Madrid, España). El análisis de TC se realizó como se describió anteriormente (Balseiro et al., 2017). En resumen, los volúmenes totales de los pulmones y las lesiones de TB se midieron utilizando imágenes de representación de volumen con diferentes patrones de densidad (es decir, lesiones sólidas, mineralizadas y cavitarias), y el volumen total de mineralización se calculó utilizando 100-300 unidades de Hounsfield.
2.7. Cuantificación del ADN bacteriano
Después de la evaluación patológica macroscópica, se recolectaron LN mediastínicos y traqueobronquiales y se almacenaron a -20 ° C hasta que se procesaron para bacteriología. Los LN enteros se descongelaron y homogeneizaron en 10 ml de agua destilada estéril utilizando un homogeneizador (Masticator, IUL Instruments, Barcelona, España). Se inactivó una alícuota de 1 ml de cada homogeneizado a 75°C durante 1 h para la cuantificación del ADN bacteriano. Paralelamente, una alícuota de 100 ml de la semilla maestra de M. caprae (~108 UFC/ml), utilizado para el inóculo impugnado, se inactivó y luego se diluyó en ocho diluciones de 10 veces para establecer la curva estándar. Las muestras de ADN se extrajeron utilizando un kit de extracción universal de espín del gen™ ID (ID.vet) y se amplificaron con el kit dúplex del complejo Mycobacterium tuberculosis (ID.vet), siguiendo las instrucciones del fabricante. La amplificación se realizó en un sistema de PCR rápida en tiempo real 7500 (Applied Biosystems, Waltham, MA, USA). Los equivalentes genómicos de UFC se calcularon como se describió anteriormente (Vidal et al., 2022).
2.8. Análisis de datos
Se realizó un diseño completamente aleatorizado para comparar los efectos de la infección por M. caprae (factor primario) por las vías EB e IN. En primer lugar, todas las distribuciones de datos se analizaron mediante la prueba de normalidad de Shapiro-Wilk. La temperatura y el peso corporal se compararon mediante una prueba t unidireccional no pareada. Las respuestas inmunes específicas de antígeno (medidas por IGRA, IgG-ELISA), los volúmenes de lesión y la carga de ADN micobacteriano se compararon mediante la prueba no paramétrica de Mann-Whitney. Para los análisis estadísticos se utilizó GraphPad Prism versión 8.0.0 (San Diego, CA, EUA).
3. Resultados
3.1. Provocación endobronquial inducida por respuestas inmunitarias más tempranas y más fuertes
En la Figura 1 se presentan las respuestas medias de IFN-γ antígeno específico en sangre total antes y después del desafío para cada grupo de tratamiento. Se detectó un aumento en las respuestas específicas de IFN-γ a los antígenos PPD-B, P22 y E/C en ambos grupos después del desafío (semana 0, Figuras 1A-C). Los animales del grupo EB mostraron una respuesta máxima de IFN-γ a los tres antígenos en las semanas 3 y 5, que fue significativamente mayor que en los animales del grupo IN (P < 0,01; excepto P < 0,05 para PPD-B en la semana 5). Las respuestas específicas de IFN-γ en animales con desafíos intranasales aumentaron progresivamente durante semanas, mientras que los niveles de IFN-γ provocados después del desafío endobronquial disminuyeron al final del experimento cuando las respuestas en ambos grupos tendían a converger (sin diferencias significativas en las semanas 7 y 9).
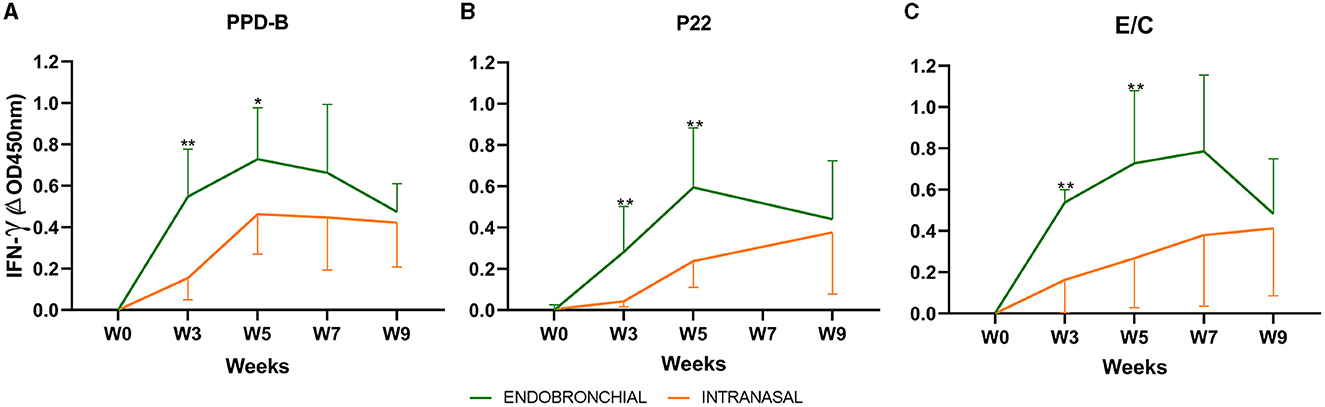 Figura 1. Respuestas de IFN-γ en sangre total antes y después del desafío: el gráfico muestra los niveles de IFN-γ medidos por ELISA. Los resultados se expresan como ΔOD450mn ± IC del 95%. (A) Respuesta contra la tuberculina bovina (PPD-B). B) Respuesta al complejo P22. (C) Respuesta contra el cóctel de antígeno E/C. *P < 0,05, **P < 0,01, prueba de Mann-Whitney. Grupos: Endobronquial (n = 7, verde) e Intranasal (n = 7, naranja). Dos animales del grupo endobronquial fueron sacrificados humanamente en la semana 7 y un animal del grupo intranasal.
Figura 1. Respuestas de IFN-γ en sangre total antes y después del desafío: el gráfico muestra los niveles de IFN-γ medidos por ELISA. Los resultados se expresan como ΔOD450mn ± IC del 95%. (A) Respuesta contra la tuberculina bovina (PPD-B). B) Respuesta al complejo P22. (C) Respuesta contra el cóctel de antígeno E/C. *P < 0,05, **P < 0,01, prueba de Mann-Whitney. Grupos: Endobronquial (n = 7, verde) e Intranasal (n = 7, naranja). Dos animales del grupo endobronquial fueron sacrificados humanamente en la semana 7 y un animal del grupo intranasal.
Los niveles de IgG para el antígeno MPB83 y el complejo antigénico P22, así como la seroconversión individual, se estudiaron utilizando dos ELISA a lo largo del estudio (Figura 2). La provocación endobronquial indujo un aumento temprano de las respuestas específicas de IgG MPB83 (una respuesta máxima en las semanas 5 y 7), y todos los animales con EB se seroconvirtieron en la semana 5 p.c. Por el contrario, solo se detectó una respuesta leve en animales IN, no se detectó seroconversión en 2 de ellos a lo largo del experimento, y los otros cinco animales se seroconvirtieron entre las semanas 5 y 9 (Figura 2A). En comparación con MPB83, las respuestas de IgG a P22 fueron más progresivas en el grupo EB, alcanzando un pico al final del experimento (semana 9), pero se detectó seroconversión en seis de siete animales. Las respuestas de IgG a P22 fueron prácticamente indetectables en el grupo IN durante todo el experimento, y solo un animal mostró una clara seroconversión (Figura 2B).
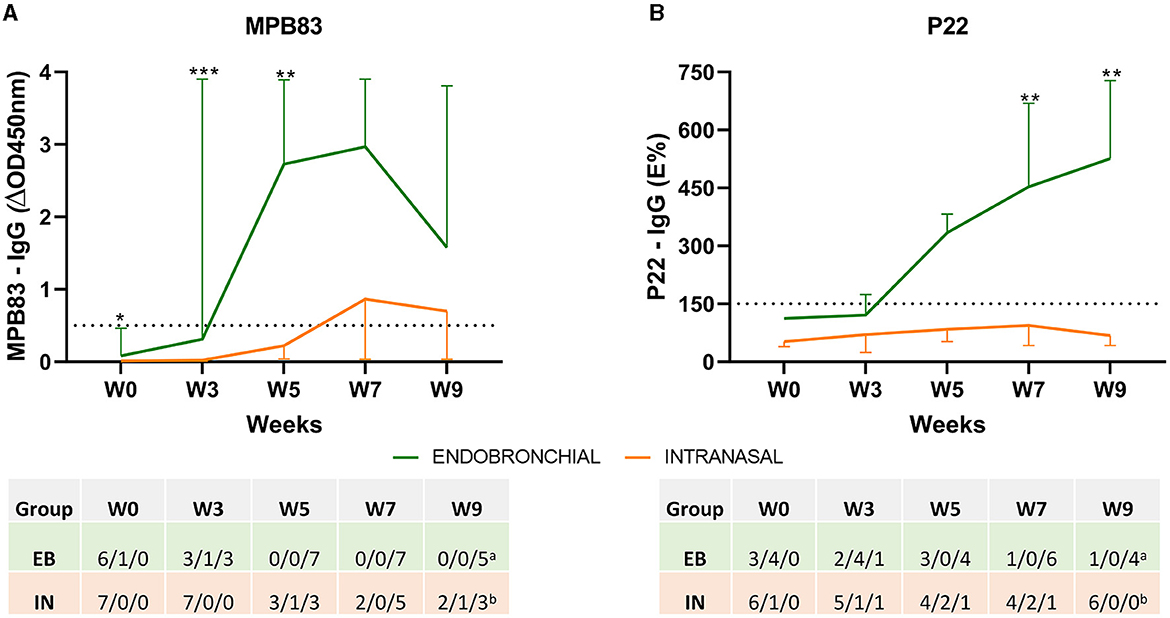 Figura 2. Respuestas de anticuerpos antes y después del desafío. La figura muestra los niveles medios de IgG frente a los antígenos MPB83 y P22 medidos por ELISA a lo largo del estudio. (A) Los resultados de MPB83-ELISA se expresan como ΔOD450mn ± IC del 95%. Una muestra se consideró positiva cuando ΔOD450nm ≥ 0,05. (B) Los resultados de P22-ELISA se expresan como E%. E% = [OD450nm media del pocillo recubierto de antígeno/(2 × media de control negativo OD450nm)] × 100. Una muestra se considera negativa cuando está ≤ 100%, no concluyente entre 110 y 150% y seroconvertida cuando el porcentaje es ≥150%. La línea horizontal discontinua muestra el punto de corte para la positividad. *P < 0.05, **P < 0.01, ***P < 0.001. Prueba de Mann-Whitney. La tabla indica el número de animales y su estado de seroconversión: negativo/no concluyente/positivo. Grupos: endobronquiales (EB, N = 7, un N = 5 en W9) e intranasal (IN, N = 7, bN = 6 en W9).
Figura 2. Respuestas de anticuerpos antes y después del desafío. La figura muestra los niveles medios de IgG frente a los antígenos MPB83 y P22 medidos por ELISA a lo largo del estudio. (A) Los resultados de MPB83-ELISA se expresan como ΔOD450mn ± IC del 95%. Una muestra se consideró positiva cuando ΔOD450nm ≥ 0,05. (B) Los resultados de P22-ELISA se expresan como E%. E% = [OD450nm media del pocillo recubierto de antígeno/(2 × media de control negativo OD450nm)] × 100. Una muestra se considera negativa cuando está ≤ 100%, no concluyente entre 110 y 150% y seroconvertida cuando el porcentaje es ≥150%. La línea horizontal discontinua muestra el punto de corte para la positividad. *P < 0.05, **P < 0.01, ***P < 0.001. Prueba de Mann-Whitney. La tabla indica el número de animales y su estado de seroconversión: negativo/no concluyente/positivo. Grupos: endobronquiales (EB, N = 7, un N = 5 en W9) e intranasal (IN, N = 7, bN = 6 en W9).
3.2. Los signos clínicos relacionados con la enfermedad aparecieron más tarde en cabras con desafiamiento intranasal
La temperatura rectal, el peso corporal y los signos clínicos de TB se registraron semanalmente durante todo el experimento (Figura 3).
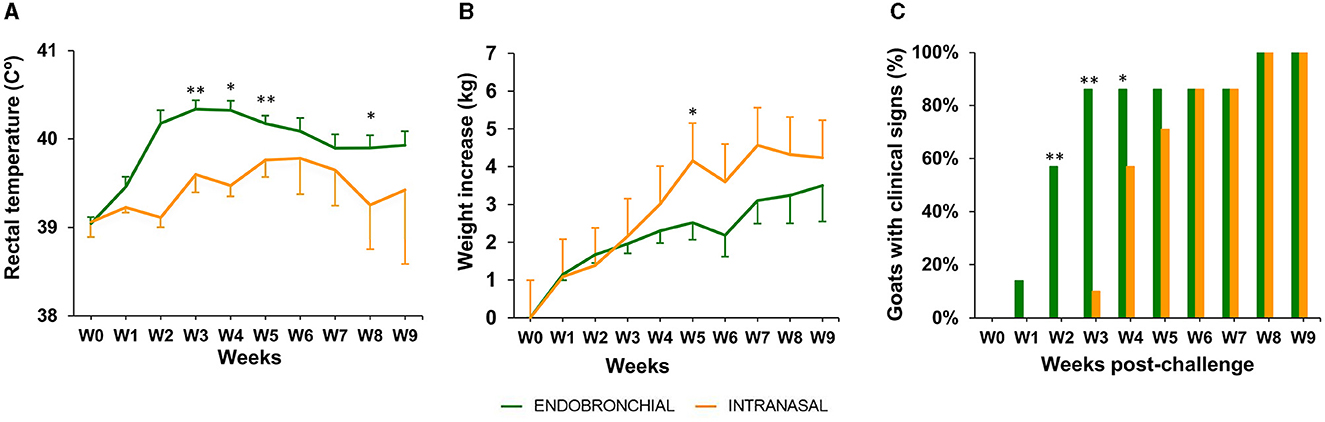 Figura 3. Temperatura rectal, peso corporal y signos clínicos después de la provocación. (A) La temperatura rectal media semanal de cada grupo expresada en °C ± IC 95%. (B) Los aumentos medios semanales acumulados del peso corporal de cada grupo expresados en ΔKg (Kg en cada semana después del desafío menos Kg en la semana 0) ± IC del 95%. (C) El porcentaje de animales con presencia de signos clínicos relacionados con la TB en cada grupo. Los signos clínicos observados fueron tos, disnea, secreción ocular, ganglios linfáticos agrandados, secreción nasal y anorexia (los grupos se compararon mediante la prueba de chi-cuadrado). Grupos: endobronquiales (verde, N = 7; N = 5 en las semanas 8 y 9) intranasal (naranja, N = 7; N = 6 en las semanas 8 y 9). La temperatura corporal y el peso se compararon mediante la prueba t unidireccional no pareada. *P < 0,05, **P < 0,01.
Figura 3. Temperatura rectal, peso corporal y signos clínicos después de la provocación. (A) La temperatura rectal media semanal de cada grupo expresada en °C ± IC 95%. (B) Los aumentos medios semanales acumulados del peso corporal de cada grupo expresados en ΔKg (Kg en cada semana después del desafío menos Kg en la semana 0) ± IC del 95%. (C) El porcentaje de animales con presencia de signos clínicos relacionados con la TB en cada grupo. Los signos clínicos observados fueron tos, disnea, secreción ocular, ganglios linfáticos agrandados, secreción nasal y anorexia (los grupos se compararon mediante la prueba de chi-cuadrado). Grupos: endobronquiales (verde, N = 7; N = 5 en las semanas 8 y 9) intranasal (naranja, N = 7; N = 6 en las semanas 8 y 9). La temperatura corporal y el peso se compararon mediante la prueba t unidireccional no pareada. *P < 0,05, **P < 0,01.
En el grupo EB, se observó un pico de temperatura rectal media entre las semanas 2 y 4 p.c., siendo estadísticamente significativamente mayor en comparación con el grupo IN (P < 0,01, semanas 2 y 4; P < 0,05, semana 3; Figura 3A). También se observó un pico leve en el grupo IN entre las semanas 5 y 7, aunque aún se mantuvo ligeramente más bajo que el grupo EB, y disminuyó en la semana 8 para ser significativamente menor que el grupo EB nuevamente (P < 0.05).
El aumento de peso corporal medio fue mayor en el grupo IN en comparación con el grupo EB desde la semana 4, siendo estadísticamente significativo en la semana 5 (P <0,05, Figura 3B), aunque se observó un estancamiento en el aumento del peso corporal a partir de la semana 5 en adelante. En contraste, los animales pertenecientes al grupo EB mostraron un leve aumento en el peso corporal medio desde la semana 6 hasta el final del experimento, donde la diferencia en el aumento de peso acumulado medio (ΔKg, Kg en las semanas 9-0) entre los grupos IN y EB fue mínima (4.2 ± 3.3 IC 95% y 3.5 ± 2.9 IC 95%, respectivamente).
La presencia o ausencia de signos clínicos, distintos de la pérdida de peso o la fiebre, compatibles con TB se registró en todos los animales desafiados hasta el punto final del experimento (Figura 3C). Los signos observados incluyeron tos, disnea, secreción ocular, ganglios linfáticos agrandados, secreción nasal y anorexia. Un animal del grupo EB mostró signos clínicos en la semana 1, 4 en la semana 2 y 6 desde la semana 3 hasta el punto final, mientras que se observó un retraso de 2 semanas en la aparición de los signos clínicos en el grupo IN: 1, 4 y 6 animales en las semanas 3, 4 y desde 5 hasta el punto final, respectivamente (Figura 3C). La proporción de animales con signos clínicos fue significativamente mayor en el grupo de EB en las semanas 2 (P < 0,01), 3 (P < 0,01) y 4 (P < 0,05) en comparación con el grupo IN. Todos los animales de experimentación mostraron signos clínicos en las semanas 8 y 9.
3.3. Los animales con dificultades endobronquiales presentaron lesiones pulmonares más graves
Todas las cabras mostraron lesiones de TB en la necropsia. Las lesiones pulmonares se evaluaron cuantitativamente mediante TC. Todos los animales desafiados por la vía EB (7/7) tenían lesiones pulmonares, mientras que solo 4/7 animales del grupo IN presentaron lesiones pulmonares, y la gravedad y diseminación de estas lesiones fueron mucho menores en comparación con las encontradas en el grupo EB. La Figura 4 muestra la extensión de los granulomas de TB pulmonar expresados como el volumen de lesiones pulmonares, la diseminación intrapulmonar de las lesiones TB expresada como el número de lóbulos pulmonares afectados y el grado de desarrollo de las lesiones de TB pulmonar expresado como la relación de volumen entre mineralización y lesión de cada grupo. El grupo EB mostró un volumen medio significativamente mayor de lesiones pulmonares en comparación con el grupo IN (P < 0,001, Figura 4A). Además, el grupo EB mostró un mayor número de lóbulos afectados en comparación con el grupo IN (P < 0,01, Figura 4B). Cinco de cada siete animales con EB mostraron lesiones de TB en los siete lóbulos pulmonares, mientras que solo un animal IN mostró lesiones en seis lóbulos pulmonares. El grupo de EB también mostró un volumen mediano significativamente mayor de mineralización pulmonar (18,36 cm3, IC 95%: 2. 634–84,53, P < 0,001) en comparación con el grupo IN (0 cm3, IC 95%: 0–0,72), así como una mayor proporción mediana de mineralización de lesiones pulmonares (P < 0,01; Figura 4C) indicativo de una progresión más rápida de la infección de TB pulmonar.
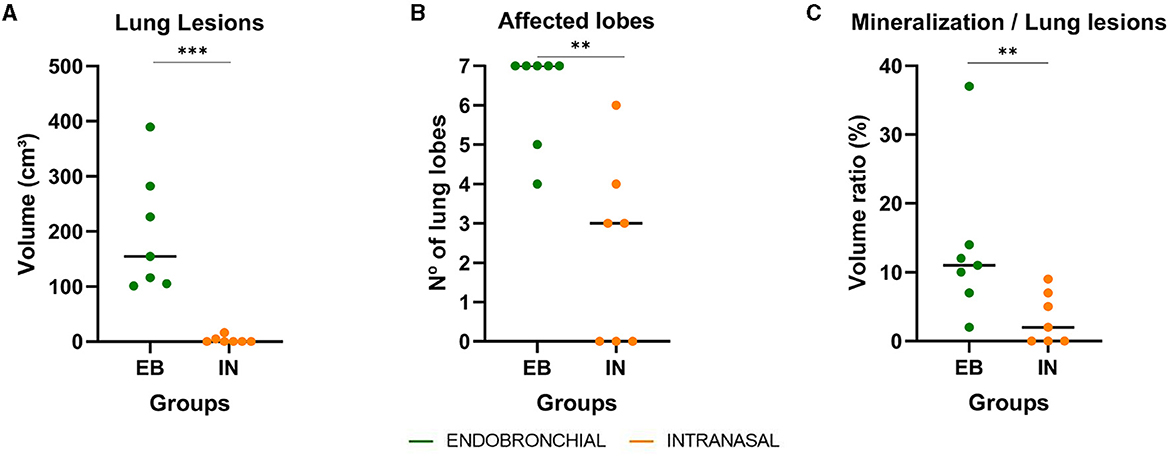 Figura 4. Hallazgos patológicos pulmonares en cabras desafiadas por M. caprae endobronquialmente (EB) e intranasal (IN). (A) Volúmenes de lesiones de TB pulmonar expresados en cm3 medidos por tomografía computarizada (TC). (B) Número de lóbulos pulmonares con lesiones de TB. (C) La relación entre el volumen de mineralización y el volumen de lesiones pulmonares expresado en %. Grupos: endobronquial (n = 7, verde) e intranasal (n = 7, naranja). **P <0.01, ***P <0.001, prueba de Mann-Whitney.
Figura 4. Hallazgos patológicos pulmonares en cabras desafiadas por M. caprae endobronquialmente (EB) e intranasal (IN). (A) Volúmenes de lesiones de TB pulmonar expresados en cm3 medidos por tomografía computarizada (TC). (B) Número de lóbulos pulmonares con lesiones de TB. (C) La relación entre el volumen de mineralización y el volumen de lesiones pulmonares expresado en %. Grupos: endobronquial (n = 7, verde) e intranasal (n = 7, naranja). **P <0.01, ***P <0.001, prueba de Mann-Whitney.
3.4. La provocación intranasal causó lesiones más graves en la cabeza, pero formas de TB menos generalizadas
Todos los animales con desafiamiento intranasal mostraron lesiones en LN retrofaríngeas (FR), mientras que estas lesiones solo se detectaron en 2/7 animales del grupo EB, y el volumen medio de lesiones en los LN de RF fue significativamente mayor en el grupo IN en comparación con el grupo EB (P < 0.01, Figura 5C). En contraste, solo 3/7 animales que recibieron el desafío IN desarrollaron lesiones de TB en LN pulmonares, mientras que estas lesiones se encontraron macroscópicamente en todos los BRE desafiados. La mediana del volumen de lesiones de TB en la LN pulmonar fue significativamente mayor en el grupo de EB en comparación con el grupo de IN (P < 0,001, Figura 5A), y la carga de ADN bacteriano en LN pulmonares, estimada como equivalentes de UFC por qPCR, también fue significativamente mayor en el grupo de EB (P < 0,05, Figura 5B).
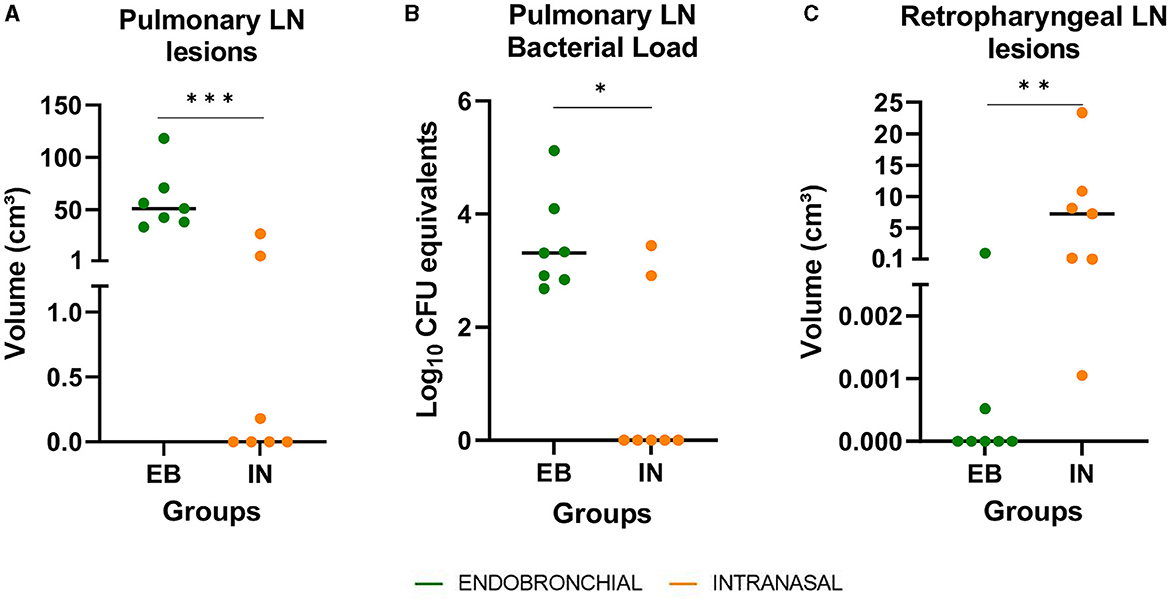 Figura 5. Los resultados post-mortem en los ganglios linfáticos respiratorios (LN). (A) El volumen de lesiones en LN pulmonar (traqueobronquial y mediastínico) expresado en cm3. (B) Carga de ADN de M. caprae en LN pulmonar, medida por PCR cuantitativa y expresada como Log10 Equivalentes de UFC. (C) El volumen de lesiones en LN retrofaríngeo expresado en cm3. Grupos: endobronquial (EB, verde) desafiado e intranasal (IN, naranja). *P < 0.05, **P < 0.01, ***P < 0.001, prueba de Mann-Whitney.
Figura 5. Los resultados post-mortem en los ganglios linfáticos respiratorios (LN). (A) El volumen de lesiones en LN pulmonar (traqueobronquial y mediastínico) expresado en cm3. (B) Carga de ADN de M. caprae en LN pulmonar, medida por PCR cuantitativa y expresada como Log10 Equivalentes de UFC. (C) El volumen de lesiones en LN retrofaríngeo expresado en cm3. Grupos: endobronquial (EB, verde) desafiado e intranasal (IN, naranja). *P < 0.05, **P < 0.01, ***P < 0.001, prueba de Mann-Whitney.
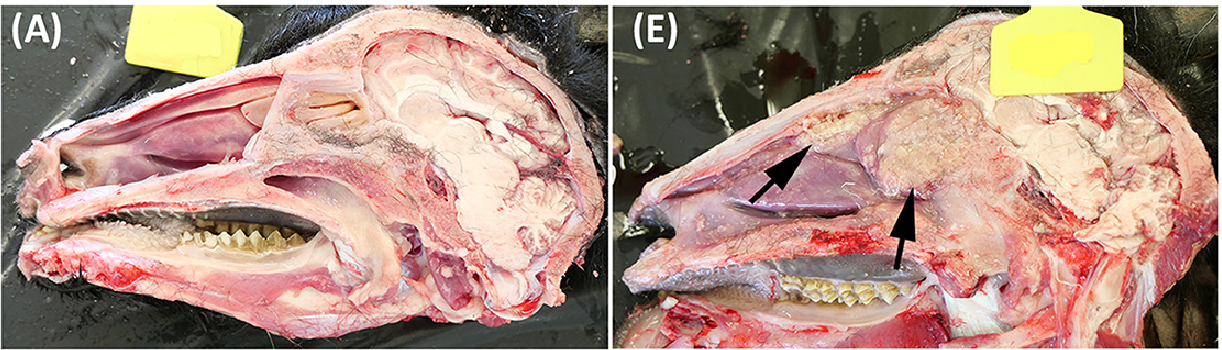
Todas las lesiones extrapulmonares macroscópicamente compatibles con TB fueron confirmadas como tales mediante examen histopatológico. En general, el grupo IN presentó afectación mayor de la cabeza, mientras que en el grupo EB se encontraron lesiones compatibles con TB más graves en las cavidades torácica y abdominal. Cuatro de los siete animales del grupo IN presentaban un infiltrado inflamatorio granulomatoso intenso en la cavidad nasal (ver Figuras 6E, F), y los tres animales presentaban lesiones en los ganglios linfáticos retrofaríngeos y/o submandibulares.
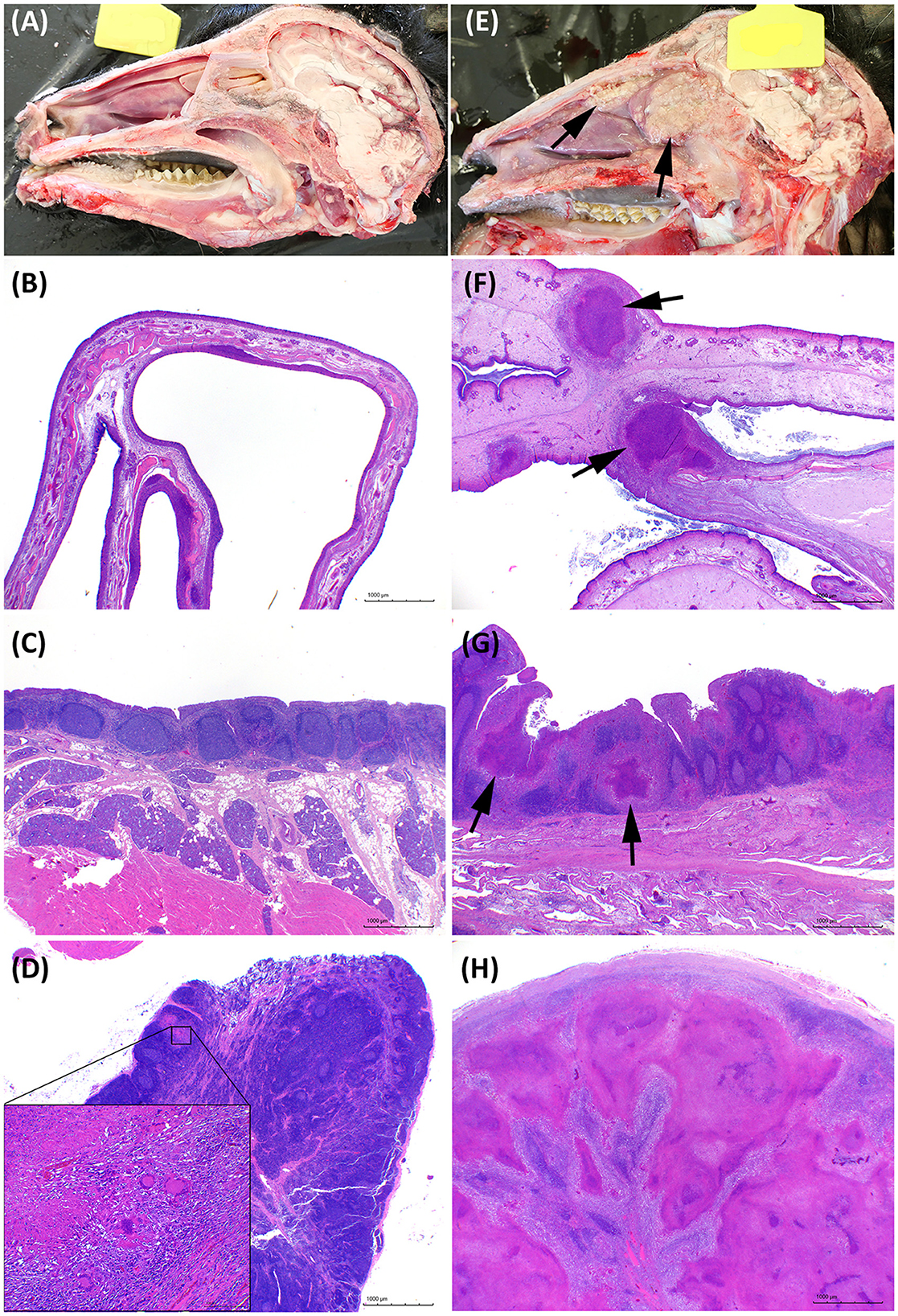 Figura 6. Características patológicas en la cabeza. (A-D) Imágenes representativas de cabras desafiadas por la vía endobronquial (EB). (E-H) Imágenes representativas de cabras desafiadas por vía intranasal (IN). (A, E) Sección longitudinal de la cabeza. Las lesiones granulomatosas se marcan con flechas en la cabra IN-desafiada. (B, F) Sección histológica transversal de un cornete nasal normal comparado con un cornete nasal edematoso agrandado con lesiones granulomatosas multifocales (flechas). Tinción de hematoxilina y eosina (H&E), barras de 1.000 μm. (C, G) Mucosa nasofaríngea con tejido linfoide asociado a la mucosa. Granulomas múltiples notables (flechas) en el animal IN en G. H&E, barras de 1.000 μm. (D, H) Las lesiones tuberculosas en los ganglios linfáticos retrofaríngeos del grupo con EB desafiado estaban ausentes o eran mínimas como la que se muestra en el inserto en (B), o extensas y obliterantes de todo el ganglio linfático en el grupo IN como se muestra en H. H&E, barras de 1.000 μm.
Figura 6. Características patológicas en la cabeza. (A-D) Imágenes representativas de cabras desafiadas por la vía endobronquial (EB). (E-H) Imágenes representativas de cabras desafiadas por vía intranasal (IN). (A, E) Sección longitudinal de la cabeza. Las lesiones granulomatosas se marcan con flechas en la cabra IN-desafiada. (B, F) Sección histológica transversal de un cornete nasal normal comparado con un cornete nasal edematoso agrandado con lesiones granulomatosas multifocales (flechas). Tinción de hematoxilina y eosina (H&E), barras de 1.000 μm. (C, G) Mucosa nasofaríngea con tejido linfoide asociado a la mucosa. Granulomas múltiples notables (flechas) en el animal IN en G. H&E, barras de 1.000 μm. (D, H) Las lesiones tuberculosas en los ganglios linfáticos retrofaríngeos del grupo con EB desafiado estaban ausentes o eran mínimas como la que se muestra en el inserto en (B), o extensas y obliterantes de todo el ganglio linfático en el grupo IN como se muestra en H. H&E, barras de 1.000 μm.
Las figuras 6 y 7 muestran ejemplos de lesiones de TB desarrolladas en animales representativos desafiados por IN y EB en la cabeza y los pulmones, respectivamente. La sección longitudinal de la cabeza de cabras con desafiación intranasal evidenció lesiones granulomatosas extensas multifocales a coalescentes bilaterales en la cavidad nasal de 4/7 cabras; los endocornetes y la concha nasal media (en la cara caudal de la cavidad nasal) fueron siempre los más afectados, mientras que la concha nasal dorsal y ventral y el tabique nasal estuvieron más involucrados (Figura 6E). Microscópicamente, se observaron granulomas de extensión variable en los cornetes nasales (Figura 6F) y la mucosa nasofaríngea (Figura 6G), mientras que los animales desafiados a EB no presentaron lesiones visibles en esta localización (Figuras 6A, B). Las lesiones en los ganglios linfáticos de la cabeza fueron más graves en el grupo IN (Figura 6H) mientras que mínimas o ausentes en el grupo EB (Figura 6D). Microscópicamente, los patrones lesionales observados fueron equivalentes en ambos grupos, difiriendo solo en su extensión y ubicación. Por otro lado, las imágenes renderizadas de los pulmones obtenidas por TC revelaron lesiones pulmonares más extensas y un mayor volumen total de mineralización pulmonar en los animales desafiados a EB (Figura 7).
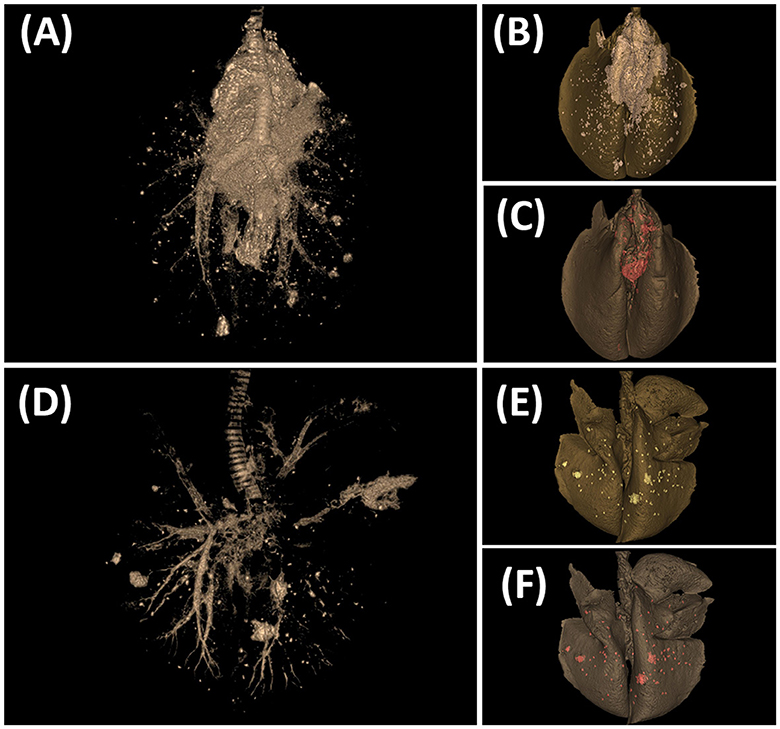 Figura 7. Lesiones tuberculosas evidenciadas por tomografía computarizada (TC) en los pulmones. (A-C) Cabra desafiada por la vía endobronquial. (D-F) Cabra desafiada por vía intranasal. (A, D) Imagen de tomografía computarizada que muestra el árbol traqueobronquial y las lesiones de TB. (B, E) Imagen representada por TC de lesiones de TB (blanquecinas) en el volumen total del pulmón (gris oscuro). (C, F) Imagen renderizada por TC de mineralización (rojo) en el volumen total del pulmón (gris oscuro).
Figura 7. Lesiones tuberculosas evidenciadas por tomografía computarizada (TC) en los pulmones. (A-C) Cabra desafiada por la vía endobronquial. (D-F) Cabra desafiada por vía intranasal. (A, D) Imagen de tomografía computarizada que muestra el árbol traqueobronquial y las lesiones de TB. (B, E) Imagen representada por TC de lesiones de TB (blanquecinas) en el volumen total del pulmón (gris oscuro). (C, F) Imagen renderizada por TC de mineralización (rojo) en el volumen total del pulmón (gris oscuro).
La figura 8 presenta la distribución de las lesiones tuberculosas en todos los animales de cada grupo. Los animales del grupo EB tienen una afectación mínima en la estructura de la cabeza, mientras que todos los animales del grupo IN tenían lesiones en la cabeza (todos ellos en los LN retrofaríngeos). Por otro lado, todos los animales del grupo EB presentaban lesiones en el tórax pero también en la cavidad abdominal (especialmente en el bazo), indicativas de generalización hematógena temprana.
 Figura 8. Distribución de las lesiones tuberculosas. Los glóbulos azules y rojos indican la ausencia y presencia de lesiones, respectivamente. (*) En el caso de la RN de RF, la LN pulmonar y los pulmones, una gradación de los niveles rojos representa la distribución por quintiles de los volúmenes de las lesiones o el número de lóbulos afectados (escala: L -Bajo: 1- a H -Alto: 5-). Grupos: desafiados endobronquiales (EB) (N = 7) e intranasales (IN) desafiados (N = 7). LN: ganglio linfático; SM: submandibular; FR: retrofaríngea; PL: pulmonar; HP: hepática; EM: mesentérica.
Figura 8. Distribución de las lesiones tuberculosas. Los glóbulos azules y rojos indican la ausencia y presencia de lesiones, respectivamente. (*) En el caso de la RN de RF, la LN pulmonar y los pulmones, una gradación de los niveles rojos representa la distribución por quintiles de los volúmenes de las lesiones o el número de lóbulos afectados (escala: L -Bajo: 1- a H -Alto: 5-). Grupos: desafiados endobronquiales (EB) (N = 7) e intranasales (IN) desafiados (N = 7). LN: ganglio linfático; SM: submandibular; FR: retrofaríngea; PL: pulmonar; HP: hepática; EM: mesentérica.
4. Discusión
Dado que la vacunación del ganado contra la TB está actualmente prohibida en la UE debido a su interferencia con las herramientas de diagnóstico actuales utilizadas en los programas de erradicación, la cabra representa un excelente modelo traslacional para investigar el efecto de las vacunas contra la TB, que pueden probarse en condiciones de campo (Pérez de Val et al., 2012, 2013; Bezos et al., 2017; Arrieta-Villegas et al., 2018; Roy et al., 2018; Melgarejo et al., 2022). Además, las cabras también son un modelo animal adecuado para la tuberculosis humana porque se parecen más que los pequeños animales de laboratorio y poseen características anatómicas clave como el complejo árbol bronquial (Mclaughlin et al., 1961) y el parénquima pulmonar organizado en una red de septos interlobulares que tienden a encapsular las lesiones (Gil et al., 2010), el tracto respiratorio y la vascularización pulmonar (Magno et al., 1990), y los tejidos linfoides respiratorios (Liebler-Tenorio y Pabst, 2006).
El presente estudio tuvo como objetivo evaluar la nebulización IN de M. caprae como una vía de entrada de infección similar a un campo. La justificación era reproducir mejor las características de la progresión natural de la infección tuberculosa, pero de manera controlada, a fin de mejorar la monitorización de los parámetros clínicos, inmunológicos, bacteriológicos y patológicos que podrían utilizarse como predictores de la eficacia de la vacuna en estudios posteriores. El nuevo enfoque se comparó con la infección experimental bien establecida a través de la inoculación endobronquial (Pérez de Val et al., 2011). La gravedad y la progresión de la enfermedad no solo se compararon por la diferente distribución de las lesiones en los grupos EB e IN, sino que también se evaluaron holísticamente considerando todos los parámetros mencionados anteriormente, según investigaciones previas sobre patogenicidad de la TB en cabras (Pérez de Val et al., 2013; Domingo et al., 2014).
Los resultados mostraron que la infección por IN ralentizó la progresión de la enfermedad en comparación con la vía EB en términos de cinética de respuesta inmune mediada por células (respuestas IFN-γ específicas de antígeno) y la aparición de signos clínicos (aumento de peso corporal, temperatura rectal y signos respiratorios). El retraso de las respuestas proinflamatorias (determinadas por los niveles de IFN-γ) en el grupo IN puede explicarse por un desarrollo más lento de lesiones granulomatosas que normalmente muestran una correlación directa con las respuestas de IFN-γ específicas de antígeno (Vordermeier et al., 2002; Pérez de Val et al., 2012). La cinética y la intensidad de las respuestas proinflamatorias en el grupo IN son consistentes con los picos de temperatura rectal más progresivos, menos intensos y retrasados (semanas 5-7 p.c en el grupo IN en lugar de semanas 2-4 p.c. en el grupo EB). Las tasas de seroconversión retardada (MPB83) o la ausencia de respuestas humorales detectables (P22) en la mayoría de los animales del grupo IN también son indicativas de una progresión más lenta de la enfermedad. La menor intensidad de las respuestas IgG específicas de MPB83 en el grupo IN también puede asociarse con una menor gravedad de las lesiones de TB y la carga bacteriana, como se describió previamente en bovinos y caprinos (Lyashchenko et al., 2004; Pérez de Val et al., 2011).
Sin embargo, al final del estudio, todos los animales con IN desafiados mostraron signos clínicos compatibles con la TB que indicaban que la infección estaba bien establecida. Esto también fue apoyado por el hecho de que las ganancias acumuladas de peso corporal de los grupos IN y EB tendieron a converger al final del experimento. Estudios previos, llevados a cabo por nuestro grupo de investigación, demostraron que el aumento del peso corporal en cabritos de cabra, desafiados experimentalmente con M. caprae, se correlaciona inversamente con el resultado patológico de la TB (Melgarejo et al., 2022).
Desde el punto de vista patológico, la infección por EB induce una progresión más rápida de la enfermedad con el desarrollo temprano de lesiones pulmonares grandes-extensas similares a las encontradas en ciertos casos crónicos avanzados de TB caprina en el campo (Domingo et al., 2014). Por el contrario, después de 9 semanas, las cabras infectadas por la vía IN mostraron lesiones pulmonares moderadas similares a las que generalmente se obtienen en infecciones naturales, caracterizadas por lesiones granulomatosas nodulares pulmonares multifocales pequeñas a medianas con un grado variable de encapsulación, presencia variable de granulomas satélite y, ocasionalmente, lesiones coalescentes más grandes con cavitación central. Estas lesiones pulmonares a menudo se asocian con lesiones en los ganglios linfáticos torácicos (Domingo et al., 2014). El principal inconveniente de la ruta IN son las intensas lesiones granulomatosas encontradas en la cavidad nasal y la LN de la cabeza en algunos animales, que fueron inducidas artificialmente por la plataforma de nebulización utilizada para inocular las micobacterias. Estas lesiones no suelen observarse en casos de campo (Sánchez et al., 2011). Esto podría explicarse por el hecho de que durante el desafío, una proporción considerable de las gotitas que contenían micobacterias a granel entregadas en la cavidad nasal no se inhalaron y permanecieron en las vías respiratorias superiores, generando así lesiones granulomatosas locales. Por el contrario, es probable que los aerosoles en el aire que transportan micobacterias en condiciones de campo accedan al parénquima pulmonar directamente y en instalaciones discretas, evitando así las vías respiratorias superiores (Daniel et al., 2009).
En una infección experimental realizada en terneros inoculados intranamentalmente con M. bovis, la mayoría de los animales (11/12) desarrollaron lesiones granulomatosas de TB en LNs asociadas con el tracto respiratorio superior, y solo cuatro de ellos tenían lesiones en los pulmones o LN traqueobronquial (McCorry et al., 2005). En el presente estudio, investigamos no solo los LN de la cabeza, sino que también realizamos una sección longitudinal del cráneo para investigar la cavidad nasal. Encontramos granulomas intranasales macroscópicos en 4/7 animales que obstruyeron parcialmente las vías respiratorias superiores y, en un caso, provocaron disnea severa que condujo a la eutanasia humanitaria de un animal en la semana 8 antes de la finalización del experimento. Las variaciones putativas de la ubicación de la cánula en el meato nasal dorsal o medio frente al meato nasal ventral podrían explicar la ubicación de las lesiones en el aspecto caudal de la cavidad nasal en 4/7 animales, mientras que en los 3/7 animales sin lesiones, la cánula probablemente se introdujo en el meato ventral. En uno de estos animales, las lesiones en el pulmón fueron las más graves del grupo (animal 179, sugestivo de una administración efectiva del inóculo al pulmón), mientras que los otros dos solo desarrollaron lesiones en los ganglios linfáticos retrofaríngeos. Además, dos animales del grupo IN presentaban lesiones en la LN mesentérica, y esto podría explicarse por la ingestión parcial del inóculo (en el caso del animal 153, no se observó lesión en la nariz), por la ingestión de las micobacterias de las lesiones granulomatosas que se desarrollan en la cavidad nasal y/o ganglios linfáticos asociados (en el caso del animal 226) o, menos probable, debido a la diseminación linfohematógena a la cavidad abdominal. La participación de LN mesentérica fue un hallazgo frecuente en entornos naturales en un estudio de campo llevado a cabo en un rebaño caprino, donde la vía de transmisión más probable fueron los comederos compartidos entre animales infectados y susceptibles (Vidal et al., 2017). La diseminación de las lesiones de TB más allá de las vías respiratorias superiores y la cavidad torácica también ocurrió en todos los animales con EB (es decir, todos ellos mostraron lesiones en el bazo), muy probablemente debido a una diseminación linfohematógena desde el complejo primario generado en los pulmones y LN pulmonar, similar a la reportada en estudios previos (Arrieta-Villegas et al., 2018; Melgarejo et al., 2022). Este fenómeno también podría haber ocurrido en dos animales desafiados por IN-desafiados que mostraron lesiones en el bazo (sugestivas de diseminación hematógena), uno de los cuales tenía las lesiones de TB pulmonar más extensas en el grupo desafiado por IN, sin afectación de la cavidad nasal.
To properly develop a suitable infection model to measure the efficacy of TB treatments, it would be necessary to refine the nebulization procedure to ensure that most of the inoculum enters into the trachea, avoiding the biased involvement of the nasal cavity. This could be accomplished by introducing the cannula directly into the ventral nasal meatus. Another explanation for the skewed distribution of lesions in the IN-challenged goats could be the fact that the animals might not have inhaled normally when inoculated and even tried to reject or swallow the inoculum. Thus, sedation of the goats before the experimental challenge could also facilitate a more direct delivery to the lungs.
Hasta la fecha, se han modelado diferentes enfoques para las infecciones experimentales de MTBC en cabras: transtorácica (Bezos et al., 2010, 2015), endobronquial (Pérez de Val et al., 2011; Wedlich et al., 2022), la aerosolización (Gonzalez-Juarrero et al., 2013), y el enfoque de infección por contacto, es decir, la exposición de cabras susceptibles a las infectadas por contacto cercano (Bezos et al., 2017; Roy et al., 2019). Este último tiene la ventaja de imitar la infección natural en el rebaño, pero tiene la desventaja de no controlar puntos críticos como el punto de tiempo de la infección, la dosis de infección y la ruta de infección, lo que dificulta el monitoreo del progreso de la infección y, lo que es más crítico, la comparación entre los grupos de tratamiento. Del mismo modo, el uso de aerosolizadores permite la inhalación de micobacterias (González-Juarrero et al., 2013) pero no permite depositar el inóculo en un sitio definido del tracto respiratorio en el punto de inicio del experimento, para comparar la evolución patológica desde el sitio de infección entre los grupos de tratamiento. El dispositivo de atomización utilizado en el presente estudio pulveriza gotitas > 30 mm de diámetro que se asemejan a las excretadas por estornudos o tos. Con la nebulización IN se puede controlar el punto de tiempo de infección y las condiciones de dosis de infección, pero aún así no asegurar el sitio de infección dentro del tracto respiratorio, lo que resulta en lesiones moderadas de TB pulmonar en solo 4/7 animales, probablemente porque una fracción significativa del inóculo se retuvo en la cavidad nasal, mientras que todas las cabras infectadas por inoculación EB mostraron lesiones pulmonares de TB como se describió previamente en todas las infecciones experimentales de cabras con M. caprae o M. bovis por esta vía (Pérez de Val et al., 2011, 2012, 2013; Arrieta-Villegas et al., 2018, 2020; Melgarejo et al., 2022; Wedlich et al., 2022). Sin embargo, el modelo EB, al igual que el transtorácico, puede inducir lesiones caseoso-necrotizantes avanzadas incluso en individuos vacunados, limitando la capacidad de predecir el efecto protector de los candidatos vacunados (Arrieta-Villegas et al., 2020). En contraste, la infección por IN indujo lesiones pulmonares de baja a moderada con un bajo grado de mineralización, lo que sugiere una etapa de desarrollo más inicial que puede facilitar la evaluación de la contención de las lesiones de TB que se diseminan en animales inmunizados. Se requiere la optimización del modelo para llegar a un compromiso entre (A) el control de las condiciones (dosis, punto de inoculación), (B) la duración del experimento y (C) la reproducibilidad del fenotipo de campo de TB para evaluar con precisión la eficacia de las vacunas probadas.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / material complementario, las consultas adicionales pueden dirigirse a los autores correspondientes.
Declaración ética
Los estudios en animales fueron aprobados por el Comité de Bienestar Animal de la Generalitat de Catalunya. Los estudios se realizaron de acuerdo con la legislación local y los requisitos institucionales. No se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio porque los animales fueron comprados para estos estudios.
Contribuciones del autor
BP y EV concibieron y planificaron el estudio. CM, AC, CP, MM, ZC, GC, XM, YE, MD, EV y BP realizaron los experimentos y contribuyeron a la recolección de datos. CM, AC, JF, CP, YE, EV y BP analizaron e interpretaron los datos. BP y MD adquirieron fondos y estuvieron a cargo de la administración del proyecto. CM, EV y BP escribieron el borrador original. MD contribuyó a escribir, revisar y editar la versión final del manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este estudio fue financiado a través de una subvención del Ministerio de Ciencia e Innovación de España (Ref. PID2019-105155RB-C32/AEI/10.13039/501100011033). El IRTA contó con el apoyo del Programa CERCA/Generalitat de Catalunya. CM es beneficiario de una beca predoctoral del programa Don Carlos Antonio López de la República del Paraguay (Ref. 88/2020).
Reconocimientos
Los autores agradecen a Abel Muñoz, Mónica Pérez, Rosa López, Anna Barceló y al personal de la Unidad BLS-3 del IRTA-CReSA su destacado apoyo técnico.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
Aranaz, A., Primos, D., Mateos, A. y Domínguez, L. (2003). Elevación de Mycobacterium tuberculosis subsp. caprae Aranaz et al. 1999 a la clasificación de especies como peine de Mycobacterium caprae. nov., sp. nov. Int. J. Syst. Evol. Microbiol. 53, 1785–1789. DOI: 10.1099/ijs.0.02532-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Arrieta-Villegas, C., Allepuz, A., Grasa, M., Martín, M., Cervera, Z., Mercader, I., et al. (2020). Eficacia a largo plazo de la vacunación con BCG en rebaños caprinos con una alta prevalencia de tuberculosis. 10, 20369. doi: 10.1038/s41598-020-77334-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Arrieta-Villegas, C., Perálvarez, T., Vidal, E., Puighibet, Z., Moll, X., Canturri, A., et al. (2018). Eficacia de la vacunación parenteral contra la tuberculosis con Mycobacterium bovis inactivado por calor en cabras experimentalmente desafiadas. PLoS ONE 13, e0196948. doi: 10.1371/journal.pone.0196948
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Balseiro, A., Altuzarra, R., Vidal, E., Moll, X., Espada, Y., Sevilla, I. A., et al. (2017). Evaluación de BCG y vacunas inactivadas contra Mycobacterium bovis en un modelo experimental de infección tuberculosa en ovinos. PLoS ONE 12, e0180546. doi: 10.1371/journal.pone.0180546
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Bezos, J., Casal, C., Álvarez, J., Roy, A., Romero, B., Rodríguez-Bertos, A., et al. (2017). Evaluación de la vacuna contra Mycobacterium tuberculosis SO2 utilizando un modelo natural de infección tuberculosa en cabras. Veterinario J. 223, 60–67. doi: 10.1016/j.tvjl.2017.04.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Bezos, J., Casal, C., Díez-Delgado, I., Romero, B., Liandris, E., Álvarez, J., et al. (2015). Las cabras desafiadas con diferentes miembros del complejo Mycobacterium tuberculosis muestran diferentes cuadros clínicos. Veterinario Immunol. Inmunopatol. 167, 185–189. doi: 10.1016/j.vetimm.2015.07.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Bezos, J., de Juan, L., Romero, B., Álvarez, J., Mazzucchelli, F., Mateos, A., et al. (2010). Infección experimental con Mycobacterium caprae en cabras y evaluación del estado inmunológico en animales coinfectados por tuberculosis y paratuberculosis. Veterinario Immunol. Inmunopatol. 133, 269–275. doi: 10.1016/j.vetimm.2009.07.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Buddle, B. M., Martin Vordermeier, H. y Hewinson, R. G. (2016). Modelos experimentales de infección de tuberculosis en ganado doméstico. Microbiol. Espectro. 4, 44–66. DOI: 10.1128/microbiolspec. TBTB2-0017-2016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cano-Terriza, D., Risalde, M. A., Rodríguez-Hernández, P., Napp, S., Fernández-Morente, M., Moreno, I., et al. (2018). Vigilancia epidemiológica del complejo Mycobacterium tuberculosis en cerdos criados extensivamente en el sur de España. Prev. Vet. Med. 159, 87–91. doi: 10.1016/j.prevetmed.2018.08.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Català, M., Prats, C., López, D., Cardona, P. J. y Alonso, S. (2020). Un modelo de reacción-difusión para comprender la formación de granulomas dentro del lóbulo secundario durante la infección por tuberculosis. PLoS ONE 15, 1–20. doi: 10.1371/journal.pone.0239289
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Daniel, R., Evans, H., Rolfe, S., De La Rua-Domenech, R., Crawshaw, T., Higgins, R. J., et al. (2009). Papers: brote de tuberculosis causada por Mycobacterium bovis en cabras doradas de Guernsey en Gran Bretaña. Rec. 165, 335–342. DOI: 10.1136/VR.165.12.335
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Domingo, M., Vidal, E. y Marco, A. (2014). Patología de la tuberculosis bovina. Res. Vet. 97, S20–S29. doi: 10.1016/j.rvsc.2014.03.017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Gil, O., Díaz, I., Vilaplana, C., Tapia, G., Díaz, J., Fort, M., et al. (2010). La encapsulación del granuloma es un factor clave para contener la infección tuberculosa en minicerdos. PLoS ONE 5, e10030. doi: 10.1371/journal.pone.0010030
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Gonzalez-Juarrero, M., Bosco-Lauth, A., Podell, B., Soffler, C., Brooks, E., Izzo, A., et al. (2013). Aerosol experimental Mycobacterium bovis modelo de infección en cabras. Tuberculosis 93, 558–564. doi: 10.1016/j.tube.2013.05.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Infantes-Lorenzo, J. A., Moreno, I., Risalde, M. D. L. Á., Roy, Á., Villar, M., Romero, B., et al. (2017). Caracterización proteómica de derivados proteicos purificados bovinos y aviares e identificación de antígenos específicos para el serodiagnóstico de la tuberculosis bovina. Clin. Proteoma. 14, 36. DOI: 10.1186/S12014-017-9171-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Infantes-Lorenzo, J. A., Moreno, I., Roy, A., Risalde, M. A., Balseiro, A., de Juan, L., et al. (2019). Especificidad de la prueba serológica para la detección de tuberculosis en bovinos, caprinos, ovinos y porcinos en diferentes situaciones epidemiológicas. BMC Vet. 15, 70. DOI: 10.1186/S12917-019-1814-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Liebler-Tenorio, E., y Pabst, R. (2006). Estructura y función de MALT en animales de granja. Vet. 37, 257–280. doi: 10.1051/vetres:2006001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Lyashchenko, K., Whelan, A. O., Greenwald, R., Pollock, J. M., Andersen, P., Hewinson, R. G., et al. (2004). Asociación de respuestas de anticuerpos potenciados por tuberculina con patología e inmunidad mediada por células en bovinos vacunados con Mycobacterium bovis BCG e infectados con M. bovis. Infecta. Inmune. 72, 2462–2467. doi: 10.1128/IAI.72.5.2462-2467.2004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Magno, M., Long Nadel, J., Wanner, A. y Lockhart, A. (1990). Anatomía comparada de la circulación traqueobronquial. Eur. Respir. J. 13, 557S−563S.
McCorry, T., Whelan, A. O., Welsh, M. D., McNair, J., Walton, E., Bryson, D. G., et al. (2005). Desprendimiento de Mycobacterium bovis en el moco nasal de bovinos infectados experimentalmente con tuberculosis por vía intranasal e intratraqueal. Rec. 157, 613–618. DOI: 10.1136/VR.157.20.613
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Mclaughlin, R. F., Tyler, W. S., y Canadá, R. (1961). Un estudio de la anatomía pulmonar submacroscópica en varios mamíferos. Am. J. Anat. 108, 149–165. doi: 10.1002/aja.1001080203
Melgarejo, C., Planas, C., Cobos, A., Arrieta-Villegas, C., Sevilla, I. A., Bezos, J., et al. (2022). Un estudio de prueba de conclept para investigar la eficacia de las autovacunas inactivadas por calor en cabras con Mycobacterium caprae desafió experimentalmente. 12, 22132. DOI: 10.1038/S41598-022-26683-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Napp, S., Allepuz, A., Mercader, I., Nofrarias, M., López-Soria, S., Domingo, M., et al. (2013). Evidencia de cabras que actúan como reservorios domésticos de tuberculosis bovina. Rec. 172, 663. DOI: 10.1136/VR.101347
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Pérez de Val, B., López-Soria, S., Nofrarías, M., Martín, M., Vordermeier, H. M., Villarreal-Ramos, B., et al. (2011). Modelo experimental de tuberculosis en cabra doméstica tras infección endobronquial por Mycobacterium caprae. Clin. Vacc. Immunol. 18, 1872–1881. doi: 10.1128/CVI.05323-11
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Pérez de Val, B., Napp, S., Velarde, R., Lavín, S., Cervera, Z., Singh, M., et al. (2017). Seguimiento serológico de la tuberculosis en una población de jabalíes en contacto con ganado infectado. Transbound. Emerg. Dis. 64, 275–283. doi: 10.1111/tbed.12368
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Pérez de Val, B., Vidal, E., Villarreal-Ramos, B., Gilbert, S. C., Andaluz, A., Moll, X., et al. (2013). Una vacuna vectorizada por adenovirus multiantigénicos mejora la protección inducida por BCG de las cabras contra la infección pulmonar por tuberculosis y previene la progresión de la enfermedad. PLoS ONE 8, e81317. doi: 10.1371/journal.pone.0081317
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Pérez de Val, B., Villarreal-Ramos, B., Nofrarías, M., López-Soria, S., Romera, N., Singh, M., et al. (2012). Las cabras preparadas con Mycobacterium bovis BCG y potenciadas con un adenovirus recombinante que expresa Ag85A muestran una mayor protección contra la tuberculosis. Clin. Vacc. Immunol. 19, 1339–1347. doi: 10.1128/CVI.00275-12
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ramírez, I. C., Santillán, M. A. y Dante, V. (2003). La cabra como modelo experimental de rumiante para la infección tuberculosa. Pequeño Rumin. 47, 113–116. doi: 10.1016/S0921-4488(02)00243-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Rodríguez, S., Bezos, J., Romero, B., de Juan, L., Álvarez, J., Castellanos, E., et al. (2011). Infección por Mycobacterium caprae en ganado y fauna silvestre, España. Emerg. Infecta. Dis. 17, 532–535. DOI: 10.3201/EID1703.100618
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Roy, Á., Risalde, M. A., Bezos, J., Casal, C., Romero, B., Sevilla, I., et al. (2018). Respuesta de cabras a la vacunación intramuscular con Mycobacterium bovis matado por calor y desafío natural. Comp. Immunol. Microbiol. Infecta. Dis. 60, 28–34. doi: 10.1016/j.cimid.2018.09.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Roy, A., Tomé, I., Romero, B., Lorente-Leal, V., Infantes-Lorenzo, J. A., Domínguez, M., et al. (2019). Evaluación de la inmunogenicidad y eficacia de las vacunas BCG y MTBVAC utilizando un modelo de transmisión natural de la tuberculosis. Vet. 50, 1–3. DOI: 10.1186/S13567-019-0702-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sánchez, J., Tomás, L., Ortega, N., Buendía, A. J., del Río, L., Salinas, J., et al. (2011). Características microscópicas e inmunológicas de granulomas tuberculoides y tuberculosis pulmonar cavitaria en cabras naturalmente infectadas. J. Comp. Pathol. 145, 107–117. doi: 10.1016/j.jcpa.2010.12.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Seva, J., Menchén, V., Navarro, J. A., Pallarés, F. J., Villar, D., Vásquez, F., et al. (2002). Programa de erradicación de la tuberculosis caprina: un estudio inmunohistoquímico. Pequeño Rumin. 46, 107–114. doi: 10.1016/S0921-4488(02)00174-8
Tanner, R., O’Shea, M. K., Fletcher, H. A. y McShane, H. (2016). Ensayos de inhibición del crecimiento micobacteriano in vitro: una herramienta para la evaluación de la inmunidad protectora y la evaluación de la eficacia de la vacuna contra la tuberculosis. Vacuna 34, 4656–4665. doi: 10.1016/j.vaccine.2016.07.058
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Vidal, E., Arrieta-Villegas, C., Grasa, M., Mercader, I., Domingo, M. y Pérez de Val, B. (2017). Evaluación de campo de la eficacia de la vacuna BCG de Mycobacterium bovis contra la tuberculosis en cabras. BMC Vet. 13, 252. doi: 10.1186/s12917-017-1182-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Vidal, E., Burgaya, J., Michelet, L., Arrieta-Villegas, C., Cantero, G., de Cruz, K., et al. (2022). Infección experimental por Mycobacterium microti en ratones de banco (Myodes glareolus). Microorganismos 10, 135. doi: 10.3390/microorganismos10010135
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Vidal, E., Grasa, M., Perálvarez, T., Martín, M., Mercader, I. y Pérez de Val, B. (2018). Transmisión de tuberculosis causada por Mycobacterium caprae entre ovejas lecheras y cabras. Pequeño Rumin. 158, 22–25. doi: 10.1016/j.smallrumres.2017.11.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Vordermeier, H. M., Chambers, M. A., Cockle, P. J., Whelan, A. O., Simmons, J. y Hewinson, R. G. (2002). Correlación de la producción de interferón gamma específico de ESAT-6 con patología en bovinos después de la vacunación con Mycobacterium bovis BCG contra tuberculosis bovina experimental. Infectar. Inmune. 70, 3026–3032. doi: 10.1128/IAI.70.6.3026-3032.2002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Wedlich, N., Figl, J., Liebler-Tenorio, E. M., Köhler, H., von Pückler, K., Rissmann, M., et al. (2022). Inoculación por pulverización intrabronquial guiada por videoendoscopia de Mycobacterium bovis en cabras y evaluación comparativa de lesiones pulmonares con diversos métodos de imagen. Frente. Vet. Sci. 9, 877322. DOI: 10.3389/FVETS.2022.877322
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: tuberculosis, Mycobacterium caprae, cabra, infección experimental, intranasal, endobronquial
Cita: Melgarejo C, Cobos A, Planas C, Fondevila J, Martín M, Cervera Z, Cantero G, Moll X, Espada Y, Domingo M, Vidal E y Pérez de Val B (2023) Comparación del resultado patológico y la progresión de la enfermedad de dos modelos experimentales de desafío de Mycobacterium caprae en cabras: inoculación endobronquial vs. nebulización intranasal. Frente. Microbiol. 14:1236834. doi: 10.3389/fmicb.2023.1236834
Recibido: 08 Junio 2023; Aprobado: 25 de julio de 2023;
Publicado: 11 agosto 2023.
Editado por:
Hong Yin, Academia China de Ciencias Agrícolas, China
Revisado por:
Heike Uta Köhler, Friedrich-Loeffler-Institut, Alemania Elisabeth M. Liebler-Tenorio, Friedrich-Loeffler-Institut, Alemania
Copyright © 2023 Melgarejo, Cobos, Planas, Fondevila, Martín, Cervera, Cantero, Moll, Espada, Domingo, Vidal y Pérez de Val. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Bernat Pérez de Val, bernat.perez@irta.cat; Enric Vidal, enric.vidal@irta.cat
†Estos autores han contribuido igualmente a este trabajo y comparten la última autoría
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía
