Neurorrehabilitación intensiva y trasplante alogénico de células madre en mielopatía degenerativa canina

Neurorrehabilitación intensiva y trasplante alogénico de células madre en mielopatía degenerativa canina
 Débora Gouveia1,2,3,
Débora Gouveia1,2,3,  Jéssica Correia1,3,
Jéssica Correia1,3,  Ana Cardoso1,2,
Ana Cardoso1,2,  Carla Carvalho1,
Carla Carvalho1,  Ana Catarina Oliveira1,2,
Ana Catarina Oliveira1,2,  António Almeida4,
António Almeida4,  Óscar Gamboa4,
Óscar Gamboa4,  Lénio Ribeiro3,
Lénio Ribeiro3,  Mariana Branquinho5,6,7,
Mariana Branquinho5,6,7,  Ana Sousa5,6,7,
Ana Sousa5,6,7,  Bruna Lopes5,6,7,
Bruna Lopes5,6,7,  Patrícia Sousa5,6,7,
Patrícia Sousa5,6,7,  Alícia Moreira5,6,7,
Alícia Moreira5,6,7,  André Coelho5,6,7,
André Coelho5,6,7,  Alexandra Rêma5,6,7,
Alexandra Rêma5,6,7,  Rui Alvites5,6,7,8,
Rui Alvites5,6,7,8,  António Ferreira4,7,9,
António Ferreira4,7,9,  Ana Colette Maurício5,6,7* y
Ana Colette Maurício5,6,7* y  Ângela Martins1,2,3
Ângela Martins1,2,3- 1Hospital Veterinario de Arrábida, Centro de Rehabilitación Animal de Arrábida, Setúbal, Portugal
- 2Escuela Superior de Salud, Protección y Bienestar Animal, Instituto Politécnico de la Lusofonía, Lisboa, Portugal
- 3Facultad de Medicina Veterinaria, Universidad de Lusófona, Lisboa, Portugal
- 4Facultad de Medicina Veterinaria, Universidad de Lisboa, Lisboa, Portugal
- 5Departamento de Clínicas Veterinárias, Instituto de Ciências Biomédicas de Abel Salaza, Universidade do Porto, Porto, Portugal
- 6Centro de Estudos de Ciência Animal, Instituto de Ciências, Tecnologias e Agroambiente da Universidade do Porto, Porto, Portugal
- 7Laboratorio Asociado de Ciencias Animales y Veterinarias (AL4AnimalS), Lisboa, Portugal
- 8Instituto Universitário de Ciências da Saúde (IUCS), Cooperativa de Ensino Superior Politécnico e Universitário (CESPU), Gandra, Portugal
- 9CIISA – Centro Interdisciplinar-Investigáo em Saúde Animal, Faculdade de Medicina Veterinária, Av. Universi dade Técnica de Lisboa, Lisboa, Portugal
Introducción: La mielopatía degenerativa (DM) es una enfermedad neurodegenerativa de la médula espinal con neuronas motoras superiores, con signos clínicos progresivos y crónicos, similar a la esclerosis lateral amiotrófica (ELA). La DM tiene una etiología compleja asociada principalmente con la mutación del gen SOD1 y su papel tóxico, sin tratamiento específico. La rehabilitación intensiva diaria mostró un tiempo de supervivencia cercano a los 8 meses, pero la mayoría de los animales son sacrificados de 6 a 12 meses después del inicio de los signos clínicos.
Métodos: Este estudio clínico prospectivo de cohorte cegada controlada tiene como objetivo evaluar la capacidad de respuesta de regeneración neural de perros con DM sometidos a un protocolo intensivo de neurorehabilitación con trasplante de células madre mesenquimales (MSC). En total, se incluyeron 13 perros no ambulatorios (OFS 6 u 8) con genotipo homocigoto DM/DM y diagnosticados por exclusión. Todos fueron asignados al grupo de neurorrehabilitación intensiva con protocolo de CEM (INSCP) (N = 8) o al grupo de protocolo de rehabilitación ambulatoria (ARP) (n = 5), que difieren en cuanto a la intensidad del entrenamiento, la frecuencia de las modalidades y el trasplante de CMM. El grupo INSCP fue hospitalizado durante 1 mes (T0 a T1), seguido de trasplante de MSC (T1) y un segundo mes (T2), mientras que el grupo ARP estuvo bajo tratamiento ambulatorio durante los mismos 2 meses.
Resultados: El tiempo medio de supervivencia de la población total fue de 375 días, con 438 días para el grupo INSCP y 274 para el grupo ARP, con una marcada diferencia en el análisis de supervivencia de Kaplan-Meier. Al comparar los resultados de la literatura, también hubo una clara diferencia en la prueba t de una muestra (p = 0,013) con un aumento en el tiempo de aproximadamente el 70%. Las clasificaciones de OFS entre los grupos en cada punto temporal fueron significativamente diferentes (p = 0,008) por el ANOVA unidireccional y la prueba t de muestra independiente.
Discusión: Este INSCP demostró ser seguro, factible y una posibilidad para una larga progresión de perros DM con calidad de vida y mejora funcional. Este estudio debe continuar.
1. Introducción
La mielopatía degenerativa (DM) es una enfermedad neurodegenerativa de la médula espinal caracterizada por la aparición progresiva y crónica de signos clínicos en perros de razas grandes (1, 2). Estos signos son principalmente de neurolocalización T3-L3 e incluyen ataxia propioceptiva y paraparesia espástica (3, 4), similares a los presentados en pacientes humanos con esclerosis lateral amiotrófica (ELA) (5).
La mayoría de los perros tienen entre 5 y 14 años de edad (6) y los signos clínicos se presentan en promedio en los 9 años (3, 7), independientemente del sexo y otras enfermedades (3, 8).
Esta enfermedad tiene una prevalencia del 0,19% en perros (1, 7) pero una prevalencia específica del 2,01% en el pastor alemán (1), que es la primera raza descrita con DM (9). Sin embargo, diferentes autores ya han descrito la confirmación histológica de la enfermedad en otras razas, como Siberian Husky (10), Caniche miniatura (11), Boxer (12-14), Pembroke Welsh Corgi (1, 15-17), Rhodesian ridgeback (12), Chesapeake Bay Retriever (12), Bernese Bouvier, Kerry Blue terrier, Golden Retriever, Pug (3) y también perros de raza mixta (9 ). También hay otras razas descritas pero sin confirmación histológica (6).
La mielopatía degenerativa tiene una etiología compleja y desconocida (7), pero se han desarrollado estudios recientes que demuestran la mutación del gen SOD1 como una de las principales causas (18). Este gen se presenta como un homodímero que convierte los radicales superóxido en hidrógeno y peróxido de oxígeno (5). Por lo tanto, la superóxido dismutasa (SOD), una enzima involucrada en la dismutasa de los radicales superóxido, tiene tres isoformas SOD: citoplasmática (SOD1), mitocondrial (SOD2) y secretada fuera de la célula (SOD3). Además, algunas investigaciones en DM han destacado dos proteínas mutantes SOD1 (E40K y T18S) como insolubles y capaces de inducir un papel tóxico asociado con estas isoformas (19-21).
Existen varios diagnósticos diferenciales relacionados con perros geriátricos y lesiones de la médula espinal T3-L3 (por ejemplo, enfermedad del disco intervertebral (IVDD) Hansen tipo II, neoplasia y meningoencefalomielitis) (4). Por lo tanto, el diagnóstico antemortem depende de la historia clínica (aparición y progresión de los signos neurológicos), las neuronas motoras superiores (UMN), los signos clínicos compatibles con mielopatía T3-L3, la ausencia de lesión compresiva de la médula espinal y los cambios inflamatorios en el líquido cefalorraquídeo (LCR). El examen complementario estándar de oro es la resonancia magnética (MRI), pero también se realiza tomografía computarizada / TC para excluir la enfermedad del disco, la discospondilitis y la neoplasia (4, 22).
Por lo tanto, para el diagnóstico final de DM, es necesario tener antecedentes y signos clínicos compatibles (9), la presencia de mutación del gen SOD1 (5) y la exclusión de otras enfermedades de la médula espinal (4, 7). Sin embargo, la DM puede coexistir con otras enfermedades del sistema nervioso, lo que resulta en la necesidad de un diagnóstico preciso en el futuro, por ejemplo, a través de biomarcadores específicos (23). Según un estudio realizado en 2017, un biomarcador adecuado sería la cadena pesada de neurofilamentos (pNFH) que se libera en el líquido intersticial durante la lesión axonal y la neurodegeneración (24).
La conexión entre DM y ELA se basa en las similitudes genéticas de ambas enfermedades, es decir, la mutación en el nucleótido SOD1 (25). En la ELA, aproximadamente el 20% de los casos tienen la mutación SOD1 (26) transmitida como enfermedad autosómica dominante, mientras que la DM es autosómica recesiva (5). Además, los resultados de los estudios realizados en perros con DM pueden permitir una mejor comprensión de la efectividad de las intervenciones terapéuticas en el tratamiento de la ELA (3).
No existe un tratamiento específico para la DM (6, 27). El enfoque farmacológico médico se basa en fármacos antiinflamatorios no esteroideos o esteroides, como la prednisolona, debido a su efecto sobre el tratamiento de los signos neurológicos, sin embargo, con poca evidencia con respecto a la progresión de la enfermedad (28).
Otros enfoques terapéuticos incluyen un protocolo inicial basado en ejercicios físicos activos y suplementos con vitamina B, vitamina E, ácido aminocaproico y N-acetilcisteína (8, 29).
El ácido aminocaproico bloquea las vías de inflamación y reduce la degradación de la fibrina (29). Por otro lado, la N-acetilcisteína, un precursor del glutatión, elimina los radicales libres, evitando la activación de enzimas que causan daño tisular (30). La suplementación vitamínica puede contribuir a la mejora de los perros con DM, inhibiendo la liberación de prostaglandinas y citoquinas que actúan sobre la cascada de inflamación (29).
Los perros con mielopatía degenerativa que no están en un enfoque multimodal alcanzan la enfermedad en etapa terminal dentro de los 6 meses posteriores al diagnóstico inicial (29, 31). Un estudio de Kathmann et al. (6) informó que la fisioterapia diaria aumentó el tiempo de supervivencia en estos perros. En 22 perros con DM, los que tenían protocolo intensivo de fisioterapia mostraron una supervivencia de casi 8 meses, en comparación con un protocolo moderado (~ 4 meses) o sin ningún protocolo (~ 2 meses). En otro estudio con perros bajo un protocolo similar, el 15-20% no mostró un empeoramiento del estado neurológico, y algunos perros sobrevivieron durante más de 4 años (31). Por lo tanto, el pronóstico de la DM sigue siendo malo y, en la mayoría de los casos, los perros son sacrificados entre 6 y 12 meses después de los primeros signos clínicos (1).
La medicina regenerativa es la rama de la medicina que promueve la regeneración de tejidos y la consiguiente recuperación funcional a través del rebrote o reemplazo de células, tejidos u órganos lesionados. Entre los diferentes enfoques terapéuticos considerados en Medicina Regenerativa, las terapias basadas en células, es decir, aquellas que utilizan células madre, son las más exploradas. En particular, se ha estudiado el trasplante de MSC, que son células multipotentes aisladas de tejidos maduros con efectos paracrinos y la capacidad de diferenciarse en linajes específicos (32), para regenerar potencialmente tejidos u órganos dañados (33, 34). Esta aplicación se ha descrito en varias enfermedades humanas con claros efectos pro-regenerativos, como la diabetes mellitus (35), leucemia mieloide crónica (36), cirrosis (37), fibrosis pulmonar (38), enfermedad de Crohn (39), insuficiencia cardíaca (40) y enfermedades del sistema nervioso, como la esclerosis múltiple (41), la enfermedad de Parkinson (42) y otras enfermedades neurológicas (43). Más recientemente, se han comenzado a explorar nuevas metodologías para maximizar la efectividad de las MSC como componente terapéutico, es decir, el uso de sus productos de secreción como sustituto del uso de las propias células. El conjunto de factores solubles secretados por las células (secretoma) incluye factores de crecimiento, citocinas, quimiocinas y glicoproteínas, y los factores vesiculares incluyen microvesículas y exosomas. En conjunto, la eficacia pro-regenerativa de estos factores paracrinos ha demostrado ser tan eficaz o más eficaz que el uso de células, sin las desventajas asociadas con la administración celular directa en un organismo vivo (44).
Además, hay varios estudios de trasplante que utilizan MSC aplicadas en el perro como modelo clínico, es decir, en lesiones de la médula espinal (45), queratitis superficial crónica (46), dermatitis (47), osteoartritis y regeneración del cartílago (48-50), así como otras enfermedades musculoesqueléticas (51).
Se ha descrito que el trasplante de células madre en la ELA disminuye los síntomas clínicos, con signos reportados de neuroprotección, curación del tejido nervioso y mayor tiempo de supervivencia (52). Otros estudios mostraron que la administración intratecal mejoró la función motora, con menos degeneración neuronal (53), y reducción de la astrogliosis y la microgliosis, principalmente debido a sus efectos antiinflamatorios (54).
El conjunto de diferentes modalidades asociadas con los ejercicios activos (6) y la administración de células madre (54) puede aumentar potencialmente el bienestar de los perros con DM a largo plazo (55).
En cuanto a las modalidades de neurorrehabilitación, la estimulación eléctrica funcional (FES) promueve la neuromodulación con una baja intensidad de corriente que permite la contracción muscular (56, 57), con pulsos eléctricos cortos que estimulan las neuronas motoras cerca del punto motor o mediante estimulación aferente periférica (57, 58). Los parámetros eléctricos suelen ser de 25 a 50 Hz durante 15-20 minutos en cada sesión (59).
Además, el entrenamiento locomotor basado en la repetición de tareas pretende lograr la neuroplasticidad (57), mejorando la masa muscular y la capacidad oxidativa (60). Esto puede resultar en una deambulación coordinada, consistente (61) y simétrica (62). El entrenamiento en cinta rodante bajo el agua puede ser un elemento fundamental en la rehabilitación de estos perros, estimulando el sistema neuromuscular y aumentando el rango de movimiento, incluso en comparación con el entrenamiento en cinta rodante terrestre (63, 64).
Por lo tanto, este estudio clínico prospectivo de cohorte cegada controlada tiene como objetivo evaluar la capacidad de respuesta de regeneración neural de perros con DM sometidos a un protocolo intensivo de neurorrehabilitación con trasplante de MSC. Se plantea la hipótesis de que la asociación de este protocolo con el trasplante de células madre puede ser una posibilidad para una progresión positiva y más larga de estos perros.
2. Materiales y métodos
Este estudio clínico prospectivo de cohorte cegada controlada se realizó en el Centro de Rehabilitación Animal de Arrábida (CRAA y CR2AL, Portugal) entre marzo de 2015 y marzo de 2023, previa aprobación del comité de ética de la Facultad de Medicina Veterinaria de Lusófona (Lisboa, Portugal) (No. 113-2021) y después de firmar un consentimiento informado de los propietarios. Nuestro estudio ha sido enviado para su publicación en el sitio web de AVMA Animal Health Studies (AAHSD) y se le ha asignado el siguiente número: Estudio #: AAHSD005642.
2.1. Presentación de la población
El presente estudio incluyó 13 perros (n = 13) con paraparesia no ambulatoria, clasificados con la puntuación de campo abierto (OFS) (65) como OFS 6 o OFS 8, sin hiperestesia espinal y que presentaban signos clínicos de UMN compatibles con la neurolocalización T3-L3 en el examen de neurorrehabilitación, indicando cierto grado de cronicidad y espasticidad en las extremidades posteriores.
En todos los perros, el diagnóstico de DM se realizó mediante la exclusión de mielopatías inmunomediadas (por ejemplo, babesiosis y ehrlichiosis); mielopatías parasitarias (por ejemplo, leishmaniasis, neosporosis y toxoplasmosis); y mielopatía viral (por ejemplo, moquillo). Todos fueron realizados por serología de sangre y LCR. También se realizó citología del LCR para analizar el contenido de proteína. Se realizó TC y/o RM para excluir mielopatías compresivas T3-L3, como IVDD Hansen tipo I y tipo II; quistes aracnoideos espinales; lesión traumática; y lesión vascular (embolia fibrocartilaginosa).
Seguido de los resultados negativos de todos los exámenes antes mencionados, todos los perros tuvieron que presentar una prueba genética positiva para la mutación del gen SOD1 exón 2 (genotipo homocigótico DM/DM) del mismo laboratorio (Genevet).®
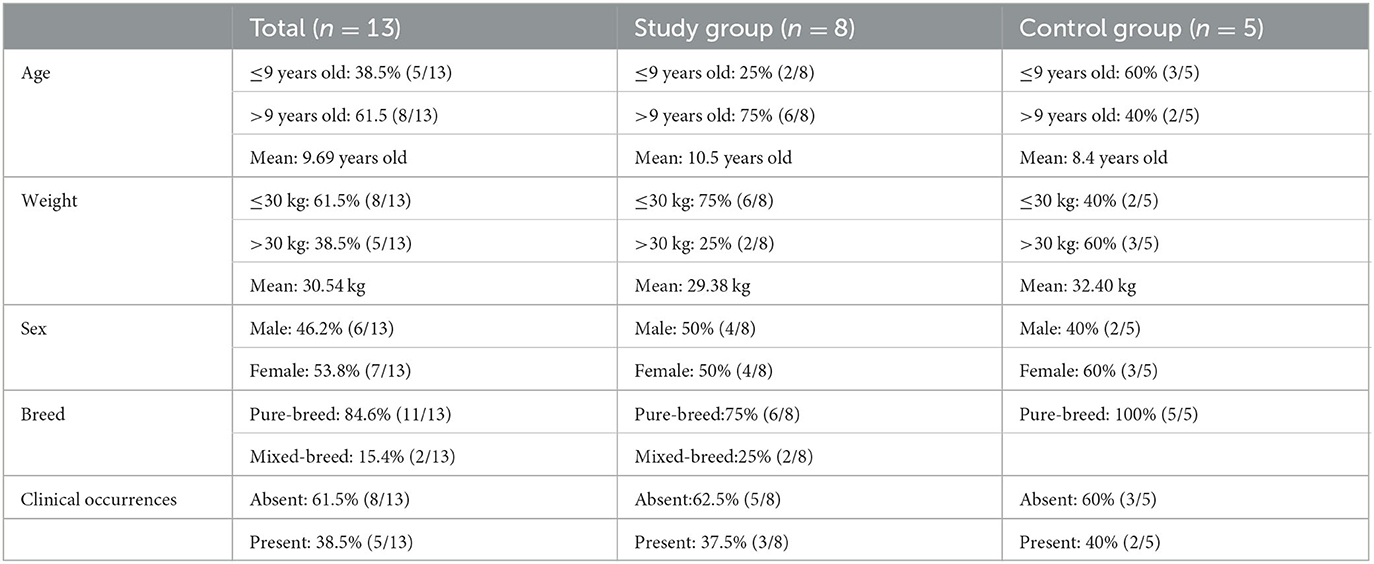
La caracterización muestral de la población en cuanto a edad, sexo, raza, etc., se describe en la Tabla 1.
2.2. Diseño del estudio
Después de la exclusión, 13 perros permanecieron en el estudio independientemente de su edad, peso, sexo, raza y ocurrencias clínicas. Todos fueron sometidos a una consulta de neurorrehabilitación al ingreso y fueron aleatorizados por estratificación de acuerdo con las decisiones de tratamiento de los propietarios. El grupo de estudio incluyó perros cuyos dueños aceptaron el protocolo de neurorrehabilitación intensiva con células madre (INSCP) (n = 8) y el grupo control incluyó perros sometidos a un protocolo de rehabilitación ambulatoria (ARP) (n = 5).
La consulta de admisión y las evaluaciones adicionales a lo largo del estudio fueron grabadas (cámara Canon EOS Rebel T6 1300 D) y realizadas por un examinador e instructor certificado en rehabilitación canina (CCRP), que estaba cegado a la aleatorización y al protocolo implementado. El proceso de aleatorización fue completado por un estudiante de CCRP (D.G.) que implementó el protocolo y trabajó con los perros con el equipo de rehabilitación restante, otro CCRP (A.O.) y otro estudiante de CCRP (C.C.). Un tercio de la PCRC ciega (AC) fue responsable de la evaluación de todas las películas (en cámara regular y lenta), considerando un desacuerdo interobservador <20%.
La consulta de neurorrehabilitación se llevó a cabo en un ambiente controlado y tranquilo, utilizando un fórceps de mosquito Halsted de 12 cm y un martillo Taylor de 18 cm, incluida la evaluación de la marcha (caminata de 6 metros) y la clasificación OFS; estado mental; postura; palpación de la columna vertebral; reacciones posturales; reflejos espinales periféricos (reflejo rotuliano, de abstinencia, cráneo-tibial, extensor cruzado, Babinsky y tronco cutáneo); percepción superficial y profunda del dolor; tono muscular; y rango de movimiento de flexión/extensión de todas las articulaciones para evaluar la rigidez muscular y/o la espasticidad.
Los perros de ambos grupos presentaron OFS 6 o OFS 8, reflejos clónicos rotulianos y cráneo-tibiales, disminución del reflejo de abstinencia en algunos casos pero en otros positivo para el reflejo extensor cruzado, reflejo cutáneo del tronco positivo hasta L5 y percepción positiva del dolor. Todos presentaron hipertonía del grupo músculo extensor de las extremidades posteriores e hipotonía de los músculos isquiotibiales, mostrando también cierto grado de debilidad muscular y atrofia. El algoritmo de estudio representativo se describe en el material suplementario.
2.2.1. INSCP
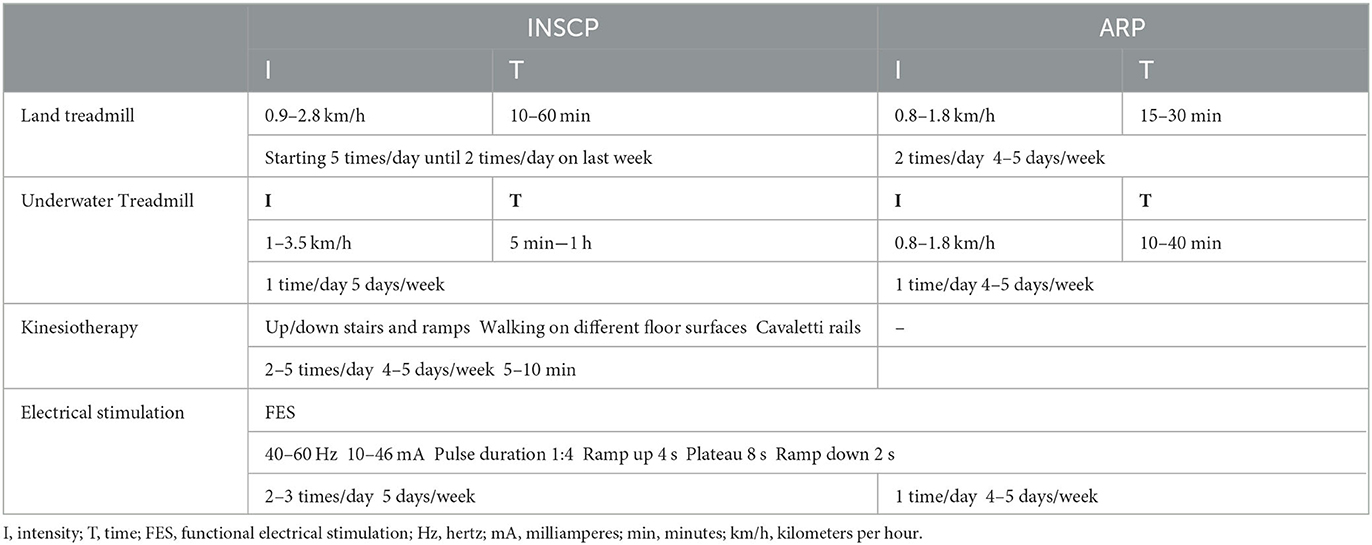
El grupo INSCP incluyó perros que estuvieron bajo régimen de hospitalización durante 2 meses y realizó el siguiente entrenamiento (Tabla 2).
2.2.1.1. Formación locomotora
El entrenamiento locomotor implementado se basó en repeticiones rápidas de ciclo de pasos, siempre aplicadas en un ambiente tranquilo, e idealmente con estimulación musical (66, 67). Debido a la presentación de reflejos clónicos, los movimientos de la bicicleta solo fueron necesarios para modular el ritmo del ciclo de pasos, rara vez requiriendo estimulación de la cola y perineal.
En estos movimientos cíclicos, se debe evitar el estiramiento de las extremidades posteriores, pero con una estimulación vigorosa de los receptores aferentes cutáneos en la superficie de la cinta rodante (68). La implementación temprana del entrenamiento cuadrúpedo está destinada a la estimulación completa.
El entrenamiento en cinta rodante terrestre se inició con 0,9 km/h con el objetivo de alcanzar 2,8 km/h durante 10 min hasta un máximo de 60 min, inicialmente con 5 repeticiones al día en la primera semana, hasta 2 repeticiones en la última semana (Figura 1A). El entrenamiento en cinta rodante bajo el agua se inició al ingreso o al día siguiente, siempre con temperatura del agua cercana a 26°C, comenzando con 5 min hasta alcanzar 1 h, 5 días/semana, y velocidades de 1 km/h hasta 3,5 km/h (Figura 1B), con cuidado de signos de sobreentrenamiento (67) (Tabla 2).
 Figura 1. Entrenamiento locomotor. (A) Entrenamiento en cinta rodante terrestre. (B) Entrenamiento en cinta rodante bajo el agua.
Figura 1. Entrenamiento locomotor. (A) Entrenamiento en cinta rodante terrestre. (B) Entrenamiento en cinta rodante bajo el agua.
Los ejercicios de kinesioterapia también se incluyeron en el protocolo, como subir / bajar escaleras y rampas; en diferentes superficies de piso; y rieles Cavaletti. Estos circuitos se realizaron 2-5 veces / día, 4-5 días / semana durante 5-10 min.
2.2.1.2. Estimulación eléctrica
La estimulación eléctrica funcional consistió en la estimulación nerviosa con un electrodo aplicado en la región anatómica L7-S1 y el otro electrodo en el punto motor muscular del tendón de la corva. Los parámetros fueron 40–60 Hz, 10–36 mA, duración del pulso 1:4, aumento de 4 s, meseta 8 s y rampa de bajada 2 s. Estos se realizaron 2-3 veces / día, 5 días / semana, de acuerdo con la evolución neurológica.
2.2.1.3. Preparación de células madre mesenquimales
La preparación de las terapias basadas en células utilizadas en este estudio clínico siguió una adaptación del protocolo patentado por la Universidad de Oporto (WO2019175773—Composiciones para uso en el tratamiento de afecciones musculoesqueléticas y métodos para producir las mismas aprovechando la actividad sinérgica de dos tipos diferentes de células estromales / madre mesenquimales (Regenera), PCT / IB2019 / 052006) (69). En este estudio se utilizaron MSC de membrana sinovial canina previamente cosechadas, aisladas y caracterizadas (datos aún no publicados) (cSM-MSC). Todas las SM-MSC utilizadas en este estudio se obtuvieron de la membrana sinovial de un perro donante sano y joven y se recolectaron mediante artroscopia. Antes de la cosecha, los propietarios firmaron un consentimiento informado y el animal se sometió a una evaluación médica y ortopédica completa, así como a una detección de enfermedades infecciosas y contagiosas. Después de la recolección de la membrana sinovial, se realizó el aislamiento celular como se describió anteriormente (70). La combinación terapéutica aplicada consistió en la administración de cSM-MSCs alogénicos suspendidos en suero autólogo. La sangre total se recogió previamente de los animales a tratar, en tubos de recolección de sangre seca. Después de la coagulación, los tubos se centrifugaron a 2.300 rpm durante 10 min y su sobrenadante (suero) se aisló y recogió. Luego, el suero se inactivó por inmersión en un baño de agua a 56 ° C durante 20 minutos, seguido de enfriamiento en hielo. Finalmente, el suero se centrifugaba y filtraba utilizando un filtro de jeringa de 0,22 μm y se almacenaba a -20 °C hasta su uso posterior. Para cada administración, ~5 × 10®6 Las cSM-MSC alogénicas criopreservadas de bajo paso (P2) se descongelaron en un baño de agua a 37 °C. Después de la descongelación, el contenido celular se transfirió a un tubo estéril y se diluyó en DPBS estéril y previamente filtrado. La mezcla se centrifugó a 1.600 rpm durante 10 min. Después de la centrifugación, el sobrenadante se eliminó con un solo movimiento, y el pellet celular se resuspendió en ~ 2 ml de suero autólogo previamente descongelado en un baño de agua a 37 ° C. El recuento celular y la viabilidad se determinaron mediante el ensayo de colorante de exclusión Trypan Blue (Invitrogen).TM) utilizando un contador automático (Countess II FL Automated Cell Counter, Thermo Fisher Scientific). El número de células se ajustó a 5 × 106 células/ml. Luego, 2 ml de la solución de cSM-MSCs suspendida en suero autólogo se transfirieron a un vial perforable tapado y se conservaron en hielo hasta el momento de la administración.®
2.2.1.4. Trasplante de células madre mesenquimales
El trasplante de células madre fue realizado el día 30 (T1) por el jefe del departamento de neurología de la Facultad de Medicina Veterinaria de la Universidad de Lisboa (A.F.) y su equipo, de la siguiente manera: acceso vascular y fluidoterapia durante el procedimiento; inducción con propofol (2 mg/kg); intubación endotraqueal y mantenimiento anestésico con isoflurano; tricotomía de la región cervical dorsal y asepsia; trasplante intratecal basado en los puntos de referencia de la prominencia occipital y el proceso espinoso de C2, con una aguja de punta de lápiz de calibre 22 insertada cranealmente en el borde de las alas del atlas, penetrando en el espacio subaracnoideo; extracción de 1 ml de LCR para un tubo estéril; administración de 1 ml de células madre; y posicionamiento vertical del perro durante 10 min.
2.2.2. Protocolo de rehabilitación ambulatoria
El grupo de protocolo de rehabilitación ambulatoria estaba bajo un régimen ambulatorio, 4-5 veces por semana. Este protocolo se basó en el entrenamiento locomotor y la estimulación eléctrica con pocas alteraciones (Tabla 2). Además, no hubo administración de MSC en estos perros.
2.2.2.1. Formación locomotora
La principal diferencia en el entrenamiento locomotor fue la frecuencia. Los perros del grupo ARP solo realizaron dos repeticiones durante 15-30 minutos de entrenamiento en cinta rodante terrestre para la sesión. En cuanto a la cinta de correr bajo el agua, se realizó una vez durante 10-40 min. Ambos entrenamientos tuvieron velocidades de 0.8-1.8 km / h, de acuerdo con la tolerancia de cada perro, y las sesiones se realizaron de 4 a 5 días / semana.
2.2.2.2. Estimulación eléctrica
En cuanto a la estimulación eléctrica funcional, el protocolo fue el mismo para ambos grupos; sin embargo, el grupo ARP solo tuvo una repetición en cada sesión, 4-5 días / semana.
2.3. Resultados y seguimiento
Los perros de ambos grupos fueron admitidos (T0) y evaluados de acuerdo con su estado neurológico y clasificados con la OFS. Los perros INSCP fueron hospitalizados en el centro de rehabilitación y después del primer mes de rehabilitación intensiva (T1), fueron sometidos a trasplante de células madre en el día 30 (T1), seguido del segundo mes de rehabilitación (T2) y alta médica al final. Los perros ARP estuvieron bajo sesiones ambulatorias de rehabilitación durante los mismos 2 meses.
Los perros de ambos grupos fueron evaluados al final del día 30 (T1) y el día 60 (T2). Los seguimientos se realizaron y registraron 1 mes después del alta médica (1FU) y el último seguimiento fue de acuerdo con cada perro, como se presenta en la Figura 2.
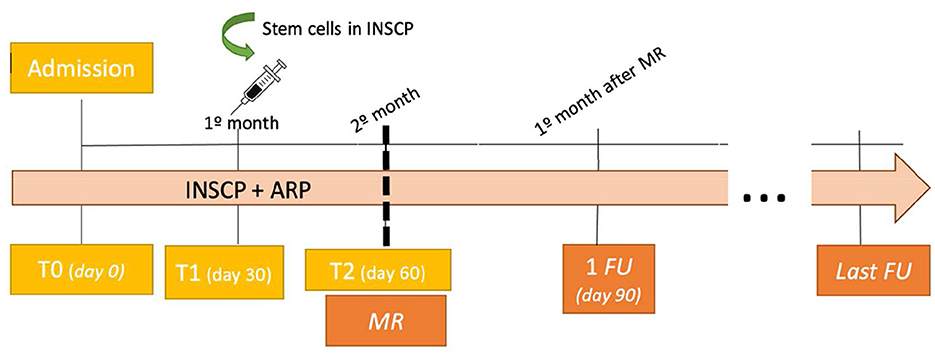 Figura 2. Resultados y algoritmo de monitorización (n = 13). INSCP, protocolo intensivo de neurorrehabilitación con células madre; ARP: protocolo de rehabilitación ambulatoria; MR: alta médica; FU, seguimiento.
Figura 2. Resultados y algoritmo de monitorización (n = 13). INSCP, protocolo intensivo de neurorrehabilitación con células madre; ARP: protocolo de rehabilitación ambulatoria; MR: alta médica; FU, seguimiento.
2.4. Análisis estadístico
Los registros se documentaron utilizando Microsoft Office Excel 365 (Microsoft Corporation, Redmond, WA, EUA) y se procesaron en el software IBM SPSS Statistics 25 (International Business Machines Corporation, Armonk, NY, USA). Se registraron la prueba de normalidad de Shapiro-Wilk, las medias aritméticas, el mínimo, el máximo, la desviación estándar (DE) y el error estándar de la media (SEM) para las variables continuas edad y peso. Se realizó estadística descriptiva con análisis de frecuencia para todas las variables nominales categóricas. También se realizaron pruebas de Chi-cuadrado para verificar analogías relevantes probadas por un valor p de <0,05. Se utilizó una prueba t de muestra para la comparación con estudios publicados anteriormente. Las medias marginales estimadas para la comparación en cada punto de tiempo con respecto a las puntuaciones OFS y el tiempo de supervivencia se realizaron mediante Análisis de Varianza (ANOVA unidireccional) para medidas repetidas y la prueba HSD post-Tukey. Además, se realizó el análisis de supervivencia de Kaplan-Meier.®®
3. Resultados
En este estudio clínico prospectivo de cohorte controlada ciega, de los 13 perros homocigóticos con DM, la variable cualitativa binominal sexo presentó 53,8% (7/13) de hembras y 46,2% (6/13) de perros machos. Para la variable binominal raza, se observó que el 15,4% (2/13) eran perros mestizos y el 84,6% (11/13) eran perros de raza pura, incluyendo los pastores alemanes (n = 7) como los más prevalentes, seguidos por el Collie (n = 1), Alaskan Malamute (n = 1), Weimaraner (n = 1) y Setter (n = 1).
El análisis descriptivo de las variables cuantitativas continuas para edad y peso es reportado en el material suplementario, con un promedio de 9,69 años y 30,54 kg, y una distribución normal verificada por la Prueba de Normalidad de Shapiro-Wilk (n < 50) para la edad (p = 0,684) y el peso (p = 0,233).
Las ocurrencias clínicas estuvieron ausentes en el 61,5% (8/13) y presentes en el 38,5% (5/13), de las cuales tres pertenecían al grupo estudio y dos al grupo control.
Los resultados de la OFS se documentaron para los grupos de INSCP y ARP, en cada punto temporal (T0, T1, T2, 1FU y Última FU), y se consideró la deambulación cuando la OFS ≥ 11, como se muestra en la Figura 3. En cuanto a la clasificación OFS, el desacuerdo entre observadores fue del 11%.
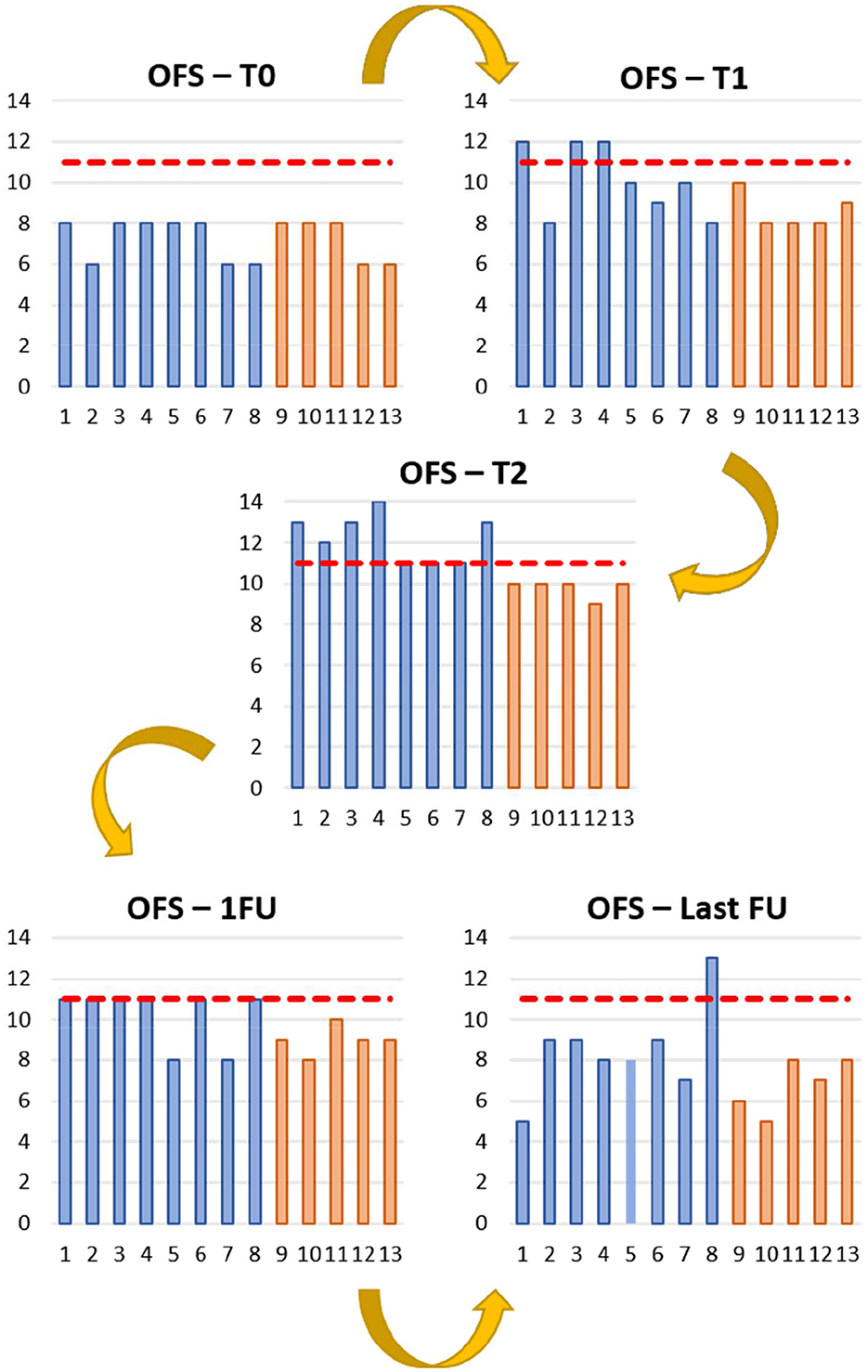 Figura 3. Informes de puntuación de campo abierto (OFS) de los grupos de estudio (azul) y control (naranja) durante los diferentes puntos temporales. T0 (día 0); T1 (día 30); T2 (día 60); 1FU (día 90); Último FU (último seguimiento). Eje Y: OFS; Eje X: Perros 1 a 13; — OFS 11.
Figura 3. Informes de puntuación de campo abierto (OFS) de los grupos de estudio (azul) y control (naranja) durante los diferentes puntos temporales. T0 (día 0); T1 (día 30); T2 (día 60); 1FU (día 90); Último FU (último seguimiento). Eje Y: OFS; Eje X: Perros 1 a 13; — OFS 11.
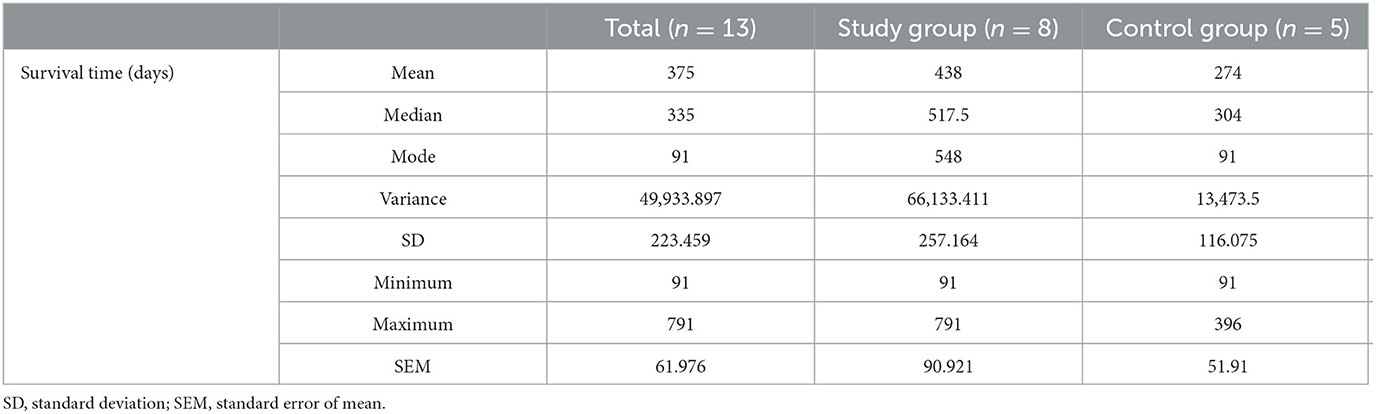
En el presente estudio, se obtuvo un tiempo de supervivencia promedio total de 375 días, siendo el grupo INSCP presentando un tiempo promedio de supervivencia de 438 días en comparación con 274 días para el grupo ARP, como se muestra en la Tabla 3 y la Figura 4A. Los días mínimos de supervivencia para cada grupo fueron de 91 días, aunque el grupo INSCP presentó un máximo de 791 días en comparación con 396 días para el grupo ARP. Comparando ambos grupos según el tiempo de supervivencia, las diferencias también se demostraron mediante el análisis de supervivencia (Kaplan-Meier), como se muestra en la Figura 4B.
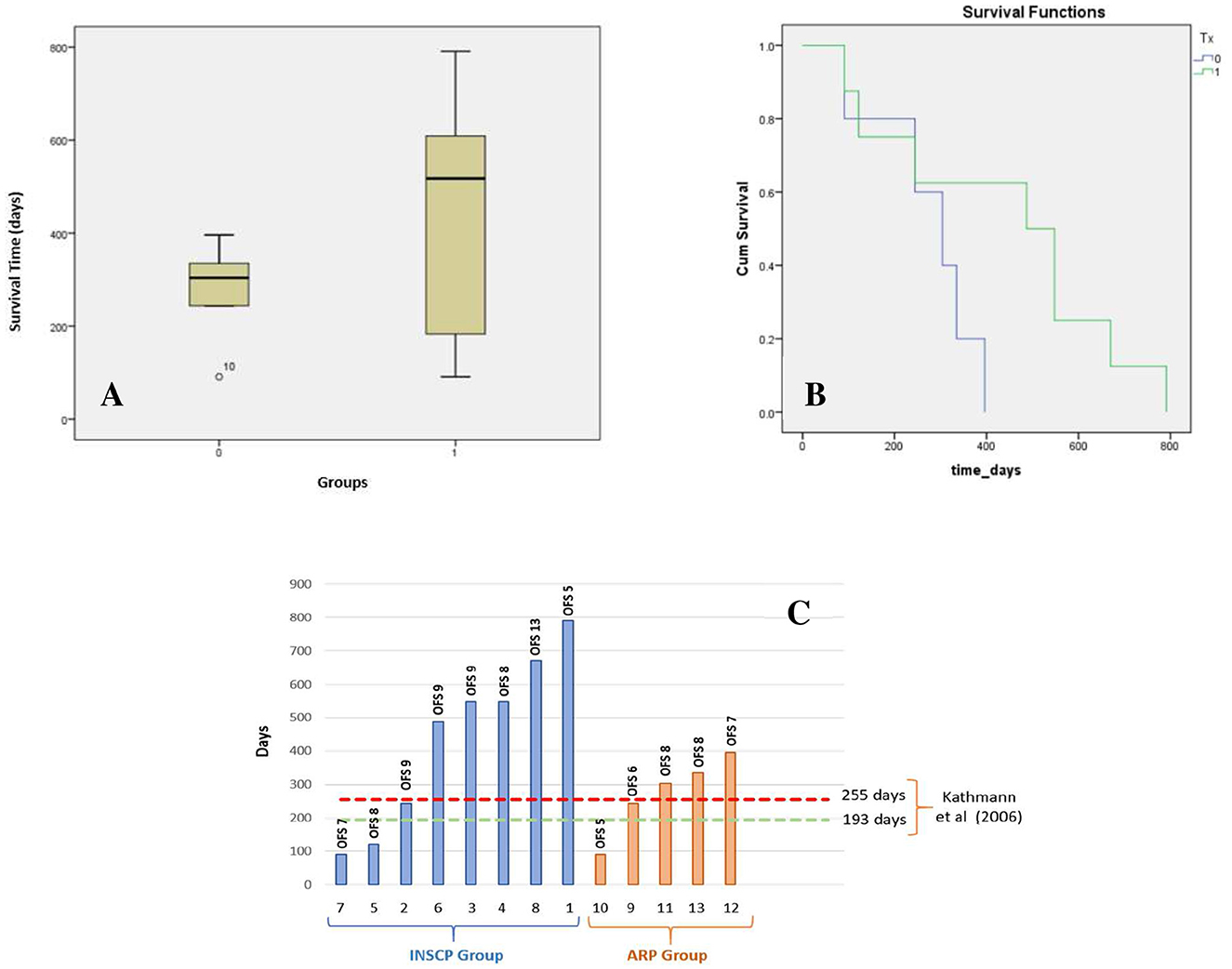 Figura 4. Tiempo de supervivencia de la población del estudio. (A) Diagrama de caja de tiempo de supervivencia (días) para los grupos INSCP (1) y ARP (0); Eje X: grupos (INSCP y ARP); Eje Y: tiempo de supervivencia (días). (B) análisis de supervivencia de Kaplan-Meier; eje y: supervivencia acumulativa (Cum); Eje X: tiempo de supervivencia (días) del grupo INSCP (verde) y del grupo ARP (azul). (C) Tiempo de supervivencia de los grupos INSCP y ARP con puntaje de campo abierto (OFS) para cada perro en el último seguimiento y comparación con Kathmann et al. (6); Eje Y: días; Eje X: perros del grupo INSCP (azul) y del grupo ARP (naranja).
Figura 4. Tiempo de supervivencia de la población del estudio. (A) Diagrama de caja de tiempo de supervivencia (días) para los grupos INSCP (1) y ARP (0); Eje X: grupos (INSCP y ARP); Eje Y: tiempo de supervivencia (días). (B) análisis de supervivencia de Kaplan-Meier; eje y: supervivencia acumulativa (Cum); Eje X: tiempo de supervivencia (días) del grupo INSCP (verde) y del grupo ARP (azul). (C) Tiempo de supervivencia de los grupos INSCP y ARP con puntaje de campo abierto (OFS) para cada perro en el último seguimiento y comparación con Kathmann et al. (6); Eje Y: días; Eje X: perros del grupo INSCP (azul) y del grupo ARP (naranja).
Por las pruebas de Chi-cuadrado, la edad [X2(1,n = 13)�(1,n = 13)2 = 0,008, p = 0,928], peso [X2(1,n = 13)�(1,n = 13)2 = 1,593, p = 0,207], y sexo [X2(1,n = 13)�(1,n = 13)2 = 0,124, p = 0,725] no mostraron interferencia en el tiempo de supervivencia.
Kathmann et al. (6) demostraron un tiempo medio de supervivencia de 255 días para nueve perros y 130 días para seis perros, considerando fisioterapia intensiva y moderada, respectivamente. El presente estudio informó el tiempo de supervivencia (días) para cada perro de ambos grupos y los resultados de la OFS en el último seguimiento. Esta comparación se presenta en la Figura 4C.
Al comparar la fisioterapia intensiva y moderada de Kathmann et al. (6) (tiempo medio de supervivencia 193 días) con el presente estudio (n = 13), significación en la prueba t de una muestra [t(12) = 2,932, p = 0,013]. Aunque, al considerar el grupo INSCP (n = 8) con el grupo de fisioterapia intensiva (n = 9) de Kathmann et al. (6), con un tiempo medio de supervivencia de 255 días, no se observó significación [t(7) = 2,009, p = 0,085].
Considerando la OFS del grupo INSCP y el grupo ARP, una significación [F(1,64) = 7,490, p = 0,008] entre ellos por el ANOVA unidireccional se detectó, así como una significación [t(63) = −2,737, p = 0,008] por la prueba t de la muestra independiente. Este hallazgo también pudo verificarse en el gráfico de evolución de las medias marginales estimadas de la OFS (Figura 5).
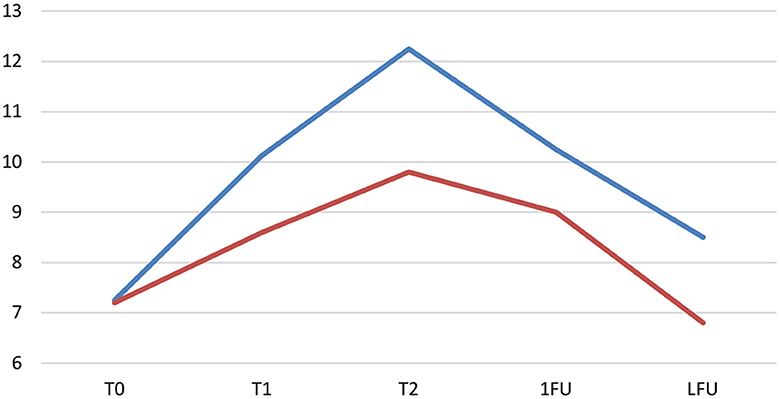 Figura 5. Evolución de la puntuación de campo abierto (OFS): medias marginales estimadas tanto en el grupo INSCP (azul) como en el grupo ARP (naranja). Eje Y: OFS; Eje X: T0 (día 0); T1 (día 30); T2 (día 60); 1FU (día 90); LFU, último seguimiento.
Figura 5. Evolución de la puntuación de campo abierto (OFS): medias marginales estimadas tanto en el grupo INSCP (azul) como en el grupo ARP (naranja). Eje Y: OFS; Eje X: T0 (día 0); T1 (día 30); T2 (día 60); 1FU (día 90); LFU, último seguimiento.
Para el grupo INSCP, con respecto a la evolución de la OFS para cada punto de tiempo, una diferencia significativa [F(4,64) = 14,287, p ≤ 0,001]. La prueba post-Tukey HSD se realizó entre puntos temporales y mostró que desde T0 hasta el primer seguimiento, siempre se demostraron significaciones (p = 0,003 con T1; p ≤ 0,001 con T2 y p = 0,001 con 1FU). Considerando T1 hasta T2 (1 mes después del trasplante de células madre), los resultados mostraron significancia (p = 0,039), y, también, desde T2 hasta el último seguimiento de cada perro (p ≤ 0,001), se observó una curva descendente consistente, como se muestra en la Figura 5.
4. Discusión
La distribución en cuanto al sexo fue mayor para las perras con 53,8% (7/13), coincidiendo con Coates et al. (1) quienes reportaron un total de 21 perros con cinco machos y 16 hembras. Además, se observó una prevalencia similar en un estudio de March et al. (15) con 18 perros, cuatro machos y 14 hembras. Sin embargo, muchos autores se refirieron a la ausencia de predisposición sexual en la DM (3, 8).
En cuanto a la predisposición a la raza, que ya está indicada en la literatura (3), el pastor alemán tuvo la mayor prevalencia con 53,8% (7/13), lo que concuerda con la mayoría de las investigaciones sobre DM (9, 12, 71-73). Aunque el diagnóstico histológico se describe como un mero 0,19%, este porcentaje aumenta drásticamente hasta el 2,01% en el pastor alemán (1). En 2018, Donner et al. (74) estudiaron la frecuencia y distribución de enfermedades genéticas en perros de razas mixtas y puras, señalando a la DM como el número uno de los rankings. Sin embargo, no se puede ignorar la compleja etiología de esta enfermedad, como los efectos inmunológicos (75), metabólicos, nutricionales (76, 77), oxidativos (1) y excitotóxicos (78).
La edad promedio de aparición de los signos clínicos fue de 9,69 años, similar a los reportados en la literatura (3, 7). En contraste, el peso medio tuvo una alta variabilidad entre los estudios según las razas más representadas. Por ejemplo, un estudio en Pembroke Welsh Corgi reportó un promedio de 11 kg (1, 17), mucho más bajo que los 30.54 kg de este estudio. Otros estudios con razas más grandes presentaron pesos medios >25 kg, como Polizopolou et al. (31) y Johnston et al. (72).
Los 13 perros que fueron aleatorizados para el grupo INSCP y el grupo ARP según la decisión de tratamiento del propietario presentaron una distribución normal por el Shapiro-Wilk Normality Test para edad (p = 0,684) y peso (p = 0,233) y fueron comparados en el estudio. Del total de estos perros, y en ambos grupos, casi el 60% no presentó ningún tipo de ocurrencia clínica, probablemente debido a los criterios de inclusión (paraparesia no ambulatoria OFS 6 u 8).
Durante los tiempos de evaluación (T0, T1 y T2) y el primer seguimiento, se observó un aumento de OFS ≥11 en la mayoría de los perros del grupo INSCP, indicando deambulación (79) y reportado para cada punto de tiempo con significación (p ≤ 0,001). Esto también fue apoyado por la prueba post-Hukey, con significaciones siempre presentes entre T0 y 1FU (p = 0,003 con T1; p ≤ 0,001 con T2 y p = 0,001 con 1FU). Aunque, todos los perros en ambos grupos parecieron tener una mejoría con respecto a su estado sensoriomotor hasta el primer seguimiento (1FU).
Este aumento del estado neurológico entre T0 y T1 se debió principalmente a la asociación entre el entrenamiento locomotor con las modalidades de estimulación eléctrica, como se esperaba y ya mencionado por Kathmann et al. (80) y Miller et al. (81). Estos son conceptos de neurorrehabilitación (82), que permiten el control neural del movimiento después de cambiar las entradas sensoriales (83) mediante el trabajo de la capacidad intrínseca de generar movimientos rítmicos (84).
El entrenamiento locomotor ayuda a reaprender el paso con un patrón de deambulación coordinado y modulado (57, 67) basado en una interacción dinámica entre las entradas aferentes para todos los receptores funcionales (por ejemplo, propioceptivo y biomecánico) (85, 86). Esto se puede aplicar a través del entrenamiento en cinta rodante con soporte de peso corporal (BWSTT), que ayuda a reducir la espasticidad al reemplazar el disparo sensorial hiperexcitable anormal con señalización funcional, disminuyendo el espasmo / contracción muscular (87, 88) y mejorando la coordinación y la deambulación (89), esencial para los perros con DM afectados con signos UMN, por ejemplo, reflejos clónicos.
Una de las estrategias de entrenamiento locomotor reside en la estimulación de las neuronas propioespinales descendentes, esenciales para activar las redes neuronales que conducen a la recuperación gradual (90, 91).
Además, FES estimula el reclutamiento antinatural de fibras musculares al involucrar neuronas motoras de gran diámetro que tienen fibras de velocidad de conducción rápida, en lugar de reclutar neuronas motoras de diámetro pequeño, que son más lentas y resistentes a la fatiga (92). Se ha informado que esta modalidad modula los circuitos neuronales (93, 94) y permite ciclos repetitivos de entradas/salidas, suprimiendo la sinaptogénesis aferente excesiva y mejorando los circuitos neuronales restantes (95).
Los perros DM presentan cambios en las miofibras y los tejidos conectivos que pueden alterar las propiedades eléctricas, con disminución progresiva del tamaño de las miofibras y aumento de la grasa y el tejido conectivo que pueden aumentar la resistencia (96). En la etapa temprana de la DM, los perros se caracterizan por atrofia por desuso (3, 97), pero en la DM tardía, comienzan los signos de las neuronas motoras inferiores, como la atrofia neurogénica. Esto es siempre con una localización caudodistal asociada a atrofia secundaria a axonopatía distal (25, 96), con perfiles de mielina reemplazados por grandes áreas de astrogliosis (9, 13, 72, 98).
En las Figuras 3, 5, los resultados más altos de OFS fueron de T1 a T2 principalmente en el grupo INSCP, con una marcada significación entre los grupos (p = 0,039). Así, después del trasplante intratecal (IT) de células madre, lo que resulta en una distribución celular indirecta a través del sistema nervioso central (SNC) por el LCR (99). Esta técnica pretende evitar el efecto pulmonar de «primer paso» y el atrapamiento celular, limitando su efecto terapéutico (100, 101). Además, evita la barrera hematoencefálica, permitiendo enfocar los efectos tróficos de las células directamente en el SNC (99, 102, 103).
Las MSC aplicadas fueron células mesenquimales derivadas de la membrana sinovial. Las MSC pueden promover la supervivencia celular y la reparación de tejidos al aumentar la secreción paracrina de factores neurotróficos y angiogénicos (104-106), como el factor neurotrófico derivado del cerebro (BDNF), el factor neurotrófico ciliar (CNTF) (107, 108), la neurotrofina-1 (NT-1), la neurotrofina-3 (NT-3), el factor de crecimiento nervioso (NGF), el factor de crecimiento de fibroblastos (FGF) y el factor neurotrófico derivado de células gliales (GDNF) (109-114). Todos estos apoyan la neurogénesis, el crecimiento axonal, la remielinización y el metabolismo celular (114-119), contribuyendo también a la capacidad de reclutar precursores de oligodendrocitos (41). Recientemente, los efectos terapéuticos y también el potencial inmunomodulador de SM-MSCs se demostraron después de la aplicación en perros en Medicina Veterinaria y después de una caracterización preliminar de su secretoma (70).
En este estudio clínico prospectivo de cohorte cegada controlada, el tiempo medio de supervivencia fue de 375 días en la población total, con el grupo INSCP teniendo 438 días en comparación con el grupo ARP con 274 días. En el grupo INSCP hubo una supervivencia máxima de 791 días (Tabla 3), que se puede observar en el diagrama de caja de tiempo de supervivencia (Figura 4A) y en el análisis de supervivencia de Kaplan-Meier (Figura 4B).
Por lo tanto, la principal diferencia puede estar relacionada con el trasplante de MSCs en el grupo INSCP, además de la neurorrehabilitación intensiva. Las MSCs potencian la expresión de acuaporina 1 y CXCR4, dos proteínas de membrana implicadas en la migración celular, que ayudan en los mecanismos de «homing» (114), potenciados por la posición vertical del perro durante 10 min que se incluyó después de esta técnica de trasplante de células madre.
Como se explicó anteriormente y considerando el diseño del estudio, la selección de ambos grupos fue de acuerdo con la decisión de tratamiento de los propietarios. Aunque no hubo evidencia clara del papel exclusivo de las MSC dadas las diferencias de ambos protocolos e incluso si la neurorrehabilitación intensiva demostró tener siempre una ligera mejoría en comparación con la ARP, se observó una progresión positiva evidente después del trasplante (T1), con todos los perros del INSCP logrando la deambulación en este período (Figura 3). Es la opinión de los autores que estos resultados no solo se debieron al mismo entrenamiento intensivo aplicado hasta el alta, lo que sugiere que también fue la combinación del protocolo intensivo de neurorrehabilitación con el trasplante de MSCs lo que permitió esta evolución.
La DM implica la degeneración walleriana que causa fragmentación de los axones dañados, generando desechos y deposición extracelular de moléculas relacionadas con la mielina con proteoglicanos de sulfato de condroitina que inhiben la regeneración neural y la neuroplasticidad a largo plazo. Para retrasar esta progresión degenerativa de la enfermedad, se informa el papel de GDNF (120), posiblemente contribuyendo al aumento de la longitud de las dendritas, el número de dendritas o una combinación de ambas. Por lo tanto, con el objetivo de lograr la potenciación a largo plazo debido al tejido restante reactivable (95).
La comparación de la población total (n = 13) con la literatura previa (6) considerando perros sometidos a fisioterapia moderada o intensiva (n = 15), por la prueba t de una muestra, reveló una diferencia significativa (p = 0,013), como se puede ver en la Figura 4C con solo tres perros (dos del INSCP y uno del ARP) logrando una tasa de supervivencia inferior a los 193 días reportados por Kathmann et al. (6).
El tiempo medio de supervivencia se compara entre el grupo de fisioterapia intensiva del estudio mencionado (255 días) y nuestro grupo INSCP (438 días). Aunque se observó un aumento de casi el 70%, no se obtuvo significación. Por lo tanto, los autores creen que la rehabilitación intensiva es el mínimo necesario que estos perros necesitan para aumentar su tiempo de supervivencia como ya se ha demostrado, pero el trasplante de células madre puede retrasar la progresión y aumentar el tiempo de supervivencia. Sin embargo, no hay suficientes datos, y la investigación debe continuar.
Al comparar los resultados de OFS entre los grupos INSCP y ARP (ANOVA unidireccional y prueba t de muestras independientes), también hubo una clara diferencia significativa. La Figura 5 demuestra esta disparidad en relación con las medias marginales estimadas en cada momento del estudio. En la misma figura, hay una disminución significativa desde el alta médica hasta el último seguimiento, justificada por la naturaleza degenerativa y progresiva de la enfermedad, donde las células gliales juegan un papel crítico en la patogénesis de este tipo de enfermedades neurodegenerativas, como la ELA (121-123). Pocos estudios también informan la importancia del aumento de las células gliales y las moléculas inflamatorias, parcialmente responsables de la progresión de la enfermedad (15, 124, 125).
En un futuro próximo, sería de gran interés tener una prueba rápida y factible para evaluar la proteína fosforilada de subunidad pesada de neurofilamentos (pNF-H), un componente estructural importante de los axones mielinizados grandes, que podría ser útil para medir el daño axonal (23, 126-128).
La principal causa de muerte fue la eutanasia por progresión de la DM con 69,2% (9/13). La eutanasia se realizó después del último seguimiento de cada perro solo si presentaban los siguientes signos clínicos: debilidad toracolumbar; atrofia de la masa muscular de las extremidades posteriores; disminución de los reflejos espinales de las extremidades posteriores y del reflejo cutáneo del tronco; disminución del tono muscular abdominal; y disminución del equilibrio del trunci.
El 30,8% restante (4/13) falleció por causas médicas internas, todas pertenecientes al grupo INSCP. De estos, tres perros tenían síndrome cardiorrenal secundario a miocardiopatía dilatada (con un tiempo de supervivencia de 244, 487 y 670 días) y un perro era secundario a neoplasia esplénica (con un tiempo de supervivencia de 781 días). El único perro que murió de miocardiopatía dilatada tuvo un examen histopatológico positivo para mielopatía degenerativa (Informe de necropsia N° 40/20).
Para la neurorrehabilitación en perros con DM, es importante para la noción de astrogliosis, que ocurre principalmente en la región del asta dorsal, que da lugar a los tractos espinocerebelosos dorsales (72). En esta enfermedad, la lesión se centrará en el funículo dorsal, incluidos los tractos ascendentes y descendentes dentro de la porción dorsal del funículo lateral y las vías ascendentes dentro del funículo dorsal (3, 25). Esto puede explicar la pérdida constante de propiocepción, lo que lleva a la necesidad de entrenamiento locomotor y asociación con ejercicios de kinesioterapia (por ejemplo, alternancia de niveles de agua, cinta de correr hacia atrás y ejercicios en el hogar). En este estudio después de T2, todos los perros solo fueron estimulados por ejercicios en el hogar 3 veces / día, como caminar por lixiviación (15 min), rieles de cavaletti (2 min), escaleras (2 min), rampas (2 min) y ejercicios de desequilibrio propioceptivo (5 min).
Por lo tanto, estos resultados están de acuerdo con la literatura previa y sugieren que la combinación del trasplante de AD-MSCs con protocolos intensivos de neurorrehabilitación puede proporcionar una mejora funcional (129) sin efectos secundarios relacionados a largo plazo (130, 131). La misma asociación ya se aplicó en pacientes con ELA (120, 131), lo que resultó en un enfoque seguro y factible (132, 133).
Es posible concluir que este INCSP puede ser una opción para una progresión larga de perros DM con calidad de vida y sin sufrimiento. En opinión del autor, su implementación debe ser lo más temprana posible y no en la etapa tardía de DM.
Las limitaciones de este estudio fueron el pequeño tamaño de la muestra y el proceso de aleatorización basado en el consentimiento del propietario. Además, solo hubo un caso con un diagnóstico histológico definitivo, falta de biomarcadores y ausencia de neurorrehabilitación intensiva después del alta médica.
Declaración de disponibilidad de datos
Los datos brutos que apoyan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue revisado y aprobado por CEBEA-Comissão de Ética e Bem-estar Animal da Universidade Lusófona (Facultad de Medicina Veterinaria de Lusófona, Lisboa, Portugal, No. 113-2021). Se obtuvo el consentimiento informado por escrito de los tutores para la participación de sus animales en este estudio.
Contribuciones del autor
Todos los autores enumerados han hecho una contribución sustancial, directa e intelectual al trabajo y lo aprobaron para su publicación.
Financiación
RA reconoce al Centro de Estudos de Ciência Animal (CECA), Instituto de Ciências, Tecnologias e Agroambiente (ICETA), Universidad de Porto (UP) y Fundação para a Ciência e Tecnologia (FCT) por la financiación y disponibilidad de todos los recursos técnicos, estructurales y humanos necesarios para el desarrollo de este estudio. Este estudio fue apoyado a través del proyecto UIDB/00211/2020 financiado por FCT/MCTES a través de fondos nacionales. Los autores agradecen a FCT por financiar el proyecto 2022.04501.PTDC (Olfabionerve—Olfactory Mucosa Mesenchymal Stem Cells and Biomaterials Promoting Peripheral Nerve Regeneration) y las becas de doctorado AS (SFRH/BD/146689/2019) BL (2021.05265.BD). PS agradece al Instituto Politécnico de Leiria-Centro para el Desarrollo Rápido y Sostenible de Productos (CDRSP), Universidad de Oporto (UP), Centro de Estudios de Ciencia Animal (CECA) e Instituto de Ciencias, Tecnologías y Agroambiente (ICETA) por la financiación (UIDB/04044/2020) y la disponibilidad de todos los recursos necesarios para este estudio. Amo agradece el apoyo financiero del proyecto H2Cure—Desenvolvimento de formulações de géis e pensos de Mel, Goma Gelana e Ácido Hialurónico para tratamento de feridas—POCI-01-0247-FEDER-047032. Aco agradece el apoyo financiero del proyecto PRECOGFIL—Filamentos dentados pre-tensionados para correção transvaginal do prolapso do compartimento anterior e posterior—PTDC/EMD-EMD/2229/2020.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1192744/full#supplementary-material
Referencias
1. Coates JR, March PA, Oglesbee M, Ruaux CG, Olby NJ, Berghaus RD, et al. Caracterización clínica de una mielopatía degenerativa familiar en Pembroke Welsh Corgi Dogs. J Vet Pasante Med. (2007) 21:1323–31. doi: 10.1111/j.1939-1676.2007.tb01955.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Guzzi RF, Formenton MR, Colombia KP, Veras M, Guilherme Joaquim JF, Fantoni DT. Mielopatia Degenerativa Em Cães: Um Desafio Na Medicina Veterinária E Na Reabilitação Animal. Rev Unimar Ciênc. (2014) 23, 11–16.
3. Coates JR, Wininger FA. Mielopatía degenerativa canina. Veterinario Clin N am Small Anim Pract. (2010) 40:929–50. doi: 10.1016/j.cvsm.2010.05.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Neeves J, Granger N. Una actualización sobre la mielopatía degenerativa en perros. Comp Anim. (2015) 20:408–12. doi: 10.12968/coan.2015.20.7.408
5. Awano T, Johnson GS, Wade CM, Katz ML, Johnson GC, Taylor JF, et al. El análisis de asociación de todo el genoma revela una mutación SOD1 en la mielopatía degenerativa canina que se asemeja a la esclerosis lateral amiotrófica. Proc Natl Acad Sci USA. (2009) 106:2794–9. DOI: 10.1073/PNAS.0812297106
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Kathmann I, Cizinauskas S, Doherr MG, Steffen F, Jaggy A. La fisioterapia controlada diaria aumenta el tiempo de supervivencia en perros con sospecha de mielopatía degenerativa. J Vet Pasante Med. (2006) 20:927–32. doi: 10.1111/j.1939-1676.2006.tb01807.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Zeng R, Coates JR, Johnson GC, Hansen L, Awano T, Kolicheski A, et al. Distribución de la raza de alelos SOD1 previamente asociados con mielopatía degenerativa canina. J Vet Pasante Med. (2014) 28:515–21. DOI: 10.1111/JVIM.12317
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Dewey CW, da Costa RC. «Mielopatías: trastornos de la médula espinal» en Dewey CW, da Costa Rc, editores. Guía práctica de neurología canina y felina, 3ª ed. Ames IA: Willey Blackwell (2016). págs. 353–356.
9. Averill DR. Mielopatía degenerativa en el perro pastor alemán envejecido: hallazgos clínicos y patológicos. J Am Vet Med Assoc. (1973) 162:1045–51.
10. Bichsel P, Vandevelde M, Lang J, Kull-Hächler S. Mielopatía degenerativa en una familia de perros husky siberianos. J Am Vet Med Assoc. (1983) 183:998–1000.
11. Matthews NS, de Lahunta A. Mielopatía degenerativa en un caniche miniatura adulto. J Am Vet Med Assoc. (1985) 186:1213–5.
12. Awano T, Johnson GS, Wade CM, Katz ML, Johnson GC, Taylor JF, et al. Mielopatía degenerativa en perros perdigueros de Chesapeake Bay. J Vet Pasante Med. (2009) 23:401–2.
13. Miller AD, Barber R, Porter BF, Peters RM, Kent M, Platt SR, et al. Comunicación breve: mielopatía degenerativa en dos perros boxer. Veterinario Pathol. (2009) 46:684–7. doi: 10.1354/vp.08-VP-0270-M-BC
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Zeiler GE, van der Zwan H, Oosthuizen MC. Pruebas genéticas de mielopatía degenerativa canina en la población sudafricana de perros boxer. J S Afr Vet Assoc. (2013) 84:1–5. doi: 10.4102/jsava.v84i1.1005
15. PA de marzo, Coates JR, Abyad RJ, Williams DA, O’Brien DP, Olby NJ, et al. Mielopatía degenerativa en 18 perros Pembroke Welsh Corgi. Veterinario Pathol. (2009) 46:241–50. DOI: 10.1354/VP.46-2-241
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Ogawa M, Uchida K, Park E-S, Kamishina H, Sasaki J, Chang H-S, et al. Observación inmunohistoquímica de mielopatía degenerativa canina en dos perros Pembroke Welsh Corgi. J Vet Med Sci. (2011) 73:1275–9. DOI: 10.1292/JVMS.11-0097
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Ogawa M, Uchida K, Yamato O, Inaba M, Uddin MM, Nakayama H. Pérdida neuronal y disminución de la expresión de GLT-1 observada en la médula espinal de perros Pembroke Welsh Corgi con mielopatía degenerativa canina. Veterinario Pathol. (2014) 51:591–602. doi: 10.1177/0300985813495899
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Mandrioli L, Gandini G, Gentilini F, Chiocchetti R, Turba ME, Avallone G, et al. Mielopatía degenerativa en perros hovawart: caracterización molecular, características patológicas y acumulación de proteína superóxido dismutasa 1 mutante. J Comp Pathol. (2021) 182:37–42. doi: 10.1016/j.jcpa.2020.11.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Crisp MJ, Beckett J, Coates JR, Miller TM. Mielopatía degenerativa canina: caracterización bioquímica de la superóxido dismutasa 1 en el primer modelo natural de esclerosis lateral amiotrófica no humana. Exp Neurol. (2013) 248:1–9. doi: 10.1016/j.expneurol.2013.05.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Nagai M, Aoki M, Miyoshi I, Kato M, Pasinelli P, Kasai N, et al. Ratas que expresan transgenes citosólicos humanos de superóxido dismutasa de cobre-zinc con esclerosis lateral amiotrófica: las mutaciones asociadas desarrollan enfermedad de la neurona motora. J Neurosci. (2001) 21:9246–54. doi: 10.1523/JNEUROSCI.21-23-09246.2001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Rothstein JD. Hipótesis actuales para la biología subyacente de la esclerosis lateral amiotrófica. Ana Neurol. (2009) 65:53–4. DOI: 10.1002/ANA.21543
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Cooper JJ, Young BD. 4th JFG, Fosgate GT y Levine JM. (2014). Comparación entre la tomografía computarizada sin contraste y la resonancia magnética para la detección y caracterización de la mielopatía toracolumbar causada por hernia de disco intervertebral en perros. Veterinario Radiol. Ultrasonido. 55, 182–189. doi: 10.1111/vru.12114
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Toedebusch CM, Bachrach MD, Garcia VB, Johnson GC, Katz ML, Shaw G, et al. Niveles de líquido cefalorraquídeo de neurofilamento fosforilado pesado como marcador diagnóstico de mielopatía degenerativa canina. J Vet Pasante Med. (2017) 31:513–20. DOI: 10.1111/JVIM.14659
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Vu LT, Bowser, R. Biomarcadores basados en fluidos para la esclerosis lateral amiotrófica. Neuroterapéutica. (2017) 14:119–34. DOI: 10.1007/S13311-016-0503-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Nardone R, Höller Y, Taylor AC, Lochner P, Tezzon F, Golaszewski S, et al. Mielopatía degenerativa canina: un modelo de esclerosis lateral amiotrófica humana. Zoología. (2015) 119:64–73. doi: 10.1016/j.zool.2015.09.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Valdmanis PN, Belzil VV, Lee J, Dion PA, St-Onge J, Hince P, et al. Una mutación que crea un pseudoexón en SOD1 causa ELA. Ann Hum Genet. (2009) 73:652–7. doi: 10.1111/j.1469-1809.2009.00546.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Kobatake Y, Nakata K, Sakai H, Sasaki J, Yamato O, Takashima S, et al. El curso clínico a largo plazo de la mielopatía degenerativa canina y el potencial terapéutico de la curcumina. Veterinario Sci. (2021) 8:192. DOI: 10.3390/VETSCI8090192
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Corral C. Mielopatía degenerativa canina. Veterinaria Nurs. (2020) 11:228–31. DOI: 10.12968/vetn.2020.11.5.228
29. Clemmons RM. Mielopatía degenerativa. Veterinario Clin N am Small Anim Pract. (1992) 22:965–71. doi: 10.1016/S0195-5616(92)50087-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Boothe DM. Fármacos que actúan sobre la coagulación y la coagulación. En:Boothe DM, , editor. Farmacología Clínica y Terapéutica de Pequeños Animales. Filadelfia, PA: W. B. Saunders (2001). págs. 107–24.
31. Polizopoulou ZS, Koutinas AF, Patsikas MN, Soubasis N. Evaluación del protocolo terapéutico propuesto en 12 perros con mielopatía degenerativa tentativa. Acta Vet Hung. (2008) 56:1588–2705. doi: 10.1556/avet.56.2008.3.3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Kolios G, Moodley Y. Introducción a las células madre y la medicina regenerativa. Respiración 85. (2013) 3–10. doi: 10.1159/000345615
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Ratajczak MZ, Ratajczak J, Kucia M. Very small embryonic-like stem cells (VSELs). Circ Res. (2019) 124:208–10. doi: 10.1161/CIRCRESAHA.118.314287
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Mocchi M, Dotti S, Bue MD, Villa R, Bari E, Perteghella S, et al. Medicina veterinaria regenerativa para trastornos musculoesqueléticos: ¿pueden las células madre mesenquimales / estromales y su secretoma ser la nueva frontera? Células. (2020) 9:1453. doi: 10.3390/cells9061453
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Trivedi P, Hematti P. Derivación y caracterización inmunológica de células estromales mesenquimales de células madre embrionarias humanas. Exp Hematol. (2008) 36:350–9. doi: 10.1016/j.exphem.2007.10.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Hackanson B, Waller CF. Seguimiento a largo plazo de pacientes con leucemia mieloide crónica que han recibido trasplante autólogo de células madre. Ana Hematol. (2011) 90:395–9. DOI: 10.1007/S00277-010-1094-Y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Chen C-T, Shih Y-RV, Kuo TK, Lee OK, Wei Y-H. Cambios coordinados de la biogénesis mitocondrial y enzimas antioxidantes durante la diferenciación osteogénica del mesenquimal humano. Células madre. (2008) 26:960–8. doi: 10.1634/stemcells.2007-0509
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Tzouvelekis A, Koliakos G, Ntolios P, Baira I, Bouros E, Oikonomou A, et al. Terapia con células madre para la fibrosis pulmonar idiopática: una propuesta de protocolo. J Transl Med. (2011) 9:182. doi: 10.1186/1479-5876-9-182
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Clerici M, Cassinotti A, Onida F, Trabattoni D, Annaloro C, Volpe AD, et al. Efectos inmunomoduladores del autotrasplante de células madre hematopoyéticas no seleccionadas en la enfermedad de Crohn refractaria. Dig Liver Dis. (2011) 43:946–52. doi: 10.1016/j.dld.2011.07.021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Pouly J, Bruneval P, Mandet C, Proksch S, Peyrard S, Amrein C, et al. Cardiac Stem cells in the real world. J Thorac Cardiovasc Surg. (2008) 135:673–8. doi: 10.1016/j.jtcvs.2007.10.024
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Uccelli A, Laroni A, Freedman M. Células madre mesenquimales para el tratamiento de la esclerosis múltiple y otras enfermedades neurológicas. Revisión. (2011) 10:649–56. doi: 10.1016/S1474-4422(11)70121-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Filho MD, Ribeiro P, Oliveira LF, Paula D, Capuano V, Assunção T, et al. Terapia con células madre mesenquimales en la enfermedad de Parkinson. Neurólogo. (2018) 23:141–7. doi: 10.1097/NRL.0000000000000188
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Gögel S, Gubernator M, Minger S. Progress and prospects: stem cells and neurological diseases. Gen Ther. (2011) 18:1–6. doi: 10.1038/gt.2010.130
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Muzes G, Sipos F. Mesenchymal stem cell-derived secretome: a potential therapeutic option for autoimmune and immune-mediated inflammatory diseases. Células. (2022) 11:2300. doi: 10.3390/cells11152300
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Moore SA, Granger N, Olby NJ. Apuntando a los éxitos traslacionales a través de CANSORT-SCI: uso de perros para identificar tratamientos efectivos para la lesión de la médula espinal. J Neurotrauma. (2017) 34:2007–18. doi: 10.1089/neu.2016.4745
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Pereira AL, Bittencourt MKW, Barros MA, Malago R, Panattoni JFM, de Morais BP, et al. Uso subconjuntival de células madre mesenquimales alogénicas para tratar la queratitis superficial crónica en perros pastores alemanes: estudio piloto. Abierto Vet J. (2022) 12:744–53. doi: 10.5455/OVJ.2022.v12.i5.20
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Najera J, Hao J. Avances recientes en la terapia con células madre mesenquimales para la dermatitis atópica. J Cell Biochem124. (2023) 181–7. DOI: 10.1002/JCB.30365
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Olsen A, Johnson V, Webb T, Santangelo KS, Dow S, Duerr FM. Evaluación de células madre mesenquimales alogénicas administradas por vía intravenosa para el tratamiento de la osteoartritis del codo en perros: un estudio piloto. Vet Comp Orthop Traumatol. (2019) 32:173–81. DOI: 10.1055/S-0039-1678547
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Brondeel C, Pauwelyn G, de Bakker E, Saunders J, Samoy Y, Spaas JH. Reseña: terapia mesenquimal con células madre en la investigación de la artrosis canina: «experientia docet» (la experiencia nos enseñará). Front Vet Sci. (2021) 8:668881. DOI: 10.3389/fvets.2021.668881
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Olsson DC, Teixeira BL, Jeremias TD, Réus JC, Canto GD, Porporatti AL, et al. Administración de células madre mesenquimales de tejido adiposo en la articulación de la cadera de perros con osteoartritis: una revisión sistemática. Res Vet Sci. (2021) 135:495–503. doi: 10.1016/j.rvsc.2020.11.014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Guercio A, Di Marco P, Casella S, Cannella V, Russotto L, Purpari G, et al. Producción de células madre mesenquimales caninas a partir de tejido adiposo y su aplicación en perros con artrosis crónica de las articulaciones humeroradiales. Cell Biol Int. (2012) 36:189–94. doi: 10.1042/CBI20110304
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Fontanilla CV, Gu H, Liu Q, Zhu TZ, Zhou C, Johnstone BH, et al. Corrección: los medios condicionados con células madre derivadas de tejido adiposo prolongan el tiempo de supervivencia de un modelo de ratón de esclerosis lateral amiotrófica. (2016) 6:20747. DOI: 10.1038/srep20747
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Chudickova M, Vackova I, Urdzikova LM, Jancova P, Kekulova K, Rehorova M, et al. El efecto de las células estromales mesenquimales derivadas de la jalea de Wharton y sus medios condicionados en el tratamiento de una lesión de la médula espinal en ratas. Int J Mol Sci. (2019) 20:4516. DOI: 10.3390/IJMS20184516
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Andrzejewska A, Lukomska B, Janowski M. Mesenchymal stem cells: from roots to boost. Células madre. (2019) 37:855–64. doi: 10.1002/stem.3016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Mcgonagle L, Blythe L, Levine D. Historia de la rehabilitación física canina. En:Millis DL, Levine D, , editores. D Canine Rehabilitation and Physical Therapy, 2nd ed. Filadelfia, PA: Elsevier Saunders (2014). págs. 1–7.
56. Hamid S, Hayek R. Papel de la estimulación eléctrica para la rehabilitación y la regeneración después de la lesión de la médula espinal: una visión general. Eur Spin J. (2008) 17:1256–69. DOI: 10.1007/S00586-008-0729-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Martins Â, Gouveia D, Cardoso A, Carvalho C, Coelho T, Silva C, et al. Un estudio clínico controlado de neurorrehabilitación intensiva en perros post-quirúrgicos con extrusión aguda severa de disco intervertebral. Animales. (2021) 11:3034. DOI: 10.3390/ANI11113034
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Holsheimer J. Computer modelling of spinal cord stimulation and its contribution to therapeutic efficacy. Cuerda giratoria. (1998) 36:531–40. doi: 10.1038/sj.sc.3100717
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Bockstahler B, Levine D. Estimulación eléctrica. En:Millis DL, Levine D, , editores. Rehabilitación canina y terapia física, 2ª ed. Filadelfia, PA: Elsevier Saunders (2014). págs. 342–58.
60. Hicks AL. Entrenamiento locomotor en personas con lesión medular: ¿es este ejercicio? Médula espinal. (2020) 59:1–8. DOI: 10.1038/S41393-020-0502-Y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
61. Martinez M, Delivet-Mongrain H, Rossignol S. El entrenamiento en cinta promueve cambios espinales que conducen a la recuperación locomotora después de una lesión parcial de la médula espinal en gatos. J Neurophysiol. (2013) 109:2909–22. doi: 10.1152/jn.01044.2012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Rossignol S, Martinez M, Escalona M, Kundu A, Delivet-Mongrain H, Alluin O, et al. Los efectos «beneficiosos» del entrenamiento locomotor después de varios tipos de lesiones espinales en gatos y ratas. Prog Brain Res. (2015) 218:173–98. doi: 10.1016/bs.pbr.2014.12.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Marsolais GS, Dvorak G, Conzezmius MG. Efectos de la rehabilitación postoperatoria sobre la función de las extremidades después de la reparación del ligamento cruzado craneal en perros. J Am Vet Med Assoc. (2002) 220:1325–1133. doi: 10.2460/javma.2002.220.1325
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Monk ML, Preston CA, McGowan CM. Efectos de la fisioterapia postoperatoria intensiva temprana sobre la función de las extremidades después de la osteotomía de nivelación de la meseta tibial en perros con deficiencia del ligamento cruzado craneal. Am J Vet Res. (2006) 67:529–36. DOI: 10.2460/AJVR.67.3.529
Resumen de PubMed | Texto completo de CrossRef | Google Académico
65. Olby NJ, De Risio L, Muñana KR, Wosar MA, Skeen TM, Sharp NJ, et al. Desarrollo de un sistema de puntuación funcional en perros con lesiones medulares agudas. Am J Vet Res. (2001) 62:1624–8. DOI: 10.2460/AJVR.2001.62.1624
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. Lewis MJ, Bowditch J, Laflen B, Perry N, Yoquelet R, Thomovsky SA. Estudio piloto sobre la viabilidad de la rehabilitación sensorial en la lesión medular canina. Front Vet Sci. (2022) 9:921471. doi: 10.3389/fvets.2022.921471
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Gouveia D, Cardoso A, Carvalho C, Almeida A, Gamboa Ó, Ferreira A, et al. Enfoque de la neurorrehabilitación de pequeños animales mediante entrenamiento locomotor: una actualización. Animales 12. (2022) 3582. DOI: 10.3390/ANI12243582
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Gouveia D, Cardoso A, Carvalho C, Gonçalves AR, Gamboa Ó, Canejo-Teixeira R, et al. Influencia del shock espinal en la neurorrehabilitación de perros ANNPE. Animales. (2022) 12:1557. DOI: 10.3390/ANI12121557
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Santos AR, Pedrosa S, Branquinho M, Alvites R, Mauricio A, Camões S, et al. WO2019175773 – Composiciones para uso en el tratamiento de afecciones musculoesqueléticas y métodos para producir las mismas aprovechando la actividad sinesgística de dos tipos diferentes de células estromales / madre mesenquimales (regenera). Universidad de Oporto (PCT/IB2019/052006) (2019). ®
70. Leal Reis I, Lopes B, Sousa P, Sousa AC, Branquinho M, Caseiro AR, et al. Células madre mesenquimales alogénicas derivadas de la sinobia para el tratamiento de tendinopatías y desmopatías equinas—Prueba de concepto. Animales. (2023) 13:1312. DOI: 10.3390/ANI13081312
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Braund KG, Vandevelde M. German Shepherd dog myelopathy: a morphologic and morphometric study. Am J Vet Res. (1978) 39:1309–15.
72. Johnston PE, Barrie JA, McCulloch MC, Anderson TJ, Griffiths IR. Patología del sistema nervioso central en 25 perros con radiculomielopatía degenerativa crónica. Veterinario Rec. (2000) 146:629–33. DOI: 10.1136/VR.146.22.629
Resumen de PubMed | Texto completo de CrossRef | Google Académico
73. Holder AL, Price JA, Adams JP, Volk HA, Catchpole B. Un estudio retrospectivo de la prevalencia de la mutación de la mielopatía degenerativa canina asociada a la superóxido dismutasa 1 (SOD1: c.118G > A) en una población de referencia de perros pastores alemanes del Reino Unido. Genet Canino Epidemiol. (2014) 1:10. doi: 10.1186/2052-6687-1-10
Resumen de PubMed | Texto completo de CrossRef | Google Académico
74. Donner J, Anderson H, Davison S, Hughes AM, Bouirmane J, Lindqvist J, et al. Frecuencia y distribución de 152 variantes genéticas de enfermedades en más de 100.000 perros mestizos y de raza pura. PLoS Genet. (2018) 14:E1007361. doi: 10.1371/journal.pgen.1007361
Resumen de PubMed | Texto completo de CrossRef | Google Académico
75. Waxman FJ, Clemmons RM, Hinrichs DJ. Mielopatía progresiva en perros pastores alemanes mayores. I Respuesta deprimida a mitógenos dependientes del timo. J Immunol. (1980) 124:1209–15. doi: 10.4049/jimmunol.124.3.1209
Resumen de PubMed | Texto completo de CrossRef | Google Académico
76. Johnston PE, Knox K, Gettinby G, Griffiths IR. Concentraciones séricas de a-tocoferol en perros pastores alemanes con radiculomielopatía degenerativa crónica. Veterinario Rec. (2001) 148:403–7. DOI: 10.1136/VR.148.13.403
Resumen de PubMed | Texto completo de CrossRef | Google Académico
77. Fechner H, Johnston PE, Sharp NJ, Montague P, Griffiths IR, Wang X, et al. Análisis genético molecular y de expresión del ARNm de la proteína de transferencia de alfa-tocoferol en perros pastores alemanes con mielopatía degenerativa. Berl Munch Tierarztl Wochenschr. (2003) 11:631–6.
78. Olby NJ, Sharp NJ, Muñana KR, Papich MG. Las lesiones compresivas crónicas y agudas de la médula espinal en perros se asocian con un aumento de los niveles de glutamato lumbar en LCR. J Vet Pasante Med. (1999) 13:240. DOI: 10.1089/NE.1999.16.1215
Resumen de PubMed | Texto completo de CrossRef | Google Académico
79. Lewis MJ, Jeffery ND, Olby NJ, Canrt-S C. I. Ambulación en perros con percepción de dolor ausente después de una lesión aguda de la médula espinal toracolumbar. Front Vet Sci. (2021) 7:560. DOI: 10.3389/FVETS.2020.00560
Resumen de PubMed | Texto completo de CrossRef | Google Académico
80. Kathmann I, Demierre S, Jaggy A. Rehabilitation methods in small animal neurology. Schweiz Arco Tierheilkd. (2001) 143:495–502.
81. Miller LA, Torraca D, Taboada L. Estudio observacional retrospectivo y análisis de dos protocolos diferentes de terapia de fotobiomodulación combinados con terapia de rehabilitación como intervenciones terapéuticas para la mielopatía degenerativa canina. Photobiomodul Photomed Laser Surg. (2020) 38:195–205. doi: 10.1089/photob.2019.4723
Resumen de PubMed | Texto completo de CrossRef | Google Académico
82. Lima R, Monteiro A, Salgado AJ, Monteiro S, Silva NA. Fisiopatología y enfoques terapéuticos para la lesión de la médula espinal. Int J Mol Sci. (2022) 23:13833. DOI: 10.3390/IJMS232213833
Resumen de PubMed | Texto completo de CrossRef | Google Académico
83. Sherrington CS. Flexión-reflejo de la extremidad, reflejo de extensión cruzada, y reflejo de pisar y pararse. J Physiol. (1910) 40:28–121. doi: 10.1113/jphysiol.1910.sp001362
Resumen de PubMed | Texto completo de CrossRef | Google Académico
84. Brown TG, Sherrington CS. Los factores intrínsecos en el acto de progresión en el mamífero. Proc R Soc Lond Ser B contiene Pap A Biol Character. (1911) 84:308–19. DOI: 10.1098/RSPB.1911.0077
85. Rossignol S, Frigon A. Recovery of lomotion after spinal cord injury: some facts and mechanisms. Annu Rev Neurosci. (2011) 34:413–40. doi: 10.1146/annurev-neuro-061010-113746
Resumen de PubMed | Texto completo de CrossRef | Google Académico
86. Bouyer LJG, Rossignol S. Contribución de las entradas cutáneas de la pata trasera al control de la locomoción en gatos intactos. J Neurophysiol. (2003) 90:3625–39. doi: 10.1152/jn.00496.2003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
87. Edgerton VR, Leon RD, Harkema SJ, Hodgson JA, London N, Reinkensmeyer DJ, et al. Reentrenamiento de la médula espinal lesionada. J Physiol. (2001) 533:15–22. doi: 10.1111/j.1469-7793.2001.0015b.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
88. Norton JA, Gorassini MA. Cambios en la coherencia intermuscular relacionada corticalmente que acompañan a las mejoras en las habilidades locomotoras en la lesión incompleta de la médula espinal. J Neurophysiol. (2006) 95:2580–9. doi: 10.1152/jn.01289.2005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
89. Smith AC, Knikou M. Una revisión sobre el entrenamiento locomotor después de la lesión de la médula espinal: reorganización de los circuitos neuronales espinales y recuperación de la función motora. Plast neural. (2016) 1216258:1–20. doi: 10.1155/2016/1216258
Resumen de PubMed | Texto completo de CrossRef | Google Académico
90. Behrman AL, Harkema SJ. Entrenamiento locomotor después de una lesión de la médula espinal humana: una serie de estudios de casos. Phys Ther. (2000) 80:688–700. doi: 10.1093/ptj/80.7.688
Resumen de PubMed | Texto completo de CrossRef | Google Académico
91. Shah PK, Garcia-Alias G, Choe J, Gad P, Gerasimenko Y, Tillakaratne N, et al. Uso del entrenamiento de pasos cuadrúpedos para volver a involucrar las redes interneuronales espinales y mejorar la función locomotora después de una lesión de la médula espinal. Cerebro. (2013) 136:3362–77. doi: 10.1093/cerebro/awt265
Resumen de PubMed | Texto completo de CrossRef | Google Académico
92. Fouad K, Tetzlaff W. Entrenamiento de rehabilitación y plasticidad después de una lesión de la médula espinal. Exp Neurol. (2012) 235:91–9. doi: 10.1016/j.expneurol.2011.02.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
93. Kralj A, Bajd T, Turk R, Krajnik J, Benko H. Gait restoration in paraplegic patients: a feasibility demonstration using multichannel surface electrode FES. J Rehabil R D. (1983) 20:3–20.
94. Hendricks HT, IJzerman MJ, de Kroon JR, Groen FA, Zilvold G. Estimulación eléctrica funcional por medio de la ‘Ness Handmaster Orthosis’ en pacientes con accidente cerebrovascular crónico: un estudio exploratorio. Clin Rehabil. (2001) 15:217–20. DOI: 10.1191/026921501672937235
Resumen de PubMed | Texto completo de CrossRef | Google Académico
95. Shinozaki M, Nagoshi N, Nakamura M, Okano H. Mecanismos de la terapia con células madre en lesiones de la médula espinal. Células. (2021) 10:2676. doi: 10.3390/cells10102676
Resumen de PubMed | Texto completo de CrossRef | Google Académico
96. Kowal JB, SA, Pandeya SR, Cochran RJ, Sabol JC, Rutkove SB, et al. Miografía de impedancia eléctrica en perros con mielopatía degenerativa. Front Vet Sci. (2022) 9:874277. DOI: 10.3389/FVETS.2022.874277
Resumen de PubMed | Texto completo de CrossRef | Google Académico
97. Shelton GD, Johnson GC, O’Brien DP, Katz ML, Pesayco JP, Chang BJ, et al. La mielopatía degenerativa asociada con una mutación sin sentido en el gen de la superóxido dismutasa 1 (SOD1) progresa a neuropatía periférica en los corgis y boxeadores galeses de Pembroke. J Neurol Sci. (2012) 318:55–64. doi: 10.1016/j.jns.2012.04.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
98. Griffiths IR, Duncan ID. Radiculomielopatía degenerativa crónica en el perro. J Small Anim Pract. (1975) 16:461–71. doi: 10.1111/j.1748-5827.1975.tb05773.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
99. Karussis D, Karageorgiou C, Vaknin-Dembinsky A, Gowda-Kurkalli B, Gomori JM, Kassis I, et al. Seguridad y efectos inmunológicos del trasplante mesenquimal de células madre en pacientes con esclerosis múltiple y esclerosis lateral amiotrófica. Arco Neurol. (2010) 67:1187–94. doi: 10.1001/archneurol.2010.248
Resumen de PubMed | Texto completo de CrossRef | Google Académico
100. Fischer UM, Harting MT, Jimenez F, Monzon-Posadas WO, Xue H, Savitz SI, et al. El paso pulmonar es un obstáculo importante para la administración intravenosa de células madre: el efecto pulmonar de primer paso. Desarrollo de células madre. (2009) 18:683–92. doi: 10.1089/SCD.2008.0253
Resumen de PubMed | Texto completo de CrossRef | Google Académico
101. Takahashi Y, Tsuji O, Kumagai G, Hara CM, Okano HJ, Miyawaki A, et al. Estudio comparativo de métodos para administrar células madre / progenitoras neurales para tratar la lesión de la médula espinal en ratones. Celular Trans. (2011) 20:727–39. doi: 10.3727/096368910X536554
Resumen de PubMed | Texto completo de CrossRef | Google Académico
102. Bakshi A, Hunter C, Swanger S, Lepore A, Fischer I. Entrega mínimamente invasiva de células madre para la lesión de la médula espinal: ventajas de la técnica de punción lumbar. J Neurosurg Columna vertebral. (2004) 1:330–7. doi: 10.3171/spi.2004.1.3.0330
Resumen de PubMed | Texto completo de CrossRef | Google Académico
103. Benavides FP, Pinto GB, Heckler MC, Hurtado DM, Teixeira LR, Monobe MM, et al. Trasplante intratecal de células madre mesenquimales autólogas y alogénicas derivadas de médula ósea en perros. Trasplante de células. (2021) 30:1–11. doi: 10.1177/09636897211034464
Resumen de PubMed | Texto completo de CrossRef | Google Académico
104. Paul G, Anisimov SV. El secretoma de las células madre mesenquimales: posibles implicaciones para la neuroregeneración. Biochimie. (2013) 95:2246–56. doi: 10.1016/j.biochi.2013.07.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
105. Villatoro AJ, Alcoholado C, Martín-Astorga MC, Fernández V, Cifuentes M, Becerra J. Análisis comparativo y caracterización de factores solubles y exosomas de tejido adiposo cultivado y células madre mesenquimales de médula ósea en especies caninas. Veterinario Immun Immunopathol. (2019) 208:6–15. doi: 10.1016/j.vetimm.2018.12.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
106. Murphy MB, Moncivais K, Caplan AI. Células madre mesenquimales: terapias sensibles al medio ambiente para la medicina regenerativa. Exp Mol Med. (2013) 45:E54–E16. doi: 10.1038/emm.2013.94
Resumen de PubMed | Texto completo de CrossRef | Google Académico
107. Aras Y, Sabanci PA, Kabatas S, Duruksu G, Subasi C, Erguven M, et al. Los efectos del trasplante de células madre mesenquimales derivadas del tejido adiposo durante las fases aguda y subaguda después de la lesión de la médula espinal. Neurosurg turco. (2016) 26:127–39. doi: 10.5137/1019-5149.JTN.15724-15.0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
108. Huang L, Fu C, Xong F. Terapia con células madre para la lesión de la médula espinal. Trasplante de células. (2021) 30:1–16. doi: 10.1177/0963689721989266
Resumen de PubMed | Texto completo de CrossRef | Google Académico
109. Potapova IA, Gaudette GR, Brink PR, Robinson RB, Rosen MR, Cohen IS, et al. Las células madre mesenquimales apoyan la migración, la invasión de la matriz extracelular, la proliferación y la supervivencia de las células endoteliales in vitro. Células madre. (2007) 25:1761–8. DOI: 10.1634/stemcells.2007-0022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
110. Boido M, Piras A, Valsecchi V, Spigolon G, Mareschi K, Ferrero I, et al. El trasplante de células del estroma mesenquimal humano modula el medio neuroinflamatorio en un modelo de ratón de esclerosis lateral amiotrófica. Citoterapia. (2014) 16:1059–72. doi: 10.1016/j.jcyt.2014.02.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
111. Teixeira FG, Carvalho MM, Neves-Carvalho A, Panchalingam KM, Behie LA, Pinto L, et al. El secretoma de los progenitores mesenquimales del cordón umbilical actúa como modulador de la proliferación y diferenciación neuronal/glial. (2015) 11:288–97. DOI: 10.1007/S12015-014-9576-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
112. Vizoso FJ, Eiro N, Cid S, Schneider J, Perez-Fernandez R. Mesenchymal stem cell secretome: towards cell-free therapeutic strategies in regenerative medicine. Int J Mol Sci. (2017) 25:1852. DOI: 10.3390/IJMS18091852
Resumen de PubMed | Texto completo de CrossRef | Google Académico
113. Kolar MK, Itte VN, Kingham PJ, Novikov LN, Wiberg M, Kelk P. Los efectos neurotróficos de diferentes células madre mesenquimales dentales humanas. (2017) 7:1260. DOI: 10.1038/S41598-017-12969-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
114. Cofano F, Boido M, Monticelli M, Zenga F, Ducati A, Vercelli A, et al. Células madre mesenquimales para la lesión de la médula espinal: opciones actuales, limitaciones y futuro de la terapia celular. Int J Mol Sci. (2009) 20:2698. DOI: 10.3390/IJMS20112698
Resumen de PubMed | Texto completo de CrossRef | Google Académico
115. Lu P, Jones LL, Tuszynski MH. Las células estromales de la médula que expresan BDNF apoyan el crecimiento axonal extenso en los sitios de lesión de la médula espinal. Exp Neurol. (2005) 191:344–60. doi: 10.1016/j.expneurol.2004.09.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
116. Crigler L, Robey RC, Asawachaicharn A, Gaupp D, Phinney DG. Las subpoblaciones de células madre mesenquimales humanas expresan una variedad de moléculas neurorreguladoras y promueven la supervivencia de las células neuronales y la neuritogénesis. Exp. Neurol. (2006) 198:54–64. doi: 10.1016/j.expneurol.2005.10.029
Resumen de PubMed | Texto completo de CrossRef | Google Académico
117. Wright KT, Masri WE, Osman A, Roberts S, Chamberlain G, Ashton BA, et al. Las células del estroma de la médula ósea estimulan el crecimiento de neuritas sobre los proteoglicanos neurales (CSPG), la glicoproteína asociada a la mielina y Nogo-A. Biochem Biophys Res Commun. (2007) 354:559–66. doi: 10.1016/j.bbrc.2007.01.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
118. Teixeira FG, Carvalho MM, Sousa N, Salgado AJ. Sepero de células madre mesenquimales: ¿un nuevo paradigma para la regeneración del sistema nervioso central? Cell Mol Life Sci. (2013) 70:3871–82. DOI: 10.1007/S00018-013-1290-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
119. Hofer HR, Tuan RS. Los factores tróficos secretados de las células madre mesenquimales apoyan las terapias neurovasculares y musculoesqueléticas. Células madre Res ther. (2016) 7:131. DOI: 10.1186/S13287-016-0394-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
120. Deng L, Ruan Y, Chen C, Frye CC, Xiong W, Jin X, et al. Caracterización de la morfología dendrítica y fenotipo de neurotransmisores de las neuronas propioespinales descendentes torácicas tras la transección completa de la médula espinal y el tratamiento con GDNF. Exp Neurol. (2016) 277:103–14. doi: 10.1016/j.expneurol.2015.12.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
121. Boillée S, Velde CV, Cleveland DW. ELA: una enfermedad de las neuronas motoras y sus vecinos no neuronales. Neurona. (2006) 52:39–59. doi: 10.1016/j.neuron.2006.09.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
122. Yamanaka K, Chun SJ, Boillee S, Fujimori-Tonou N, Yamashita H, Gutmann DH, et al. Los astrocitos como determinantes de la progresión de la enfermedad en la esclerosis lateral amiotrófica hereditaria. Nat Neurosci. (2008) 11:251–3. DOI: 10.1038/NN2047
Resumen de PubMed | Texto completo de CrossRef | Google Académico
123. Naji A, Favier B, Deschaseaux F, Rouas-Freiss N, Eitoku M, Suganuma N. Mesenchymal stem/stromal cell function in modulating cell death. Células madre Res ther. (2019) 10:56. DOI: 10.1186/S13287-019-1158-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
124. Lovett MC, Coates JR, Shu Y, Oglesbee MJ, Fenner W, Moore SA. Evaluación cuantitativa de hsp70, IL-1β y TNF-α en la médula espinal de perros con mielopatía degenerativa asociada a SOD40 E1K. Veterinario J. (2014) 2:312–7. doi: 10.1016/j.tvjl.2014.03.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
125. Hashimoto K, Kobatake Y, Asahina R, Yamato O, Islam MS, Sakai H, et al. Firmas inflamatorias reguladas al alza de la médula espinal en la mielopatía degenerativa canina. Res Vet Sci. (2020) 135:442–9. doi: 10.1016/j.rvsc.2020.11.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
126. Shaw G, Yang C, Ellis R, et al. El neurofilamento hiperfosforilado NF-H es un biomarcador sérico de lesión axonal. Biochem Biophys Res Commun. (2005) 336:1268–77. doi: 10.1016/j.bbrc.2005.08.252
Resumen de PubMed | Texto completo de CrossRef | Google Académico
127. Petzold A, Shaw G. Comparación de dos métodos ELISA para medir los niveles de la cadena pesada de neurofilamentos fosforilados. J Immunol Métodos. (2007) 319:34–40. doi: 10.1016/j.jim.2006.09.021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
128. Anderson KJ, Scheff SW, Miller KM, Roberts KN, Gilmer LK, Yang C, et al. La forma axonal fosforilada de la subunidad de neurofilamentos NF-H (pNF-H) como biomarcador sanguíneo de lesión cerebral traumática. J Neurotrauma. (2008) 25:1079–85. DOI: 10.1089/NE.2007.0488
Resumen de PubMed | Texto completo de CrossRef | Google Académico
129. Ma Y-H, Liang Q-Y, Ding Y, Han I, Zeng X. Multimodal repair of spinal cord injury with mesenchymal stem cells. Neurocolumna vertebral. (2022) 19:616–29. doi: 10.14245/ns.2244272.136
Resumen de PubMed | Texto completo de CrossRef | Google Académico
130. El-Kheir WA, Gabr H, Awad MR, Ghannam O, Barakat Y, Farghali HAMA, et al. La terapia celular autóloga derivada de la médula ósea combinada con fisioterapia induce una mejoría funcional en pacientes con lesión crónica de la médula espinal. Trasplante de células. (2014) 23:729–45. doi: 10.3727/096368913X664540
Resumen de PubMed | Texto completo de CrossRef | Google Académico
131. Li M, Chen H, Zhu M. Mesenchymal stem cells for regenerative medicine in central nervous system. Neurosci frontal. (2022) 16:1068114. doi: 10.3389/fnins.2022.1068114
Resumen de PubMed | Texto completo de CrossRef | Google Académico
132. Syková E, Rychmach P, Drahorádová I, Konrádová Š, RuŽičková K, Voríšek I, et al. Trasplante de células estromales mesenquimales en pacientes con esclerosis lateral amiotrófica: resultados del ensayo clínico fase I/IIa. Trasplante de células. (2017) 26:647–58. doi: 10.3727/096368916X693716
Resumen de PubMed | Texto completo de CrossRef | Google Académico
133. Sykova E, Cizkova D, Kubinova S. Mesenchymal stem cells in treatment of spinal cord injury and amyotrophic lateral sclerosis. Front Cell Dev Biol. (2021) 9:695900. DOI: 10.3389/fcell.2021.695900
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cita: Gouveia D, Correia J, Cardoso A, Carvalho C, Oliveira AC, Almeida A, Gamboa Ó, Ribeiro L, Branquinho M, Sousa A, Lopes B, Sousa P, Moreira A, Coelho A, Rêma A, Alvites R, Ferreira A, Maurício AC y Martins  (2023) Neurorehabilitación intensiva y trasplante alogénico de células madre en mielopatía degenerativa canina. Frente. Vet. Sci. 10:1192744. doi: 10.3389/fvets.2023.1192744
Recibido: 23 de marzo de 2023; Aprobado: 12 de junio de 2023;
Publicado: 13 julio 2023.
Editado por:
Jennifer Genevieve Barrett, Virginia Tech, Estados Unidos
Revisado por:
Zbigniew Adamiak, Clínica Veterinaria Białystok, Polonia
Haithem Ali Mohamed Ahmed Farghali, Universidad de El Cairo, Egipto
Rogerio Martins Amorim, Universidad Estatal de São Paulo, Brasil
Copyright © 2023 Gouveia, Correia, Cardoso, Carvalho, Oliveira, Almeida, Gamboa, Ribeiro, Branquinho, Sousa, Lopes, Sousa, Moreira, Coelho, Rêma, Alvites, Ferreira, Maurício y Martins. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Ana Colette Maurício, acmauricio@icbas.up.pt; ana.colette@hotmail.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía