Osteosarcoma extraesquelético primario de la vena cava caudal posthepática
Osteosarcoma extraesquelético primario de la vena cava caudal posthepática en un perro—Caso clínico
 Giovanni Tremolada1,2*
Giovanni Tremolada1,2*  Lynn Griffin1,2
Lynn Griffin1,2  Alison C. Manchester2
Alison C. Manchester2  Tawfik Aboellail2
Tawfik Aboellail2  Janis M. Lapsley3
Janis M. Lapsley3  Laura E. Selmic3
Laura E. Selmic3- 1Flint Animal Cancer Center, Colorado State University College of Veterinary Medicine, Fort Collins, CO, Estados Unidos
- 2Departamento de Ciencias Clínicas, Facultad de Medicina Veterinaria de la Universidad Estatal de Colorado, Fort Collins, CO, Estados Unidos
- 3Departamento de Ciencias Clínicas Veterinarias, Universidad Estatal de Ohio, Columbus, OH, Estados Unidos
El osteosarcoma extraesquelético (EOSA) en perros es un tumor mesenquimal maligno raro de tejidos blandos somáticos o, más comúnmente, de órganos viscerales con un mal pronóstico. En perros, se ha descrito que los EOSA surgen de múltiples ubicaciones, pero de manera diferente a los humanos, nunca de un vaso principal. En este informe, describimos el primer caso de un EOSA que surge de la vena cava caudal posthepática en un perro macho castrado de raza mixta macho de 7 años. Este informe se centra en la descripción de los retos diagnósticos para obtener un diagnóstico preoperatorio, destaca la importancia de la histopatología para un diagnóstico correcto e introduce un nuevo diagnóstico diferencial para un animal que presenta una sospecha de trombo de la vena cava.
Introducción
El osteosarcoma extraesquelético (EOSA) en perros es un tumor mesenquimal maligno raro de tejidos blandos somáticos o, más comúnmente, de órganos viscerales que se caracteriza por la producción de osteoide sin afectación de hueso o tejido perióstico. Una excepción a esta definición son los tumores malignos mixtos de la glándula mamaria y la tiroides (carcinosarcomas), donde se considera que la producción de osteoides está relacionada con la metaplasia estromal asociada con adenocarcinomas (1). La EOSA es un tumor agresivo con una mediana de supervivencia reportada que varía de 26 a 190 días, dependiendo del tratamiento recibido (2–4). En perros, se han descrito EOSA que surgen de múltiples ubicaciones, como el intestino delgado (1-3), el bazo (1, 4), el hígado (3), la raíz mesentérica (4, 5), el ojo (6), el corazón (7), las meninges (8), la glándula salival (9), el pulmón (10), la glándula suprarrenal (1), el testículo (1) y la vagina (1), o desarrollado como consecuencia de la inflamación crónica del gossypiboma (11, 12).
En los seres humanos, la EOSA también es un tumor raro y tiende a surgir más comúnmente del tejido blando de las extremidades que de los órganos viscerales (1). Algunos informes publicados en humanos describen EOSA primarias que se originan en la arteria pulmonar (13, 14), mientras que, según el mejor conocimiento de los autores, no hay informes publicados que describan EOSA que surja de los principales vasos sanguíneos en pacientes veterinarios.
El propósito de este relato de caso fue describir una EOSA surgida de la vena cava caudal posthepática en un perro, agregando a la lista de los diagnósticos diferenciales que deben considerarse y destacando la necesidad de biopsiar la masa para obtener un diagnóstico correcto.
Presentación del caso
Un perro mestizo macho castrado de 7 años y 6,4 kg fue presentado a su veterinario primario por una historia de 5 días de anorexia, poliuria / polidipsia, signos gastrointestinales inespecíficos y un rápido inicio de distensión abdominal. El examen físico no fue destacable, excepto por la distensión abdominal moderada a marcada y la presencia de onda de líquido palpable. Se realizó un análisis bioquímico sérico, hemograma completo (CSC), lipasa pancreática específica canina, ácidos biliares preprandiales y análisis de orina, y los hallazgos se informan en la Tabla 1. El análisis de orina mostró isostenuria (1,016) con un rastro de proteína y un sedimento negativo.
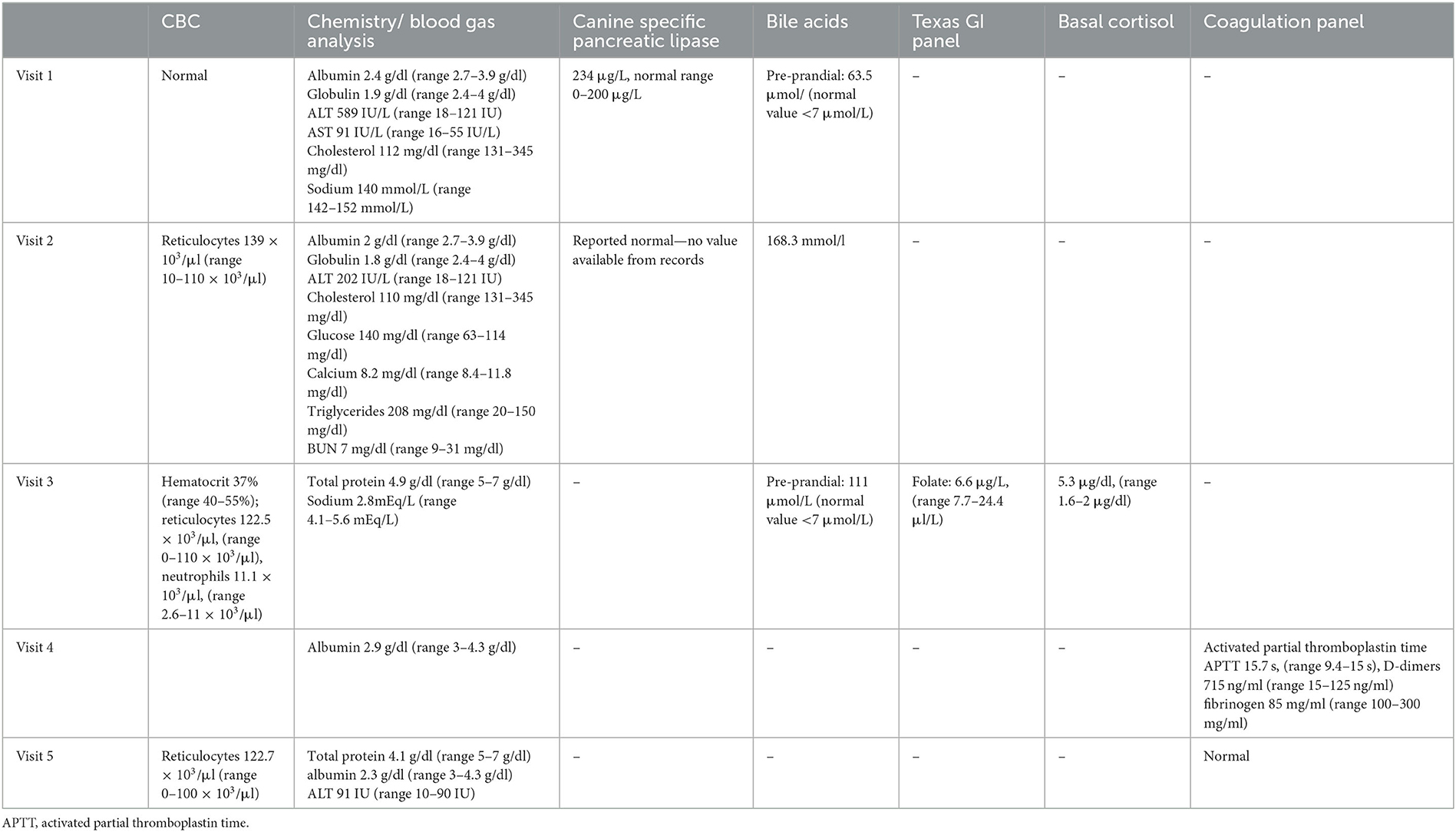 Tabla 1. Cronología de los cambios en los análisis de sangre observados antes de que se intentara la intervención quirúrgica para extirpar el trombo caval sospechoso.
Tabla 1. Cronología de los cambios en los análisis de sangre observados antes de que se intentara la intervención quirúrgica para extirpar el trombo caval sospechoso.
Debido a los valores hepáticos anormales, los síntomas gastrointestinales y la sospecha de presencia de derrame abdominal, el perro comenzó con terapia de apoyo [denamarina (32 mg / kg dos veces al día (BID), maropitant (2,2 mg / kg una vez al día (SID) y omeprazol (dosis y frecuencia desconocidas)] y fue remitido a un hospital especializado para una ecografía abdominal. Un radiólogo veterinario certificado por la junta realizó una ecografía abdominal y mostró cambios consistentes con hepatopatía inespecífica, pancreatitis y un solo nódulo esplénico pequeño. El resto del ultrasonido se consideró normal. Se realizó una abdominocentesis con una aguja de 25 g y se recogió 1 ml de líquido rosado y turbio y se envió para el análisis de líquidos. El análisis de fluidos fue consistente con un trasudado (proteína total 1,7 g/dl; células nucleadas 200/μl) con una población mixta de células mesoteliales reactivas, macrófagos y neutrófilos degenerados. No se identificaron células neoplásicas.
Sobre la base de los resultados de las pruebas, se realizó un diagnóstico tentativo de hepatopatía y pancreatitis inespecíficas.
El perro fue devuelto al veterinario primario 2 días después de la visita al hospital especializado para repetir los análisis de sangre. El CSC, la bioquímica sérica, la lipasa pancreática canina específica y los valores de ácidos biliares se informan en la Tabla 1. Los ácidos biliares aumentaron con respecto a la medición anterior, pero no estaba claro si el animal estaba en ayunas durante la prueba o no. El perro comenzó con espironolactona (0,9 mg / kg dos veces al día por vía oral) para ayudar a reducir el volumen del derrame abdominal.
Debido a la falta de mejoría en los signos clínicos 3 semanas después de la visita inicial al veterinario primario, el perro fue remitido al servicio de medicina interna de la Universidad Estatal de Colorado (CSU) para una segunda opinión. En el examen físico, las principales anomalías observadas fueron abdomen severamente distendido con vasos subcutáneos prominentes de la pared abdominal, sarro dental suave y heces blandas en el examen rectal. Se realizaron análisis de sangre que comprenden un CBC, proteína total, ácidos biliares, análisis de gases en sangre, panel GI de Texas y cortisol basal. El CSC mostró anemia regenerativa leve y neutrofilia leve. El nivel de proteína total mejoró con respecto al examen anterior, lo que hace que la hipoalbuminemia sea poco probable que sea la causa de la ascitis. Los ácidos biliares preprandiales se incrementaron. El análisis de gases en sangre mostró hipopotasemia marcada, probablemente relacionada con el derrame abdominal crónico. El panel GI de Texas mostró bajo nivel de folato, posiblemente indicativo de malabsorción intestinal proximal, mientras que el cortisol basal fue normal (Tabla 1).
El perro fue dado de alta con el plan de continuar con la terapia diurética y reducir la frecuencia de administración de Denamarin.
Dos semanas después de la visita inicial (5 semanas después de la presentación inicial), el perro regresó a la UCE para someterse a una ecografía abdominal y se realizaron biopsias hepáticas.
La sangre para el panel de bioquímica sérica y coagulación se recogió antes de la ecografía abdominal. Los resultados mostraron hipoalbuminemia persistente y una leve elevación del tiempo de tromboplastina parcial activada, dímeros D elevados y un fibrinógeno cuantitativo bajo. El perro fue sedado y se drenó 1 L de líquido serosanguinoso del abdomen para facilitar la obtención de imágenes, pero no se envió para su análisis. Una ecografía abdominal centrada en el hígado y la vasculatura hepática identificó un parénquima hepático difusamente hiperecoico y heterogéneo y un gran trombo posthepático ecogénico en la vena cava. La ausencia de flujo sanguíneo se identificó dentro de la luz trombosada en el interrogatorio Doppler (Figura 1, izquierda). Se realizó citología hepática y reveló hiperplasia hepatocelular con inflamación mononuclear y ausencia de neoplasia manifiesta. El perro fue anestesiado secuencialmente y se realizaron biopsias hepáticas laparoscópicas para histopatología, cuantificación de cobre y hierro, y cultivo de tejidos. En el examen laparoscópico del abdomen, la división izquierda del hígado apareció congestionada (Figura 1, derecha). Se realizaron biopsias de hígado, duodeno, yeyuno e íleon. La histopatología hepática reveló una marcada congestión centrilobular con inflamación linfoplasmacítica crónica y fibrosis periportal, y se encontró inflamación linfoplasmacítica/eosinofílica leve a moderada y ectasia leve de los linfáticos de la mucosa en el intestino. El perro se recuperó bien de los procedimientos y fue dado de alta del hospital al día siguiente con clopidogrel (3,5 mg/kg SID) y una dosis aumentada de espironolactona (2,3 mg/kg por la mañana y 1,1 mg/kg por la noche).
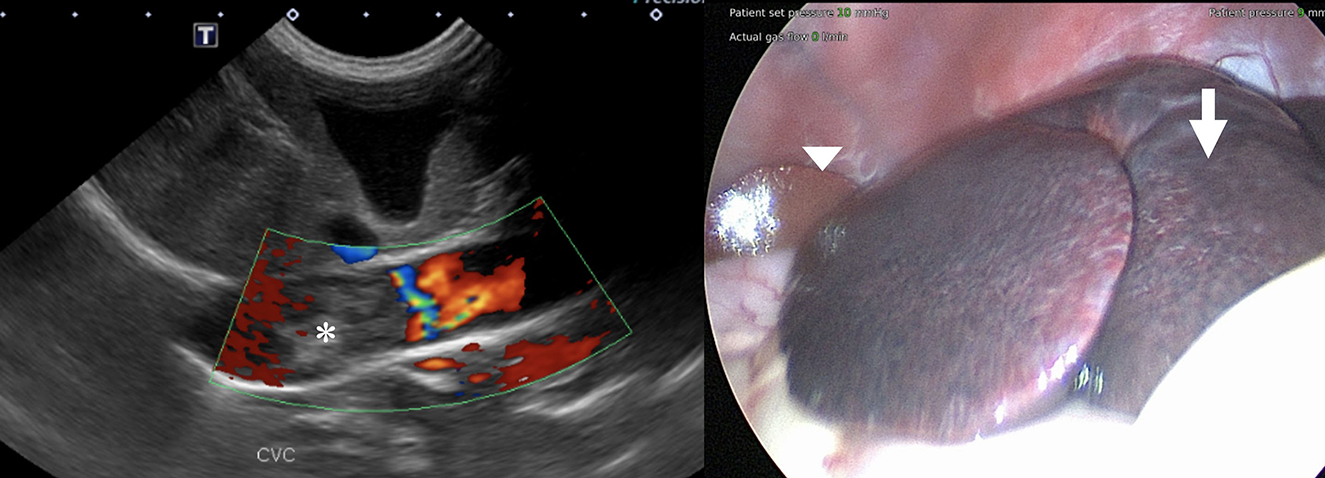
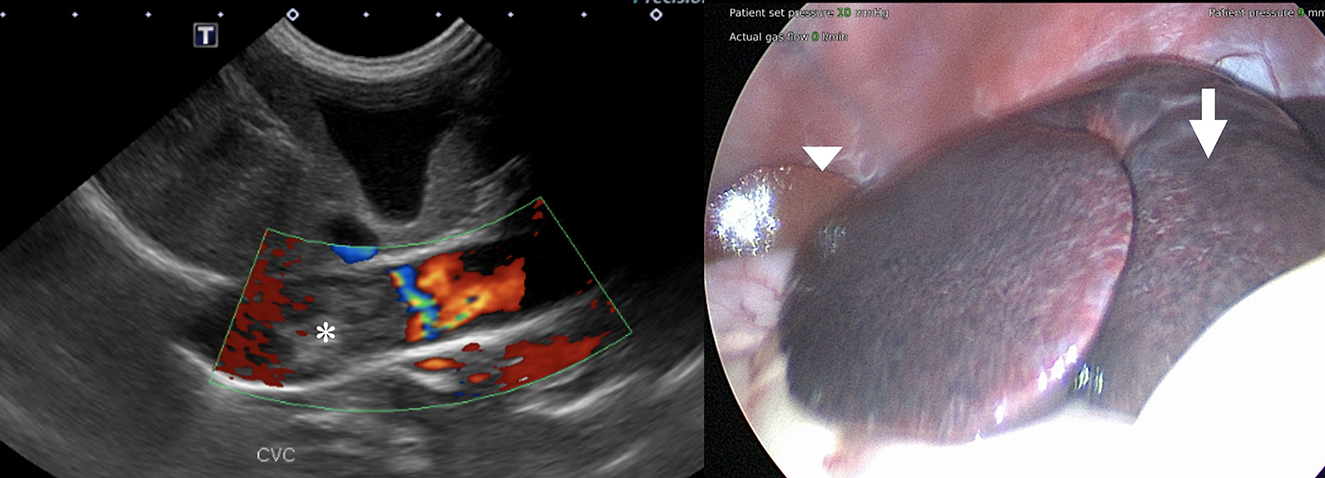 Figura 1. (Izquierda) Imagen Doppler de flujo en color del trombo sospechoso de la vena cava caudal que no muestra evidencia de flujo sanguíneo dentro de ella (asterisco). (Derecha) Vista laparoscópica del hígado antes de las biopsias. Tenga en cuenta el parénquima hepático congestionado de los lóbulos hepáticos izquierdos (flecha) en comparación con el parénquima normal del lado derecho (punta de flecha).
Figura 1. (Izquierda) Imagen Doppler de flujo en color del trombo sospechoso de la vena cava caudal que no muestra evidencia de flujo sanguíneo dentro de ella (asterisco). (Derecha) Vista laparoscópica del hígado antes de las biopsias. Tenga en cuenta el parénquima hepático congestionado de los lóbulos hepáticos izquierdos (flecha) en comparación con el parénquima normal del lado derecho (punta de flecha).
Se inició la suplementación de vitamina B12 (100 mcg/kg SID) y folatos (75 mg/kg SID) y una dieta proteica recién seleccionada (patata y pescado Royal Canin) para tratar la sospecha de linfangiectasia. El análisis de metales hepáticos reveló un aumento del valor de hierro (2.250 ppm, rango normal 400-1.200 ppm) y un valor normal de cobre (336 ppm, rango normal 120-400 ppm). No se identificó crecimiento bacteriano en el cultivo de biopsia hepática.
La ascitis del perro no mejoró después de 2 semanas de comenzar la nueva terapia. Se añadió apixaban (0,25 mg/kg dos veces al día) para ayudar a resolver el trombo de la vena cava caudal. Aún así, los signos clínicos no mejoraron y se tuvo que realizar una abdominocentesis semanalmente, eliminando 300-500 ml de líquido cada vez. Se repitió una ecografía abdominal un mes después de iniciar el tratamiento médico y no mostró ninguna reducción en el tamaño del trombo sospechoso. La extirpación quirúrgica del trombo o la colocación de stent en la vena cava caudal se volvió a ofrecer como una opción de tratamiento, pero el propietario la rechazó debido a limitaciones financieras. El perro continuó con la misma terapia médica prescrita anteriormente.
Un mes después de la última cita (9 semanas después de la presentación inicial), debido a la ascitis severa persistente que requiere abdominocentesis frecuente, el propietario eligió tener una tomografía computarizada (TC) del abdomen realizada en preparación para la trombectomía quirúrgica. El examen físico del perro no cambió. Se repitió el CSC, la bioquímica sérica y el panel de coagulación. El CBC mostró un aumento en el recuento de reticulocitos. La bioquímica sérica mostró hipoproteinemia e hipoalbuminemia y un ALT mínimamente aumentado. El tiempo de tromboplastina parcial activada y el tiempo de protrombina fueron normales. El perro también tenía un tipo de sangre y era DEA 1.1-negativo. Las radiografías torácicas se obtuvieron antes de la cirugía y mostraron un patrón intersticial difuso leve en todo el parénquima pulmonar, una vena cava caudal agrandada y sin evidencia de enfermedad metastásica. El perro fue anestesiado y un examen por TC con angiografía del abdomen reveló la presencia de una gran cantidad de tejido blando mixto / material atenuante mineral en la vena cava caudal y la vena hepática izquierda (Figura 2). El trombo se extendió desde el hígado hasta la aurícula derecha, con una mejora mínima del contraste observada en comparación con las imágenes previas al contraste. También se observó un realce de contraste irregular de los lóbulos hepáticos lateral izquierdo, medial izquierdo, cuadrado y medial derecho, un pequeño conglomerado de vasos ventrales a la vena ácigos que se comunica con la circulación portal, duplicación de la vena cava caudal a nivel de la vena renal izquierda y derrame abdominal marcado. Se priorizó un trombo de la vena cava caudal con congestión hepática secundaria y ascitis siendo la neoplasia un diagnóstico diferencial menos probable. Se drenaron dos litros de líquido serosanguinoso de la cavidad abdominal, mientras que el perro estaba bajo anestesia general en preparación para la trombectomía al día siguiente. El perro fue preparado para la cirugía, y se realizó una esternotomía mediana combinada y una laparotomía de línea media para abordar la lesión de la vena cava. Tras la inspección de la vena cava, se palpó una masa intraluminal dura que invadía la pared del vaso. La aspiración intraoperatoria con aguja fina de la lesión se realizó con una aguja de 25 g. El examen citológico reveló grupos de células con márgenes citoplasmáticos poco distintos y núcleos redondos a raramente ovoides con cromatina finamente punteada. Algunos grupos de células tenían una cantidad mínima de matriz extracelular rosada. Estos hallazgos fueron consistentes con un proceso neoplásico, y un diagnóstico de posible neoplasia neuroendocrina fue favorecido por el patólogo de turno.
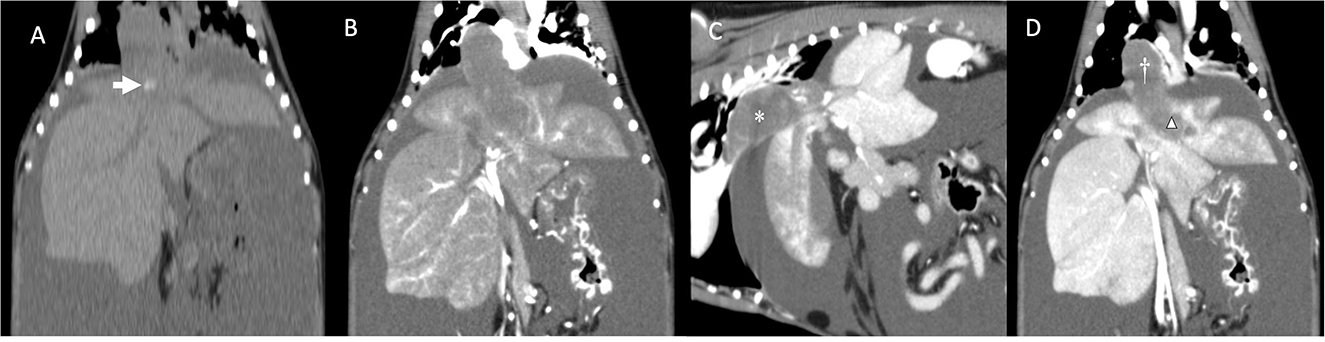 Figura 2. (A) Reconstrucción dorsal de la tomografía computarizada del perro antes de la administración del medio de contraste. Tenga en cuenta la mineralización dentro de la masa / trombo (flecha). (B) Reconstrucción dorsal de la tomografía computarizada del perro (fase arterial). Tenga en cuenta la mejora mínima del contraste en comparación con (A). (C) Reconstrucción sagital de la tomografía computarizada del perro que muestra una gran masa/trombo (asterisco) que obstruye completamente la vena cava caudal. (D) Reconstrucción dorsal de la TC del perro mostrando la gran masa/trombo ocupando la vena cava caudal (cruz) e invadiendo la vena hepática izquierda (triángulo). Tenga en cuenta la apariencia irregular de los lóbulos del hígado izquierdo congestionados. No se observa invasión parenquimatosa de la masa.
Figura 2. (A) Reconstrucción dorsal de la tomografía computarizada del perro antes de la administración del medio de contraste. Tenga en cuenta la mineralización dentro de la masa / trombo (flecha). (B) Reconstrucción dorsal de la tomografía computarizada del perro (fase arterial). Tenga en cuenta la mejora mínima del contraste en comparación con (A). (C) Reconstrucción sagital de la tomografía computarizada del perro que muestra una gran masa/trombo (asterisco) que obstruye completamente la vena cava caudal. (D) Reconstrucción dorsal de la TC del perro mostrando la gran masa/trombo ocupando la vena cava caudal (cruz) e invadiendo la vena hepática izquierda (triángulo). Tenga en cuenta la apariencia irregular de los lóbulos del hígado izquierdo congestionados. No se observa invasión parenquimatosa de la masa.
Debido a la irresecabilidad de la masa, la mala condición clínica del perro y la sospecha de proceso neoplásico, los propietarios eligieron sacrificar al perro bajo anestesia general y consintieron en realizar una necropsia. Los hallazgos de la necropsia macroscópica revelaron un hígado ligeramente agrandado y difusamente congestionado con bordes redondeados y una masa proliferativa firme, bronceada y de 5 cm × 2 cm que se expande y ocluye completamente la vena cava y una rama de la vena hepática izquierda. En el examen microscópico, la masa de la vena cava caudal estaba compuesta por células neoplásicas fusiformes a estrelladas organizadas en corrientes y verticilos incrustados dentro del estroma levemente fibroso que contenían material eosinofílico fibrilar ramificado consistente con osteoide (Figura 3). La inmunohistoquímica de la actina confirmó que la masa era intravascular dentro de la vasculatura hepática. En ausencia de una masa hepática primaria u otra neoplasia esquelética, se estableció un diagnóstico de EOSA primaria de la vena cava caudal.
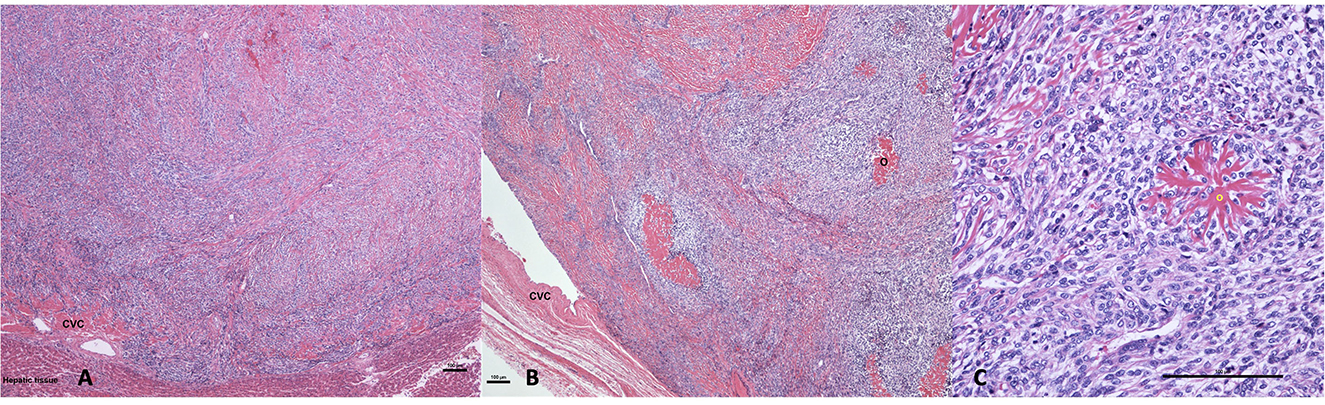 Figura 3. (A) Hematoxilina y eosina 40×: una proliferación de células fusiformes neoplásicas que llena la luz de la vena cava caudal (CVC) donde la célula neoplásica impregna la pared de la vena que colinda con el tejido hepático. (B) Hematoxilina y eosina 40×: osteosarcoma luminal que llena la luz y se adhiere parcialmente a la pared de la vena cava caudal (CVC). La neoplasia comprende la deposición multifocal de osteoide (O). (C) Hematoxilina y eosina 200×: la neoplasia está compuesta de células mitogénicamente activas, de ciruela a células estrelladas que están centradas multifocalmente en material osteoide eosinofílico ramificado (O) (barra es igual a 100 μm en cada imagen).
Figura 3. (A) Hematoxilina y eosina 40×: una proliferación de células fusiformes neoplásicas que llena la luz de la vena cava caudal (CVC) donde la célula neoplásica impregna la pared de la vena que colinda con el tejido hepático. (B) Hematoxilina y eosina 40×: osteosarcoma luminal que llena la luz y se adhiere parcialmente a la pared de la vena cava caudal (CVC). La neoplasia comprende la deposición multifocal de osteoide (O). (C) Hematoxilina y eosina 200×: la neoplasia está compuesta de células mitogénicamente activas, de ciruela a células estrelladas que están centradas multifocalmente en material osteoide eosinofílico ramificado (O) (barra es igual a 100 μm en cada imagen).
Discusión
La neoplasia intravascular rara vez se informa en la literatura humana, siendo el leiomiosarcoma el tumor más común que surge de la vena cava inferior (15, 16). El osteosarcoma es otro tumor intravascular que se ha reportado ocasionalmente, que surge de la arteria pulmonar en humanos (14). Según el conocimiento de los autores, aún no se ha descrito una neoplasia intravascular primaria originada en la vena cava caudal en perros. Sin embargo, se ha reportado previamente un caso de EOSA que surge del hígado e invade la vena cava caudal (17). El caso actual difiere de la EOSA hepático-cava reportada porque no se observó ninguna porción intraparenquimatosa de la masa ni en la TC ni en la necropsia, lo que hace que esta masa sea exclusivamente una EOSA intravascular primaria.
Un diagnóstico definitivo de un tumor intravascular a menudo se retrasa en la medicina humana debido a la dificultad de diferenciar entre la presencia de masa de un trombo blando y la rareza de estos tumores, lo que hace poco probable que se consideren como un diagnóstico diferencial (15). La misma situación ocurrió en este caso, ya que el tumor intravascular se consideró inicialmente como un trombo blando causado por el estado de hipercoagulabilidad relacionado con la enteropatía perdedora de proteínas, y la neoplasia primaria solo se sospechó en el momento de la cirugía.
Comúnmente, se utiliza una combinación de diferentes técnicas de imagen, como ultrasonido, tomografía computarizada y resonancia magnética, para obtener un diagnóstico definitivo de trombo frente a neoplasia intravascular (15). Los trombos blandos, los trombos tumorales y los tumores intravasculares primarios pueden mostrar evidencia de vascularización en el Doppler color debido a la recanalización del trombo o la presencia de vasos dentro de la masa. El flujo sanguíneo en el Doppler color no se observó en este caso. La falta de flujo sanguíneo en el Doppler color también se ha descrito en un caso de un leiomiosarcoma de vena cava inferior en un paciente humano (18). La posible explicación de este hallazgo es que la porción de la masa intravascular fotografiada era un trombo blando creado por la turbulencia del flujo precipitada por la neoplasia intravascular (19). Además, el tumor presentaba una mala vascularización que no se pudo identificar con esta técnica de imagen o se realizó la prueba Doppler en una región necrótica de la masa.
Cuando se realizó la angiografía por TC, la masa mejoró el contraste de mínima a nula en comparación con las imágenes previas al contraste. Esto está de acuerdo con lo observado en un caso de osteosarcoma condroblástico de la arteria pulmonar (14), y esta característica junto con la falta de una lesión primaria descarta la presencia de un trombo tumoral. La mala vascularización de la masa en estos dos casos podría explicar los hallazgos de la TC. En las imágenes de TC, la dilatación marcada focal de la vena cava caudal y la presencia de mineralización dentro del trombo podrían haber planteado preocupaciones para una neoplasia intravascular primaria en lugar de un trombo blando, incluso si se han reportado casos de trombos blandos crónicos mineralizados, debido a mineralización distrófica (20).
Una prueba de imagen potencialmente más precisa utilizada para diferenciar entre un trombo blando o un tumor intravascular es la tomografía por emisión de positrones con fluorodesoxiglucosa con flúor-18 (18F FDG PET-CT) (19). Debido a la actividad metabólica generalmente alta del tumor, el análogo radiactivo de la glucosa utilizado como marcador se acumula dentro del tumor y se puede identificar fácilmente en las imágenes utilizando 18F FDG PET-CT (18). Sin embargo, debido a 18Los trombos sépticos e inflamatorios de alta sensibilidad pero especificidad extremadamente baja de F FDG PET-CT pueden tener una apariencia de imagen similar a la neoplasia intravascular (19).
Los factores pronósticos negativos reportados para pacientes humanos afectados por tumores de la vena cava inferior son la presencia del síndrome de Budd-Chiari, la ubicación suprahepática del tumor, el crecimiento tumoral intraluminal y la oclusión de la vena cava inferior (16). El paciente actual tenía todos esos indicadores pronósticos negativos. Además, la masa se consideró irresecable intraoperatoriamente, justificando la decisión de la eutanasia. En la necropsia, se confirmó que la masa surgía de la pared de la vena cava caudal, y no se identificaron lesiones adicionales dentro del hígado, el sistema musculoesquelético y otros vasos principales. Tener una tomografía computarizada preoperatoria de cuerpo completo o una 18La PET-CT F FDG habría sido un método más preciso de estadificación para confirmar que la masa cava era la primaria sin otras lesiones neoplásicas, ya que la lesión ósea pequeña podría haberse pasado por alto en la necropsia.
En conclusión, este informe de caso describe por primera vez en la literatura veterinaria la presencia de un EOSA que surge de la vena cava caudal posthepática en un perro. Incluso si es raro, EOSA debe agregarse a la lista de diferenciales potenciales en animales con neoplasia intravascular. La dificultad para diagnosticar estos EOSA se debe a la rareza de estos tumores. Debido a su naturaleza asintomática, permanecen en silencio durante la mayor parte del curso de la enfermedad y generalmente se encuentran debido a su efecto oclusivo masivo u ocupante de espacio, como en los casos humanos (21). Se necesita una resección quirúrgica de la masa cuando sea posible, o una biopsia representativa, para lograr un diagnóstico definitivo. Los veterinarios, especialmente los diagnosticadores, deben ser conscientes de la posibilidad de ESOAs intravasculares, que requerirán la resección quirúrgica como la opción principal de tratamiento, especialmente cuando se sospecha neoplasia vascular.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este artículo no están fácilmente disponibles porque, este es un informe de caso, no se produjo ningún conjunto de datos. Los análisis de sangre y las imágenes del caso se pueden compartir a petición razonable. Las solicitudes de acceso a los conjuntos de datos deben dirigirse a: giovanni.tremolada@colostate.edu.
Declaración ética
No se requirió aprobación ética para los estudios con animales de acuerdo con la legislación local y los requisitos institucionales porque el animal fue tratado de acuerdo con el estándar de atención y no se realizaron procedimientos experimentales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio. Se obtuvo el consentimiento informado por escrito del participante/paciente (s) para la publicación de este informe de caso.
Contribuciones del autor
GT preparó el primer borrador. GT, AM, LG y TA manejaron al paciente o interpretaron las pruebas de imagen o realizaron la necropsia / interpretaron la histopatología y contribuyeron a la concepción del informe del caso. Todos los autores contribuyeron a la revisión del manuscrito, leyeron y aprobaron la versión presentada.
Financiación
El(los) autor(es) declara(n) que no recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Patnaik AK. Osteosarcoma extraesquelético canino y condrosarcoma: un estudio clínico-patológico de 14 casos. Veterinario Pathol. (1990) 27:46–55. doi: 10.1177/030098589002700107
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Duffy D, Selmic LE, Kendall AR, Powers BE. Resultado tras el tratamiento del osteosarcoma extraesquelético visceral y de tejidos blandos en 33 perros: 2008-2013. Veterinario Comp Oncol. (2017) 1:46–54. DOI: 10.1111/vco.12141
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Langebach A, Anderson MA, Dambach DM, Sorenmo KU, Shofer FD. Osteosarcomas extraesqueléticos en perros: un estudio retrospectivo de 169 casos (1986-1996). J Am Anim Hosp Assoc. (1998) 34:113–20. doi: 10.5326/15473317-34-2-113
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Kuntz CA, Dernell WS, Powers BE, Withrow S. Osteosarcomas extraesqueléticos en perros: 14 casos. J Am Anim Hosp Assoc. (1998) 34:26–30. doi: 10.5326/15473317-34-1-26
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Urbiztondo R, Chapman S, Benjamino K. Osteosarcoma de raíz mesentérica primaria en un perro. Veterinario Clin Pathol. (2010) 39:377–80. doi: 10.1111/j.1939-165X.2010.00239.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Heath S, Rankin AJ, Dubielzig RR. Osteosarcoma ocular primario en un perro. Veterinario Oftalmológico. (2003) 6:85–7. doi: 10.1046/j.1463-5224.2003.00256.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Schelling SH, Moses BL. Osteosarcoma intracardíaco primario en un perro. J Vet Diagn Invest. (1994) 6:396–8. doi: 10.1177/104063879400600325
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Ringenberg MA, Neitzel LE, Zachary JF. Osteosarcoma meníngeo en un perro. Veterinario Pathol. (2000) 37:653–5. DOI: 10.1354/VP.37-6-653
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Thomsen BV, Myers RK. Osteosarcoma extraesquelético de la glándula salival mandibular en un perro. Veterinario Pathol. (1999) 36:71–3. DOI: 10.1354/VP.36-1-71
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Seiler RJ. Osteosarcoma pulmonar primario en perro con osteopatía hipertrófica asociada. Veterinario Pathol. (1979) 16:369–71. doi: 10.1177/030098587901600308
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Miller MA, Aper RL, Fauber A, Blevins WE, Ramos-Vara JA. Osteosarcoma extraesquelético asociado con esponja quirúrgica retenida en un perro. J Vet Diagn Invest. (2006) 18:224–8. DOI: 10.1177/104063870601800218
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Slovak JE, Kieves NR, Haynes J. Osteosarcoma extraesquelético inducido por un granuloma de cuerpo extraño. J Am Anim Hosp Assoc. (2015) 51:315–9. doi: 10.5326/JAAHA-MS-6224
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. McConnel TH. Tumores óseos y cartilaginosos del corazón y grandes vasos: informe de un osteosarcoma de la arteria pulmonar. Cáncer. (1970) 25:611–7. doi: 10.1002/1097-0142(197003)25:3>611::AID-CNCR2820250316<3.0.CO;2-E
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Tsunezuka Y, Oda M, Takahashi M, Minato H, Watanabe G. Osteosarcoma condromatoso primario de la arteria pulmonar. Ann Thorac Surg. (2004) 77:331–4. doi: 10.1016/S0003-4975(03)00761-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Bendel EC, Maleszewski JJ, Araoz PA. Diagnóstico por imágenes de sarcomas de los grandes vasos y el corazón. Semin Ultrasonido CT MR. (2011) 32:377–404. doi: 10.1053/j.sult.2011.06.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Laskin WB, Fanburg-Smith JC, Burke AP, Kraszewska E, Fetsch JF, Miettinen M. Leiomyosarcoma of the inferior vena cava: clinicopathologic study of 40 cases. Am J Surg Pathol. (2010) 34:873–81. doi: 10.1097/PAS.0b013e3181ddf569
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Wiersma L, Kuiper RV, Gröne A. Osteosarcoma condroblástico extraesquelético hepático con angioinvasión inusual de la vena cava caudal en un perro. Tijdschr Diergeneeskd. (2010) 135:940–3.
18. Singh N, Shivdasani D, Karangutkar S. Rare case of primary lower vena cava leiomyosarcoma on F-18 fluorodeoxyglucose positron emission tomography-computed tomography scan: differentiation from nontumor thrombus in a background of procoagulant state. Indio J Nucl Med. (2014) 29:246–8. doi: 10.4103/0972-3919.142629
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Rohatgi S, Howard SA, Tirumani SH, Ramaiya NH, Krajewski KM. Multimodality imaging of tumor thrombus. Can Assoc Radiol J. (2015) 66:121–9. doi: 10.1016/j.carj.2014.11.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Rosen S, Benedicenti L, Petesch S, Reetz J, Galban EM. Caso clínico: trombos mineralizados de la arteria pulmonar en dos perros tratados por meningoencefalitis de origen desconocido. Front Vet Sci. (2020) 7:569–97. DOI: 10.3389/FVETS.2020.569597
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Joo S, Song JW, Na KJ, Park S, Park IK, Kim YT, et al. Osteosarcoma extraesquelético primario en el mediastino anterior: informe de caso y revisión. Coreano J Thorac Cardiovasc Surg. (2019) 52:243–6. doi: 10.5090/kjtcs.2019.52.4.243
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: osteosarcoma, osteosarcoma extraesquelético, vena cava, canino, perro
Cita: Tremolada G, Griffin L, Manchester AC, Aboellail T, Lapsley JM y Selmic LE (2023) Osteosarcoma extraesquelético primario de la vena cava caudal posthepática en un perro: informe de caso. Frente. Vet. Sci. 10:1197236. doi: 10.3389/fvets.2023.1197236
Recibido: 17 de julio de 2023; Aprobado: 30 de agosto de 2023;
Publicado: 21 septiembre 2023.
Editado por:
Carlos Eduardo Fonseca-Alves, Universidad Paulista, Brasil
Revisado por:
Sami Al-Nadaf, Universidad de California, Davis, Estados Unidos
Alessia Cordella, Royal Veterinary College (RVC), Reino Unido
Derechos de autor © 2023 Tremolada, Griffin, Manchester, Aboellail, Lapsley y Selmic. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY). Se permite el uso, distribución o reproducción en otros foros, siempre que se acredite al autor original y al propietario de los derechos de autor y se cite la publicación original en esta revista, de acuerdo con la práctica académica aceptada. No se permite ningún uso, distribución o reproducción que no cumpla con estos términos.
*Correspondencia: Giovanni Tremolada, giovanni.tremolada@colostate.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

