Patogenicidad comparativa de los genotipos CA1737/04 y del virus de la bronquitis infecciosa masiva en pollos
Patogenicidad comparativa de los genotipos CA1737/04 y del virus de la bronquitis infecciosa masiva en pollos ponedoras
 Ahmed Ali1,2
Ahmed Ali1,2  Muhammad Farooq1
Muhammad Farooq1  Danah Altakrouni1
Danah Altakrouni1  Shahnas M. Najimudeen1
Shahnas M. Najimudeen1  Mohamed S. H. Hassan1,3
Mohamed S. H. Hassan1,3  Ishara M. Isham1
Ishara M. Isham1  Adel A. Shalaby2
Adel A. Shalaby2  Rodrigo A. Gallardo4
Rodrigo A. Gallardo4  Mohamed Faizal Abdul-Careem1*
Mohamed Faizal Abdul-Careem1*- 1Facultad de Medicina Veterinaria, Universidad de Calgary, Calgary, AB, Canadá
- 2Departamento de Patología, Facultad de Medicina Veterinaria, Universidad Beni-Suef, Beni Suef, Egipto
- 3Departamento de Medicina Aviar y Convinina, Facultad de Medicina Veterinaria, Universidad de Assiut, Assiut, Egipto
- 4Departamento de Salud de la Población y Reproducción, Facultad de Medicina Veterinaria, Universidad de California, Davis, Davis, CA, Estados Unidos
El virus de la bronquitis infecciosa (IBV) es un virus respiratorio que causa atropismo en múltiples sistemas corporales de los pollos. Recientemente, la cepa del IBV California 1737/04 (CA1737/04) se identificó como una de las variantes circulantes del IBV entre las operaciones avícolas en América del Norte. Aquí, se caracterizó la patogenicidad y el tropismo tisular de la cepa CA1737/04 de IBV en gallinas libres de patógenos específicos (SPF) en comparación con el IBV de Massachusetts (Massachusetts). En gallinas con SPF de 30 semanas de edad se realizaron infecciones por IBV Mass o CA1737/04, mientras que el tercer grupo se mantuvo como grupo control. Después de la infección, se evaluaron los signos clínicos, la producción de huevos, la excreción viral, la serología, el examen de necropsia y la histopatología durante un período de 19 días. Además, se investigaron ciertos parámetros de afinidad tisular, que involucraron la localización de antígenos virales y la detección de copias de ARN viral en tejidos designados. Nuestros hallazgos indican que la infección con CA1737/04 o cepa Mass IBV podría inducir signos clínicos significativos, reducción de la producción de huevos y anticuerpos anti-IBV localmente en el lavado del oviducto y sistémicamente en suero. Ambas cepas del IBV mostraron niveles detectables de copias de ARN viral y patología inducida en tejidos respiratorios, renales, entéricos y reproductivos. Sin embargo, la cepa CA1737/04 IBV tuvo mayor patogenicidad, mayor tropismo tisular y mayor replicación en el riñón, el intestino grueso y diferentes segmentos del oviducto en comparación con la cepa Mass IBV. Ambas cepas de IBV liberan genoma viral por vía cloacal, sin embargo, las gallinas infectadas por IBV masivo liberan cargas genómicas de IBV más altas a través de la vía orofaríngea en comparación con las gallinas infectadas por IBV CA1737/04. En general, los hallazgos actuales podrían contribuir a una mejor comprensión de la patogenicidad del IBV CA1737/04 en gallinas ponedoras.
1 Introducción
La bronquitis infecciosa (IB) es una enfermedad respiratoria altamente contagiosa y es causada por el virus de la bronquitis infecciosa (IBV), que infecta principalmente a los pollos (1). El IBV es un gammacoronavirus perteneciente a la familia Coronaviridae. El IBV es un patógeno respiratorio primario, inicialmente se replica en las células epiteliales del tracto respiratorio superior de los pollos causando manifestaciones respiratorias como jadeo, tos, estornudos, estertores traqueales y secreción nasal (2). Además, se sabe que el IBV podría dirigirse a los macrófagos pulmonares (3) y a los monocitos (4), una posible razón por la que se disemina más allá de las vías respiratorias. Además de las enfermedades respiratorias, la infección por IBV puede provocar patologías renales, reproductivas o gastrointestinales, dependiendo de la cepa o genotipo del IBV infectante (1). En todo el mundo circulan diversos serotipos y variantes del IBV, esto se atribuye a la diversidad genética como resultado de eventos de mutación y recombinación (5). A pesar de la amplia vacunación contra el IBV, existe una escasa protección cruzada entre las cepas heterólogas (6).
La mayoría de los casos de nefropatogenicidad por IBV se han descrito en pollos de engorde. Varias cepas de IBV de tipo QX se han asociado con enfermedad renal en Asia, Europa y África (7-9). En los Estados Unidos de América (EE.UU.), SE SABE QUE EL IBV Gray, PA/Wolgemuth/98, PA/171/99 y 98, y Delmarva (DMV/1639/11) inducen patología renal (10-12). Sin embargo, se ha informado que algunas cepas de IBV también inducen nefropatogenicidad en gallinas ponedoras (13, 14). Las cepas nefropatógenas del IBV inducen nefritis, que se parece mucho a los riñones hinchados y pálidos con túbulos y uréteres distendidos como resultado de la acumulación de urato (15). En el primer informe documentado de IBV nefropatógeno, se describieron signos clínicos coexistentes de enteritis en pollos de engorde (10). Desde entonces, se ha documentado que el IBV puede infectar varias células epiteliales a lo largo del tracto digestivo prolongando la diseminación viral (16-18).
La patogenicidad del IBV en los tejidos reproductivos de los pollos está determinada principalmente por la edad de las aves en el momento de la infección, su estado inmunitario y la cepa del IBV implicada (19). El síndrome de la falsa capa debido al oviducto quístico puede ser producido por algunas cepas del IBV cuando las infecciones ocurren antes de las 2 semanas de edad (20). La infección de las ponedoras adultas puede estar asociada con una serie de signos clínicos que van desde defectos de la cáscara del huevo hasta disminuciones en la producción de huevos (21). Se ha identificado que las cepas del IBV como M41, Aust T y QX-like causan patología reproductiva con el consiguiente deterioro de la producción y la calidad de los huevos (22-24).
Ha habido numerosas cepas de IBV aisladas en los EE. UU. desde la década de 1930, la mayoría pertenecientes al linaje GI-9 (como ArkDPI), el linaje GI-17 (como DMV/1639) y el linaje GI-25 [como California 1737/04 (1737/04)] (25-27). En la actualidad, el GI-17 (al igual que el DMV/1639) es la variante más común del IBV que circula entre las aves de corral en los EE. UU.; Se aisló por primera vez en 2011 y comenzó a causar enfermedades significativas en 2014/2015 (26). En Canadá, las cepas del IBV podrían clasificarse en cuatro grupos principales, incluidas las variantes canadienses únicas (cepa Qu-mv), las clásicas [virus similares a las vacunas, como Connecticut (Connecticut) y Massachusetts (Massachusetts)], las cepas variantes de origen estadounidense (CA1737, California 99, CU_82792, Pensilvania 1220/98, Pennsylvania Wolf/98 y DMV/1639) y las variantes no canadienses/no estadounidenses o las cepas europeas (cepa 793/B) (28, 29).
En la actualidad, hay dos genotipos principales del IBV que afectan a las operaciones de las ponedoras en Canadá. Las variantes de tipo Mass afectan principalmente a las ponedoras comerciales en el oeste de Canadá (3). Las parvadas de ponedoras del este de Canadá se ven afectadas predominantemente por variantes del tipo DMV/1639 (29). Desde 2012, se ha detectado la cepa CA1737/04 en parvadas de aves de corral de Ontario (28). En 2004, se aisló por primera vez el IBV CA1737/04 de pollos de engorde (46 días de edad) y pollitas (de 4 a 6 semanas de edad) en California con antecedentes de dificultad respiratoria y nefritis, respectivamente (30). Curiosamente, CA1737/04 se detectó en gallinas ponedoras que presentaban oviductos quísticos en una granja comercial ubicada en Arizona (31). Hasta la fecha, no se han realizado estudios experimentales controlados en gallinas ponedoras para evaluar la patogenicidad de CA1737/04. En consecuencia, se llevó a cabo un experimento exhaustivo en ponedoras de Leghorn blanco libres de patógenos específicos (SPF) para examinar la patogenicidad y el tropismo tisular de CA1737/04. Esta infección experimental se comparó con la infección con una cepa Mass bien conocida relacionada con problemas de producción de huevos en el oeste de Canadá (3).
2 Materiales y métodos
2.1 Cepas virales
El aislado Mass IBV (designado como 15AB-01) del linaje GI-1 se aisló de ponedoras en Alberta con antecedentes de producción de huevos alterada (3), mientras que el IBV CA1737/04 se aisló de hisopos traqueales obtenidos de pollos de engorde (25 días de edad) con manifestaciones respiratorias en California, EE. UU. El IBV CA1737/04 fue recibido del Departamento de Salud de la Población y Reproducción de la Facultad de Medicina Veterinaria de la Universidad de California (Davis, CA, EE.UU.). La identificación del genotipo se realizó comparando fragmentos amplificados del gen de la espícula 1 con secuencias disponibles en la base de datos GenBank del NCBI. El aislado actual de IBV mostró más del 97% de similitud con CA1737/04 (EU925393) (32) que pertenece al GI-25 (33). La propagación de ambas cepas virales se logró mediante la inoculación de huevos de gallina embrionados con SPF a través de la cavidad alantoidea a los 9 a 11 días de edad. La dosis infecciosa embrionaria del 50% (EID50) de los pasajes cuarto y tercero de la Misa y CA1737/04 se determinó con base en el método de Reed y Muench (34), respectivamente.
2.2 Pollos ponedoras y declaración ética
Se obtuvieron gallinas ponedoras SPF de veinticuatro semanas de edad (White Leghorn) de la Agencia Canadiense de Inspección de Alimentos (CFIA), Ottawa, Ontario, y se transfirieron a salas de presión negativa en la Estación de Investigación de Ciencias Veterinarias (VSRS) de la Universidad de Calgary. A las gallinas se les permitió 6 semanas para aclimatarse y estabilizar la producción de huevos. A lo largo del experimento, los pollos recibieron alimento y agua ad libitum. El horario de luz comprendía 8 h de oscuridad y 16 h de luz. Todos los pollos utilizados en este estudio fueron atendidos y los procedimientos experimentales se realizaron después de la aprobación del Comité de Cuidado de Animales de Ciencias Veterinarias (VSACC) de la Universidad de Calgary (número de protocolo AC19-0011).
2.3 Grupos experimentales e infección viral
Un total de cincuenta gallinas ponedoras con FPS se dividieron aleatoriamente en tres grupos, una sala separada para cada grupo. A las 30 semanas de edad, dos grupos se infectaron con 1 × 106 EID50 de las cepas Mass y CA1737/04 del IBV. Se utilizó un volumen total de 150 μL de líquido alantoideo que contenía la cepa Mass o CA1737/04 IBV con 80 μL por vía intratraqueal, 35 μL por vía intranasal y 35 μL por vía ocular bajo anestesia con isoflurano. Por lo tanto, hubo dos grupos infectados por el IBV: infectados en masa (n = 16) e infectados por CA1737/04 (n = 18). Mientras que el tercer grupo fue infectado simuladamente con 150 μL de solución salina estéril tamponada con fosfato (PBS; Life Technologies Corporation, Grand Island, NY, Estados Unidos), este grupo se mantuvo como el control no infectado (n = 16). Después de la infección por IBV, todas las aves fueron monitoreadas diariamente para detectar signos clínicos y producción de huevos hasta 19 y 18 días después de la infección (dpi), respectivamente.
2.4 Evaluación de los signos clínicos y del rendimiento de la producción de huevos
En todos los grupos, los signos clínicos se observaron dos veces al día después de la infección experimental por IBV y se clasificaron en cuatro puntuaciones de gravedad (que van de 0 a 3) como se evaluó previamente (35). Brevemente, los signos clínicos generales, como plumas erizadas, acurrucarse junto a una fuente de calor, depresión con la cabeza baja y alas caídas, recibieron una puntuación de 1. Los signos respiratorios se escalaron de la siguiente manera: puntuación (0) (ausencia de signos), puntuación (1) leve (aumento de la respiración pero el pico permaneció cerrado), puntuación (2) moderada (aumento de la respiración con el pico abierto, tos, estornudos, ojos llorosos y secreción nasal), mientras que la puntuación (3) se describió como signos graves (jadeo marcado). Para cada grupo, se informaron las puntuaciones medias diarias de los signos clínicos y se calcularon mediante el sistema de puntuación antes mencionado.
A partir de los 3 días previos a la infección y a los 18 dpi, se registró la producción de huevos individualmente para cada grupo. El rendimiento de la puesta de huevos se evaluó como el porcentaje de producción de huevos/grupo/intervalo de tres días (100% = 1 huevo/gallina/día).
2.5 Toma de muestras y examen de necropsia
A los 3, 7, 9, 13 y 19 dpi, se recolectaron hisopos orofaríngeos (OP) y cloacales (CL) y se conservaron en PBS que contenían 2% de suero fetal de ternero y 2% de penicilina y estreptomicina (Gibco, Carlsbad, CA, Estados Unidos), alícurates y se mantuvieron a -80 °C hasta su uso. Se recolectó sangre de las venas de las alas de cada ave a 9, 13 y 19 ppp para monitorear los títulos séricos de anti-IBV. A los 9 dpi, seis aves de cada grupo fueron seleccionadas al azar y sacrificadas después de la inhalación excesiva de anestesia isoflurano y la luxación cervical para inspeccionar las lesiones macroscópicas y recolectar muestras. Del mismo modo, el resto de las aves de todos los grupos experimentales fueron sacrificadas a los 19 dpi. Se recolectaron porciones de tejido que representan varios sistemas corporales como la tráquea, el pulmón, el riñón, las amígdalas cecales, el duodeno, el colorrectal, el ovario y el oviducto (magnum, istmo, útero) en RNA Save (Biological Industries, Beit Haemek, Israel) para la cuantificación de la carga del genoma del IBV. Los especímenes de los tejidos mencionados anteriormente, con o sin amígdalas cecales, se conservaron en formol tamponado neutro al 10% (VWR International, Edmonton, AB, Canadá) para su examen histopatológico o inmunohistoquímico, respectivamente.®
Se examinaron las lesiones macroscópicas a los 9 y 19 dpi con énfasis en el tracto reproductor, es decir, ovarios y oviductos, así como se midió la longitud del oviducto en todas las aves. Con el fin de recoger los lavados del oviducto, se infundieron 10 ml de PBS frío y se masajearon suavemente a lo largo de toda la longitud del oviducto (36), luego se alícuota y se almacenaron a -80 °C hasta el procesamiento.
2.6 Técnicas
2.6.1 Monitorización de anticuerpos anti-IBV
Se recogieron muestras de sangre a 9, 13 y 19 ppp y lavados oviductales a 9 y 19 ppp para medir las respuestas de anticuerpos contra el IBV utilizando un kit ELISA comercial (IDEXX Laboratories, Inc., Westbrook, ME, Estados Unidos). El ensayo se realizó según el protocolo del fabricante. Los títulos superiores a 396 (punto de corte) se consideraron positivos.
2.6.2 Cuantificación de la carga genómica del IBV
El ácido ribonucleico (ARN) total se extrajo de los tejidos e hisopos utilizando el reactivo Trizol (Invitrogen Canada Inc., Burlington, ON, Canadá) siguiendo las recomendaciones del fabricante. La concentración de ARN se midió con un espectrofotómetro Nanodrop 1.000 (ThermoScientific, Wilmington, DE, Estados Unidos). Para sintetizar el ADNc a partir de hisopos y tejidos, utilizamos 1.000 y 2.000 ng de ARN, respectivamente, utilizando cebadores aleatorios (High-Capacity Reverse Transcription Kit®™, Applied Biosystems, Invitrogen Canada Inc., Burlington, ON, Canadá). La cuantificación de la carga genómica del IBV se realizó mediante la prueba de reacción en cadena de la polimerasa cuantitativa en tiempo real (RT-qPCR) utilizando el termociclador CFX 96-c1000 (Bio-Rad Laboratories, Mississauga, ON, Canadá). La prueba RT-qPCR se realizó en base a un SYBR Green Master Mix (Invitrogen, Burlington, ON, Canadá). Cada reacción se ajustó a un volumen neto de 20 μL, incluyendo 10 μL de mezcla maestra SYBR Green, 100 ng de ADNc por muestra y cebadores específicos directos e inversos (0,5 μL para cada uno). Los cebadores utilizados en este ensayo de RT-qPCR se dirigieron al gen de la nucleocápside (N) del IBV, como se describió anteriormente (37). Con el fin de cuantificar el número absoluto de copias del genoma del IBV, se utilizó una curva estándar utilizando seis diluciones seriadas de diez veces (10®7–102) de plásmidos preparados internamente portadores del gen IBV-N (37).
2.6.3 Histopatología
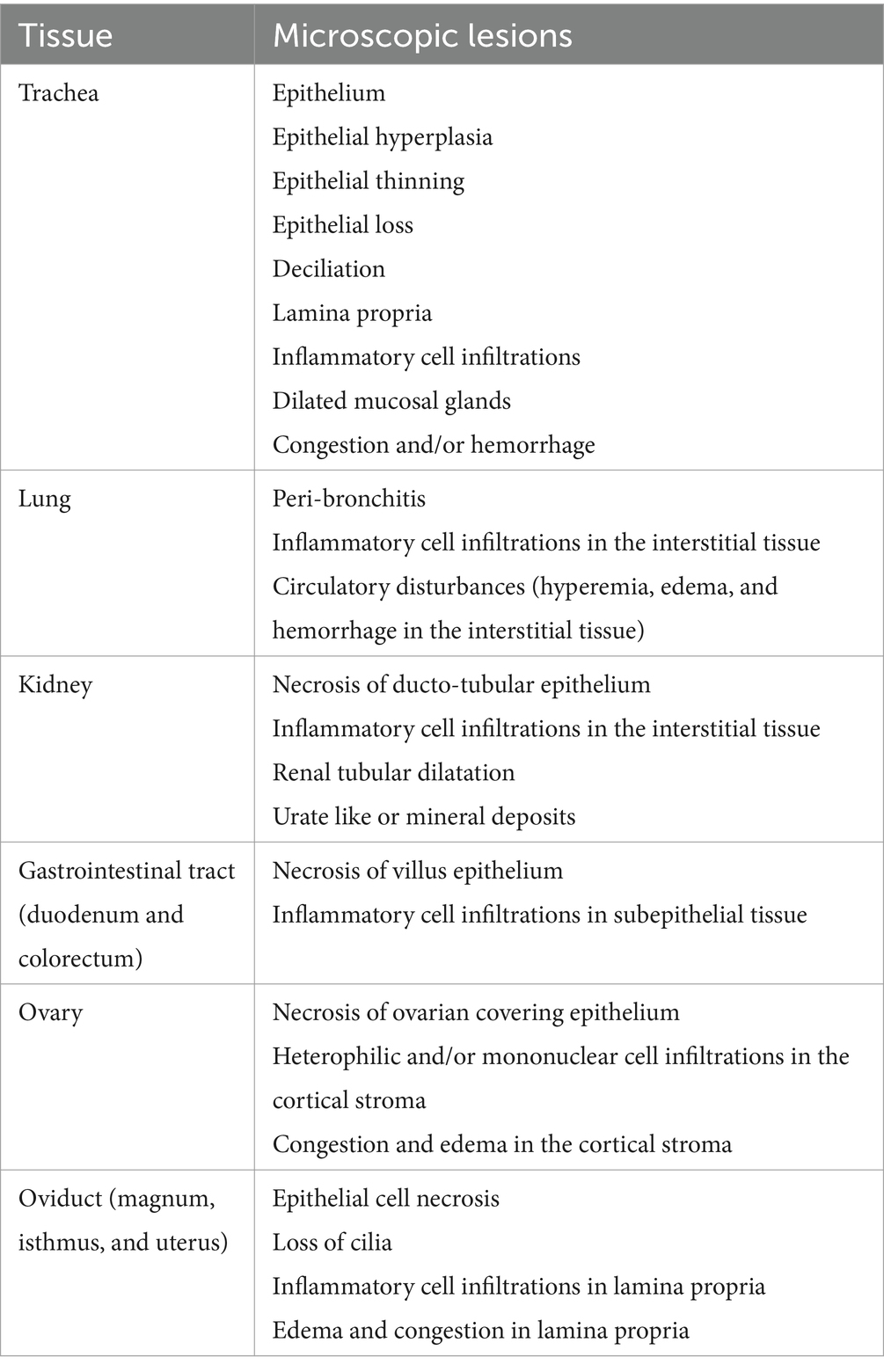
Después de cada examen de necropsia (9 y 19 dpi), las muestras de tejido fijadas en formol de la tráquea, pulmón, riñón, duodeno, colorrectal, ovario y oviducto (magnum, istmo y útero) se procesaron con técnicas histológicas estándar, se incrustaron en parafina y se cortaron en secciones de 4 μm montadas en portaobjetos de vidrio. A continuación, las secciones cortadas se tiñeron con hematoxilina y eosina (H&E) en la Unidad de Servicios de Diagnóstico (DSU) de la Universidad de Calgary según un procedimiento descrito anteriormente (38). Las secciones de tejido teñidas se visualizaron bajo microscopía óptica (Olympus BX51, Center Valley, PA, Estados Unidos) para las lesiones relacionadas con la infección por IBV. Las lesiones histopatológicas fueron listadas (Tabla 1) y puntuadas según Benyeda et al. (39) con algunas modificaciones. Las lesiones asignadas (Tabla 1) se clasificaron de la siguiente manera: sin cambios (0), leves (1), moderadas (2) o graves (3), según lo publicado anteriormente (40, 41).
2.6.4 Inmunohistoquímica
Se realizó inmunohistoquímica (IHQ) en secciones de parafina preparadas a partir de los tejidos (tráquea, pulmón, riñón, amígdalas cecales, duodeno, colorrectal, ovario, magnum, istmo y útero) recolectadas a 9 y 19 dpi. Después de la desparafinación, las secciones de tejido se trataron con peróxido de hidrógeno al 3% en metanol para bloquear la actividad de la peroxidasa endógena. Los epítopos se recuperaron calentando en el microondas las secciones de tejido en tampón de citrato de 10 mM (PH 6,0) a 850 vatios durante 10-15 min. Después de tratar los portaobjetos, se enfriaron a temperatura ambiente durante 30 minutos (min). La tinción de fondo inespecífica se apagó incubando las secciones en el tampón de bloqueo compuesto por suero de cabra al 2,5% en PBS durante 1 h a temperatura ambiente. La detección del IBV se logró utilizando un anticuerpo monoclonal anti-IBV de ratón 1:400 específico para la proteína N (Novus Biological, Bio-Techne, Toronto, ON, Canadá) en el tampón de bloqueo con una incubación nocturna a 4 °C. Como anticuerpo secundario se empleó IgG (H + L) biotinilada anti-ratón de cabra (Vector Laboratories, Burlingame, CA, Estados Unidos). La unión de anticuerpos se detectó mediante un sistema de complejo avidina-biotina-peroxidasa (ABC) (kit Vectastain ABC, Vector Laboratories, Burlingame, CA, Estados Unidos) siguiendo las instrucciones del fabricante. La visualización de la localización del antígeno se realizó mediante la incubación de las secciones en 3,3-diaminobencidina-H®2O2 (kit de sustrato DAB para peroxidasa, Vector Laboratories, Burlingame, CA, Estados Unidos). Finalmente, las secciones de tejido se contratiñeron con hematoxilina de Gill (Electron Microscopy Sciences, Hatfield, PA, Estados Unidos) y se montaron con un medio de montaje líquido a base de tolueno. Se capturaron cinco campos microscópicos con células positivas para el IBV por sección de tejido con un aumento del 20×. El porcentaje de células positivas para el IBV por campo se calculó utilizando un conjunto de datos en línea conocido como DeepLIIF (42).
2.6.5 Análisis de datos
Se compararon las proporciones de un intervalo de tres días de producción de huevos entre los grupos utilizando la prueba exacta de Fisher. Las diferencias de grupo en todos los demás parámetros probados se analizaron mediante la prueba de Kruskal-Wallis, seguida de la prueba de comparación múltiple de Dunn en cada punto de tiempo. Para evaluar la normalidad de los datos, se empleó la prueba de D’Agostino-Pearson. Se utilizó el software GraphPad Prism 9.4.1 (GraphPad Prism Software, San Diego, California, Estados Unidos) para realizar todas las pruebas y gráficos estadísticos.
3 Resultados
3.1 Manifestaciones clínicas y producción de óvulos
El grupo control no mostró signos clínicos durante todo el período de observación. Por otro lado, las gallinas de los grupos infectados por Mass y CA1737/04 por IBV mostraron dificultad respiratoria, incluyendo estornudos, estertores traqueales y jadeo, así como signos inespecíficos como depresión y plumas erizadas. Estos signos se observaron a partir de 1 y 2 dpi. Las puntuaciones clínicas medias del grupo infectado por IBV masivo fueron significativamente superiores a las calculadas en el grupo control (Figura 1A; p < 0,05) de 3 a 7 dpi. En el grupo infectado por el IBV CA1737/04, las puntuaciones medias de signos clínicos fueron significativamente más altas que las del grupo control (p < 0,05) a los 4 y 6 dpi. El pico de signos clínicos se determinó a los 4 dpi en ambos grupos infectados por el IBV (Figura 1A). Aunque las puntuaciones clínicas medias en el grupo infectado por IBV masivo fueron superiores a las observadas en el grupo infectado por IBV CA1737/04, no se detectaron diferencias estadísticamente significativas entre los dos grupos (p > 0,05). A los 9 a 10 dpi, la mayoría de las aves de los grupos infectados por el IBV Mass y CA1737/04 se recuperaron.
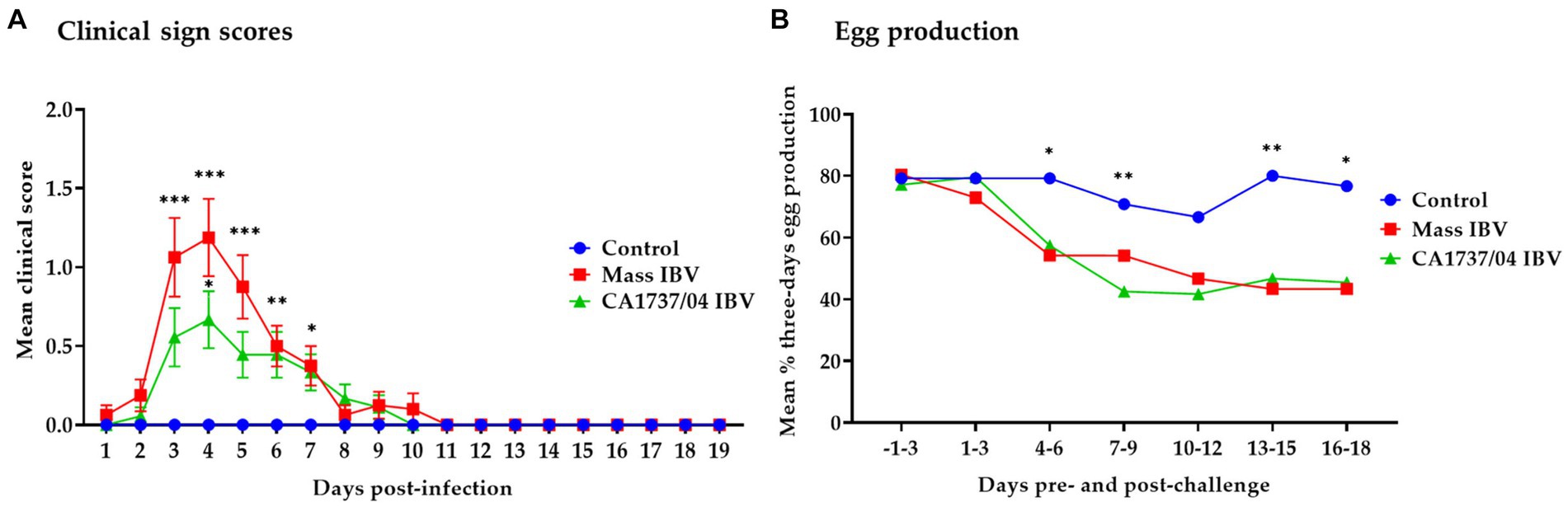 Figura 1. Puntuaciones medias diarias de signos clínicos (A) y porcentajes medios de intervalo de 3 días de producción de huevos (B) tras la infección por cepas de Mass (15AB-01) y CA1737/04 IBV. Las diferencias de los grupos en las puntuaciones medias de los signos clínicos se identificaron mediante la prueba de Kruskal-Wallis seguida de la prueba de comparación múltiple de Dunn. Las barras de error representan el error estándar de la media (SEM). Se empleó la prueba exacta de Fisher para comparar la proporción de intervalos de 3 días de producción de huevos. Los asteriscos indican diferencias significativas (p < 0,05 , p < 0,01 y p < 0,001).******
Figura 1. Puntuaciones medias diarias de signos clínicos (A) y porcentajes medios de intervalo de 3 días de producción de huevos (B) tras la infección por cepas de Mass (15AB-01) y CA1737/04 IBV. Las diferencias de los grupos en las puntuaciones medias de los signos clínicos se identificaron mediante la prueba de Kruskal-Wallis seguida de la prueba de comparación múltiple de Dunn. Las barras de error representan el error estándar de la media (SEM). Se empleó la prueba exacta de Fisher para comparar la proporción de intervalos de 3 días de producción de huevos. Los asteriscos indican diferencias significativas (p < 0,05 , p < 0,01 y p < 0,001).******
La producción de huevos de todos los grupos desde los 3 días previos a la infección hasta los 18 dpi se presenta en la Figura 1B. En el grupo infectado por IBV masivo, la producción de huevos se redujo a aproximadamente el 44% a los 5 dpi, mientras que en el grupo de CA1737/04, disminuyó a aproximadamente el 28% a los 6 dpi. Al comparar la producción de huevos durante el período previo a la infección con los 18 dpi, los grupos infectados por IBV Mass y CA1737/04 experimentaron caídas promedio del 28% y el 25%, respectivamente. Mientras que la producción de huevos en el grupo control mostró una ligera caída de aproximadamente un 4% en promedio. La producción de huevos en los grupos infectados por Mass y CA1737/04 IBV fue significativamente menor que la observada en el grupo control (p < 0,05) en los días 4-6, 13-15 y 16-18 dpi. Sin embargo, solo el grupo infectado por el IBV con CA1737/04 tuvo una producción de huevos significativamente menor en comparación con el grupo control (p < 0,05) a los 7-9 dpi. No se detectaron diferencias significativas en la producción de huevos entre los grupos infectados por IBV Mass y CA1737/04 (p > 0,05) a lo largo del experimento.
Ambas cepas del IBV indujeron cambios en la calidad externa e interna del huevo a partir de los 3 dpi. En cuanto a los problemas externos de calidad de los huevos, las gallinas infectadas masivamente por IBV mostraron un huevo sin cáscara y 10 huevos con cáscara áspera. Mientras que las gallinas infectadas con CA1737/04 por IBV mostraron solo dos huevos con grietas en el pelo de la cáscara. En cuanto a las anomalías internas en la calidad de los huevos, las gallinas infectadas por Mass IBV revelaron cinco huevos con albúmina acuosa y 3 huevos con manchas de sangre en la yema. Por otro lado, las gallinas infectadas por el IBV CA1737/04 demostraron tres huevos con albúmina acuosa y dos huevos con sangre en la yema.
3.2 Lesiones patológicas macroscópicas y longitud del oviducto
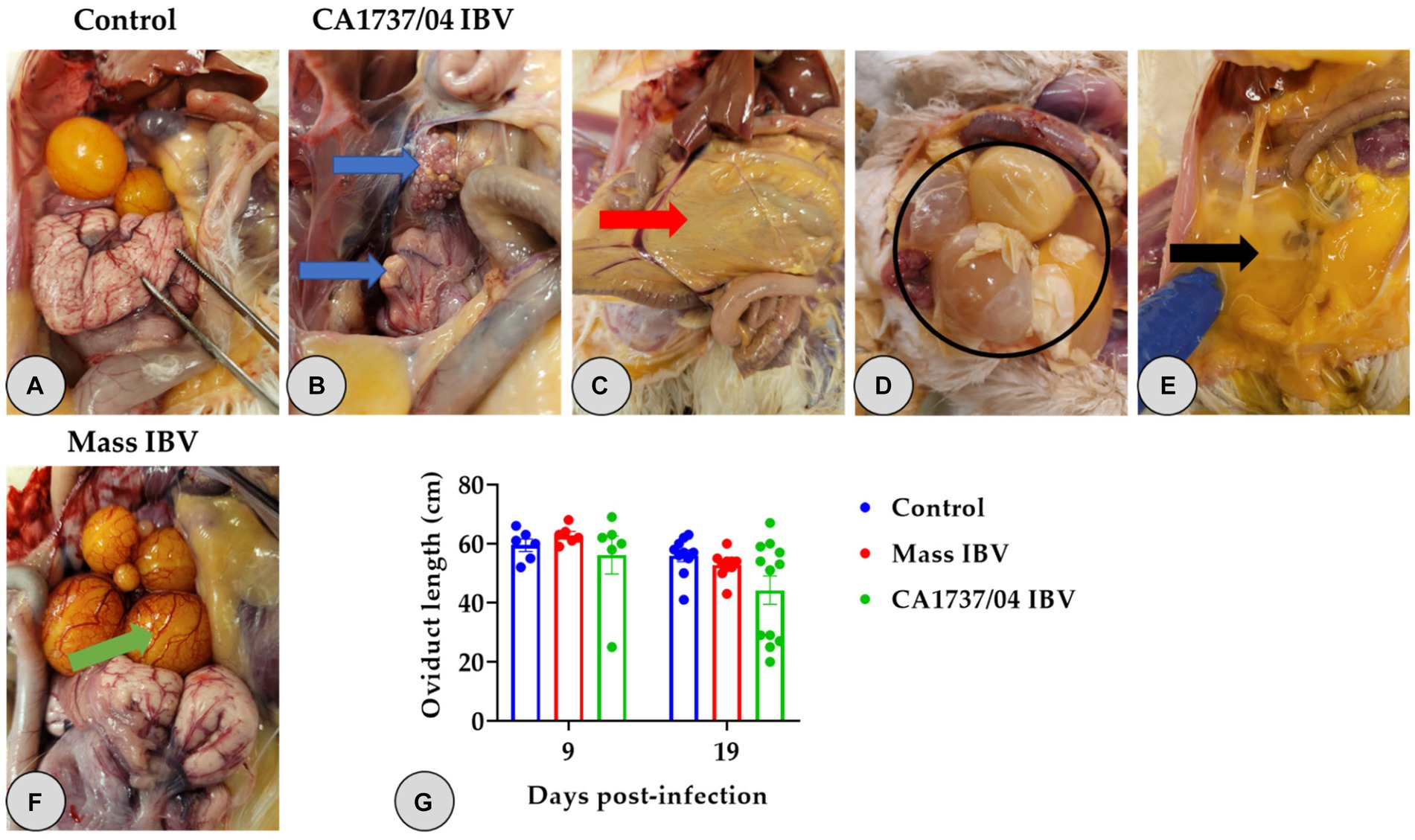
No se inspeccionaron lesiones macroscópicas en el grupo control a los 9 y 19 ppp (Figuras 2A, 3A). Sin embargo, se observaron diferentes lesiones en el sistema reproductivo de las gallinas infectadas (Tabla 2). En el grupo infectado por el IBV CA1737/04, las lesiones macroscópicas reproductivas se detectaron tanto en el ovario como en el oviducto, representando (3/6) el 50% y (8/12) el 66,7% del total de gallinas infectadas a los 9 y 19 dpi (Tabla 2), respectivamente. Las lesiones macroscópicas observadas en el grupo infectado por el IBV con CA1737/04 se presentaron principalmente en forma de peritonitis del huevo y regresión tanto del ovario como del oviducto con materiales inflamados en su interior (Figura 2B). La peritonitis del huevo apareció como un peritoneo engrosado y amarillento, y se asumió que era causada por la caída de óvulos o folículos maduros con la posterior ruptura de la yema en la cavidad abdominal (Figuras 2C-E). Por otro lado, las lesiones macroscópicas en el grupo de infección masiva por IBV se restringieron principalmente al ovario, representando el 16,7% (1/6) y el 10% (1/10) del total de hembras infectadas a los 9 y 19 dpi, respectivamente (Tabla 2). Las hembras infectadas presentaban folículos ováricos inflamados y congestionados (Figura 2F).
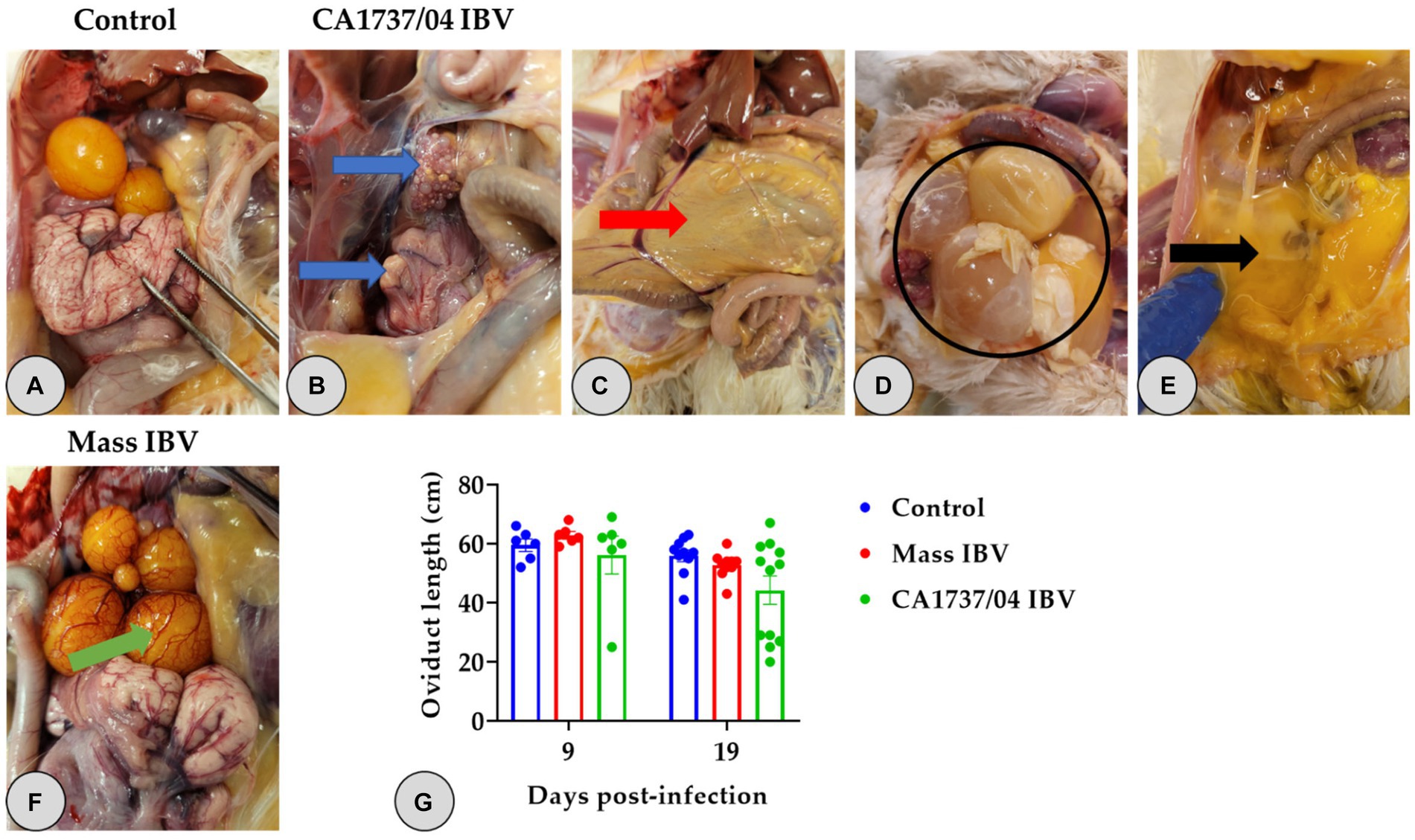 Figura 2. Lesiones macroscópicas reproductivas (A-F) y longitudes del oviducto (G) a los 9 y 19 días después de la infección por las cepas Mass (15AB-01) y CA1737/04 IBV. (A) Se refiere al grupo control sin lesiones macroscópicas. (B-E) Muestra lesiones macroscópicas observadas en el grupo infectado por el IBV CA1737/04; las flechas azules revelan la regresión del ovario y el oviducto; la flecha roja indica un peritoneo amarillento; El círculo negro y la flecha se refieren a los huevos y a la yema rota dentro de la cavidad abdominal, respectivamente. (F) Muestra folículos ováricos congestionados en el grupo infectado por IBV masivo (flecha verde). (G) Representa las medias de las longitudes de los oviductos que se compararon entre los grupos utilizando la prueba de Kruskal-Wallis seguida de la prueba de comparación múltiple de Dunn. Las barras de error representan SEM.
Figura 2. Lesiones macroscópicas reproductivas (A-F) y longitudes del oviducto (G) a los 9 y 19 días después de la infección por las cepas Mass (15AB-01) y CA1737/04 IBV. (A) Se refiere al grupo control sin lesiones macroscópicas. (B-E) Muestra lesiones macroscópicas observadas en el grupo infectado por el IBV CA1737/04; las flechas azules revelan la regresión del ovario y el oviducto; la flecha roja indica un peritoneo amarillento; El círculo negro y la flecha se refieren a los huevos y a la yema rota dentro de la cavidad abdominal, respectivamente. (F) Muestra folículos ováricos congestionados en el grupo infectado por IBV masivo (flecha verde). (G) Representa las medias de las longitudes de los oviductos que se compararon entre los grupos utilizando la prueba de Kruskal-Wallis seguida de la prueba de comparación múltiple de Dunn. Las barras de error representan SEM.
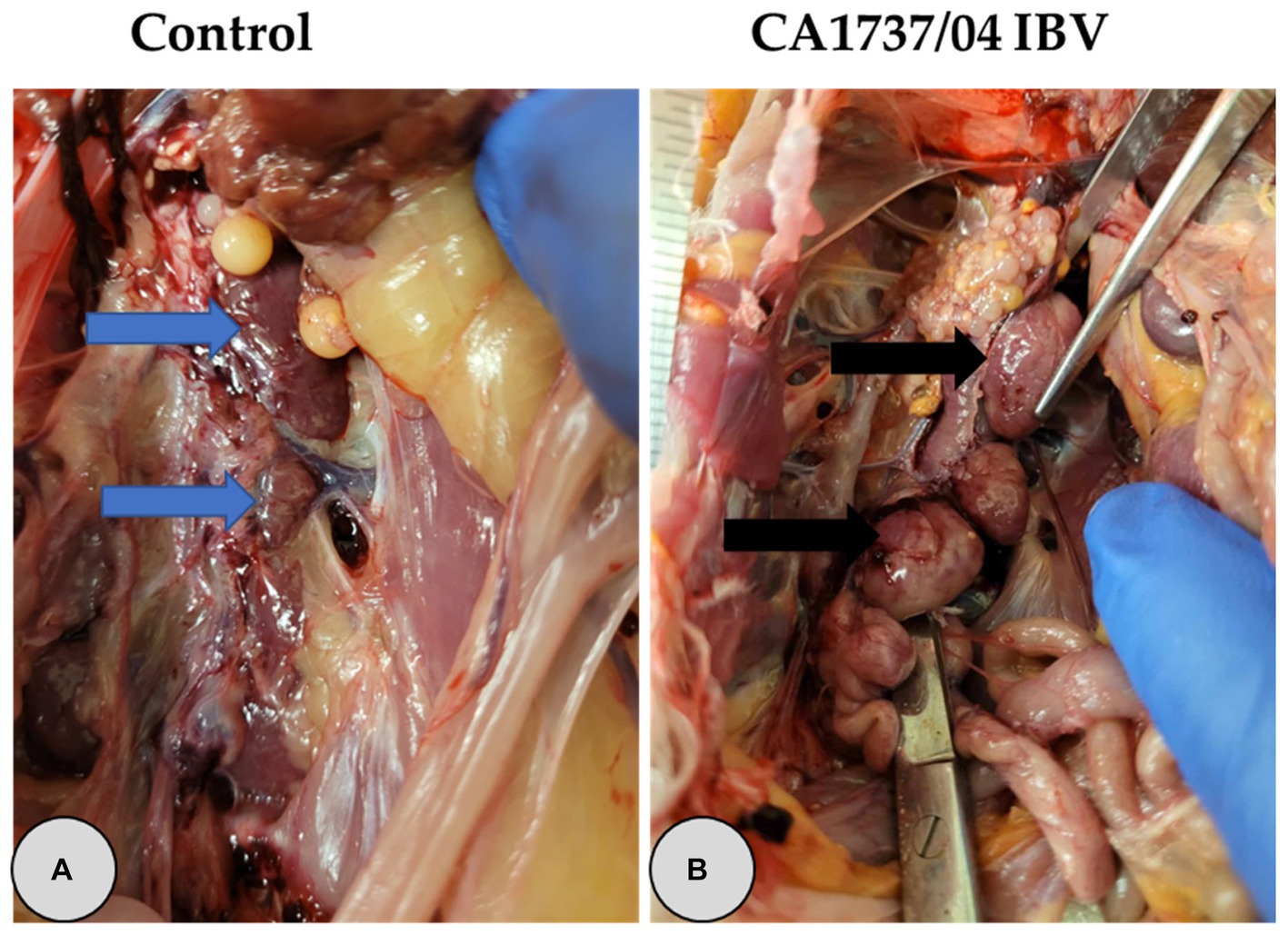 Figura 3. Lesiones macroscópicas representativas observadas en el riñón a los 9 y 19 días después de la infección por la cepa CA1737/04 del IBV. (A) Se refiere al grupo control sin lesiones macroscópicas (indicado con flechas azules). (B) Revela un riñón inflamado (mostrado por flechas negras).
Figura 3. Lesiones macroscópicas representativas observadas en el riñón a los 9 y 19 días después de la infección por la cepa CA1737/04 del IBV. (A) Se refiere al grupo control sin lesiones macroscópicas (indicado con flechas azules). (B) Revela un riñón inflamado (mostrado por flechas negras).
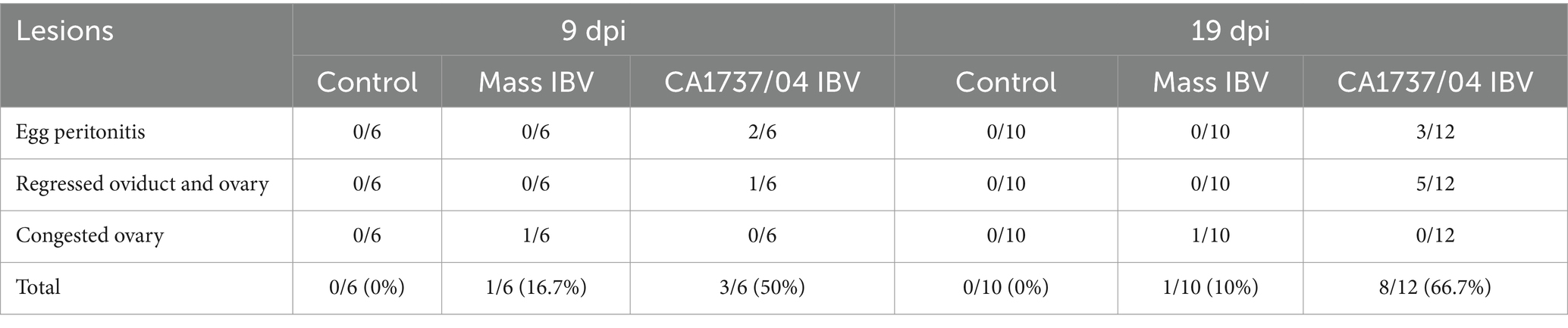 Tabla 2. Hallazgos de la necropsia de los órganos reproductores a los 9 y 19 días después de la infección con las cepas Mass IBV (15AB-01) y CA1737/04 IBV.
Tabla 2. Hallazgos de la necropsia de los órganos reproductores a los 9 y 19 días después de la infección con las cepas Mass IBV (15AB-01) y CA1737/04 IBV.
Una gallina (1/6) y dos gallinas (2/12) del grupo infectado por el IBV CA1737/04 experimentaron una marcada inflamación del riñón con depósito de urato a los 9 y 19 ppp (Figura 3B), respectivamente. Teniendo en cuenta la longitud del oviducto, no hubo diferencias significativas en la media de la longitud del oviducto entre los grupos infectados y los infectados simulados (p > 0,05) a los 9 y 19 dpi.
3.3 Respuesta inmunitaria mediada por anticuerpos
Los títulos de anticuerpos anti-IBV en todos los grupos en el lavado de suero y oviducto se muestran en las Figuras 4A y B, respectivamente. Los lavados de sueros y oviductos del grupo control no tuvieron títulos específicos de anticuerpos anti-IBV durante el período experimental. Los títulos de anticuerpos en sueros de los grupos infectados por Mass y CA1737/04 IBV fueron significativamente más altos que los monitoreados en el grupo control (p < 0,05) a los 9, 13 y 19 dpi. No se observaron diferencias significativas en los anticuerpos séricos anti-IBV entre los grupos infectados por Mass y CA1737/04 IBV (p > 0,05) a lo largo del experimento.
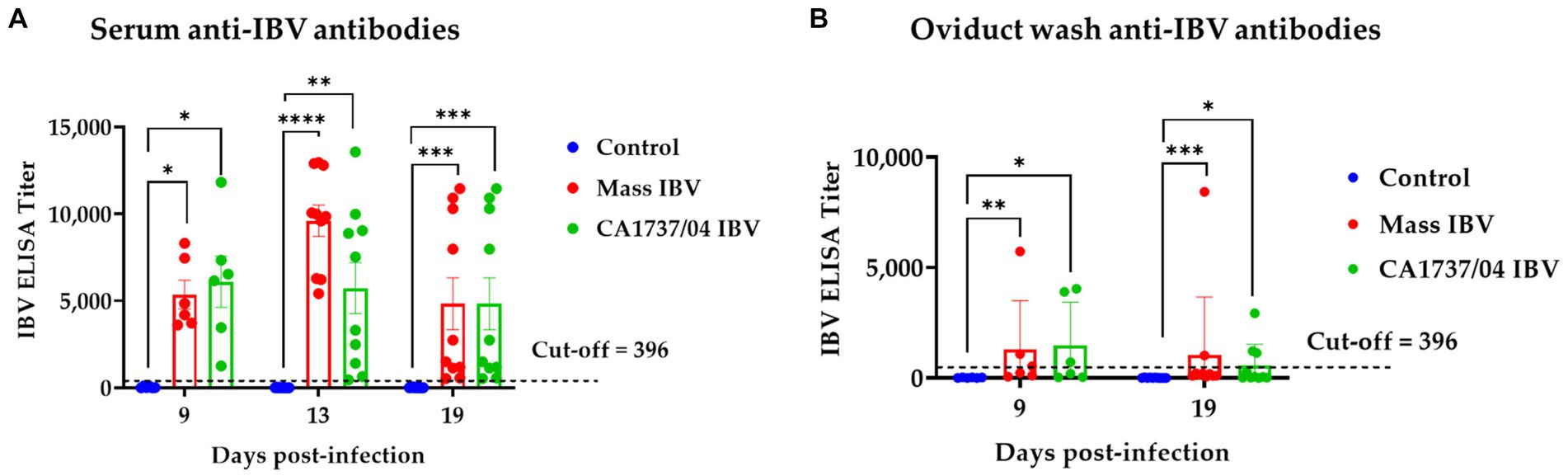 Figura 4. Anticuerpos anti-IBV en suero (A) y lavados de oviductos (B) recolectados en diferentes momentos después de la infección con cepas de IBV Mass (15AB-01) y CA1737/04 IBV. Los títulos medios se compararon entre los grupos experimentales mediante la prueba de Kruskal-Wallis y la prueba de comparación múltiple de Dunn. Las barras de error representan SEM. Los asteriscos indican diferencias significativas (p < 0,05, p < 0,01, p < 0,001 y p < 0,0001). **********
Figura 4. Anticuerpos anti-IBV en suero (A) y lavados de oviductos (B) recolectados en diferentes momentos después de la infección con cepas de IBV Mass (15AB-01) y CA1737/04 IBV. Los títulos medios se compararon entre los grupos experimentales mediante la prueba de Kruskal-Wallis y la prueba de comparación múltiple de Dunn. Las barras de error representan SEM. Los asteriscos indican diferencias significativas (p < 0,05, p < 0,01, p < 0,001 y p < 0,0001). **********
De manera similar, los grupos de infección por CA1737/04 y Mass IBV tuvieron anticuerpos anti-IBV significativamente más altos en el lavado de oviductos que los medidos en el grupo control (p < 0,05) a los 9 y 19 dpi. No hubo diferencias significativas entre los dos grupos infectados (p > 0,05) en los títulos de anticuerpos anti-IBV en ambos momentos.
3.4 Cuantificación de la carga genómica del IBV
3.4.1 Cargas genómicas del IBV en hisopos orofaríngeos y cloacales
Las cargas genómicas del IBV en hisopos OP y CL de todos los grupos se muestran en las Figuras 5A y B, respectivamente. Ninguna de las gallinas del grupo de control demostró excreción viral en los hisopos de OP y CL durante el período de observación. En general, el grupo infectado por el IBV CA1737/04 mostró cargas genómicas limitadas del IBV en los hisopos OP (Figura 5A). Las cargas genómicas del IBV en los hisopos OP del grupo Mass fueron significativamente mayores que las detectadas en el grupo infectado por IBV CA1737/04 y también en el grupo control (p < 0,05) a 3, 7 y 9 dpi. No se observó excreción viral a los 13 y 19 dpi. En cuanto a los hisopos de CL, las cargas genómicas del IBV en el grupo infectado por IBV masivo fueron significativamente mayores que las del grupo control (p < 0,05) a 3 dpi. Sin embargo, no se detectaron diferencias significativas entre los grupos (p > 0,05) a los 7 y 9 dpi. Las cargas genómicas del IBV en el grupo infectado por IBV CA1737/04 fueron significativamente mayores en comparación con el grupo control (p < 0,0,05) a 13 dpi. No hubo diferencias significativas en las cargas genómicas del IBV entre todos los grupos experimentales (p > 0,05) a los 19 dpi.
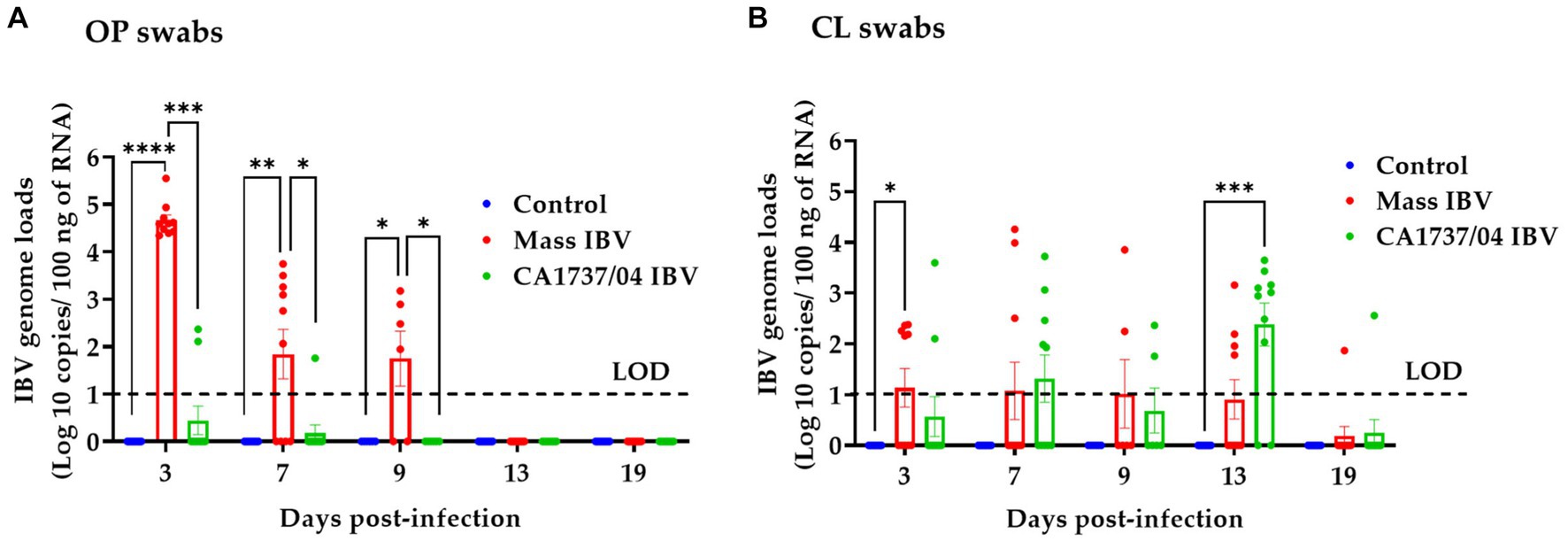 Figura 5. Las cargas genómicas del IBV se cuantificaron a partir de hisopos OP (A) y CL (B) recolectados a los 3, 7, 9, 13 y 19 días después de la infección con las cepas Mass (15AB-01) y CA1737/04 IBV. Para analizar las diferencias entre los grupos se utilizó la prueba de Kruskal-Wallis seguida de la prueba de comparación múltiple de Dunn. Las barras de error representan SEM. Los asteriscos indican diferencias significativas (p < 0,05, p < 0,01, p < 0,001 y p < 0,0001). Las líneas punteadas indican el límite de detección (LOD) del ensayo RT-qPCR.**********
Figura 5. Las cargas genómicas del IBV se cuantificaron a partir de hisopos OP (A) y CL (B) recolectados a los 3, 7, 9, 13 y 19 días después de la infección con las cepas Mass (15AB-01) y CA1737/04 IBV. Para analizar las diferencias entre los grupos se utilizó la prueba de Kruskal-Wallis seguida de la prueba de comparación múltiple de Dunn. Las barras de error representan SEM. Los asteriscos indican diferencias significativas (p < 0,05, p < 0,01, p < 0,001 y p < 0,0001). Las líneas punteadas indican el límite de detección (LOD) del ensayo RT-qPCR.**********
3.4.2 Cargas genómicas del IBV en los tejidos
Las cargas genómicas del IBV en diferentes tejidos de todos los grupos experimentales obtenidas a 9 y 19 dpi se ilustran en la Figura 6. No se detectaron cargas genómicas de IBV en todos los tejidos del grupo de control durante todo el experimento. Los tejidos recolectados de los grupos de infección por CA1737/04 y Mass IBV mostraron cargas genómicas detectables de IBV; sin embargo, la diferencia significativa entre los grupos experimentales varió para cada tejido individual y punto de tiempo.
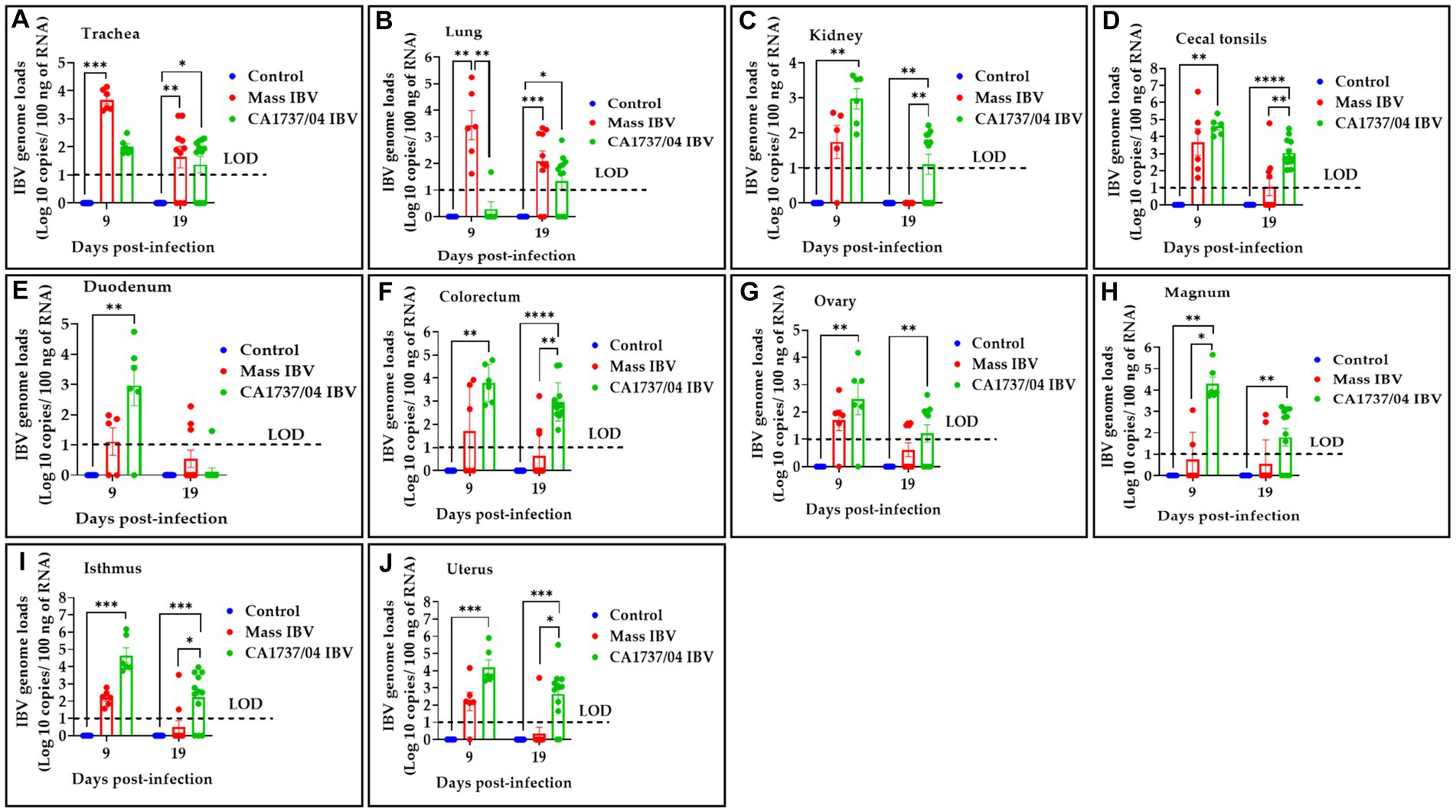 Figura 6. Se determinaron las cargas genómicas del IBV en tráquea (A), pulmón (B), riñón (C), amígdalas cecales (D), duodeno (E), colorrecto (F), ovario (G), magnum (H), istmo (I) y útero (J) recolectados a los 9 y 19 días después de la infección con las cepas de Mass (15AB-01) y CA1737/04 IBV. La diferencia de grupo se identificó mediante la prueba de Kruskal-Wallis seguida de la prueba de comparación múltiple de Dunn. Las barras de error representan SEM. Los asteriscos indican diferencias significativas (p < 0,05, p < 0,01, p < 0,001 y p < 0,0001). Las líneas punteadas muestran el límite de detección (LOD) del ensayo RT-qPCR.**********
Figura 6. Se determinaron las cargas genómicas del IBV en tráquea (A), pulmón (B), riñón (C), amígdalas cecales (D), duodeno (E), colorrecto (F), ovario (G), magnum (H), istmo (I) y útero (J) recolectados a los 9 y 19 días después de la infección con las cepas de Mass (15AB-01) y CA1737/04 IBV. La diferencia de grupo se identificó mediante la prueba de Kruskal-Wallis seguida de la prueba de comparación múltiple de Dunn. Las barras de error representan SEM. Los asteriscos indican diferencias significativas (p < 0,05, p < 0,01, p < 0,001 y p < 0,0001). Las líneas punteadas muestran el límite de detección (LOD) del ensayo RT-qPCR.**********
A los 9 dpi, el grupo infectado por el IBV con CA1737/04 tenía cargas genómicas del IBV significativamente mayores que las detectadas en el grupo control (p < 0,05) en todos los tejidos excepto en la tráquea y el pulmón (p > 0,05). Al mismo tiempo, el grupo infectado por el IBV con CA1737/04 mostró cargas genómicas del IBV significativamente más altas en comparación con las determinadas en el grupo infectado por el IBV masivo en magnum (p < 0,05). Por otro lado, el grupo infectado por IBV Mass mostró cargas genómicas de IBV más altas que las medidas en el grupo infectado por IBV CA1737/04 y el grupo control (p < 0,05) en el pulmón. Además, las cargas genómicas del IBV en la tráquea del grupo infectado por IBV fueron significativamente mayores que las observadas en el grupo control (p < 0,05).
Continuamente, a 19 dpi, el grupo infectado por el IBV con CA1737/04 mostró cargas genómicas de IBV más altas que las determinadas en el grupo control (p < 0,05) en todos los tejidos excepto en el duodeno (p > 0,05). Entre estos tejidos (riñón, amígdalas cecales, colorrectal, istmo y útero), hubo cargas genómicas significativamente mayores de IBV en el grupo infectado por IBV CA1737/04 en comparación con las detectadas en el grupo infectado por IBV masivo (p < 0,05).
3.5 Hallazgos histopatológicos
No se observaron lesiones microscópicas evidentes en ninguno de los tejidos examinados del grupo control durante todo el estudio (Figuras 7A1-E1, 8F1-I1). Sin embargo, en ambos grupos infectados por el IBV, las lesiones histopatológicas típicas inducidas por el IBV fueron evidentes en los tejidos recolectados a los 9 y 19 dpi.
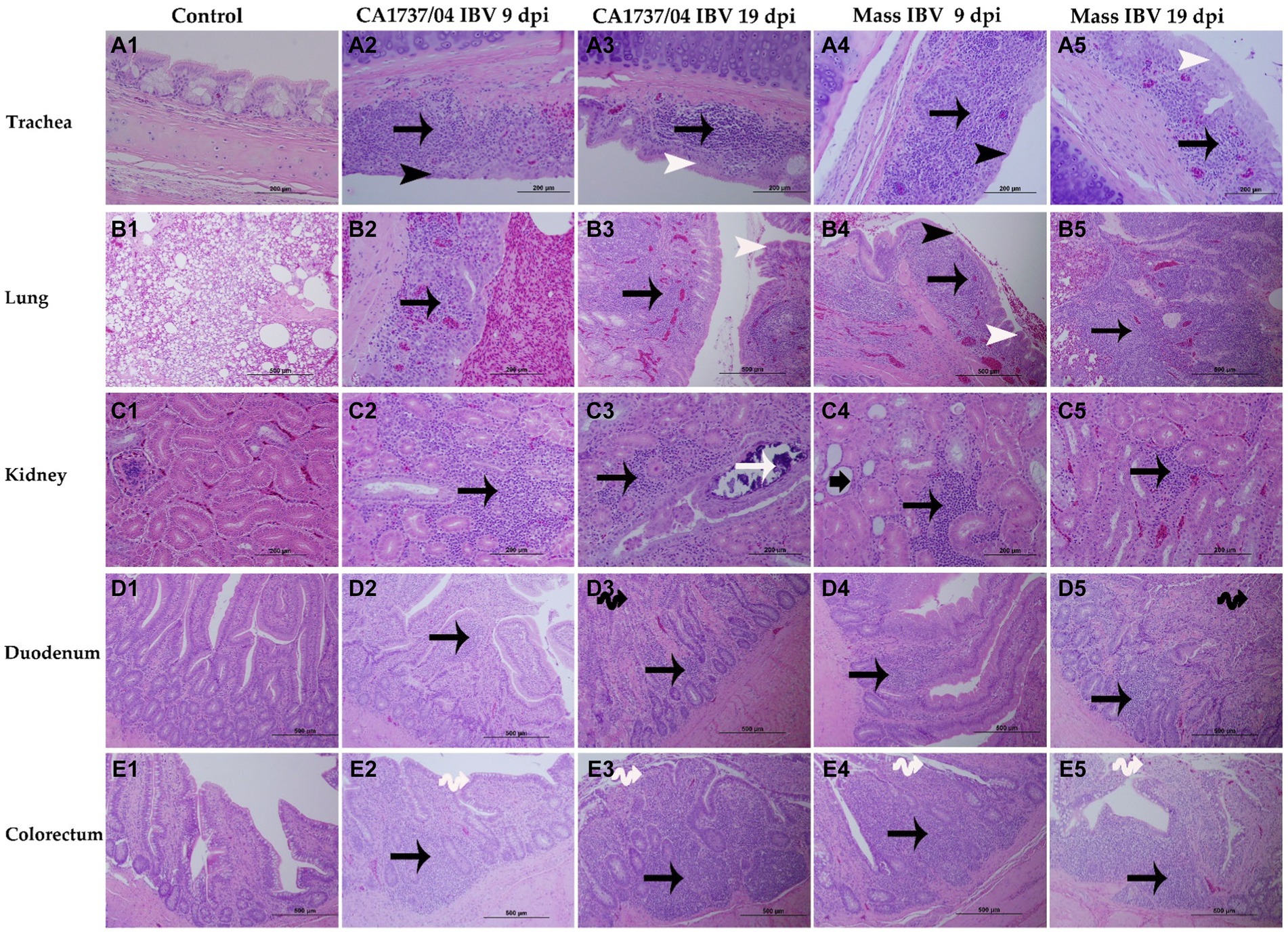 Figura 7. Cambios microscópicos observados en la tráquea (A1-A5), el pulmón (B1-B5), el riñón (C1-C5), el duodeno (D1-D5) y el colorrecto (E1-E5) a los 9 y 19 días después de la infección por las cepas de Mass (15AB-01) y CA1737/04 IBV. A1–E1 son controles. A2-E2 y A3-E3 muestran lesiones en el grupo de infección por IBV CA1737/04 a los 9 y 19 dpi, respectivamente. Mientras que A4-E4 y A5-E5 se refieren a lesiones en el grupo de infección masiva por IBV a los 9 y 19 dpi, respectivamente. Las flechas negras indican infiltraciones de células inflamatorias; las flechas negras de la cabeza muestran adelgazamiento epitelial; las flechas de punta blanca se refieren a la hiperplasia epitelial; la flecha blanca muestra depósitos intraluminales de color azul oscuro; La flecha negra corta-gruesa se refiere a la dilatación tubular; flechas negras dobles indican atrofia de vellosidades; Las flechas blancas dobles muestran la necrosis de las células epiteliales de las vellosidades intestinales.
Figura 7. Cambios microscópicos observados en la tráquea (A1-A5), el pulmón (B1-B5), el riñón (C1-C5), el duodeno (D1-D5) y el colorrecto (E1-E5) a los 9 y 19 días después de la infección por las cepas de Mass (15AB-01) y CA1737/04 IBV. A1–E1 son controles. A2-E2 y A3-E3 muestran lesiones en el grupo de infección por IBV CA1737/04 a los 9 y 19 dpi, respectivamente. Mientras que A4-E4 y A5-E5 se refieren a lesiones en el grupo de infección masiva por IBV a los 9 y 19 dpi, respectivamente. Las flechas negras indican infiltraciones de células inflamatorias; las flechas negras de la cabeza muestran adelgazamiento epitelial; las flechas de punta blanca se refieren a la hiperplasia epitelial; la flecha blanca muestra depósitos intraluminales de color azul oscuro; La flecha negra corta-gruesa se refiere a la dilatación tubular; flechas negras dobles indican atrofia de vellosidades; Las flechas blancas dobles muestran la necrosis de las células epiteliales de las vellosidades intestinales.
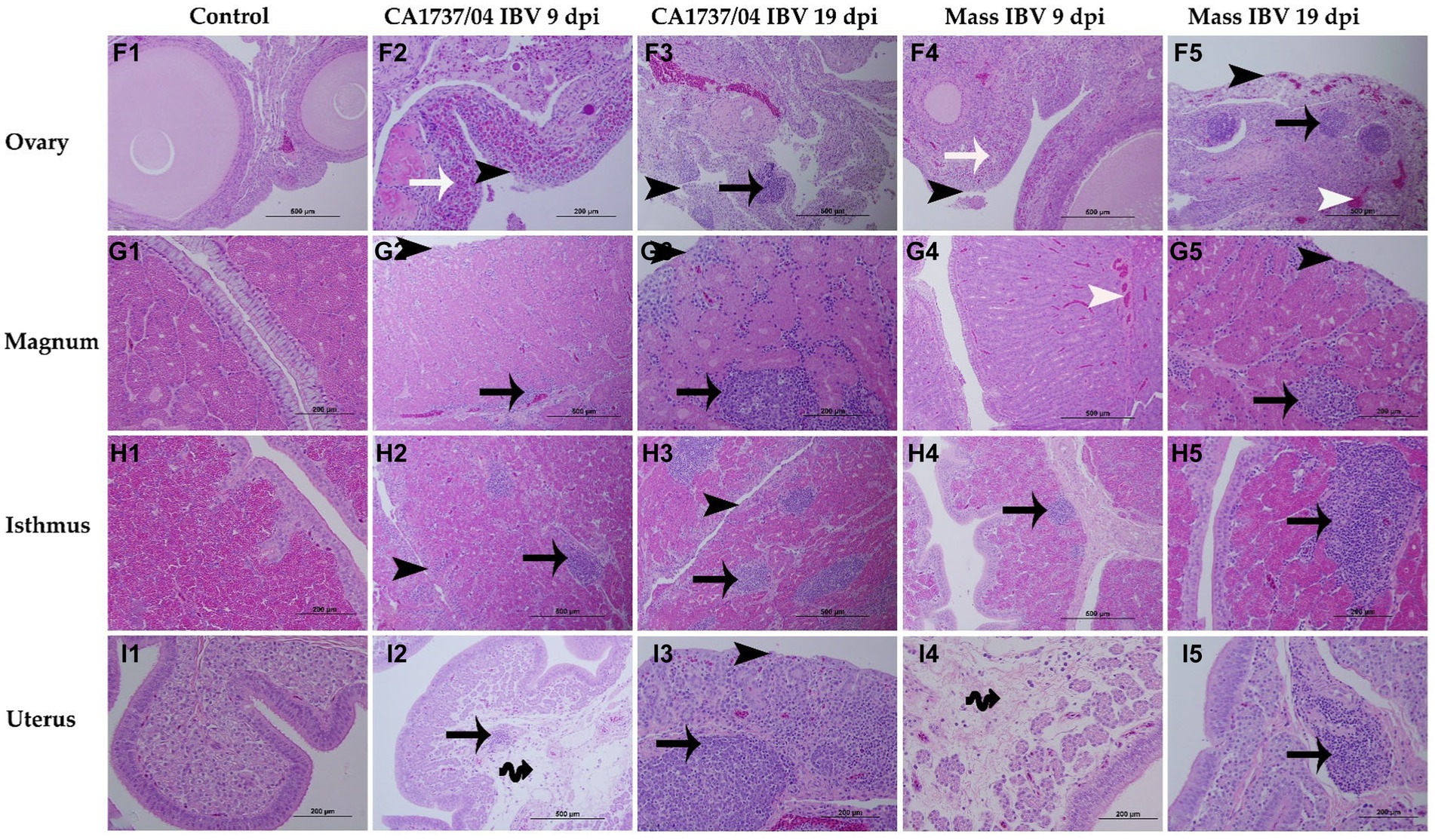 Figura 8. Cambios microscópicos observados en el ovario (F1-F5), el magnum (G1-G5), el istmo (H1-H5) y el útero (I1-I5) a los 9 y 19 días después de la infección por las cepas CA1737/04 y Mass IBV. F1–I1 son controles. F2-I2 y F3-I3 representan lesiones detectadas en el grupo infectado por el IBV CA1737/04 a los 9 y 19 dpi, respectivamente. Mientras que F4-I4 y F5-I5 muestran lesiones observadas en el grupo de masa a 9 y 19 dpi, respectivamente. Las flechas de punta negra se refieren a pérdidas epiteliales y ciliares; las flechas de punta blanca muestran capilares sanguíneos congestionados; las flechas negras indican infiltraciones de células mononucleares; las flechas blancas se refieren a los heterófilos; Las flechas negras dobles muestran edema.
Figura 8. Cambios microscópicos observados en el ovario (F1-F5), el magnum (G1-G5), el istmo (H1-H5) y el útero (I1-I5) a los 9 y 19 días después de la infección por las cepas CA1737/04 y Mass IBV. F1–I1 son controles. F2-I2 y F3-I3 representan lesiones detectadas en el grupo infectado por el IBV CA1737/04 a los 9 y 19 dpi, respectivamente. Mientras que F4-I4 y F5-I5 muestran lesiones observadas en el grupo de masa a 9 y 19 dpi, respectivamente. Las flechas de punta negra se refieren a pérdidas epiteliales y ciliares; las flechas de punta blanca muestran capilares sanguíneos congestionados; las flechas negras indican infiltraciones de células mononucleares; las flechas blancas se refieren a los heterófilos; Las flechas negras dobles muestran edema.
En la tráquea, ambos grupos infectados por el IBV mostraron un patrón similar de lesiones traqueales. Las lesiones se caracterizaron por adelgazamiento epitelial con deciliación, pérdida de células caliciformes y dilatación de las glándulas mucosas a los 9 dpi. Además, la lámina propia se engrosó con infiltraciones difusas de células linfoplasmocíticas (Figuras 7A2, A4). A los 19 dpi, las lesiones patológicas fueron principalmente menos intensas y consistieron en hiperplasia epitelial y agregaciones de células linfoplasmocíticas debajo del epitelio (Figuras 7A3, A5). No hubo diferencias significativas entre los dos grupos infectados por el IBV en cuanto a las puntuaciones de las lesiones traqueales (p > 0,05); sin embargo, los dos grupos presentaron lesiones patológicas significativamente mayores que las calculadas en el grupo control (p < 0,05) a los 9 y 19 dpi (Figura 9A).
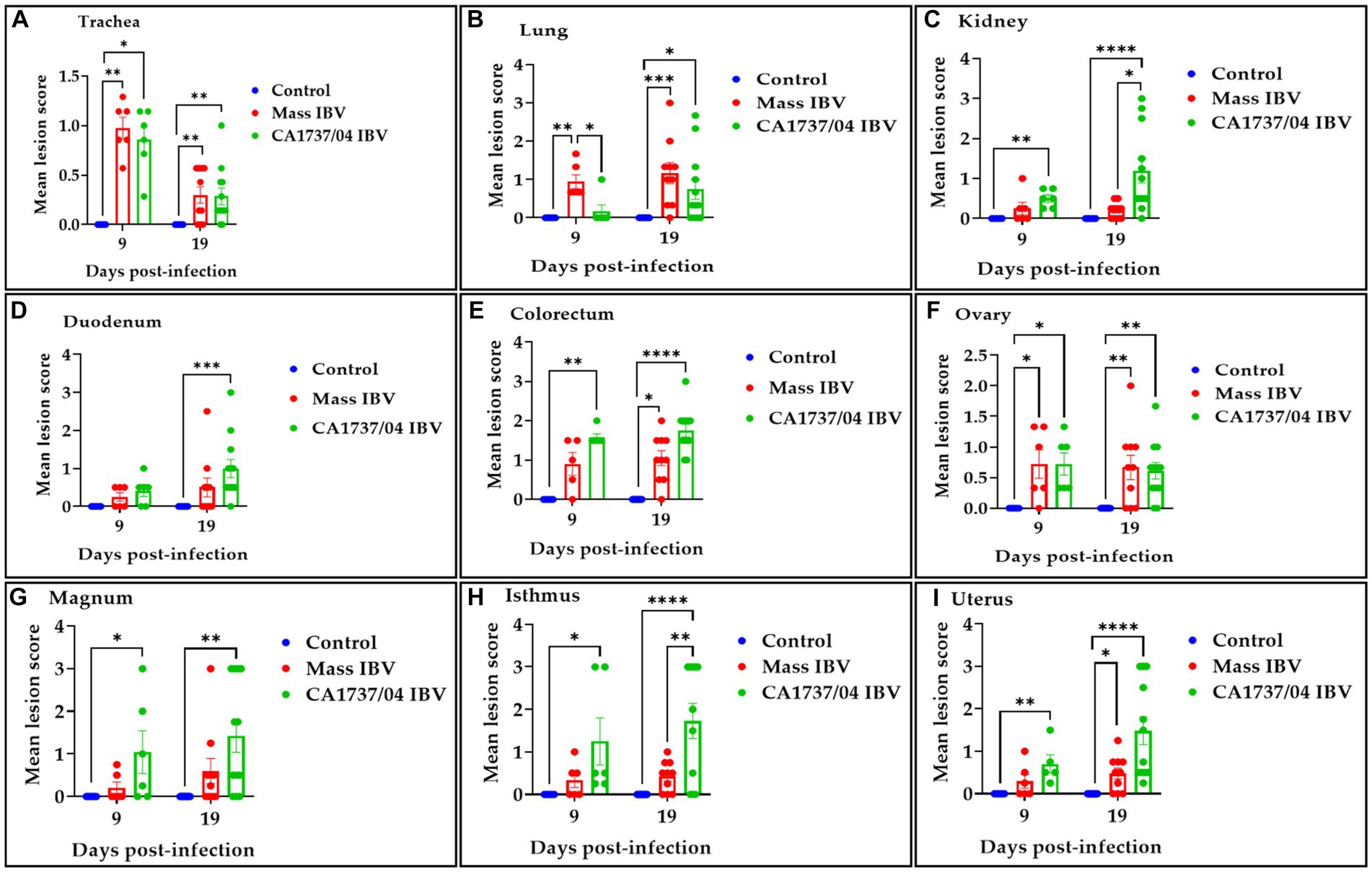 Figura 9. Se puntuaron lesiones histopatológicas en tráquea (A), pulmón (B), riñón (C), duodeno (D), colorrecto (E), ovario (F), magnum (G), istmo (H) y útero (I) a los 9 y 19 días después de la infección por Mass (15AB-01) y cepas de IBV CA1737/04. Las puntuaciones medias se compararon entre los grupos mediante la prueba de Kruskal-Wallis seguida de la prueba de comparación múltiple de Dunn. Las barras de error representan SEM. Los asteriscos indican diferencias significativas (p < 0,05, p < 0,01, p < 0,001 y p < 0,0001). **********
Figura 9. Se puntuaron lesiones histopatológicas en tráquea (A), pulmón (B), riñón (C), duodeno (D), colorrecto (E), ovario (F), magnum (G), istmo (H) y útero (I) a los 9 y 19 días después de la infección por Mass (15AB-01) y cepas de IBV CA1737/04. Las puntuaciones medias se compararon entre los grupos mediante la prueba de Kruskal-Wallis seguida de la prueba de comparación múltiple de Dunn. Las barras de error representan SEM. Los asteriscos indican diferencias significativas (p < 0,05, p < 0,01, p < 0,001 y p < 0,0001). **********
Las lesiones pulmonares se encontraron predominantemente en los bronquios secundarios. La mucosa de los bronquios secundarios reveló hiperplasia epitelial y/o adelgazamiento, y el tejido subepitelial se expandió debido a infiltraciones de células mononucleares y capilares sanguíneos congestionados (Figuras 7B2, B4). Estas lesiones se observaron en la mayoría de las gallinas del grupo infectado por IBV masivo y solo en una gallina del grupo infectado por IBV CA1737/04 a 9 dpi. Las lesiones bronquiales persistieron a 19 dpi en el grupo CA1737/04 (Figura 7B3). Sin embargo, en algunas gallinas del grupo infectado por Mass IBV, las lesiones ocupaban una amplia área del parénquima pulmonar, en la que había una marcada necrosis de aurículas e infundíbulos con infiltraciones difusas de las células mononucleares y materiales proteicos eosinófilos (Figura 7B5). El grupo Mass tuvo puntuaciones de lesión pulmonar significativamente más altas que las calculadas en el grupo infectado por IBV CA1737/04 y en el grupo control (p < 0,05) a 9 dpi. En comparación con el grupo control, las puntuaciones de las lesiones en los dos grupos infectados fueron significativamente más altas (p < 0,05) a los 19 dpi (Figura 9B).
En el riñón, las lesiones microscópicas consistieron en infiltraciones de células linfoplasmocíticas en el tejido intersticial en la mayoría de las gallinas del grupo infectado por CA1737/04 IBV a 9 dpi. Sin embargo, solo un ave en el grupo Mass mostró infiltraciones moderadas de células linfoplasmocíticas intersticiales con dilatación tubular (Figuras 7C2, C4). El grupo infectado por el IBV CA1737/04 mostró lesiones graves a los 19 dpi, incluyendo necrosis epitelial con descamación, depósitos intraluminales de color azul oscuro e infiltraciones linfoplasmocíticas o heterófilas del intersticio (Figura 7C3). Por otro lado, pocas gallinas en el grupo infectado por IBV masivo presentaron infiltraciones de células mononucleares focalmente leves en el tejido intersticial a 19 dpi (Figura 7C5). Las puntuaciones de la lesión histopatológica renal fueron significativamente más altas en el grupo infectado por el IBV con CA1737/04 en comparación con el grupo control a los 9 ppp (Figura 9C; p < 0,05). A los 19 dpi, el grupo infectado por el IBV con CA1737/04 tuvo puntuaciones de lesión significativamente más altas que las observadas en el grupo infectado por el IBV masivo y en el grupo control (p < 0,05).
En cuanto a los tejidos entéricos, los cambios microscópicos en el duodeno incluyeron infiltraciones focales de células mononucleares, ocasionalmente heterófilos en la lámina propia a 9 dpi; sin embargo, pocas gallinas tenían vellosidades atrofiadas a 19 dpi en ambos grupos infectados (Figuras 7D2-D5). En el colorrecto hubo degeneración y necrosis con desprendimiento ocasional de células epiteliales de las vellosidades intestinales, y el tejido subepitelial se infiltró difusa o focalmente con células linfohistiocíticas a 9 dpi. Estas lesiones fueron continuas hasta los 19 dpi en los dos grupos infectados (Figuras 7E2-E5). Las puntuaciones de lesión en el colorrecto del grupo infectado por el IBV CA1737/04 fueron significativamente más graves que las observadas en el grupo control (p < 0,05) a los 9 dpi. A los 19 dpi, las puntuaciones de lesión del colorrecto de ambos grupos infectados por el IBV fueron significativamente más altas en comparación con el grupo control (Figura 9E; p < 0,05). En cuanto al duodeno, las puntuaciones de lesión en el grupo infectado por el IBV CA1737/04 fueron significativamente superiores a las calculadas en el grupo control a 19 dpi (Figura 9D; p < 0,05).
En el ovario, las lesiones histopatológicas fueron casi idénticas tanto en el grupo de infección por CA1737/04 como en el de Mass IBV. Estas lesiones consistieron en necrosis parcheada del epitelio ovárico, y el estroma cortical se infiltró focal o multifocalmente con infiltraciones de células inflamatorias principalmente de heterófilos y/o tipos de células mononucleares, además de congestión de los capilares sanguíneos (Figuras 8F2-F5). Ambos grupos infectados por el IBV presentaron puntuaciones de lesiones patológicas significativamente graves en comparación con las observadas en el grupo control (p < 0,05), sin embargo, no se detectaron diferencias significativas entre ellos (Figura 9F; p > 0,05) a 9 y 19 dpi.
En diferentes porciones del oviducto (magnum, istmo y útero), las lesiones histopatológicas fueron más evidentes en el grupo infectado por IBV con CA1737/04 que en el grupo infectado por IBV masivo. En el grupo infectado por el IBV CA1737/04, las lesiones de magnum e istmo consistieron en pérdidas epiteliales y ciliares, infiltraciones de células mononucleares, edema y congestión de los capilares sanguíneos en la lámina propia a los 9 dpi (Figuras 8G2, H2). Estas lesiones se expandieron y se pronunciaron a los 19 dpi (Figuras 8G3, H3). En el útero del grupo infectado por el IBV CA1737/04 había epitelio ciliado intacto, pocas infiltraciones de células mononucleares y edema en la lámina propia a los 9 dpi (Figura 8I2). Sin embargo, los epitelios y cilios se perdieron junto con la expansión de la infiltración de células inflamatorias debajo del epitelio a los 19 ppp (Figura 8I3). Por otro lado, los hallazgos microscópicos en el grupo infectado por IBV masivo fueron en forma de epitelio intacto y lámina propia engrosada como resultado del edema y las infiltraciones de células mononucleares, particularmente en el istmo y el útero (Figuras 8H4, H5, I4, I5). En el mágnum, las lesiones solo se caracterizaron por la congestión de los capilares sanguíneos debajo del epitelio a 9 ppp (Figura 8G4). Sin embargo, pocas gallinas exhibieron desprendimiento epitelial, deciliación e infiltraciones de células mononucleares en la lámina propia a 19 dpi (Figura 8G5). Las puntuaciones de lesión en el grupo infectado por el IBV CA1737/04 fueron significativamente más altas que las calculadas en el grupo control (p < 0,05) a los 9 y 19 dpi. Además, el grupo infectado por el IBV con CA1737/04 tuvo puntuaciones histopatológicas significativamente más altas que las calculadas en el útero del grupo infectado por el IBV masivo (Figuras 9G-I; p < 0,05).
3.6 Inmunohistoquímica
Se utilizó el ensayo IHQ para determinar la distribución del antígeno viral en la tráquea, pulmón, riñón, amígdalas cecales, duodeno, colorrectal, ovario y diferentes partes del oviducto a 9 y 19 dpi. Los tejidos examinados del grupo control no mostraron inmunorreactividad durante todo el experimento (Figuras 10A1-C1, 11D1-F1, 12G1-J1).
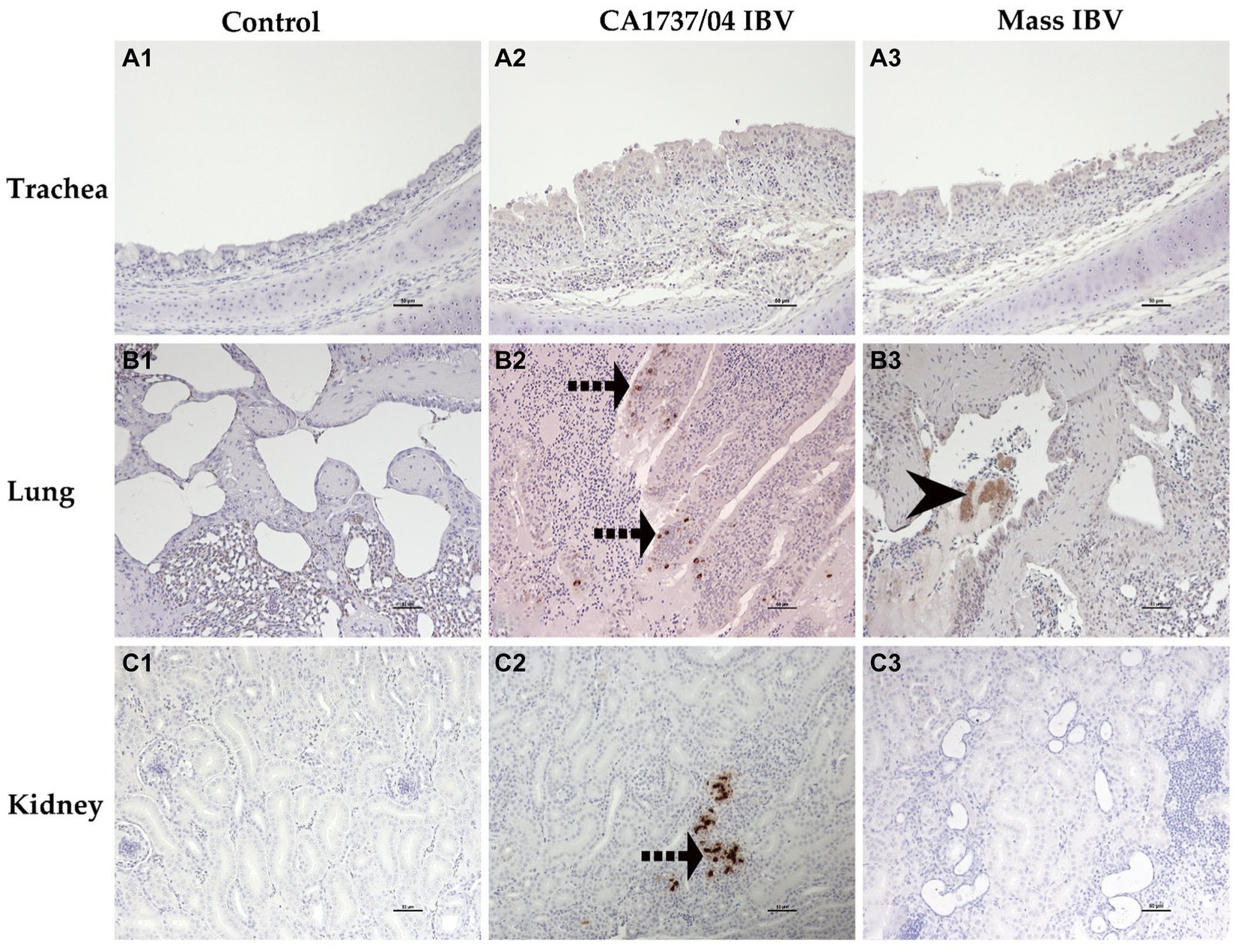 Figura 10. Detección inmunohistoquímica del antígeno del IBV en tráquea (A1-A3), pulmón (B1-B3) y riñón (C1-C3) recolectada a los 9 y 19 dpi. A1–C1 son controles. A2,A3 no representan expresión del antígeno del IBV en la tráquea de ambos grupos infectados por el IBV. B2,C2 revelan la expresión del antígeno IBV en el grupo infectado por CA1737/04-IBV. B3 muestra expresión del antígeno del IBV en el grupo infectado por el IBV en masa. Las flechas negras punteadas y la flecha negra de la cabeza indican el inmunomarcaje del antígeno viral en epitelios intactos y desprendidos, respectivamente. Barra de escala = 50 μm.
Figura 10. Detección inmunohistoquímica del antígeno del IBV en tráquea (A1-A3), pulmón (B1-B3) y riñón (C1-C3) recolectada a los 9 y 19 dpi. A1–C1 son controles. A2,A3 no representan expresión del antígeno del IBV en la tráquea de ambos grupos infectados por el IBV. B2,C2 revelan la expresión del antígeno IBV en el grupo infectado por CA1737/04-IBV. B3 muestra expresión del antígeno del IBV en el grupo infectado por el IBV en masa. Las flechas negras punteadas y la flecha negra de la cabeza indican el inmunomarcaje del antígeno viral en epitelios intactos y desprendidos, respectivamente. Barra de escala = 50 μm.
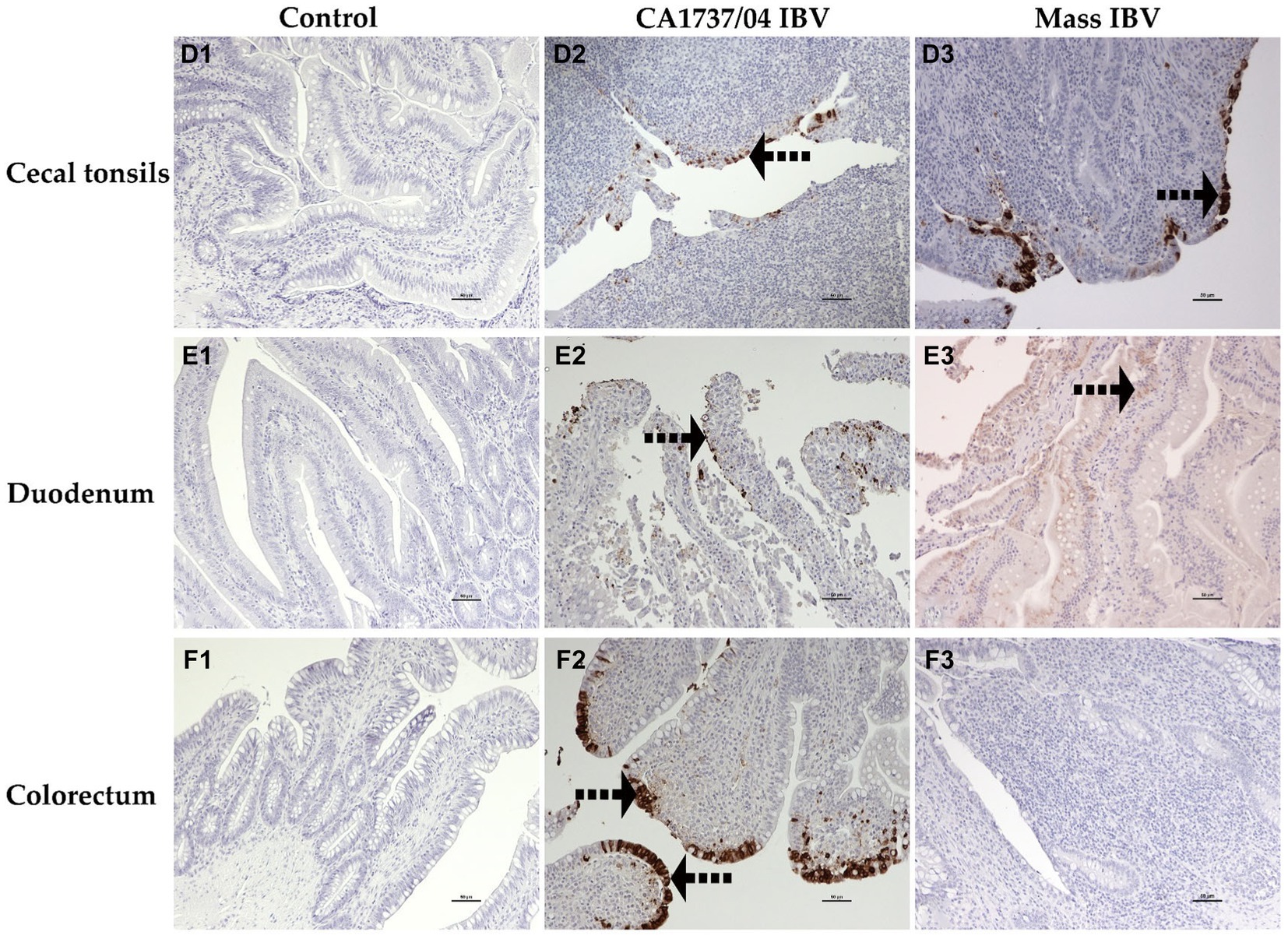 Figura 11. Detección inmunohistoquímica del antígeno del IBV en amígdalas cecales (D1-D3), duodeno (E1-E3) y colorrecto (F1-F3) recogidas a los 9 y 19 dpi. D1–F1 son controles. D2–F2 representa la expresión del antígeno del IBV en el grupo infectado por el IBV CA1737/04. D3,E3 muestran expresión del antígeno del IBV en el grupo infectado en masa. Las flechas negras punteadas se refieren al inmunomarcaje del antígeno viral en las células epiteliales. Barra de escala = 50 μm.
Figura 11. Detección inmunohistoquímica del antígeno del IBV en amígdalas cecales (D1-D3), duodeno (E1-E3) y colorrecto (F1-F3) recogidas a los 9 y 19 dpi. D1–F1 son controles. D2–F2 representa la expresión del antígeno del IBV en el grupo infectado por el IBV CA1737/04. D3,E3 muestran expresión del antígeno del IBV en el grupo infectado en masa. Las flechas negras punteadas se refieren al inmunomarcaje del antígeno viral en las células epiteliales. Barra de escala = 50 μm.
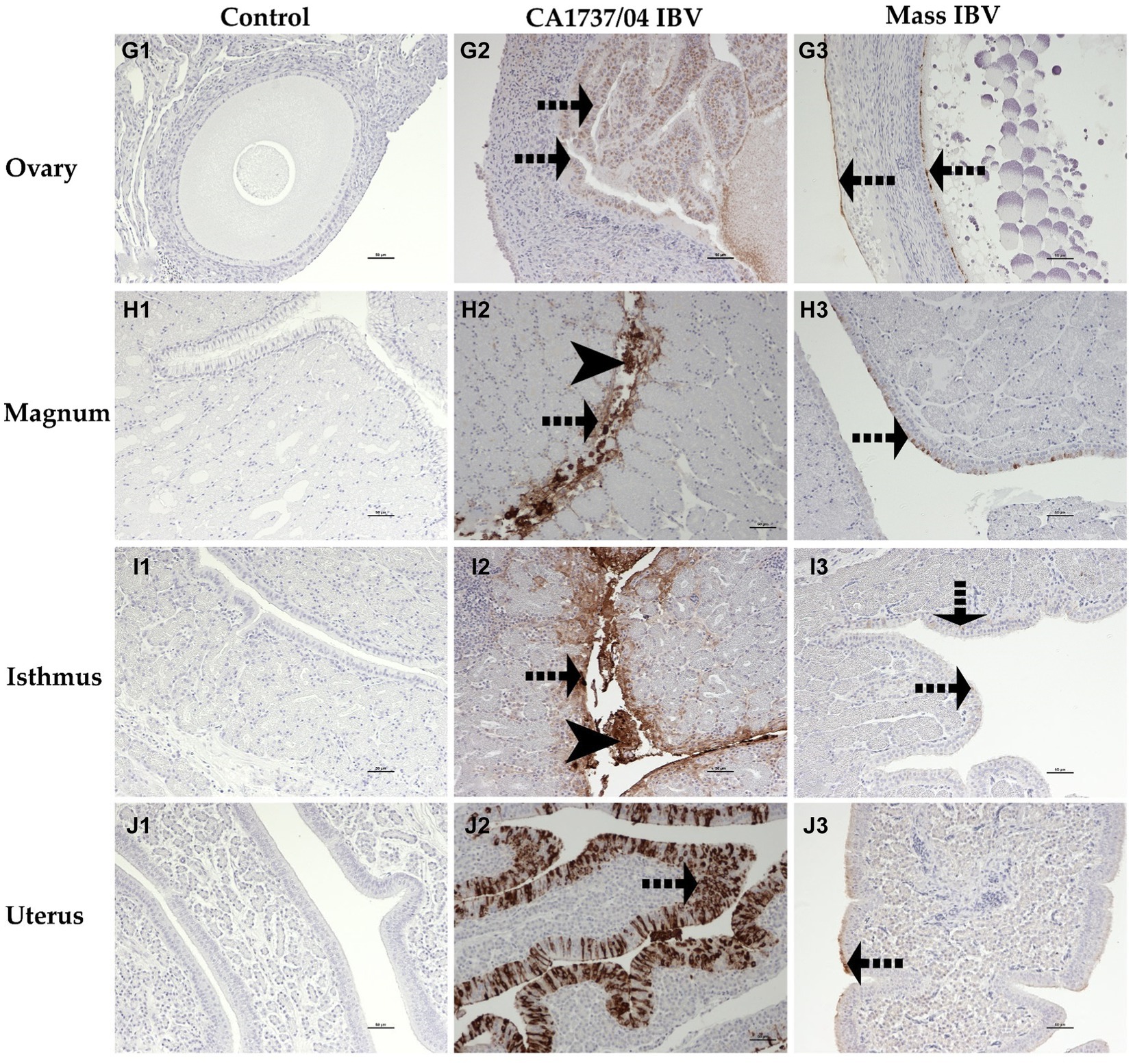 Figura 12. Detección inmunohistoquímica del antígeno del IBV en el ovario (G1-G3), magnum (H1-H3), istmo (I1-I3) y útero (J1-J3) recolectada a los 9 y 19 dpi. G1–J1 son controles. G2–J2 representan la expresión del antígeno del IBV en el grupo infectado por el IBV CA1737/04. G3-J3 muestran expresión del antígeno del IBV en el grupo de infección masiva por IBV. Las flechas negras punteadas y las flechas negras de la cabeza indican el etiquetado del antígeno viral en epitelios intactos y desprendidos, respectivamente. Barra de escala = 50 μm.
Figura 12. Detección inmunohistoquímica del antígeno del IBV en el ovario (G1-G3), magnum (H1-H3), istmo (I1-I3) y útero (J1-J3) recolectada a los 9 y 19 dpi. G1–J1 son controles. G2–J2 representan la expresión del antígeno del IBV en el grupo infectado por el IBV CA1737/04. G3-J3 muestran expresión del antígeno del IBV en el grupo de infección masiva por IBV. Las flechas negras punteadas y las flechas negras de la cabeza indican el etiquetado del antígeno viral en epitelios intactos y desprendidos, respectivamente. Barra de escala = 50 μm.
En el grupo infectado por el IBV CA1737/04, todos los tejidos analizados tuvieron un inmunomarcaje positivo, excepto la tráquea. Por el contrario, solo el pulmón, las amígdalas cecales, el duodeno, el ovario y el istmo tuvieron inmunotinción positiva en el grupo infectado por el IBV masivo en el mismo momento. A los 19 dpi, el grupo infectado por el IBV CA1737/04 mostró inmunorreactividad persistente en la mayoría de los tejidos, excepto en el pulmón y el duodeno. Sin embargo, la inmunotinción en el grupo infectado por el IBV se limitó al ovario y a varios segmentos del oviducto.
La expresión del antígeno viral se limitó principalmente a las células epiteliales de diferentes tejidos en ambos grupos infectados. En la tráquea, tanto las cepas CA1737/04 como las cepas Mass IBV no mostraron ninguna inmunorreactividad (Figuras 10A2, A3). Mientras que, en el pulmón, la inmunopositividad se limitó a las células epiteliales que recubren los bronquios secundarios. Los epitelios positivos estaban intactos en el grupo infectado por el IBV con CA1737/04 o exfoliados dentro de la luz en el grupo infectado por el IBV masivo (Figuras 10B2, B3). Mientras que en el riñón, las células con antígeno positivo en el grupo de infección por IBV CA1737/04 se detectaron en el citoplasma de las células epiteliales tubulares (Figura 10C2). Sin embargo, el riñón del grupo infectado por Mass IBV no reveló inmunorreactividad durante todo el estudio (Figura 10C3). En las amígdalas cecales y el duodeno de ambos grupos infectados por el IBV, el antígeno viral se expresó en el citoplasma de las células epiteliales intestinales a lo largo de las vellosidades (Figuras 11D2, D3, E2, E3). En el colorrecto del grupo infectado por el IBV CA1737/04, las células positivas se observaron principalmente en el citoplasma de los enterocitos en las puntas de las vellosidades intestinales (Figura 11F2). Por el contrario, el colorrecto en el grupo infectado por Mass-IBV no mostró inmunotinción (Figura 11F3). En el ovario, el antígeno viral en ambos grupos infectados por el IBV se localizó en el epitelio que cubre el ovario y/o en las células de la granulosa que recubren los folículos en crecimiento (Figuras 12G2, G3). En el magnum, el istmo y el útero, el grupo infectado por el IBV con CA1737/04 tuvo una inmunorreactividad más fuerte que el grupo infectado por el IBV masivo. El inmunomarcaje se observó principalmente en las células epiteliales, que estaban intactas en la mucosa o desprendidas dentro de la luz, particularmente en el grupo infectado por el IBV CA1737/04 (Figuras 12H2, H3, I2, I3, J2, J3).
El porcentaje de células positivas para el IBV en los grupos analizados se muestra en la Figura 13. El grupo infectado por el IBV con CA1737/04 tuvo un porcentaje significativamente mayor de células positivas para el IBV que las detectadas en el riñón y el colorrecto del grupo infectado por el IBV masivo y en el grupo control (p < 0,05; Figuras 13B, E). Además, el porcentaje de células positivas en las amígdalas cecales del grupo infectado por el IBV con CA1737/04 fue significativamente mayor que el del grupo control (p < 0,05; Figura 13C). A los 19 dpi, el grupo infectado por el IBV con CA1737/04 tenía un porcentaje significativamente mayor de células positivas para el IBV que las del grupo infectado por el IBV masivo y el grupo control (p < 0,05; Figuras 13C, H) en el istmo y las amígdalas cecales.
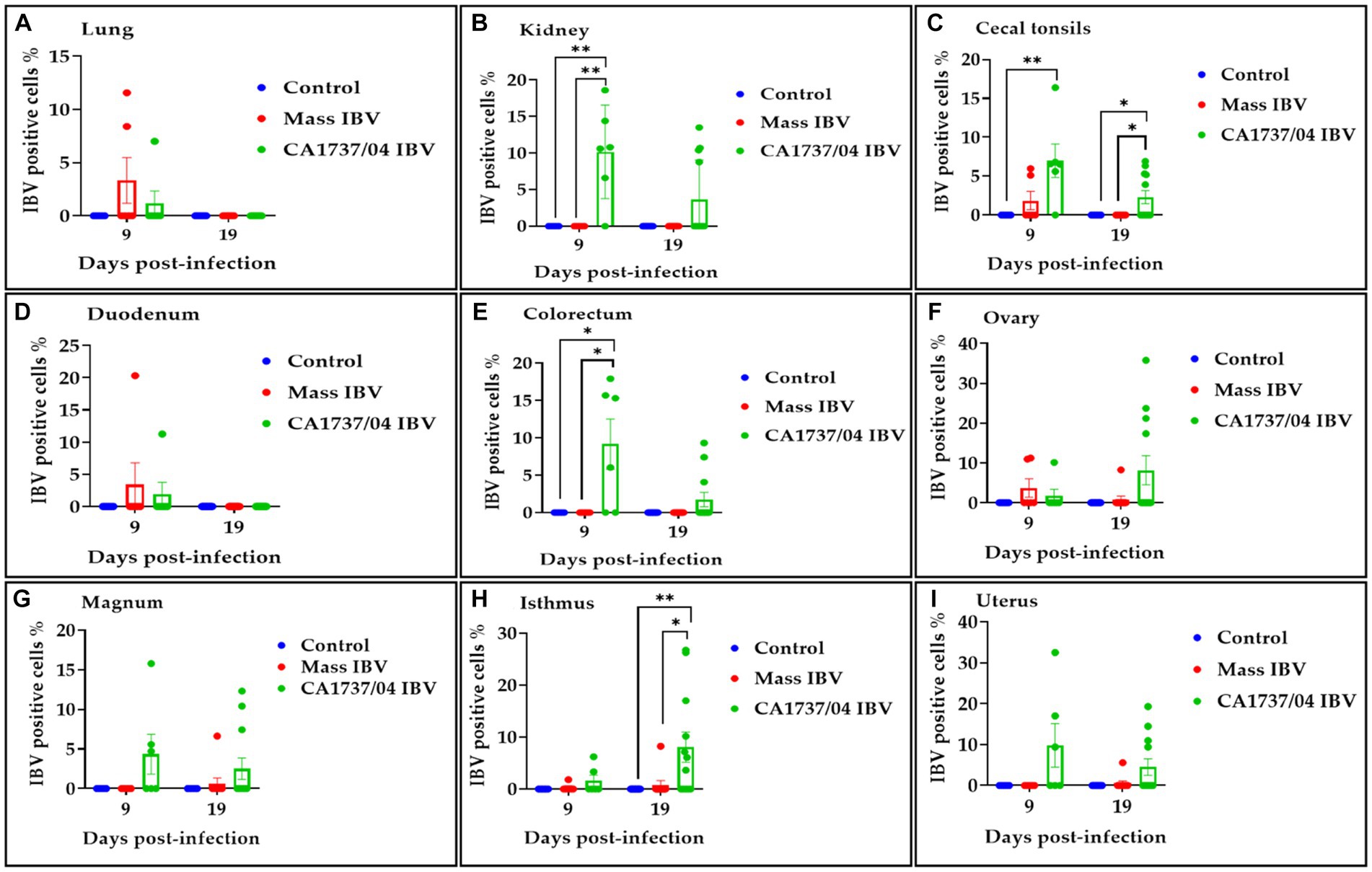 Figura 13. Porcentaje de células positivas para el IBV detectadas en el pulmón (A), riñón (B), amígdalas cecales (C), duodeno (D), colorrecto (E), ovario (F), magnum (G), istmo (H) y útero (I) a los 9 y 19 días después de la infección con las cepas CA1737/04 y Mass IBV. Se utilizó la prueba de Kruskal-Wallis seguida de la prueba de comparación múltiple de Dunn para identificar las diferencias entre los grupos. Las barras de error representan SEM, mientras que los asteriscos indican diferencias significativas (p < 0,05 y p < 0,01).***
Figura 13. Porcentaje de células positivas para el IBV detectadas en el pulmón (A), riñón (B), amígdalas cecales (C), duodeno (D), colorrecto (E), ovario (F), magnum (G), istmo (H) y útero (I) a los 9 y 19 días después de la infección con las cepas CA1737/04 y Mass IBV. Se utilizó la prueba de Kruskal-Wallis seguida de la prueba de comparación múltiple de Dunn para identificar las diferencias entre los grupos. Las barras de error representan SEM, mientras que los asteriscos indican diferencias significativas (p < 0,05 y p < 0,01).***
4 Discusión
El IBV induce resultados patológicos en múltiples sistemas corporales de los pollos y afecta gravemente a la producción avícola en todo el mundo, incluido Canadá. En 2012, se aisló una nueva cepa de IBV de origen estadounidense en Ontario, Canadá, llamada CA1737/04 IBV (28). Todos los estudios previos sobre el IBV CA1737/04 se basaron principalmente en muestras de campo, en las que el IBV CA1737/04 se asoció con enfermedades respiratorias en pollos de engorde y daño renal en pollitas (30), así como con el síndrome de la falsa capa en parvadas de ponedoras comerciales (31). Por lo tanto, el presente estudio se llevó a cabo en gallinas ponedoras SPF durante su pico de puesta para investigar la patogenicidad y el tropismo tisular del IBV CA1737/04 en comparación con la conocida cepa IBV (Mass) (3). Nuestros resultados son dobles. En primer lugar, la infección de gallinas ponedoras SPF con CA1737/04 o cepa Mass IBV dio lugar a signos clínicos, una disminución significativa en la producción de huevos y anticuerpos anti-IBV específicos sistémicamente en el suero y localmente en el lavado del tracto reproductivo. En segundo lugar, la cepa CA1737/04 del IBV es más patógena para el riñón, el colorrecto (intestino grueso) y el tracto reproductivo que la cepa Mass IBV. La razón de esto es que los tejidos infectados por el IBV CA1737/04 (riñón, colorrectal, tracto reproductivo) mostraron aumentos sustanciales en uno o más de los siguientes parámetros de patogenicidad: lesiones macroscópicas, cargas genómicas del IBV, puntuaciones histopatológicas de lesiones y localización de antígenos por IHQ, en comparación con la cepa masiva.
En este contexto, tanto las cepas CA1737/04 como las de Mass IBV indujeron dificultad respiratoria que incluyó estornudos, estertores traqueales y jadeos, así como signos no respiratorios como depresión y plumas erizadas. Los signos clínicos comenzaron a los 1 o 2 dpi y desaparecieron a los 10 dpi; observaciones similares se registraron entre pollos ponedoras infectados con la cepa IBV D1466 (43). En cuanto a la producción de huevos, se registró el inicio de una caída en la producción de huevos tanto en las cepas CA1737/04 como en las cepas Mass IBV dentro de la primera semana post-infección; Esto estuvo en línea con estudios previos (14, 44, 45). El mecanismo exacto por el cual el IBV induce una caída en la producción de huevos aún no está claro. Los efectos adversos del IBV en la producción de huevos pueden ser el resultado de lesiones patológicas en los órganos reproductivos (efecto directo) o efectos indirectos a través de la alteración del estado de salud del ave. Nuestros hallazgos mostraron que la disminución de la producción de huevos en los grupos infectados por el IBV se acompañó de marcadas lesiones macroscópicas e histopatológicas en el oviducto y el ovario, particularmente en el grupo infectado por el IBV CA1737/04. Por lo tanto, estas lesiones en el oviducto y el ovario pueden ser un factor en la disminución de la producción de huevos (6). El impacto indirecto del IBV en la producción de huevos podría explicarse por la disminución de la ingesta de alimento y agua, lo que a su vez afecta negativamente a la salud del tracto reproductivo. De manera similar, Sevoian y Levine (44) describieron a los pollos afectados después de la infección por IBV y después de retener toda la comida y el agua durante 4 días. Sin embargo, no confirmamos si la reducción del consumo de alimento y agua contribuyó a la disminución de la producción de huevos.
Además de la mala calidad de los huevos, el IBV podría provocar daños en el oviducto, interrumpiendo el desarrollo normal de los huevos y provocando problemas de calidad de los huevos, como huevos deformes, huevos de cáscara blanda y huevos con albúmina acuosa (46). Esto es consistente con la observación actual en la que se observaron anomalías externas e internas en la calidad de los huevos en ambos grupos infectados por el IBV, incluidos los huevos sin cáscara, los huevos con grietas en la cáscara, la albúmina acuosa y la sangre interna.
En la necropsia, los riñones de algunas gallinas del grupo infectado por el IBV CA1737/04 mostraron lesiones macroscópicas claras, que se presentaban en forma de riñones inflamados con uratos en los uréteres. Sin embargo, las gallinas infectadas por Mass IBV no mostraron ninguna lesión macroscópica en los riñones. Los resultados histopatológicos en los riñones fueron consistentes con las lesiones macroscópicas, en las que la cepa CA1737/04 IBV causó lesiones histopatológicas significativamente mayores en los riñones en comparación con las detectadas en la cepa Mass IBV. Los cambios microscópicos en la cepa CA1737/04 del IBV fueron predominantemente inflamación linfoplasmocítica intersticial, pero también se observaron heterófilos. Estas lesiones persistieron durante todo el período experimental (19 dpi), lo que puede considerarse como un resultado de nefritis intersticial crónica. La nefritis crónica activa (en curso) es un tipo de nefritis intersticial crónica y se caracteriza por inflamación linfoplasmocítica intersticial con evidencia de cambios necróticos entre los túbulos renales (47). En consecuencia, nuestros hallazgos revelaron la existencia de necrosis del epitelio tubular renal acompañada de infiltraciones linfoplasmocíticas en el tejido intersticial a 19 dpi. Teniendo en cuenta tanto los resultados de la necropsia como los de la histopatología, podemos concluir que la cepa CA1737/04 IBV es más patógena para el riñón que la cepa Mass IBV.
También se observaron lesiones macroscópicas en los tejidos reproductivos. Hubo un mayor número de gallinas infectadas con la cepa CA1737/04 del IBV que presentaban lesiones macroscópicas características tanto en el ovario como en el oviducto en los dos momentos de eutanasia. Mientras que las lesiones en el grupo infectado por IBV fueron menores y se restringieron al ovario. Aunque las lesiones histopatológicas se observaron más fácilmente en el oviducto del grupo infectado por el IBV con CA1737/04 que en el grupo infectado por el IBV Mass, las puntuaciones de las lesiones patológicas no revelaron ninguna diferencia significativa entre las dos cepas del IBV. Esto podría explicarse por el bajo número de aves y el sistema de puntuación de histopatología utilizado en este estudio. En el oviducto, las lesiones microscópicas consistieron en pérdidas epiteliales y ciliares, edema e infiltraciones de células inflamatorias. Las lesiones más tardías también se reportaron en otras cepas del IBV (13, 14, 44). En el ovario, las lesiones microscópicas fueron evidentes tanto en las cepas CA1737/04 como en las cepas Mass IBV, que incluyeron necrosis del epitelio que cubre el ovario e infiltraciones de células inflamatorias (mononucleares y/o heterófilas). Se ha descrito un patrón similar de lesiones ováricas tras la infección con otras cepas del IBV pertenecientes a los genotipos Mass y QX (48, 49).
Aunque los tejidos respiratorios (tráquea y pulmón) y entéricos (duodeno y colorrectal) no mostraron lesiones macroscópicas, hubo cambios microscópicos claros. En tráquea y pulmón, tanto las cepas CA1737/04 como Mass IBV presentaron lesiones histopatológicas características típicas de la infección por IBV; sin embargo, la diseminación viral de los hisopos orales en el grupo infectado por el IBV CA1737/04 fue significativamente menor en comparación con el grupo Mass, lo que indica que la diseminación viral de la cepa Mass fue mayor que la de la cepa CA1737/04 IBV en el tracto respiratorio superior. Además, las puntuaciones histopatológicas de las lesiones en el tejido respiratorio inferior (pulmón) infectado experimentalmente con la cepa Mass IBV fueron significativamente más altas que las de los infectados con la cepa CA1737/04 IBV. Estos hallazgos sugirieron que la cepa Mass se asoció con una enfermedad respiratoria más grave que la cepa CA1737/04 IBV. Estos hallazgos estuvieron en línea con un estudio anterior (31), en el que otra cepa de Mass IBV (M41) era más patógena para el tracto respiratorio que la cepa CA1737/04 de IBV; sin embargo, el experimento se llevó a cabo en pollos más jóvenes.
El examen histopatológico de la parte inicial (duodeno) y la parte terminal (colorrectal) del intestino de ambos grupos infectados por el IBV reveló un aumento del grosor de la lámina propia con infiltración de células mononucleares y, en ocasiones, atrofia de las vellosidades. Estas lesiones también se observaron en otras cepas de IBV con enteropatogenicidad (16, 50). Las lesiones entéricas se asociaron con niveles detectables de ARN viral de los hisopos cloacales en ambos grupos infectados por el IBV.
Con respecto a la respuesta inmune mediada por el humor a la infección por IBV, nuestros hallazgos mostraron que ambos grupos infectados por IBV tenían anticuerpos anti-IBV significativamente más altos en los lavados de suero y oviducto a 9-19 dpi. En estudios previos, se ha demostrado que se detectó una cantidad significativa de niveles de anticuerpos anti-IBV en lavados de oviductos a los 7 y 23 dpi (36). Además, los anticuerpos anti-IBV en los lavados de oviductos se originaron local o pasivamente a partir del suero (36). Aparte del papel de la protección de anticuerpos anti-IBV contra el IBV, algunos estudios han demostrado una relación directa entre los altos niveles de anticuerpos humorales y la protección contra la reducción de la producción de huevos en gallinas ponedoras (51, 52). Además, se sugirió que el uso de anticuerpos específicos contra el IBV en los lavados de oviductos, en lugar de suero, era un mejor indicador para evaluar la caída de la producción de huevos después de la infección (36).
En este estudio, se realizaron ensayos de IHQ y qPCR para demostrar el antígeno del IBV y el material genético en diferentes tejidos, respectivamente. Tanto los grupos infectados por CA1737/04 como los de Mass IBV mostraron niveles detectables de ARN viral en todos los tejidos, incluyendo tráquea, pulmón, riñón, amígdalas cecales, duodeno, colorrectal, ovario y oviducto. Se encontró un mayor número de copias del genoma viral en el riñón, las amígdalas cecales, el colorrecto y el oviducto de las gallinas inoculadas con la cepa CA1737/04 del IBV en comparación con la cepa Mass IBV. Estos resultados fueron consistentes con la IHQ, en la que la cepa CA1737/04 tenía un porcentaje significativamente mayor de células positivas para el IBV en estos tejidos en comparación con la cepa Mass IBV. A diferencia de otros tejidos infectados con la cepa Mass IBV, el pulmón mostró cargas genómicas más altas y persistentes del IBV. Esto puede sugerir que la cepa Mass IBV tiene una capacidad restringida para penetrar a través de la barrera sangre-aire (en el pulmón) y escapar de la respuesta del huésped para propagarse más allá de los tejidos respiratorios con cargas genómicas más altas, esto se especuló en un estudio anterior (53). Se sabe que ciertas cepas del IBV pueden persistir durante semanas en el riñón y las amígdalas cecales (16, 54). Aquí, nuestros hallazgos mostraron que la persistencia del ARN viral y el antígeno no solo estaba en el riñón y las amígdalas cecales, sino también en el colorrecto infectado con la cepa CA1737/04 IBV. Se propone el uso de estos órganos en la identificación de la cepa CA1737/04 IBV en pollos comerciales. Teniendo en cuenta los resultados de IHQ y qPCR, podemos concluir que la cepa CA1737/04 tiene un tropismo tisular más amplio, que incluye respiratorio, renal, entérico y reproductivo. Además, estos resultados mostraron que la cepa CA1737/04 IBV es más patógena para el riñón, el colorrecto y el oviducto que la cepa Mass IBV.
En resumen, en los últimos años, las parvadas de ponedoras canadienses se han encontrado con un número cada vez mayor de nuevas variantes del IBV de origen estadounidense, que tienen el potencial de convertirse en el tipo predominante de IBV. Nuestros resultados revelaron que las cepas CA1737/04 IBV y Mass IBV fueron capaces de infectar los tejidos respiratorios, renales, entéricos y reproductivos de gallinas ponedoras durante su pico de puesta. Sin embargo, la cepa CA1737/04 del IBV tuvo mayor patogenicidad y tropismo tisular en el riñón, el intestino grueso (colorrectal) y el oviducto que la cepa Mass IBV, en función de uno o más parámetros de patogenicidad. Se justifican más investigaciones para desarrollar una estrategia de vacunación para el control de la infección por el IBV CA1737/04 entre las parvadas de ponedoras canadienses.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue aprobado por el Comité de Cuidado de Animales de Ciencias Veterinarias (VSACC, por sus siglas en inglés). El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
AA: Investigación, Metodología, Validación, Redacción – revisión y edición, Análisis formal, Redacción – borrador original. MF: Análisis formal, Investigación, Escritura – revisión y edición. DA: Investigación, Redacción – revisión y edición, Análisis formal. SN: Análisis formal, Investigación, Escritura – revisión y edición. MH: Análisis formal, Investigación, Escritura – revisión y edición. II: Análisis formal, Investigación, Redacción – revisión y edición. AS: Supervisión, Validación, Redacción, Revisión y Edición. RG: Validación, Redacción – revisión y edición, Conceptualización, Metodología, Recursos. MA-C: Conceptualización, Metodología, Recursos, Validación, Redacción, Revisión y Edición, Obtención de Fondos, Investigación, Administración de Proyectos, Software, Supervisión.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Agradecemos la financiación de Agriculture and Agri-Food Canada (AAFC) a través de la financiación del Poultry Science Cluster para el Consejo Canadiense de Investigación (CPRC, Proyecto número ASC-20) y Egg Farmers of Canada (EFC, Subvención número 10022788). Los estudios de doctorado de AA son financiados por el Ministerio de Educación Superior de la República Árabe de Egipto.
Reconocimientos
Los autores están muy agradecidos a todo el personal de la Estación de Investigación de Ciencias Veterinarias (VSRS) en el campus de Spyhill, Universidad de Calgary, incluidos Greg Boorman y Greg Muench, por su ayuda en el cuidado y la cría de animales. Los autores también desean agradecer a Guido van Marle, Frank van der Meer, Carla S. Coffin y otros miembros del grupo de virología de la Universidad de Calgary por proporcionarnos acceso a su infraestructura.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1338563/full#supplementary-material
Referencias
1. Cocinero, JK , Jackwood, M y Jones, RC . Una visión a largo plazo: 40 años de investigación sobre la bronquitis infecciosa. Pathol aviar. (2012) 41:239–50. doi: 10.1080/03079457.2012.680432
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Cavanagh, D . Virus de la bronquitis infecciosa aviar por coronavirus. Res. Veterinaria. (2007) 38:281–97. doi: 10.1051/vetres:2006055
3. Amarasinghe, A , Popowich, S , De Silva Senapathi, U , Abdul-Cader, MS , Marshall, F , van der Meer, F, et al. El síndrome del huevo sin cáscara (SES, por sus siglas en inglés), muy extendido en las operaciones de ponedoras del oeste de Canadá, está relacionado con una cepa aislada del virus de la bronquitis infecciosa (IBV) de tipo Massachusetts (Massachusetts). Virus. (2018) 10:437. doi: 10.3390/v10080437
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Reddy, realidad virtual , Trus, I , Desmarets, LM , Li, Y , Theuns, S y Nauwynck, HJ . Replicación productiva del virus de la bronquitis infecciosa nefropatogénica en células monocíticas de sangre periférica, una estrategia para la diseminación viral y la infección renal en pollos. Res. Veterinaria. (2016) 47:70. doi: 10.1186/s13567-016-0354-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Lin, SY y Chen, HW . Variantes del virus de la bronquitis infecciosa: análisis molecular e investigación de patogenicidad. Int J Mol Sci. (2017) 18:2030. doi: 10.3390/ijms18102030
6. Cavanagh, D . Desarrollo de una vacuna contra el síndrome respiratorio agudo severo: experiencias de vacunación contra el coronavirus de bronquitis infecciosa aviar. Pathol aviar. (2003) 32:567–82. doi: 10.1080/03079450310001621198
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Liu, S , Chen, J , Han, Z , Zhang, Q , Shao, Y , Kong, X, et al. Virus de la bronquitis infecciosa: características del gen S1 de las vacunas utilizadas en China y eficacia de la vacunación contra cepas heterólogas procedentes de China. Pathol aviar. (2006) 35:394–9. doi: 10.1080/03079450600920984
8. Beato, MS , De Battisti, C , Terregino, C , Drago, A , Capua, I y Ortali, G . Evidencia de circulación de una cepa china del virus de la bronquitis infecciosa (QXIBV) en Italia. Rec. Veterinario (2005) 156:720. doi: 10.1136/vr.156.22.720
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Toffan, A , Monne, I , Terregino, C , Cattoli, G , Hodobo, CT , Gadaga, B, et al. QX-like infectious bronchitis virus in Africa. Vet Rec. (2011) 169:589. doi: 10.1136/vr.d7636
10. Winterfield, RW , and Hitchner, SB . Etiology of an infectious nephritis-nephrosis syndrome of chickens. Am J Vet Res. (1962) 23:1273–9.
11. Ziegler, AF , Ladman, BS , Dunn, PA , Schneider, A , Davison, S , Miller, PG, et al. Bronquitis infecciosa nefropatógena en pollos de Pensilvania, 1997-2000. Avian Dis. (2002) 46:847–58. doi: 10.1637/0005-2086(2002)046[0847:NIBIPC]2.0.CO; 2
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Gelb, J Jr, Ladman, BS , Papa, CR , Ruano, JM , Brannick, EM , Bautista, DA, et al. Caracterización del virus de la bronquitis infecciosa nefropatógena DMV/1639/11 recuperado de pollos de engorde Delmarva en 2011. Avian Dis. (2013) 57:65–70. doi: 10.1637/10313-080212-Reg.1
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Chousalkar, KK , Roberts, JR y Reece, R . Histopatología comparada de dos serotipos de virus de la bronquitis infecciosa (T y n1/88) en gallinas ponedoras y gallos. Poult Sci. (2007) 86:50–8. doi: 10.1093/ps/86.1.50
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Hassan, MSH , Najimudeen, SM , Ali, A , Altakrouni, D , Orfebre, D , Coffin, CS, et al. Inmunopatogenia del virus de la bronquitis infecciosa (IBV) Delmarva canadiense (DMV/1639): impacto en el tracto reproductivo en ponedoras. Microb Pathog. (2022) 166:105513. doi: 10.1016/j.micpath.2022.105513
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Chong, KT y Apostolov, K . La patogenia de la nefritis en pollos inducida por el virus de la bronquitis infecciosa. J Comp Pathol. (1982) 92:199–211. doi: 10.1016/0021-9975(82)90078-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Ambali, AG y Jones, RC . Patogénesis temprana en pollitos de infección por una cepa enterotrópica del virus de la bronquitis infecciosa. Avian Dis. (1990) 34:809–17. doi: 10.2307/1591367
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Chacón, JL , Assayag, MS Jr, Revolledo, L , Astolfi-Ferreira, CS , Vejarano, diputado , Jones, RC, et al. Patogenicidad y características moleculares de cepas del virus de la bronquitis infecciosa (IBV) aisladas de pollos de engorde que presentan diarrea y enfermedades respiratorias. Hno. Poult Sci. (2014) 55:271–83. doi: 10.1080/00071668.2014.903558
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. El Houadfi, M y Jones, RC . Aislamiento de virus de la bronquitis infecciosa aviar en Marruecos, incluida una variante enterotrópica. Rec. Veterinario (1985) 116:445. doi: 10.1136/vr.116.16.445-a
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Raj, GD y Jones, RC . Virus de la bronquitis infecciosa: inmunopatogenia de la infección en el pollo. Pathol aviar. (1997) 26:677–706. DOI: 10.1080/03079459708419246
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Crinion, RA , Pelota, RA y Hofstad, MS . Anomalías en pollos ponedoras después de la exposición al virus de la bronquitis infecciosa al día de edad. Avian Dis. (1971) 15:42–8. doi: 10.2307/1588386
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Jones, RC y Jordan, FT . Sitio de replicación del virus de la bronquitis infecciosa en el oviducto de gallinas infectadas experimentalmente. Rec. Veterinario (1971) 89:317–8. doi: 10.1136/vr.89.11.317
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Crinion, RA y Hofstad, MS . Patogenicidad de cuatro serotipos del virus de la bronquitis infecciosa aviar para el oviducto de pollos jóvenes de varias edades. Avian Dis. (1972) 16:351–63. doi: 10.2307/1588800
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Mork, AK , Hesse, M , Abd El Rahman, S , Rautenschlein, S , Herrler, G y Invierno, C . Las diferencias en el tropismo tisular de las células epiteliales del oviducto de pollo entre las cepas QX y B1648 del IBV del coronavirus aviar no están relacionadas con las propiedades de unión al ácido siálico de sus proteínas de pico. Res. Veterinaria. (2014) 45:67. doi: 10.1186/1297-9716-45-67
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Wibowo, MH , Ginting, TE y Asmara, W . Caracterización molecular del virus patógeno de la bronquitis infecciosa tipo 4/91 y QX que infecta granjas avícolas comerciales en Indonesia. Mundo Veterinario. (2019) 12:277–87. doi: 10.14202/vetworld.2019.277-287
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Schalk, AF y Hawn, MC . Una enfermedad respiratoria aparentemente nueva de los pollitos. J am vet med. (1931) 78:413–23.
26. Jackwood, MW y Jordan, BJ . Evolución molecular del virus de la bronquitis infecciosa y la aparición de variantes del virus que circulan en los Estados Unidos. Avian Dis. (2021) 65:631–6. doi: 10.1637/aviandiseases-D-21-00104
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Asesinato de Mueller, A , Franca, M , Jackwood, M y Jordania, B . La infección por IBV DMV/1639 a una edad temprana conduce a una mayor incidencia de formación de oviductos quísticos asociados con el síndrome de la falsa capa. Virus. (2022) 14:852. doi: 10.3390/v14050852
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Martín, EA , Descarado, ML , Hoyland, SK , Coventry, JM , Arenisca, C , Guerin, MT, et al. Genotipado de virus de bronquitis infecciosa identificados en Canadá entre 2000 y 2013. Pathol aviar. (2014) 43:264–8. doi: 10.1080/03079457.2014.916395
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Hassan, MSH , Ojkic, D , Ataúd, CS , Corcho, SC , van der Meer, F y Abdul-Careem, MF . Las variantes del virus de la bronquitis infecciosa (IBV) de Delmarva (DMV/1639) aisladas en el este de Canadá muestran evidencia de recombinación. Virus. (2019) 11:1054. doi: 10.3390/v11111054
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Woolcock, P.R. y Cardona, C . (2008). La aparición de la cepa del virus de la bronquitis infecciosa CA/1737/04 en pollos en California. Reunión Anual de la Asociación Americana de Patólogos Aviares. Nueva Orleans, LA
31. da Silva, AP , Giroux, C , Vendedores, HS , Mendoza-Reilley, A , Stoute, S y Gallardo, RA . Caracterización de un virus de bronquitis infecciosa aislado de capas comerciales que padece el síndrome de la falsa capa. Avian Dis. (2021) 65:373–80. doi: 10.1637/aviandiseases-D-21-00037
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Madera, MK , Ladman, BS , Preskenis, LA , Papa, CR , Bautista, D y Gelb, J Jr. La vacunación viva de Massachusetts protege contra un nuevo genotipo S1 del virus de la bronquitis infecciosa DMV/5642/06. Avian Dis. (2009) 53:119–23. doi: 10.1637/8454-082108-ResNote.1
33. Valastro, V , Holmes, EC , Britton, P , Fusaro, A , Jackwood, MW , Cattoli, G, et al. Filogenia basada en el gen S1 del virus de la bronquitis infecciosa: un intento de armonizar la clasificación del virus. Infectar Genet Evol. (2016) 39:349–64. doi: 10.1016/j.meegid.2016.02.015
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Caña, LJ y Muench, H . Un método sencillo para estimar el cincuenta por ciento de los criterios de valoración12. Am J Epidemiol. (1938) 27:493–7. doi: 10.1093/oxfordjournals.aje.a118408
35. De Silva Senapathi, U , Abdul-Cader, MS , Amarasinghe, A , van Marle, G , Czub, M , Gomis, S, et al. La administración in ovo de oligonucleótidos CpG protege contra la bronquitis infecciosa con el reclutamiento de células inmunitarias en el tracto respiratorio de los pollos. Virus. (2018) 10:635. doi: 10.3390/v10110635
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Raj, GD y Jones, RC . Producción local de anticuerpos en el oviducto y el intestino de gallinas infectadas con una cepa variante del virus de la bronquitis infecciosa. Veterinario Inmunol Inmunopatíaco. (1996) 53:147–61. doi: 10.1016/0165-2427(95)05545-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Kameka, AM , Haddadi, S , Kim, DS , Corcho, SC y Abdul-Careem, MF . Inducción de la respuesta inmune innata después de la infección por corona virus de bronquitis infecciosa en el tracto respiratorio de pollos. Virología. (2014) 450-451:114–21. doi: 10.1016/j.virol.2013.12.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Bancroft, JD y Layton, C . Las hematoxilinas y la eosina En: SK Suvarna, C Layton y JD Bancroft, editores. Teoría y práctica de las técnicas histológicas de Bancroft. 7ª ed. Oxford: Churchill Livingstone (2013). 179–220.
39. Benyeda, Z , Szeredi, L , Mató, T , Süveges, T , Balka, G , Abonyi-Tóth, Z, et al. Histopatología e inmunohistoquímica comparadas de los serotipos QX-like, Massachusetts y 793/B de infección por el virus de la bronquitis infecciosa en pollos. J Comp Pathol. (2010) 143:276–83. doi: 10.1016/j.jcpa.2010.04.007
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Nakamura, K , Cocinero, JK , Otsuki, K , Huggins, MB y Frazier, J.A. . Estudio comparativo de lesiones respiratorias en dos líneas de pollos de diferente susceptibilidad infectados con el virus de la bronquitis infecciosa: histología, ultraestructura e inmunohistoquímica. Pathol aviar. (1991) 20:241–57. doi: 10.1080/03079459108418761
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Chen, POR , Hosi, S , Nunoya, T e Itakura, C . Histopatología e inmunohistoquímica de lesiones renales por virus de la bronquitis infecciosa en pollitos. Pathol aviar. (1996) 25:269–83. doi: 10.1080/03079459608419141
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Ghahremani, P , Li, Y , Kaufman, A , Vanguri, R , Greenwald, N , Angelo, M, et al. Inmunofluorescencia múltiple inferida por aprendizaje profundo para la cuantificación de imágenes inmunohistoquímicas. Nat Mach Intell. (2022) 4:401–12. doi: 10.1038/s42256-022-00471-x
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Sjaak de Wit, JJ , Ter Veen, C y HCR, K . Efecto del IBV D1466 sobre la producción y calidad del huevo y el efecto del cebado heterólogo para aumentar la eficacia de una vacuna inactivada contra el IBV. Pathol aviar. (2020) 49:185–92. doi: 10.1080/03079457.2019.1710462
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Sevoiano, M y Levine, PP . Efectos de la bronquitis infecciosa en el tracto reproductivo, la producción de huevos y la calidad de los huevos de las gallinas ponedoras. Avian Dis. (1957) 1:136–64. doi: 10.2307/1587727
45. Cocinero, JK . Recuperación del virus de la bronquitis infecciosa a partir de huevos y pollitos producidos por gallinas inoculadas experimentalmente. J Comp Pathol. (1971) 81:203–11. doi: 10.1016/0021-9975(71)90093-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Crinion, RA . Calidad y producción de óvulos después de la exposición al virus de la bronquitis infecciosa al día de edad. Poult Sci. (1972) 51:582–5. doi: 10.3382/ps.0510582
47. Albassam, MA , Winterfield, RW y Thacker, HL . Comparación de la nefropatogenicidad de cuatro cepas del virus de la bronquitis infecciosa. Avian Dis. (1986) 30:468–76. doi: 10.2307/1590408
48. Pereira, NA , Alessi, AC , Montassier, HJ , Pereira, RJG , Taniwaki, S.A. , Botosso, VF, et al. Patogenicidad gonadal de una cepa del virus de la bronquitis infecciosa del genotipo de Massachusetts. Braz J Microbiol. (2019) 50:313–20. doi: 10.1007/s42770-018-0007-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Zhong, Q , Hu, YX , Jin, JH , Zhao, Y , Zhao, J y Zhang, GZ . Patogenicidad del virus de la bronquitis infecciosa virulenta aislada YN en ovario y oviducto. Microbiol veterinario. (2016) 193:100–5. doi: 10.1016/j.vetmic.2016.08.017
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Hauck, R , Gallardo, RA , Woolcock, Relaciones Públicas y Shivaprasad, HL . Un coronavirus asociado con el síndrome de retraso en el crecimiento en pollos de engorde. Avian Dis. (2016) 60:528–34. doi: 10.1637/11353-122215-Case
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Caja, PG , Holmes, HC , Finney, PM y Froymann, R . Bronquitis infecciosa en gallinas ponedoras: relación entre los niveles de anticuerpos inhibidores de la hemaglutinación y la resistencia al desafío experimental. Pathol aviar. (1988) 17:349–61. doi: 10.1080/03079458808436453
Resumen de PubMed | Texto completo de Crossref | Google Académico
52. Finney, PM , Caja, PG y Holmes, HC . Estudios con una vacuna bivalente contra el virus de la bronquitis infecciosa. Pathol aviar. (1990) 19:435–50. doi: 10.1080/03079459008418698
Resumen de PubMed | Texto completo de Crossref | Google Académico
53. Cheng, J , Huo, C , Zhao, J , Liu, T , Li, X , Yan, S, et al. Diferencias de patogenicidad entre los virus de la bronquitis infecciosa tipo QX y los virus de la bronquitis de tipo Masa. Microbiol veterinario. (2018) 213:129–35. doi: 10.1016/j.vetmic.2017.11.027
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: virus de la bronquitis infecciosa, Canadá, gallina, patogenicidad, tropismo tisular
Cita: Ali A, Farooq M, Altakrouni D, Najimudeen SM, Hassan MSH, Isham IM, Shalaby AA, Gallardo RA y Abdul-Careem MF (2024) Patogenicidad comparativa de los genotipos CA1737/04 y del virus de la bronquitis infecciosa masiva en pollos ponedores. Frente. Vet. Sci. 11:1338563. doi: 10.3389/fvets.2024.1338563
Recibido: 14 de noviembre de 2023; Aceptado: 09 de febrero de 2024;
Publicado: 28 de febrero de 2024.
Editado por:
Peirong Jiao, Universidad Agrícola del Sur de China, China
Revisado por:
Ahmed R. Elbestawy, Universidad de Menoufia, Egipto
Xiaorong Zhang, Universidad de Yangzhou, China
Derechos de autor © 2024 Ali, Farooq, Altakrouni, Najimudeen, Hassan, Isham, Shalaby, Gallardo y Abdul-Careem. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY). S
*Correspondencia: Mohamed Faizal Abdul-Careem, faizal.abdulcareem@ucalgary.ca
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía