Peste des Petits Ruminants La fusión del virus y las proteínas de hemaglutinina desencadenan una citotoxicidad mediada por células dependiente de anticuerpos en células infectadas
Peste des Petits Ruminants La fusión del virus y las proteínas de hemaglutinina desencadenan una citotoxicidad mediada por células dependiente de anticuerpos en células infectadas
- Centro de Investigación en Sanidad Animal, Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria (CISA-INIA), Madrid, España
El sistema inmunitario adaptativo utiliza múltiples mecanismos efectores para eliminar las infecciones virales. Entre esos anticuerpos, la citotoxicidad mediada por células dependientes de anticuerpos (ADCC) puede ayudar a reconocer y eliminar las células infectadas por el virus. En el presente trabajo evaluamos la contribución de ADCC a la inmunidad en dos enfermedades virales económicamente importantes que afectan a los rumiantes: la lengua azul y la peste de los pequeños rumiantes. Para este estudio se utilizaron sueros inmunes obtenidos de ovejas infectadas experimentalmente con el serotipo 8 del virus de la lengua azul (BTV) o el virus del rumiante peste des petits (PPRV) IC’89. Los sueros inmunes de PPRV podrían unirse a la superficie de las células ovinas B infectadas por PPRV, mientras que los senos inmunes de BTV no podían unirse a la superficie de las células oveja infectadas por BTV, pero podían reconocer antígenos intracelulares de BTV. La potencia ADCC del suero inmune BTV y PPRV se estableció utilizando un ensayo de citotoxicidad autóloga de ovino que empleó una fracción enriquecida con células NK como células efectoras y una fracción enriquecida con células B infectada por el virus como células diana. En este sistema, los senos inmunes desencadenaron ADCC contra las células infectadas por PPRV, pero no contra las células infectadas por BTV. Los sueros inmunes de PPRV podrían reconocer la fusión de PPRV y las proteínas de hemaglutinina en la superficie de las células transfectadas, y mejorar la lisis de estas células en los ensayos de ADCC. Esto indicó que estos antígenos virales son objetivos naturales de ADCC durante la infección por PPRV. El presente trabajo describe un nuevo mecanismo inmune efector contra el PPRV en el huésped natural que podría contribuir a la eliminación del virus, destacando la importancia de estudiar los mecanismos inmunes protectores para mejorar las vacunas actuales invocando todos los brazos efectores de la inmunidad.
Introducción
El sistema inmunitario adaptativo posee múltiples mecanismos para contener infecciones virales. Las respuestas celulares suelen ser críticas para el aclaramiento de las células infectadas por el virus. Las células T citotóxicas pueden reconocer los péptidos virales que se presentan en la superficie celular y eliminar las células infectadas (1). La producción de anticuerpos neutralizantes también se asocia a menudo con la protección de enfermedades virales (2). La unión de anticuerpos neutralizantes en la partícula viral puede bloquear la unión del virus a la célula huésped, deteriorar la fusión del virus con la membrana de la célula huésped y/o eliminar las partículas de virus a través del mecanismo dependiente de Fc, como la activación del complemento (2, 3). La producción de anticuerpos no neutralizantes también puede contribuir a la protección en algunas enfermedades virales (4). Los anticuerpos no neutralizantes pueden reconocer los antígenos virales expresados en la superficie celular de las células infectadas y mediar la citotoxicidad, ya sea a través de la activación del complemento o más comúnmente a través de mecanismos mediados por células. La citotoxicidad mediada por células dependientes de anticuerpos (ADCC) es intrínseca a la eliminación de algunas infecciones virales (5). Por ejemplo, la transferencia adoptiva de anticuerpos que promueven el ADCC protegió a los ratones contra el desafío del virus del herpes simple-2 (6). La actividad del ADCC se ha relacionado con la protección in vivo del virus de la gripe A (IAV) (7) y se ha correlacionado con la protección en un estudio de la vacuna contra el VIH (8). El mecanismo de ADCC también es esencial para la eficacia de la terapia de infusión de anticuerpos monoclonales en modelos de infección por el virus del Ébola (9). Por lo tanto, el ADCC podría contribuir significativamente a la eliminación de la enfermedad para algunas infecciones virales y la transferencia adoptiva de anticuerpos que promueven la ADCC podría tener un potencial terapéutico.
El ADCC se activa cuando una célula diana recubierta de anticuerpos es reconocida por una célula efectora a través de sus receptores Fc (5). La reticulación del receptor Fc en las células efectoras desencadena un mecanismo de citotoxicidad mediado por células que implica canonicamente la liberación de gránulos citotóxicos de células efectoras hacia la célula diana infectada. Tres tipos de receptores Fc están involucrados en los mecanismos ADCC mediados por la unión de IgG en las células diana: FcγRI (CD64) expresado en monocitos y macrófagos; FcγRII (CD32) expresado en monocitos, macrófagos y granulocitos; y FcγRIIIa En el caso de las infecciones virales, los antígenos virales expresados en la superficie celular durante la infección son los objetivos de anticuerpos más probables para el ADCC.
En el presente trabajo queríamos evaluar si el mecanismo de ADCC podría participar en la respuesta inmune y la eliminación viral en dos enfermedades virales de rumiantes económicamente importantes de notificación obligatoria a la OIE: la lengua azul (BT) y peste de los pequeños rumiantes (PPR). El virus de la lengua azul (BTV) es el agente causante de la enfermedad de la lengua azul transmitida por artrópodos que afecta a todos los rumiantes y a las ovejas más graves. BTV es el miembro prototipo del género Orbivirus que pertenece a la familia Reoviridae (10). El genoma de BTV consta de 10 segmentos de dsRNA que codifican para 12 proteínas. BTV es ahora endémica en Europa y está presente en todos los continentes (excepto la Antártida). Los anticuerpos neutralizantes se utilizan para definir los serotipos de BTV (11); y hasta ahora se han reportado 27 serotipos de BTV (12) [posiblemente 30 (13-15]. La protección BTV es específica del serotipo, y existe poca o ninguna protección entre los serotipos (16). Como tal, la vacunación BTV, que generalmente consiste en extractos de virus inactivados, solo proporciona protección específica del serotipo.
El virus Peste des Petits Ruminants (PPRV) causa PPR, una enfermedad altamente contagiosa que afecta a pequeños rumiantes y produce morbilidad grave y alta mortalidad en rehadas ingenuas, especialmente en cabras (17). PPRV se distribuye en África Central y Oriental, Oriente Medio, Turquía e India. La enfermedad ha llegado a la puerta de Europa con casos reportados en Marruecos (18), Turquía (19) y Georgia (20). PPRV es un virus envuelto en ARN de sentido negativo de una sola cadena del género Morbillivirus que pertenece a la familia Paramyxoviridae. El genoma viral codifica para 6 proteínas estructurales y 2 o 3 proteínas no estructurales (17). El PPRV puede producir inmunosupresión grave (21) que puede conducir a infecciones de patógenos oportunistas que complican aún más la recuperación de la enfermedad en el ganado afectado. Las vacunas PPRV actuales consisten en cepas atenuadas vivas que aún pueden ser inmunosupresoras, aunque en menor medida que las cepas virulentas.
Por lo tanto, hay margen para mejorar las estrategias actuales de vacunación para ambas enfermedades. Lo ideal es que una vacuna sea segura y replique la inmunidad protectora que se provoca durante la infección. Por lo tanto, es fundamental entender los mecanismos exactos que impulsan la inmunidad protectora contra estos virus para diseñar vacunas más eficaces. La protección contra ambas enfermedades virales parece requerir componentes celulares y humorales de la inmunidad adaptativa. Dado que la inmunidad a BTV y PPRV se basa en parte en anticuerpos, algunos de los cuales probablemente no sean neutralizantes, queríamos evaluar si ADCC podría contribuir a la eliminación de la enfermedad. Por lo tanto, evaluamos en el presente trabajo la capacidad de los sueros inmunes BTV y PPRV para reconocer las células infectadas por ovinos. También medimos la capacidad de estos sueros inmunes para inducir ADCC contra las células infectadas e intentamos identificar algunos de los antígenos virales que son el objetivo de este mecanismo citotóxico. Los datos presentados aquí destacan la importancia de que las vacunas desencadenen una amplia gama de funciones efectoras de inmunidad adaptativa para eliminar las infecciones virales.
Materiales y métodos
Células, virus y seres inmunes anti-PPRV y anti-BTV
293 células T (ATCC: CRL-3216) y la línea celular STC ovina (una línea de células timicas de ovino transformada por SV40 establecida en el laboratorio) se cultivaron en DMEM + 10% FBS + 2 mM L-glutamina + 1% 100X aminoácidos no esenciales + 1 mM de piruvato de sodio + 100 U/ml pen Las células BHK-21 (ATCC: CCL-10) y Vero (ATCC: CCL-81) se cultivaron en DMEM + 5% FBS + 2 mM L-glutamina + 100 U/ml penicilina/100 μg/ml estreptomicina. Vero expresando Dog-SLAM (VDS) (Dr. Parida, Pirbright, Reino Unido) se cultivaron en DMEM + 1% FBS + 2mM L-Gln + 1% 100X aminoácidos no esenciales + 1 mM de piruvato de sodio + 100 U/ml de penicilina/100 μg/ml estreptomicina + 1μg/ml de zeocina. Las células mononucleares de sangre periférica de ovino (PBMC), células NK y cultivos de fracción de células B en RPMI + 10% FBS + 2 mM L-Gln + 1% 100X aminoácidos no esenciales + 1 mM de piruvato de sodio + 100 U/ml penicilina/100 μg/ml estreptomicina + 20 m
Virus Virulent Peste des Petits Ruminants virus Costa de Marfil’89 (PPRV IC’89, linaje I) aislado, vacuna PPRV cepa Nigeria’75/1 (PPRV Nig’75, linaje II) (Dr. En el presente trabajo se utilizaron Batten, Pirbright, Reino Unido) y el serotipo 8 del virus Bluetongue (BTV-8) de Bélgica’06 (Prof Palmarini, Universidad de Glasgow, Reino Unido). Las acciones de BTV se cultivaron en células BHK-21 y las existencias de PPRV se cultivaron en VDS como se describió anteriormente (22, 23). Las poblaciones de virus se vieron salpicadas de ensayos de placa como se describe en Rodríguez-Calvo et al. (24). Las células objetivo se infectaron a una multiplicidad de infección (MOI) de tres 24 h antes de los ensayos de citotoxicidad para BTV y 48 h antes de los ensayos de citotoxicidad para PPRV. Estos puntos de tiempo se eligieron cuando los efectos citopáticos se hicieron evidentes después de 48 h para las células infectadas por BTV y 72 h para las infectadas por PPRV.
Los sueros inmunes anti-PPRV y anti-BTV se obtuvieron de ovejas que se recuperaron de infecciones experimentales con cepas virulentas de PPRV-IC’89 o BTV-8 (día 23-30 después de la infección) (22, 25). Se utilizaron sueros de los mismos animales antes de la infección por PPRV o BTV como controles ingenuos. Todas las sereas de oveja fueron desactivadas por calor antes de su uso (56 °C, 30 min).
Anticuerpos
En el presente trabajo se utilizaron los siguientes anticuerpos para caracterizar las poblaciones de células PBMC: CD16 antihumano (clón KD1, Biorad), anti-CD3 (clón CD3-12, Biorad), marcador de células B anti-bovinas (clo BAQ44A, Kingfisher Biotech), antihuman CD14 (clo TÜK4, Bio Se utilizaron anticuerpos anti-FLAG (F7425, Sigma) y anti-HA (clon 6E2, señalización celular) para detectar la expresión de proteínas en células transfectadas. El anticuerpo anti-GAPDH se utilizó como control de carga de muestras para Western Blot. El anticuerpo antiovina MHC-I (clon 41.17, Biorad) se utilizó como control positivo para etiquetar las células en ensayos de citotoxicidad celular dependientes de anticuerpos. El anticuerpo monoclonal anti-PPRV-N se utilizó 1:100 para la detección de PPRV (Dr. Libeau, CIRAD, Montpellier, Francia) en experimentos de citometría de flujo. El anticuerpo monoclonal anti-BTV-VP7 (VMRD; CJ-F-BTV-MAB-10 ML) se utilizó para la detección de BTV. El anti-ratón IgM-FITC (Clone II/41, BD biociencias), anti-ratón IgG-Alexa 488 o 647 (termociclero), anti-perno-IgG Alexa 488 (termociclero) se utilizaron como anticuerpos secundarios para la citometría de flujo e inmunofluorescencia. Se utilizaron anticuerpos secundarios conjugados con IgG anti-rabita o IgG HRP anti-Rabbit (GE Healthcare) para las manchas occidentales.
ELISA de IgG anti-BTV
El ELISA para IgG específica de BTV-8 en sueros se realizó como lo describe Martin et al. (25). En resumen, las placas de Maxisorp (termofisher) se cubrieron con diluciones en serie de BTV-8 durante la noche a 4 °C. Las placas se bloquearon con PBS + 0,05% de preadolescente + 2 % de leche durante 1 hora a temperatura ambiente, se lavaron con PBS + 0,05% de preadolescente e incubaron con suero inmune o ingenuo (dilución 1:200) durante 2 h a temperatura ambiente. Después del lavado, las placas se incubaron durante 1 hora con anticuerpos secundarios conjugados con IgG HRP anti-oveja de burro (Biorad) (dilución 1:10,000) y después de extensas reacciones de lavado se revelaron con 3, 3′, 5, 5′-Tetrametil-bencidina (TMB, Thermofisher) La absorción se leyó a 450 nm en un lector de microplacas Fluostar Omega.
Aislamiento de células mononucleares de la sangre periférica
La sangre se obtuvo de ovejas donantes saludables alojadas en el Departamento de Reproducción Animal (INIA, Madrid, España) y de células mononucleares de sangre periférica (PBMC) purificadas mediante técnicas de centrifugación estándar utilizando la separación del gradiente de Ficoll como se describe en Rojas et al. (23).
Enriquecimiento celular y expansión celular NK
Las células CD14+ se agotaron de PBMC utilizando el kit de aislamiento humano CD14 (Miltenyi) y de acuerdo con el protocolo del fabricante. El enriquecimiento de la célula T/NK y la célula B se obtuvo mediante la separación de columnas de lana de nylon (26). En resumen, el PBMC agotado por CD14 se incubaron en una columna de lana de nylon de equilibrio medio durante 45 minutos a 37 °C, un 5 % de CO2. Las células se eluccionaron en 2 fracciones. Los primeros 13-14 ml de eluato se enriquecieron en células T y NK (normalmente > 70 % y 15-20 %, respectivamente). El segundo eluado que consiste en la fracción celular expulsada de la columna se enriqueció en células B (>80% típicamente). La eficiencia de la separación se evaluó mediante citometría de flujo.
Para la expansión de la célula NK, las células CD16+ se aislaron de la fracción enriquecida con T/NK obtenida después de la separación de la columna de lana de nylon. Las células que expresan CD16 se etiquetaron con 0,5 μg/ml de anticuerpo antihumano CD16 (Clone KD1, Biorad) por 107 células durante 20 minutos en PBS + 0,2 % de BSA + 2 mM EDTA a 4 °C. Después del lavado, las células se incubaron con microperlas IgG antiratón (Miltenyi) (20 μl/107 células) durante 20 minutos en PBS + 0,2 % de BSA + 2 mM EDTA a 4 °C, se lavaron y se eluieron en la columna LS de acuerdo con el protocolo del fabricante (Milten Las células aisladas de CD16+ (2 × 105 por pozo) se expandieron con 2.000 UI/ml de IL-2 humano o 100 ng/ml de IL-2 ovino durante 21 a 28 días en 96 placas de fondo U de pozo (27, 28). Los medios suplementados con IL-2 se reponen cada 2-3 días, y las células se dividen 1:2 cada 5-7 días. La expresión de CD16 se evaluó mediante citometría de flujo antes del uso y los cultivos normalmente contenían más del 40 % de células CD16+ después de la expansión.
Citometría de flujo y ensayos de citotoxicidad
Para la tinción de citometría de flujo, las células se incubaron con anticuerpos o suero ingenuo/inmune (1:400 dilución) durante 20 minutos sobre hielo en tampón de manchas PBS (PBS + 2% FBS + 0,03% de azida de sodio). Luego, las células se lavaron e incubaron con anticuerpos secundarios si era necesario durante 20 minutos en hielo en un tampón de manchas de PBS. Las células se fijaron en un 1 % de paraformaldehído (PFA) antes de la adquisición. Para la tinción intracelular, las células se fijaron en un 4 % de PFA, permeabilizadas y teñidas en un tampón de manchas de PBS complementado con 0,2% de saponina. Se realizaron todos los controles apropiados de isotipo, solo de anticuerpos secundarios, suero ingenuo y fluorescencia menos un canal.
Los ensayos de citotoxicidad basados en citometría de flujo se realizaron como se describe (29, 30). Las células objetivo brevemente (fracción enriquecida con células B o células transfectadas 293T) fueron etiquetadas con PKH67 (Sigma). Las células objetivo se incubaron con suero ingenuo/inmune (1:400 dilución) o anticuerpo anti-MHC-I (como control positivo) durante 1 h, se lavaron y cocultivaron con células efectoras a diferentes proporciones durante 4 h. El yoduro de propidio (PI) se utilizó para etiquetar las células muertas y se añadió antes del análisis de citometría de flujo. Se incluyó la muerte celular espontánea y máxima (medida por la adición de saponcina al 0,2 %) para todas las células diana. La lisis celular específica se midió utilizando la siguiente fórmula: % de lisis específica = (% de células diana PI+ – % de muerte espontánea de la célula diana)/(% de muerte máxima de la célula diana – % de muerte espontánea de la célula diana) × 100. Las muestras se adquirieron en un citómetro de flujo FACScalibur y se realizaron análisis con el software FlowJo.
Transfección
Los genes PPRV-P, -F y -H de la cepa de la vacuna PPRV Nig’75 se clonaron en vectores plasmidos de expresión del ADNc obtenido de células infectadas por VDS. El gen PPRV-P se clonó en un plásmido de expresión pIRES que expresa una etiqueta de epítopito FLAG. Los genes PPRV-F y -H se clonaron en plásmidos de expresión pCAGG que expresaban una etiqueta de epítopo HA. 293 células T se transfectaron en 6 placas de pozo a una confluencia de ~60% con 1 μg de ADN plásmido utilizando el reactivo de transfección Mirus T siguiendo las instrucciones del fabricante. Se utilizó el plásmido vacío pCAGG como control de transfecciones. Las células transfeccionadas se utilizaron para la expresión de proteínas o como células diana 48 horas después de la transfección.
Western Blot
Los lisatos celulares se obtuvieron como se describe (31). El kit de ensayo de proteínas MicroBCA (Thermofisher) se utilizó para medir el contenido de proteínas en los lílatos celulares y se resolvieron 20 μg de proteína por carril en un 10% de SDS-PAGE. Después de la transferencia a la membrana PVDF, se sondeó la mancha con los anticuerpos primarios y secundarios apropiados y se reveló con el reactivo ECL (Thermofisher). Se detectó quimioluminiscencia utilizando una película o un Chemidoc (Biorad).
Inmunofluorescencia y microscopía confocal
Las células Vero se cultivaron en los labios y se transfectaron con 1 μg de ADN plásido utilizando el reactivo Lipofectamina 3000 (Invitrogen, Thermofisher) siguiendo las instrucciones del fabricante. Después de 24 horas, las células se fijaron con un 4 % de PFA durante 20 minutos, se permeabilizaron en PBS +0,05% Triton X-100 y se bloquearon con el diluyente de reactivo de anticuerpos Dako. Los clips de cubierta se incubaron con el anticuerpo primario diluido en el diluyente del reactivo de anticuerpos Dako durante la noche a 4 °C. Luego se incubaron las cubiertas con anticuerpos secundarios diluidos en el diluyente de reactivo de anticuerpos Dako durante 45 minutos a temperatura ambiente. Los clips de las cubiertas se mancharon con DAPI antes de montarlos con medios de montaje Prolong. Las imágenes se capturaron con un objetivo de 63x utilizando un microscopio confocal LSM 880 (Zeiss). El software ImageJ se utilizó para el análisis de imágenes.
Análisis estadístico
El análisis estadístico se realizó con el software Graphpad Prism. Las pruebas estadísticas utilizadas para el análisis de datos se describen en la leyenda de la figura. Los niveles de significación fueron los siguientes: *p < 0,05; **p < 0,01; y ***p < 0,001.
Resultados
Las IgG de PPRV pero no de BTV Las senos inmunes pueden reconocer antígenos virales en la superficie de las células infectadas
Para que ADCC se lleve a cabo la unión a la IgG a la superficie de las células infectadas es necesario. Esta unión puede desencadenar la muerte celular a través del reconocimiento por los receptores Fc presentes en las células efectoras (5). Para determinar si los sueros inmunes de las ovejas infectadas por PPRV IC’89 o BTV-8 podrían reconocer las células infectadas, evaluamos mediante citometría de flujo la unión superficial de estos sueros en las células del huésped natural (oveja) infectadas con PPRV IC’89 o BTV-8 (Figura 1). La entrada de células PPRV está mediada por la unión a los receptores SLAM en las células inmunitarias (32) o a la nectina-4 en las células epiteliales (33). Elegimos evaluar la infección por PPRV en las células inmunitarias, ya que estos son objetivos tempranos durante el ciclo infeccioso del virus. Enriquecimos el PBMC ovino en células B utilizando fraccionamiento de lana de nylon e infectamos estas células con PPRV IC’89 en MOI 3. La infección por PPRV podría detectarse mediante citometría de flujo en el ovino enriquecido con células B PBMC con anticuerpo anti-PPRV-N (Figura 1A). Los sueros inmunes de PPRV podrían unirse específicamente a PBMC enriquecido con células B infectados con PPRV IC’89 en comparación con los sueros ingenuos (Figura 1B). Los sueros inmunes de PPRV también podrían reconocer los antígenos intracelulares de PPRV cuando se realizaba la tinción en células permeabilizadas (Figura 1C). Detectamos un aumento en la intensidad media de fluorescencia de las células infectadas (MFI) utilizando tres diferentes sueros inmunes PPRV de ovino que indican que los sueros inmunes PPRV podrían detectar antígenos PPRV de superficie en células infectadas (Figura 1D). Para la infección por BTV, se utilizó una línea celular STC ovina establecida, ya que el virus puede infectar un amplio espectro de tipos de células in vitro. Se detectó infección por BTV (MOI 3) en las células STC mediante citometría de flujo con anticuerpo anti-BTV-VP7 (Figura 1E). Los sueros inmunes de BTV-8 no podían unirse específicamente a la superficie de las células STC infectadas con BTV-8 (Figura 1F). Sin embargo, los sueros inmunes BTV-8 podrían reconocer específicamente las células infectadas por BTV-8 cuando las preparaciones celulares se permeabilizaron (Figura 1G). La capacidad del suero inmune a BTV para reconocer el virus y las células infectadas se confirmó mediante ELISA e inmunofluorescencia (Figura suplementaria 1). La unión de varios sueros inmunes BTV-8 en células infectadas por STC se evaluó para confirmar este hallazgo (Figura 1H). Si bien los sueros inmunes podían reconocer antígenos intracelulares de BTV en las células STC infectadas, la intensidad de fluorescencia de estos sueros en la tinción de superficies fue equivalente a la de los sueros BTV ingenuos. Esto indicó que las células infectadas por BTV-8 solo expresaban en la superficie celular niveles bajos de antígenos BTV reconocibles por los sueros inmunes. Por el contrario, los sueros inmunes al PPRV podrían detectar antígenos del PPRV en la superficie de las células infectadas.
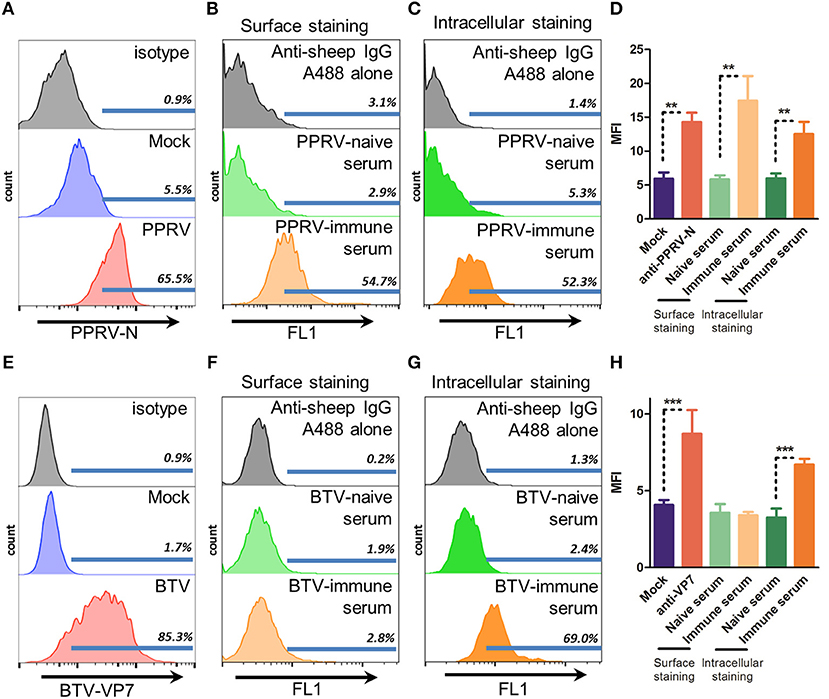 FIGURA 1. Los sueros inmunes de PPRV, pero no de BTV, se unen a las células infectadas. (A-D) Histogramas de citometría de flujo representativos (n = 3) de PBMC de ovino enriquecido con células B infectados simuladamente o infectados con PPRV IC’89 a MOI 3 durante 48 h y teñidos con (A) anticuerpo anti-PPRV-N, (B) manchado en la superficie, o (C) teñidos intra (D) Intensidad media de fluorescencia (MFI) de la ovina enriquecida con células B infectadas por PPRV IC’89 teñida con anticuerpo anti-PPRV-N, senos sin PPRV o -inmunes. Se representa la media ± SD MFI para 3 senos ingenuos e inmunes. **p < 0,01 ANOVA de un solo sentido con la prueba posterior de Bonferroni. (E-H) Histogramas representativos de citometría de flujo de células STC (n = 2-44) infectadas simuladas o infectadas con BTV-8 a MOI 3 durante 24 h y (E) teñidos con anticuerpo anti-BTV-VP7; (F) superficie teñida con suero inmune o inmune a BTV o, como control, anticuerpo secundario solo (H) Intensidad media de fluorescencia (MFI) de las células STC infectadas por BTV-8, teñidas con anticuerpos anti-BTV-VP7, seres ingenuos con BTV o -inmunes. Se representa la media de ± SD MFI para 2 a 4 senos ingenuos e inmunes. ***p < 0,001 ANOVA de un solo sentido con la prueba posterior de Bonferroni.
FIGURA 1. Los sueros inmunes de PPRV, pero no de BTV, se unen a las células infectadas. (A-D) Histogramas de citometría de flujo representativos (n = 3) de PBMC de ovino enriquecido con células B infectados simuladamente o infectados con PPRV IC’89 a MOI 3 durante 48 h y teñidos con (A) anticuerpo anti-PPRV-N, (B) manchado en la superficie, o (C) teñidos intra (D) Intensidad media de fluorescencia (MFI) de la ovina enriquecida con células B infectadas por PPRV IC’89 teñida con anticuerpo anti-PPRV-N, senos sin PPRV o -inmunes. Se representa la media ± SD MFI para 3 senos ingenuos e inmunes. **p < 0,01 ANOVA de un solo sentido con la prueba posterior de Bonferroni. (E-H) Histogramas representativos de citometría de flujo de células STC (n = 2-44) infectadas simuladas o infectadas con BTV-8 a MOI 3 durante 24 h y (E) teñidos con anticuerpo anti-BTV-VP7; (F) superficie teñida con suero inmune o inmune a BTV o, como control, anticuerpo secundario solo (H) Intensidad media de fluorescencia (MFI) de las células STC infectadas por BTV-8, teñidas con anticuerpos anti-BTV-VP7, seres ingenuos con BTV o -inmunes. Se representa la media de ± SD MFI para 2 a 4 senos ingenuos e inmunes. ***p < 0,001 ANOVA de un solo sentido con la prueba posterior de Bonferroni.
Los Seras Inmunitarios De Las Ovejas Infectadas Por PPRV Inducen ADCC Contra Las Células Infectadas
El ADCC se evalúa clásicamente utilizando células NK derivadas de PBMC como células efectoras. ADCC está mediado por la reticulación CD16 en estas células por IgG unida a la superficie de la célula diana. CD16 se expresa en varias poblaciones de células mononucleares periféricas (células NK y subconjuntos de células T γδ, monocitos y macrófagos). Sin embargo, las células NK solo representan una pequeña proporción del PBMC total (típicamente < 5 %); por lo tanto, necesitábamos obtener una fracción de PBMC ovino enriquecida en células NK frescas. Dado que las células NK también pueden mediar la matanza alogénica de las células objetivo, decidimos evaluar el ADCC en un sistema autólogo para minimizar la muerte no específica de las células diana. Por lo tanto, también necesitábamos obtener una fracción de célula objetivo autóloga de la misma oveja donante.
Para obtener nuestra fracción de PBMC ovina enriquecida en células NK, primero eliminamos los monocitos CD14+ (ya que estas células también pueden expresar CD16) utilizando cuentas magnéticas comerciales recubiertas de anticuerpos anti-CD14 y el agotamiento confirmado por citometría de flujo. Se utilizaron parcelas de puntos FSC/SSC para la discriminación celular y la tinción de control de isotipos para la configuración de puertas (Figuras 2A, B). La fracción PBMC agotada por CD14, que siempre contenía < 1% de células CD14+ y conservaba una población CD16+ Figuras 2B, se separó en columnas de lana de nylon. La primera fracción eluida de la columna de lana de nylon se enriqueció en células T y NK. Esta fracción normalmente contenía más del 70 % de células CD3+ y del 15 al 20 % de células CD16+, y se utilizaba como células efectoras (Figura 2C). La segunda fracción elutada al enjuagar las células atrapadas en la columna de lana de nylon se enriqueció en células B (>70% de marcadores de células B + células) y se utilizó como células objetivo (Figura 2D). Esta fracción podría infectarse efectivamente con PPRV-IC’89 (Figura 1A) o BTV-8 (Figura 2E).
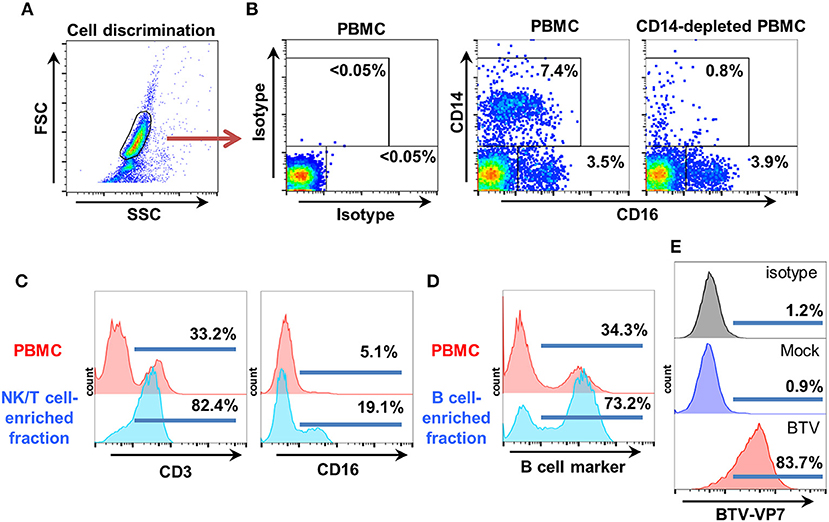 FIGURA 2. Aislamiento de células objetivo y efectoror para ensayos de ADCC de ovino. (A) El PBMC de ovino se obtuvo mediante la separación de centrifugación de gradiente estándar.Las células CD14+ se agotaron utilizando microparadas anti-CD14 como lo describe el fabricante. La discriminación celular se estableció utilizando puntos de FSC/SSC. (B) Se muestran las parcelas de puntos representativas de citometría de flujo (n = 4) para la tinción de CD14 y CD16 en PBMC y en PBMC agotada por CD14. Se utilizaron controles de isotipo para establecer gatings CD14/CD16. (C) La fracción efector utilizada en los ensayos ADCC se obtuvo después de la elución de PBMC agotado por CD14 de columnas de lana de nylon. Esta fracción está enriquecida en células NK y T. Se muestran histogramas de citometría de flujo representativo (n = 6) después de la tinción de CD3 y CD16 en PBMC y en el eluato enriquecido con células NK/T. (D) La fracción de célula objetivo autóloga utilizada en los ensayos ADCC se obtuvo después de limpiar las células atrapadas en la columna de lana de nylon. Esta fracción se enriquece en células B. Se muestran histogramas representativos de citometría de flujo (n = 6) para la expresión del marcador de células B en PBMC y el eluato enriquecido con células B. (E) La fracción enriquecida con células B fue infectada de forma simulada o infectada con BTV-8 (MOI 3). La infección de las células objetivo con BTV-8 se monitoreó mediante citometría de flujo utilizando tinción anti-BTV-VP7.
FIGURA 2. Aislamiento de células objetivo y efectoror para ensayos de ADCC de ovino. (A) El PBMC de ovino se obtuvo mediante la separación de centrifugación de gradiente estándar.Las células CD14+ se agotaron utilizando microparadas anti-CD14 como lo describe el fabricante. La discriminación celular se estableció utilizando puntos de FSC/SSC. (B) Se muestran las parcelas de puntos representativas de citometría de flujo (n = 4) para la tinción de CD14 y CD16 en PBMC y en PBMC agotada por CD14. Se utilizaron controles de isotipo para establecer gatings CD14/CD16. (C) La fracción efector utilizada en los ensayos ADCC se obtuvo después de la elución de PBMC agotado por CD14 de columnas de lana de nylon. Esta fracción está enriquecida en células NK y T. Se muestran histogramas de citometría de flujo representativo (n = 6) después de la tinción de CD3 y CD16 en PBMC y en el eluato enriquecido con células NK/T. (D) La fracción de célula objetivo autóloga utilizada en los ensayos ADCC se obtuvo después de limpiar las células atrapadas en la columna de lana de nylon. Esta fracción se enriquece en células B. Se muestran histogramas representativos de citometría de flujo (n = 6) para la expresión del marcador de células B en PBMC y el eluato enriquecido con células B. (E) La fracción enriquecida con células B fue infectada de forma simulada o infectada con BTV-8 (MOI 3). La infección de las células objetivo con BTV-8 se monitoreó mediante citometría de flujo utilizando tinción anti-BTV-VP7.
El ADCC se midió mediante citometría de flujo utilizando células diana etiquetadas con el marcador de membrana PKH67 (Figura 3A) e infectadas con BTV-8 (Figura 3B) o PPRV IC’89 (Figura 3C). La muerte celular se evaluó con tinción de yoduro de propidio. La capacidad de los sueros inmunes de BTV para producir ADCC contra las células infectadas por BTV se evaluó utilizando células efectoras y objetivo obtenidas de tres ovejas donantes (Figura 3D). Los sueros inmunes de BTV no indujeron lisis específicas de las células diana infectadas por BTV en comparación con las células incubadas con sueros naïve de BTV o sin preincubación sérico. Las células objetivo etiquetadas con anticuerpos anti-MHC-I fueron lyseadas específicamente por células efectoras, lo que indica que las células efectoras podrían mediar con el ADCC en estos experimentos. La capacidad de 3 sueros inmunes PPRV (A, B y C) para producir ADCC contra células diana infectadas por PPRV también se evaluó con células efectoras y objetivo purificadas de tres ovejas donantes PBMC (Figura 3E). Los tres sueros inmunes de PPRV promovieron la lisis específica de las células infectadas por PPRV IC’89 en comparación con las células diana incubadas en ausencia de sueros o con los sueros ingenuos correspondientes. Por lo tanto, los sueros inmunes de PPRV contienen anticuerpos que median con el ADCC contra las células diana infectadas por el virus. No pudimos detectar el mecanismo ADCC contra las células infectadas por BTV con sueros inmunes.
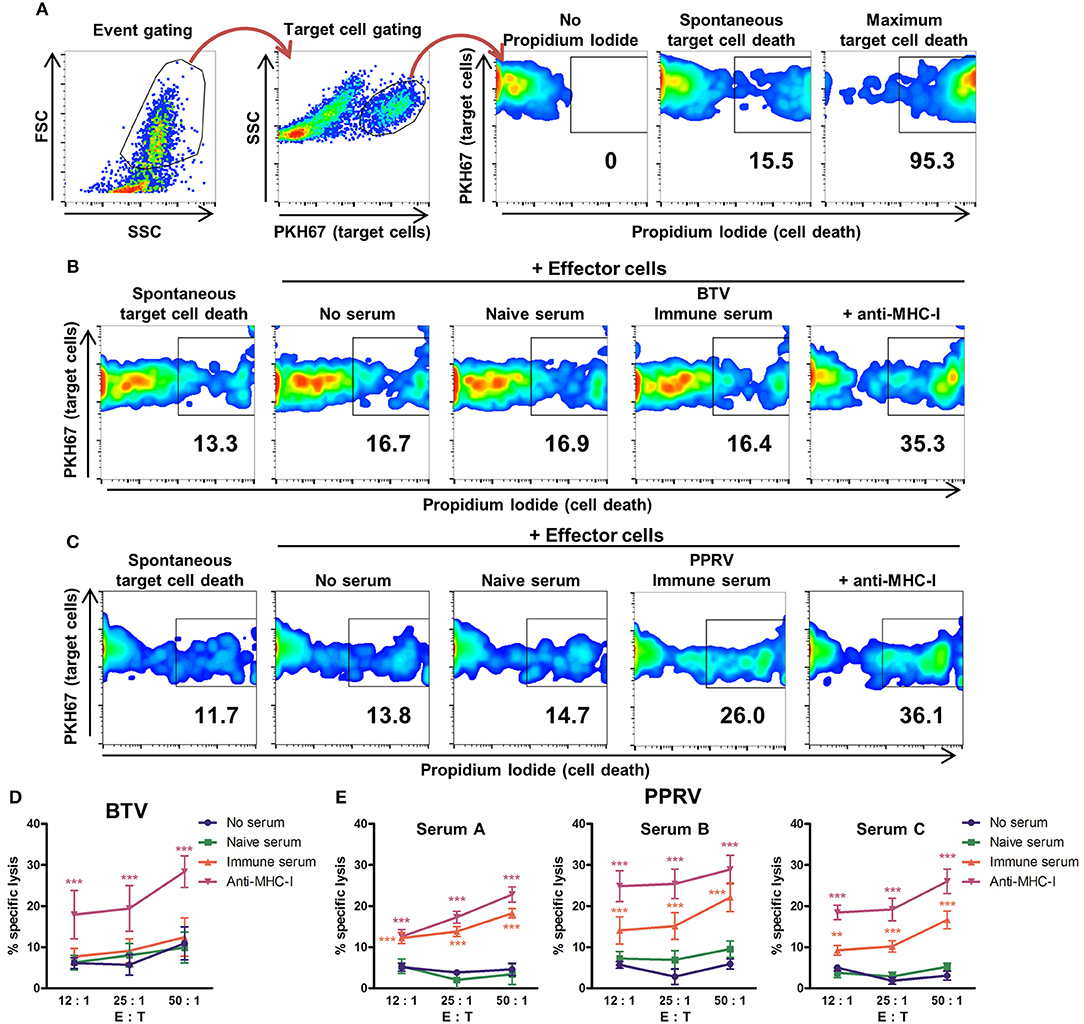 FIGURA 3. Los sueros de ovejas inmunes al PPRV pueden mediar en el ADCC contra las células infectadas por el PPRV. (A) Estrategia de Gating para ensayos ADCC basados en citometría de flujo. Las parcelas de puntos FSC/SSC discriminaron los escombros y permitieron la gating de eventos. Las células objetivo (eventos PKH67+) se bloquearon para realizar el análisis de viabilidad con la tinción de yoduro de propidio (PI). La clasificación para las células muertas se basó en muestras de PI sin teñir. La muerte máxima de las células objetivo se midió mediante la adición de 0,2% de saponina. (B,C) Ejemplos de parcelas de puntos de citometría (duplicados de tres experimentos independientes para cada suero) utilizadas para medir la lisis específica de células diana por células efectoras. Gráficos de puntos representativos de (B) BTV- o (C) fracción enriquecida con células B infectadas por PPRV (células objetivo) cultivadas en ausencia de células efectoras (muerte de células espontáneas) o en presencia de células efectoras (fracción autóloga de células NK/T) después de la incubación con anticuerpo anti-MHC (D) Lílisis específica media (±SEM) en tres experimentos independientes de células infectadas por BTV incubadas con anticuerpos anti-MHC-I como control positivo, sin suero, ingenuo o inmune a BTV en una relación de efector a células objetivo diferente (E: T). ***p < 0,001 ANOVA bidireccional con post-prueba de Dunnett (E) LÍLISIS específica media (±SEM) en tres experimentos independientes contra células infectadas por PPRV incubadas con anticuerpos anticuerpos anti-MHC-I como control positivo, sin suero, suero a PPRV A, B o C inmune al PPRV, B o suero inmune al PPRV a una relación de efector a célula objetivo (E:
FIGURA 3. Los sueros de ovejas inmunes al PPRV pueden mediar en el ADCC contra las células infectadas por el PPRV. (A) Estrategia de Gating para ensayos ADCC basados en citometría de flujo. Las parcelas de puntos FSC/SSC discriminaron los escombros y permitieron la gating de eventos. Las células objetivo (eventos PKH67+) se bloquearon para realizar el análisis de viabilidad con la tinción de yoduro de propidio (PI). La clasificación para las células muertas se basó en muestras de PI sin teñir. La muerte máxima de las células objetivo se midió mediante la adición de 0,2% de saponina. (B,C) Ejemplos de parcelas de puntos de citometría (duplicados de tres experimentos independientes para cada suero) utilizadas para medir la lisis específica de células diana por células efectoras. Gráficos de puntos representativos de (B) BTV- o (C) fracción enriquecida con células B infectadas por PPRV (células objetivo) cultivadas en ausencia de células efectoras (muerte de células espontáneas) o en presencia de células efectoras (fracción autóloga de células NK/T) después de la incubación con anticuerpo anti-MHC (D) Lílisis específica media (±SEM) en tres experimentos independientes de células infectadas por BTV incubadas con anticuerpos anti-MHC-I como control positivo, sin suero, ingenuo o inmune a BTV en una relación de efector a células objetivo diferente (E: T). ***p < 0,001 ANOVA bidireccional con post-prueba de Dunnett (E) LÍLISIS específica media (±SEM) en tres experimentos independientes contra células infectadas por PPRV incubadas con anticuerpos anticuerpos anti-MHC-I como control positivo, sin suero, suero a PPRV A, B o C inmune al PPRV, B o suero inmune al PPRV a una relación de efector a célula objetivo (E:
La expresión de proteínas PPRV-F y -H en células infectadas media el reconocimiento ADCC por suero PPRV-Immune
A continuación, nos proncimos determinar qué productos del gen PPRV podrían ser reconocidos por los sueros inmunes. La partícula PPRV está envuelta y contiene dos proteínas transmembranas codificadas por el genoma viral: una proteína de fusión (F) responsable de la fusión de la partícula viral con la membrana plasmática celular y una hemaglutinina (H) responsable de la fijación del receptor en la célula diana (17). La infección por PPRV también produce sincitis debido a la expresión de la proteína F en la superficie celular de las células infectadas. Además, se cree que el PPRV sale de las células infectadas por brote y, por lo tanto, las proteínas PPRV-F y PPRV-H probablemente estén presentes en la superficie celular de las células infectadas (34). Los anticuerpos contra las proteínas F y H se pueden detectar en individuos que se recuperaron de la infección por Morbillivirus, y la vacunación con adenovirus recombinante que expresa estos genes produce anticuerpos anti-PPRV y protege contra el desafío viral virulento (35-37). Por lo tanto, planteamos la hipótesis de que PPRV-F y H podrían ser objetivos para ADCC en células infectadas.
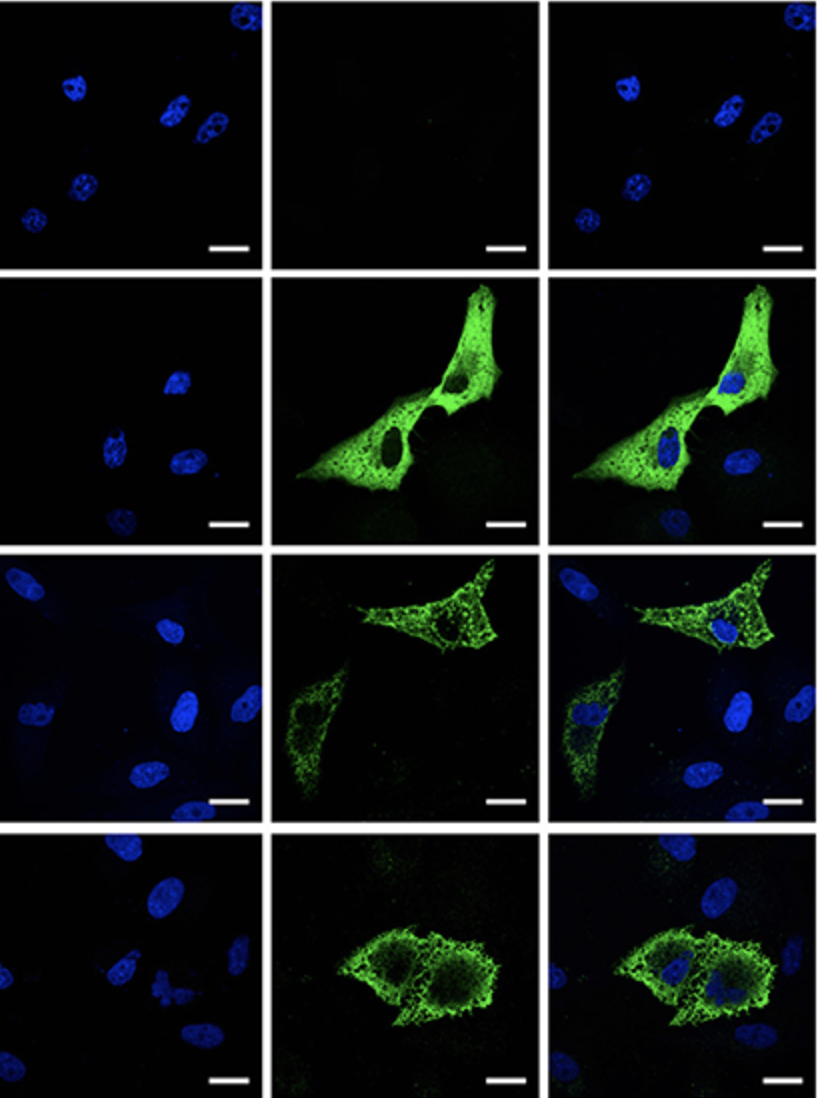
Para probar esta hipótesis, el ADNc F y H obtenido de las células infectadas PPRV-Nig’75 se clonaron en vectores de expresión pCAGG que contienen una etiqueta de epítope de HA para su detección. Como control para un producto del gen intracelular PPRV, el ADNc del gen de la fosfoproteína P de PPRV-Nig’75 se clonó en un vector de expresión pIRES junto con un epítope de etiqueta FLAG. La expresión de las proteínas PPRV-F, -H y -P se verificó mediante inmunofluorescencia después de la transfección de las células Vero (Figura 4A). Esto se confirmó además mediante el análisis de Western-blot de células 293T (Figura 4B) o células Vero (datos no mostrados) transfectadas con estos plásmidos. La detección de etiquetas HA/FLAG reveló bandas en el peso molecular previsto para PPRV-H (~70 kDa), PPRV-F (~59 kDa) y PPRV-P (~75-79 kDa dependiendo de la fosforilación).
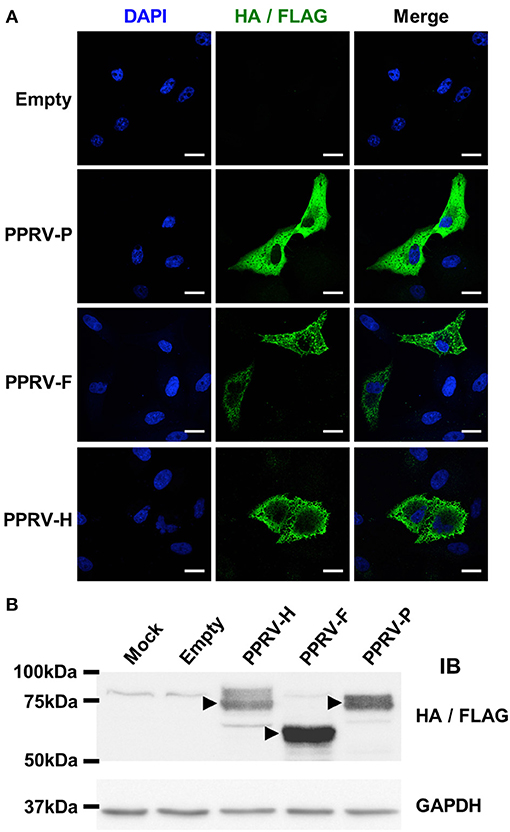 FIGURA 4. Expresión de PPRV-P, -F y -H en células transfectadas. (A) Las células Vero se cultivaron en capas, transfectadas con pCAGG-Empty, -PPRV-F-HA, -PPRV-H-HA o pIRES-PPRV-P-FLAG, y la expresión de proteínas se evaluó con anticuerpos antietiquetas (HA/FLAG). Los ácidos nucleicos se visualizaron mediante la tinción DAPI. Se muestran imágenes confocales representativas de células transfectadas. Barra de escala = 20 μm. (B) Las células 293T fueron simuladas (Mock) o transfectadas con pCAGG-Empty, -PPRV-F-HA, -PPRV-H-HA o pIRES-PPRV-P-FLAG, y se obtuvo lisato celular. Las proteínas se resolvieron con un 10% de SDS-PAGE, se transfirieron a la membrana de nitrocelulosa y se sondearon (IB) para la expresión de proteínas utilizando anticuerpos antietiquetas (HA/FLAG). Las membranas también se sondearon con anticuerpos anti-GAPDH como control de carga. Las puntas de flecha indican bandas de proteínas en el peso molecular previsto para PPRV-H (70 kDa), PPRV-F (59 KDa) y PPRV-P (75-79 kDa dependiendo de la fosforilación).
FIGURA 4. Expresión de PPRV-P, -F y -H en células transfectadas. (A) Las células Vero se cultivaron en capas, transfectadas con pCAGG-Empty, -PPRV-F-HA, -PPRV-H-HA o pIRES-PPRV-P-FLAG, y la expresión de proteínas se evaluó con anticuerpos antietiquetas (HA/FLAG). Los ácidos nucleicos se visualizaron mediante la tinción DAPI. Se muestran imágenes confocales representativas de células transfectadas. Barra de escala = 20 μm. (B) Las células 293T fueron simuladas (Mock) o transfectadas con pCAGG-Empty, -PPRV-F-HA, -PPRV-H-HA o pIRES-PPRV-P-FLAG, y se obtuvo lisato celular. Las proteínas se resolvieron con un 10% de SDS-PAGE, se transfirieron a la membrana de nitrocelulosa y se sondearon (IB) para la expresión de proteínas utilizando anticuerpos antietiquetas (HA/FLAG). Las membranas también se sondearon con anticuerpos anti-GAPDH como control de carga. Las puntas de flecha indican bandas de proteínas en el peso molecular previsto para PPRV-H (70 kDa), PPRV-F (59 KDa) y PPRV-P (75-79 kDa dependiendo de la fosforilación).
A continuación, queríamos determinar si los sueros inmunes PPRV podrían detectar la presencia de estas proteínas PPRV en la superficie de las células transfectadas. Las células transfectadas 293T se incubaron con sueros inmunes, se tiñeron con anticuerpos IgG anti-oveja secundarios conjugados con Alexa488 y fluorescencia determinada por citometría de flujo (Figura 5A). Los sueros inmunes de PPRV podrían unirse a las células transfectadas PPRV-F y PPRV-H, pero no a las células falsamente transfeccionadas, transfectadas con un vector de expresión vacía o con un vector de expresión PPRV-P. Por lo tanto, los sueros inmunes de PPRV pueden reconocer las proteínas PPRV-F y -H en la superficie celular. Para determinar si la unión específica de la IgG presente en los sueros inmunes podría desencadenar ADCC contra las células que expresan PPRV-F o -H, utilizamos células transfectadas incubadas con sueros inmunes como objetivos en ensayos de citotoxicidad. Las células NK ovinas expandidas de IL-2 se utilizaron como células efectoras (Figura 5B). La lisis específica se aumentó contra las células diana que expresan PPRV-F o -H utilizando células NK aisladas de cuatro ovejas donantes diferentes. En conjunto, estos datos muestran que las proteínas PPRV-F y -H pueden ser objetivos de ADCC en células infectadas por PPRV.
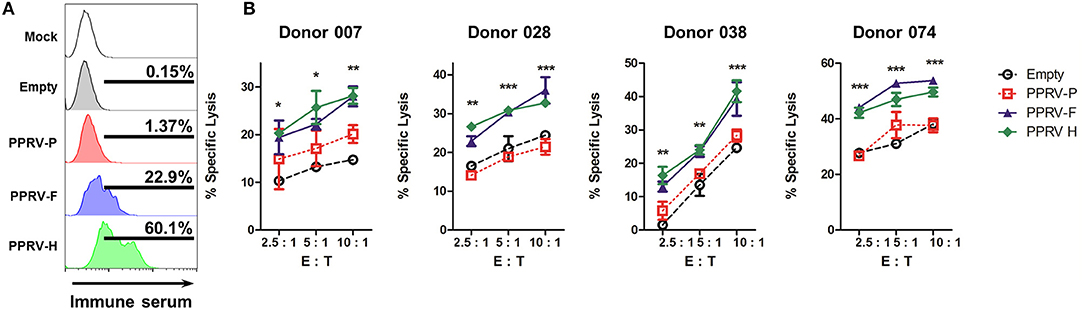 FIGURA 5. ADCC está dirigido a las proteínas PPRV-F y -H. Las células 293T fueron transfeccionadas de forma simulada, transfectadas con un plásmido de expresión vacía o plásmidos PPRV -P, -F o -H expresando.( A) Las células 293T transfectadas se incubaron con suero inmune anti-PPRV y anticuerpo secundario anti-oveja IgG-alexa488. La unión de IgG de oveja a las células transfectadas se evaluó mediante citometría de flujo. Se muestran histogramas representativos de citometría de flujo de tres experimentos independientes. (B) Las células 293T transfecciadas se incubaron con suero inmune PPRV y se utilizaron como células diana. ADCC se midió mediante ensayos de citotoxicidad de citometría de flujo utilizando células NK ovinas expandidas por IL-2 (>40% de células CD16+) de ovejas donantes como células efectoras. Se muestra una lisis específica (media ± SD) en ensayos ADCC realizados en cuatro ovejas donantes a una relación de efector a célula objetivo diferente (E: T). *p < 0,05; **p < 0,01; ***p < 0,001 ANOVA bidireccional con post-prueba de Bonferroni (PPRV-P, -F o -H vs. vacío).
FIGURA 5. ADCC está dirigido a las proteínas PPRV-F y -H. Las células 293T fueron transfeccionadas de forma simulada, transfectadas con un plásmido de expresión vacía o plásmidos PPRV -P, -F o -H expresando.( A) Las células 293T transfectadas se incubaron con suero inmune anti-PPRV y anticuerpo secundario anti-oveja IgG-alexa488. La unión de IgG de oveja a las células transfectadas se evaluó mediante citometría de flujo. Se muestran histogramas representativos de citometría de flujo de tres experimentos independientes. (B) Las células 293T transfecciadas se incubaron con suero inmune PPRV y se utilizaron como células diana. ADCC se midió mediante ensayos de citotoxicidad de citometría de flujo utilizando células NK ovinas expandidas por IL-2 (>40% de células CD16+) de ovejas donantes como células efectoras. Se muestra una lisis específica (media ± SD) en ensayos ADCC realizados en cuatro ovejas donantes a una relación de efector a célula objetivo diferente (E: T). *p < 0,05; **p < 0,01; ***p < 0,001 ANOVA bidireccional con post-prueba de Bonferroni (PPRV-P, -F o -H vs. vacío).
Discusión
Las respuestas al ADCC son parte de los mecanismos inmunes efectores desencadenados por varias infecciones virales (6–9, 38–40), y en algunos casos están mejor correlacionadas con la protección que los anticuerpos neutralizantes (8, 41). De hecho, ADCC representa una de las bases para la protección conferida por los anticuerpos no neutralizantes. Aquí evaluamos la respuesta ADCC provocada por dos virus rumiantes, BTV y PPRV. En primer lugar, mostramos que BTV no induce una respuesta de ADCC. En segundo lugar, describimos por primera vez que las células ovinas infectadas con PPRV pueden ser objetivos de una respuesta de ADCC. Además, nuestros resultados muestran que las proteínas PPRV F y H son los principales objetivos de ADCC. Estos datos sugieren que las células ADCC y NK podrían desempeñar un papel importante en la modulación del curso de las infecciones por PPRV.
En trabajos anteriores demostramos que el adenovirus recombinante que expresaba proteínas estructurales BTV o PPRV provocaba inmunidad celular y humoral y protegía a las ovejas contra el desafío del virus (25, 30, 36). En el caso de BTV, la protección se produjo a pesar de que solo se indujeron anticuerpos anti-BTV no neutralizantes. BTV es el miembro prototipo del género Orbivirus no envuelto. BTV solo codifica para una proteína transmembrana (la viroporina NS3) cuyo dominio extracelular corto está glicosilado (10). Sin embargo, las partículas de BTV están estrechamente asociadas con las membranas celulares, ya que la liberación de partículas se ha asociado con el brote. Por lo tanto, es plausible que los anticuerpos anti-BTV puedan detectar el antígeno BTV en la superficie de las células infectadas. Sin embargo, el trabajo presentado aquí indica que es poco probable que los antígenos BTV sean reconocidos por los sueros inmunes en la superficie de las células infectadas. Demos que los senos inmunes de BTV no contenían anticuerpos que desencadenan el ADCC. Por lo tanto, es poco probable que las células infectadas por BTV sean atacadas por ADCC in vivo. Sería interesante en el trabajo futuro evaluar si los anticuerpos dirigidos a la fracción extracelular de NS3 podrían mediar en el reconocimiento de células infectadas o en el mecanismo de ADCC. Dada la importancia del NS3 en la liberación de partículas BTV de las células de mamíferos (42), la inducción de anticuerpos anti-NS3 también podría formar la base para una terapia reactiva de serotipo cruzado.
PPRV es un morbilivirus, cuya partícula viral envuelta posee dos proteínas estructurales transmembranas que también se expresan en las células infectadas (17). Aquí mostramos que las células del huésped natural infectado con PPRV pueden ser objetivos para ADCC. Por lo tanto, los sueros inmunes de las ovejas infectadas por PPRV contienen anticuerpos anti-PPRV que desencadenan el ADCC contra las células infectadas. También mostramos que las proteínas de fusión y hemaglutinina codificadas por PPRV pueden ser atacadas por este mecanismo citotóxico. Por lo tanto, ADCC probablemente esté involucrado en el aclaramiento de las células infectadas por PPRV durante la infección. Para confirmar la relevancia del ADCC en la eliminación de PPRV in vivo, sería interesante en futuros trabajos aislar los anticuerpos monoclonales que median en este efecto y determinar si su administración puede proporcionar protección contra el desafío virulento.
Los anticuerpos que median en ADCC tienen el potencial de proteger a través de los serotipos de virus. Esto es sugerido por los estudios de IAV, donde Ab de reacción cruzada puede mediar en la protección (43). La inducción de anticuerpos que median el ADCC también se ha correlacionado con una mejor protección después del desafío de la IAV en pacientes (44). Tales abdominales ampliamente reactivos cruzados podrían expandirse después de los brotes estacionales de IAV y formar la base para la protección parcial observada. En el caso de PPRV, los sueros obtenidos de las ovejas infectadas por PPRV IC’89 podrían mediar con ADCC contra las células diana que expresan las proteínas de fusión y hemaglutinina de la cepa heterogénea PPRV-Nig’75. Por lo tanto, los anticuerpos mediadores de ADCC contra el PPRV podrían contribuir potencialmente a la protección contra varios linajes de PPRV.
Detectamos ADCC contra dos proteínas transmembranas PPRV, pero no para la fosfoproteína intracelular. Hay evidencia limitada de que el ADCC podría atacar los antígenos virales intracelulares. En IAV, la transferencia de Ab no neutralizante que reconoce NP proporciona protección en modelos murinos (45, 46). De hecho, el NP podría expresarse transitoriamente en la superficie celular de las células infectadas por IAV (47) y, por lo tanto, podría ser el objetivo de ADCC. Sin embargo, la evidencia está limitada en cuanto a la relevancia de dicho mecanismo citotóxico durante las infecciones por IAV. Sería interesante en el trabajo futuro evaluar si ADCC puede atacar la nucleoproteína PPRV, ya que los anticuerpos dirigidos contra este abundante antígeno PPRV durante la infección son fácilmente detectables en los sueros animales recuperados.
En conjunto, nuestros datos indican que es poco probable que los sueros inmunes de BTV contengan anticuerpos que median en el ADCC. Por el contrario, los sueros inmunes de PPRV contienen anticuerpos que desencadenan el ADCC contra las células infectadas. Estos anticuerpos se dirigen a la fusión de PPRV y a las proteínas de hemaglutinina. Por lo tanto, ADCC podría contribuir a la eliminación viral en las infecciones por PPRV. Este trabajo destaca los diversos mecanismos efectores inmunes empleados por el huésped para eliminar el PPRV. Aclarar el mecanismo involucrado en la eliminación efectiva del patógeno podría ayudar a diseñar enfoques de vacunación más racionales contra estas enfermedades económicamente importantes.
Declaración ética
Este estudio se llevó a cabo de estricta conformidad con las recomendaciones de las directrices del Código de Métodos y Consideraciones de Bienestar en la Investigación Conductual con Animales (Directiva 86/609EC; RD1201/2005) y se hicieron todos los esfuerzos para minimizar el sufrimiento. Los experimentos fueron aprobados por el Comité de Ética de los Experimentos con Animales (CEEA) (número de permiso: 10/142792.9/12) del Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria (INIA) español y la Comisión de ética estatal de bienestar animal (números de permiso: CBS2012/06 y PROEX 228/14).
Contribuciones del autor
JR, DR-M, MA y VM realizaron los experimentos. JR, DR-M y NS analizaron los datos. JR y NS diseñaron el estudio y escribieron el manuscrito. Todos los autores contribuyeron a la revisión del manuscrito, leyeron y aprobaron la versión presentada.
Financiación
MA fue financiado por una subvención FPI (BES-2013-066406) del Ministerio de Economía y Competitividad español. Este trabajo fue financiado por subvenciones AGL2015-64290R, ADENONET Redes de Excelencia del Ministerio de Economía y Competitividad español; y S2013/ABI-2906-PLATESA de la Comunidad de Madrid y la Unión Europea (Fondo Europeo de Desarrollo Regional, fondos FEDER).
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Agradecimientos
Queremos dar las gracias por la ayuda técnica, Dr. Ana Villa para microscopía confocal y Dr. Esther Morel para citometría de flujo. Los autores desean dar las gracias a todos los miembros del laboratorio New Strategies for the Control of Relevant Pathogens in Animal Health.
Material complementario
El material complementario de este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fimmu.2018.03172/full#supplementary-material
Referencias
1. Van Kaer L. El principal complejo de histocompatibilidad de clase I restringió el procesamiento y la presentación de antígenos. Antígenos tisulares (2002) 60:1–9. doi: 10.1034/j.1399-0039.2002.600101.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
2. Hefferon KL. Los anticuerpos neutralizantes en términos generales y la promesa de vacunas universales: ¿dónde estamos ahora? Inmunoterapia (2014) 6:51–7. doi: 10.2217/imt.13.150
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
3. Pierson TC, Diamond MS. Mecanismos moleculares de la neutralización mediada por anticuerpos de la infección por flavivirus. Expert Rev Mol Med. (2008) 10:e12. doi: 10.1017/S1462399408000665
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
4. Excler JL, Ake J, Robb ML, Kim JH, Plotkin SA. Anticuerpos funcionales no neutralizantes: un nuevo «viejo» paradigma para las vacunas contra el VIH. Vacuna Clínica Inmunoterapia. (2014) 21:1023-36. doi: 10.1128/CVI.00230-14
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
5. Gómez Román VR, Murray JC, Weiner LM. Citotoxicidad celular dependiente de anticuerpos (ADCC) En: Ackerman ME, Nimmerjahn F, editores. Anticuerpo Fc. Boston, MA: Prensa Académica (2014). p. 1–27.
6. Balachandran N, Bacchetti S, Rawls WE. Protección contra el desafío letal de los ratones BALB/c mediante la transferencia pasiva de anticuerpos monoclonales a cinco glicoproteínas del virus del herpes simple tipo 2. Infecta el sistema inmunológico. (1982) 37:1132–7.
7. Jegaskanda S, Reading PC, Kent SJ. Citotoxicidad celular dependiente de anticuerpos específicos de la gripe: hacia una vacuna universal contra la gripe. J Immunol. (2014) 193:469–75. doi: 10.4049/jimmunol.1400432
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
8. Haynes BF, Gilbert PB, McElrath MJ, Zolla-Pazner S, Tomaras GD, Alam SM, et al. Análisis de inmunidad correlacionado de un ensayo de eficacia de la vacuna contra el VIH-1. N Engl J Med. (2012) 366:1275–86. doi: 10.1056/NEJMoa1113425
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
9. Liu Q, Fan C, Li Q, Zhou S, Huang W, Wang L, et al. Los anticuerpos que inducen citotoxicidad celular dependientes de anticuerpos afectan significativamente el tratamiento posterior a la exposición de la infección por el virus del Ébola.Representante de ciencia ficción (2017) 7:45552. doi: 10.1038/srep45552
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
10. Mohl BP, Roy P. Montaje y maduración del cápside del virus de la lengua azul. Virus (2014) 6:3250-70. doi: 10.3390/v6083250
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
11. Organización Mundial de Sanidad Animal (OIE). Lengua azul (infección con lengua azul. En: Manual de pruebas de diagnóstico y vacunas de la OIE para animales terrestres (2014).
12. Schulz C, Breard E, Sailleau C, Jenckel M, Viarouge C, Vitour D, et al. Serotipo 27 del virus de la lengua azul: detección y caracterización de dos nuevas variantes en Córcega, Francia. J Gen Virol. (2016) 97:2073–83. doi: 10.1099/jgv.0.000557
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
13. Sun EC, Huang LP, Xu QY, Wang HX, Xue XM, Lu P, et al. Aparición de un nuevo serotipo del virus de la lengua azul, China 2014. Transbound Emerg Dis. (2016) 63:585–9. doi: 10.1111/tbed.12560
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
14. Savini G, Puggioni G, Meloni G, Marcacci M, Di Domenico M, Rocchigiani AM, et al. Nuevo y suputo virus de la lengua azul en cabras sanas de Cerdeña, Italia. Infecta a Genet Evol. (2017) 51:108-17. doi: 10.1016/j.meegid.2017.03.021
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
15. Marcacci M, Sant S, Mangone I, Goria M, Dondo A, Zoppi S, et al. Uno tras otro: una nueva cepa del virus de la lengua azul relacionada con el virus toggenburg detectada en la región de Piedmont (noroeste de Italia), extiende el panel de nuevas cepas atípicas de BTV. Transbound Emerg Dis. (2018) 65:370–4. doi: 10.1111/tbed.12822
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
16. Martinelle L, Dal Pozzo F, Thys C, De Leeuw I, Van Campe W, De Clercq K, et al. Evaluación de la protección cruzada inducida por una vacuna serotipo 8 contra el virus de la lengua azul (BTV) hacia otros serotipos de BTV en condiciones experimentales. Veterinario Res. (2018) 49:63. doi: 10.1186/s13567-018-0556-4
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
17. Kumar N, Maherchandani S, Kashyap SK, Singh SV, Sharma S, Chaubey KK, et al. Infección por el virus de los pequeños rumiantes de pequeños rumiantes: una revisión completa. Virus (2014) 6:2287–327. doi: 10.3390/v6062287
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
18. Baazizi R, Mahapatra M, Clarke BD, Ait-Oudhia K, Khelef D, Parida S. Peste des petits ruminants (PPR): una enfermedad tropical descuidada en la región del Magreb del Norte de África y su amenaza para Europa. PLoS ONE (2017) 12:e0175461. doi: 10.1371/journal.pone.0175461
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
19. Sevik M, Sait A. Caracterización genética del virus peste des petits ruminants, Turquía, 2009-2013. Res Vet Sci. (2015) 101:187-95. doi: 10.1016/j.rvsc.2015.05.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
20. Donduashvili M, Goginashvili K, Toklikishvili N, Tigilauri T, Gelashvili L, Avaliani L, et al. Identificación del virus peste des petits ruminants, Georgia, 2016. Infectos emergentes Dis. (2018) 24:1576–8. doi: 10.3201/eid2408.170334
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
21. Rojas JM, Sevilla N, Martin V. Inmunosupresión inducida por PPRV en la interfaz de la interacción virus-anfitrión. Br J Virol.(2016) 3:140–60. doi: 10.17582/journal.bjv/2016.3.5.140.160
22. Rojas JM, Moreno H, García A, Ramírez JC, Sevilla N, Martin V. Dos vectores de vacunas adenovirales deficientes de replicación para la inducción de respuestas inmunitarias al PPRV. Vacuna (2014) 32:393-400. doi: 10.1016/j.vaccine.2013.11.033
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
23. Rojas JM, Pena L, Martin V, Sevilla N. Los epítopes de células T ovinas y murinas de la proteína no estructural 1 (NS1) del serotipo 8 del virus de la lengua azul (BTV-8) se comparten entre los serotipos virales. Veterinario Res. (2014) 45:30. doi: 10.1186/1297-9716-45-30
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
24. Rodríguez-Calvo T, Rojas JM, Martin V, Sevilla N. El interferón tipo I limita la capacidad del virus de la lengua azul para infectar precursores hematopoyéticos y células dendríticas in vitro e in vivo. J Virol. (2014) 88:859–67. doi: 10.1128/JVI.02697-13
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
25. Martin V, Pascual E, Avia M, Pena L, Valcarcel F, Sevilla N. La eficacia protectora en ovejas de las vacunas con vectores de adenovirus contra el virus de la lengua azul está asociada con respuestas específicas de las células T. PLoS ONE (2015) 10:e0143273. doi: 10.1371/journal.pone.0143273
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
26. Hathcock KS. Enriquecimiento de células T por no adherencia al nylon. Curr Protoc Immunol. (2001) 30:3.2.1.–4. doi: 10.1002/0471142735.im0302s30
27. Elhmouzi-Younes J, Boysen P, Pende D, Storset AK, Le Vern Y, Laurent F, et al. Los linfocitos sanguíneos ovino CD16+/CD14- presentan todas las principales características de las células asesinas naturales. Veterinario Res. (2010) 41:4. doi: 10.1051/vetres/2009052
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
28. Connelley T, Storset AK, Pemberton A, MacHugh N, Brown J, Lund H, et al. NKp46 define las células ovinas que tienen características correspondientes a las células NK. Veterinario Res. (2011) 42:37. doi: 10.1186/1297-9716-42-37
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
29. Rojas JM, Spada R, Sanz-Ortega L, Morillas L, Mejias R, Mulens-Arias V, et al. La deficiencia de subunidad reguladora beta de PI3K p85 no afecta a la diferenciación de las células NK y aumenta la activación mediada por NKG2D. J Leukoc Biol. (2016) 100:1285–96. doi: 10.1189/jlb.1A1215-541RR
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
30. Rojas JM, Avia M, Pascual E, Sevilla N, Martin V. La vacunación con adenovirus recombinante que expresa las proteínas peste des petits ruminants virus-F o -H provoca respuestas de células T a los epítopos que surjan durante la infección por PPRV. Veterinario Res. (2017) 48:79. doi: 10.1186/s13567-017-0482-x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
31. Mulens-Arias V, Rojas JM, Perez-Yague S, Morales Mdel P, Barber DF. SPION recubierto de polietimina exhibe posibles propiedades antimetastáticas intrínsecas que inhiben la mi gración y la invasión de células tumorales pancreáticas. J Control Release (2015) 216:78–92. doi: 10.1016/j.jconrel.2015.08.009
32. Pawar RM, Dhinakar Raj G, Balachandran C. Relación entre el nivel de ARNm de la molécula de activación de linfocitos de señalización y la replicación del virus Peste-des-petits-ruminants en las células mononucleares de la sangre periférica de los animales anfitriones. Acta Virol. (2008) 52:231–6.
33. Birch J, Juleff N, Heaton MP, Kalbfleisch T, Kijas J, Bailey D. Caracterización de la nectina-4 ovina, un nuevo receptor del virus de los rumiantes de la peste des petits. J Virol. (2013) 87:4756–61. doi: 10.1128/JVI.02792-12
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
34. Harrison MS, Sakaguchi T, Schmitt AP. Montaje y brotación del paraméxicovirus: construcción de partículas que transmiten infecciones. Int J Biochem Cell Biol. (2010) 42:1416-29. doi: 10.1016/j.biocel.2010.04.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
35. Herbert R, Barón J, Batten C, Barón M, Taylor G. El adenovirus recombinante que expresa la hemaglutinina del virus Peste des petits ruminants (PPRV) protege a las cabras contra el desafío con virus patógeno; una vacuna DIVA para PPR.Veterinario Res. (2014) 45:24. doi: 10.1186/1297-9716-45-24
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
36. Rojas JM, Moreno H, Valcarcel F, Pena L, Sevilla N, Martin V. La vacunación con adenovirus recombinantes que expresan las proteínas F o H del virus de los rumiantes peste des petits supera la inmunosupresión viral e induce la inmunidad protectora contra el desafío del PPRV en ovejas. PLoS ONE (2014) 9:e101226. doi: 10.1371/journal.pone.0101226
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
37. Holzer B, Taylor G, Rajko-Nenow P, Hodgson S, Okoth E, Herbert R, et al. Determinación de la dosis mínima totalmente protectora de la vacuna DIVA basada en adenovirus contra el desafío del virus de los rumiantes de la peste des petits en cabras de África Oriental. Veterinario Res. (2016) 47:20. doi: 10.1186/s13567-016-0306-4
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
38. Bonsignori M, Pollara J, Moody MA, Alpert MD, Chen X, Hwang KK, et al. Los anticuerpos que median la citotoxicidad celular dependientes de anticuerpos de un ensayo de eficacia de la vacuna contra el VIH-1 se dirigen a múltiples epítopos y utilizan preferentemente la familia de genes VH1. J Virol. (2012) 86:11521-32. doi: 10.1128/JVI.01023-12
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
39. Jegaskanda S, Weinfurter JT, Friedrich TC, Kent SJ. La citotoxicidad celular dependiente de anticuerpos se asocia con el control de la infección pandémica por el virus de la gripe H1N1 de los macacos. J Virol. (2013) 87:5512–22. doi: 10.1128/JVI.03030-12
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
40. Sun P, Morrison BJ, Beckett CG, Liang Z, Nagabhushana N, Li A, et al. Desgranulación de células NK como marcador para medir la citotoxicidad dependiente de anticuerpos en la neutralización y no neutralización de sueros humanos de pacientes con dengue. J Immunol Methods (2017) 441:24-30. doi: 10.1016/j.jim.2016.11.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
41. Forthal DN, Landucci G, Katz J, Tilles JG. Comparación de anticuerpos específicos del virus del sarampión con citotoxicidad celular dependiente de anticuerpos y funciones neutralizantes. J Infecta a Dis. (1993) 168:1020–3. doi: 10.1093/infdis/168.4.1020
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
42. Beaton AR, Rodriguez J, Reddy YK, Roy P. La proteína de tráfico de membrana calpactina forma un complejo con la proteína del virus de la lengua azul NS3 y media en la liberación del virus. Proc Natl Acad Sci USA. (2002) 99:13154–9. doi: 10.1073/pnas.192432299
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
43. DiLillo DJ, Tan GS, Palese P, Ravetch JV. Los anticuerpos específicos del tallo de la hemaglutinina que neutralizan ampliamente requieren interacciones FcgammaR para la protección contra el virus de la gripe in vivo. Nat Med. (2014) 20:143–51. doi: 10.1038/nm.3443
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
44. Jegaskanda S, Luke C, Hickman HD, Sangster MY, Wieland-Alter WF, McBride JM, et al. Generación y capacidad protectora de la citotoxicidad celular dependiente de anticuerpos específicos del virus de la gripe en humanos provocada por vacunación, infección natural y desafío experimental. J Infecta a Dis. (2016) 214:945–52. doi: 10.1093/infdis/jiw262
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
45. Carragher DM, Kaminski DA, Moquin A, Hartson L, Randall TD. Un nuevo papel de los anticuerpos no neutralizantes contra las nucleoproteínas en la facilitación de la resistencia al virus de la gripe. J Immunol. (2008) 181:4168–76. doi: 10.4049/jimmunol.181.6.4168
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
46. LaMere MW, Lam HT, Moquin A, Haynes L, Lund FE, Randall TD, et al. Contribuciones de la antinucleoproteína IgG a la inmunidad heterosubtípica contra el virus de la gripe. J Immunol. (2011) 186:4331–9. doi: 10.4049/jimmunol.1003057
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
47. Bodewes R, Geelhoed-Mieras MM, Wrammert J, Ahmed R, Wilson PC, Fouchier RA, et al. Evaluación in vitro de la importancia inmunológica de un anticuerpo monoclonal humano dirigido a la nucleoproteína del virus de la gripe.Inmunidad de la vacuna Clin. (2013) 20:1333–7. doi: 10.1128/CVI.00339-13
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Palabras clave: células NK, ADCC, Morbillivirus, virus de la lengua azul, BTV, ovejas, PPRV
Cita: Rojas JM, Rodríguez-Martín D, Avia M, Martín V y Sevilla N (2019) Peste des Petits Ruminants Virus Fusion and Hemagglutininin Proteins Trigger Anticuerpo Mediated Cytotoxicidad Mediada por células dependiente de anticuerpos en células infectadas. Delante. Immunol. 9:3172. doi: 10.3389/fimmu.2018.03172
Recibido: 31 de agosto de 2018; Aceptado: 24 de diciembre de 2018;
Publicado: 14 de enero de 2019.
Editado por:
Fabrizio Ceciliani, Universidad de Milán, Italia
Revisado por:
Jayne Hope, Universidad de Edimburgo, Reino Unido
Sara Louise Cosby, Queen’s University Belfast, Reino Unido
Hinh Ly, Universidad de Minnesota Twin Cities, Estados Unidos
Copyright © 2019 Rojas, Rodríguez-Martín, Avia, Martín y Sevilla. *Correspondencia: Noemí Sevilla, sevilla@inia.es
Descargo de responsabilidad: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamación que pueda ser hecha por su fabricante no está garantizado o respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

 José M. Rojas
José M. Rojas Verónica Martín
Verónica Martín  Noemí Sevilla
Noemí Sevilla