Potencial antibacteriano de cepas comerciales y silvestres de bacterias lácticas aisladas de leche cruda

Potencial antibacteriano de cepas comerciales y silvestres de bacterias lácticas aisladas de leche cruda ovina y caprina contra Mycoplasma agalactiae
 Marion Toquet1,
Marion Toquet1,  Esther Bataller1,
Esther Bataller1,  Jesús Gomis1,
Jesús Gomis1,  Antonio Sánchez2,
Antonio Sánchez2,  Raquel Toledo-Perona1,
Raquel Toledo-Perona1,  Christian De la Fe2,
Christian De la Fe2,  Juan Carlos Corrales2 y
Juan Carlos Corrales2 y  Ángel Gómez-Martín1*
Ángel Gómez-Martín1*- 1Grupo de Investigación Agentes Microbiológicos Asociados a la Reproducción Animal (ProVaginBIO), Departamento Producción y Sanidad Animal, Salud Pública Veterinaria y Ciencia y Tecnología de los Alimentos, Facultad de Veterinaria, Universidad Cardenal Herrera-CEU, Universidades CEU, Valencia, España
- 2Grupo de Investigación en Salud de Rumiantes, Departamento de Sanidad Animal, Facultad de Veterinaria, Universidad de Murcia, Murcia, España
Introducción: La complejidad de la lucha contra la agalactia contagiosa (AC) ha planteado la necesidad de terapias antimicrobianas alternativas, como los probióticos. Las bacterias del ácido láctico (LAB) están presentes en la glándula mamaria de pequeños rumiantes y su efecto antimicrobiano se ha descrito previamente contra especies como Mycoplasma bovis, pero nunca contra Mycoplasma agalactiae (Ma). Este estudio in vitro tiene como objetivo evaluar la actividad antimicrobiana contra Ma de cepas LAB ovinas y caprinas y un probiótico comercial humano (L2) de Lactobacillus spp.
Métodos: Se aislaron un total de 63 posibles cepas de LAB de nueve granjas ovinas y caprinas en España, se seleccionaron tres cepas aisladas (33B, 248D y 120B) de las 63 cepas, en función de su capacidad para crecer en un medio específico in vitro, para un experimento in vitro para evaluar su actividad antimicrobiana contra Ma en leche de cabra procesada (GM) a ultra alta temperatura (UHT). Un probiótico vaginal comercial de las mujeres también se incluyó en el estudio. El inóculo de L2 se preparó a una concentración de 3,24 × 108 UFC/ml y la concentración promedio del inóculo de las BAL silvestres variaron de 7,9 × 107 a 8,4 × 108 UFC/ml.
Resultados: El probiótico comercial L2 redujo significativamente la concentración de Ma a 0.000 log UFC/ml (p < 0.001), la cepa 33B la redujo de 7.185 a 1.279 log UFC/ml (p < 0.001), y 120B de 6.825 a 6.466 log UFC/ml (p < 0.05). La cepa 248D presentó un efecto bacteriostático en GM. Además, las tres cepas silvestres y el probiótico comercial produjeron una reducción significativa del pH (p < 0,001).
Discusión: Este es el primer informe in vivo del potencial antimicrobiano de las cepas de BAL contra Ma y su interacción. Nuestros resultados apoyan posibles estrategias alternativas futuras a la terapia antibiótica, previamente no contempladas, para combatir la AC en pequeños rumiantes. Se necesitan estudios adicionales para dilucidar los mecanismos de acción a través de los cuales estas BAL son capaces de inhibir el Ma y para evaluar la seguridad del uso de estas cepas en posibles estudios in vivo.
1. Introducción
La agalactia contagiosa (AC) es un síndrome infeccioso con un importante impacto socioeconómico en el sector lácteo de pequeños rumiantes debido a los efectos negativos en la producción de leche, el sacrificio prematuro, la disminución de las tasas de crecimiento y los altos costos de las medidas de control. Se caracteriza por una tríada de manifestaciones clínicas: mastitis, artritis y queratoconjuntivitis, pero ocasionalmente puede afectar el tracto reproductivo y respiratorio (1-3). Es un síndrome multietiológico ya que cuatro especies diferentes del género Mycoplasma están involucradas en cabras: Mycoplasma agalactiae (Ma), Mycoplasma mycoides subsp. capri, Mycoplasma capricolum subsp. capricolum y Mycoplasma putrefaciens. El Ma es considerado como el principal agente etiológico que afecta a cabras y ovejas, ya que las otras tres especies de micoplasmas sólo han sido descritas esporádicamente como la causa de la enfermedad en la especie ovina (4, 5).
Hoy en día, la lucha contra la AC se basa en la vacunación y la terapia antibiótica, pero la ausencia de una estrategia satisfactoria causa dificultades para erradicar la AC en las regiones endémicas. En España, se ha puesto en marcha un programa nacional de voluntariado basado en un diagnóstico preciso y el control de la enfermedad (6). Por un lado, la vacunación contra AC tiene su limitación; Si bien las vacunas comerciales pueden reducir los síntomas y la excreción (3), no evitan la eliminación en la leche (7) y, por lo tanto, el estado de portador persiste (8). Se han sugerido diferentes explicaciones para la falta de una vacunación eficiente, como la compleja etiología en cabras, la alta plasticidad del genoma de las cepas circulantes o su capacidad para evadir el sistema inmune (3). En este sentido, el desarrollo de vacunas que puedan prevenir satisfactoriamente la infección en manadas o la entrada en zonas libres de AC no parece ser un logro a corto y medio plazo.
Por otro lado, la terapia antimicrobiana puede mejorar la salud de los animales, pero no elimina el patógeno (8). Se supone que los agentes antimicrobianos pueden reducir la excreción bacteriana y los síntomas clínicos. Sin embargo, el uso de agentes antimicrobianos puede generar resistencias antimicrobianas (RAM), lo que puede comprometer la efectividad de la terapia antimicrobiana (3). De hecho, varios estudios han reportado una reducción en las susceptibilidades a los antibióticos de las especies de micoplasma asociadas con AC en diferentes países (9-16).
En este contexto que rodea el control y la prevención de la AC, ha surgido la necesidad de explorar terapias alternativas, como el uso de probióticos en los últimos años en personas y animales. Los probióticos son microorganismos vivos que, cuando se administran en cantidades adecuadas, confieren un beneficio para la salud del huésped (17). Las bacterias del ácido láctico (BAL) ofrecen varias ventajas como probióticos potenciales y pueden considerarse como alternativas a los antibióticos (18). Son microorganismos seguros capaces de producir diferentes compuestos como bacteriocinas, ácidos orgánicos como ácido láctico, peróxido de hidrógeno, diacetilo y dióxido de carbono que favorecen la inhibición de microorganismos patógenos. Las bacterias del ácido láctico son bacterias Gram-positivas, se pueden encontrar en la microbiota de varias ubicaciones anatómicas como la cavidad oral, la piel, el tracto gastrointestinal y el tracto reproductivo (19-23). Su presencia en la leche cruda de pequeños rumiantes es bien conocida (24), y algunas cepas han sido probadas in vitro por sus posibles características probióticas (25, 26). Hasta donde sabemos, las BAL aisladas en pequeños rumiantes nunca han sido desafiadas contra patógenos pertenecientes a Mycoplasma spp.
En un estudio previo, una primera dosis de un probiótico vaginal comercial para mujeres «L1» fue inoculada intravaginalmente en ovejas con el fin de prevenir la vaginosis producida por el uso de dispositivos intravaginales. Este estudio reportó la capacidad de L1 para reducir la neutrofilia vaginal producida por las esponjas de sincronización del estro sin alterar el estado de salud animal (27). Además, una dosis más alta «L2» de este probiótico comercial se ha probado in vitro contra Mycoplasma bovis (Mb) en semen bovino y moco cervical y mostró actividad antimicrobiana contra el patógeno. Esta actividad antimicrobiana de Lactobacillus spp. se asoció a su capacidad de acidificar el medio (28, 29). En este sentido, la sensibilidad in vitro de Ma al pH ácido se ha reportado en semen diluido de bucks (30). Mycoplasma bovis comparte el 99% de su genoma con Ma (31) y ambos pertenecen al grupo de los homínicos, compartiendo similitudes relevantes de la RAM intrínseca y, por lo tanto, de las medidas de control (32, 33).
El objetivo de este estudio microbiológico fue evaluar el potencial antimicrobiano in vitro de bacterias lácticas, aisladas de leche cruda ovina y caprina, frente a Mycoplasma agalactiae y compararlo con la eficacia de la dosis comercial de probióticos L2. Para lograr este objetivo, se evaluó la viabilidad de Mycoplasma agalactiae y bacterias del ácido láctico, así como las oscilaciones del pH extracelular en leche de cabra comercial y en un medio de cultivo específico de Mycoplasma spp.
2. Materiales y métodos
El diseño del estudio incluyó varios pasos. El primero fue el muestreo de 72 animales de nueve granjas diferentes. El segundo paso consistió en el aislamiento de LAB de la leche cruda de cabra y oveja obtenida en el primer paso y la evaluación de su capacidad de crecimiento in vitro en un medio de cultivo de micoplasma específico. El tercer paso consistió en la caracterización molecular de las cepas seleccionadas. El paso final fue la realización del experimento in vitro para evaluar la actividad antibacteriana de las diferentes BAL frente al Ma. Todos los resultados del experimento in vitro fueron analizados estadísticamente a posteriori. Además, también analizamos la composición LAB de las horas extras L2.
2.1. Descripción y muestreo de los animales
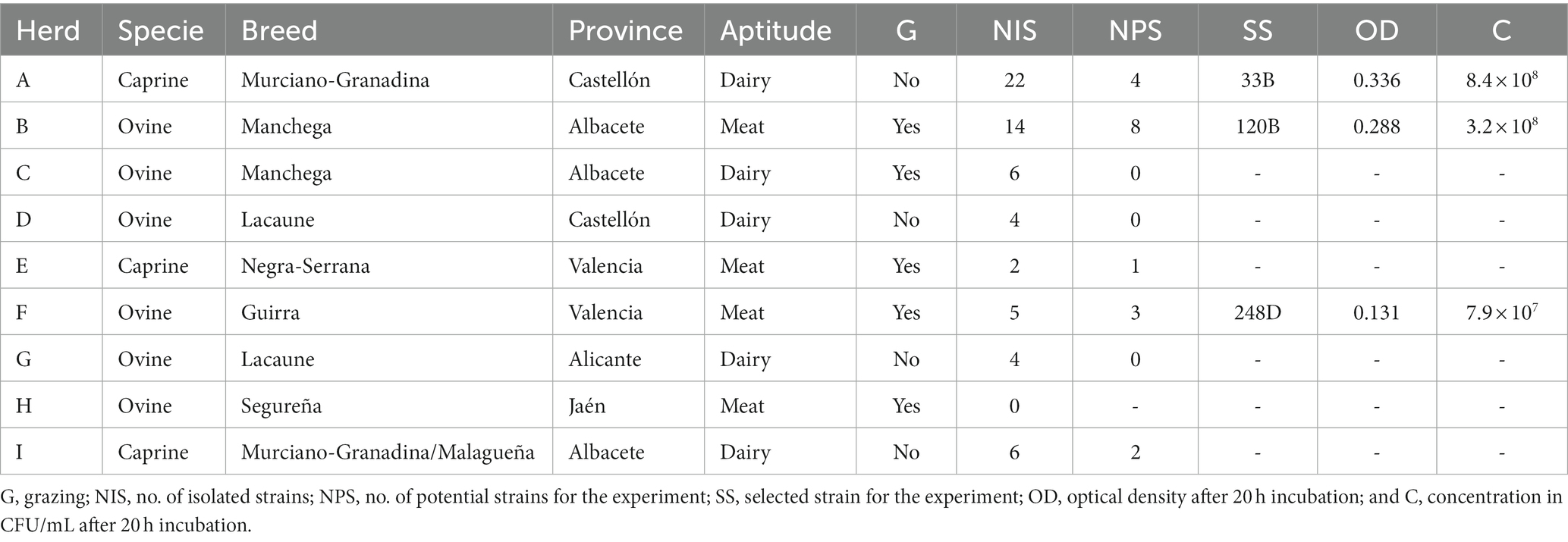
Las posibles cepas LAB utilizadas en este estudio (n = 63) pertenecen a una colección del grupo de investigación ProVaginBIO de la Universidad CEU-Cardenal Herrera en Valencia, España y se aislaron de leche cruda de ovinos (n = 48) y caprinos (n = 24), incluyendo carne y lechería oveja y caprina, de nueve granjas diferentes (seis ovinas; tres caprinas) ubicadas en diferentes regiones de España. Las características de las diferentes manadas muestreadas se pueden ver en la Tabla 1.
Un ganado ovino (rebaño B) sufrió un brote de AC un año antes de que se tomaran las muestras, se observó una reducción en la producción de leche y / o atrofia mamaria en el 18% de los animales. En este mismo rebaño, se aisló una cepa de Ma con un perfil alarmante en las pruebas de sensibilidad a los antibióticos. Por esta razón, no se utilizó terapia antimicrobiana. Otro rebaño (rebaño I) manifestó un brote clínico durante el muestreo caracterizado por mastitis clínica, baja producción de leche y artritis en niños. En este caso, se estaba utilizando un tratamiento con tetraciclinas en animales que mostraban signos clínicos. El uso de antibióticos en los otros rebaños fue anecdótico.
Antes de la recolección de muestras, se realizó un examen físico de la ubre a través de observación externa y palpación para descartar la presencia de mastitis clínica. También se realizó una prueba de mastitis de California (KerbaTEST, KERBL) antes de recolectar muestras de leche para garantizar que los animales no se vieran afectados por la mastitis subclínica. A posteriori, todas las muestras de leche se inocularon en un medio específico modificado para el crecimiento de micoplasmas (34), agar Columbia con 5% de sangre ovina (BD) y agar MacConkey (BD)™™ (27) para descartar la presencia de mastitis.
2.2. Aislamiento y selección de bacterias lácticas
El aislamiento de LAB se llevó a cabo mediante la inoculación de las muestras de leche cruda ovina y caprina en agar Man, Rogosa y Shape (MRS) (Scharlau) (35), y las colonias de LAB se caracterizaron macroscópicamente dependiendo de su morfología y se congelaron a −80°C en criotubos con 500 μL de MRS líquido y 500 μL de glicerol al 50%.
Las 63 cepas aisladas fueron probadas para su crecimiento en el medio PH. Cada cepa se activó en placas de agar MRS, y una colonia se incubó en 4 mL de medio de pH líquido a 37°C durante 20 h a 150 rpm. Las diluciones se realizaron con solución salina tampón fosfato y cuatro diluciones diferentes se colocaron en agar MRS. La densidad óptica (OD) también se midió a 600 nm. Cepas con DO inferior a 0,100 y con una concentración inferior a 107 Se descartaron UFC/ml para asegurar un rendimiento de escalado efectivo para una posible producción industrial de la cepa seleccionada. Un total de 18 cepas cumplieron los criterios de selección y cuatro cepas, cada una de ellas de un tipo diferente de producción animal (cabra lechera, cabra de carne, oveja lechera y oveja de carne), con la concentración más alta (UFC/ml) después de 20 h de incubación y una cepa adicional aislada del rebaño I, que tenía un brote de AC en curso en el momento del muestreo, fueron seleccionados para la caracterización molecular previa al experimento in vitro. Las tres últimas BAL seleccionadas para ser probadas in vitro contra Ma se pueden encontrar en la Tabla 1.
2.3. Caracterización molecular e identificación bacteriana de cepas silvestres de BAL
Las cepas seleccionadas fueron caracterizadas, antes del experimento in vitro. Se procesaron para la extracción de ADN genómico y se identificaron en base a la amplificación por PCR y secuenciación del gen 16S rRNA utilizando cebadores universales bacterianos (27F 5′-AGAGTTTGATCC TGGCTCAG y 1492R 5′-GGTT ACCTTGTTA CGACTT). La PCR se realizó siguiendo la metodología descrita anteriormente (21). Los productos de PCR fueron purificados, y secuenciados y analizados para la homología de secuencia por BLAST.1 Las secuencias fueron corregidas y alineadas por ClustalW con el Análisis de Genética Evolutiva Molecular (MEGA) 7. La identificación bacteriana se llevó a cabo comparando la secuencia del problema con la base de datos GenBank a través de la aplicación Blast.
2.4. Diseño del experimento in vitro
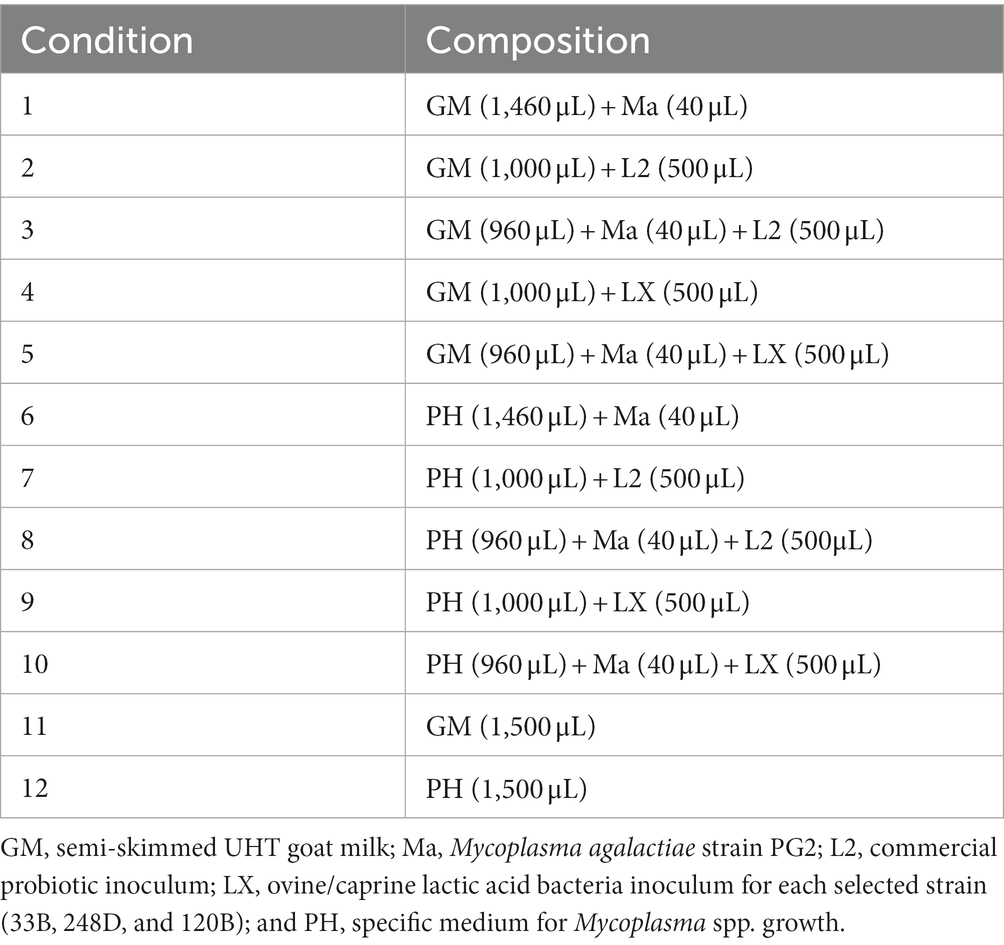
Se prepararon diez condiciones experimentales (Tabla 2) en tubos tipo Eppendorf de 1,5 mL de capacidad siguiendo una adaptación de un protocolo previo (28, 29). Se incluyeron como controles negativos un undécimo (C11) y un duodécimo (C12) microtubos. Cada cepa LAB silvestre (LX) se probó en tres réplicas independientes de las condiciones experimentales. Las condiciones se incubaron durante 15 h.
2.4.1. Preparación del inóculo Mycoplasma agalactiae
El inóculo Ma se preparó utilizando la cepa de referencia (PG2, NCTC10123) en medio PH con ampicilina y siguiendo el protocolo descrito anteriormente (28, 29). El cultivo se incubó a 37°C durante 48 h, luego se realizó un subcultivo e incubó 48 h a 37°C nuevamente para obtener nuestro inóculo con una concentración aproximada de 1 × 107-8UFC/ml, basado en inoculaciones previas y la dosis infectiva de Ma (30), y calculado como se describió anteriormente (36).
2.4.2. Preparación del inóculo láctico ovino o caprino silvestre
El inóculo LAB (LX) ovino/caprino consistió en el cultivo de una sola colonia de cada una de las cepas LAB seleccionadas, previamente aisladas de leche cruda, en 4 mL de medio PH sin antibióticos añadidos a 37°C durante 20 h. Los tubos se centrifugaron a 4.000 rpm durante 15 min. El sobrenadante fue descartado y el precipitado se reconstituyó en microtubos de 1,5 mL con 500 μL de medio PH sin antibióticos. La concentración media del inóculo LX varió de 7,9 × 107 a 8,4 × 108 UFC/ml.
2.4.3. Preparación del inóculo L2
El inóculo del probiótico comercial (L2) se preparó a una concentración de 3,24 × 108 UFC/ml como se describió anteriormente (28, 29). Una cápsula de un probiótico comercial basado en una mezcla de Lactobacillus crispatus, Lactobacillus gasseri, y Lactobacillus brevis (NS Femibiotic®, Cinfa) se reconstituyó en medio de PH.
2.4.4. Determinación de la viabilidad de Mycoplasma agalactiae y bacterias lácticas
Las concentraciones (UFC/ml) de Ma y BAL se determinaron después de 15 min (T0) y 15 h (T15). La viabilidad de Ma se determinó con un protocolo de diluciones seriadas previamente descrito (36) utilizando caldo de PH suplementado con ampicilina para diluciones seriadas y agar PH suplementado con ampicilina para recuentos bacterianos (34). La viabilidad de LAB se determinó en placas de agar MRS, con diluciones también realizadas en caldo de pH. Cada dilución fue chapada por duplicado.
2.4.5. Medición del pH
El pH de cada condición se midió con un medidor de pH calibrado (SensION™ + pH3, Hach, LPV2000.98.0002) en T0 y T15. El electrodo se desinfectó con detergente, alcohol y agua destilada estéril entre la medición de cada condición para evitar la contaminación.
2.5. Análisis estadístico del pH, bacterias del ácido láctico y viabilidad de Mycoplasma agalactiae
Los recuentos de Ma y LAB se transformaron como log (1 + C), donde C fue el recuento obtenido (UFC/ml) para cada condición analítica y organismo. El análisis estadístico se realizó utilizando un procedimiento lineal general implementado en el programa Statistical Analysis System Institute (SAS), siguiendo el modelo: YIJK = μ + SYo + Cj + Tk + TCjk + eIJK, donde YIJK = pH y log UFC/ml de Ma y log UFC/ml de BAL en cada cepa estudiada (33B, 120B y 248D); μ = media; SYo = efecto muestral; Cj = efecto de las condiciones analíticas; Tk = efecto del tiempo; CTjk = efecto de la interacción entre la condición analítica y el tiempo; y eIJK = efecto residual.
2.6. Composición microbiana de L2 en T0 y T15
Se utilizó un enfoque basado en marcadores utilizando el gen de la subunidad de ARN ribosómico 16S (16SrRNA) para confirmar el Lactobacillus spp. presente en L2 y para estudiar su fluctuación en la condición 2 (C2) en T0 y T15, la condición 3 (C3) en T0 y T15, la condición 7 (C7) en T0 y T15, y la condición 8 (C8) en T0 y T15.
La composición y estructura de las comunidades microbianas muestreadas se evaluó mediante la amplificación y secuenciación de las regiones variables V3-V4 del gen 16S rRNA. Se utilizó el enfoque de secuenciación Illumina Miseq 300 × 2. La amplificación se realizó después de 25 ciclos de PCR. Se incluyó un control negativo de la extracción de ADN, así como un control positivo de Mock Community para garantizar el control de calidad. Las lecturas sin procesar demultiplexadas hacia adelante y hacia atrás se procesaron como se muestra en la siguiente Tabla 3 utilizando QIIME2 (40).
La asignación taxonómica de filotipos se realizó utilizando un clasificador bayesiano entrenado con la base de datos Silva versión 138 (99% de secuencias completas OTU) (41).
3. Resultados
3.1. Identificación de cepas de bacterias lácticas silvestres
Con base en las secuencias obtenidas, la cepa 33B se identificó como Enterococcus mundtii (OQ538168), cepa 120B como Enterococcus hirae (OQ538169) y cepa 248D como Enterococcus hirae (OQ538170), y el número de presentación de GenBank fue SUB12912028. Las otras dos cepas que fueron seleccionadas para la caracterización molecular fueron identificadas como Staphylococcus aureus subsp. aureus y, por lo tanto, no se incluyeron en el experimento in vitro.
3.2. Controles negativos del experimento in vitro
Las condiciones C11 (GM) y C12 (PH) siempre resultaron negativas en las placas de agar de sangre de oveja, las placas de agar MRS y las placas de agar PH en T0 y T15. El pH promedio de C11 en T0 y T15 varió de 6.61 a 6.69, respectivamente, y el pH promedio de C12 en T0 y T15 varió de 7.51 y 7.68.
3.3. Efectos sobre la viabilidad y el pH de las bacterias Mycoplasma agalactiae y del ácido láctico
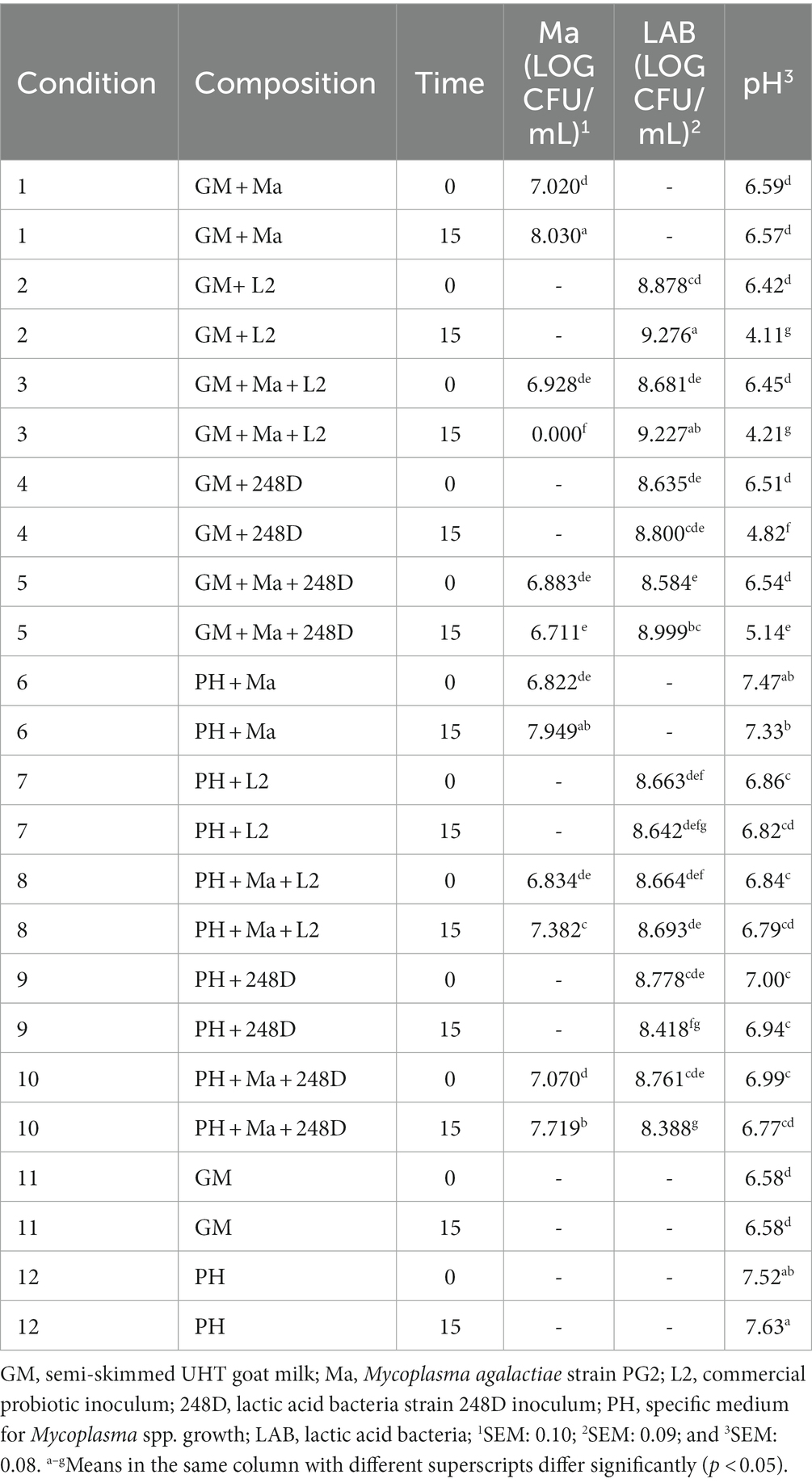
En el modelo propuesto in vitro, y para cada cepa de BAL estudiada, la condición misma, el tiempo y la interacción entre condición y tiempo tuvieron un efecto significativo (p < 0,001) sobre el pH y el log UFC/mL de Ma. La condición del factor contribuyó significativamente a la variación logarítmica CFU/ml observada de las BAL en todos los estudios de deformación de las BAL en todos los estudios de deformación de las BAL y mientras que los factores tiempo y la interacción entre la condición y el tiempo contribuyeron significativamente para la cepa 33B y 120B de la LAB, y para la 248D, respectivamente.
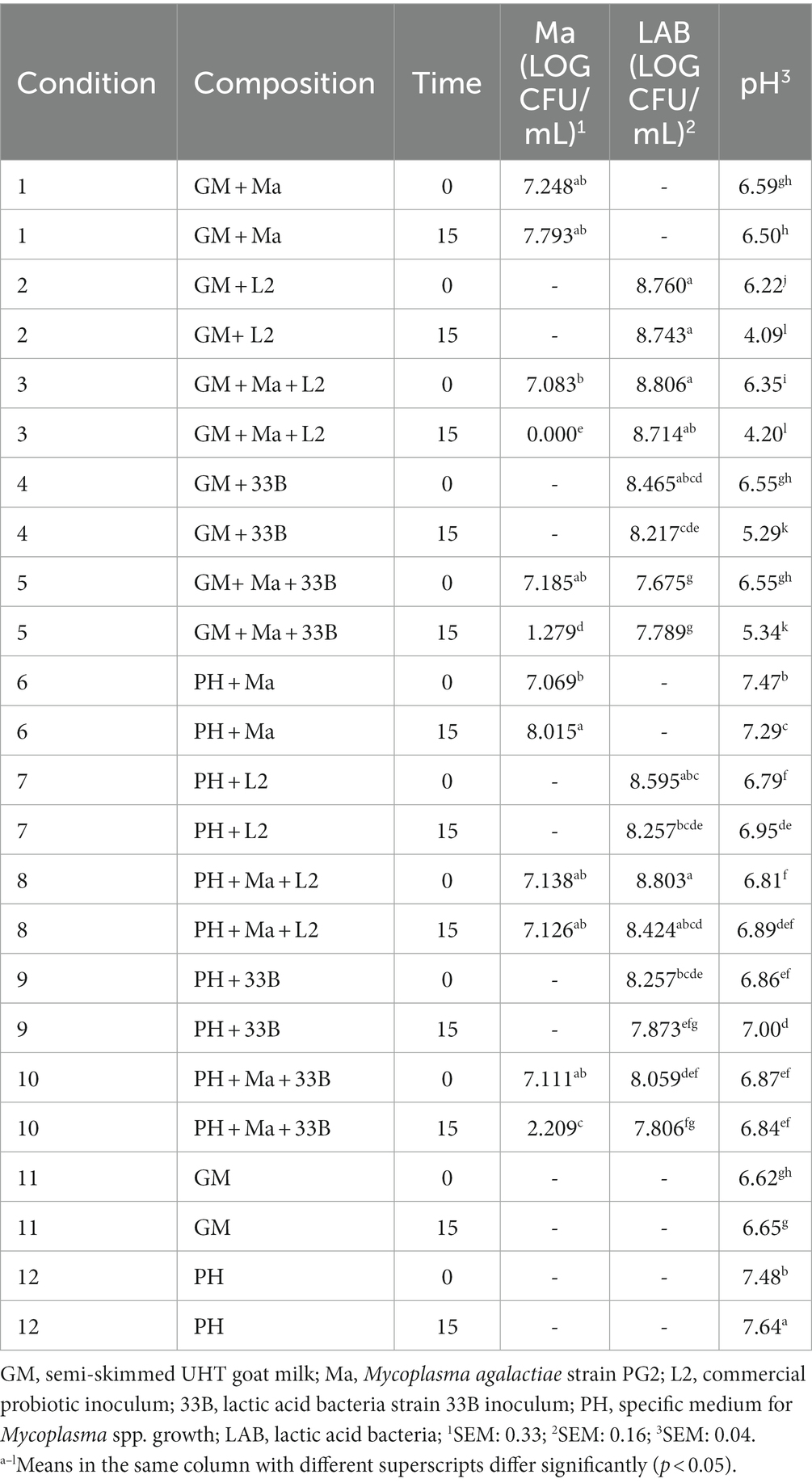
3.3.1. Cepa 33B
La Tabla 4 detalla la evolución del pH y la viabilidad de Ma y LAB a lo largo del tiempo para el experimento con la cepa 33B. En condiciones favorables, condición 1 (C1) y condición 6 (C6), la concentración de Ma aumentó significativamente, y el pH mostró valores estables entre T0 y T15. La cepa 33B produjo una disminución estadísticamente significativa de la concentración de Ma en GM [condición 5 (C5)] y medio de pH [condición 10 (C10)]. El pH disminuyó significativamente (p < 0,001) en GM en presencia de la cepa 33B [condición 4 (C4) y C5] entre T0 y T15, pero no lo hizo en el medio de pH [condición 9 (C9) y C10] aunque fue estadísticamente significativamente menor en C9-C10 en comparación con C12. No se observaron diferencias entre T0 y T15 para la concentración de LAB.
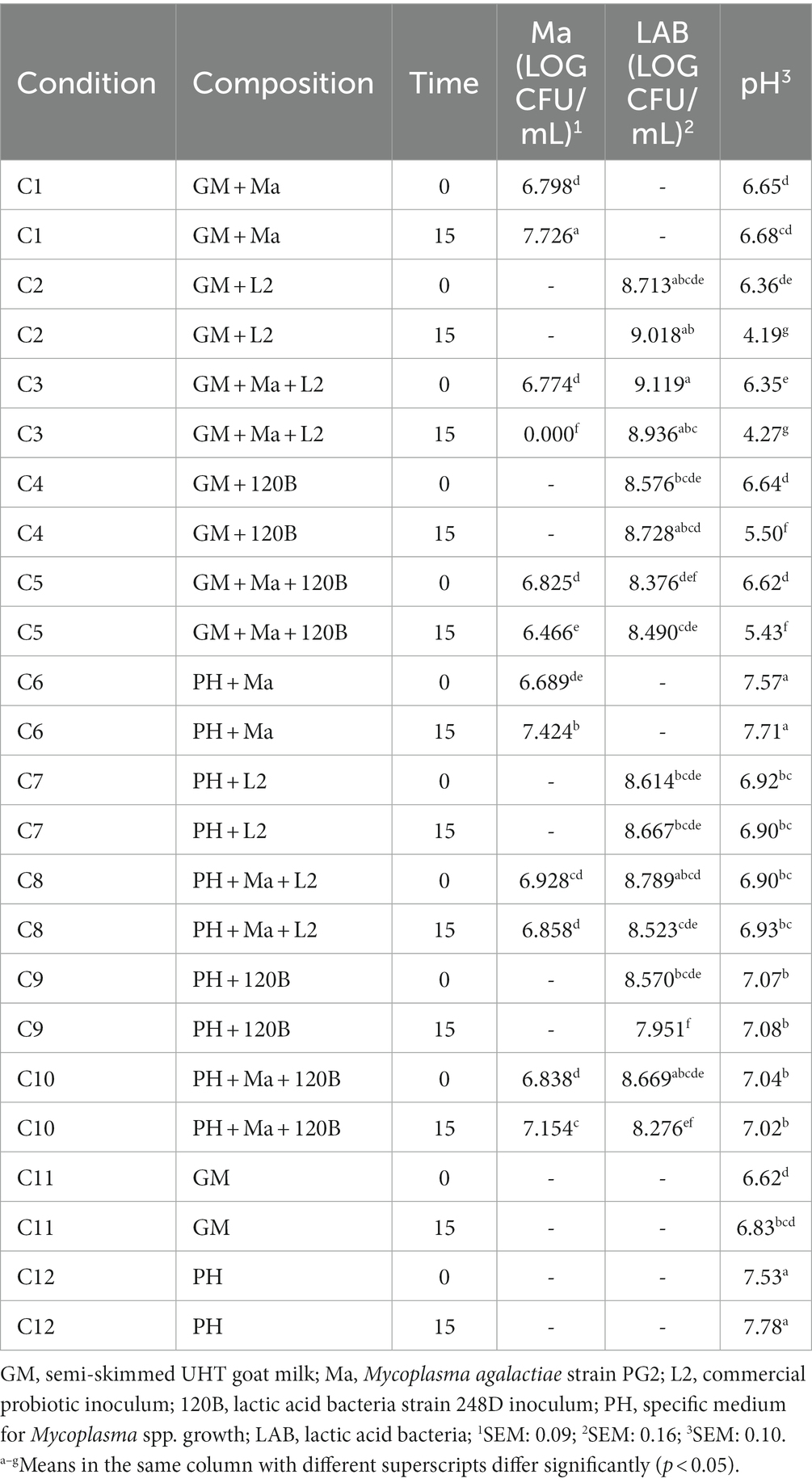
3.3.2. Cepa 248D
La Tabla 5 detalla la evolución del pH y la viabilidad de Ma y LAB a lo largo del tiempo para el experimento con la cepa 248D. En condiciones favorables (C1 y C6), la concentración de Ma aumentó significativamente y el pH mostró valores estables entre T0 y T15. La concentración de la cepa LAB 248D aumentó significativamente con la presencia de Ma en GM (C5). Aunque no redujo la concentración de Ma en GM (C5), fue capaz de prevenir la proliferación de Ma entre T0 y T15 ya que la concentración de Ma no aumentó en C5 y fue significativamente menor que C1 en T15. La cepa 248D también fue capaz de disminuir significativamente el pH con el tiempo en GM (C4-5), aunque sin la presencia de Ma (C4) el pH fue significativamente menor en T15 en comparación con C5. Por otro lado, en el medio PH la concentración de LAB 248D disminuyó significativamente en T15 (C9-10) y Ma aumentó significativamente en T15 con la presencia de la cepa 248D (C10). El pH del medio de PH fue estable en el tiempo, aunque las condiciones con LAB (C7-10) tuvieron un pH significativamente menor en comparación con C6 y C12.
3.3.3. Cepa 120B
La Tabla 6 detalla la evolución del pH y la viabilidad de Ma y LAB a lo largo del tiempo para el experimento con la cepa 120B. En condiciones favorables (C1 y C6), la concentración de Ma aumentó significativamente y el pH mostró valores estables entre T0 y T15. En presencia de la cepa 120B, se puede observar una disminución significativa en la concentración de Ma entre T0 y T15 en GM, asociada con una reducción significativa del pH (C5). Este no fue el caso en el medio PH (C10), donde la concentración de Ma aumentó significativamente en T15 asociada con una estabilidad en la concentración de LAB y el pH.
3.3.4. Probiótico comercial (L2)
El inóculo comercial L2 fue capaz de inhibir completamente el Ma en GM ya que no se observaron colonias en T15 en ninguna de las tres réplicas de las tres cepas silvestres de LAB (C3 en las Tablas 4-6). La concentración de LAB fue similar en T0 y T15 en todos los experimentos, excepto para la cepa 248D (C2-3, Tabla 5) donde se observó un aumento significativo de la concentración de LAB en T15 en GM. El pH en GM se redujo significativamente en todos los experimentos (C2-C3, Tablas 4-6) cuando se agregó L2. No se observó reducción del pH entre T0 y T15 en condiciones de pH medio (C7-8 en las Tablas 4-6), donde L2 está presente. Sin embargo, hubo una diferencia significativa entre el pH del pH medio sin BAL (C6 y C12) y C7 y C8 en T0 (Tablas 4-6).
3.4. Composición de L2 por condición y tiempo de las bacterias del ácido láctico
El análisis metagenómico (Figura 1) reveló que las tres especies de BAL en condiciones que contienen L2 (C2-C3 y C7-C8) fueron Lactobacillus crispatus, Lactobacillus gasseri y Lactobacillus brevis, según lo descrito por el fabricante, tanto en T0 como en T15. Lactobacillus crispatus fue siempre la especie de BAL más abundante en todas las condiciones mencionadas en T0 y T15, aunque su abundancia relativa (AR) disminuyó en T15 en todas las condiciones, con una AR > 50% excepto en T15 en GM con presencia de Ma (C3). Lactobacillus gasseri fue la segunda más abundante de las tres especies en ambos momentos, excepto en T15 en C3. La AR de L. gasseri en T15 se mantuvo similar en GM (C2-C3) pero aumentó en medio PH (C7-C8). Finalmente, L. brevis fue siempre la especie menos abundante, excepto en C3 en T15 donde fue más abundante que L. gasseri. Su AR aumentó en T15 en todas las condiciones, excepto en C8.
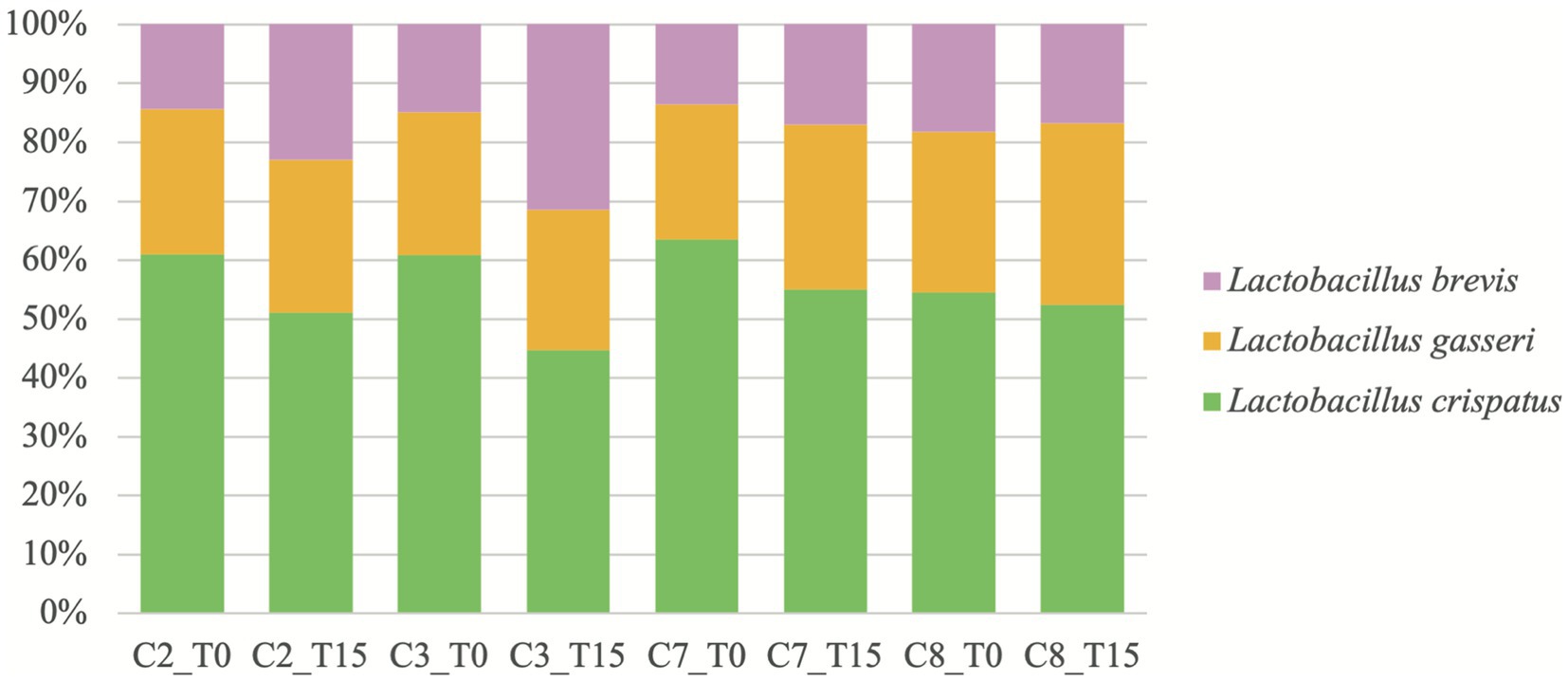 Figura 1. Abundancias relativas, reportadas como porcentajes, de Lactobacillus spp. a lo largo del tiempo en condiciones donde L2 está presente. C2: condición 2 con leche de cabra y L2; C3: condición 3 con leche de cabra, Mycoplasma agalactiae PG2 y L2; C7: condición 7 con medio PH y L2; C8: condición 8 con medio de PH, Mycoplasma agalactiae PG2 y L2; T0: después de 15 min de incubación; y T15: después de 15 h de incubación.
Figura 1. Abundancias relativas, reportadas como porcentajes, de Lactobacillus spp. a lo largo del tiempo en condiciones donde L2 está presente. C2: condición 2 con leche de cabra y L2; C3: condición 3 con leche de cabra, Mycoplasma agalactiae PG2 y L2; C7: condición 7 con medio PH y L2; C8: condición 8 con medio de PH, Mycoplasma agalactiae PG2 y L2; T0: después de 15 min de incubación; y T15: después de 15 h de incubación.
4.Discusión
El presente estudio in vitro informa del efecto antimicrobiano contra Ma de una selección de aislados de LAB silvestres de la leche de ovejas y cabras sanas. Estas cepas se aislaron en rebaños localizados en la península (Tabla 1), área donde los agentes etiológicos asociados a AC se han aislado con frecuencia en especies ovinas y caprinas (4, 42). El control y la prevención de la agalactia contagiosa representan un desafío debido a varios factores: presencia de portadores asintomáticos, movimiento incontrolado de animales, variabilidad en etiología y antigenicidad, las limitaciones de las vacunas disponibles comercialmente y el aumento de la RAM de micoplasmas asociados con AC (1-3, 10). Nuestros resultados sugieren que el probiótico comercial utilizado en este estudio, basado en una combinación de Lactobacillus spp., o LAB silvestre de origen ovino y caprino, podría tener el potencial de ser utilizado como antimicrobianos para el control o la prevención de la mastitis causada por Ma.
Nuestro trabajo evidencia que es necesario un número importante de aislamientos bacterianos en varias parvadas para obtener cepas de LAB capaces de crecer en un medio de cultivo que permitan sus ensayos in vitro y demuestren un posible uso comercial (Tabla 1). Las tres cepas silvestres de LAB involucradas en los experimentos in vitro fueron capaces de inhibir el crecimiento de Ma en GM. La cepa 248D tuvo un efecto bacteriostático ya que no disminuyó significativamente el número de Ma en T15, pero sí impidió su facilidad para replicarse y aumentó su concentración en GM a 37 ° C (Tabla 5, C5 y C1). Las cepas 33B y 120B fueron capaces de reducir significativamente la concentración de Ma en T15 en GM (Tablas 4, 6; C5) aunque la inhibición por 33B fue significativamente mayor que la inhibición producida por 120B (p < 0,001).
La reducción del pH es una característica importante de las BAL ya que puede inhibir el crecimiento de bacterias patógenas (43). Se ha sugerido que la acidificación del medio inhibe Ma y M. mycoides subsp. capri. en semen diluido de ciervos, ya que estas especies son sensibles a los cambios de pH (30). Por lo tanto, una de las causas de la inhibición producida por estas BAL puede ser la caída en el pH de los GM que producen, que no ocurre cuando el GM solo lleva Ma y, por lo tanto, el patógeno aumenta su concentración (C1). Todas las cepas silvestres ovinas y caprinas probadas en los experimentos in vitro fueron capaces de acidificar el modificado genéticamente (Tablas 4-6; C4) ya que hubo una diferencia significativa entre el pH GM de T0 y T15.
Sin embargo, la cepa 33B, identificada como E. mundtii, fue capaz de inhibir Ma en medio PH (Tabla 4, C10) con un pH cercano al neutro y, por lo tanto, podría mostrar una mejor capacidad antimicrobiana que L2 (Tablas 5, 6, C8) en ambientes donde el pH es neutro y la acidificación del medio no es posible. Esto sugiere que la acidificación del pH puede no ser el único efecto antimicrobiano de las BAL contra el Ma y que se deben buscar otros mecanismos antimicrobianos.
Las bacterias probióticas tienen varios mecanismos de acción para inhibir las bacterias patógenas in vivo: compitiendo por nutrientes, evitando la adhesión de los patógenos, produciendo sustancias inhibidoras, modulando la respuesta inmune del huésped y reduciendo la biodisponibilidad de las toxinas (18). Es poco probable que LAB y Ma compitan por los mismos nutrientes dado que LAB usa glucosa para producir ácido láctico (44) y Ma no puede fermentar glucosa a diferencia de otras especies como M. mycoides subsp. capri, M. capricolum subsp. capricolum y M. putrefasciens (30). Por lo tanto, proponemos la hipótesis de que estas bacterias podrían tener un mayor efecto inhibitorio contra las especies de micoplasmas fermentadores de azúcar. En el caso del Ma, la producción de sustancias inhibidoras in vitro podría ser uno de los mecanismos antimicrobianos utilizados por las BAL además del efecto nocivo producido por la acidificación del pH extracelular, dado que la inhibición en medio PH (Tabla 4, C10) se produjo sin una acidificación del medio para la cepa 33B.
Una de las sustancias inhibidoras producidas por las BAL son las bacteriocinas, y la leche cruda puede considerarse como una fuente de cepas de BAL con potencial bacteriogénico (45, 46). La cepa CRL 1656 de E. mundtii aislada de la leche de vaca ha sido reportada como cepa productora de bacteriocina y mostró una actividad bacteriocigénica contra el patógeno Listeria monocytogenes Scott A y L. innocua 7. Esta cepa también es capaz de producir una buena cantidad de peróxido de hidrógeno, otra sustancia inhibidora producida por LAB. Se ha recomendado su uso como probiótico en vacas (46). Otra cepa, E. mundtii EM ML2/2, aislada de leche cruda de cabra, produjo una sustancia bacteriocina y mostró una actividad óptima a pH 6.3 (47).
Las otras dos cepas de LAB, ambas aisladas de ovejas de carne, con un potencial bacteriostático (248D) y bactericida (120B) se identificaron como Enterococcus hirae. Estos resultados demuestran que se pueden observar diferentes efectos antimicrobianos contra Ma para diferentes cepas de la misma especie LAB. Otras cepas de E. hirae ST57ACC y DF105Mi han mostrado actividad antimicrobiana contra L. monocytogenes mediante la producción de bacteriocinas capaces de resistir el procesamiento de alimentos (25, 45). Una cepa aislada de GM también fue capaz de modular la microbiota intestinal en perros y no presentó ningún gen de virulencia (43).
En cuanto a la evaluación del probiótico comercial, la adición de L2 en GM (C3) mostró una actividad bactericida significativamente mayor (p < 0,001) contra Ma que la observada con la cepa 33B y 120B en GM (Tablas 4, 6; C2-C5). Esto también podría estar relacionado con la disminución significativa del pH observada en todos los experimentos. De hecho, L2 redujo significativamente el pH del GM por debajo de cinco, cuando con Ma (Tablas 4-6, C3), mientras que las cepas 33B, 120B o incluso 248D redujeron el pH a valores entre 5.14 y 5.43 (Tablas 4-6, C5). En estudios previos, se evaluó in vitro un inóculo similar contra Mb en semen diluido bovino y moco cervical de bovinos, y también se observó una reducción significativa en el pH (28, 29). De acuerdo con estos estudios, nuestros resultados mostraron que L2 también puede crecer y acidificar el medio extracelular en GM incluso cuando está contaminado por Ma y podría ser una herramienta utilizada como una estrategia antimicrobiana como se ha sugerido (30). Sin embargo, como se mencionó anteriormente, otras posibles influencias, como la competencia por nutrientes o la posible presencia de péptidos bioactivos, no deben descartarse como un mecanismo antimicrobiano de las BAL (18).
Estos datos con respecto a L2 podrían mostrar un posible aumento en el potencial antimicrobiano contra Ma cuando varias especies de Lactobacillus spp. se utilizan juntas como probióticos en GM. En este sentido, la combinación de varias cepas de LAB suele emplearse en probióticos comerciales debido a su sinergia que aumenta su actividad biológica (48). La composición exacta de este inóculo o uno de composición similar no había sido evaluada en estudios previos (28, 29). En el presente estudio, el análisis metagenómico de las condiciones con L2 evidenció por primera vez, la composición real de este inóculo desarrollado a partir de un probiótico comercial para uso humano. Los resultados mostraron que, efectivamente, tres especies de Lactobacillus spp. son inoculadas con nuestro protocolo (Figura 1). Nuestro estudio metagenómico de la dinámica de las tres especies de Lactobacillus spp. de L2 mostró que L. brevis aumentó su concentración en detrimento de L. crispatus en GM contaminado con Ma o no, mientras que L. gasseri tenía una AR constante a lo largo del tiempo. Esto proporciona una primera aproximación de la dinámica de estas especies de lactobacilos en dos medios diferentes y el posible papel de L. brevis en la inhibición de Ma en GM. Esta especie ha sido aislada en leche cruda de cabra (49) y parece tener un efecto antimicrobiano contra varios patógenos como Bacillus cereus (50), Escherichia coli, S. aureus, Klebsiella pneumoniae y Pseudomonas aeruginosa (51). Sin embargo, se informó que L. brevis no pudo acidificar la leche durante una fermentación de 20,5 h a 37 ° C (50) y, por lo tanto, no pudo ser responsable del pH significativamente más bajo observado en T15 en GM (C2-C3) y utilizar diferentes mecanismos para inhibir patógenos. Lactobacillus gasseri también se ha aislado en leche cruda caprina (52, 53) y parece ser un componente principal de la flora vaginal humana, así como L. crispastus (54), aunque el último nunca se ha aislado en leche hasta donde sabemos.
En general, este trabajo sugiere el potencial antimicrobiano de las BAL contra el Ma en condiciones in vitro, un patógeno importante de la glándula mamaria de los pequeños rumiantes. Previamente se sugirió la necesidad de explorar posibles aplicaciones de LAB, presente en la microbiota de la glándula mamaria, como estrategia de control y prevención contra la mastitis de pequeños rumiantes (24). Diferentes estudios han demostrado el efecto positivo de las BAL y sus metabolitos en el bienestar de los animales de granja. Se ha demostrado que el uso de probióticos basados en BAL reduce la aparición de patógenos en granjas a gran escala (55). Los resultados del presente estudio in vitro sugerirían la necesidad de inocular, in vivo en modelos caprinos y ovinos, las cepas identificadas en este estudio con potencial antimicrobiano contra Ma. En este sentido, un estudio preliminar desarrolló un método de inoculación intravaginal en ovejas, con dosis inferiores a L2 del probiótico comercial utilizado en este estudio, que mostró los primeros signos de efectos antiinflamatorios y no tuvo efectos perjudiciales para la salud de los animales (27).
Por otro lado, desde un punto de vista epidemiológico, nuestros resultados muestran que las BAL con un efecto negativo contra Ma pueden estar presentes de forma natural en la glándula mamaria de ovejas (248D, 120B) y cabras (33B) de regiones endémicas de AC (Tabla 1). En los tres rebaños donde se aislaron las cepas con potencial antimicrobiano, el uso de antibióticos fue anecdótico. Los rebaños donde se aislaron 33B y 248D no tuvieron ningún brote de AC, al menos en la última década, aunque manifestaron síntomas compatibles con AC en el pasado. Por el contrario, la parvada ovina donde se aisló 120B, tenía una historia clínica de AC un año antes de que se realizara este estudio. Se sabe que después de un brote clínico de AC, los rebaños afectados generalmente se infectan crónicamente. Esto normalmente se atribuye a un equilibrio creado entre el huésped y el patógeno, dependiendo del estado inmunológico de la manada. Además, se acepta que la infección generalmente no se elimina después del uso de antibióticos y vacunas (2, 56, 57). Nuestros resultados muestran la existencia de BAL con potencial antimicrobiano frente al Ma en un rebaño infectado crónicamente por AC (cepa 120B, Rebaño B, Tabla 1). Curiosamente, aproximadamente un año después de este aislamiento, se observó un nuevo episodio de disminución de la producción de leche en este rebaño en animales donde Ma fue aislado nuevamente pero no se aisló BAL. Por lo tanto, el aislamiento de LAB nunca coincidió con el de Ma y viceversa. En el rebaño que tenía un brote clínico de AC en el momento de este estudio (Tabla 1, rebaño I), tampoco se aislaron BAC. Sugerimos la hipótesis de que este tipo de población bacteriana (BAL) podría contribuir al mantenimiento del estado asintomático aparente de un alto número de animales en parvadas infectadas. Además, debemos considerar que las especies patógenas de Mycoplasma en rumiantes como las asociadas a AC (3, 58, 59), en animales asintomáticos, generalmente se encuentran en ubicaciones anatómicas como líquido articular, ganglios linfáticos, cerebro o canal auditivo externo, perpetuando la infección en los rebaños. Proponemos que con esta estrategia los patógenos no solo intenten evitar el sistema inmune y la terapia antimicrobiana (1, 2) sino también la cohabitación con grupos bacterianos con potencial antimicrobiano como el LAB. De hecho, estas poblaciones de BAL se pueden encontrar en la microbiota del epitelio de los tractos respiratorio, mamario y reproductivo (23, 24, 60), que son ubicaciones anatómicas que están colonizadas por micoplasma asociado con AC y vinculadas a la ruta de excreción (34). En este sentido, en un estudio previo con Salmonella sp., el aislamiento de LAB fue menos importante en perros que fueron positivos a este patógeno (21). En base a esta hipótesis, el uso de antibióticos podría dañar la barrera natural, que representan las BAL con capacidad antimicrobiana, en lugares como la glándula mamaria de pequeños rumiantes. Los resultados reportados aquí podrían ser la primera indicación de una interacción infravalorada de LAB con otros agentes microbianos, como el Ma, y sugieren la necesidad de llevar a cabo nuevos estudios sobre la ecología bacteriana en animales infectados con AC.
En conclusión, este estudio marca la primera descripción del potencial antimicrobiano de las BAL contra el Ma, por lo tanto, una posible nueva alternativa a los antibióticos utilizados para el control de la AC. Hasta donde saben los autores, la evaluación del potencial antimicrobiano de las BAL silvestres contra micoplasmas del grupo de los homínicos no ha sido reportada previamente. En este sentido, el inóculo L2, elaborado a partir de un probiótico comercial humano basado en Lactobacillus spp., se manifiesta como una estrategia capaz de lograr la inhibición completa de Ma in vitro en GM. La presencia de E. hirae y E. mundtii también se confirma en leche ovina y caprina con capacidad bacteriostática o bactericida in vitro frente a Ma en leche. La interacción entre BAL y Ma reportada aquí sugiere un posible papel de LAB en la dinámica de micoplasmosis que debe ser estudiada. Nuestros resultados sugieren la necesidad de diseñar más estudios in vitro para caracterizar otros aspectos de estas cepas de BAL, como otras propiedades funcionales, biopreservación y seguridad, así como tratar de comprender los mecanismos inhibitorios, con el fin de corroborar su potencial probiótico. Además, se necesitarían estudios in vivo para confirmar su potencial antimicrobiano contra micoplasmas asociados con AC y su inocuidad en la salud de los animales.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres del repositorio o repositorios y los números de acceso se pueden encontrar en: https://www.ncbi.nlm.nih.gov/; OQ538168, OQ538169 y OQ538170.
Contribuciones del autor
MT, EB y ÁG-M diseñaron el estudio y escribieron el manuscrito con el aporte de todos los autores. MT, JG, RT-P y ÁG-M recolectaron las muestras. MT y RT-P procesaron y analizaron las muestras. MT, EB, JG, RT-P y ÁG-M realizaron los experimentos de laboratorio. MT recogió y preparó los datos. AS analizó los datos. MT, EB, AS, JC, CF y ÁG-M interpretaron los datos. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este trabajo fue apoyado por la Generalitat Valenciana (España; GVA/2020/026) y el Ministerio de Ciencia e Innovación (PID2020-119462RA-I00/AEI/10.13039/501100011033). MT está respaldado por un contrato predoctoral de la CEU-UCH, RT-P por un contrato predoctoral de la Generalitat Valenciana (CIACIF/2021/245), y ÁG-M por un contrato «Ramón y Cajal» del Ministerio de Ciencia e Innovación (RYC2021-032245-I).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Notas
1. ^ http://www.ncbi.nlm.nih.gov/
Referencias
1. Bergonier, D, Berthelot, X, and Poumarat, F. Contagious agalactia of small rumiants: current knowledge concerning epidemiology, diagnosis and control.: -EN- -FR- -ES. Rev Sci Tech OIE. (1997) 16:848–73. doi: 10.20506/rst.16.3.1062
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Corrales, JC, Esnal, A, de la Fe, C, Sánchez, A, Assunçao, P, Poveda, JB, et al. Agalactia contagiosa en pequeños rumiantes. Pequeño Rumin Res. (2007) 68:154–66. doi: 10.1016/j.smallrumres.2006.09.010
3. Gómez-Martín, Á, Amores, J, Paterna, A, and De la Fe, C. Contagious agalactia due to Mycoplasma spp. in small dairy rumiants: epidemiology and prospects for diagnosis and control. Veterinario J. (2013) 198:48–56. doi: 10.1016/j.tvjl.2013.04.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Ariza-Miguel, J, Rodríguez-Lázaro, D, y Hernández, M. Estudio de Mycoplasma agalactiae en explotaciones ovejas lecheras en España. BMC Vet Res. (2012) 8:171. doi: 10.1186/1746-6148-8-171
5. Kumar, A, Rahal, A, Chakraborty, S, Verma, AK, y Dhama, K. Mycoplasma agalactiae, un agente etiológico de Agalactia contagiosa en pequeños rumiantes: una revisión. Veterinario Med Int. (2014) 2014:1–13. doi: 10.1155/2014/286752
6. MAPA . Programa Nacional Voluntario de Vigilancia, Control y Erradicación de la Agalaxia Contagiosa Ovina y Caprina 2021–2023. (2021). Disponible en: https://www.mapa.gob.es/es/ganaderia/temas/sanidad-animal-higiene-ganadera/programaagalaxiacontagiosa2021-2023final_tcm30-437638.pdf
7. Dudek, K, Sevimli, U, Migliore, S, Jafarizadeh, A, Loria, GR, y Nicholas, RAJ. Vacunas para enfermedades por micoplasma de pequeños rumiantes: un área de investigación desatendida. Patógenos. (2022) 11:75. doi: 10.3390/patógenos11010075
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Nicolás, RAJ . Mejoras en el diagnóstico y control de enfermedades de pequeños rumiantes causadas por micoplasmas. Pequeño Rumin Res. (2002) 45:145–9. doi: 10.1016/S0921-4488(02)00095-0
9. Antunes, NT, Tavío, MM, Mercier, P, Ayling, RD, al-Momani, W, Assunção, P, et al. In vitro susceptibilidades de Mycoplasma putrefaciens aislados de campo. Agentes antimicrobianos Chemother. (2007) 51:3452–4. doi: 10.1128/AAC.00420-07
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Jaÿ, M, and Tardy, F. Contagious Agalactia in sheep and goats: current perspectives. VMRR. (2019) 10:229–47. doi: 10.2147/VMRR. S201847
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Loria, GR, Sammartino, C, Nicholas, RAJ, and Ayling, RD. In vitro susceptibilidades de aislados de campo de Mycoplasma agalactiae a oxitetraciclina, tilosina, enrofloxacina, espiramicina y lincomicina-espectinomicina. Res Vet Sci. (2003) 75:3–7. doi: 10.1016/S0034-5288(03)00030-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Paterna, A, Sánchez, A, Gómez-Martín, A, Corrales, JC, de la Fe, C, Contreras, A, et al. Comunicación corta: susceptibilidad antimicrobiana in vitro de cepas de Mycoplasma agalactiae aisladas de cabras lecheras. J Dairy Sci. (2013) 96:7073–6. DOI: 10.3168/JDS.2012-6492
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Paterna, A, Tatay-Dualde, J, Amores, J, Prats-van der Ham, M, Sánchez, A, de la Fe, C, et al. Evaluación in vitro de la susceptibilidad antimicrobiana de aislados caprinos de Mycoplasma mycoides subsp. capri. Veterinario J. (2016) 214:96–101. doi: 10.1016/j.tvjl.2016.05.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Poumarat, F, Gautier-Bouchardon, AV, Bergonier, D, Gay, E, and Tardy, F. Diversity and variation in antimicrobial susceptibility patterns over time in Mycoplasma agalactiae isolates collected from sheep and winats in France. J Appl Microbiol. (2016) 120:1208–18. doi: 10.1111/jam.13083
15. Prats-van der Ham, M, Tatay-Dualde, J, de la Fe, C, Paterna, A, Sánchez, A, Corrales, JC, et al. Molecular resistance mechanisms of Mycoplasma agalactiae to macrolides and lincomycin. Vet Microbiol. (2017) 211:135–40. doi: 10.1016/j.vetmic.2017.10.012
16. Tatay-Dualde, J, Prats-van der Ham, M, de la Fe, C, Paterna, A, Sánchez, A, Corrales, JC, et al. Antimicrobial susceptibility and multilocus sequence typing of Mycoplasma capricolum subsp. capricolum. PLoS One. (2017) 12:e0174700. doi: 10.1371/journal.pone.0174700
17. FAO-WHO . Report of a joint FAO/WHO expert consultation on evaluation of health and nutritional properties of probiotics in food including powder Milk with live lactic acid Bacteria. (2001) Available at: https://www.iqb.es/digestivo/pdfs/probioticos.pdf
18. Vieco-Saiz, N, Belguesmia, Y, Raspoet, R, Auclair, E, Gancel, F, Kempf, I, et al. Benefits and inputs from lactic acid Bacteria and their Bacteriocins as alternatives to antibiotic growth promoters during food-animal production. Front Microbiol. (2019) 10:57. doi: 10.3389/fmicb.2019.00057
19. Bosch, M, Nart, J, Audivert, S, Bonachera, MA, Alemany, AS, Fuentes, MC, et al. Isolation and characterization of probiotic strains for improving oral health. Arch Oral Biol. (2012) 57:539–49. doi: 10.1016/j.archoralbio.2011.10.006
20. Chenoll, E, Casinos, B, Bataller, E, Astals, P, Echevarría, J, Iglesias, JR, et al. Novel probiotic Bifidobacterium bifidum CECT 7366 strain active against the pathogenic bacterium Helicobacter pylori. Appl Environ Microbiol. (2011) 77:1335–43. doi: 10.1128/AEM.01820-10
21. Jimenez-Trigos, E, Toquet, M, Barba, M, Gómez-Martín, Á, Quereda, JJ, and Bataller, E. Search of antimicrobial lactic acid bacteria from Salmonella-negative dogs. BMC Vet Res. (2022) 18:12. doi: 10.1186/s12917-021-03070-x
22. Niederle, MV, Bosch, J, Ale, CE, Nader-Macías, ME, Aristimuño Ficoseco, C, Toledo, LF, et al. Skin-associated lactic acid bacteria from north American bullfrogs as potential control agents of Batrachochytrium dendrobatidis. PLoS One. (2019) 14:e0223020. doi: 10.1371/journal.pone.0223020
23. Otero, MC, Morelli, L, and Nader-Macias, ME. Probiotic properties of vaginal lactic acid bacteria to prevent metritis in cattle. Lett Appl Microbiol. (2006) 43:91–7. doi: 10.1111/j.1472-765X.2006.01914.x
24. Toquet, M, Gómez-Martín, Á, y Bataller, E. Review of the bacterial composition of healthy milk, mastitis milk and colostrum in small rumiants. Res Vet Sci. (2021) 140:1–5. doi: 10.1016/j.rvsc.2021.07.022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Furtado, DN, Favaro, L, Nero, LA, de Melo Franco, BDG, and Todorov, SD. Producción de nisina por Enterococcus hirae DF105Mi aislada de leche de cabra brasileña. Probióticos Antimicrobianos Prot. (2019) 11:1391–402. DOI: 10.1007/S12602-019-09553-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Makete, G, Aiyegoro, OA, and Thantsha, MS. Isolation, identification and screening of potential probiotic Bacteria in Milk from south African Saanen goats. Probióticos Antimicrobianos Prot. (2017) 9:246–54. DOI: 10.1007/S12602-016-9247-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Quereda, JJ, García-Roselló, E, Barba, M, Mocé, ML, Gomis, J, Jiménez-Trigos, E, et al. Uso de probióticos en esponjas intravaginales en ovejas: un estudio piloto. Animales. (2020) 10:719. DOI: 10.3390/ANI10040719
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. García-Galán, A, de la Fe, C, Gomis, J, Bataller, E, Sánchez, A, Quereda, JJ, et al. La adición de Lactobacillus spp. afecta negativamente la viabilidad de Mycoplasma bovis en el moco cervical bovino. BMC Vet Res. (2020) 16:251. DOI: 10.1186/S12917-020-02454-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. García-Galán, A, Gómez-Martín, Á, Bataller, E, Gomis, J, Sánchez, A, Gadea, J, et al. La adición de Lactobacillus spp., Enrofloxacino o doxiciclina afecta negativamente la viabilidad de Mycoplasma bovis en semen bovino diluido. Animales. (2020) 10:837. DOI: 10.3390/ANI10050837
30. Gómez-Martín, A, Uc, N, Vieira, LA, Gadea, J, Cadenas, J, Sánchez, A, et al. Capacidad de supervivencia de Mycoplasma agalactiae y Mycoplasma mycoides subsp capri en el semen diluido de cabras y sus efectos sobre la calidad del esperma. Teriogenología. (2015) 83:911–9. doi: 10.1016/j.theriogenology.2014.11.029
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Pettersson, B, Uhlen, M, y Johansson, KE. Filogenia de algunos micoplasmas de rumiantes basada en secuencias de ARNr 16S y definición de un nuevo grupo dentro del grupo Hominis. Int J Syst Bacteriol. (1996) 46:1093–8. doi: 10.1099/00207713-46-4-1093
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Furneri, PM, Rappazzo, G, Musumarra, MP, Di Pietro, P, Catania, LS, y Roccasalva, LS. Dos nuevas mutaciones puntuales en A2062 se asociaron con resistencia a antibióticos macrólidos de 16 miembros en cepas mutantes de Mycoplasma hominis. Agentes antimicrobianos Chemother. (2001) 45:2958–60. doi: 10.1128/AAC.45.10.2958-2960.2001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Königsson, M . Variación intraespecífica en las secuencias del gen 16S rRNA de las cepas Mycoplasma agalactiae y Mycoplasma bovis. Veterinario Microbiol. (2002) 85:209–20. doi: 10.1016/S0378-1135(01)00517-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Gómez-Martín, Á, de la Fe, C, Amores, J, Sánchez, A, Contreras, A, Paterna, A, et al. Localización anatómica de Mycoplasma mycoides subsp. capri y Mycoplasma agalactiae en portadores auriculares machos de cabra naturalmente infectados. Veterinario Microbiol. (2012) 157:355–62. doi: 10.1016/j.vetmic.2012.01.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Reuter, G . Medios electivos y selectivos para bacterias lácticas. Int J Food Microbiol. (1985) 2:55–68. doi: 10.1016/0168-1605(85)90057-1
36. Albers, AC, y Fletcher, RD. Método simple para la cuantificación de micoplasmas viables. Aplicación Environ Microbiol. (1982) 43:958–60. doi: 10.1128/aem.43.4.958-960.1982
37. Callahan, BJ, McMurdie, PJ, Rosen, MJ, Han, AW, Johnson, AJA, and Holmes, SP. DADA2: high-resolution sample inference from Illumina amplicon data. Métodos Nat. (2016) 13:581–3. DOI: 10.1038/NMETH.3869
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Price, MN, Dehal, PS, y Arkin, AP. FastTree: cálculo de grandes árboles de evolución mínima con perfiles en lugar de una matriz de distancias. Mol Biol Evol. (2009) 26:1641–50. DOI: 10.1093/molbev/msp077
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Katoh, K, y Standley, DM. MAFFT multiple sequence alignment software version 7: improvements in performance and usability. Mol Biol Evol. (2013) 30:772–80. DOI: 10.1093/molbev/mst010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Bolyen, E, Rideout, JR, Dillon, MR, Bokulich, NA, Abnet, CC, al-Ghalith, GA, et al. Ciencia de datos de microbiomas reproducible, interactiva, escalable y extensible utilizando QIIME 2. Nat Biotechnol. (2019) 37:852–7. DOI: 10.1038/S41587-019-0209-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Wang, Q, Garrity, GM, Tiedje, JM, and Cole, JR. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy. Aplicación Environ Microbiol. (2007) 73:5261–7. doi: 10.1128/AEM.00062-07
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Amores, J, Sánchez, A, Gómez-Martín, Á, Corrales, JC, Contreras, A, and de la Fe, C. Surveillance of Mycoplasma agalactiae and Mycoplasma mycoides subsp. capri in dairy winat herd. Pequeño Rumin Res. (2012) 102:89–93. doi: 10.1016/j.smallrumres.2011.09.008
43. de Castro Santos Melo, C, da Silva Freire, A, Galdeano, MA, da Costa, CF, de Oliveira Gonçalves, APD, Dias, FS, et al. Potencial probiótico de Enterococcus hirae en leche de cabra y su supervivencia en condiciones gastrointestinales caninas simuladas in vitro. Res Vet Sci. (2021) 138:188–95. doi: 10.1016/j.rvsc.2021.06.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Wang, Y, Wu, J, Lv, M, Shao, Z, Hungwe, M, Wang, J, et al. Características metabólicas de las bacterias del ácido láctico y las aplicaciones en expansión en la industria alimentaria. Frente Bioeng Biotechnol. (2021) 9:612285. DOI: 10.3389/fbioe.2021.612285
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Cavicchioli, VQ, Camargo, AC, Todorov, SD y Nero, LA. Nuevas cepas bacteriocinógenas de Enterococcus hirae y Pediococcus pentosaceus con actividad antilisterial aisladas de queso artesanal brasileño. J Dairy Sci. (2017) 100:2526–35. DOI: 10.3168/JDS.2016-12049
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Espeche, MC, Otero, MC, Sesma, F, y Nader-Macias, MEF. Cribado de propiedades superficiales y producción de sustancias antagónicas por bacterias lácticas aisladas de la glándula mamaria de vacas sanas y mastíticas. Veterinario Microbiol. (2009) 135:346–57. doi: 10.1016/j.vetmic.2008.09.078
47. Lauková, A, Focková, V, y Pogány, SM. Enterococcus mundtii aislado de leche cruda eslovaca de cabra y su potencial bacteriocinogénico. IJERPH. (2020) 17:9504. doi: 10.3390/ijerph17249504
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Kwoji, ID, Aiyegoro, OA, Okpeku, M, y Adeleke, MA. Probióticos multicepa: la sinergia entre aislados mejora las actividades biológicas. Biología. (2021) 10:322. doi: 10.3390/biología10040322
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Pisano, MB, Deplano, M, Fadda, ME, and Cosentino, S. Microbiota of Sardinian Goat’s Milk and preliminary characterization of prevalent LAB species for starter or adjunct cultures development. Biomed Res Int. (2019) 2019:1–7. DOI: 10.1155/2019/6131404
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Rönkä, E, Malinen, E, Saarela, M, Rinta-Koski, M, Aarnikunnas, J, y Palva, A. Probiotic and milk technological properties of Lactobacillus brevis. Int J Food Microbiol. (2003) 83:63–74. doi: 10.1016/S0168-1605(02)00315-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Singh, V, Ganger, S, y Patil, S. «Caracterización de Lactobacillus brevis con propiedades probióticas potenciales e inhibición de biopelículas contra Pseudomonas aeruginosa.» en The 1st international electronic conference on microbiology. MDPI (2020). pág. 14. Disponible en: https://www.mdpi.com/2504-3900/66/1/14
52. Abdou, AM, Hedia, RH, Omara, ST, Mahmoud, MAEF, Kandil, MM y Bakry, MA. Comparación entre especies de probióticos aislados de diferentes animales. Mundo veterinario. (2018) 11:227–30. doi: 10.14202/vetworld.2018.227-230
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Singh, N, Sharma, C, Gulhane, RD, Rokana, N, Singh, BP, Puniya, AK, et al. Efectos inhibitorios de los lactobacilos de origen de la leche de cabra contra el crecimiento y la formación de biofilm por patógenos: un estudio in vitro. Biosci de alimentos. (2018) 22:129–38. doi: 10.1016/j.fbio.2018.02.001
54. Pan, M, Hidalgo-Cantabrana, C, and Barrangou, R. Host and body site-specific adaptation of Lactobacillus crispatus genomes. NAR Genom Bioinform. (2020) 2:LQAA001. doi: 10.1093/nargab/lqaa001
55. Zamojska, D, Nowak, A, Nowak, I, and Macierzyńska-Piotrowska, E. Probiotics and Postbiotics as substitutes of antibiotics in farm animals: a review. Animales. (2021) 11:3431. doi: 10.3390/ani11123431
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Agnone, A, la Manna, M, Sireci, G, Puleio, R, Usticano, A, Ozdemir, U, et al. Una comparación de la eficacia de las vacunas comerciales y experimentales para la agalactia contagiosa en ovejas. Pequeño Rumin Res. (2013) 112:230–4. doi: 10.1016/j.smallrumres.2012.12.022
57. de la Fe, C, Assunção, P, Saavedra, P, Tola, S, Poveda, C, y Poveda, JB. Ensayo de campo de dos vacunas duales contra Mycoplasma agalactiae y Mycoplasma mycoides subsp. mycoides (tipo colonia grande) en cabras. Vacuna. (2007) 25:2340–5. doi: 10.1016/j.vaccine.2006.11.050
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Loria, GR, y Nicholas, RAJ. Agalactia contagiosa: la pesadilla del pastor. Veterinario J. (2013) 198:5–6. doi: 10.1016/j.tvjl.2013.06.017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Nicholas, RAJ, y Ayling, RD. Mycoplasma bovis: enfermedad, diagnóstico y control. Res Vet Sci. (2003) 74:105–12. doi: 10.1016/S0034-5288(02)00155-8
60. Amat, S, Holman, DB, Timsit, E, Schwinghamer, T, y Alexander, TW. Evaluación de la microbiota nasofaríngea en ganado vacuno de carne transportado a un corral de engorde, con un enfoque en bacterias productoras de ácido láctico. Microbiol frontal. (2019) 10:1988. DOI: 10.3389/fmicb.2019.01988
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cita: Toquet M, Bataller E, Gomis J, Sánchez A, Toledo-Perona R, De la Fe C, Corrales JC y Gómez-Martín & (2023) Potencial antibacteriano de cepas comerciales y silvestres de bacterias lácticas aisladas de leche cruda ovina y caprina contra Mycoplasma agalactiae. Frente. Vet. Sci. 10:1197701. doi: 10.3389/fvets.2023.1197701
Recibido: 31 de marzo de 2023; Aprobado: 06 Junio 2023;
Publicado: 22 junio 2023.
Editado por:
Ilias Giannenas, Universidad Aristóteles de Tesalónica, Grecia
Revisado por:
Alireza Seidavi, Universidad Islámica Azad, Rama Rasht, Irán
Haben Fesseha Gebremeskel, Universidad Wolaita Sodo, Etiopía
Evanthia Petridou, Universidad Aristóteles de Tesalónica, Grecia
Copyright © 2023 Toquet, Bataller, Gomis, Sánchez, Toledo-Perona, De la Fe, Corrales y Gómez-Martín. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Ángel Gómez-Martín, angel.gomezmartin@uchceu.es
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía