Propiedades multifuncionales de las cepas de bacterias lácticas derivadas de las heces caninas
 Yunjiang LiuUn †
Yunjiang LiuUn † Jiali Wang1†
Jiali Wang1† Haohong Zheng1†
Haohong Zheng1† Jialiang Xin1†
Jialiang Xin1† Zhijun Zhong1
Zhijun Zhong1 Haifeng Liu1
Haifeng Liu1 Hualin Fu1
Hualin Fu1 Ziyao Zhou1
Ziyao Zhou1 Xianmeng Qiu2*
Xianmeng Qiu2* Guangneng Peng1*
Guangneng Peng1*- 1Laboratorio Clave de Enfermedades Animales y Salud Humana de la Provincia de Sichuan, Facultad de Medicina Veterinaria, Universidad Agrícola de Sichuan, Chengdu, China
- número arábigoNuevo Ruipeng Pet Healthcare Group Co., Ltd., Chengdu, China
Introducción: Los probióticos, especialmente las bacterias del ácido láctico (BAL), pueden promover la salud de los animales huéspedes de diversas maneras, como la regulación de la flora intestinal y la estimulación del sistema inmunológico del huésped.
Métodos: En este estudio, se aislaron 206 cepas de BAL de 48 muestras fecales caninas. Se seleccionaron once cepas de BAL en función del rendimiento de crecimiento, la resistencia a los ácidos y a las sales biliares. Los 11 candidatos se sometieron a una evaluación exhaustiva de las propiedades probióticas, incluida la actividad antipatógena, la adhesión, la seguridad, la capacidad antioxidante y los metabolitos.
Resultados: Los resultados de las pruebas de actividad antipatógena mostraron que 11 cepas de BAL exhibieron un fuerte efecto inhibitorio y capacidad de coagregación contra cuatro patógenos objetivo (E. coli, Staphylococcus aureus, Salmonella braenderup y Pseudomonas aeruginosa). Los resultados de la prueba de adhesión mostraron que las 11 cepas de BAL tenían una alta hidrofobicidad de la superficie celular, capacidad de autoagregación, capacidad de formación de biopelículas y capacidad de adhesión a las células Caco-2. Entre ellos, Lactobacillus acidophilus (L177) mostró una fuerte actividad en varios experimentos de adhesión. Las pruebas de seguridad mostraron que 11 cepas de BAL son sensibles a la mayoría de los antibióticos, siendo L102, L171 y L177 las que tienen la tasa de sensibilidad más alta, con un 85,71%, y no se produjo hemólisis en todas las cepas. Los resultados de las pruebas de antioxidantes mostraron que todas las cepas mostraron una buena tolerancia aH2O2, alta capacidad de barrido para 1,1-difenil-2-trinitrofenilhidracina (DPPH) e hidroxilo (OH–). Además, 11 cepas de BAL pueden producir altos niveles de metabolitos, incluidos exopolisacáridos (EPS), ácido γ-aminobutírico (GABA) e hidrolasa de sales biliares (BSH).
Discusión: Este estudio proporciona una caracterización exhaustiva de las cepas de BAL derivadas de caninos, destacando su potencial multifuncional como probióticos. Las diversas capacidades de las cepas las convierten en candidatas prometedoras para los suplementos dietéticos caninos, que ofrecen un enfoque holístico de la salud canina. Investigaciones posteriores deberían validar su eficacia in vivo para garantizar su aplicación práctica.
Introducción
Los perros son las mascotas más comunes en los hogares de todo el mundo. Sin embargo, son susceptibles a las enfermedades del sistema digestivo, como gastroenteritis, pancreatitis y enfermedad inflamatoria intestinal debido a cambios en la dieta, el medio ambiente y el sistema inmunitario debilitado. Estas enfermedades pueden alterar la microbiota intestinal del organismo, provocando síntomas como vómitos, diarrea, alergias y obesidad (1). Los antibióticos suelen ser el método preferido para controlar estas enfermedades (2, 3). Sin embargo, el uso excesivo de antibióticos puede acelerar el desarrollo y la propagación de bacterias multirresistentes, lo que representa una amenaza significativa para el tratamiento de enfermedades (4). Un estudio de la resistencia a los medicamentos en bacterias intestinales aisladas de perros domésticos reveló una resistencia generalizada a los antibióticos, incluida la resistencia a la enrofloxacina, la penicilina, la tetraciclina, la amoxicilina, la oxacilina, la eritromicina y la gentamicina (5-8). Además, el uso prolongado de antibióticos puede debilitar la inmunidad natural y alterar el equilibrio de las bacterias intestinales (9). Como resultado, se necesitan enfoques alternativos para mantener la salud de los perros domésticos.
Los probióticos, específicamente las bacterias del ácido láctico (BAL), a menudo se consideran alternativas potenciales a los antibióticos debido a su seguridad, alta eficacia, poca o ninguna capacidad para desarrollar resistencia a los medicamentos y falta de efectos secundarios tóxicos. Las BAL son un grupo de bacterias que incluye los géneros Lactobacillus, Lactococcus, Pediococcus, Enterococcus y Streptococcus, que se encuentran comúnmente en las heces y los alimentos fermentados lácteos (10). Numerosos estudios han demostrado que las BAL tienen varios beneficios para la salud del huésped, como la prevención de agentes infecciosos, la regulación del sistema inmunológico, la reducción de alergias y obesidad, la capacidad antioxidante, el aumento de la biodisponibilidad vitamínica y la reducción de la ansiedad (1, 11-15). Sin embargo, la investigación sobre la función probiótica de las BAL en caninos domésticos es limitada. Aunque los estudios han evaluado la tolerancia de las BAL caninas a los ácidos y las sales biliares, la actividad antibacteriana y la sensibilidad a los antibióticos (16-18), faltan pruebas como la evaluación de antioxidantes y metabolitos. Los estudios han demostrado que las BAL pueden reducir la producción de radicales libres y el daño a las células al mantener el equilibrio redox en el cuerpo (19). La evaluación de la capacidad antioxidante de las BAL en caninos puede mejorar el valor clínico del cribado de estas bacterias.
Si bien numerosos estudios han caracterizado las cepas probióticas para uso humano (20), existe una brecha notable en el desarrollo y la autorización de cepas probióticas específicas para mascotas, como los perros (21). La especificidad de la especie es crucial en los probióticos, ya que las cepas aisladas de la especie huésped tienen más probabilidades de colonizar eficazmente e interactuar beneficiosamente con el microbioma del huésped (18). Este estudio tiene como objetivo abordar esta brecha mediante la caracterización de cepas de bacterias lácticas (BAL) aisladas de heces caninas, con un enfoque en su potencial como probióticos multifuncionales adaptados para uso canino. Nuestra investigación podría contribuir significativamente al desarrollo de probióticos eficaces y seguros para perros.
Materiales y métodos
Aislamiento, purificación e identificación de BAL a partir de heces caninas
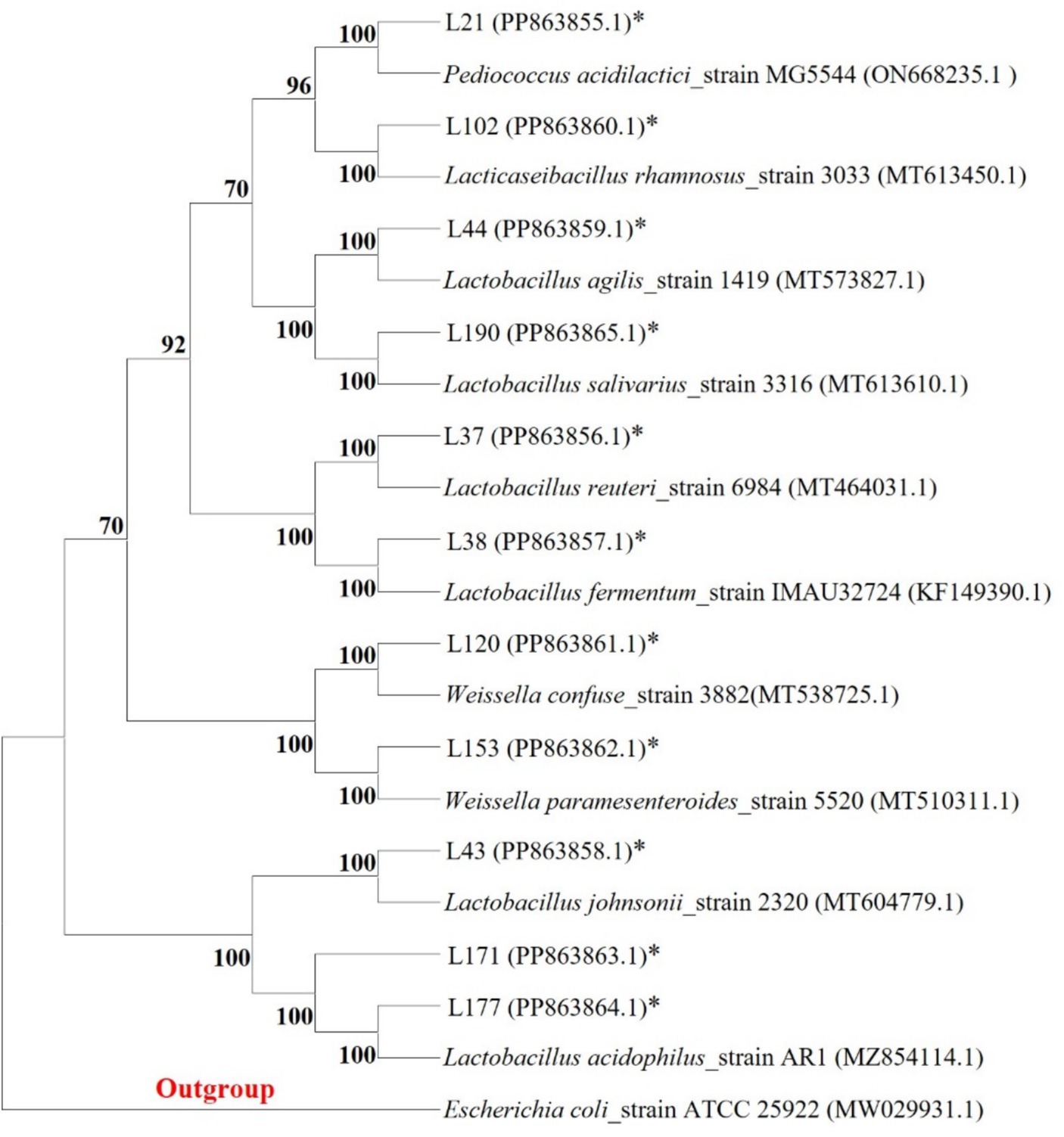
Recolectamos muestras fecales de 48 perros adultos sanos (de 1 a 5 años) reclutados en clínicas veterinarias locales. Todos los perros fueron examinados para asegurarse de que estaban libres de enfermedades gastrointestinales y que no habían recibido antibióticos o probióticos durante al menos 6 meses. Fueron alimentados principalmente con comida seca comercial para perros y se mantuvieron en entornos domésticos. Los propietarios mantuvieron la dieta regular sin suplementos adicionales durante el estudio. Las muestras fecales se recogieron en recipientes estériles, se almacenaron a 4 °C y se procesaron en 24 h. Aislamiento e identificación de cepas de BAL basado en el informe de Zhang (22). Cada muestra de heces (1 g) se suspendió en 10 mL de suero fisiológico después de ser triturada. A continuación, se aplicaron 0,1 mL de la suspensión a placas de agar MRS (de Man, Rogosa y Sharpe Medium) (Hopebio, Qingdao, China) y se incubaron anaeróbicamente a 37°C durante 24 a 72 h hasta obtener colonias individuales. Las colonias individuales se purificaron a través de tres pasos consecutivos en agar MRS. Las colonias individuales se purificaron y enriquecieron utilizando medio líquido MRS. A continuación, los cultivos bacterianos se amplificaron y secuenciaron utilizando cebadores de ADNr 16S. Finalmente, las secuencias se utilizaron para la identificación de especies a través de la función BLAST en el sitio web oficial del NCBI. El árbol filogenético se construyó utilizando el software MEGA11 (Mega Limited, Auckland, Nueva Zelanda) para las secuencias de cepas aisladas y secuencias homólogas, empleando el modelo de 2 parámetros de Kimura y el método UPGMA.
Cinética de crecimiento
Con base en investigaciones previas (23), probamos el rendimiento de crecimiento de las cepas de BAL mediante la construcción de una curva de crecimiento utilizando caldo MRS como control negativo. Cincuenta microlitros (1%) de cada cultivo de cepas de BAL en fase exponencial media se inocularon en 50 mL de caldo MRS fresco y se incubaron a 37°C durante 48 h. La absorbancia a 600 nm se midió cada 2 h de 0 a 24 h y cada 4 h de 25 a 48 h. De cada tipo de BAL, seleccionamos tres cepas con el mejor rendimiento de crecimiento como cepas candidatas. Después de determinar el período de crecimiento de las cepas de BAL, el valor de OD600 de las BAL se ajustó a aproximadamente 0,1 antes de todos los experimentos posteriores, a menos que se indique lo contrario.
Tolerancia a ácidos y sales biliares
La prueba de tolerancia a las sales ácidas y biliares se realizó con base en Mayur con ajustes menores (24). El pH del medio caldoso MRS se ajustó a 2,0, 3,0 y 4,0 utilizando 0,1 mol/L de HCl. A continuación, el medio se esterilizó a 121 °C durante 20 min. Las cepas de BAL se inocularon en el medio MRS y se cultivaron hasta la fase logarítmica tardía. Se centrifugó 1 mL del cultivo y se resuspendió en un volumen igual de solución de MRS con diferente pH, y se cultivó en una incubadora a 37 °C durante 2 h. Se utilizó el método de conteo en placa para contar las bacterias viables en las muestras a 0 h (N0) y 2 h (N1). Las muestras se diluyeron en serie, se colocaron en agar MRS y se incubaron anaeróbicamente. A continuación, se contaron las unidades formadoras de colonias (UFC) para determinar el número de bacterias viables. A partir de los resultados del conteo, se calculó la tasa de supervivencia. Ajustar las concentraciones finales del medio de caldo MRS a 0,1, 0,3 y 0,5% utilizando sales biliares (Solarbio, Pekín, China). El método de prueba de resistencia a las sales biliares es el mismo que el de la prueba de resistencia a los ácidos. Calcule la tasa de supervivencia: tasa de supervivencia (%) = N1/N0 × 100.
Detección de actividad antipatógena
Actividad antibacteriana
La detección de la actividad antipatógena se realizó con base en el informe de Zhang con ajustes menores (22). La capacidad inhibitoria del sobrenadante libre de células (SFC) de las cepas de BAL frente a cuatro bacterias enteropatógenas comunes se determinó mediante el método de la copa de Oxford. Las bacterias patógenas para esta prueba fueron Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922, Salmonella braenderup H9812 y Pseudomonas aeruginosa PAO1. La cepa LAB se activó e inoculó en caldo MRS, se cultivó a 37 °C durante 24 h y luego se centrifugó a 4500 rpm durante 10 min bajo enfriamiento. El sobrenadante se neutralizó a pH 7,0 utilizando NaOH estéril 1 M y se filtró a través de un filtro estéril de 0,22 μm para obtener el CFS para su uso posterior. Al mismo tiempo, se activaron 4 bacterias patógenas en el caldo LB en las mismas condiciones. Las bacterias patógenas cultivadas en la fase estable se diluyeron a 107 UFC/mL, y 100 μL se distribuyeron uniformemente en el medio sólido LB para su uso posterior. Coloque 3 tazas Oxford estériles en cada medio de cultivo, agregue 200 μL de CFS de las cepas aisladas en las tazas Oxford respectivamente, use un medio de cultivo líquido MRS ordinario como control en blanco, coloque el medio de cultivo en una incubadora a 37 ° C para cultivo estático durante 24 h, mida y registre el diámetro de la zona de inhibición.
Capacidad de coagregación con patógenos
Utilice las cepas patógenas mencionadas en la sección de pruebas de actividad antibacteriana para determinar la capacidad de coagregación de las cepas BAL. Mezclar los cultivos de las cepas de BAL activadas con volúmenes iguales de los cuatro cultivos de bacterias patógenas (2 mL cada uno), vórtice para mezclar e incubar a 37°C durante 2 h. A continuación, se midió la absorbancia (mezcla A) de cada suspensión bacteriana mezclada a 600 nm. La absorbancia de una sola suspensión de cepas de BAL (ALAB) y suspensiones bacterianas patógenas (Apatógeno) se midió a 600 nm en el grupo control. Para las bacterias patógenas, use las cepas mencionadas en la sección de prueba de actividad antibacteriana. La prueba se repitió tres veces y se calculó de acuerdo con la siguiente fórmula: Tasa de coagregación (%) = 1 – Unamezcla/[(ABAL + Unpatógeno)/2] × 100.
Detección de la actividad de adherencia
Actividad de agregación automática
La actividad de autoagregación se llevó a cabo sobre la base del informe de Zhang con ajustes menores (22). Las cepas de BAL cultivadas durante la noche se centrifugaron a 4.500 r/min durante 10 min para recoger las células. A continuación, las células se lavaron dos veces con 1 × PBS estéril y se ajustaron a una concentración de 108 UFC/ml antes de descansar. La absorbancia de la capa superior de la suspensión bacteriana se midió a las 0 (A0) y 6 (A1) horas, respectivamente. El experimento se repitió tres veces. La tasa de autoagregación bacteriana: tasa de autoagregación (%) = 1 − (A1/A0) × 100.
Hidrofobicidad de la superficie celular
Las cepas de BAL activadas se introdujeron en el medio líquido MRS a una concentración de 1% (v/v) y se incubaron durante la noche, se recogieron los microorganismos por centrifugación a 8.000 × g durante 10 min a 4 °C y se lavaron tres veces con 1 × PBS estéril (pH = 7,4). A continuación, los organismos se resuspendieron en PBS y la absorbancia de la suspensión de las cepas BAL se ajustó a OD600 = 0,60 ± 0,05 (A0). La hidrofobicidad de las cepas de BAL en diversos disolventes orgánicos se determinó utilizando el método reportado por Kos et al. (25) con ligeras modificaciones. Se añadió 1 mL de diferentes disolventes orgánicos (acetato de etilo, xilol y triclorometano) a 3 mL de suspensión de cepas BAL, se agitó en vórtice y se agitó durante 2 min, y luego se dejó reposar durante 20 min, y luego se midió el valor OD de la fase acuosa a 600 nm mediante espectrofotómetro UV (A1). El experimento se repitió tres veces. La hidrofobicidad de las cepas de BAL se calculó según la siguiente fórmula: tasa de hidrofobicidad (%) = (1−A1/A0) × 100.
Adhesión a las células Caco-2
La adhesión a las células de Caco-2 se llevó a cabo con base en el informe de Wang con ajustes menores (26). Las células de adenocarcinoma colorrectal (Caco-2) se compraron en el CHINA CENTER FOR TYPE CULTURE COLLECTION, numeradas GDC0153. Las células de Caco-2 se cultivaron hasta un estado subconfluente del 80-90% en un matraz de cultivo celular, luego se digirieron con tripsina al 0,25% y se contaron con un hemocitómetro. La concentración de células viables se ajustó a 1 × 105 células/mL (VC) utilizando medio DMEM. La suspensión celular se añadió a una placa de cultivo celular de 12 pocillos a un volumen de 1 mL por pocillo. A continuación, la placa se colocó en una incubadora de cultivo celular a una temperatura constante de 37 °C y 5% de CO2 durante 48 h hasta que las células formaron una monocapa. Las células se cultivaron durante 1 día antes del ensayo de adhesión. Al inicio del ensayo de adhesión se sustituyó el medio por DMEM alto en glucosa antirresistente, las células se lavaron tres veces con PBS estéril y se añadió 1 mL de una suspensión de cepas LAB a una concentración de 1 × 108 UFC/mL (V0) a cada pocillo, 37 °C y 5% de CO2 en una incubadora de cultivo celular a temperatura constante durante 2 h. Después del período de incubación, las células se sometieron a tres lavados con PBS estéril para eliminar cualquier célula BAL no adherida. Posteriormente, se utilizó tripsina al 0,25% para digerir las células. Las células se recolectaron y se sometieron a una dilución en gradiente de diez veces después de la digestión completa. Se utilizó el recuento de colonias en placa (V1) para determinar el número de BAL adherentes viables después de la dilución en medios sólidos de MRS. El experimento se llevó a cabo tres veces. La tasa de adhesión y el índice de adhesión de las BAL a las células Caco-2 se calcularon mediante la siguiente fórmula: Tasa de adhesión (%) = (V1/V0) × 100; Índice de adherencia (UFC/célula) = V1/VC.
Determinación de la capacidad formadora de biopelículas
Las investigaciones demuestran que las cepas de BAL con una fuerte capacidad de formación de biopelículas tienen una mejor resistencia al calor y a la congelación (27). La capacidad de las cepas de BAL para formar una biopelícula se determinó mediante tinción de violeta cristalino (28). La suspensión de cepas LAB en la fase de retardo se inoculó en una placa de cultivo celular de 96 pocillos a 200 μL/pocillo, y se cultivó en una incubadora a 37 °C durante 24 h para formar una biopelícula estable, y se utilizó un medio líquido MRS en blanco como control. Las bacterias se lavaron tres veces con PBS estéril para eluir las bacterias planctónicas, y luego se secaron a temperatura ambiente durante 15 min; fijado en solución de metanol (200 μL) durante 15 min y secado a temperatura ambiente durante 10 min; teñido en solución de violeta cristalina al 1% (200 μL) durante 20 min, lavado 3 veces con agua destilada y secado a temperatura ambiente durante 10 min; eluido en solución de ácido acético al 33% (200 μL) durante 10 min. El valor de OD de la solución decolorada a 595 nm se midió mediante un contador de enzimas (el control se registró como A0 y los lactobacilos se registraron como A). La fuerza de la capacidad de formación de biopelículas de los lactobacilos se evaluó de acuerdo con los siguientes criterios: sin capacidad de formación de biopelículas (-): A<A0; débil capacidad formadora de biofilm (+): A0<A ≤ 2A0; capacidad moderada de formación de biofilm (++): 2A0<A ≤ 4A0; y fuerte capacidad de formación de biopelícula (+++): A>4A0. Los experimentos se repitieron tres veces.
Evaluación de la seguridad
Actividad hemolítica
La prueba de evaluación de seguridad se llevó a cabo sobre la base del informe de Zhang con ajustes menores (22). Para evaluar la actividad hemolítica, las cepas de BAL se rayaron en placas de agar sangre y se incubaron durante 48 h a 37 °C. Se utilizó Staphylococcus aureus ATCC 25923 como control positivo. β-hemólisis, en la que todos los eritrocitos se hidrolizan, formando un área clara alrededor de la colonia. α-hemólisis es cuando los eritrocitos se hidrolizan parcialmente, formando un área verde alrededor de la colonia. γ-hemólisis ocurre cuando los eritrocitos no responden y no hay hemólisis alrededor de la colonia.
Susceptibilidad a los antibióticos
La susceptibilidad a los antibióticos de las cepas de BAL seleccionadas se evaluó mediante la prueba de difusión en disco. Se probaron dieciocho antimicrobianos (Shunyoubio, Shanghái, China), incluyendo penicilina G (P, 10 μg), ampicilina (AMP, 10 μg), amoxicilina (LMA, 25 μg), eritromicina (E, 15 μg), cefuroxim (CXM, 30 μg), cefotaxima (CTX, 30 μg), oxacilina (OX, 5 μg), cefazolina (KZ, 30 μg), norfloxacino (NOR, 5 μg), rifampicina (RD, 5 μg), clindamicina (DA, 10 μg), cloranfenicol (C, 30 μg), tetraciclina (TE, 30 μg) y vancomicina (VA, 30 μg). Los cultivos frescos durante la noche de cada cepa de BAL se diluyeron a una concentración de 108 UFC/mL. Posteriormente, 100 μL de los cultivos diluidos se extendieron en placas de agar MRS y se secaron. Las cepas de BAL se sometieron a pruebas de susceptibilidad a los antibióticos utilizando los antibióticos mencionados anteriormente. Se colocaron manualmente tres discos antibióticos uniformes en la superficie de las placas de MRS secas, que luego se invirtieron y se incubaron durante 48 h en condiciones anaeróbicas a 37 °C. La susceptibilidad a los antibióticos se clasificó como resistente (R), moderadamente susceptible (M) o sensible (S) con base en el diámetro de la zona de inhibición (mm) según los parámetros del Clinical and Laboratory Standards Institute (29).
Evaluación de la capacidad antioxidante
Inocular cepas de BAL activadas en el medio líquido MRS. Después del cultivo durante la noche, la mezcla debe centrifugarse a 4 °C y 8.000 × g durante 10 min. El sobrenadante debe recolectarse para obtener un sobrenadante libre de células. A continuación, el pellet debe resuspenderse en PBS y la concentración de células debe ajustarse a 1 × 109 UFC/mL para obtener una suspensión bacteriana.
Tolerancia a H2O2
Se utilizó el método reportado por Xiong et al. (30) para medir la tolerancia de las cepas de BAL a H2O2. Se inoculó un cultivo líquido de cepas de BAL con una concentración de 1 × 108 UFC/mL en un medio de cultivo líquido MRS que contenía 0, 0,5, 1,0, 1,5 y 2,0 mmol/L H2O2 a un volumen de inóculo de 2% (v/v). La mezcla se incubó durante 8 h a 37 °C en una incubadora de temperatura constante, y el valor de OD del medio de cultivo se midió a una longitud de onda de 600 nm utilizando un espectrofotómetro UV. El experimento se repitió tres veces.
Capacidad de eliminación de radicales DPPH
La capacidad de eliminación de radicales libres de 1,1-difenil-2-picrilhidrazilo (DPPH) de las cepas de BAL se detectó de acuerdo con el método de la literatura (31). Se añadieron 2 mL de solución de etanol absoluto DPPH de 0,2 mmol/L a un tubo de centrífuga que contenía 1 mL de bacterias lácticas, sobrenadante libre de células o suspensión bacteriana. La mezcla se agitó en vórtice y se dejó reaccionar durante 30 minutos a temperatura ambiente en la oscuridad a 4 °C. Posteriormente, se centrifugó a 8.000 × g durante 10 min para recoger el sobrenadante. El valor de OD del sobrenadante se midió a una longitud de onda de 517 nm utilizando un espectrofotómetro UV (muestra de OD). Se utilizó etanol anhidro como grupo blanco en lugar de la solución de etanol absoluto DPPH (ODblanco), y se utilizó agua destilada como grupo de control en lugar de la muestra para la reacción (control OD). El experimento se repitió tres veces, después de eso, se calculó la tasa de eliminación de radicales libres DPPH de LAB utilizando la siguiente fórmula: Tasa de eliminación de radicales libres DPPH (%) = [1−(muestraOD − OD en blanco)/OD control] × 100.
Determinación de la capacidad de eliminación de radicales libres OH
La determinación de la capacidad de barrido de OH− siguió el protocolo descrito por Alam et al. (32), con ciertos ajustes. Un tubo centrífugo recibió quinientos microlitros de cepas BAL, sobrenadante libre de células o suspensión. Esto se acompañó de la adición de 1 mL de 1,10-fenantrolina al 0,1%, 1 mL de PBS, 1 mL de 2,5 mmol/L de FeSO4 y 1 mL de 20 mmol/L H2O2. Después de un período de incubación de 1,5 h en un baño de agua a 37 °C, se midió el OD536 de la mezcla de reacción resultante (muestra de OD). En el grupo blanco, un volumen constante de etanol absoluto sustituyó a H2O2 (OD blanco). De manera similar, en el grupo de control, la solución de muestra se reemplazó con un volumen equivalente de agua destilada (control OD). La tasa de eliminación de radicales OH− de las cepas de BAL se determinó aplicando la siguiente fórmula: Tasa de eliminación de radicales libres OH− (%) = [(muestra OD −control OD)/(ODen blanco−control OD)] × 100.
Determinación de la capacidad de eliminación de radicales libres deO2
La capacidad de barrido de los radicales libres deO2− por cepas BAL se evaluó siguiendo el procedimiento detallado por Liu et al. (33). A 100 μL de cepas de BAL sobrenadante libre de células o suspensión bacteriana, se añadieron 2,8 mL de Tris-HCl 0,05 mol/L (pH 8,2) y 100 μL de pirogalol 0,05 mol/L. La mezcla se agitó en vórtice y se incubó a 25 °C, protegida de la luz. Después de 4 min de incubación, la reacción se detuvo mediante la adición de 1 mL de HCl de 8 mol/L. Utilice un espectrofotómetro UV para medir el valor de OD de la solución de reacción a una longitud de onda de 320 nm (muestra de OD). Ajuste a cero con agua destilada. El agua destilada reemplaza la muestra para la reacción como grupo de control (control OD). El experimento se repitió tres veces. A continuación, calcule la tasa de eliminación de radicales libres O2− de las cepas de BAL de acuerdo con la siguiente fórmula: O2− tasa de eliminación de radicales libres (%) = [muestra de 1−OD/control de OD] × 100.
Determinación de metabolitos
Determinación de la capacidad de producción de exopolisacáridos (EPS)
La capacidad de producción de EPS de las cepas de BAL se determinó de acuerdo con el método reportado por Ren et al. (34). El sobrenadante libre de células de las cepas LAB se preparó de acuerdo con el método utilizado en la prueba de antioxidantes. El sobrenadante se mezcló con ácido tricloroacético hasta una concentración final de 40 mg/mL, se incubó a 4 °C durante la noche y se centrifugó para recoger la fase acuosa superior (8.000 × g, 4 °C, 10 min). Posteriormente, se añadieron 250 μL de fenol al 6% y 1 mL de ácido sulfúrico concentrado al líquido recogido, se mezclaron bien y se incubaron en hielo durante 1 min. El valor OD de la solución de reacción se midió a una longitud de onda de 490 nm utilizando un lector de microplacas. Se trazó una curva estándar utilizando soluciones de glucosa con concentraciones de 3,125, 6,25, 12,5, 25, 50 y 100 mg/L para calcular la concentración de EPS producida por las cepas de BAL. El experimento se repitió tres veces.
Determinación de la capacidad de producción de ácido gamma-aminobutírico (GABA)
La capacidad productora de GABA de las cepas de BAL se determinó de acuerdo con Zhang et al. (35). En primer lugar, las cepas de BAL activadas se inocularon en medio de peptona de extracto de levadura glucosa (GYP), se cultivaron durante la noche y se centrifugaron a 4 °C durante 10 min a 8.000 × g para recoger el sobrenadante. Posteriormente, se añadieron 200 μL de tampón borato 0,2 mol/L (pH 9,0), 1 mL de fenol al 6% y 0,4 mL de solución de hipoclorito de sodio con un contenido de cloro disponible del 5,5% a 0,5 mL del sobrenadante. Finalmente, el sobrenadante que contenía el compuesto se hirvió durante 10 min, se enfrió en un baño de hielo durante 20 min, y luego se mezcló con 2 mL de una solución de etanol al 60% por vórtice. El valor OD de la solución de reacción se midió a una longitud de onda de 645 nm utilizando un lector de microplacas. Se trazó una curva patrón utilizando patrones de GABA con concentraciones de 0, 0,2, 0,4, 0,6, 0,8 y 1,0 g/L para calcular la concentración de GABA producida por las cepas de BAL. El experimento se repitió tres veces.
Determinación de la capacidad productora de hidrolasa de sales biliares (BSH)
La capacidad de las cepas de BAL para producir BSH se determinó de acuerdo con Wang et al. (36), y el sobrenadante libre de células se preparó de acuerdo con el método de prueba antioxidante. En primer lugar, se mezclaron 1 mL de suspensión bacteriana y 10 mmol/L de ditiotreitol en un tubo de centrífuga y se sonicaron durante 10 min. Después de eso, la mezcla se centrifugó a 4 ° C y 8,000 × g durante 10 min para obtener un extracto libre de células. A continuación, se añadieron 180 μL de PBS, 10 μL de solución de taurocolato de sodio 0,1 mol/L y 10 μL de sobrenadante libre de células o extracto libre de células en un tubo de centrífuga y se calentaron en un baño de agua a 37 °C durante 30 min. A continuación, se añadieron 200 μL de ácido tricloroacético al 15%. Después de reaccionar durante 1 min, la mezcla se centrifugó a 4 °C y 8.000 × g durante 10 min. Se recolectaron cien microlitros de sobrenadante y se mezclaron con 1,9 mL de solución cromogénica de ninhidrina. Finalmente, después de calentar en un baño de agua hirviendo durante 15 min y un baño de agua helada durante 3 min, se midió el OD570 del reactivo para calcular el contenido de BSH producido por las cepas de BAL mediante curva estándar. En esta prueba, primero se agregó ácido tricloroacético a la muestra y luego se agregó una solución de taurocolato de sodio para la reacción como grupo de control. Se construyó una curva estándar utilizando patrones de glicina a concentraciones de 0, 0,1, 0,2, 0,3, 0,4 y 0,5 μmol/L.
Análisis estadístico
Todos los resultados se expresaron como media ± DE, y la significación estadística de las diferencias se evaluó mediante ANOVA de un factor utilizando SPSS 28 (IBM, Estados Unidos), seguido de la prueba de rangos múltiples de Duncan para el análisis post hoc. Las diferencias se consideraron significativas a p < 0,05 y extremadamente significativas a p < 0,01.
Resultados
En este estudio, se obtuvieron un total de 206 cepas de BAL a partir de 48 muestras fecales caninas. Con base en la identificación del ADNr 16S, la especie bacteriana con mayor número de aislados fue Enterococcus faecalis (122), seguida de Ligilactobacillus animalis (16), Limosilactobacillus reuteri (14), Enterococcus faecium (14), Weissella confusa (14), Ligilactobacillus salivarius (6), Weissella paramesenteroides (5), Lactobacillus acidophilus (5), Enterococcus hirae (2), Pediococcus acidilactici (2), Lactobacillus johnsonii (2), Limosilactobacillus fermentum (1), Ligilactobacillus agilis (1), Enterococcus lactis (1) y Lacticaseibacillus rhamnosus (1).
Entre estas cepas, seleccionamos 11 candidatos probióticos en función de su buen rendimiento de crecimiento y resistencia a los ácidos y las sales biliares (no se muestran los datos de rendimiento del crecimiento). En la Tabla 1 se presenta información sobre 11 cepas bacterianas, incluidas sus especies y los números correspondientes. En la Tabla 2 se enumeran las tasas de supervivencia de las 11 cepas de BAL a diferentes concentraciones de pH y sales biliares. Los resultados mostraron que todas las cepas tuvieron tasas de supervivencia relativamente buenas a pH = 4, y Lactobacillus acidophilus L77 tuvo la tasa de supervivencia más alta del 86,34%. Los resultados de resistencia a las sales biliares mostraron que las cepas L43 y L153 tuvieron las tasas de supervivencia más altas con concentraciones de sales biliares de 0,1 y 0,3% con 58,15 y 23,67%, respectivamente. Todas las cepas no mostraron viabilidad a una concentración de sales biliares del 0,5%. El árbol filogenético, construido a partir de las secuencias del gen ADNr 16S y mostrado en la Figura 1, proporciona una representación visual de la relación genética entre estos aislados. Estas cepas fueron evaluadas por sus propiedades probióticas, como actividad antipatógena, adherencia, seguridad, capacidad antioxidante y metabolitos.
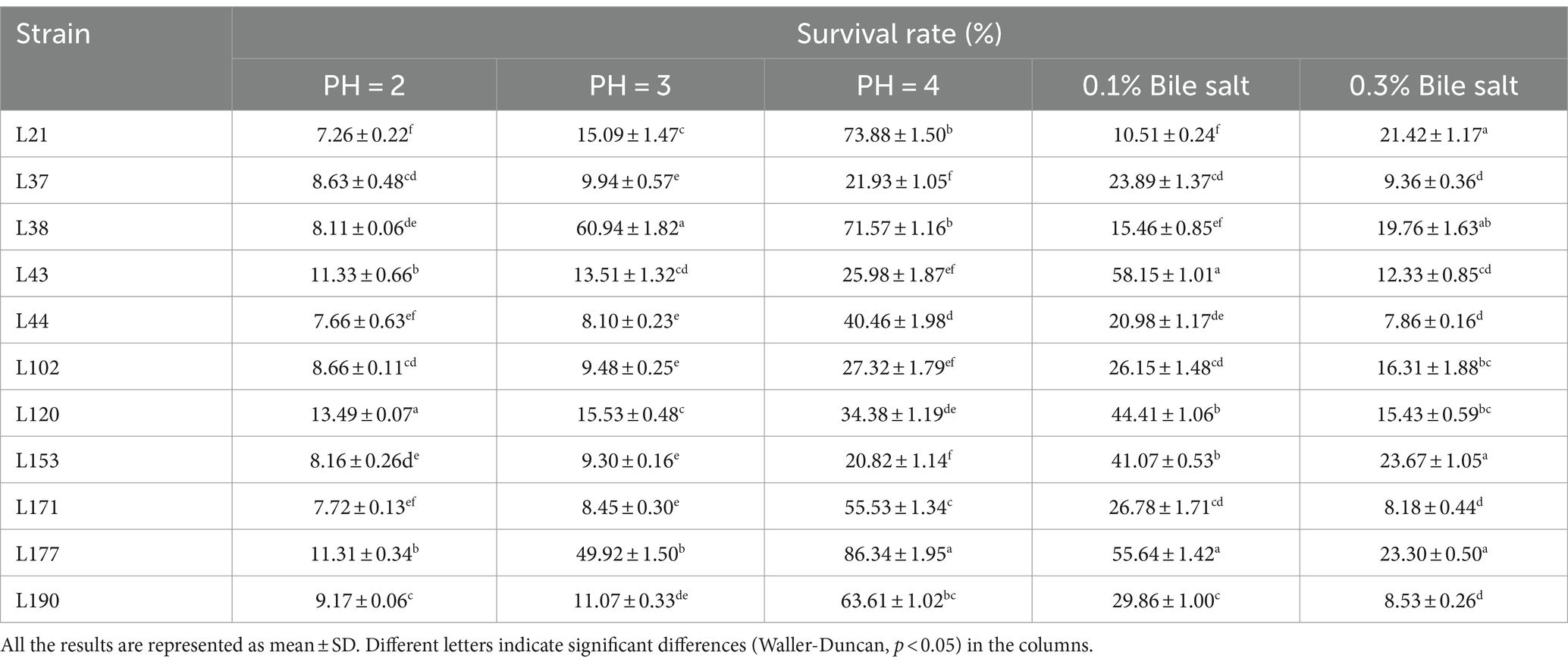
Tabla 2. Tasas de supervivencia de 11 cepas de BAL en diferentes concentraciones de pH y sales biliares.
Detección de actividad antipatógena
Para evaluar las capacidades antipatógenas de estos 11 candidatos, probamos su actividad antagonista contra patógenos entéricos comunes, incluidos Escherichia coli (ATCC 25922), Staphylococcus aureus (ATCC 25923), Salmonella braenderup (H9812) y Pseudomonas aeruginosa (PAO 1), utilizando el método de la copa de Oxford. Con base en estudios previos, la actividad antipatógena de estas BAL se clasificó en cuatro rangos: I, 8 mm < diámetro de área ≤ 12 mm; II, 12 mm < diámetro de área ≤ 16 mm; III, 16 mm < de diámetro de área ≤ 20 mm; IV, 20 mm < de diámetro de área. Como se muestra en la Tabla 3, los diámetros de las zonas de inhibición de las 11 cepas fueron todas mayores de 10 mm, lo que indica que todas tuvieron actividad antagonista significativa contra cuatro patógenos intestinales comunes, pero sus rendimientos no fueron exactamente los mismos. Entre ellas, las bacterias con los efectos antibacterianos más fuertes contra Escherichia coli, Staphylococcus aureus, Salmonella braenderup y Pseudomonas aeruginosa son L38, L177, L177 y L43, respectivamente.
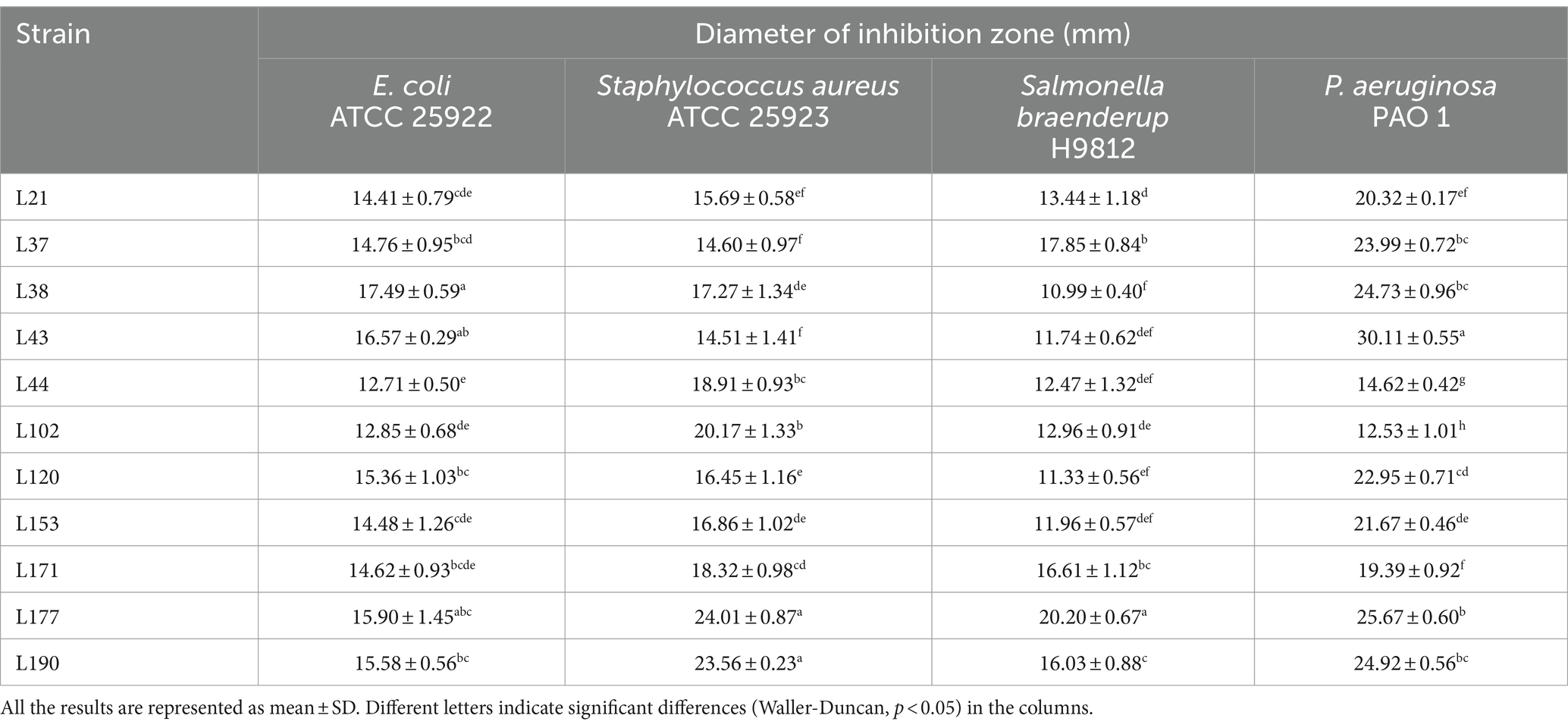
Tabla 3. Detección de actividad antagónica de cepas de BAL en muestras fecales caninas por el método de la copa de Oxford.
En cuanto a la actividad de coagregación, las 11 cepas fueron capaces de co-agregar los cuatro patógenos, como se muestra en la Tabla 4. Entre ellas, la cepa L177 tiene la mayor capacidad de coagregación con Escherichia coli (ATCC 25922), Salmonella braenderup (H9812) y P. aeruginosa (PAO 1). También tiene una capacidad de coagregación extremadamente fuerte con Staphylococcus aureus (ATCC 25923).
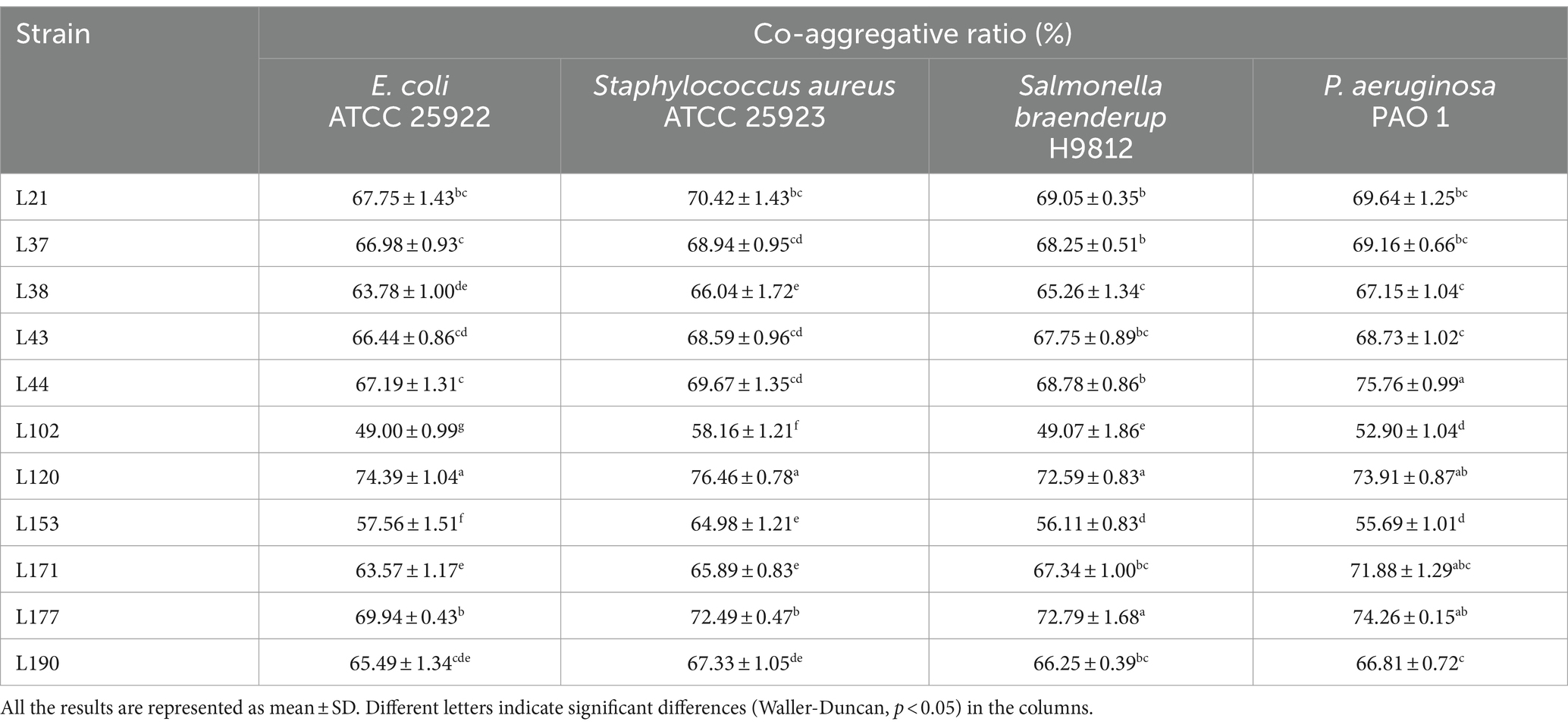
Tabla 4. Actividad coagregativa de cepas de BAL de muestras fecales caninas frente a bacterias patógenas.
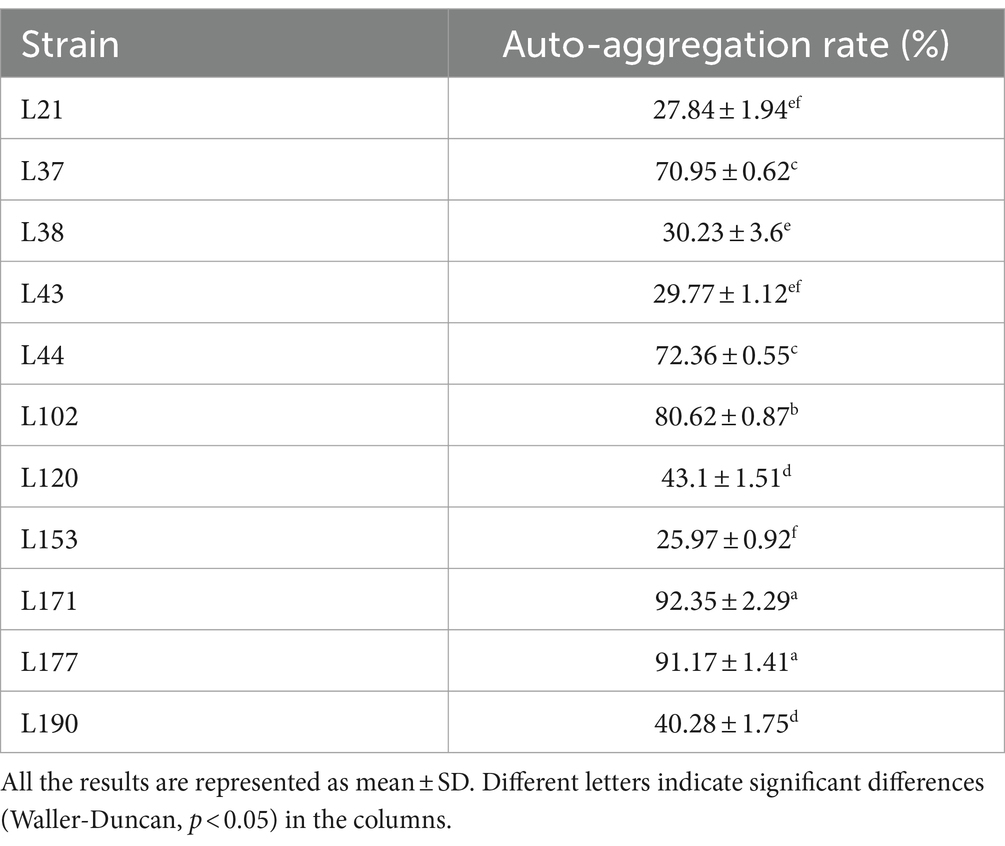
Detección de la actividad de adherencia
Como se muestra en la Tabla 5, las cepas L171 y L177 mostraron altas tasas de autoagregación. Ambos superaron el 90%.
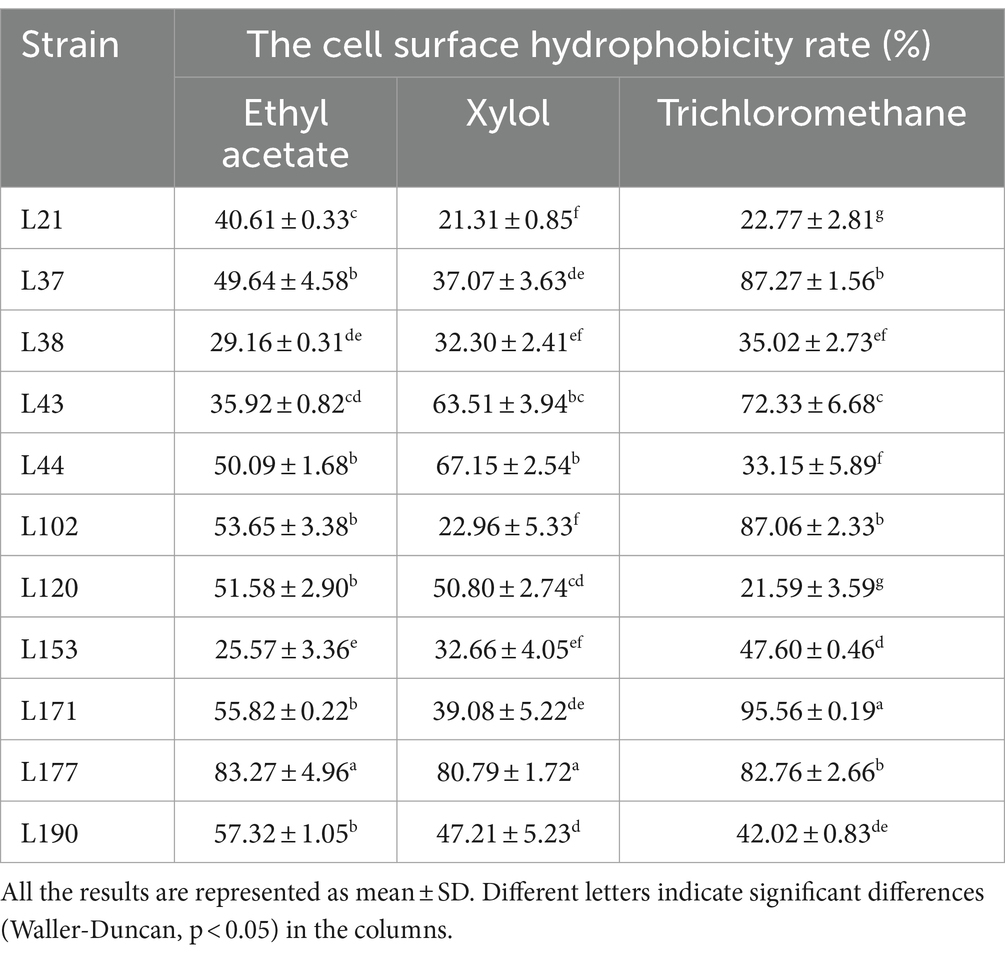
Los resultados de la hidrofobicidad de la superficie celular se presentan en la Tabla 6. Se observaron diferencias significativas entre las tasas de hidrofobicidad de varias cepas de BAL cuando se expusieron a diferentes soluciones. L177 exhibió las tasas más altas de hidrofobicidad para el acetato de etilo y el xilol. L171 exhibió las tasas más altas de hidrofobicidad para triclorometano.
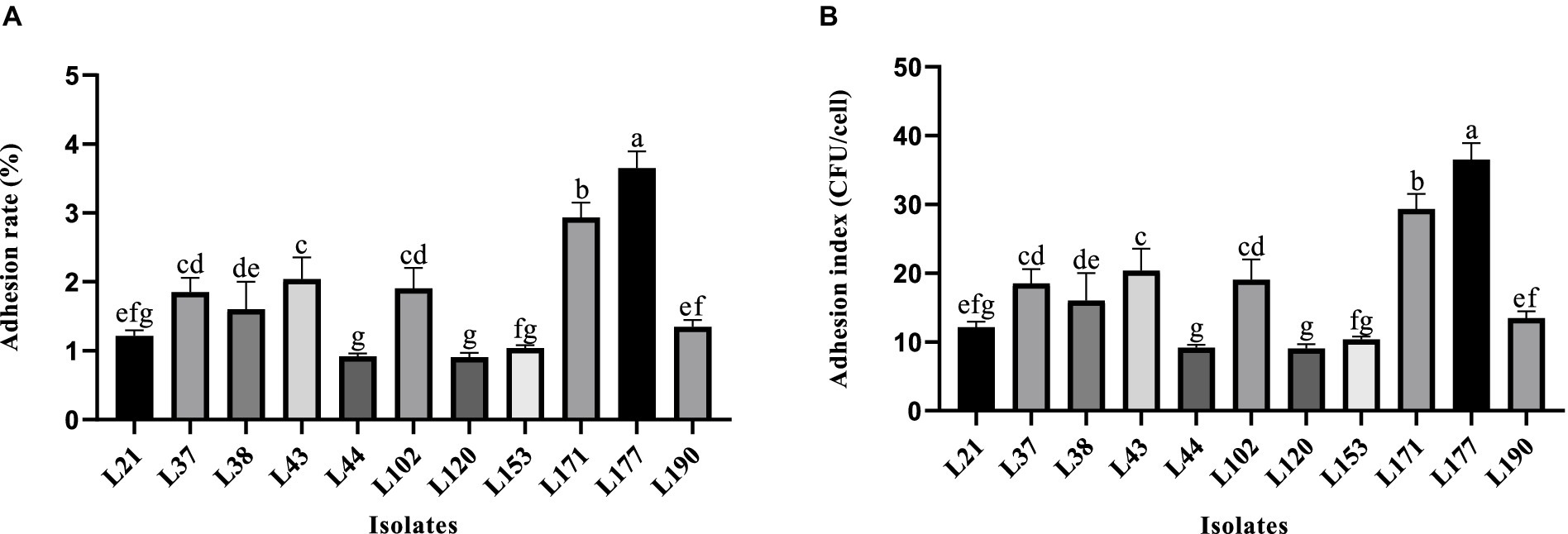
La Figura 2 muestra la variabilidad en la capacidad de adhesión de las 11 cepas LAB a las células Caco-2. La cepa L177 exhibió la mayor capacidad de adhesión (tasa de adhesión del 3,62%, índice de adhesión del 36,17), seguida de la cepa L171 (tasa de adhesión del 2,82%, índice de adhesión del 28,17). Cabe destacar que ambas bacterias son Lactobacillus acidophilus.
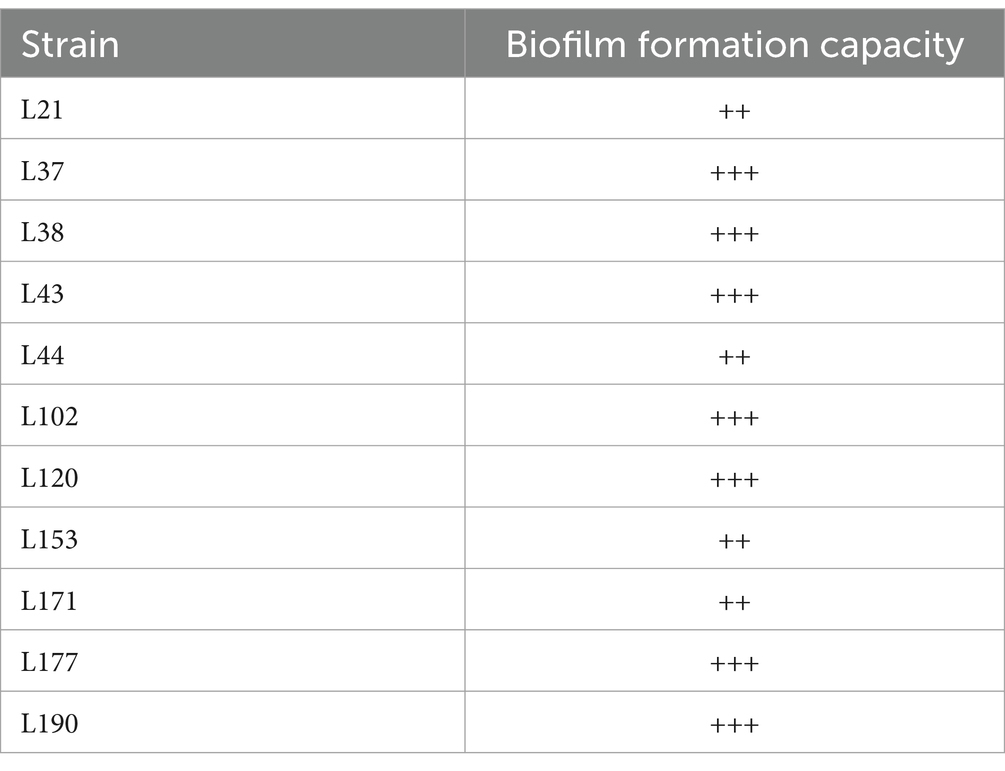
La Tabla 7 muestra que las 11 cepas de BAL mostraron una buena capacidad de formación de biopelícula. Las cepas L21, L44, L153 y L171 mostraron una capacidad moderada de formación de biopelículas (++), mientras que las cepas L37, L38, L43, L102, L120, L177 y L190 exhibieron una fuerte capacidad de formación de biopelículas (+++).
Evaluación de la seguridad
Para garantizar la aplicabilidad in vivo, todos los probióticos potenciales deben ser no hemolíticos. Los resultados de la prueba de hemólisis indicaron que ninguno de los 11 candidatos era hemolítico, ya que no produjeron un asa hemolítica β en este experimento.
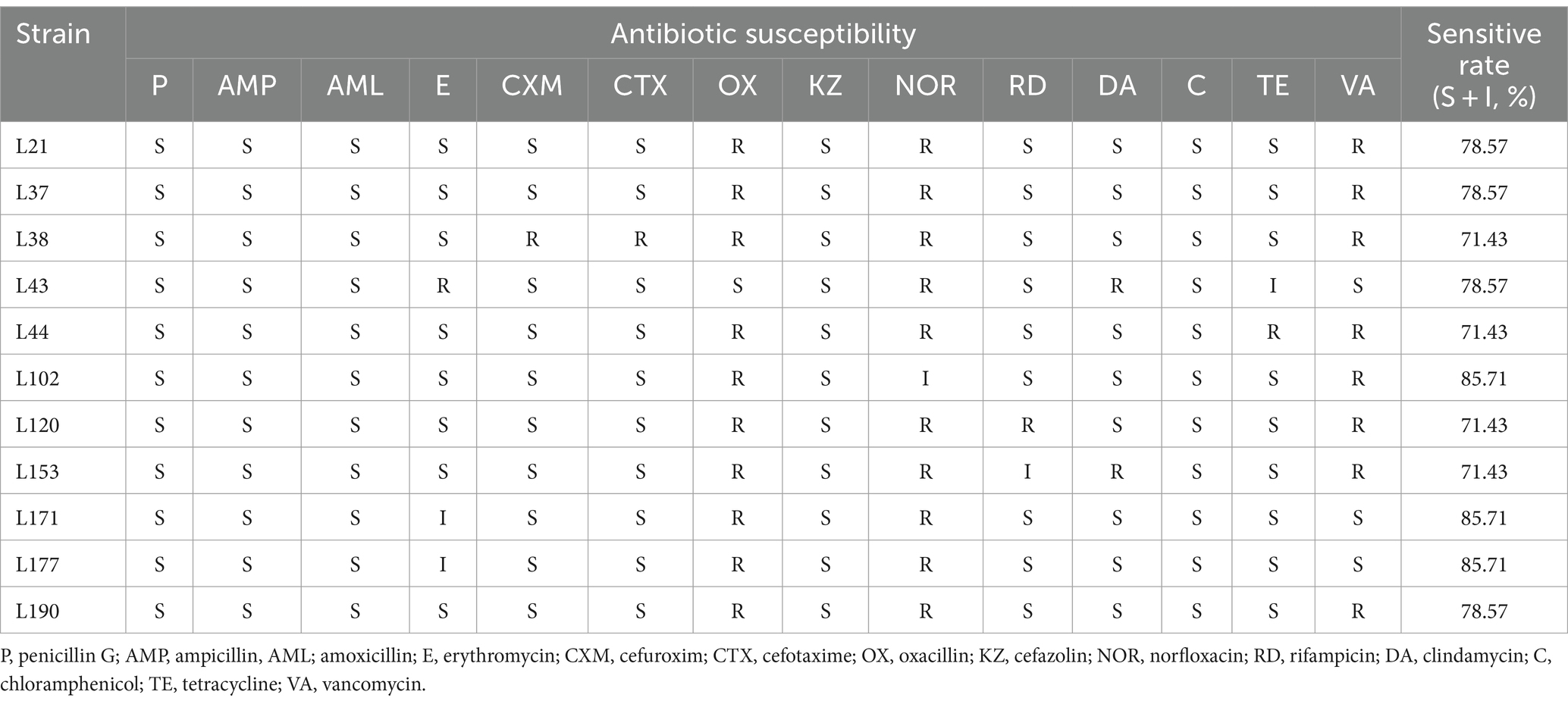
En la Tabla 8 se muestran los resultados de la evaluación de la susceptibilidad de 11 cepas de BAL a 14 antibióticos de uso común. La tasa de resistencia (tanto resistente como intermedia) fue del 0% (0/11) para la penicilina G, la ampicilina y la amoxicilina. Para la Eritromicina, la tasa de resistencia fue del 27,27% (3/11), para el Cefuroxim y la Cefotaxima del 9,09% (1/11), para la Oxacilina del 90,91% (10/11), para la Cefazolina del 0% (0/11), para la Norfloxacina del 100% (11/11), para la Rifampicina y la Clindamicina del 18,18% (2/11), para el Cloranfenicol del 0% (0/11), para la Tetraciclina del 18,18% (2/11), para la Vancomicina del 72,73% (8/11). Todos los aislados fueron susceptibles en más de un 70% a 14 antibióticos. L102, L171 y L177 mostraron la tasa de susceptibilidad más alta de 85.71%. Los resultados de los diámetros de las zonas de inhibición de las 11 cepas de BAL se muestran en la Tabla Suplementaria S1.
Evaluación de la capacidad antioxidante
Tolerancia a H2O2
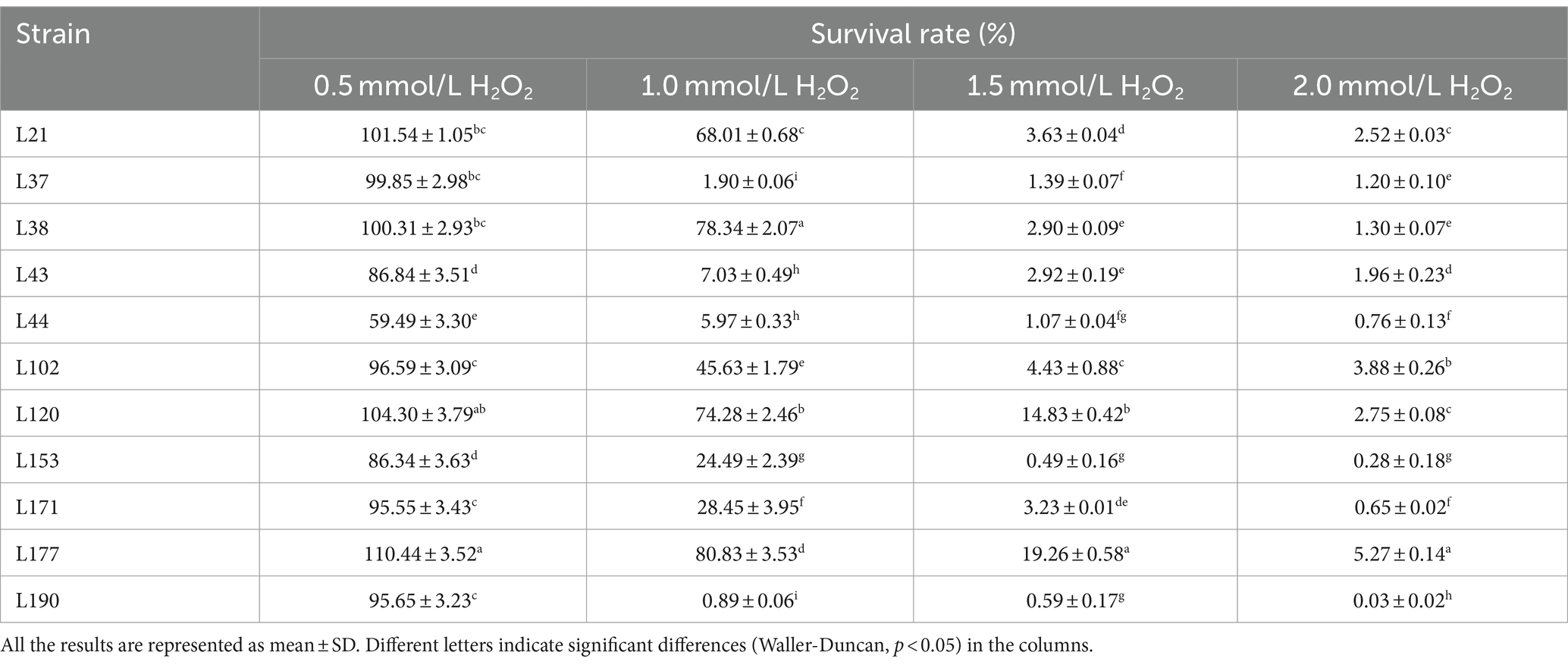
Las tablas 9 y 10 muestran las capacidades antioxidantes de las 11 cepas de BAL, incluida la tolerancia alH2O2, la capacidad de eliminación de radicales DPPH, la capacidad de eliminación de radicales hidroxilo y la capacidad de eliminación de aniones superóxido. Se encontró que once cepas de BAL sobrevivieron en ambientes con concentraciones variables deH2O2. Sin embargo, su tasa de supervivencia fue relativamente menor en 2 mmol/L H2O2 en comparación con concentraciones más bajas. Entre los aislados, L177 exhibió la mayor supervivencia en ambientes con diferentes concentraciones deH2O2.
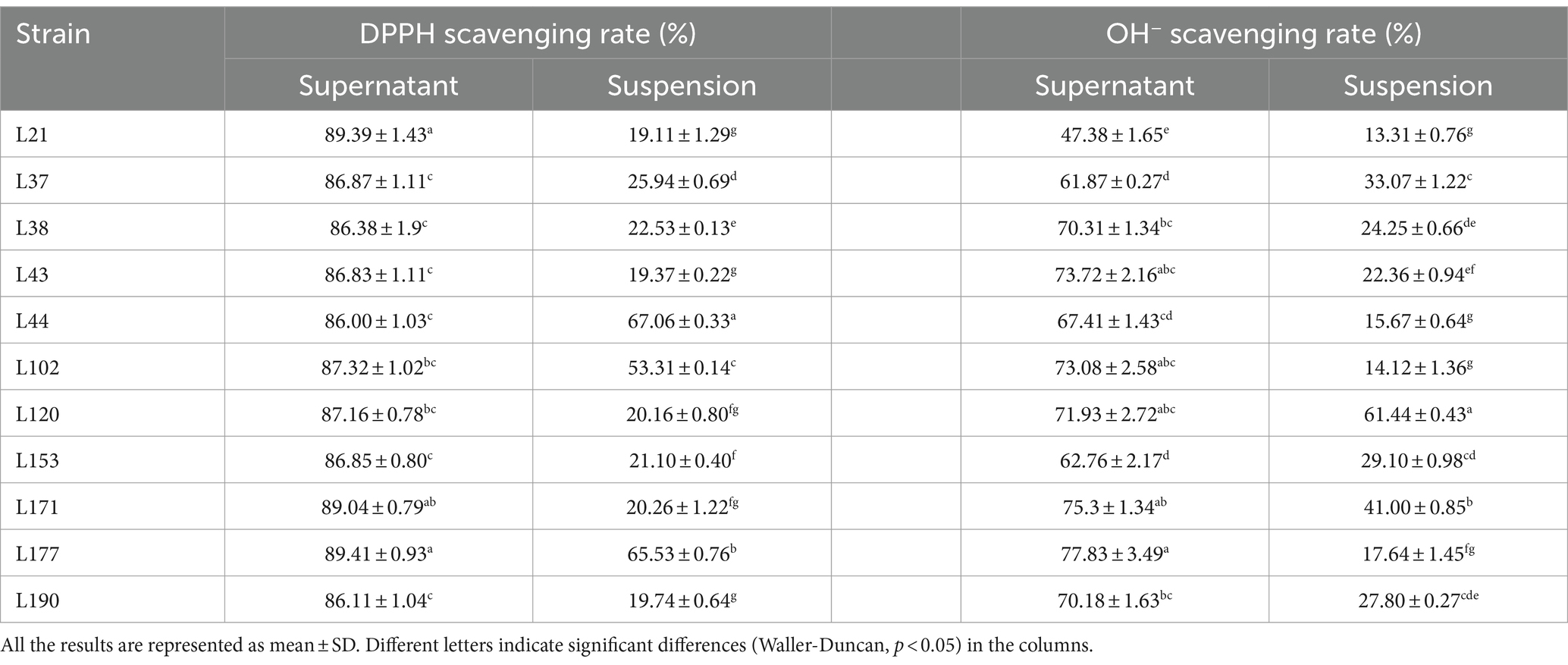
En experimentos de eliminación de radicales libres, los sobrenadantes libres superaron sistemáticamente a las suspensiones bacterianas. Las tasas de eliminación de las suspensiones bacterianas por DPPH oscilaron entre el 19,11 y el 67,06%. La tasa más alta (67,06 ± 0,33) se observó en la cepa L44. El aclaramiento DPPH de los sobrenadantes generalmente se mantuvo en el rango de 86.00 a 89.41%. El aclaramiento más alto (89,41 ± 0,93) se observó para la cepa L177. El aclaramiento de OH− de las suspensiones bacterianas osciló entre 13,31 y 61,44%, siendo la cepa L120 la que presentó el aclaramiento más alto (61,44 ± 0,43). Las tasas de remoción de OH− de los sobrenadantes oscilaron entre 47,38 y 77,83%, siendo la cepa L177 la que presentó la tasa más alta (77,834 ± 3,49). Ninguna de las cepas aisladas mostró la capacidad de eliminarO2-, ya sea en la suspensión bacteriana o en el sobrenadante libre de células.
Determinación de metabolitos
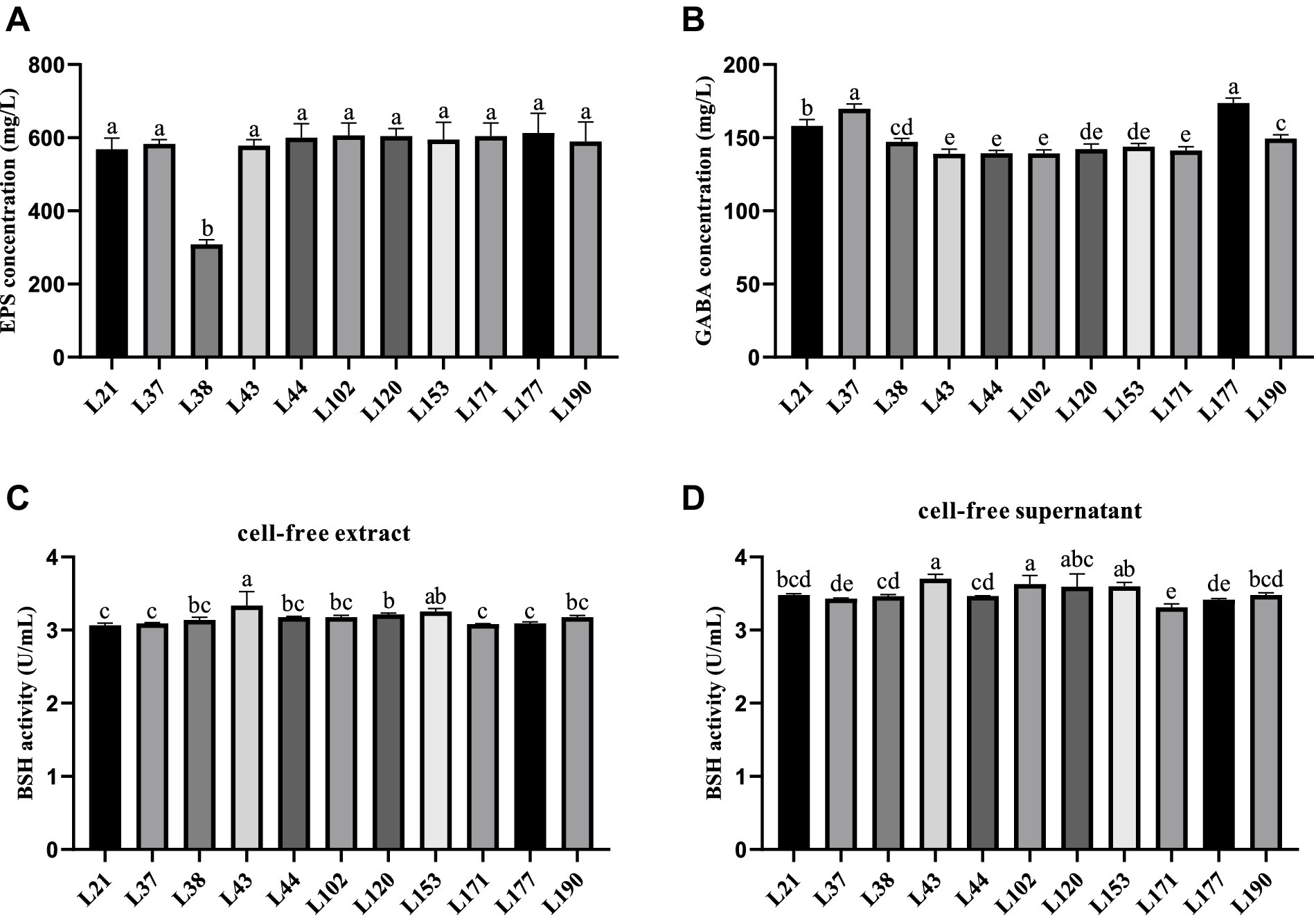
La Figura 3 muestra los resultados de la evaluación de metabolitos para las 11 cepas de BAL. Todas las cepas, excepto la cepa L38, exhibieron una capacidad de producción de EPS de más de 550 mg/L, lo que indica una buena capacidad de producción de EPS (Figura 3A). La capacidad de producción de GABA de los aislados osciló entre 139,09 y 173,79 mg/L, y las cepas L177 y L37 mostraron fuertes capacidades de producción de GABA, que fueron de 173,79 y 169,81 mg/L, respectivamente (Figura 3B). La capacidad del sobrenadante libre de células para producir BSH fue ligeramente mejor que la de los extractos libres de células, pero no hubo mucha variabilidad entre las cepas. La capacidad de producción de BSH del extracto libre de células de las cepas BAL osciló entre 3,06 y 3,33 U/mL, la cepa L43 mostró la actividad de BSH más fuerte (Figura 2C). Mientras que el sobrenadante libre de células de las cepas BAL osciló entre 3,31 y 3,70 U/mL, la cepa L43 también mostró la actividad BSH más fuerte (Figura 2D).
Discusión
En la actualidad, existe un creciente interés por los probióticos en medicina veterinaria (37). Los probióticos son una alternativa para reducir el uso de antibióticos y pueden tratar y prevenir infecciones, así como problemas gastrointestinales como indigestión y vómitos en animales de compañía (38-40). Sin embargo, los probióticos ampliamente utilizados en la investigación aplicada en caninos son principalmente de origen no canino, lo que puede conducir a una eficacia deficiente debido a problemas de homología (41). En este estudio, se examinaron 11 candidatos con buen rendimiento de crecimiento y tolerancia a ácidos y sales biliares de las heces de perros sanos. Se caracterizaron exhaustivamente estas posibles propiedades candidatas, incluidas las propiedades antipatógenas, la adherencia, la seguridad, la actividad antioxidante y el perfil de metabolitos. El objetivo fue evaluar su posible uso como probióticos caninos.
La actividad antipatógena y las propiedades de seguridad se consideran las propiedades más importantes para los laboratorios de probióticos. En el presente estudio, probamos la actividad antagonista de 11 candidatos contra 4 patógenos entéricos comunes. Se encontró que once cepas de BAL inhiben el crecimiento de todas estas cepas patógenas. Entre ellas, la actividad antibacteriana de las BAL frente a las cepas de Pseudomonas aeruginosa es generalmente mejor que la de otras bacterias patógenas, lo que puede estar relacionado con la producción de algunas enzimas que pueden degradar las biopelículas de Pseudomonas aeruginosa durante el crecimiento de las BAL (42). Además, Pseudomonas aeruginosa puede causar diversas infecciones en los perros, incluyendo queratitis ulcerosa, otitis, pioderma, infecciones del tracto urinario, infecciones de la piel y del tracto respiratorio (43). Esto sugiere que se espera que nuestros candidatos a BAL contribuyan al tratamiento y la prevención de estas enfermedades en perros en el futuro. En particular, en la preparación preliminar consideramos que los aminoglucósidos generalmente requieren metabolismo aeróbico para su actividad óptima, por lo que este antibiótico no se incluyó en la parte de las pruebas de susceptibilidad a los antibióticos de este estudio. Sin embargo, aunque la mayoría de las BAL son anaeróbicas o anaerobias facultativas, los estudios han demostrado que las BAL exhiben una variabilidad considerable en su susceptibilidad a los aminoglucósidos (44, 45). Además, las BAL pueden albergar genes de resistencia a los aminoglucósidos (46). Por lo tanto, en futuros estudios finales sobre aislados de LAB, incluiremos aminoglucósidos en el grupo de prueba para evaluar completamente la resistencia de estos aislados.
Las cepas de BAL deben adherirse a las células epiteliales intestinales del huésped para resistir la invasión de bacterias patógenas, mantener el equilibrio dentro de la microbiota intestinal y modular la respuesta inmunitaria (47). Esta adhesión se correlaciona con la hidrofobicidad de la superficie celular y la actividad de autoagregación. La hidrofobicidad mejorada de la superficie celular facilita la interacción entre las cepas de BAL y las células epiteliales, mientras que la actividad de autoagregación permite que las cepas de BAL alcancen altas densidades celulares dentro del intestino (48). En este estudio, se encontró que 11 cepas de BAL derivadas de caninos eran hidrofóbicas a solventes orgánicos como acetato de etilo, xilol y triclorometano, lo que sugiere que estas cepas pueden interactuar más estrechamente con las células epiteliales del huésped, mejorando así su capacidad para influir positivamente en la salud del huésped. Además, estas cepas exhibieron autocoagulación y adhesión a las células Caco-2. Entre las cepas, Lactobacillus acidophilus (L177) mostró la caracterización más fuerte. Resultados similares fueron reportados para Lactobacillus acidophilus M92 por Kos et al. (25). Se ha demostrado que los probióticos en estado periplásmico exhiben una tolerancia gastrointestinal superior y capacidad de adherencia en comparación con los probióticos en estado libre (49). En este estudio, las 11 cepas potenciales de BAL exhibieron sólidas capacidades de formación de biopelículas. Estos hallazgos indican que estas cepas poseen la capacidad de adherirse, colonizar y prosperar dentro del tracto gastrointestinal.
Cuando el cuerpo se somete a estrés oxidativo, produce grandes cantidades de especies reactivas de oxígeno (ROS), incluidos los radicalesH2O2, DPPH, OH y O2. El exceso de ROS ataca proteínas, lípidos, ácidos nucleicos y otras biomoléculas, exacerbando aún más el estrés oxidativo. El daño oxidativo a estas biomoléculas puede desencadenar la apoptosis y se asocia con una variedad de enfermedades, como inflamación, cáncer, aterosclerosis, envejecimiento y enfermedades degenerativas (50). Múltiples estudios han demostrado que las BAL poseen una potente capacidad antioxidante, capaz de inhibir el estrés oxidativo y mitigar el daño causado por las enfermedades asociadas (51). Se ha demostrado que las BAL ejercen su capacidad antioxidante a través de los sistemas de eliminación de ROS y redox (19). Es importante tener en cuenta que la capacidad antioxidante y los mecanismos de las diferentes especies de BAL varían. En este estudio, las 11 cepas de BAL derivadas de caninos demostraron una alta tolerancia a 0,5 y 1,0 mmol/L H2O2, así como una alta capacidad de eliminación de radicales DPPH y OH–. Sin embargo, no mostraron ninguna capacidad de barrido de radicalesO2−, lo que es consistente con los hallazgos de Kuda et al. (52). Además, las cepas L120 y L177 demostraron la capacidad de tolerar 1,5 mmol/L H2O2. Entre las cepas, L177 exhibió la mayor capacidad de eliminación de radicales DPPH y OH-. Estos resultados indican que las 11 cepas de BAL derivadas de caninos poseen una buena capacidad antioxidante, siendo Lactobacillus acidophilus L177 la que mejor se desempeña.
La producción de metabolitos beneficiosos es un factor crucial en la evaluación de los probióticos funcionales. El EPS, producido por las BAL durante la reproducción y el metabolismo, es un metabolito importante que promueve la salud animal. Los estudios han demostrado que el EPS puede tener efectos beneficiosos en el organismo a través de efectos antibacterianos, antivirales, antioxidantes, antitumorales e inmunomoduladores (53). Por lo tanto, el cribado de cepas de BAL que producen EPS y el análisis cuantitativo de EPS han atraído una atención considerable. Hamet et al. (54) examinaron 28 cepas de Lactobacillus spp. con capacidades de producción de EPS que oscilaron entre 20 y 370 mg/L. En este estudio, las 11 cepas de BAL demostraron una fuerte capacidad de producción de EPS que osciló entre 308,39 y 612,78 mg/L, lo que sugiere posibles efectos multifuncionales. Este estudio es uno de los pocos que evalúa la capacidad de producción de EPS de LAB a partir de canis. El GABA es un neurotransmisor inhibidor del sistema nervioso central de los mamíferos. Se ha investigado por sus funciones fisiológicas, como estimular el apetito, ayudar a la digestión, controlar la epilepsia, suprimir el crecimiento de células cancerosas y aumentar la función inmunológica (55, 56). Por lo tanto, el cribado de las BAL productoras de GABA es un foco de investigación actual. Sin embargo, hay pocos informes sobre BAL productoras de GABA de origen canino. En este experimento, descubrimos que 11 cepas de BAL produjeron 139,09-173,79 g/L de GABA, que es comparable a los 0,16 g/L producidos por Lactobacillus plantarum 8,014 según lo informado por Li et al. (57). Esto sugiere que las 11 cepas de BAL tienen el potencial de ser probióticos. La hidrolasa de sales biliares (BSH) es una enzima intracelular producida por la flora intestinal durante el crecimiento y la reproducción. Regula el equilibrio de los ácidos biliares en el huésped, afecta el metabolismo de los lípidos y controla el colesterol, así como regula las enfermedades intestinales (58). Por lo tanto, es importante realizar pruebas de detección de BAL que producen BSH. Pinto et al. encontraron que la actividad de BSH estaba ausente en los siete aislados de Lactobacillus examinados (59). Tsai et al. (60) examinaron 800 cepas de Lactobacillus y encontraron solo 22 con actividad BSH. En el presente estudio, se encontró que 11 cepas de BAL tenían actividad BSH, lo que sugiere posibles funciones probióticas.
Estos hallazgos sugieren que las cepas de BAL identificadas, en particular Lactobacillus acidophilus (L177), son prometedoras como probióticos multifuncionales para suplementos dietéticos caninos. Sus diversas capacidades ofrecen un enfoque holístico que puede mejorar la salud canina al modular la flora intestinal, mejorar las respuestas inmunitarias y proporcionar protección antioxidante.
Declaración de disponibilidad de datos
Todos los datos de secuenciación de cepas se han depositado en la base de datos del NCBI, a la que se puede acceder utilizando los números de acceso: PP863855.1, ON668235.1, PP863860.1, MT613450.1, PP863859.1, MT573827.1, PP863865.1, MT613610.1, PP863856.1, MT464031.1, PP863857.1, KF149390.1, PP863861.1, MT538725.1, PP863862.1, MT510311.1 PP863858.1, MT604779.1, PP863863.1, PP863864.1, MZ854114.1, MW029931.1. Otros datos para este estudio están disponibles a petición razonable de los autores correspondientes.
Declaración ética
Los estudios con animales fueron aprobados por el Comité de Ética y Bienestar Animal de la Universidad Agrícola de Sichuan. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
YL: Conceptualización, Curación de datos, Análisis formal, Metodología, Software, Supervisión, Redacción – borrador original, Redacción – revisión y edición. JW: Investigación, Software, Escritura – borrador original. HZ: Curación de datos, Redacción – borrador original. JX: Metodología, Redacción – borrador original. ZhZ: Supervisión, Redacción – revisión y edición. NS: Supervisión, Redacción – revisión y edición. HF: Supervisión, Redacción – revisión y edición. ZiZ: Software, Supervisión, Redacción – revisión y edición. XQ: Supervisión, Redacción – revisión y edición. GP: Supervisión, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio contó con el apoyo financiero del «13º Subproyecto Especial de Cinco Años» de China del Departamento Nacional de Ciencia y Tecnología (No. 2016YFD0501009).
Reconocimientos
Nos gustaría agradecer a Yueyan Zeng, Jinpeng Yang, Ruihu Wu, Wancheng Li y otros socios del laboratorio por su ayuda en nuestros experimentos.
Conflicto de intereses
XQ era empleado de New Ruipeng Pet Healthcare Group Co., Ltd.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1404580/full#supplementary-material
Referencias
1. Lee, W-J y Hase, K. Metabolitos generados por la microbiota intestinal en la salud y las enfermedades animales. Nat Chem Biol. (2014) 10:416–24. doi: 10.1038/nchembio.1535
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Simpson, KW y Jergens, AE. Dificultades y avances en el diagnóstico y tratamiento de la enfermedad inflamatoria intestinal canina. Vet Clin North Am Pequeño Anim Pract. (2011) 41:381–98. doi: 10.1016/j.cvsm.2011.02.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Westermarck, E, Skrzypczak, T, Harmoinen, J, Steiner, JM, Ruaux, CG, Williams, DA, et al. Diarrea crónica sensible a la tilosina en perros. J Veterinario Pasante Med. (2005) 19:177–86. doi: 10.1111/j.1939-1676.2005.tb02679.x
4. Aslam, B, Wang, W, Arshad, MI, Khurshid, M, Muzammil, S, Rasool, MH, et al. Resistencia a los antibióticos: un resumen de una crisis mundial. Infectar la resistencia a los medicamentos. (2018) 11:1645–58. doi: 10.2147/IDR. S173867
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Amar, C, Kittl, S, Spreng, D, Thomann, A, Korczak, BM, Burnens, AP, et al. Genotipos y resistencia a antibióticos de aislados caninos de Campylobacter jejuni. Microbiol veterinario. (2014) 168:124–30. doi: 10.1016/j.vetmic.2013.10.006
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Ben Said, L, Dziri, R, Sassi, N, Lozano, C, Ben Slama, K, Ouzari, I, et al. Distribución de especies, resistencia a antibióticos y rasgos de virulencia en enterococos caninos y felinos en Túnez. Acta Vet colgado. (2017) 65:173–84. doi: 10.1556/004.2017.018
7. Stefanetti, V, Bietta, A, Pascucci, L, Marenzoni, ML, Coletti, M, Franciosini, MP, et al. Investigación de la resistencia a antibióticos y la formación de biopelículas de cepas de Staphylococcus pseudintermedius aisladas de pioderma canino. Vet Ital. (2017) 53:289–96. doi: 10.12834/VetIt.465.2275.6
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Yoon, JW, Lee, K-J, Lee, S-Y, Chae, M-J, Park, J-K, Yoo, J-H, et al. Perfiles de resistencia a antibióticos de aislados de Staphylococcus pseudintermedius de pacientes caninos en Corea. J Microbiol Biotechnol. (2010) 20:1764–8.
9. Patangia, DV, Anthony Ryan, C, Dempsey, E, Paul Ross, R, y Stanton, C. Impacto de los antibióticos en el microbioma humano y consecuencias para la salud del huésped. Microbiología. (2022) 11:E1260. DOI: 10.1002/mbo3.1260
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Pessione, E. Contribución de las bacterias lácticas a la complejidad de la microbiota intestinal: luces y sombras. La célula frontal infecta el microbiol. (2012) 2:86. doi: 10.3389/fcimb.2012.00086
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Arqués, JL, Rodríguez, E, Langa, S, Landete, JM y Medina, M. Actividad antimicrobiana de las bacterias lácticas en productos lácteos e intestino: efecto sobre los patógenos. Biomed Res Int. (2015) 2015:584183. doi: 10.1155/2015/584183
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Hill, D, Sugrue, I, Arendt, E, Hill, C, Stanton, C, y Ross, RP. Avances recientes en fermentación microbiana para lácteos y salud. F1000Res. (2017) 6:751. doi: 10.12688/f1000research.10896.1
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Kim, K-T, Kim, J-W, Kim, S-I, Kim, S, Nguyen, TH y Kang, C-H. Efecto antioxidante y antiinflamatorio y propiedades probióticas de bacterias lácticas aisladas de heces caninas y felinas. Microorganismos. (2021) 9:1971. DOI: 10.3390/microorganismos9091971
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Linares, DM, Gómez, C, Renes, E, Fresno, JM, Tornadijo, ME, Ross, RP, et al. Bacterias lácticas y bifidobacterias con potencial para diseñar alimentos lácteos naturales, biofuncionales y saludables que promuevan la salud. Microbiol frontal. (2017) 8:846. doi: 10.3389/fmicb.2017.00846
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Martínez, RCR, Bedani, R, y Saad, SMI. Evidencia científica de los efectos sobre la salud atribuidos al consumo de probióticos y prebióticos: una actualización para las perspectivas actuales y los retos futuros. Hno. J Nutr. (2015) 114:1993–2015. doi: 10.1017/S0007114515003864
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Beasley, SS, Manninen, TJK, y Saris, PEJ. Bacterias lácticas aisladas de heces caninas. J Appl Microbiol. (2006) 101:131–8. doi: 10.1111/j.1365-2672.2006.02884.x
17. Coman, MM, Verdenelli, MC, Cecchini, C, Belà, B, Gramenzi, A, Orpianesi, C, et al. Caracterización probiótica de aislados de lactobacilos de heces caninas. J Appl Microbiol. (2019) 126:1245–56. doi: 10.1111/jam.14197
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Jang, H-J, Son, S, Kim, J-A, Jung, MY, Choi, Y-J, Kim, D-H, et al. Caracterización y ensayo funcional de probióticos caninos. Microbiol frontal. (2021) 12:625562. doi: 10.3389/fmicb.2021.625562
19. Feng, T, and Wang, J. Oxidative stress tolerance and antioxidant capacity of lactic acid bacteria as probiotic: a systematic review. Gut Microbes. (2020) 12:1801944. doi: 10.1080/19490976.2020.1801944
20. Zommiti, M, Feuilloley, MGJ, and Connil, N. Update of probiotics in human world: a non-stop source of benefactions till the end of time. Microorganisms. (2020) 8:1907. doi: 10.3390/microorganisms8121907
21. Yang, Q, and Wu, Z. Gut probiotics and health of dogs and cats: benefits, applications, and underlying mechanisms. Microorganisms. (2023) 11:2452. doi: 10.3390/microorganisms11102452
22. Zhang, W, Lai, S, Zhou, Z, Yang, J, Liu, H, Zhong, Z, et al. Screening and evaluation of lactic acid bacteria with probiotic potential from local Holstein raw milk. Front Microbiol. (2022) 13:918774. doi: 10.3389/fmicb.2022.918774
23. Liu, W, Chen, M, Duo, L, Wang, J, Guo, S, Sun, H, et al. Characterization of potentially probiotic lactic acid bacteria and bifidobacteria isolated from human colostrum. J Dairy Sci. (2020) 103:4013–25. doi: 10.3168/jds.2019-17602
24. Acharya, MR, y Shah, RK. Selección de aislados humanos de bifidobacterias para su uso como probióticos. Appl Biochem Biotechnol. (2002) 102-103:081–98. doi: 10.1385/abab:102-103:1-6:081
25. Kos, B, Susković, J, Vuković, S, Simpraga, M, Frece, J y Matosić, S. Capacidad de adhesión y agregación de la cepa probiótica Lactobacillus acidophilus M92. J Appl Microbiol. (2003) 94:981–7. doi: 10.1046/j.1365-2672.2003.01915.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Wang, J, Pu, Y, Zeng, Y, Chen, Y, Zhao, W, Niu, L, et al. Potencial multifuncional de cinco cepas de bacterias lácticas derivadas del panda gigante (Ailuropoda melanoleuca). Probióticos, proteínas antimicrobianas. (2023) 15:668–81. doi: 10.1007/s12602-021-09881-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Cheow, WS y Hadinoto, K. Probióticos de Lactobacillus rhamnosus similares a biopelículas encapsulados en microcápsulas de alginato y carragenina que exhiben una termotolerancia mejorada y resistencia a la liofilización. Biomacromoléculas. (2013) 14:3214–22. doi: 10.1021/BM400853D
28. Stepanovic, S, Vukovic, D, Dakic, I, Savic, B, y Svabic-Vlahovic, M. Una prueba de placa de microtitulación modificada para la cuantificación de la formación de biopelículas estafilocócicas. J Métodos de Microbiol. (2000) 40:175–9. doi: 10.1016/s0167-7012(00)00122-6
29. Pruebas de susceptibilidad a los antimicrobianos | Pruebas de MIC | Biosafe (s.f.). Disponible en: https://www.biosafe.fi/antimicrobial-susceptibility-testing-mic-testing (consultado el 6 de enero de 2024).
30. Xiong, L, Ni, X, Niu, L, Zhou, Y, Wang, Q, Khalique, A, et al. Aislamiento y cribado preliminar de una cepa de Weissella confusa de panda gigante (Ailuropoda melanoleuca). Probióticos, proteínas antimicrobianas. (2019) 11:535–44. doi: 10.1007/s12602-018-9402-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Lin, MY, y Chang, FJ. Efecto antioxidante de las bacterias intestinales Bifidobacterium longum ATCC 15708 y Lactobacillus acidophilus ATCC 4356. Dig Dis Sci. (2000) 45:1617–22. doi: 10.1023/a:1005577330695
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Alam, MN, Bristi, NJ y Rafiquzzaman, M. Revisión sobre la evaluación de la actividad antioxidante de los métodos in vivo e in vitro. Saudi Pharm J. (2013) 21:143–52. doi: 10.1016/j.jsps.2012.05.002
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Liu, W, Wang, H, Pang, X, Yao, W y Gao, X. Caracterización y actividad antioxidante de dos polisacáridos de bajo peso molecular purificados de los cuerpos fructíferos de Ganoderma lucidum. Int J Biol Macromol. (2010) 46:451–7. doi: 10.1016/j.ijbiomac.2010.02.006
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Ren, Z, Cui, T, Zeng, J, Chen, L, Zhang, W, Xu, X, et al. La molécula dirigida a la glucosiltransferasa inhibe la formación de biopelículas y la virulencia de Streptococcus mutans. Agentes antimicrobianos quimioterápicos. (2016) 60:126–35. doi: 10.1128/AAC.00919-15
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Zhang, Q, Xiang, J, Zhang, L, Zhu, X, Evers, J, van der Werf, W, et al. Optimización de las condiciones de remojo y germinación para mejorar el contenido de ácido gamma-aminobutírico en arroz integral germinado japónica e índica. J Funct Alimentos. (2014) 10:283–91. doi: 10.1016/j.jff.2014.06.009
36. Wang, Z, Zeng, X, Mo, Y, Smith, K, Guo, Y y Lin, J. Identificación y caracterización de una hidrolasa de sales biliares de Lactobacillus salivarius para el desarrollo de nuevas alternativas a los antibióticos promotores del crecimiento. Appl Environ Microbiol. (2012) 78:8795–802. doi: 10.1128/AEM.02519-12
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Bhogoju, S, y Nahashon, S. Avances recientes en la aplicación de probióticos en salud y nutrición animal: una revisión. Agricultura. (2022) 12:304. doi: 10.3390/agricultura12020304
38. Gupta, R, y Sharma, S. Papel de las alternativas a los antibióticos en la mitigación de la crisis de resistencia a los antimicrobianos. Indio J Med Res. (2022) 156:464–77. doi: 10.4103/ijmr. IJMR_3514_20
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Lee, D, Goh, TW, Kang, MG, Choi, HJ, Yeo, SY, Yang, J, et al. Perspectivas y avances en probióticos y el microbioma intestinal en animales de compañía. J Anim Sci Technol. (2022) 64:197–217. doi: 10.5187/jast.2022.e8
40. Silva, D. R., Sardi, J.De, Pitangui, N. S., Roque, S. M., Silva, A. C. B. y Rosalen, P. L. (2020). Los probióticos como terapia antimicrobiana alternativa: realidad actual y rumbos futuros. J Funct Alimentos 73,:104080. doi: 10.1016/j.jff.2020.104080
41. Hanifeh, M, Spillmann, T, Huhtinen, M, Sclivagnotis, YS, Grönthal, T y Hynönen, U. Adhesión ex vivo de Enterococcus faecalis y Enterococcus faecium a la mucosa intestinal de beagles sanos. Animales. (2021) 11:3283. doi: 10.3390/ani11113283
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Chappell, TC, y Nair, NU. Los lactobacilos modificados genéticamente muestran actividades anti-biofilm y supresoras del crecimiento contra Pseudomonas aeruginosa. Microbiomas de NPJ Biofilms. (2020) 6:48–10. doi: 10.1038/s41522-020-00156-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Comisión Técnica de Salud y Bienestar Animal de la EFSA (AHAW)Nielsen, SS, Bicout, DJ, Calistri, P, Canali, E, Drewe, JA, et al. Evaluación de la inclusión y categorización de enfermedades animales en el marco de la legislación zoosanitaria (Reglamento (UE) n.º 2016/429): Pseudomonas aeruginosa resistente a los antimicrobianos en perros y gatos. EFSA J. (2022) 20:E07310. doi: 10.2903/j.efsa.2022.7310
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Jaimee, G, y Halami, PM. Resistencia emergente a los aminoglucósidos en bacterias lácticas de origen alimentario: una amenaza inminente. Aplicación Microbiol Biotechnol. (2016) 100:1137–51. doi: 10.1007/s00253-015-7184-y
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Stefańska, I, Kwiecień, E, Jóźwiak-Piasecka, K, Garbowska, M, Binek, M y Rzewuska, M. Susceptibilidad antimicrobiana de las cepas de bacterias del ácido láctico de uso potencial como aditivos para piensos: el criterio básico de seguridad y utilidad. Frente Vet Sci. (2021) 8:687071. doi: 10.3389/fvets.2021.687071
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Rozman, V, Lorbeg, PM, Treven, P, Accetto, T, Janežič, S, Rupnik, M, et al. Información genómica sobre la resistencia a los antibióticos y el mobiloma de las bacterias lácticas y las bifidobacterias. Alianza de Ciencias de la Vida. (2023) 6:e202201637. doi: 10.26508/lsa.202201637
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Poimenidou, SV, Skarveli, A, Saxami, G, Mitsou, EK, Kotsou, M y Kyriacou, A. Inhibición del crecimiento, adherencia e invasión de Listeria monocytogenes en células Caco-2 por posibles bacterias probióticas del ácido láctico aisladas de muestras fecales de neonatos sanos. Microorganismos. (2023) 11:363. DOI: 10.3390/microorganismos11020363
Resumen de PubMed | Texto completo de Crossref | Google Académico
48. Buck, BL, Altermann, E, Svingerud, T y Klaenhammer, TR. Análisis funcional de factores de adhesión putativos en Lactobacillus acidophilus NCFM. Appl Environ Microbiol. (2005) 71:8344–51. doi: 10.1128/AEM.71.12.8344-8351.2005
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Wang, X, Cao, Z, Zhang, M, Meng, L, Ming, Z y Liu, J. Administración oral bioinspirada de la microbiota intestinal mediante el autorrecubrimiento con biopelículas. Sci Adv. (2020) 6:EABB1952. doi: 10.1126/sciadv.abb1952
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Chaudhary, P, Janmeda, P, Docea, AO, Yeskaliyeva, B, Abdull Razis, AF, Modu, B, et al. Estrés oxidativo, radicales libres y antioxidantes: posibles diafonías en la fisiopatología de las enfermedades humanas. Frente Químico. (2023) 11:1158198. doi: 10.3389/fchem.2023.1158198
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Nakagawa, H, y Miyazaki, T. Efectos beneficiosos de las bacterias del ácido láctico antioxidante. AIMS Microbiol. (2017) 3:1–7. doi: 10.3934/microbiol.2017.1.1
Resumen de PubMed | Texto completo de Crossref | Google Académico
52. Kuda, T, Kawahara, M, Nemoto, M, Takahashi, H y Kimura, B. Propiedades antioxidantes y antiinflamatorias in vitro de bacterias lácticas aisladas de intestinos de peces y peces fermentados de la región de Sanriku Satoumi en Japón. Alimentos Res Int. (2014) 64:248–55. doi: 10.1016/j.foodres.2014.06.028
53. Werning, ML, Hernández-Alcántara, AM, Ruiz, MJ, Soto, LP, Dueñas, MT, López, P, et al. Funciones biológicas de los exopolisacáridos de bacterias lácticas y sus beneficios potenciales para humanos y animales de granja. Seguridad alimentaria. (2022) 11:1284. doi: 10.3390/alimentos11091284
Resumen de PubMed | Texto completo de Crossref | Google Académico
54. Hamet, MF, Piermaria, JA, y Abraham, AG. Selección de cepas de lactobacilos productoras de EPS aisladas de granos de kéfir y caracterización reológica de las leches fermentadas. LWT Food Sci Technol. (2015) 63:129–35. doi: 10.1016/j.lwt.2015.03.097
55. Bravo, JA, Forsythe, P, Chew, MV, Escaravage, E, Savignac, HM, Dinan, TG, et al. La ingestión de la cepa de lactobacilos regula el comportamiento emocional y la expresión central del receptor GABA en un ratón a través del nervio vago. Proc Natl Acad Sci USA. (2011) 108:16050–5. doi: 10.1073/pnas.1102999108
Resumen de PubMed | Texto completo de Crossref | Google Académico
56. Dicks, LMT. Bacterias intestinales y neurotransmisores. Microorganismos. (2022) 10:1838. DOI: 10.3390/microorganismos10091838
Resumen de PubMed | Texto completo de Crossref | Google Académico
57. Li, Y, Chen, X, Shu, G y Ma, W. Cribado de bacterias lácticas productoras de ácido gamma-aminobutírico y su aplicación en la producción de arroz fermentado con Monascus. Acta Sci Pol Technol Aliment. (2020) 19:387–94. doi: 10.17306/J.AFS.0868
Resumen de PubMed | Texto completo de Crossref | Google Académico
58. Bourgin, M, Kriaa, A, Mkaouar, H, Mariaule, V, Jablaoui, A, Maguin, E, et al. Hidrolasas de sales biliares: en la encrucijada de la microbiota y la salud humana. Microorganismos. (2021) 9:1122. DOI: 10.3390/microorganismos9061122
Resumen de PubMed | Texto completo de Crossref | Google Académico
59. Pinto, A, Barbosa, J, Albano, H, Isidro, J y Teixeira, P. Cribado de bacterias bacteriocinógenas del ácido láctico y su caracterización como potenciales probióticos. Microorganismos. (2020) 8:393. doi: 10.3390/microorganismos8030393
Resumen de PubMed | Texto completo de Crossref | Google Académico
60. Tsai, C-C, Lin, P-P, Hsieh, Y-M, Zhang, Z, Wu, H-C y Huang, C-C. Potencial reductor del colesterol de las bacterias lácticas basado en la actividad de la hidrolasa de sales biliares y el efecto de cepas potentes sobre el metabolismo del colesterol in vitro e in vivo. Revista ScientificWorld. (2014) 2014:690752. doi: 10.1155/2014/690752
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: bacterias lácticas, caninos, probióticos, actividad antimicrobiana, adhesión, capacidad antioxidante, metabolito
Cita: Liu Y, Wang J, Zheng H, Xin J, Zhong Z, Liu H, Fu H, Zhou Z, Qiu X y Peng G (2024) Propiedades multifuncionales de las cepas de bacterias lácticas derivadas de las heces caninas. Frente. Vet. Sci. 11:1404580. doi: 10.3389/fvets.2024.1404580
Recibido: 21 de marzo de 2024; Aceptado: 10 de junio de 2024;
Publicado: 05 de agosto de 2024.
Editado por:
Luciana Rossi, Universidad de Milán, Italia
Revisado por:
Piera Anna Martino, Universidad de Milán, Italia
Daniel Hernández-Patlán, Universidad Nacional Autónoma de México, México
Atte Johannes Von Wright, Universidad de Finlandia Oriental, Finlandia
Dinesh Kumar Dahiya, Roswell Park Comprehensive Cancer Center, Estados Unidos
Derechos de autor © 2024 Liu, Wang, Zheng, Xin, Zhong, Liu, Fu, Zhou, Qiu y Peng. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Atribución (CC BY).
*Correspondence: Guangneng Peng, pgn.sicau@163.com; Xianmeng Qiu, moc.621@16324180031
†Estos autores han contribuido por igual a este trabajo y comparten la primera autoría
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía