Qué hacer y qué no hacer en modelos animales grandes de insuficiencia aórtica
Qué hacer y qué no hacer en modelos animales grandes de insuficiencia aórtica
 Nina E. Trimmel1, Melanie M. Hierweger1, Andrea S. Leuthardt1, Marian Kukucka3, Thorald Stolte2, Christian T. Stoeck1,4, Volkmar Falk2,3,5, Maximiliano Y. Emmert3,5, Markus Kofler3 y Nikola Cesarovic2,3*
Nina E. Trimmel1, Melanie M. Hierweger1, Andrea S. Leuthardt1, Marian Kukucka3, Thorald Stolte2, Christian T. Stoeck1,4, Volkmar Falk2,3,5, Maximiliano Y. Emmert3,5, Markus Kofler3 y Nikola Cesarovic2,3*- 1Centro de Investigación Quirúrgica, Hospital Universitario de Zúrich, Universidad de Zúrich, Zúrich, Suiza
- 2Departamento de Ciencias y Tecnología de la Salud, Instituto Federal Suizo de Tecnología, Zúrich, Suiza
- 3Departamento de Cirugía Cardiotorácica y Vascular, Centro Alemán del Corazón de Berlín, Berlín, Alemania
- 4Instituto de Ingeniería Biomédica, Universidad y ETH Zurich, Zúrich, Suiza
- 5Departamento de Cirugía Cardiovascular, Charité-Universitätsmedizin Berlin, Berlín, Alemania
La insuficiencia aórtica causada por fuga paravalvular (PVL) es una de las complicaciones más temidas después del reemplazo de la válvula aórtica transcatéter (TAVI) en pacientes. Los cerdos domésticos (Sus scrofa domestica) son un modelo de animales grandes populares para estudiar estas afecciones y desarrollar nuevas técnicas diagnósticas y terapéuticas. Sin embargo, los modelos basados en la implantación de la válvula protésica son intensivos en tiempo, costosos y a menudo dificultan más mediciones hemodinámicas, como el bucle fotovoltaico y el flujo de resonancia magnética 4D, al causar anomalías en el movimiento de la pared relacionadas con la implantación y la degradación de la calidad de la imagen de la resonancia magnética. Este estudio describe en detalle el establecimiento de un modelo porcino mínimamente invasivo adecuado para estudiar los efectos de la regurgitación aórtica «paravalvular» de leve a moderada en el rendimiento del ventrículo izquierdo (LV) y los patrones de flujo sanguíneo, particularmente bajo la influencia de la postcarga alterada, la precarga, el estado inotrópico y la frecuencia cardíaca Se utilizaron seis cerdos domésticos (blancos suizos grandes, hembras, 60-70 kg de peso corporal) para establecer este modelo. Los defectos en el punto de la bisagra de los leaflets aórticos y el anillo se crearon percutáneamente mediante la técnica de perforación y dilatación, ya sea en la cúspide coronaria derecha (RCC) o en la cúspide no coronaria (NCC). Los cambios hemodinámicos, así como el rendimiento del VI, se registraron mediante mediciones de bucle fotovoltaico, mientras que los patrones de flujo sanguíneo se evaluaron mediante resonancia magnética 4D. El rendimiento del VI se vio desafiado adicionalmente por la alteración farmacéutica de la inotropía cardíaca, la cronotropía y la poscarga. El trabajo presentado tiene como objetivo elaborar lo que se debe y no se debe hacer en los modelos porcina de insuficiencia aórtica y tiene la intención de profundizar la curva de aprendizaje para los investigadores que planean usar este o modelos similares dando información valiosa que van desde la selección de animales hasta las opciones de acceso vascular, la colocación del catéter de bucle fotovoltaico, la mejora de la adquisición y el
Introducción
Fondo
El nuevo inicio de la regurgitación aórtica se considera una de las principales complicaciones después de las intervenciones de reemplazo de la válvula aórtica. El flujo regurgitante entre la válvula protésica y el tejido aórtico nativo se denomina fuga paravalvular (PVL), y a menudo es causado por la malaposición de las dos estructuras y el consiguiente sellado insuficiente. Incluso con válvulas cardíacas transcatéter de nueva generación, implantadas en pacientes con zona de aterrizaje de dispositivo favorable (válvula aórtica tricúspide, sin calcificación grave del tracto de salida del ventrículo izquierdo), la tasa de PVL al menos leve sigue siendo de alrededor del 30 % (1) y aumenta a casi el 60 % para los pacientes con zonas de aterrizaje En los pacientes, la mayoría de las PVL se consideran hemodinámicamente insignificantes; sin embargo, la literatura contemporánea sugiere que incluso la PVL leve se asocia con una peor supervivencia postoperatoria (2). Experimentalmente, se podría demostrar que ya una PVL de leve a moderada altera los patrones de flujo sanguíneo intraventricular al alterar la formación de vórtices fisiológicos, causando así un aumento potencial en la disipación de la energía del ventrículo izquierdo (3). Todas las circunstancias que alteran el gasto cardíaco deben interpretarse a la luz de la tendencia actual a utilizar válvulas cardíacas transcatéter en pacientes más jóvenes y físicamente más activos. Los modelos de animales de alta fidelidad con PVL de leve a moderado son una necesidad insatisfecha de proporcionar evidencia de la importancia de dicha alteración dinámica de fluidos en relación con la reducción de la función cardíaca.
Rosa et al. describieron anteriormente un modelo porcino de PVL creado reemplazando la válvula aórtica nativa por una de laboratorio, mientras dejaban intencionalmente espacio para el flujo regurgitante entre la válvula y la pared aórtica (4). Aunque el modelo parece ofrecer oportunidades para desarrollar y probar enfoques terapéuticos para reducir o eliminar el flujo regurgitante, el modelo no solo es difícil de reproducir, sino que también dificulta la evaluación de las características del flujo sanguíneo en detalle con la resonancia magnética de flujo 4D, ya que la calidad de la imagen se degrada, dependiendo del tipo de stent y la orientación del stent en relación con el Para superar esta limitación, desarrollamos un modelo animal grande de PVL leve mediante perforación transcatéter de la válvula aórtica en el punto de la bisagra del anillo y el leaflet (3). Después de la selección de animales de tamaño adecuado libres de patógenos que podrían influir en la salud cardíaca, los defectos de la válvula aórtica se crean de forma percutánea y transcatéter utilizando la técnica de perforación y dilatación. En detalle, bajo la guía fluoroscopia y ecocardiográfica, se navega una vaina icable hacia la cúspide no coronaria (NCC) o corinaria derecha (RCC) de la válvula aórtica. Una vez en posición, se utiliza un cable guía coronario rígido para perforar el punto de la bisagra del leaflet-anulo. Luego se pasa un globo coronario sobre el cable y se infla para producir un defecto estandarizado que causa regurgitación aórtica (es decir, PVL). Para una evaluación exitosa de los efectos en el rendimiento del ventrículo izquierdo (LV), es fundamental establecer una posición estable del catéter de bucle fotovoltaico resistente a las manipulaciones durante la creación de PVL, lo que permite una comparación directa entre el estado saludable y los efectos hemodinámicos inmediatos de PVL. Además, los medicamentos se pueden usar para alterar los parámetros hemodinámicos, como la poscarga cardíaca (es decir, la presión y resistencia aórtica), la frecuencia cardíaca y la contractilidad, que se sabe que influyen en la gravedad y los efectos negativos de la regurgitación aórtica. Por lo tanto, el modelo animal también simula a los pacientes hipertensos y/o taquicárdicos que sufren de regurgitación aórtica, lo que potencialmente conduce a una mejor comprensión de los procesos subyacentes responsables del remodelado cardíaco adverso en esta población.
Los pacientes que sufren de PVL grave muestran síntomas claros y pueden beneficiarse de la terapia dirigida a las directrices. Sin embargo, para aquellos pacientes que solo muestran PVL de leve a moderado, la situación es menos clara. Esta población muestra una amplia variedad de síntomas y un espectro terapéutico que va desde el monitoreo de enfermedades hasta las intervenciones invasivas. Además, actualmente, la influencia del origen del chorro PVL y sus efectos en el flujo y la función del ventrículo izquierdo no se tienen en cuenta en gran medida. Por lo tanto, el propósito principal de este modelo es proporcionar una plataforma de gran animal traslacional reproducible, rentable y éticamente justificable para investigar los efectos fluidos dinámicos y energéticos de la PVL aórtica de leve a moderada que se origina en las áreas de la válvula aórtica clínicamente asociadas con la presentación de PVL, es decir, la cúspide derecha
El trabajo presentado tiene como objetivo elaborar los hacer y no hacer al establecer un modelo de insuficiencia aórtica/PVL para estudios hemodinámicos. Beneficiarse de las curvas de aprendizaje de los demás reducirá la redundancia en la investigación con animales y mejorará la calidad de los datos de acuerdo con los principios 3R establecidos en todo el mundo como el enfoque ético para regular el uso de animales con fines científicos (6).
La selección de animales de tamaño adecuado libres de patógenos cardíacos es un requisito previo clave
El uso del cerdo doméstico (Sus Scrofa Domestica) en estudios preclínicos desempeña un papel importante en la evaluación de la eficacia y seguridad de los nuevos dispositivos médicos cardíacos antes de su uso en ensayos clínicos en humanos (7-9). Sin embargo, al planificar y ejecutar los ensayos porcinos, se debe tener en cuenta una variedad de aspectos. El estado de salud de los cerdos domésticos varía mucho dependiendo de su origen; por lo tanto, se debe realizar un cribado previo riguroso de las enfermedades que afectan a la salud y la función cardíaca. Una multitud de enfermedades infecciosas y deficiencias nutricionales pueden alterar la salud cardiovascular de los cerdos comerciales. Entre los agentes infecciosos más importantes se encuentran el Circovirus porcino tipo 2 (PCV2), que se ha asociado previamente con insuficiencia cardíaca en cerdos jóvenes debido a la miocarditis necrotizante aguda o fibrosante crónica, y vasculitis crónica en múltiples órganos (10). El virus de la encefalomicarditis (EMCV) que causa miocarditis aguda y muerte súbita en cerdos pre-sebrados y fracaso reproductivo en cerdas (11) se ha convertido en motivo de preocupación reciente en el contexto del xenotrasplante. Aunque se describe como asintomático en cerdos mayores, el virus parece persistir en el miocardio durante un período prolongado (11). Haemophilus parasuis, la causa de la enfermedad de Glasser, suele causar pleuritis serofibrinosa, pericarditis, peritonitis y artritis (12). La endocarditis porcina es otra entidad de la enfermedad bien conocida, siendo Streptococcus suis y Erysipelothrix rhusiopathiae las bacterias dominantes aisladas de las válvulas cardíacas infectadas (13). La cardiopatía de la morera en cerdos se caracteriza por lesiones de miocarditis hemorrágica aguda y necrosis miocárdica y se ha asociado con deficiencia de vitamina E/selene (14), estudios recientes con sospechando una asociación viral en la enfermedad (15).
Las diferencias anatómicas entre cerdos y humanos son otro aspecto a tener en cuenta al usar este modelo animal. Por lo tanto, la mayoría de las diferencias surgen de que los cerdos son cuadrúpedos, por lo que tienen un tórax más estrecho en laterolateral en lugar de en la orientación dorso-ventral, a diferencia de los humanos que presentan un pecho «comprimido» con el dorso-ventralmente (16). En consecuencia, el eje cardíaco principal del corazón porcino se inclina ventrocaudalmente y forma un ángulo más pronunciado. Sin embargo, una gran mayoría de las dimensiones cardíacas en los cerdos parecen correlacionarse bien con el ser humano adulto promedio (16), aunque el volumen y las dimensiones del auricular izquierdo pueden ser más pequeños en los cerdos que el tamaño del anillo mitral equivalente que se ve en los humanos (17). Además, la masa cardíaca relativa en ciertas razas de cerdos parece disminuir significativamente de 5 gr/kg de peso corporal a solo 2,3 a 2,9 gr/kg de peso corporal, a medida que se alcanza la madurez (18). Como la selección preexperimental de cerdos se basa comúnmente en el peso corporal, es necesario considerar esta correlación no lineal entre la masa corporal y el tamaño cardíaco. En general, en los implantes de válvulas aórtica transcatéter (TAVI) en cerdos, las complicaciones a menudo se asocian con el exceso o subtensificación de la válvula y son comparables a las observadas en los seres humanos, a saber, la oclusión coronaria, la ruptura de la raíz aórtica o la postimplantación del anillo, PVL o la La válvula cardíaca, en particular, el tamaño de la válvula aórtica en los ensayos preclínicos requiere un enfoque diferente al que se utiliza normalmente en las clínicas. En comparación con el anillo calcificado enfermo de los pacientes, el anillo de un cerdo sano es más dinámico durante el ciclo cardíaco, lo que exige un exceso de tamaño adecuado para evitar problemas de migración y estabilidad que obstaculicen el sellado suficiente entre la válvula protésica y la pared aórtica (21).
La combinación de fluoroscopia e imágenes de ultrasonido es necesaria para guiar la creación de PVL y evaluar clínicamente su posición y gravedad
Sin embargo, la fluoroscopia se utilizó para obtener una imagen de la posición de la vaina ictable, ya que no permite la visualización de las estructuras cardíacas de tejidos blandos, lo que es necesario para proporcionar una visualización adecuada de la anatomía cardíaca dirigida necesaria para la creación exitosa de PVL, la fluoroscopia se complementa mejor con ultrasonido. Mientras que la ecocardiografía transtorácica (TTE) en cerdos es técnicamente difícil por el tórax en forma de quilla mencionado anteriormente y por las costillas estrechamente espaciadas (22), se puede obtener una vista de tres cámaras, que muestra un eje largo del ventrículo izquierdo y la válvula aórtica colocando una sonda de eco transesofágico (TEE) Para obtener una vista simultánea del eje corto del tracto de salida del ventrículo izquierdo y la válvula aórtica, se puede introducir una sonda de ecocardiografía intracardíaca (ICE) a través de la vena femoral y colocarla en una ubicación de AR baja en una posición posteroflexida seguida de una rotación en el sentido contrario a las agujas del reloj de 60 La combinación de estas modalidades de imagen permite una perforación del leaflet valvular aórtico preciso y reproducible.
La resonancia magnética 4D se complementa mejor con el análisis de bucle fotovoltaico para evaluar los efectos de la PVL en la función del VI
Para una evaluación exhaustiva de la PVL en la hemodinámica del ventrículo izquierdo, los datos de flujo de resonancia magnética 4D se complementan mejor con el análisis del bucle fotovoltaico del ventrículo izquierdo, que se considera el estándar de oro para evaluar la función cardíaca durante cada ciclo cardíaco (26). Los bucles fotovoltaicos ofrecen información valiosa sobre la fisiopatología de la PVL en el modelo porcino. Sin embargo, el análisis del bucle fotovoltaico no solo requiere conocimiento de las particularidades anatómicas y fisiológicas del cerdo, sino también habilidades analíticas integrales para un procesamiento adecuado de datos. Por lo tanto, los estudios preclínicos integrales se benefician en gran medida de las colaboraciones interdisciplinarias de veterinarios, médicos e ingenieros, para garantizar el bienestar animal, la traducibilidad del estudio y la reproducibilidad mediante datos de alta calidad.
Materiales y equipos
animales
• Cerdos blancos grandes, hembras, 60-70 kg de peso corporal
Drogas
• Ketamina (Ketasol®-100 ad us.vet. ; Dr. E. Graeub AG, Berna, Suiza; 15 mg/kg de peso corporal).
• Azaperon (Stresnil® ad us.vet. ; Elanco Tiergesundheit AG, Basilea, Suiza; 2 mg/kg de peso corporal).
• Atropina 1 % (Atropinsulfat KA veterinario 0,1%; Kantonsapotheke, Suiza; 0,05 mg/kg de peso corporal).
• Ungüento para los ojos con vitamina A (vitamina A Blache Augensalbe, Bausch & Lomb Swiss AG, Zug, Suiza).
• Propofol (Propofol ® Lipuro 1%, B. Braun Medical AG; Sempach, Suiza; 1-2 mg/kg de peso corporal (bolo), 3-0 mg/kg/h de perfusión continua).
• Isoflurano (AttaneTM Isoflurane ad.us.vet., Piramal Enterpr. India, Lyssach, Suiza, 1–2%).
• Buprenorfina (Temgesic® Indivior Schweiz AG, Baar, Suiza; 0,01 mg/kg).
• Amiodarona (Cordarone®, Sanofi-Aventis (Suisse) SA, Vernier, Suiza, 150 mg/100 ml 5% de glucosa, goteo lento).
• Solución de Ringer (Ringerfundin®, B. Braun Medical AG, Sempach, Suiza, 5 ml/kg/h).
• Heparina de sodio (Na-Heparina, B. Braun Medical AG, Sempach, Suiza).
• Dobutamina (Dobutrex®, Teva Pharma AG, Basilea, Suiza, 2,5 mg/ml, infusión continua hasta su efecto).
• Fenilefrina (Neo-Synephrine HCl, Ospedialia AG, Hünenberg, Suiza, 0,1 mg/ml, infusión continua a efecto).
• Solución salina hipertónica (Natrium Chloratum Sintetica 25%, Sintetica S.A., Mendrisio, Suiza, 0,25 ml/kg 15% NaCl hipertónico).
Materiales
• Catéter intravenoso (BD Venflon TM Pro Safety, Becton Dickinson Infusion Therapy, Helsingborg, Suecia, 18G).
• Tubo endotraqueal (Bivona®, ID: 9 mm, OD: 12,4 mm, 37FR, Longitud: 56 cm, Globo: 5 cm).
• Catéter de balón urinario (Rüsch®, Ch 12, Teleflex Medical GmbH, Belp, Suiza).
• Vaina de acceso vascular (Avanti®+ Introducer, 6-10 F, Cordis®, Miami Lakes FL, EE. UU.).
• Sonda de ecocardiografía intracardiaca (ICE) (catéter ViewFlexTM Xtra ICE, St.Jude Medical, Minnesota, EE. UU.).
• Sonda de eco transesofágica (transductor TEE X7-2T, Philips, Ámsterdam, Países Bajos).
• Funda de guía direccional direccional (AgilisTM EPI Steerable Sheath, 8.5F, St. Jude Medical, Minnetonka, MN, EE. UU., o DESTINOTM Alcance 8,5F ID, longitud utilizable 77 cm, curva 17 mm, Oscor®, Florida, EE. UU.).
• Catéter de bucle fotovoltaico (catéter Ventri-Cath; 5F, 12E, 10 mm, DField, Pigtail, 122 cm; ADInstruments Limited, Oxford, Reino Unido).
• Catéter de cola de cerdo (Infiniti 5F PIG 145.038 125 cm, Cordis Corporation, Miami Lakes, EE. UU.).
• Alambre guía J-tip (Rosen, Heavy-Duty Corewire J-tip, 0,035″, 180 cm, Cordis®, Miami Lakes FL, EE. UU.).
• Alambre guía extra afilado (Lunderquist®, 0,035″260 cm, Cook Medical, Bjaeverskov, Dinamarca).
• Alambre guía coronario (Alambre guía IRON MAN, 0,014′′ 190 cm, Abbott Vascular, Santa Clara CA, EE. UU.).
• Globo PTCA (Globo de dilatación NC Emerge MONORAILTM PTCA 5 × 12 mm, Boston Scientific Corporation, Marlborough, MA, EE. UU.).
Equipo
• Máquina de anestesia (Dräger Fabius GS, Dräger Medical, Lübeck, Alemania).
• Monitoreo anestésico (Dräger Infinity, Dräger Medical, Lübeck, Alemania).
• Fluoroscopia C-Arm (Allura Xper FD20, Philips Healthcare, Horgen, Suiza).
• Máquina de ultrasonido (TEE) (iE33, Philips Healthcare, Horgen, Suiza).
• Máquina de ultrasonido (ICE) (CX50, Philips Healthcare, Horgen, Suiza).
• Sistema DSI Ponemah (DataScience International, St. Paul, Minnesota, EE. UU.).
• Millar Mikro-Tip® Pressure Volume System (MPVS) Ultra Foundation Systems (AD Instruments, Oxford, Reino Unido).
• Unidad de adquisición de Powerlab 16/35 (AD Instruments, Oxford, Reino Unido).
• Escáner clínico de RM 3T (Ingenia, Philips Healthcare, Best, Países Bajos).
Métodos
Adquisición de animales, chequeo médico y anestesia
Seis cerdos domésticos (n = 6; hembras blancas grandes y suizas intactas, 60-70 kg de peso corporal) fueron incluidos en este estudio aprobado por el Comité local de Investigación Experimental de Animales (Oficina Veterinaria Cantonal de Zúrich, Suiza) con los números de licencia ZH213/2019. La vivienda de animales y todos los procedimientos experimentales se ajustaban a la ley suiza de protección del bienestar animal y se ajustaban a la Directiva europea 2010/63/UE del Parlamento Europeo y al Consejo sobre la protección de los animales utilizados con fines científicos, y a la Guía para el cuidado y el uso de los animales de laboratorio. Todos los cerdos utilizados en este estudio fueron examinados bajo el programa nacional de vigilancia de la peste porcina clásica y africana, la fiebre aftosa, la enfermedad de Aujeszky, el síndrome reproductivo y respiratorio porcino (RSPR) y la enfermedad vesicular porcino. Los lechones se vacunan contra H. parasuis y Circovirus porcino a la edad de 3 semanas y 6 semanas. Las cerdas se vacunan a la edad de 5 a 7 meses y repetidamente antes de dar a luz contra el Parvovirus y E. rhusiopathiae. Además, las cerdas se vacunan contra Escherichia coli a las 5 y 3 semanas antes del parto. A su llegada, todos los cerdos deben ser evaluados clínicamente por observación (comportamiento general, postura y marcha, lesiones visibles, color de la piel, patrón respiratorio, apetito, defecación y micción) y si se indica mediante un examen físico.
La auscultación cardiopulmonar en el cerdo despierto no es factible, ya que restringir al animal es estresante y causará una vocalización fuerte. Los cerdos utilizados en este estudio fueron premedicados con una inyección intramuscular de ketamina (Ketasol®-100 ad us.vet. ; Dr. E. Graeub AG, Berna, Suiza; 15 mg/kg de peso corporal), azaperona (Stresnil® ad us.vet. ; Elanco Tiergesundheit AG, Basilea, Suiza; 2 mg/kg de peso corporal) y atropina (Atropinsulfat KA vet 0,1%; Kantonsapotheke, Suiza; 0,05 mg/kg de peso corporal). La anestesia se indujo mediante la administración intravenosa de propofol (Propofol ® Lipuro 1%, B. Braun Medical AG; Sempach, Suiza; 1-2 mg/kg de peso corporal) para lograr la relajación y la disminución del reflejo de la deglución suficiente para la intubación. Luego se mantuvo la anestesia con isoflurano (AttaneTM Isoflurane ad.us.vet., Piramal Enterpr. India; Lyssach, Suiza, 1,5-3 vol%) en combinación con un 50 % de oxígeno bajo respiración espontánea, y en combinación con una infusión de tasa constante de propofol (Propofol ® Lipuro 1%, B. Braun Medical AG; Sempach, 5-10 mg/kg/h). Para el medicamento para el dolor, se administró buprenorfina (Temgesic® Indivior Schweiz AG, Baar, Suiza; 0,01 mg/kg). Todos los cerdos recibieron amiodarona (Cordarona, Sanofi-Aventis (Suisse) SA, Vernier, Suiza, 150 mg/100 ml 5% de glucosa) como agente antiarrítmico, ya antes de la instrumentalización. Solución de Ringer (Ringerfundin®, B. Braun Medical AG, Sempach, Suiza, 5 ml/kg de peso corporal/h) se infundió a lo largo del experimento. Se realizó un análisis de gases en sangre regularmente y se monitoreó el gasto urinario entre 0,5 y 1 ml/kg de peso corporal/h y se ajustó la sustitución de líquidos en consecuencia.
Instrumentalización animal
La colocación percutánea guiada por ultrasonido de una vaina introductora arterial femoral (Avanti®+ Introducer, 6F, Cordis®, Miami Lakes FL, EE. UU.), una vaina introductora venosa femoral (Avanti®+ Introducer, 10F, Cordis®, Miami Lakes FL, EE. UU.) y una vaina introductora de la arteria
Preparación, colocación y optimización de datos de bucles fotovoltaicos
Preparación del banco del catéter
Antes del experimento, el catéter de bucle fotovoltaico y la cubeta de calibración de rho se colocaron en agua tibia (37 °C) durante 30 minutos. Colocar el catéter de bucle fotovoltaico en una vaina de acceso vascular largo evita así la falta de torsión del catéter antes de su uso. Durante este período, se puede preparar una solución salina hipertónica del 15 % para la corrección de la conductancia paralela, basada en la recomendación de AD Instruments. Mediante el uso de una solución hipertónica del 15 %, se logra una buena calibración sin efectos adversos en el animal.
Después de la inmersión requerida, se extrajo una pequeña cantidad de sangre arterial (<1 ml) para medir la resistividad, la conductividad y la temperatura de la sangre con la cubeta de rho. La medición final debe tomarse cuando la temperatura coincida con la temperatura central esperada del animal. Los cambios importantes en la composición sanguínea o la temperatura corporal pueden justificar mediciones repetidas de ró cuvette intraprocedimiento. El sensor de presión del catéter de bucle fotovoltaico se pone a cero a temperatura corporal sumergiendo la punta justo debajo de la superficie de una solución salina fisiológica.
Colocación del catéter y calibración in situ
Stonko et al. (27) describieron anteriormente el punto de acceso óptimo para que el avance del catéter PV Loop en cerdos sea a través de la arteria braquial derecha, o cualquiera de las arterias carótidas, con cada una de estas rutas de acceso, el catéter se puede dirigir naturalmente hacia el arco aórtico ascendente. Sin embargo, como la arteria carótida se utilizó en nuestro entorno para introducir la vaina direccional para la perforación de la hoja aórtica, utilizamos la arteria femoral izquierda para insertar el catéter de bucle fotovoltaico. La falta de un lumen de cable guía ha demostrado que hace que la colocación del catéter de bucle fotovoltaico sea más difícil, ya que es necesario navegar por el arco aórtico para cruzar la válvula aórtica. Para facilitar la dirección del catéter de bucle fotovoltaico sobre el arco y a través de la válvula aórtica, se puede colocar un catéter de coleta en el seno aórtico para mejorar la orientación durante la fluoroscopia. Después de colocar el catéter de bucle fotovoltaico en el ventrículo izquierdo, es necesario asegurarse de que no haya saturación de las lecturas de volumen segmentario, lo que se presentaría como líneas máximas y horizontales y requeriría un aumento de la ganancia de volumen en el software MPVS. Para generar bucles fotovoltaicos acumulativos significativos, es necesario determinar los segmentos de volumen intraventricular relevantes. El catéter de coleta en el seno aórtico ayuda a visualizar el nivel de la válvula aórtica, por lo que el número de segmentos de catéter de bucle fotovoltaico por debajo de la válvula aórtica se puede determinar fácilmente en fluoroscopia (Figuras 1A, B). Dentro de LabChart, los segmentos no relevantes se pueden reconocer como bucles de cruce con la forma del número 8 (Figura 1C).
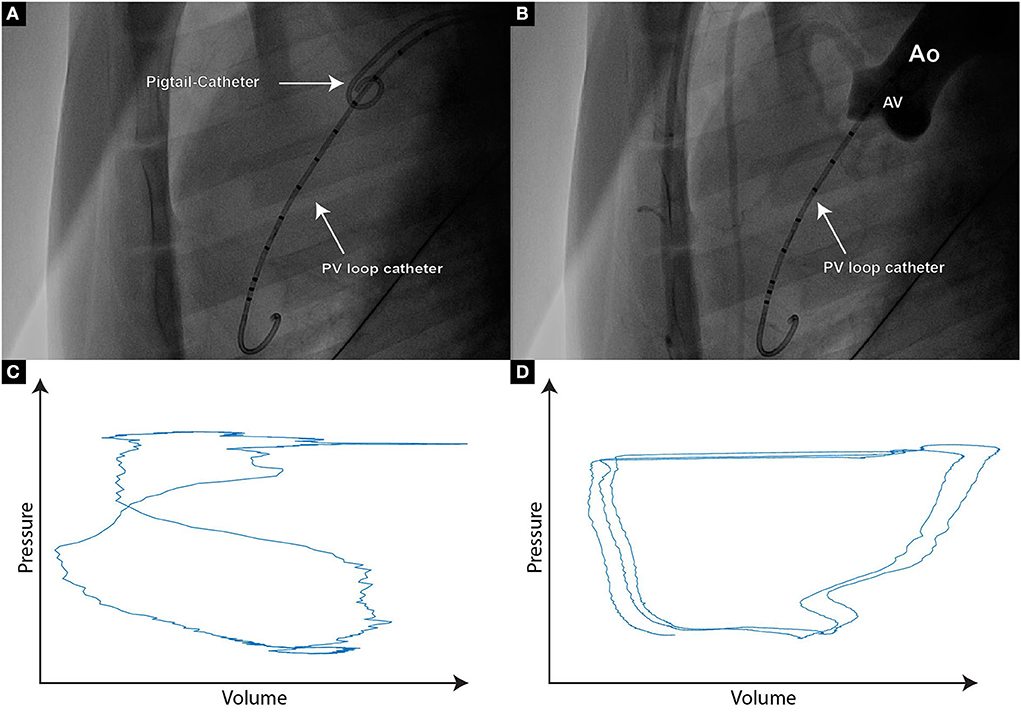 FIGURA 1. (A) Imagen fluoscópica de un catéter PigTail que se coloca en la cúspide de la válvula aórtica, lo que permite la evaluación de los segmentos del catéter de bucle fotovoltaico que se colocan de manera confiable dentro del ventrículo izquierdo; (B) Si la incertidumbre con respecto a los segmentos de bucle fotovoltaico dentro del ventrículo izquierdo persiste, el Dichos segmentos no deben incluirse en un análisis adicional; (D) Curvas de bucle fotovoltaico compuesto de paradoja que muestren el aumento de volumen durante la sístole y la disminución de volumen durante la diástole. Si se producen tales curvas, es necesario considerar el reposicionamiento del catéter de bucle fotovoltaico.
FIGURA 1. (A) Imagen fluoscópica de un catéter PigTail que se coloca en la cúspide de la válvula aórtica, lo que permite la evaluación de los segmentos del catéter de bucle fotovoltaico que se colocan de manera confiable dentro del ventrículo izquierdo; (B) Si la incertidumbre con respecto a los segmentos de bucle fotovoltaico dentro del ventrículo izquierdo persiste, el Dichos segmentos no deben incluirse en un análisis adicional; (D) Curvas de bucle fotovoltaico compuesto de paradoja que muestren el aumento de volumen durante la sístole y la disminución de volumen durante la diástole. Si se producen tales curvas, es necesario considerar el reposicionamiento del catéter de bucle fotovoltaico.
Al iniciar el flujo de trabajo de bucle fotovoltaico de animales grandes dentro de LabChart, se puede realizar una calibración de 2 puntos para la presión y el volumen estableciendo voltajes fijos dentro del software Millar MPVS Ultra. Los volúmenes mínimos y máximos se pueden calcular multiplicando el número de segmentos por el volumen de segmento mínimo y máximo que se ve dentro de MPVS Ultra. Si el bucle fotovoltaico acumulativo resultante de todos los segmentos muestra formas sesgadas como contracciones isovolumétricas no verticales o relajaciones, el posicionamiento del catéter del bucle fotovoltaico no es ideal y debe ajustarse (Figura 1D), asegurando que el catéter esté en una posición estable dentro del ventrículo, sin interferir con las cuerdas o los músculos papilares. Los movimientos fuertes del catéter de bucle fotovoltaico también pueden indicar enredos y, por lo tanto, también requieren reposicionamiento. Se puede observar una oscilación menor entre los dos volúmenes diastólicos finales debido a la respiración y generalmente se acepta. Debido a las constantes contracciones cardíacas, la posición del catéter de bucle fotovoltaico puede cambiar con el tiempo. Tales cambios de posición pueden causar cambios en los parámetros medidos (particularmente en el volumen del VI) y hacer que las comparaciones a lo largo del tiempo sean bastante difíciles. Por lo tanto, el catéter debe fijarse en su lugar. Sugerimos que la fijación del catéter de bucle fotovoltaico se garantice con un clip de abrazadera de soldadura genérico que se coloca muy cerca del punto de acceso arterial.
La eliminación del volumen de conductancia paralela que se origina en el miocardio se puede lograr mediante una inyección intravenosa rápida de la solución salina hipertónica de acuerdo con el flujo de trabajo fotovoltaico de animales grandes. Para eliminar los artefactos inducidos por la respiración, la ventilación mecánica se detiene durante aproximadamente cinco bucles antes de la inyección y se mantiene durante cinco bucles adicionales después de regresar al volumen intraventricular basal. Los valores altos de R2 deben obtenerse con poca varianza en función de los bucles elegidos, con el fin de obtener un volumen paralelo robusto.
Como último paso de calibración, las mediciones del catéter de bucle fotovoltaico se corrigen por la falta de homogeneidad del campo eléctrico mediante la aplicación de la corrección alfa, donde el volumen de accidente cerebrovascular medido del catéter de bucle fotovoltaico se compara con otro tipo de medición, como la ecocardiografía o la resonancia magnética. En nuestro caso, nos basamos en las mediciones de TEE para una comparación simultánea. La integridad de las válvulas y los movimientos cardíacos también se verifican mediante un análisis de TEE.
Mediciones de referencia
Para medir bucles congruentes sin artefactos respiratorios, se registran 20 bucles fotovoltaicos sin respiración, normalmente en la posición respiratoria final, lo que permite el trazado de los 10 bucles centrales. Para la derivación de parámetros hemodinámicos, como el trabajo de accidente cerebrovascular, el volumen del accidente cerebrovascular o el gasto cardíaco, recomendamos adquirir bucles de más de 1 minuto bajo ventilación mecánica, lo que permite un promedio de un gran número de bucles.
Intervenciones
Paso 1: Colocación de la sonda ICE y TEE
Se colocó una sonda de ecocardiografía intracardíaca (ICE) (catéter ViewFlexTM Xtra ICE, St.Jude Medical, Minnesota, EE. UU.) a través de la vaina de acceso venoso femoral, se obtuvieron imágenes en una máquina de ultrasonido Philips CX50 (Philips, Ámsterdam, Países Bajos). Además, se insertó una sonda de eco transesofágico (X7-2T TEE Transductor, Philips, Ámsterdam, Países Bajos) y se adquirieron imágenes en la máquina de ultrasonido Philips i33 (Philips, Ámsterdam, Países Bajos).
Paso 2: Colocación de la funda villo
Una funda de guía direccional direccional (AgilisTM EPI Steerable Sheath, 8.5F, St. Jude Medical, Minnetonka, MN, EE. UU., o DESTINOTM Reach 8.5F ID, longitud utilizable 77 cm, curva 17 mm, Oscor®, Florida, EE. UU.) se introdujo sobre un cable guía extra rígido (Lunderquist®, 0,035′′/260 cm, Cook Medical, Bjaeverskov, Dinamarca)
El arco aórtico de los cerdos difiere en anatomía en comparación con los humanos. Hay dos arterias ramificadas que surgen del arco aórtico, la primera, el tronco braquiocefálico, que afecta tanto a las arterias carótidas comunes como a la arteria subclavia derecha, y en segundo lugar, la arteria subclavia izquierda (28). Aunque cualquiera de las arterias carótidas común surge del tronco braquiocefálico, la introducción de la vaina icable a través de la arteria carótida izquierda parece ser favorable para apuntar al NCC o RCC de la válvula aórtica.
El posicionamiento de la vaina se verificó con TEE y ICE, así como fluoscópicamente (Figuras 2A–C).
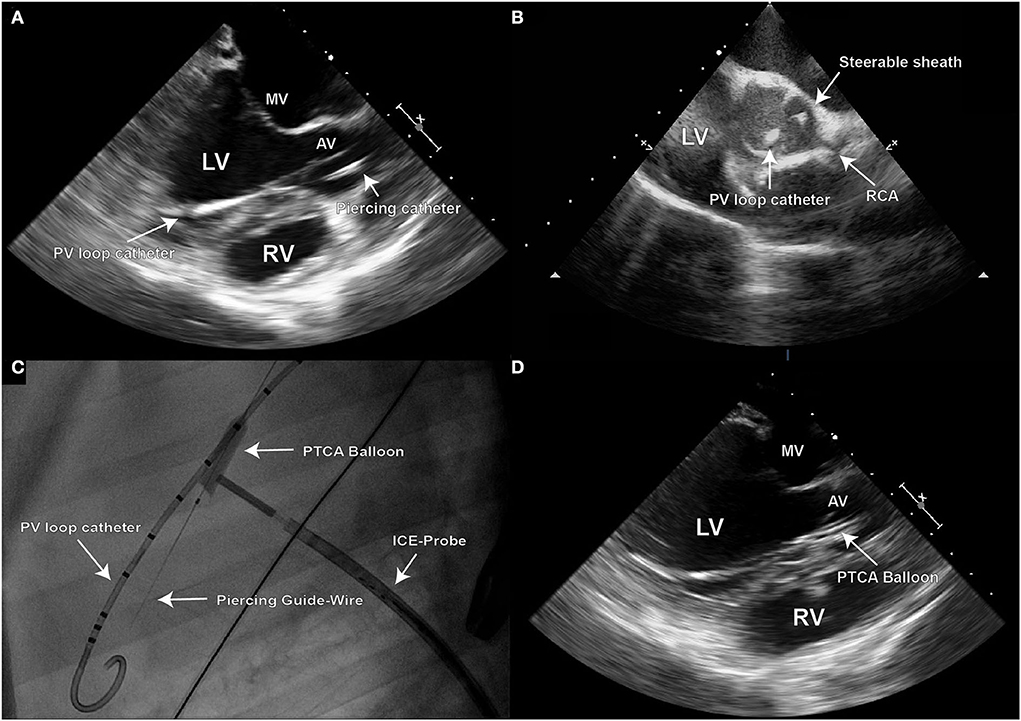 FIGURA 2. Debido al carácter 2D de la imagen ecocardiográfica, se necesitan dos proyecciones perpendiculares distintas (eje largo y corto) para una navegación procedimental precisa; (A) imagen de eco del eje largo transesofágico (TEE) que demuestre la posición final de la vaina direccional en el objetivo para la creación del defecto en el punto de la bisagra del leaflet El globo PTCA inflado utilizado para la dilatación de defectos también se puede visualizar en la vista de eje largo TEE.
FIGURA 2. Debido al carácter 2D de la imagen ecocardiográfica, se necesitan dos proyecciones perpendiculares distintas (eje largo y corto) para una navegación procedimental precisa; (A) imagen de eco del eje largo transesofágico (TEE) que demuestre la posición final de la vaina direccional en el objetivo para la creación del defecto en el punto de la bisagra del leaflet El globo PTCA inflado utilizado para la dilatación de defectos también se puede visualizar en la vista de eje largo TEE.
Paso 3: Perforación del vals de la válvula aórtica
Después de apuntar al NCC o RCC, respectivamente, bajo la guía de la ecocardiografía transesofágica e intracardía, así como la fluoroscopia, la bisagra del folleto fue perforada con un extremo rígido de un cable guía coronario (Alambre guía de IRON MAN, 0,014′′ 190 cm, Abbott Vascular, Santa Clara CA, EE Para mejorar la visibilidad del cable guía en la imagen de eco, el cable se puede enrear con papel de lija. Se puede encontrar una protuberancia septal aparente o un estante muscular septal en cerdos justo debajo del RCC y se perfora fácilmente accidentalmente (Figuras 3A, B). Perforar el bulto septal dirigirá el cable guía hacia el ventrículo derecho y, si pasa desapercibido, el defecto creado causará una fístula aorto-ventricular derecha (Figuras 3C, D). Después de verificar la posición del cable guía en el ventrículo izquierdo, el sitio de punción de la róvaula se dilató con un globo PTCA de 5 mm (nglobo de dilatación NC Emerge MONORAILTM PTCA 5 × 12 mm, Boston Scientific Corporation, Marlborough, MA, EE. UU.). El globo debe usar hilo dental varias veces en su estado inflado a través del folleto para garantizar un tamaño de defecto suficiente.
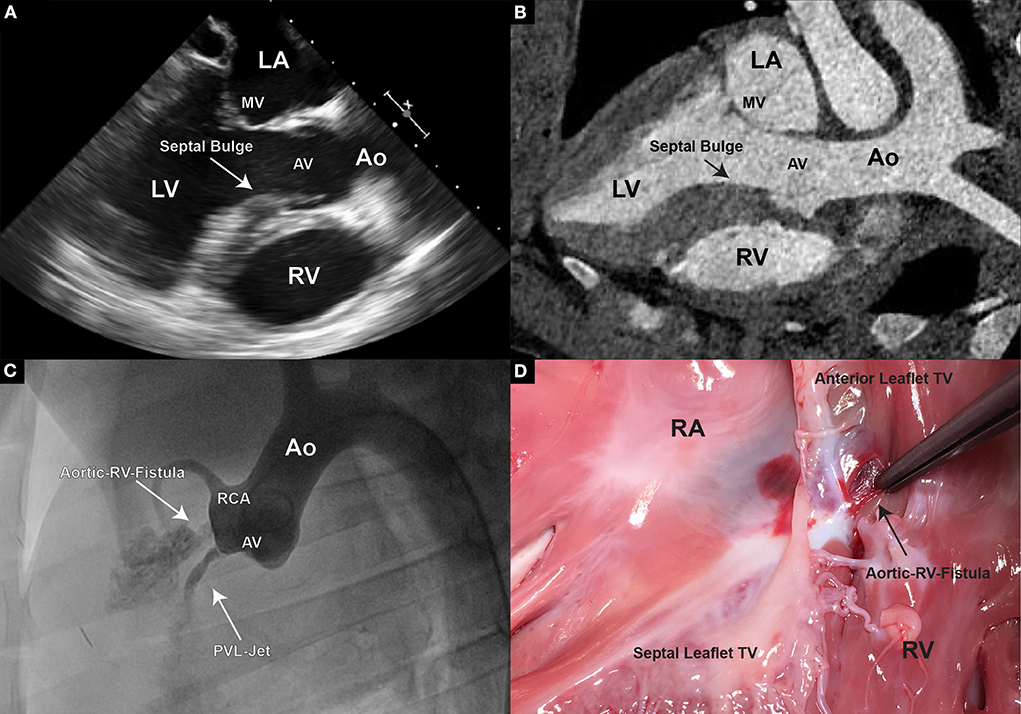 FIGURA 3. (A) En TEE, los cerdos muestran una característica única de la pared septal engrosada. Especialmente la porción directamente debajo de la válvula aórtica, correspondiente a la ubicación del RCC. El engrosamiento de esta región se hace prominente, especialmente durante la sístole final y la diastole temprana; (B) Sin embargo, en la TC, generalmente solo se puede observar un engrosamiento general de la pared septal, y a menudo no se detectable ningún «bulto» prominente; (C) Se realiza un aortograma después de un piercing erróneo en Se pudo observar un flujo directo de contraste con el ventrículo derecho que demuestra una comunicación ventricular aorto-derecha; (D) Tras un examen patológico se encontró una fístula que conectaba la raíz aórtica y el ventrículo derecho.
FIGURA 3. (A) En TEE, los cerdos muestran una característica única de la pared septal engrosada. Especialmente la porción directamente debajo de la válvula aórtica, correspondiente a la ubicación del RCC. El engrosamiento de esta región se hace prominente, especialmente durante la sístole final y la diastole temprana; (B) Sin embargo, en la TC, generalmente solo se puede observar un engrosamiento general de la pared septal, y a menudo no se detectable ningún «bulto» prominente; (C) Se realiza un aortograma después de un piercing erróneo en Se pudo observar un flujo directo de contraste con el ventrículo derecho que demuestra una comunicación ventricular aorto-derecha; (D) Tras un examen patológico se encontró una fístula que conectaba la raíz aórtica y el ventrículo derecho.
Verificación de PVL
Se utilizó la ecografía Doppler para la evaluación inicial de la presencia y gravedad de PVL (Figura 4A). Por lo tanto, el ancho del chorro se mide en relación con el diámetro del tracto de salida del ventrículo izquierdo (LVOT). Se busca un ancho de chorro de un mínimo del 25 % al máximo del 65 % del LVOT, ya que esto se considera una regurgitación aórtica de leve a moderada por las directrices de ASE sobre regurgitación aórtica (29). Además, se puede realizar una aortografía para la cuantificación densitométrica periprocediprocediada de PVL (Figura 4B). La cuantificación final de PVL se realizó mediante el análisis de seguimiento de partículas de postprocesamiento en conjuntos de datos de resonancia magnética de flujo 4D.
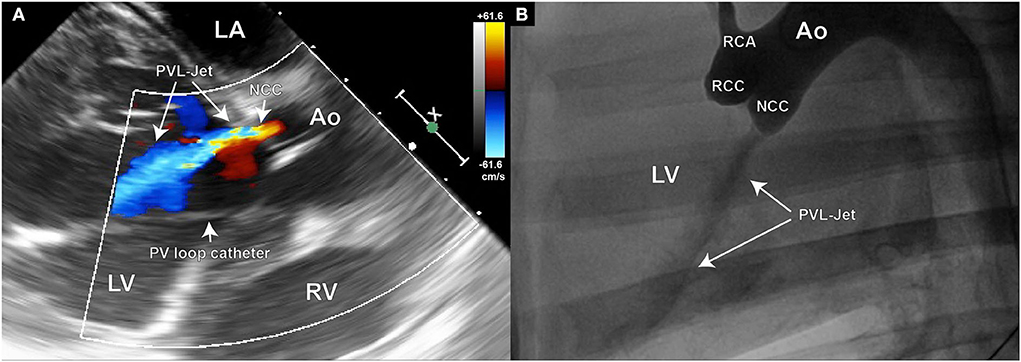 FIGURA 4. La ecocardiografía y la aortografía se pueden utilizar para verificar el defecto de la válvula aórtica; (A) Imagen Doppler en color del chorro de insuficiencia aórtica creado en la región NCC de la válvula aórtica; (B) Imagen aortográfica del mismo animal en posición laterolateral que también demuestra la existencia del chorro regurgitante. Estas imágenes se pueden utilizar más tarde para la cuantificación densitométrica del volumen regurgitante.
FIGURA 4. La ecocardiografía y la aortografía se pueden utilizar para verificar el defecto de la válvula aórtica; (A) Imagen Doppler en color del chorro de insuficiencia aórtica creado en la región NCC de la válvula aórtica; (B) Imagen aortográfica del mismo animal en posición laterolateral que también demuestra la existencia del chorro regurgitante. Estas imágenes se pueden utilizar más tarde para la cuantificación densitométrica del volumen regurgitante.
Rendimiento desafiante del VI
La regurgitación de la válvula aórtica provoca un aumento de la presión y el volumen diastólicos finales en el ventrículo izquierdo y un aumento de la postcarga (30). La dobutamina es una sustancia farmacológica utilizada alternativamente en lugar de vasodilatadores, para inducir el estrés cardíaco (31). La dobutamina tiene un efecto inotrópico positivo que conduce a un aumento del gasto cardíaco al aumentar selectivamente el volumen del accidente cerebrovascular y por una disminución refleja en la resistencia vascular periférica total (32). La dobutamina se utiliza clínicamente como una mezcla racémica, por la cual uno de los estereoisómeros tiene un fuerte efecto agonómico adrenérgico sobre α1 y un efecto más débil sobre la actividad β1 y β2, el otro estereisómero estimula predominantemente los adrenoceptores β1 Por lo tanto, causando un efecto nulo mediado por α1 en la vasculatura, un aumento inducido por β2 en la frecuencia cardíaca y un efecto inotrópico positivo mediado por los tres receptores (33).
En este estudio, se realizó una prueba de esfuerzo de dobutamina al inicio, después de la inducción de PVL y durante las mediciones de flujo de resonancia magnética. La dobutamina (Dobutrex, Teva Pharma AG, Basilea, Suiza; 0,5 mg/ml) se administró a través de una bomba continua por vía intravenosa. Se apuntó y mantuvo un aumento del 30 % en la frecuencia cardíaca durante 10 minutos (bucle de VPV) o durante la adquisición del flujo de resonancia magnética.
La fenilefrina es una amina simpaticomimética de acción directa que funciona como agonista α1-adrenérgico. Se cree que los efectos α1-adrenérgicos descritos causan una venoconstricción que conduce a un aumento temporal de la precarga y, en mayor medida, a una constricción arterial que aumentará la resistencia vascular sistémica y la poscarga (34). En los cerdos, la administración de fenilefrina se asocia con un aumento de la presión arterial sistémica, el volumen del accidente cerebrovascular y el gasto cardíaco sin cambios en la frecuencia cardíaca. Se observó un efecto de mejora de la carga previa en la administración de dosis bajas de fenilefrina, mientras que dosis más altas parecían aumentar la contractilidad de manera independiente de la carga (35). En el estudio presentado, también se realizó un desafío de fenilefrina al inicio, después de la inducción de PVL y durante las mediciones de flujo de resonancia magnética. La fenilefrina (Neo-sinefrina HCl, Ospedialia AG, Hüneberg, Suiza, 0,1 mg/ml) también se administró a través de una bomba continua por vía intravenosa. Esta vez se apuntó y se mantuvo un aumento del 30 % en la presión arterial media durante más de 10 minutos (bucle de VPV) o la duración de la adquisición del flujo de resonancia magnética, respectivamente.
Imágenes por resonancia magnética
Debido al tamaño y peso del animal, las imágenes de RM se realizaron en un sistema clínico de 3T. Los animales se colocaron en la posición lateral derecha. Durante las mediciones, los animales deben estar ventilados mecánicamente y se debe controlar la presión arterial y el CO2 del end-mareal (etCO2). El ventilador y el equipo de monitoreo se colocan comúnmente fuera de la jaula de Faraday, por lo tanto, el monitoreo de etCO2 se realiza a través de una línea Heidelberger de 14 m y para la ventilación mecánica, se necesitan mangueras de aproximadamente 2 m × 12 m.
Todas las imágenes se realizan comúnmente durante la respiración ventilada y la sincronización cardíaca mediante una unidad de oximetría de pulso sujeta a la cola del animal.
Las imágenes funcionales consistieron en imágenes equilibradas de precesión libre de estado estacionario utilizadas clínicamente en vistas de dos, tres y cuatro cámaras, así como en una vista de eje corto que cubría todo el ventrículo izquierdo. Los parámetros de la imagen fueron los siguientes: Campo de visión: 300 × 300 × 96 mm, resolución espacial 2 × 2 mm2, grosor de la rebanada 8 mm, TR/TE 2,7 ms/1,35 ms, activación retrospectiva, resolución temporal 31 ms, y bajo factor de muestreo 2.
La imagen de flujo 4D se realiza utilizando un patrón de muestreo cartesiano 3D pseudoespiral escasamente muestreado utilizando incrementos de ángulo dorado (36, 37). La dirección de codificación de frecuencia está alineada con la dirección izquierda-derecha para capturar el movimiento de la pared torácica y el volumen de la imagen se planifica en paralelo a la vista de cuatro cámaras. Los parámetros de imagen fueron los siguientes: FOV 300 × 410 × 90 mm, resolución espacial 2,5 × 2,5 × 2,5 mm, excitaciones por disparo 5, resolución temporal adquirida 21 ms, TR/TE 3,9/2.2 ms-2,2-2,2,5 ms. Para estimar la velocidad máxima esperada y ajustar la fuerza de codificación de velocidad (venc), se realizó un escaneo rápido 2D codificado por la velocidad a través del plano en tres posiciones de corte: distal, dentro y proximal de la válvula aórtica. Los venc aplicados para las imágenes de flujo 4D en nuestro entorno fueron: 140-180 cm/s (baseline), 150-180 cm/s (fenilfrina) y 180-280 cm/s (dobutamina).
La reconstrucción local de imágenes de bajo rango se puede realizar sin conexión dentro del marco de MRecon (GyroTools LLC, Zúrich, Suiza) que incorpora la Berkeley Advanced Reconstruction Toolbox (BART) (36, 37). Se deben reconstruir dos estados de movimiento respiratorio para minimizar los artefactos respiratorios con un factor de muestreo inferior de aproximadamente seis cada uno.
Eutanasia y patología macroscópica
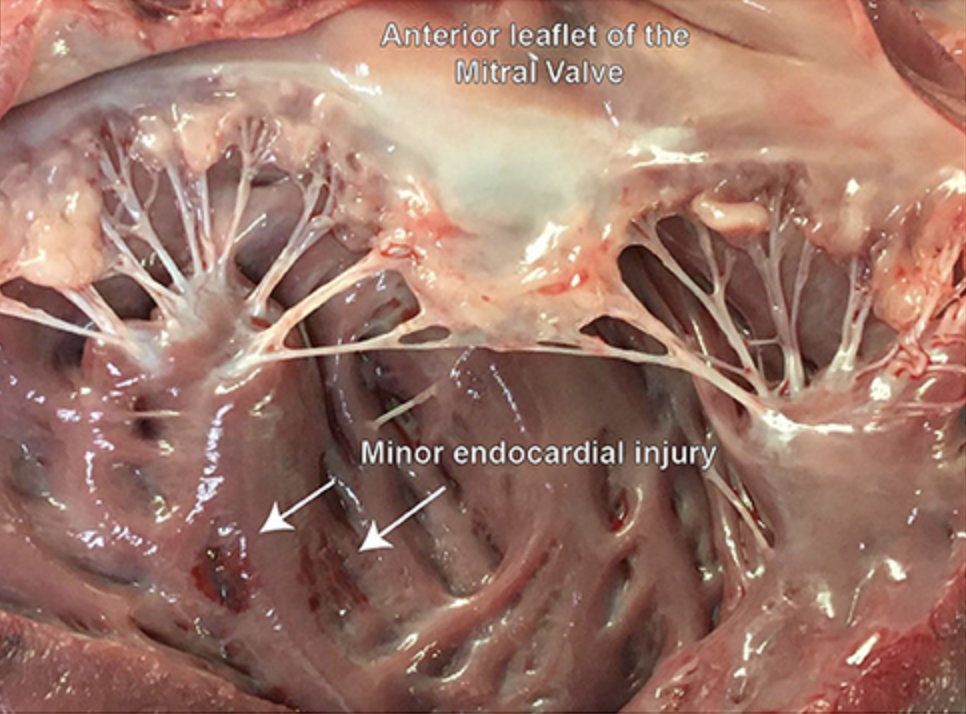
Al final del estudio, los cerdos fueron completamente heparinizados (300 UI/kg) y sacrificados bajo anestesia general mediante la administración de una sobredosis de pentobarbital sódico (Eskonarkon®ad.us.vet., Streuli Pharma AG, Uznach, Suiza; 75 mg/kg de peso corporal) por vía intravenosa. El corazón se extirpó completamente a través de una esternotomía y el arco aórtico se abrió longitudinalmente. El tamaño del defecto de los folletos, la ubicación y la lesión adicional en la LVOT o el tejido endocárdico se evalúan y documentan ópticamente (Figuras 5A, B).
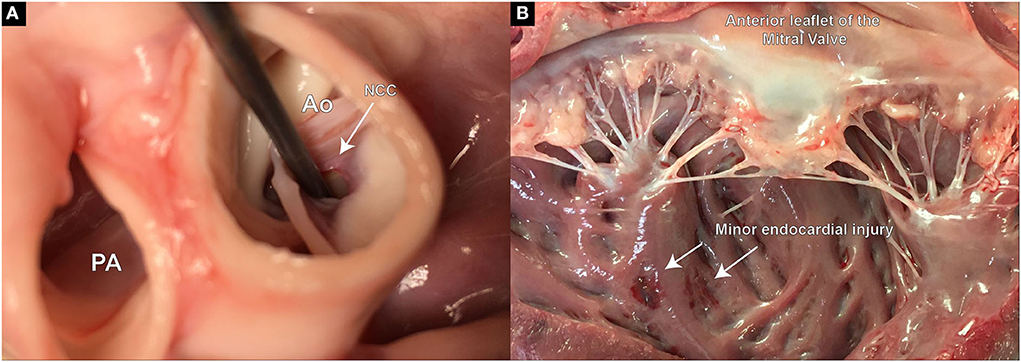 FIGURA 5. Examen post mortem del tamaño del defecto, la ubicación y las posibles lesiones extravalvulares creadas durante el procedimiento. (A) Demuestra el defecto colocado con precisión en el punto de la bisagra del leaflet aórtico en la región del RCC; (B) Legión leve lesión en la superficie endocárdica del ventrículo izquierdo, muy probablemente causada durante la inserción del cable guía perforante.
FIGURA 5. Examen post mortem del tamaño del defecto, la ubicación y las posibles lesiones extravalvulares creadas durante el procedimiento. (A) Demuestra el defecto colocado con precisión en el punto de la bisagra del leaflet aórtico en la región del RCC; (B) Legión leve lesión en la superficie endocárdica del ventrículo izquierdo, muy probablemente causada durante la inserción del cable guía perforante.
Resultados (anticipados)
Es posible la creación de defectos de PVL aórtico colocados con precisión con un tamaño definido
Para modelar la PVL de la válvula aórtica, el defecto debe colocarse en el punto de la bisagra entre el leaflet y el anillo valvular. Se debe tener cuidado de que los defectos no se coloquen dentro del tejido del folleto, ya que esto no imitaría la situación clínica. En nuestro estudio, las áreas objetivo de defectos se establecieron en los puntos de la bisagra de la cúspide coronaria derecha (RCC) o de la cúspide no coronaria (NCC) de la válvula aórtica, respectivamente, ya que representan los principales sitios de predilección para los PVL en la clínica. En los seis animales reportados, tres defectos de NCC y tres de RCC fueron atacados y creados con éxito utilizando el método descrito. Vale la pena señalar que las imágenes intraprocedimientos y la orientación de procedimiento fueron más difíciles para los defectos del RCC, lo que llevó a una mayor duración del procedimiento en este grupo. Inmediatamente después de la creación del defecto, se pudieron observar los chorros regurgitantes aórtico resultantes en el TEE en los seis animales (Figuras 6A–F). Sin embargo, debido a la posición anatómica del origen del chorro y su trayectoria en el VI, los chorros regurgitantes NCC se pudieron visualizar completamente, mientras que solo era parcialmente posible para los chorros RCC (Figuras 6A–C). Además, el análisis post mortem mostró que los defectos 3/3 NCC y 2/3 RCC se colocaron con precisión dentro de la estrecha región de la bisagra en el centro del valn de la válvula. Debido a una punción errónea en 1/3 del RCC que creó una fístula ventricular aorto-derecha (Figuras 3C, D), la ubicación del objetivo del RCC se movió ligeramente lateralmente y el defecto se colocó a 5 mm lateralmente desde el punto medio. Sin embargo, todos los animales se mantuvieron hemodinámicamente estables después de la creación de defectos y durante las mediciones posteriores.
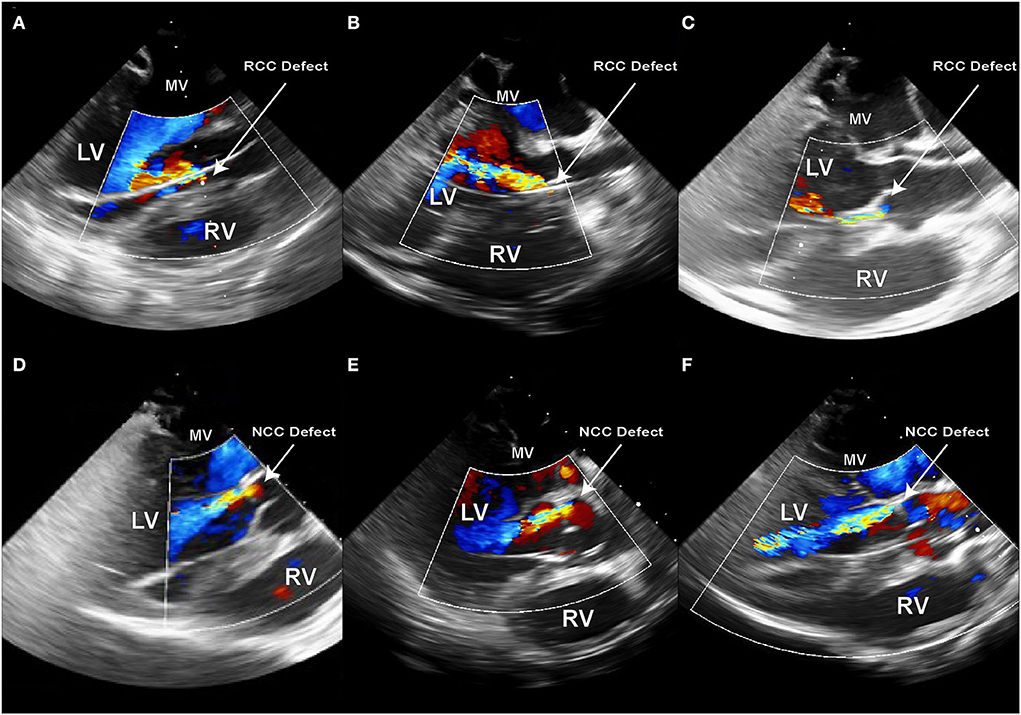 FIGURA 6. Ecocardiografía inmediatamente después de la creación del defecto PVL en animales consecutivos sx. (A-C) Defectos creados en la región anular del RCC; (D-F) Defectos creados en la región anular del NCC; el chorro PVL que se origina en la región del NCC tiene una trayectoria a lo largo del folleto anterior de la válvula mitral y se pueden visualizar completamente a lo largo de su trayectoria en el VI. Por otro lado, los chorros RCC fluyen a lo largo del tabique o en un ángulo pronunciado a través del VI.
FIGURA 6. Ecocardiografía inmediatamente después de la creación del defecto PVL en animales consecutivos sx. (A-C) Defectos creados en la región anular del RCC; (D-F) Defectos creados en la región anular del NCC; el chorro PVL que se origina en la región del NCC tiene una trayectoria a lo largo del folleto anterior de la válvula mitral y se pueden visualizar completamente a lo largo de su trayectoria en el VI. Por otro lado, los chorros RCC fluyen a lo largo del tabique o en un ángulo pronunciado a través del VI.
El posicionamiento estable del catéter de bucle fotovoltaico permite medir los efectos agudos de los chorros PVL en el trabajo ventricular y la comparación directa con el estado basal
Se ha informado ampliamente del hecho de que la PVL grave y/o la insuficiencia aórtica tienen un efecto negativo en la supervivencia y la calidad de vida del paciente. Sin embargo, el impacto de los chorros de leves a moderados es menos claro y los pacientes muestran una amplia gama de síntomas. Es importante entender qué impacto podrían tener estos chorros en los parámetros de trabajo del ventrículo izquierdo. Sin embargo, esto solo es posible si el catéter de bucle fotovoltaico es capaz de registrar señales muy comparables antes y después de la creación del defecto y si los parámetros hemodinámicos (como la presión arterial, la frecuencia cardíaca y la contractilidad cardíaca) permanecen dentro de márgenes muy estrechos. La extracción del catéter de bucle fotovoltaico durante el procedimiento de creación de defectos haría que esta comparación fuera casi imposible (Figura 7A). Para evitar la extracción del catéter, nuestro enfoque inicial fue la colocación transseptal del catéter de bucle fotovoltaico en el VI. Sin embargo, las señales obtenidas por tal enfoque eran de calidad insuficiente y el catéter no se podía mantener en una posición estable, lo que llevó a una salida muy variable. En consecuencia, desarrollamos un método para colocar el catéter de bucle fotovoltaico en la comisura de la válvula aórtica entre LCC y RCC. En esta posición, el catéter se mantuvo estable incluso durante la creación del catéter fotovoltaico. Por lo tanto, se podría hacer una comparación directa entre el estado saludable (de base) y el estado PVL (Figura 7B). Lo que es más importante, la posición del catéter de bucle fotovoltaico y la señal se mantuvieron estables durante todo el estudio, incluso a lo largo de los cambios hemodinámicos inducidos por el fármaco (Figura 7B).
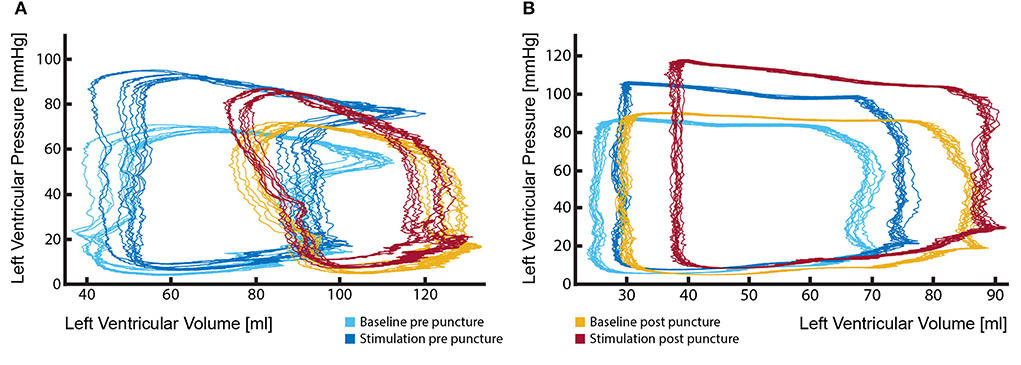 FIGURA 7. La posición estable del catéter de bucle fotovoltaico durante todo el procedimiento es fundamental para la evaluación de los efectos de los chorros regurgitantes aórticos en el rendimiento del ventrículo izquierdo. (A) Cambio marcado en las curvas del bucle fotovoltaico después de la extracción y reinserción del catéter después de la creación del defecto. Tales cambios hacen que la comparación del rendimiento del VI entre el estado sano (bucleos azul claro y oscuro) y el estado de insuficiencia aórtica (bucle rojo y amarillo) sea particularmente desafiante y potencialmente engañosa; (B) Al mantener el catéter en una posición estable durante todo el procedimiento, se podrían realizar mediciones confiables, delineando los efectos que la regurgit Además, son posibles investigaciones en condiciones hemodinámicas modificadas farmacológicamente (anillas azules oscuros frente a bucles rojos).
FIGURA 7. La posición estable del catéter de bucle fotovoltaico durante todo el procedimiento es fundamental para la evaluación de los efectos de los chorros regurgitantes aórticos en el rendimiento del ventrículo izquierdo. (A) Cambio marcado en las curvas del bucle fotovoltaico después de la extracción y reinserción del catéter después de la creación del defecto. Tales cambios hacen que la comparación del rendimiento del VI entre el estado sano (bucleos azul claro y oscuro) y el estado de insuficiencia aórtica (bucle rojo y amarillo) sea particularmente desafiante y potencialmente engañosa; (B) Al mantener el catéter en una posición estable durante todo el procedimiento, se podrían realizar mediciones confiables, delineando los efectos que la regurgit Además, son posibles investigaciones en condiciones hemodinámicas modificadas farmacológicamente (anillas azules oscuros frente a bucles rojos).
Los cambios inducidos por medicamentos en la postcarga y la frecuencia cardíaca permiten el estudio de la PVL aórtica en condiciones clínicamente relevantes
El aumento de la poscarga contribuye notablemente a la gravedad de la PVL, ya que agrava la regurgitación de la válvula aórtica. En un entorno experimental, la fenilefrina, como agonista α1-adrenérgico, se puede utilizar para inducir la constricción arterial periférica, lo que aumentará la resistencia vascular sistémica y la poscarga. Se puede evaluar y correlacionar el efecto directo del aumento de la resistencia vascular en el volumen de regurgitación.
Anteriormente se ha encontrado que un aumento de la frecuencia cardíaca en pacientes con regurgitación de la válvula aórtica disminuye el flujo de regurgitante por accidente cerebrovascular y por unidad de tiempo (38) y una reducción de la presión diastólica final del ventrículo izquierdo (LVEDP) (39). En un estudio anterior, la dobutamina en cerdos sanos ha demostrado aumentar la frecuencia cardíaca y la fracción de eyección, con una disminución del volumen diastólico final del ventrículo izquierdo y el volumen sistólica final, y sin cambios en el volumen del accidente cerebrovascular (40). Además, se ha demostrado que la dobuamina cambia el patrón de flujo sanguíneo intracardiaco en cerdos sanos (40).
El efecto de la dobutamina aparentemente contrarresta el aumento inducido por la insuficiencia de la válvula aórtica en la LVEDP y la postcarga en la fisiología cardiovascular y el patrón de flujo sanguíneo intracardiaco. Por lo tanto, examina aspectos importantes de la situación clínica en los pacientes, en la que la regurgitación de la válvula aórtica puede manifestarse en un aumento de la hipertensión arterial que mitigó la poscarga o un aumento de la frecuencia cardíaca inducido por la fibrilación auricular taquicárdica de nuevo inicio. Este último está presente en alrededor del 5 % de la implantación de la válvula transcatéter y en un notable 40 % de los reemplazos quirúrgicos de la válvula aórtica (1). Ambas condiciones clínicas son factores de riesgo cardiovascular probados por sí mismas y pueden tener un efecto sinérgico negativo en el aumento de la mortalidad y la morbilidad inducida por la PVL.
La ecocardiografía y la densitometría proporcionan una solución fiable para la evaluación experimental de la gravedad de la PVL en un modelo porcino
Aunque la ecocardiografía es un desafío en el modelo porcino, con adaptaciones técnicas moderadas, la mayoría de las estructuras cardíacas relevantes para la intervención se pueden visualizar fácilmente (23). Sin embargo, proporcionar ventanas ecocardiográficas apropiadas para las evaluaciones de flujo Doppler es mucho más difícil. Además, los chorros PVL tienen una trayectoria distinta dentro del espacio 3D del LV. Debido a una ventana de eco limitada en TEE, a menudo es imposible seguir el chorro en toda su longitud. En nuestro estudio, esto fue particularmente difícil en el grupo RCC, donde ya dentro del LVOT el chorro salía del plano de eco (Figuras 6A–C). Sin embargo, para la evaluación de la gravedad de la PVL aórtica, el ancho del chorro dentro de la LVOT se utiliza a menudo como un parámetro confiable en la clínica (41, 42). Tales mediciones son reproduciblemente alcanzables por TEE en cerdos y podrían demostrar que 6/6 defectos creados han causado regurgitación aórtica de leve a moderada. Por otro lado, la densitometría es mucho menos sensible, aunque no completamente insensible, a los ángulos de proyección y a las ventanas de imagen. A diferencia de los humanos, la mejor proyección para las imágenes densitométricas de la insuficiencia aórtica es una proyección laterolateral. Se debe tener cuidado de que no se imagine ninguna superposición de las estructuras cardíacas y aórticas y que las escápulas no estén en el marco. Además, la inyección de agente de contraste de alto volumen (20 ml en 1,5 s) en la raíz aórtica necesaria para el análisis densitométrico podría conducir a un corto aumento de la presión aórtica local. Como la diferencia en las presiones aórtica y diastólica del VI es la fuerza impulsora detrás de la regurgitación aórtica, tal aumento de la presión en el lado aórtico exactamente en el momento de la evaluación podría conducir a una sobreestimación de PVL. Aunque se ha demostrado una clara correlación entre la evaluación ecocardiográfica y la densitometría del volumen de regurgitante en pacientes (43), actualmente no hay datos de ensayos con animales.
La resonancia magnética de flujo 4D ofrece respuestas a los patrones de flujo sanguíneo ventricular alterados y la posible remodelación adversa
Se ha demostrado que el flujo sanguíneo intraventricular diastólica adquirido con resonancia magnética 4D se altera en cerdos con PVL de leve a moderado en un sitio defectuoso (NCC vs. RCC) de forma dependiente (3), así como bajo estrés de dobutamina solo en comparación con cerdos sanos (40). Se describe que las desviaciones del flujo sanguíneo diastólica fisiológica dan lugar a una mayor disipación de energía dentro del VI (44). El efecto del aumento farmacológico de la poscarga o la frecuencia cardíaca en los patrones de flujo intracardiaco en la resonancia magnética 4D puede dar más información sobre los cambios de energía cinética dentro del grupo sanguíneo del ventrículo izquierdo en PVL de leve a moderado.
Discusión
La regurgitación o fuga paravalvular (PVL) es una complicación asociada con los reemplazos de las válvulas transcatéter y causa un flujo sanguíneo turbulento por debajo de la válvula respectiva con diversas consecuencias clínicas (42). Los modelos porcinos para el estudio de los efectos del flujo sanguíneo alterado y la hemodinámica en la salud cardíaca después de la inducción de PVL son de gran interés. Sin embargo, los estudios hemodinámicos se ve fácilmente sesgados por consideraciones insuficientes de factores de confusión. Además de seleccionar cerdos de tamaño y peso adecuados, el estado de salud puede tener un impacto significativo en las propiedades cardiovasculares y hemodinámicas y debe evaluarse antes de la compra de animales. En las granjas comerciales, los cerdos a menudo se someten a prácticas de manipulación que causan estrés agudo (45). Las principales vías activadas por los factores estresantes son el eje hipotalámico-hipofisario-adrenal (HPA) y el sistema nervioso simpático (46). Por lo tanto, el manejo sin estrés de los cerdos utilizados para los estudios hemodinámicos es esencial. Se debe conceder un tiempo de aclimatación adecuado para los animales en una nueva instalación, ya que durante el transporte y después del estancado, los cerdos se enfrentan a una variedad de factores estresantes que conducen a cambios inducidos por el estrés en los sistemas cardiovascular, endocrino, inmune y reproductivo (47-49). El transporte y alojamiento de cerdos en grupos familiares puede atenuar el estrés social (50). Para evitar el estrés por calor o frío en los cerdos, es fundamental basar la temperatura de la vivienda en el contenido energético de la dieta, el estado de crecimiento del cerdo y la vivienda del grupo (51). La utilización de animales estresados antes de que su estado fisiológico se normalice puede tener efectos considerables e involuntarios en los resultados de la investigación cardiovascular (49). Mientras que los mediadores primarios del estrés (por ejemplo, catecolaminas y glucocorticoides) volverán a los valores fisiológicos en 24 horas, los cambios en los sistemas inmunitario y endocrino pueden tardar hasta 7 días en normalizarse (49). Los cambios en la dieta deben inducirse gradualmente durante el tiempo de aclimatación. Los animales que muestran diarrea deben ser excluidos de cualquier estudio, ya que la diarrea contribuye a una mayor pérdida de electrolitos y agua sobre la luz intestinal (52), lo que causa una interrupción de la homeostasis y el equilibrio ácido-base. Se ha demostrado que estos cambios afectan a la contractilidad y el ritmo cardíacos con un resultado potencialmente mortal (53, 54). Los estudios en ratas mostraron que la diarrea osmótica, a menudo acompañada de una reducción en la ingesta de alimentos, causa una reducción en el peso cardíaco y el contenido de proteínas mediante la reducción de la síntesis de proteínas (55). Se utilizan varios protocolos anestésicos en cerdos de laboratorio, cada uno con sus ventajas y desventajas. Los requisitos para el protocolo anestésico son particularmente altos cuando se realizan estudios hemodinámicos. La sedación intramuscular adecuada es comúnmente necesaria en los cerdos, para un manejo seguro y para colocar un catéter intravenoso en la vena auricular para la inducción de la anestesia general. Por lo tanto, los medicamentos anestésicos disociativos como la ketamina y la tiletamina a menudo se combinan con agentes sedantes como la azaperona, el midazolam, el zolazepam o los agonistas α-2, como la detomidina, la medetomidina o la dexmedetomidina (56-59). Como se describe que los agonistas α-2 inducen efectos cardiovasculares adversos como la bradicardia, el aumento de la resistencia vascular sistémica, la reducción del gasto cardíaco y el suministro de oxígeno (60, 61), son menos adecuados para la investigación cardiovascular. La anestesia se puede mantener con agentes por inhalación o medicamentos intravenosos (TIVA), o una combinación de ambos. El isoflurano y otros anestésicos volátiles tienen efectos dependientes de la dosis en la función hemodinámica y respiratoria que pueden atenuarse cuando se combinan con anestesia y analgesia parcialmente intravenosas (PIVA) (62, 63). Anecdóticamente, el umbral de fibrilación ventricular (VF) en los cerdos es notablemente más bajo que en los seres humanos. Una razón plausible es el sistema Purkinje, que se encuentra transversalmente en cerdos y subendocárdico en humanos (64). Dado que los cerdos son más propensos a la VF y otras arritmias cardíacas durante las intervenciones cardíacas, los agentes antiarrítmicos son una parte integral de un protocolo anestésico exitoso. La amiodarona es un potente medicamento antiarrítmico utilizado con éxito en el tratamiento de las arritmias ventriculares y supraventriculares en cerdos (65, 66). Sin embargo, un estudio en perros mostró una disminución relacionada con la dosis en la resistencia vascular coronaria y sistémica, así como una disminución en la contractilidad cardíaca después de la administración de amiodarona (67). Los efectos secundarios hemodinámicos que resultan en una disminución de la presión aórtica (sestóstólica, diastólica y media) y ventricular izquierda (sístólica y diastólica final) también se describen en humanos (68). Por lo tanto, se debe tener en cuenta el efecto hemodinámico de la amiodarona como un potente medicamento antiarrítmico en cerdos. Los modelos porcinos de PVL aórtica se crean comúnmente mediante la implantación de una válvula protésica (TAVI) (4). Por lo tanto, las válvulas aórticas protésicas se pueden implantar en una materia antegrada transapicamente a través de un acceso subxifoide o una mini-toracotomía en el sexto espacio intercostal (69) o retrógrada a través de una vaina de acceso percutáneo en la arteria femoral (70). Los abordajes percutáneos a menudo se ven obstaculizados por la necesidad de grandes vainas de acceso, lo que aumenta el riesgo de disección arterial y perforación (71). Por otro lado, los enfoques transapicales requieren la colocación de una gran vaina de acceso a través del ápice del ventrículo izquierdo. El sitio de la punción se cierra con una sutura de la cuerda del bolso después de una implantación valvular exitosa, lo que a menudo causa anomalías en el movimiento de la pared regional apical con una disminución general de la función ventricular izquierda debido a una lesión miocárdica (72). Por lo tanto, los modelos de PVL inducidos por TAVI son poco prácticos para los estudios hemodinámicos. Además, aunque no hay riesgo de movimiento o desplazamiento de la válvula protésica utilizando un sistema de resonancia magnética que funcione a 1,5 T o menos, la presencia de un artefacto puede afectar la calidad de las imágenes de diagnóstico y la evaluación del flujo 4D a través de la válvula protésica (73). Por lo tanto, el modelo porcino mínimamente invasivo y reproducible descrito es ideal para una investigación detallada de los efectos hemodinámicos y el impacto a corto plazo causado por la PVL de leve a moderada en los pacientes. A pesar de una alta tasa de éxito (6/6) en la creación de regurgitación aórtica de leve a moderada, el objetivo específico de los puntos de la bisagra del prospecto, especialmente en la región del RCC, sigue siendo algo difícil y no completamente desprovisto de complicaciones. Cuando los puntos medios de la bisagra del folleto NCC son claramente visibles y se pueden llegar fácilmente con el método y el equipo descritos, la configuración de los defectos de RCC requiere adaptaciones en las imágenes intraprocedimientos, así como en la técnica de intervención. Además, la característica porcina única del estante septal muscular (abultamiento septal) colocado justo debajo del leaflet aórtico del RCC podría ser la causa de complicaciones si se perfora erróneamente (21). En nuestro estudio, esto ocurrió en un tercio de los defectos dirigidos al RCC. Además, los efectos de dicha estructura en la trayectoria y trayectoria del chorro PVL que se origina en RCC actualmente no pueden excluirse y deben considerarse como una limitación a la trazabilidad de los resultados. Sin embargo, debido a la naturaleza mínimamente invasiva de la técnica de creación de defectos PVL (el procedimiento requiere una vena femoral y dos accesos arteriales), el modelo descrito aquí ofrece potencialmente una plataforma viable para la investigación a largo plazo de la remodelación cardíaca y otros efectos adversos causados por la PVL aórtica. De acuerdo con los principios 3R, dicho modelo representaría un refinamiento sustancial en comparación con la implantación quirúrgica o incluso transcatéter de una válvula defectuosa (4). Además, las manipulaciones postoperatorias necesarias para la administración de terapia anticoagulante después de los implantes valvulares no son necesarias en nuestro modelo, ya que no hay material extraño trombogénico. Como los orificios PVL representan áreas de flujo de alta velocidad, no se espera que se curen espontáneamente en nuestro modelo. Sin embargo, estos aspectos, así como la inducción y progresión de la remodelación cardíaca adversa, deben evaluarse cuidadosamente en estudios diseñados específicamente para ese propósito. Los bucles de presión-volumen ( buclesPV) son el estándar de oro para las medidas dependientes de la carga en tiempo real e independientes de la carga de la función sistólica y diastólica del ventrículo izquierdo. Recientemente se ha publicado una guía práctica sobre las mediciones de bucle fotovoltaico en cerdos (27). Sin embargo, las mediciones del bucle fotovoltaico se alteran fácilmente a través de otras intervenciones, como la perforación del valvular aórtica. Para evitar interferencias en la válvula aórtica y para evitar mover el catéter de bucle fotovoltaico entre las mediciones, se consideró la colocación transseptal del catéter PVL. La punción transséptica se realizó bajo la guía del ICE y se verificó mediante atriografía izquierda. Sin embargo, con la altura auricular izquierda mucho más baja en los cerdos que en los humanos (74) y la fosa porcina ovalada es más profunda y de posición más superior, la colocación transseptal del catéter de bucle fotovoltaico conduce a un desplazamiento lateral de la valva posterior de la válvula mitral, haciendo que el catéter se mueva ampliamente con la apertura y el
Al realizar estudios hemodinámicos en cerdos, se debe considerar aún más una gestión optimizada de los fluidos intraoperatorios, que es esencial para mantener el volumen intravascular y, por lo tanto, la precarga cardíaca y el gasto cardíaco. Los procedimientos anestésicos de larga duración tienden a causar hipovolemia debido a las pérdidas continuas a través de la ventilación mecánica y la salida urinaria. Además, se debe tener en cuenta la pérdida de sangre a través de la vaina de acceso y los catéteres, que se agrava aún más debido a la terapia anticoagulante. El estado del volumen intravascular debe evaluarse y compensarse a lo largo del estudio combinando los parámetros de laboratorio, la administración de líquidos y las mediciones de la producción de orina con el seguimiento de la presión venosa central y el gasto cardíaco (75).
A pesar de tener en cuenta todo lo que se debe y no se describe al establecer un modelo porcino para la PVL, es de esperar una variabilidad interindividual sustancial en la compensación hemodinámica a la PVL en cerdos. Es aún más importante tener un modelo estandarizado y reproducible de PVL para excluir el sesgo procesal.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
El estudio con animales fue revisado y aprobado por la Oficina Veterinaria Cantonal de Zúrich, Suiza (ZH213/2019).
Contribuciones de los autores
NC: conceptualización, diseño de estudio, desarrollo del modelo animal, procedimiento quirúrgico, manejo de animales, preparación y revisión del manuscrito. MW, LG y MKo: desarrollo del modelo animal, procedimiento quirúrgico y preparación del manuscrito. NT, MH, AL y TS: manejo y anestesia de animales. MKu: diseño de estudio y análisis de imágenes ecocardiográficas. CS: Protocolo de resonancia magnética 4D y procedimiento de imagen y preparación del manuscrito. VF y ME: interpretación de datos y revisión crítica del manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este trabajo fue apoyado por una subvención de investigación de la Fundación Suiza del Corazón y se realizó en el marco de la iniciativa ETHeart. Financiación de acceso abierto proporcionada por ETH Zurich.
Agradecimientos
Los autores desean dar las gracias al Prof. Margarete Arras, Sra. Flora Nicholls, y los cuidadores de animales del Laboratorio Biológico Central por su valioso apoyo en el alojamiento de animales.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Mack MJ, Leon MB, Thourani VH, Makkar R, Kodali SK, Russo M, et al. Reemplazo de la válvula aórtica transcatéter con una válvula expandible por balón en pacientes de bajo riesgo. N Engl J Med. (2019) 380:1695–705. doi: 10.1056/NEJMoa1814052
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
2. Sponga S, Perron J, Dagenais F, Mohammadi S, Baillot R, Doyle D, et al. Impacto de la regurgitación residual después del reemplazo de la válvula aórtica. Eur J Cardiothorac Surg.(2012) 42:486–92. doi: 10.1093/ejcts/ezs083
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
3. Cesarovic N, Weisskopf M, Kron M, Glaus L, Peper ES, Buoso S, et al. Los chorros regurgitantes aórticos leves orientados septaalmente influyen negativamente en las perspectivas del flujo sanguíneo del ventrículo izquierdo del estudio en animales de resonancia magnética de flujo 4D. Médico Cardiovascular Frontal. (2021) 8:711099. doi: 10.3389/fcvm.2021.711099
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
4. Rosa B, Machaidze Z, Mencattelli M, Manjila S, Shin B, Price K, et al. Cirugía cardíaca robotoria guiada por cardioscópica: reparación de fugas paravalvulares. Ann Thorac Surg.(2017) 104:1074–9. doi: 10.1016/j.athoracsur.2017.03.028
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
5. Bunck AC, Juttner A, Kroger JR, Burg MC, Kugel H, Niederstadt T, et al. Imágenes de flujo de contraste en fase 4D para la visualización del flujo dentro del stent y la evaluación de la permeabilidad del stent en los stents vasculares periféricos: un estudio fantasma. Eur J Radiol. (2012) 81:e929-37. doi: 10.1016/j.ejrad.2012.05.032
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
6. Kirk RGW. Recuperar los principios de la técnica experimental humana: los 3R y la esencia humana de la investigación animal. Valores humanos de ciencia y tecnología. (2018) 43:622-48. doi: 10.1177/0162243917726579
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
7. Yi GH, Cheng Y, Aboodi MS, Farnan R, Kar S, Burkhoff D, et al. Seguridad y viabilidad de la administración percutánea de un nuevo dispositivo de asistencia circulatoria (CircuLite(R) SYNERGY(R)) en el modelo porcino. Eurointervención. (2013) 9:259–68. doi: 10.4244/EIJV9I2A42
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
8. Monreal G, Sherwood LC, Sobieski MA, Giridharan GA, Slaughter MS, Koenig SC. Modelos de animales grandes para la investigación y el desarrollo de dispositivos de asistencia ventricular izquierda. ASAIO J. (2014) 60:2–8. doi: 10.1097/MAT.0000000000000005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
9. Smerup M, Pedersen TF, Nyboe C, Funder JA, Christensen TD, Nielsen SL, et al. Un modelo porcino a largo plazo para la evaluación de las válvulas cardíacas protésicas. Foro de la oición del corazón. (2004) 7:E259-64. doi: 10.1532/HSF98.20041015
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
10. Opriessnig T, Janke BH, Halbur PG. Lesiones cardiovasculares en cerdos infectados de forma natural o experimental con circovirus porcino tipo 2. J Comp Pathol. (2006) 134:105-10. doi: 10.1016/j.jcpa.2005.06.007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
11. Brewer LA, Lwamba HC, Murtaugh MP, Palmenberg AC, Brown C, Njenga MK. El virus de la encefalomiocarditis porcina persiste en el miocardio de cerdo e infecta las células miocárdicas humanas. (2001) 75:11621–9. doi: 10.1128/JVI.75.23.11621-11629.2001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
12. Neil DH, McKay KA, L’Ecuyer C, Corner AH. Enfermedad de Glasser de los cerdos producida por la inoculación intraqueal de haemophilus suis. Can J Comp Med. (1969) 33:187-93.
13. Jensen HE, Gyllensten J, Hofman C, Leifsson PS, Agerholm JS, Boye M, et al. Hallazgos histológicos y bacteriológicos en la endocarditis valvular de cerdos en edad de sacrificio. J Vet Diagn Invest. (2010) 22:921-7. doi: 10.1177/104063871002200611
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
14. Pallares FJ, Yaeger MJ, Janke BH, Fernández G, Halbur PG. Concentraciones de vitamina E y selenio en hígados de cerdos diagnosticados con cardiopatía de morera. J Vet Diagn Invest.(2002) 14:412-4. doi: 10.1177/104063870201400509
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
15. Shen H, Thomas PR, Ensley SM, Kim WI, Loynachan AT, Halbur PG, et al. Los niveles de vitamina E y selenio están dentro del rango normal en los cerdos diagnosticados con cardiopatía de morera y falta evidencia de afectación viral en el síndrome. Transbound Emerg Dis. (2011) 58:483–91. doi: 10.1111/j.1865-1682.2011.01224.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
16. Lelovas PP, Kostomitsopoulos NG, Xanthos TT. Una visión general anatómica y fisiológica comparativa del corazón porcino. J Am Assoc Lab Anim Sci. (2014) 53:432–8.
17. Crick SJ, Sheppard MN, Ho SY, Gebstein L, Anderson RH. Anatomía del corazón de cerdo: comparaciones con la estructura cardíaca humana normal. J Anat. (1998) 193 (Pt 1):105–19. doi: 10.1046/j.1469-7580.1998.19310105.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
19. Barbanti M, Yang TH, Rodes Cabau J, Tamburino C, Wood DA, Jilaihawi H, et al. Características anatómicas y de procedimiento asociadas con la ruptura de la raíz aórtica durante el reemplazo de la válvula aórtica transcatéter expandible en balón. Circulación.(2013) 128:244–53. doi: 10.1161/CIRCULATIONAHA.113.002947
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
20. Ribeiro HB, Nombela-Franco L, Urena M, Mok M, Pasian S, Doyle D, et al. Obstrucción coronaria después de la implantación de la válvula aórtica transcatéter: una revisión sistemática. JACC Cardiovasc Interv. (2013) 6:452–61. doi: 10.1016/j.jcin.2012.11.014
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
21. Benhassen LL, Ropcke DM, Lading T, Skov JK, Bechsgaard T, Skov SN, et al. Dinámica asimétrica del anillo aórtico nativo evaluada por transductor de fuerza y ecomicrometría en un modelo porcino. Tecnología de Ingeniería Cardiovascular. (2019) 10:482–9. doi: 10.1007/s13239-019-00418-1
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
22. Kerut EK, Valina CM, Luka T, Pinkernell K, Delafontaine P, Alt EU. Técnica e imágenes para la ecocardiografía transtorácica del cerdo de laboratorio. Ecocardiografía. (2004) 21:439–42. doi: 10.1111/j.0742-2822.2004.04003.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
23. Sundermann SH, Cesarovic N, Falk V, Bettex D. Ecocardiografía transesofágica bidimensional y tridimensional en cerdos grandes utilizada como modelo para terapias de válvulas cardíacas transcatéter: planos y valores estándar. Interactuar Cardiovasc Thorac Surg. (2016) 22:580–6. doi: 10.1093/icvts/ivv381
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
24. Billig S, Zayat R, Ebeling A, Steffen H, Nix C, Hatam N, et al. Ecocardiografía transesofágica en cerdos: evaluación de la estructura, función y trabajo miocárdico del ventrículo izquierdo y derecho. Imágenes cardiovasculares Int J. (2021) 37:835-46. doi: 10.1007/s10554-020-02053-7
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
25. Naqvi TZ, Zarbatany D, Molloy MD, Logan J, Buchbinder M. Ecocardiografía intracardíaca para la reparación percutánea de la válvula mitral en un modelo porcino. J Am Soc Echocardiogr. (2006) 19:147-53. doi: 10.1016/j.echo.2005.09.008
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
26. Burkhoff D, Mirsky I, Suga H. Evaluación de las propiedades ventriculares sistólicas y diastólicas a través del análisis de presión-volumen: una guía para investigadores clínicos, traslacionales y básicos. Am J Physiol Heart Circ Physiol. (2005) 289:H501–12. doi: 10.1152/ajpheart.00138.2005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
27. Stonko DP, Edwards J, Abdou H, Elansary NN, Lang E, Savidge SG, et al. Un enfoque técnico y analítico de datos para los bucles de presión-volumen a lo largo de numerosos ciclos cardíacos. JVS Vasc Sci. (2022) 3:73–84. doi: 10.1016/j.jvssci.2021.12.003
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
28. Lin C, Wang L, Lu Q, Li C, Jing Z. Reparación endovascular del arco aórtico en cerdos mediante injertos de stent de doble rama mejorados. Ann R Coll Surg Engl. (2013) 95:134–9. doi: 10.1308/003588413X13511609955814
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
29. Zoghbi WA, Adams D, Bonow RO, Enriquez-Sarano M, Foster E, Grayburn PA, et al. Recomendaciones para la evaluación no invasiva de la regurgitación valvular nativa: un informe de la Sociedad Americana de Ecocardiografía desarrollado en colaboración con la Sociedad de Resonancia Magnética Cardiovascular. J Am Soc Echocardiogr. (2017) 30:303–71. doi: 10.1016/j.echo.2017.01.007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
30. Maurer G. Regurgitación aórtica. Corazón. (2006) 92:994-1000. doi: 10.1136/hrt.2004.042614
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
31. Lak HM, Ranka S, Goyal A. Pruebas de esfuerzo farmacológico. Isla del Tesoro (FL): StatPearls. (2022).
32. Ruffolo RR Jr. La farmacología de la dobutamina. Soy J Med Sci. (1987) 294:244–8. doi: 10.1097/00000441-198710000-00005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
33. Dubin A, Lattanzio B, Gatti L. El espectro de efectos cardiovasculares de la dobutamina, desde sujetos sanos hasta pacientes con shock séptico. Rev Bras Ter Intensiva. (2017) 29:490–8. doi: 10.5935/0103-507X.20170068
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
34. Richards E, López MJ, Maani CV. Fenilefrina. StatPearls. Treasure Island (FL): StatPearls Publishing Copyright © 2022, StatPearls Publishing LLC. (2022).
35. Wodack KH, Graessler MF, Nishimoto SA, Behem CR, Pinnschmidt HO, Punke MA, et al. Evaluación de los efectos hemodinámicos centrales de la fenilefrina: un experimento animal. J Clin Monit Comput. (2019) 33:377–84. doi: 10.1007/s10877-018-0204-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
36. Walheim J, Dillinger H, Gotschy A, Kozerke S. Resonancia magnética del tensor de flujo 5D para mapear de manera eficiente las tensiones de reynolds del flujo sanguíneo aórtico in vivo. Representante de ciencia ficción (2019) 9:18794. doi: 10.1038/s41598-019-55353-x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
37. Walheim J, Dillinger H, Kozerke S. Re resonancia magnética cardiovascular de flujo multipunto 5D: mapeo acelerado de movimiento cardíaco y respiratorio resuelto de las velocidades medias y turbulentas. J Cardiovasc Magn Reson. (2019) 21:42. doi: 10.1186/s12968-019-0549-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
38. Warner HR, Toronto AF. Efecto de la frecuencia cardíaca sobre la insuficiencia aórtica medida por una técnica de dilución de tinte. Circ Res. (1961) 9:413–7. doi: 10.1161/01. RES.9.2.413
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
39. Juez TP, Kennedy JW, Bennett LJ, Wills RE, Murray JA, Blackmon JR. Efectos hemodinámicos cuantitativos de la frecuencia cardíaca en la regurgitación aórtica.Circulación. (1971) 44:355-67. doi: 10.1161/01. CIR.44.3.355
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
40. Cesarovic N, Busch J, Lipiski M, Fuetterer M, Fleischmann T, Born S, et al. Patrones de flujo sanguíneo del ventrículo izquierdo en reposo y bajo estrés por dobutamina en cerdos sanos. NMR Biomed. (2019) 32:e4022. doi: 10.1002/nbm.4022
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
41. Fanous EJ, Mukku RB, Dave P, Aksoy O, Yang EH, Benharash P, et al. Evaluación de fugas paravalvulares: desafíos en la evaluación de la gravedad y los enfoques intervencionistas.Curr Cardiol Rep. (2020) 22:166. doi: 10.1007/s11886-020-01418-7
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
42. Pinheiro CP, Rezek D, Costa EP, Carvalho ES, Moscoso FA, Taborga PR, et al. Regurgitación paravalvular: resultados clínicos en tratamientos quirúrgicos y percutáneos. Arq Bras Cardiol. (2016) 107:55–62. doi: 10.5935/abc.20160086
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
43. Schultz CJ, Slots TL, Yong G, Aben JP, Van Mieghem N, Swaans M, et al. Un método objetivo y reproducible para la cuantificación de la regurgitación aórtica después de TAVI.Eurointervención. (2014) 10:355–63. doi: 10.4244/EIJY14M05_06
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
44. Stugaard M, Koriyama H, Katsuki K, Masuda K, Asanuma T, Takeda Y, et al. La pérdida de energía en el ventrículo izquierdo obtenida mediante el mapeo del flujo vectorial como una nueva medida cuantitativa de la gravedad de la regurgitación aórtica: un estudio experimental y clínico combinado. Imágenes cardiovasculares De Eur Heart J. (2015) 16:723-30. doi: 10.1093/ehjci/jev035
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
45. Martinez-Miro S, Tecles F, Ramon M, Escribano D, Hernández F, Madrid J, et al. Causas, consecuencias y biomarcadores del estrés en los cerdos: una actualización. BMC Vet Res.(2016) 12:171. doi: 10.1186/s12917-016-0791-8
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
46. Won E, Kim YK. El estrés, el sistema nervioso autónomo y la vía inmuno-cinurenina en la etiología de la depresión. Curr Neuropharmacol. (2016) 14:665–73. doi: 10.2174/1570159X14666151208113006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
47. Seidler T, Alter T, Krüger M, Fehlhaber K. Transporte de estrés: consecuencias para la translocación bacteriana, la contaminación endógena y la actividad bactericida del suero de los cerdos de sacrificio. Berl Munch Tierarztl Wochenschr. (2001) 114:375-7. doi: 10.31274/safepork-180809-1163
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
48. Zucker BA, Kruger M. Efecto del estrés de transporte sobre el contenido de endotoxinas en la sangre de los cerdos de sacrificio. Berl Munch Tierarztl Wochenschr. (1998) 111:208-10.
49. Obernier JA, Baldwin RL. Establecer un período apropiado de aclimatación después del transporte de animales de laboratorio. ILAR J. (2006) 47:364–9. doi: 10.1093/ilar.47.4.364
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
50. Otten W, Puppe B, Kanitz E, Schon PC, Stabenow B. Efectos fisiológicos y conductuales de diferentes éxitos durante la confrontación social en cerdos con experiencia previa de dominio.Physiol Behav. (2002) 75:127-33. doi: 10.1016/S0031-9384(01)00630-8
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
51. Quiniou N, Noblet J, van Milgen J, Dubois S. Modelización de la producción de calor y el equilibrio energético en cerdos en crecimiento alojados en grupo expuestos a temperaturas ambiente bajas o altas. Br J Nutr. (2001) 85:97–106. doi: 10.1079/BJN2000217
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
52. Shah GS, Das BK, Kumar S, Singh MK, GP de Bhandari. Base ácida y alteración electrolítica en la diarrea. Kathmandu Univ Med J (KUMJ). (2007) 5:60–2.
53. Frustaci A, Pennestrì, Scoppetta C. Daño miocárdico debido a hipopotasemia e hipofosfatemia. Postgrado Med J. (1984) 60:679–81. doi: 10.1136/pgmj.60.708.679
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
54. Kane MG, Luby JP, Krejs GJ. Secreción intestinal como causa de hipopotasemia y paro cardíaco en un paciente con strongiloidiasis. Dig Dis Sci. (1984) 29:768-72. doi: 10.1007/BF01312953
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
55. Hunter RJ, Patel VB, Miell JP, Wong HJ, Marway JS, Richardson PJ, et al. La diarrea reduce las tasas de síntesis de proteínas cardíacas en fracciones de proteínas miofibrilares en ratas in vivo. J Nutr. (2001) 131:1513–9. doi: 10.1093/jn/131.5.1513
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
56. Heinonen ML, Raekallio MR, Oliviero C, Ahokas S, Peltoniemi OA. Comparación de azaperona-detomidina-butorfano-ketamina y azaperona-tiletamina-zolazepam para anestesia en lechones. Veterinario Anaesth Analg. (2009) 36:151–7. doi: 10.1111/j.1467-2995.2008.00443.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
57. Santos M, Bertran de Lis BT, Tendillo FJ. Efectos de la dexmedetomidina intramuscular en combinación con ketamina o alfaxalone en cerdos. Veterinario Anaesth Analg. (2016) 43:81–5. doi: 10.1111/vaa.12259
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
58. Sakaguchi M, Nishimura R, Sasaki N, Ishiguro T, Tamura H, Takeuchi A. Anestesia inducida en cerdos mediante el uso de una combinación de medetomidina, butorfanol y ketamina y su inversión mediante la administración de atipamezol. Am J Vet Res. (1996) 57:529-34.
59. Lee JY, Kim MC. Anestesia de cerdos en crecimiento con tiletamina-zolazepam y reversión con flumazenil. J Vet Med Sci. (2012) 74:335–9. doi: 10.1292/jvms.10-0501
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
60. Vainio OM, Bloor BC, Kim C. Efectos cardiovasculares de una combinación de ketamina-medetomidina que produce sedación profunda en mini cerdos de Yucatán. Laboratorio Anim Sci. (1992) 42:582-8.
61. Tendillo FJ, Mascias A, Santos M, Segura IA, San Roman F, Castillo-Olivares JL. Efectos cardiopulmonares y analgésicos de la xilazina, la detomidina, la medetomidina y el antagonista atipamezole en cerdos anestesiados con isoflurano. Laboratorio Anim Sci.(1996) 46:215–9.
62. Duval JD, Pang JM, Boysen SR, Caulkett NA. Efectos cardiopulmonares de una técnica de anestesia intravenosa parcial para cerdos de laboratorio. J Am Assoc Lab Anim Sci. (2018) 57:376–81. doi: 10.30802/AALAS-JAALAS-17-000164
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
63. Lervik A, Raszplewicz J, Ranheim B, Solbak S, Toverud SF, Haga HA. ¿Dexmedetomidina o fentanilo? Estabilidad cardiovascular y analgesia durante la anestesia intravenosa total de propofol-cetamina en cerdos experimentales. Veterinario Anaesth Analg. (2018) 45:295–308. doi: 10.1016/j.vaa.2017.08.012
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
64. Glomset DJ, Glomset AT. Un estudio morfológico del sistema de conducción cardíaca en ungulados, perros y hombres: Parte II: El sistema purkinje. Soy Corazón J. (1940) 20:677–701. doi: 10.1016/S0002-8703(40)90530-0
65. Gill J, Heel RC, Fitton A. Amiodarona. Una visión general de sus propiedades farmacológicas y una revisión de su uso terapéutico en arritmias cardíacas. Drogas. (1992) 43:69-110. doi: 10.2165/00003495-199243010-00007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
66. Sattler SM, Lubberding AF, Skibsbye L, Jabbari R, Wakili R, Jespersen T, et al. El tratamiento con amiodarona en la fase temprana del infarto agudo de miocardio protege contra la fibrilación ventricular en un modelo porcino. J Cardiovasc Transl Res. (2019) 12:321-30. doi: 10.1007/s12265-018-9861-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
67. Singh BN, Jewitt DE, Downey JM, Kirk ES, Sonnenblick EH. Efectos de la amiodarona y L8040, nuevos medicamentos antianginales y antiarrítmicos, en la hemodinámica cardíaca y coronaria y en los potenciales intracelulares cardíacos. Clin Exp Pharmacol Physiol. (1976) 3:427–42. doi: 10.1111/j.1440-1681.1976.tb00620.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
68. Cote P, Bourassa MG, Delaye J, Janin A, Froment R, David P. Efectos de la amiodarona en la hemodinámica cardíaca y coronaria y en el metabolismo miocárdico en pacientes con enfermedad arterial coronaria. Circulación. (1979) 59:1165-72. doi: 10.1161/01. CIR.59.6.1165
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
69. Huber CH, Cohn LH, von Segesser LK. Reemplazo de válvula de acceso directo, un enfoque novedoso para la implantación de válvulas sin bomba utilizando stents con válvulas. J Am Coll Cardiol. (2005) 46:366-70. doi: 10.1016/j.jacc.2005.04.028
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
70. Ferrari M, Figulla HR, Schlosser M, Tenner I, Frerichs I, Damm C, et al. Reemplazo de la válvula aórtica transarterial con un stent autoen expansión en cerdos. Corazón. (2004) 90:1326-31. doi: 10.1136/hrt.2003.028951
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
71. Masson JB, Kovac J, Schuler G, Ye J, Cheung A, Kapadia S, et al. Implantación de la válvula aórtica transcatéter: revisión de la naturaleza, el manejo y la evitación de complicaciones de procedimiento. JACC Cardiovasc Interv. (2009) 2:811–20. doi: 10.1016/j.jcin.2009.07.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
72. Barbash IM, Dvir D, Ben-Dor I, Corso PJ, Goldstein SA, Wang Z, et al. Impacto del reemplazo de la válvula aórtica transapical en el movimiento de la pared apical. J Am Soc Echocardiogr. (2013) 26:255-60. doi: 10.1016/j.echo.2012.11.003
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
73. Edwards MB, Taylor KM, Shellock FG. Válvulas cardíacas prostáticas: evaluación de las interacciones del campo magnético, el calentamiento y los artefactos a 1,5 T. Imágenes de resonancia magnética. (2000) 12:363–9. doi: 10.1002/1522-2586(200008)12:2<363::aid-jmri21>3.0.co;2-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
74. Lipiski M, Eberhard M, Fleischmann T, Halvachizadeh S, Kolb B, Maisano F, et al. Evaluación basada en la tomografía computarizada de las dimensiones cardíacas porcinas para ayudar en la planificación previa al estudio y optimizar la selección de modelos para la investigación preclínica. Representante de ciencia ficción (2020) 10:6020. doi: 10.1038/s41598-020-63044-1
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
75. Kalantari K, Chang JN, Ronco C, Rosner MH. Evaluación del estado del volumen intravascular y la capacidad de respuesta del volumen en pacientes gravemente enfermos.Riñón Int. (2013) 83:1017-28. doi: 10.1038/ki.2012.424
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Palabras clave: modelo animal grande, válvula aórtica, fuga paravalvular, insuficiencia aórtica (IA), mínimamente invasivo, bucle fotovoltaico, resonancia magnética, cerdo
Cita: Weisskopf M, Glaus L, Trimmel NE, Hierweger MM, Leuthardt AS, Kukucka M, Stolte T, Stoeck CT, Falk V, Emmert MY, Kofler M y Cesarovic N (2022) Dos y no hacer en modelos animales grandes de insuficiencia aórtica.Frente. Veterinario. Sci. 9:949410. doi: 10.3389/fvets.2022.949410
Editado por:
Stefano Guido, Universidad de Edimburgo, Reino Unido
Revisado por:
Michel R. Labrosse, Universidad de Ottawa, Canadá
Kelly Yamada, Escuela de Medicina Icahn en el Monte Sinaí, Estados Unidos
Copyright © 2022 Weisskopf, Glaus, Trimmel, Hierweger, Leuthardt, Kukucka, Stolte, Stoeck, Falk, Emmert, Kofler y Cesarovic.
*Correspondencia: Nikola Cesarovic, Nikola.Cesarovic@hest.ethz.ch
†Estos autores han contribuido por igual a este trabajo
Descargo de responsabilidad: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamación que pueda ser fabricado por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía