Quimiosensibilidad de tres cultivos primarios derivados de pacientes de mesotelioma pericárdico canino
 Quimiosensibilidad de tres cultivos primarios derivados de pacientes de mesotelioma pericárdico canino mediante tratamiento con monoterapia y combinación
Quimiosensibilidad de tres cultivos primarios derivados de pacientes de mesotelioma pericárdico canino mediante tratamiento con monoterapia y combinación
 Rina Nabeta1
Rina Nabeta1  Ami Kanaya1
Ami Kanaya1  Mohamed Elbadawy2,3,4
Mohamed Elbadawy2,3,4  Tatsuya Usui2
Tatsuya Usui2  Tetsuya Furya5
Tetsuya Furya5  Kazuhiko Suzuki6
Kazuhiko Suzuki6  TsuyoshiUchide1*
TsuyoshiUchide1*- 1Laboratorio de Patología Molecular y Terapéutica Veterinaria, Facultad de Agricultura, Universidad de Agricultura y Tecnología de Tokio, Fuchu, Tokio, Japón
- 2Laboratorio de Farmacología Veterinaria, Facultad de Agricultura, Universidad de Agricultura y Tecnología de Tokio, Fuchu, Tokio, Japón
- 3Departamento de Farmacología, Facultad de Medicina Veterinaria, Universidad de Benha, Benha, Egipto
- 4Departamento de Patología, Facultad de Medicina Veterinaria, Universidad de Georgia, Athens, GA, Estados Unidos
- 5Laboratorio de Enfermedades Infecciosas Veterinarias, Facultad de Agricultura, Universidad de Agricultura y Tecnología de Tokio, Fuchu, Tokio, Japón
- 6Laboratorio de Toxicología Veterinaria, Facultad de Agricultura, Universidad de Agricultura y Tecnología de Tokio, Fuchu, Tokio, Japón
Introducción: El mesotelioma canino es un tumor maligno poco frecuente que afecta principalmente a las cavidades corporales, como las cavidades pericárdicas y pleurales. La quimioterapia juega un papel crucial en el tratamiento de los mesoteliomas caninos. Nuestro objetivo fue comparar los efectos antitumorales de los agentes quimioterapéuticos monofármacos y combinados en los cultivos primarios derivados de pacientes de mesotelioma pericárdico canino establecidos en este estudio. Planeamos generar modelos de xenoinjertos para futuros estudios.
Material y métodos: Se recogieron muestras de derrame de tres perros con mesotelioma pericárdico diagnosticado histológicamente y se utilizaron para cultivo primario. Las células cultivadas se caracterizaron mediante inmunotinción para pancitoqueratina AE1/AE3, vimentina, gen supresor de tumores de Wilms 1 (WT1) y citoqueratina 5 (CK5). Para evaluar las propiedades tumorigénicas de las células en el derrame y generar un modelo de xenoinjerto, la suspensión celular se inyectó en un ratón inmunodeficiente combinado severo (SCID) por vía subcutánea (SC) o intraperitoneal (IP). Por último, se evaluó la quimiosensibilidad de los cultivos primarios establecidos frente a cuatro fármacos, doxorrubicina, vinorelbina, carboplatino y gemcitabina, mediante un tratamiento monofarmacológico, así como un tratamiento combinado de carboplatino a una concentración fija, ya sea 10 o 100 μM, y gemcitabina a diferentes concentraciones que oscilan entre 0 y 1000 μM, mediante un ensayo de viabilidad celular.
Resultados: Los cultivos primarios se generaron con éxito y se caracterizaron por doble positividad para AE1/AE3 y vimentina y tinción positiva para WT-1 y CK5, confirmando el origen mesotelial de las células. En los modelos de xenoinjerto, el ratón SC desarrolló una masa subcutánea, mientras que el ratón IP desarrolló múltiples nódulos intraperitoneales. Las masas eran histopatológicamente compatibles con mesoteliomas. El ensayo de quimiosensibilidad reveló que el carboplatino tuvo los efectos antitumorales más altos entre los cuatro tratamientos probados con un solo fármaco. Además, el carboplatino a 100 μM combinado con gemcitabina a dosis clínicamente relevantes demostró el aumento de los efectos antitumorales en comparación con el tratamiento con agente único.
Discusión y conclusión: Los cultivos primarios y los modelos de xenoinjertos generados en este estudio podrían ser herramientas útiles para estudios in vitro e in vivo del mesotelioma canino. El carboplatino es un agente quimioterapéutico altamente eficaz contra el mesotelioma canino cuando se usa como agente único y en combinación con gemcitabina.
1. Introducción
El mesotelioma canino es un tumor maligno poco frecuente que surge de las células mesoteliales que recubren la superficie de las cavidades corporales. Los mesoteliomas caninos afectan principalmente a las cavidades pericárdica y pleural (1-3). Los perros con mesotelioma a menudo muestran signos clínicos inespecíficos, como letargo, anorexia, pérdida de peso, disnea o insuficiencia cardíaca debido a la acumulación de líquido en las cavidades corporales afectadas (4-6). El diagnóstico por imágenes es muy eficaz para detectar derrames en cavidades corporales; Sin embargo, a menudo no se puede determinar la causa del derrame como mesotelioma porque rara vez, si es que alguna vez, desarrollan una masa discreta lo suficientemente grande como para ser detectada por esta modalidad menos invasiva hasta las últimas etapas de la enfermedad (2, 4, 7-10). Debido a la ausencia de signos clínicos específicos y a la dificultad del diagnóstico precoz mediante herramientas diagnósticas habituales, la resección quirúrgica completa de la masa no es posible en la mayoría de los casos debido a la progresión de la enfermedad en el momento del diagnóstico (6, 11).
La quimioterapia juega un papel crucial en el tratamiento de los mesoteliomas caninos irresecables, al igual que en los humanos, debido a la tendencia de los mesoteliomas a formar pequeñas lesiones nodulares difusas a lo largo de las cavidades corporales, y la dificultad para dirigirse a la superficie de las cavidades corporales mediante radioterapia, que es otra opción terapéutica útil para los tumores sólidos irresecables. Sin embargo, los estudios in vitro e in vivo sobre la eficacia de la quimioterapia y los protocolos de tratamiento estándar para el mesotelioma canino son escasos. De hecho, la mayoría de los casos publicados de mesotelioma canino utilizaron empíricamente agentes quimioterapéuticos clásicos basados en informes previos de un solo caso o series de casos pequeñas, en los que se logró una supervivencia más prolongada en comparación con los registros históricos no tratados (6, 11-15). Recientemente, se ha publicado un artículo de revisión sobre los resultados de perros tratados con quimioterapia basado en 40 casos retrospectivos (11). En ese estudio se confirmó la efectividad de la quimioterapia, ya que fue el único tratamiento asociado de forma independiente con la supervivencia en la cohorte. Sin embargo, la naturaleza retrospectiva del estudio limita la capacidad de determinar el agente quimioterapéutico más eficaz para el mesotelioma.
La escasez de estudios fundamentales se debe en parte a la falta de herramientas básicas de investigación, como líneas celulares y modelos animales preclínicos de mesotelioma canino. Por lo tanto, los objetivos de este estudio fueron (i) establecer y caracterizar cultivos primarios derivados de pacientes caninos con mesotelioma pericárdico como modelo experimental in vitro, (ii) generar modelos animales de xenoinjertos para futuros estudios preclínicos in vivo, y (iii) realizar un ensayo de quimiosensibilidad utilizando cultivos primarios derivados de pacientes para determinar la eficacia de la quimioterapia y comparar los efectos antineoplásicos de los agentes quimioterapéuticos seleccionados actualmente Disponible para pacientes veterinarios contra mesoteliomas pericárdicos caninos. Este estudio tuvo como objetivo establecer un modelo experimental y proporcionar una base científica para el uso de agentes quimioterapéuticos y posibles protocolos de tratamiento.
2. Material y métodos
2.1. Recogida de muestras
Las muestras de derrame se obtuvieron de forma estéril mediante pericardiocentesis o toracocentesis guiadas por ecografía utilizando una aguja de calibre 23 de perros que fueron remitidos al Centro Médico Animal de la Universidad de Agricultura y Tecnología de Tokio, entre 2018 y 2019 para el diagnóstico tentativo de mesotelioma pericárdico. Las muestras incluidas en este estudio se obtuvieron de perros con diagnóstico confirmado a través de histopatología, mientras que las que no tuvieron confirmación histopatológica fueron excluidas del estudio. Los propietarios de todos los perros incluidos en este estudio proporcionaron su consentimiento informado verbal y escrito. Se obtuvo la aprobación de la ética animal y todo el estudio se llevó a cabo de acuerdo con las recomendaciones de las Directrices del Comité de Ética de Investigación Clínica de la Universidad de Agricultura y Tecnología de Tokio (n.º 0016017).
2.2. Cultivo celular
Las muestras de derrame recolectadas se procesaron inmediatamente para el cultivo celular primario. Las células del derrame se aislaron por centrifugación a 600 g durante 3 min y se lavaron tres veces con solución salina tamponada con fosfato (PBS). Cuando una muestra tenía una contaminación sanguínea prominente, se incubó con tampón de lisis de glóbulos rojos (tampón de lisado de glóbulos rojos Hybri-Max, Sigma Life Science) durante 15 minutos a 37 °C para eliminar los glóbulos rojos. Después de la centrifugación final, los gránulos celulares que contenían células neoplásicas se resuspendieron en medio de cultivo, RPIM-1604 suplementado con suero bovino feto (FBS) inactivado al 10% y 100 μg/ml de Primocina (InvivoGen), a la concentración de 1 × 106 células/ml. Para todos los experimentos de este estudio se utilizó un medio de cultivo con la misma composición. Un total de 10 mL de la suspensión celular se sembró en un recipiente de 75 cm2 matraz de cultivo. Las células se cultivaron en una incubadora humidificada a 37 °C y 5% de CO2. Las células se pasaron al 70-80% de confluencia.
2.3. Inmunotinción
Se realizó inmunotinción para caracterizar cultivos primarios de mesotelioma pericárdico canino. En primer lugar, las células cultivadas se lavaron en PBS, se separaron del matraz mediante tratamiento con una solución de tripsina/ácido etilendiaminotetraacético (EDTA) al 0,25% durante 10 min a temperatura ambiente y se suspendieron en el medio de cultivo. Células a una concentración final de 103 Las células/pocillo se sembraron en un microportaobjetos de vidrio (Matsunami, TF0808). Después de 24 horas de incubación, las células se fijaron en una solución de paraformaldehído al 4% durante 15 min y se lavaron tres veces con PBS durante 5 min cada una. A continuación, las células se trataron con Triton-X al 0,2% durante 10 min y se lavaron tres veces en PBS. El bloqueo se realizó con albúmina sérica bovina al 10% durante 30 min antes de aplicar el anticuerpo primario e incubar a temperatura ambiente durante 3 h. Los anticuerpos primarios utilizados fueron contra la pancitoqueratina AE1/AE3 (dilución 1:100; Novus Biologicals), vimentina (dilución 1:500; Santa Cruz Biotechnology), el gen supresor de tumores de Wilms 1 (WT1) (listo para usar; Dako) y citoqueratina 5 (CK-5) (dilución 1:400; GeneTex). Finalmente, se añadió un anticuerpo secundario marcado con fluorescencia (anticuerpo IgG de ratón conjugado con Alexa Fluor 488, dilución 1:500; abcam) y se incubó a temperatura ambiente durante una hora. Los núcleos se contratiñeron con Hoechst (dilución 1:1000). Las imágenes se obtuvieron mediante un microscopio de fluorescencia (Olympus).
2.4. Modelos de xenoinjerto
Para evaluar las capacidades tumorigénicas de las células en el derrame y establecer un modelo experimental in vivo para futuros estudios, se generaron dos modelos de xenoinjerto de mesotelioma pericárdico canino mediante la inyección de una suspensión celular (caso 1, MC18003; paso a 0) en diferentes sitios. Se sacrificaron dos ratones con inmunodeficiencia combinada severa (IDCG) (Aprobación ética animal nº 29-92). A los ratones SCID se les inyectó suspensión celular (1 × 106 células en 50 μl PBS) por vía subcutánea (ratón SC) o intraperitoneal (ratón IP). Los ratones fueron monitoreados para detectar cambios en las condiciones de salud, como la apariencia grosera, la condición corporal, el estado respiratorio, el comportamiento clínico y el crecimiento de cualquier masa visible. Cuando se desarrolló una masa visible en un ratón SC, ambos ratones fueron sacrificados con isoflurano y se realizó una necropsia. Se analizaron histopatológicamente las masas subcutáneas e intraperitoneales encontradas durante la necropsia. Los tejidos se fijaron en formol tamponado neutro al 10%, se incluyeron en parafina y se tiñeron con hematoxilina y eosina (H&E) de forma rutinaria. Las imágenes fueron capturadas por un microscopio óptico (Olympus).
2.5. Ensayo de quimiosensibilidad
Se realizó un ensayo de quimiosensibilidad para evaluar y comparar los efectos antitumorales de diferentes fármacos quimioterapéuticos en células de mesotelioma canino. En este estudio se utilizaron tres cultivos primarios generados a partir del derrame pleural (MC18003, MC19002 MC19009; paso a los 2-6). Dos agentes quimioterapéuticos utilizados convencionalmente para el mesotelioma canino, carboplatino y doxorrubicina, y otros dos agentes quimioterapéuticos utilizados para el mesotelioma humano y disponibles para pacientes veterinarios, vinorelbina y gemcitabina, se probaron como agentes únicos. El carboplatino, la doxorrubicina y la vinorelbina se probaron a 0,1, 1, 10 y 100 μM, mientras que la gemcitabina se probó a 1, 10, 100 y 1000 μM. Además, se evaluaron los efectos del tratamiento combinado con carboplatino y gemcitabina, un agente a base de platino y un antimetabolito, respectivamente, teniendo en cuenta que la quimioterapia de primera línea para el mesotelioma humano había sido una terapia combinada con un antineoplásico basado en platino y un nuevo antimetabolito. La gemcitabina se probó a diferentes concentraciones que oscilaban entre 0 y 1000 μM, mientras que la concentración de carboplatino se fijó en 10 o 100 μM. Los fármacos quimioterápicos utilizados en este estudio fueron los de uso clínico. Como tales, eran solubles en agua y primero se disolvía un fármaco en polvo en solución salina estéril, seguido de una dilución a cada concentración con medio de cultivo. Los grupos control se cultivaron solo en medio de cultivo.
Se sembraron aproximadamente 5000 células por pocillo en medio de cultivo de 100 μl en una microplaca de 96 pocillos para el ensayo de quimiosensibilidad. Después de 24 horas de incubación y lavado en PBS, se dispensó un medio de cultivo de 100 μl que contenía un agente quimioterapéutico. Las células se incubaron con un agente quimioterapéutico durante 72 h antes de un ensayo de viabilidad celular. Para el tratamiento combinado, las células se trataron inicialmente con gemcitabina durante 4 h, seguido de un tratamiento con carboplatino durante 68 h. La viabilidad celular se midió utilizando el Cell Counting Kit-8 (CCK-8) (Dojindo) de acuerdo con las instrucciones del fabricante. Brevemente, se añadieron 10 μl de solución de CCK-8 a cada pocillo. Después de 2 h de incubación, se midió la absorbancia a 450 nm utilizando un lector de microplacas. Se calculó la viabilidad celular y se comparó con la del control sin tratamiento. El ensayo se realizó por duplicado para las réplicas técnicas y se repitió tres veces en diferentes ocasiones para las réplicas biológicas.
2.6. Análisis estadístico
Se calculó el promedio (media) y el error estándar (EE), y se examinaron las diferencias entre muestras. Para el análisis estadístico se realizó la prueba de Kruskal-Wallis, seguida de la prueba de Steel-Dwass para el análisis post-hoc. La significación estadística se fijó en p ≤ 0,05.
3. Resultados
3.1. Casos clínicos de mesotelioma pericárdico canino
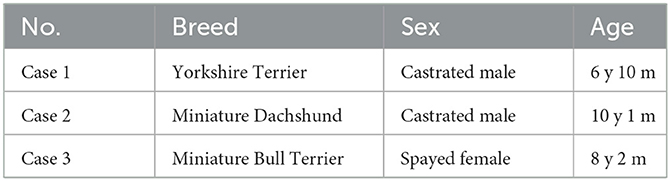
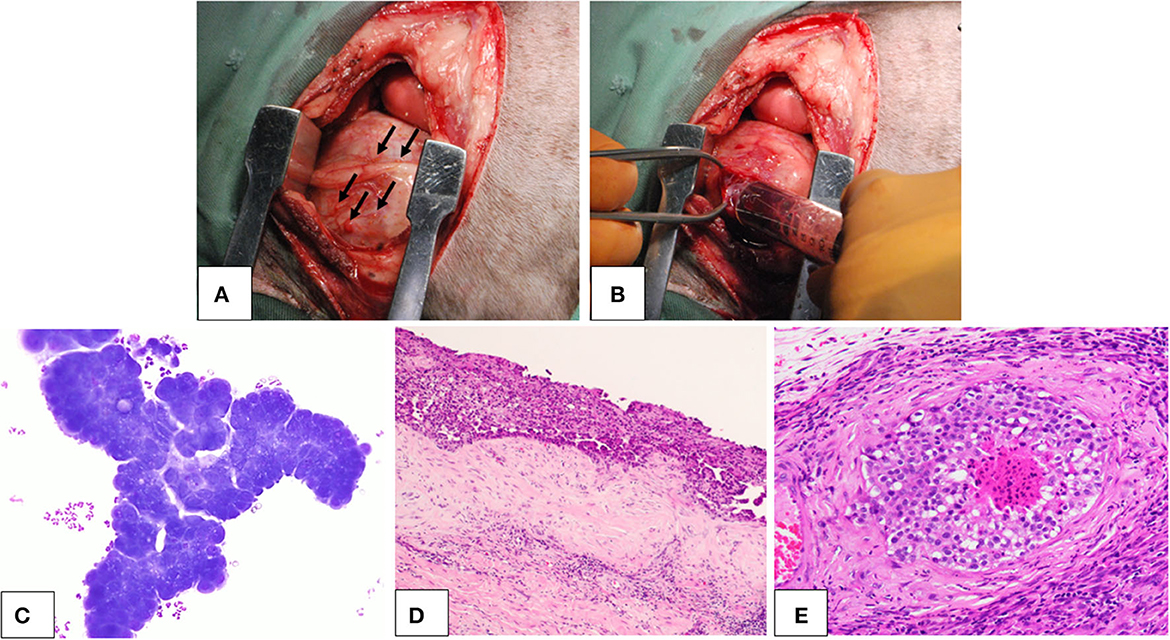
Tres perros fueron diagnosticados de mesotelioma pericárdico basándose en la histopatología del pericardio resecado. La señalización de los perros se presenta en la Tabla 1. Los tres perros mostraron signos clínicos atribuibles al mesotelioma, como letargo, anorexia, pérdida de peso, disnea e insuficiencia cardíaca, incluido taponamiento cardíaco e insuficiencia cardíaca derecha debido al derrame. No presentaban grandes masas discretas en el diagnóstico por imagen, incluida la tomografía computarizada y la ecografía, y durante la cirugía se encontraron múltiples nódulos pequeños en la superficie del pericardio y la pleura (Figuras 1A, B). Las muestras de derrame para cultivo celular contenían numerosas células neoplásicas (Figura 1C). La histopatología del pericardio resecado reveló una marcada proliferación de células mesoteliales neoplásicas e invasión a los vasos y tejidos más profundos (Figuras 1D, E).
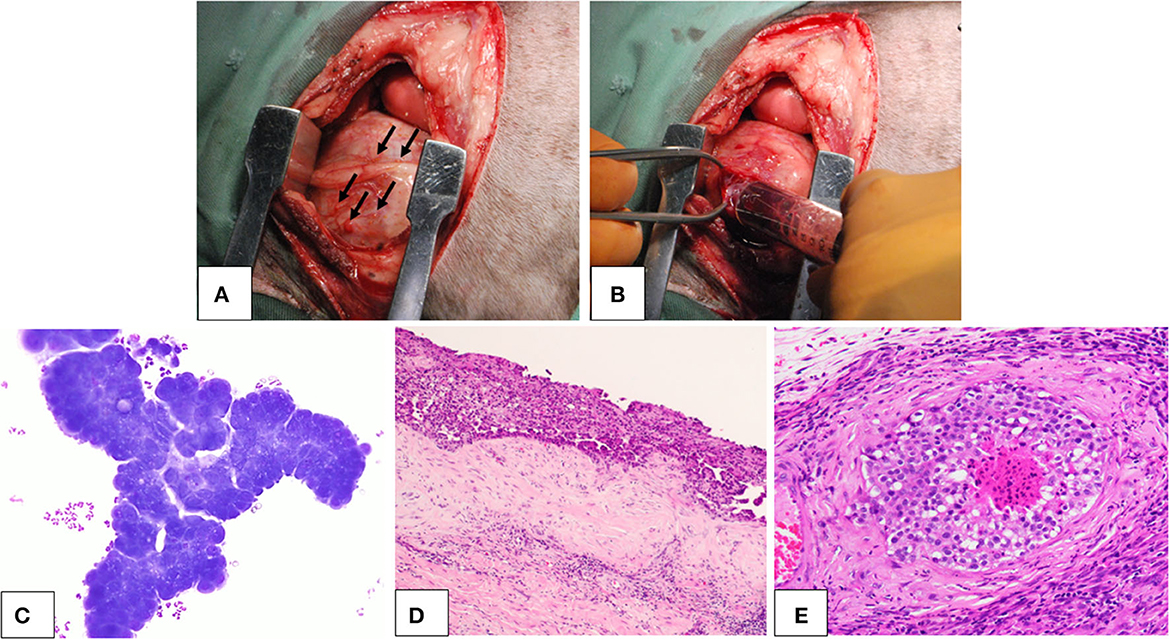 Figura 1. Mesotelioma pericárdico canino. Lesiones macroscópicas, citología e histopatología. (A, B) Hallazgos macroscópicos del mesotelioma pericárdico canino durante la cirugía. (A) Se observaron pequeñas lesiones nodulares (flechas) en toda la cavidad pleural, incluyendo el pericardio y la pleura. (B) Durante la pericardiectomía, se recogieron derrames pleurales y pericárdicos de aspecto hemorrágico. (C) Citología del derrame pericárdico en un perro con mesotelioma pericárdico. Se observaron células neoplásicas en conglomerados que mostraban una marcada atipia celular. (D, E) Histopatología del mesotelioma pericárdico canino con (D) bajo (×4) y (E) alto (×200) aumento. Las células neoplásicas alineadas con el mesotelio proliferaron en capas gruesas. El tumor presentaba evidencias de invasión tisular y vascular, lo que indicaba su naturaleza maligna.
Figura 1. Mesotelioma pericárdico canino. Lesiones macroscópicas, citología e histopatología. (A, B) Hallazgos macroscópicos del mesotelioma pericárdico canino durante la cirugía. (A) Se observaron pequeñas lesiones nodulares (flechas) en toda la cavidad pleural, incluyendo el pericardio y la pleura. (B) Durante la pericardiectomía, se recogieron derrames pleurales y pericárdicos de aspecto hemorrágico. (C) Citología del derrame pericárdico en un perro con mesotelioma pericárdico. Se observaron células neoplásicas en conglomerados que mostraban una marcada atipia celular. (D, E) Histopatología del mesotelioma pericárdico canino con (D) bajo (×4) y (E) alto (×200) aumento. Las células neoplásicas alineadas con el mesotelio proliferaron en capas gruesas. El tumor presentaba evidencias de invasión tisular y vascular, lo que indicaba su naturaleza maligna.
3.2. Cultivo celular e inmunotinción
A partir de las muestras de derrame se generaron cultivos celulares primarios. Las células en el cultivo formaron láminas monocapa y crecieron en una disposición de pavimento epitelial sin inhibición de contacto (Figura 2A). Las células eran de forma poligonal a dendrítica y tenían núcleos redondos a ovalados y nucléolos prominentes de tamaño mediano, con núcleos gigantes ocasionales, binucleación o múltiples nucléolos. La inmunotinción reveló que las células eran positivas para AE1/AE3 y vimentina, que eran marcadores epiteliales y mesenquimales, respectivamente (Figuras 2B, C). Además, las células fueron positivas para los marcadores mesoteliales WT1 y CK5 (Figuras 2D, E). El patrón de inmunotinción de WT1 fue mayoritariamente nuclear, con tinción citoplasmática débil, mientras que CK5 mostró un patrón de inmunotinción citoplasmática.
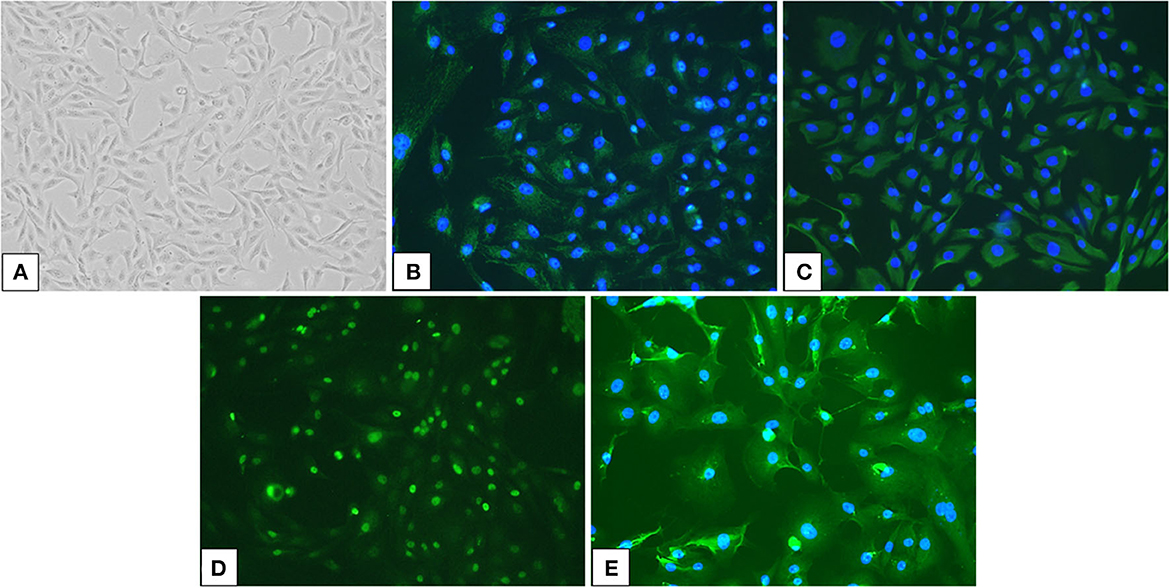 Figura 2. Cultivo de células aisladas de una muestra de derrame de un perro con mesotelioma pericárdico y su inmunorreactividad para marcadores mesoteliales. (A) Se aislaron y cultivaron células neoplásicas en el derrame pleural de un perro con mesotelioma pericárdico (×100). (B, E) Las células neoplásicas cultivadas fueron doblemente positivas para los marcadores epiteliales (B) pan-citoqueratina (AE1/AE3) y el marcador mesenquimal (C) vimentina, así como para los marcadores mesoteliales (D) gen supresor de tumores de Wilms 1 (WT1) y (E) citoqueratina 5 (CK5) por inmunofluorescencia (×200).
Figura 2. Cultivo de células aisladas de una muestra de derrame de un perro con mesotelioma pericárdico y su inmunorreactividad para marcadores mesoteliales. (A) Se aislaron y cultivaron células neoplásicas en el derrame pleural de un perro con mesotelioma pericárdico (×100). (B, E) Las células neoplásicas cultivadas fueron doblemente positivas para los marcadores epiteliales (B) pan-citoqueratina (AE1/AE3) y el marcador mesenquimal (C) vimentina, así como para los marcadores mesoteliales (D) gen supresor de tumores de Wilms 1 (WT1) y (E) citoqueratina 5 (CK5) por inmunofluorescencia (×200).
3.3. Modelos de xenoinjerto
El ratón SC desarrolló una masa visible 60 días después de la inyección de la suspensión celular cuando se realizó una necropsia de ratones SC e IP (Figura 3). La necropsia reveló una masa discreta e inmóvil en los tejidos subcutáneos a los musculares donde se inyectaron las células (Figura 3A). La masa era de ~10 mm de diámetro, firme y de color blanco a tostado en la superficie cortada. El ratón IP desarrolló varios pequeños nódulos pedunculados que variaban en tamaño (1-2 mm de diámetro) en la membrana serosa a lo largo de la cavidad peritoneal (Figura 3D). Los nódulos eran discretos, parecidos a dormitorios, exofíticos y de color blanco a tostado.
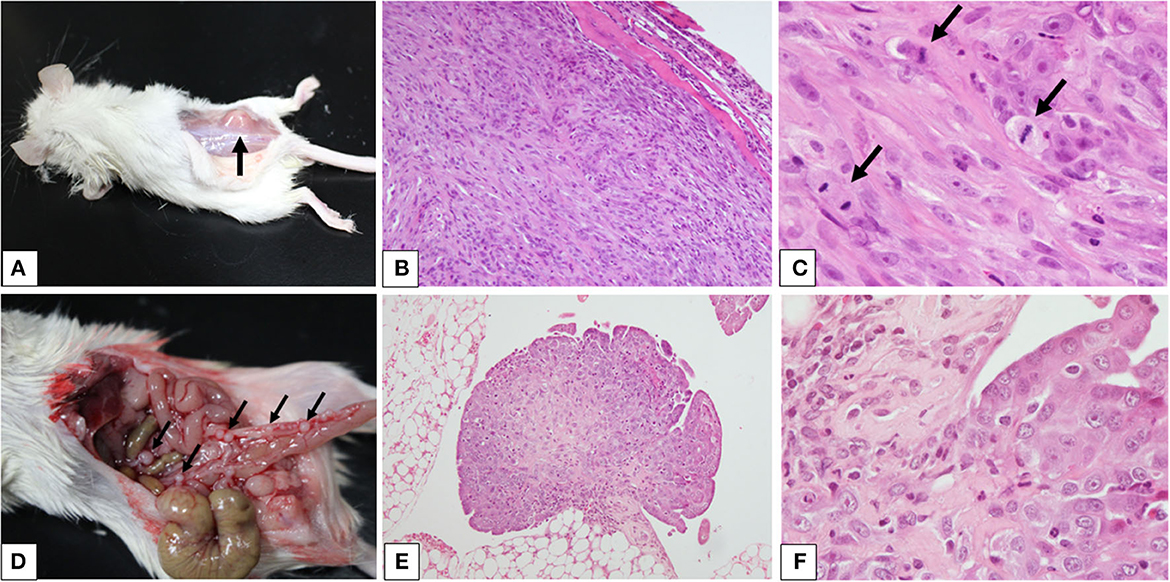 Figura 3. Modelos de xenoinjerto de mesotelioma pericárdico canino utilizando ratones inmunodeficientes combinados severos. (De la A a la F) Se crearon modelos de xenoinjerto de mesotelioma pericárdico canino mediante la inyección de células neoplásicas en el tejido subcutáneo (A) o en la cavidad intraperitoneal. Las masas se indican con las flechas. La histopatología de las masas que se desarrollaron en el tejido subcutáneo (B, ×100 y C, ×400) o en la cavidad intraperitoneal [(E) ×100 y (F) ×400] reveló rasgos característicos del mesotelioma. Se observó una alta actividad mitótica [(C) flechas].
Figura 3. Modelos de xenoinjerto de mesotelioma pericárdico canino utilizando ratones inmunodeficientes combinados severos. (De la A a la F) Se crearon modelos de xenoinjerto de mesotelioma pericárdico canino mediante la inyección de células neoplásicas en el tejido subcutáneo (A) o en la cavidad intraperitoneal. Las masas se indican con las flechas. La histopatología de las masas que se desarrollaron en el tejido subcutáneo (B, ×100 y C, ×400) o en la cavidad intraperitoneal [(E) ×100 y (F) ×400] reveló rasgos característicos del mesotelioma. Se observó una alta actividad mitótica [(C) flechas].
La histopatología de la masa del ratón SC reveló una masa elevada y bien delimitada que crecía en la capa muscular (Figura 3B). La masa estaba compuesta por láminas de células cohesivas de cuboidales a poligonales en el área periférica, con haces de células fusiformes en el centro. Las células poligonales tenían abundante citoplasma eosinófilo con núcleos grandes, redondos a ovalados, cromatina finamente punteada y nucléolos prominentes. Las células fusiformes tenían cantidades pequeñas a moderadas de citoplasma eosinófilo con núcleos ovalados a alargados, cromatina gruesa y, ocasionalmente, nucléolos visibles (Figura 3C). Los nódulos del ratón IP mostraron patrones de crecimiento papilar y exofítico (Figura 3E). Se adhirieron a la membrana serosa e invadieron el tejido adiposo. Los patrones de crecimiento y las características celulares fueron similares a los observados en el ratón SC (Figura 3F). Estos hallazgos fueron consistentes con mesotelioma.
3.4. Ensayo de quimiosensibilidad
Los efectos antitumorales de los cuatro quimioterápicos en cultivos primarios de mesoteliomas pericárdicos caninos se evaluaron mediante un ensayo de viabilidad celular como agente único (Figura 4) o en combinación (Figura 5). En cuanto al tratamiento con agente único, tanto la doxorrubicina como la vinorelbina mostraron efectos inhibidores del crecimiento dependientes de la dosis. En comparación con el control sin tratamiento, la doxorrubicina inhibió el crecimiento celular al 64,3 % (± 5,9) (media ± EE), al 49,7 % (± 5,7), al 27,5 % (± 5,0) y al 9,8 % (± 1,2) en promedio a 0,1 μM, 1 μM, 10 μM y 100 μM, respectivamente. Se observó significación estadística a ≥10 μM en las tres líneas celulares (P ≤ 0,05). De manera similar, la vinorelbina inhibió el crecimiento celular al 46,2% (± 4,3), al 44,0% (± 4,0), al 31,3% (± 2,2) y al 6,0% (± 1,0) en promedio a 0,1 μM, 1, 10 μM y 100 μM, respectivamente, con una significación estadística detectada a ≥1 μM en todas las líneas celulares (P ≤ 0,05). A diferencia de los dos quimioterápicos anteriores que mostraron efectos dependientes de la dosis, el carboplatino suprimió el crecimiento celular solo a 100 μM, e inhibió el crecimiento celular al 99,0% (± 4,3), 98,0% (± 5,4), 89,0% (± 5,0), 20,6% (± 2,9) en promedio a 0,1, 1, 10 y 100 μM, respectivamente. La significación estadística se detectó a 100 μM en las tres líneas. Los efectos inhibidores del crecimiento de la gemcitabina fueron inconsistentes entre las líneas celulares. Dos líneas celulares (caso 1, MC18003; caso 2, MC19002) fueron sensibles a la gemcitabina a una dosis de 1 μM, mientras que la otra línea celular (caso 3, MC19009) fue resistente al fármaco incluso a 1000 μM. Teniendo en cuenta las concentraciones plasmáticas máximas de cada fármaco cuando se administró clínicamente, doxorrubicina a 0,5-1 μM, vinorelbina a 0,15-1 μM, carboplatino a 100-250 μM y gemcitabina a 80-100 μM, que fueron equivalentes a ~30 mg/m2, 15–20 mg/m2, 300 mg/m2y 675 mg/m2, respectivamente, fueron más relevantes para el entorno clínico (16-22). En estas condiciones, el carboplatino fue el más eficaz de los cuatro fármacos probados.
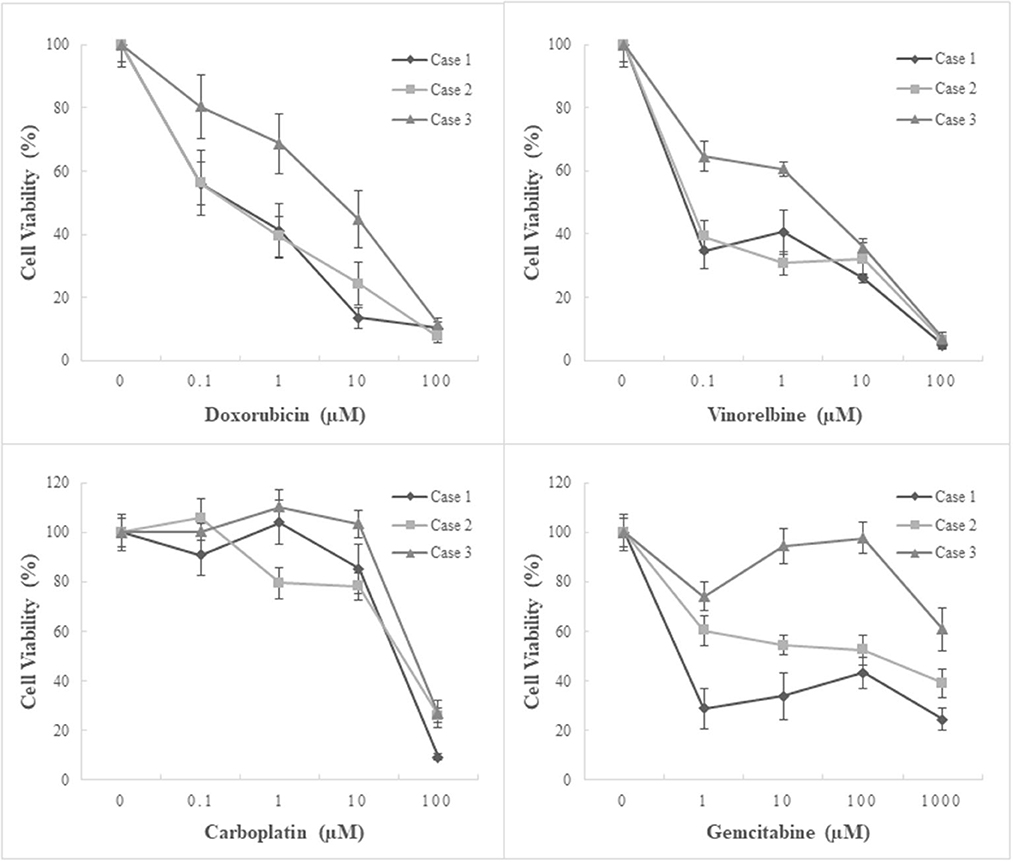 Figura 4. Ensayo de quimiosensibilidad utilizando tres cultivos primarios derivados de pacientes de mesotelioma pericárdico canino. Tratamiento con agente único. Se trataron tres cultivos primarios de mesotelioma pericárdico canino derivados de pacientes con cuatro agentes quimioterapéuticos: doxorrubicina, vinorelbina, carboplatino y gemcitabina, como agente único. El carboplatino demostró los efectos inhibidores más altos sobre el crecimiento celular entre los cuatro fármacos, especialmente en concentraciones clínicamente relevantes.
Figura 4. Ensayo de quimiosensibilidad utilizando tres cultivos primarios derivados de pacientes de mesotelioma pericárdico canino. Tratamiento con agente único. Se trataron tres cultivos primarios de mesotelioma pericárdico canino derivados de pacientes con cuatro agentes quimioterapéuticos: doxorrubicina, vinorelbina, carboplatino y gemcitabina, como agente único. El carboplatino demostró los efectos inhibidores más altos sobre el crecimiento celular entre los cuatro fármacos, especialmente en concentraciones clínicamente relevantes.
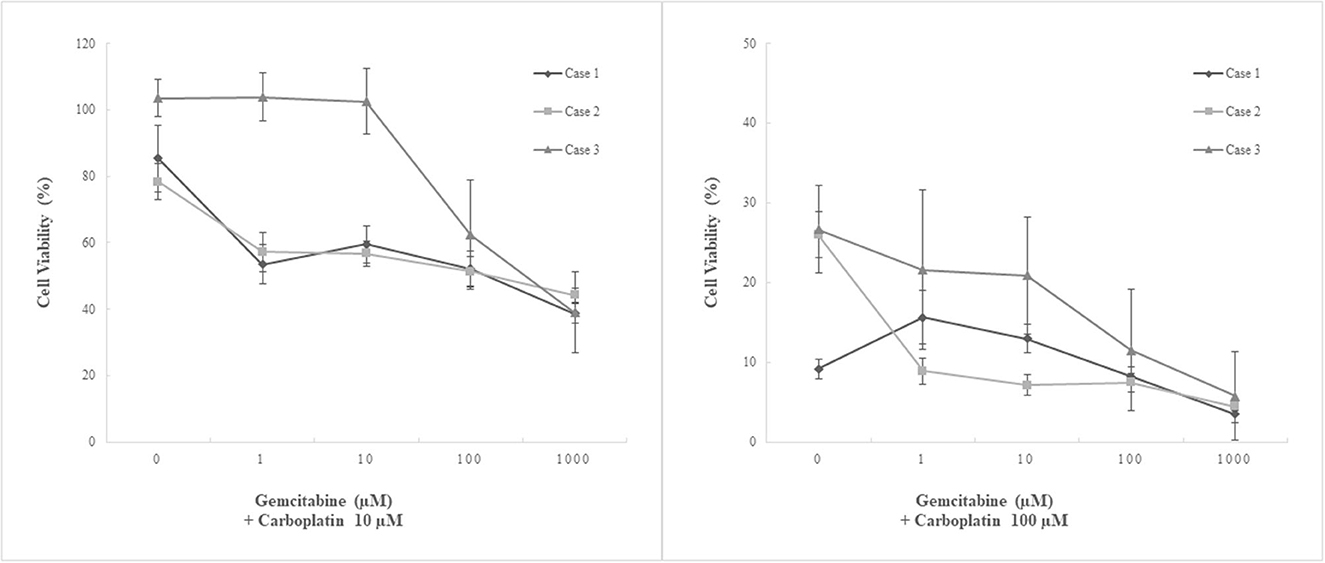 Figura 5. Ensayo de quimiosensibilidad utilizando tres cultivos primarios derivados de pacientes de mesotelioma pericárdico canino. Tratamiento combinado. Se trataron tres cultivos primarios de mesotelioma pericárdico canino derivados de pacientes con una combinación de dos agentes quimioterapéuticos, carboplatino y gemcitabina. El carboplatino a 10 μM combinado con cualquier concentración clínicamente relevante (<100 μM) de gemcitabina no mostró efectos antitumorales aumentados. Por otro lado, el carboplatino a 100 μM combinado con ≥1 μM de gemcitabina disminuyó significativamente la viabilidad celular en una línea celular (caso 2, MC19002) en comparación con el tratamiento con agente único. Otra línea celular que mostró resistencia relativa al carboplatino (caso 3, MC19009) también tendió a disminuir la viabilidad celular cuando se trató con 100 μM de carboplatino y 100 μM o más de gemcitabina; sin embargo, no se detectó significación estadística.
Figura 5. Ensayo de quimiosensibilidad utilizando tres cultivos primarios derivados de pacientes de mesotelioma pericárdico canino. Tratamiento combinado. Se trataron tres cultivos primarios de mesotelioma pericárdico canino derivados de pacientes con una combinación de dos agentes quimioterapéuticos, carboplatino y gemcitabina. El carboplatino a 10 μM combinado con cualquier concentración clínicamente relevante (<100 μM) de gemcitabina no mostró efectos antitumorales aumentados. Por otro lado, el carboplatino a 100 μM combinado con ≥1 μM de gemcitabina disminuyó significativamente la viabilidad celular en una línea celular (caso 2, MC19002) en comparación con el tratamiento con agente único. Otra línea celular que mostró resistencia relativa al carboplatino (caso 3, MC19009) también tendió a disminuir la viabilidad celular cuando se trató con 100 μM de carboplatino y 100 μM o más de gemcitabina; sin embargo, no se detectó significación estadística.
Se realizó tratamiento combinado con carboplatino y gemcitabina. El carboplatino a 10 μM, en el que el tratamiento con monoterapia no mostró efectos inhibidores, suprimió significativamente el crecimiento celular solo cuando se trató con gemcitabina a 1000 μM en combinación. No se observaron efectos inhibidores aumentados a concentraciones clínicamente relevantes de gemcitabina (≤ 100 μM). Por el contrario, el carboplatino a 100 μM combinado con ≥1 μM de gemcitabina disminuyó significativamente la viabilidad celular en una línea celular (caso 2, MC19002) en comparación con el tratamiento con agente único. Otra línea celular que mostró resistencia relativa al carboplatino (caso 3, MC19009) también tendió a disminuir la viabilidad celular a una dosis de 100 μM o más de gemcitabina con 100 μM de carboplatino; sin embargo, no se detectó significación estadística.
4. Discusión
En este estudio, se generaron con éxito cultivos primarios de mesotelioma pericárdico a partir del derrame pleural de pacientes caninos. Se utilizaron derrames pleurales, en lugar de tejidos tumorales, debido a su relativamente fácil accesibilidad y eficacia en el establecimiento de cultivos. El derrame pleural se observa cuando se altera el delicado equilibrio entre la pleura parietal y visceral y el espacio pleural (23). La mayoría de los mesoteliomas afectan a la pleura parietal y visceral y, a menudo, se asocian con derrame pleural. Las células cancerosas en la pleura producen mediadores inflamatorios, aumentan la permeabilidad vascular y causan acumulación de líquidos (es decir, derrame) en la cavidad pleural (24). Las células del mesotelioma también pueden implantarse y propagarse a través de los espacios cavitarios, invadir los tejidos y vasos más profundos y obstruir el drenaje linfático, lo que facilita aún más el desarrollo del derrame (25, 26). En estadios avanzados de mesotelioma, el derrame suele clasificarse como exudado o derrame neoplásico, que contiene numerosas células neoplásicas del tumor. Nuestras muestras también exhibieron esta característica, ya que las células de mesotelioma en etapas avanzadas tienden a exfoliarse fácilmente en fluidos (6, 23). Curiosamente, las células cancerosas flotantes conservan la capacidad de formar focos secundarios, al menos en parte debido al apoyo de los nutrientes y la supervivencia y los estimuladores mitogénicos suministrados por el derrame (26). Además, los perros con mesotelioma pericárdico a menudo experimentan taponamiento cardíaco o disnea debido al derrame de los espacios pericárdico y pleural. La pericardiocentesis o toracocentesis es un procedimiento paliativo para reducir la carga del derrame; La recolección de muestras de derrame para cultivo primario es un enfoque eficaz para recolectar células cancerosas y un procedimiento bien tolerado con algunos beneficios para un paciente, incluso en etapas avanzadas donde la intervención quirúrgica ya no es necesaria. Además, los pacientes pueden someterse a la colocación del portal para el manejo del derrame y la posible quimioterapia intracavitaria, lo que hace que el derrame sea un recurso factible para el cultivo (5, 6, 26, 27).
Las células cultivadas se caracterizaron por inmunotinción, que reveló inmunorreactividad tanto para la pan-citoqueratina como para la vimentina. Estos marcadores se utilizan de forma rutinaria para el cribado inicial de tejidos neoplásicos con el fin de clasificar los tumores epiteliales y mesenquimales. Debido a que la mayoría de los cánceres suelen marcarse positivamente con pancitoqueratina o vimentina sola, la tinción positiva con ambos marcadores a menudo proporciona una pista inicial para el posible diagnóstico de mesotelioma. Por lo tanto, la positividad dual suele considerarse uno de los rasgos característicos del mesotelioma, y ambos marcadores se utilizan tradicionalmente en combinación para la identificación presuntiva de células mesoteliales, especialmente en medicina veterinaria, donde los anticuerpos fiables son limitados (1, 2, 6, 28-31). Como algunos otros cánceres pueden mostrar una doble positividad, en nuestro estudio también se utilizaron anticuerpos específicos para las células mesoteliales, a saber, WT1 y CK5. En humanos, ambos se consideran marcadores positivos de mesotelioma (32, 33). WT1 es un factor de transcripción esencial para el desarrollo de riñones y gónadas e históricamente se sabe que es responsable de la tumorigénesis del tumor de Wilms, un tumor renal raro en humanos (34). Se han demostrado alteraciones en este gen en varios tumores, y los estudios han demostrado que puede desempeñar un papel oncogénico en estos tumores (34-40). En los mesoteliomas humanos, WT1 puede promover la proliferación celular, la migración y la quimiorresistencia (41). Una revisión que analizó 88 artículos publicados enumeró el WT1 como uno de los marcadores diagnósticos más específicos para el mesotelioma con una especificidad del 96% (42). El canino WT1 fue clonado molecularmente por Sakai et al. en 2017. Los autores demostraron la reactividad cruzada de la proteína WT1 canina con un anticuerpo monoclonal anti-humano WT1 de ratón (43). En este estudio, se utilizó el mismo clon (6F-H2) del anticuerpo WT1, que mostró una reactividad positiva contra células primarias cultivadas de mesotelioma pericárdico canino. Este resultado es consistente con un estudio reciente que demostró la utilidad diagnóstica de WT1 en el mesotelioma canino (44). El marcaje positivo con el anticuerpo anti-WT1 fue fuertemente sugestivo del origen mesotelial de las células. CK5 es otro marcador de mesotelioma utilizado en medicina humana para diferenciar el mesotelioma del adenocarcinoma pulmonar (45-47). La inmunorreactividad de CK5 se ha detectado en aproximadamente el 64-97% de los mesoteliomas en derrames, preparaciones de bloques celulares y cortes histológicos (42, 45, 46). Como las células cultivadas fueron positivas para WT1 y CK5, así como doble positividad para pan-citoqueratina y vimentina, se confirmó un origen mesotelial.
Las células adquiridas a partir de derrames también demostraron propiedades tumorigénicas cuando se inyectaron en un ratón SCID. Los hallazgos macroscópicos e histopatológicos de las masas que se desarrollaron en ratones SCID fueron similares a los observados en pacientes caninos, incluidos los casos clínicos involucrados en este estudio (10, 25, 48-50). Los mesoteliomas tienden a desarrollarse como múltiples lesiones pequeñas elevadas, nodulares, papilares, miliares o similares a placas en la superficie de la membrana serosa en lugar de grandes masas discretas, como se observa en los tumores malignos típicos. Teniendo en cuenta esta característica del mesotelioma, generamos dos tipos diferentes de modelos de xenoinjerto: SC e IP. Los modelos SC se han creado con frecuencia para estudios in vivo de varios cánceres a través de procedimientos relativamente sencillos, como la inyección subcutánea de suspensiones celulares. Una masa subcutánea, si se desarrolla, podría palparse o evaluarse macroscópicamente, de modo que cuando la masa haya crecido significativamente, se pueda determinar el punto final de los experimentos para minimizar la carga sobre un animal en términos de ética animal (51). En este estudio, ambos ratones fueron sacrificados cuando una masa visible en el modelo SC alcanzó un tamaño razonable, ya que era difícil evaluar las lesiones intraperitoneales y la progresión de la enfermedad en el modelo IP; Sin embargo, ambos ratones se comportaron bien clínicamente durante el experimento. Además, una masa visible discreta es adecuada para la evaluación de los efectos antitumorales durante el descubrimiento de fármacos o estudios preclínicos, que es uno de los principales propósitos de los experimentos in vivo (52). La metástasis subcutánea o siembra de mesotelioma es una complicación rara de la intervención quirúrgica o toracocentesis y se ha descrito esporádicamente en perros con mesotelioma (3, 53). Por lo tanto, este modelo de SC puede ser útil para comprender los mecanismos de metástasis subcutáneas o siembra de mesoteliomas y para investigar las opciones de tratamiento óptimas. Por el contrario, el modelo IP recapitula los mesoteliomas típicos, formando lesiones nodulares miliares en la membrana serosa a lo largo de la cavidad corporal afectada. Dado que los tratamientos para los mesoteliomas caninos suelen incluir la quimioterapia intracavitaria como único método o en combinación con quimioterapia intravenosa (11), este modelo IP podría ser adecuado para comprender la biología y patogenia del tumor, además de evaluar la efectividad de la quimioterapia intracavitaria e intravenosa o nuevas modalidades terapéuticas en un microambiente tumoral más apropiado. Una desventaja importante del modelo IP sobre el modelo SC es la dificultad para evaluar el desarrollo tumoral, la progresión de la enfermedad y la respuesta a un fármaco o modalidad terapéutica de interés. Por lo tanto, los investigadores deben disponer de una herramienta especial, como la tomografía por emisión de positrones-tomografía computarizada (PET-CT), como en el estudio de Collin et al., que proporciona una disponibilidad limitada a los investigadores en el campo veterinario (54). Alternativamente, se puede evaluar el peso de los tumores y el volumen de derrame si el criterio de valoración experimental estaba predeterminado (55).
Dado que los mesoteliomas caninos tienden a no formar masas discretas y, a menudo, se diagnostican en estadios avanzados en los que la resección quirúrgica completa no es posible, la quimioterapia es el pilar del tratamiento (11). Sin embargo, faltan estudios preclínicos sustanciales sobre los efectos de los agentes quimioterapéuticos en los mesoteliomas caninos debido a la falta de disponibilidad de herramientas básicas de investigación, como las líneas celulares de mesotelioma canino. Para abordar este problema, primero generamos cultivos primarios utilizando muestras clínicas y utilizamos estos cultivos para estudios in vitro para investigar los efectos antitumorales de los agentes quimioterapéuticos en los mesoteliomas caninos. Los cuatro medicamentos fueron seleccionados para las pruebas en base a estudios caninos y humanos publicados anteriormente. Los fármacos a base de platino, como el cisplatino y el carboplatino, y los antibióticos citotóxicos, incluida la doxorrubicina, se han utilizado para tratar los mesoteliomas en pacientes veterinarios por vía intracavitaria o intravenosa o ambas (11-15). Los otros dos fármacos investigados en este estudio, la vinorelbina y la gemcitabina, se han utilizado a menudo en pacientes humanos después de que recaen o demuestran quimiorresistencia contra un régimen de primera línea que consiste en un agente a base de platino, cisplatino o carboplatino, combinado con un nuevo antimetabolito (56-58). Estos dos fármacos tienen una ventaja sobre otros fármacos, ya que están disponibles para pacientes veterinarios con algún grado de estudios fundamentales completados (20, 59-63). Nuestros resultados respaldan el uso histórico del carboplatino como la quimioterapia de primera elección en monoterapia para el mesotelioma canino, ya que demostró los efectos inhibidores del crecimiento más altos a dosis clínicamente relevantes entre los cuatro probados. El carboplatino, en particular, fue de interés debido a su toxicidad relativamente baja en comparación con el cisplatino. Debido a que muchos pacientes con mesotelioma son de mediana edad a ancianos, a menudo tienen comorbilidades que limitan el uso de cisplatino, que es altamente tóxico. Sin embargo, el cisplatino sigue siendo una opción de tratamiento atractiva cuando no existen limitaciones para su uso, dados sus mecanismos de acción similares a los de un agente quimioterapéutico a base de platino. Curiosamente, la eficacia potencial del cisplatino en los mesoteliomas caninos fue sugerida por un estudio reciente (64). En el mismo estudio, el carboplatino también mostró grados considerables de efectos antitumorales, lo que fomentó el uso clínico continuo de agentes quimioterapéuticos a base de platino. La doxorrubicina se consideró apropiada para su uso dada su actividad moderada, como se muestra en este estudio, en línea con los resultados clínicos informados previamente (11, 13). La vinorelbina es única en el sentido de que puede administrarse por vía intravenosa u oral (20). Aunque su uso clínico en pacientes veterinarios es limitado, la vinorelbina puede ser una candidata razonable para la quimioterapia de segunda o tercera línea con un solo fármaco. Sin embargo, se requieren más estudios preclínicos y clínicos para validar estos resultados.
Recientemente, las estrategias terapéuticas para el mesotelioma humano han evolucionado notablemente debido a la introducción de varios medicamentos nuevos contra el cáncer, incluido un nuevo antimetabolito (57, 58, 65). Hasta 2004, la quimioterapia en monoterapia con fármacos a base de platino era el tratamiento de primera línea para los mesoteliomas irresecables. Desde entonces, se han llevado a cabo extensos estudios sobre el nuevo antimetabolito, y su alta tasa de respuesta cuando se combina con medicamentos basados en platino ha llevado a un cambio en el protocolo estándar a quimioterapia combinada que consiste en agentes basados en platino y antimetabolito, que fue aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos (57, 58, 65). Investigamos la utilidad potencial de la quimioterapia combinada con carboplatino (un agente a base de platino) y gemcitabina (un antimetabolito). Se eligió la gemcitabina debido a su relativa accesibilidad para los pacientes veterinarios y su conocida sinergia con los agentes a base de platino. Los mecanismos que subyacen a estos efectos sinérgicos no se comprenden completamente; sin embargo, se ha especulado con una alteración de la reparación del ácido desoxirribonucleico (ADN) y un aumento de la formación de aductos de platino-ADN (66-69). En este estudio, se observaron efectos inhibidores del crecimiento aumentados en líneas celulares que mostraron resistencia relativa al carboplatino después del tratamiento con un solo agente. Curiosamente, la gemcitabina revierte la resistencia al cisplatino, otro agente a base de platino, en varios cánceres humanos (70). Los agentes a base de platino funcionan formando aductos de ADN con platino para formar enlaces intra e interhebra que alteran la estructura del ADN, inhiben la replicación y la transcripción y, en última instancia, conducen a la muerte celular (71). La reparación del ADN es un determinante significativo de la sensibilidad a los agentes a base de platino, y la resistencia a menudo se relaciona con los sistemas funcionales de reparación del ADN (71). La gemcitabina puede restaurar la sensibilidad al platino en las células cancerosas al afectar el sistema de reparación del ADN. La gemcitabina incorpora sus metabolitos en el ADN, lo que conduce a la terminación de la ADN polimerasa. La incorporación ocurre con un nucleótido adicional después del metabolito, evitando la escisión por parte de las exonucleasas de ADN, una enzima crucial para la reparación del ADN (66, 69). La gemcitabina también inhibe la ribonucleótido reductasa, una enzima importante en la replicación y reparación del ADN (66, 69). Además, las estructuras distorsionadas del ADN creadas por la gemcitabina son favorables para unir el platino al ADN, que es un mecanismo de acción vital del carboplatino (66). Esta interacción ventajosa entre el carboplatino y la gemcitabina hace que estos dos fármacos sean candidatos prometedores para la terapia combinada. El tratamiento combinado con carboplatino y gemcitabina mostró eficacia contra líneas celulares quimiorresistentes en nuestro estudio. Esto sugiere que el uso de esta combinación como un posible protocolo de rescate, o como un tratamiento de segunda línea para cánceres refractarios previamente tratados con quimioterapia en monoterapia, podría ser una opción razonable. Se necesitan más estudios para evaluar la utilidad clínica de este protocolo en pacientes caninos.
En conclusión, este estudio demostró la factibilidad de utilizar cultivos primarios generados a partir de derrames de perros con mesoteliomas pericárdicos desarrollados espontáneamente. Proporciona a los investigadores herramientas fundamentales para estudios in vitro e in vivo. Además, nuestros resultados pueden contribuir a un uso más racional de fármacos anticancerígenos, como los agentes basados en platino, en quimioterapia monofármica o combinada contra los mesoteliomas caninos.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
Los estudios en animales fueron aprobados por el Comité de Ética de Investigación Clínica de la Universidad de Agricultura y Tecnología de Tokio (n.º 0016017). Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
RN: Conceptualización, Análisis formal, Investigación, Metodología, Recursos, Visualización, Redacción, borrador original, Redacción, revisión y edición. AK: Investigación, Recursos, Redacción, revisión y edición. ME: Investigación, Metodología, Redacción, Revisión y Edición. TUs: Conceptualización, Curación de datos, Investigación, Administración de proyectos, Recursos, Supervisión, Redacción, revisión y edición. TF: Conceptualización, Investigación, Supervisión, Redacción, Revisión y Edición. KS: Conceptualización, Análisis formal, Investigación, Metodología, Redacción, revisión y edición. Conceptualización, Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Recursos, Supervisión, Validación, Redacción, revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este trabajo fue apoyado por la subvención JSPS KAKENHI número 20K06408.
Reconocimientos
Los autores desean agradecer al Dr. Yudai Tamada, al Sr. Taichi Murakami, al Dr. Risako Kobatake y al Dr. Yuka Kobayashi por su apoyo en la adquisición y análisis de datos, así como por el cuidado crítico de los pacientes. Los autores agradecen al Dr. Ryuji Fukushima por realizar los procedimientos quirúrgicos y brindar cuidados críticos a los pacientes. Finalmente, los autores expresan sinceramente su gratitud al Dr. Ikki Mitsui por compartir su profundo conocimiento y experiencia con nosotros y por su dedicado trabajo en histopatología.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Vural S.A., Ozyildiz Z. Ozsoy SuleY. Mesotelioma pleural en un perro de nueve meses Ir. Vet J. (2007) 60:30–3. doi: 10.1186/2046-0481-60-1-30
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. McDonough SP, MacLachlan NJ, Tobias AH. Mesotelioma pericárdico canino. Veterinario Pathol. (1992) 29:256–60. doi: 10.1177/030098589202900312
3. Morgan KRS, Dominic CG, Beeler-Marfisi J, Craig K, Hoddinott KL, O’Sullivan S, et al. Metástasis presunta de mesotelioma pericárdico después de pericardiocentesis repetida en un perro. ¿Puede Vet J. (2019) 60:972–5.
4. Ikede BO, Zubaidy A, Gill CW. Mesotelioma pericárdico con taponamiento cardíaco en un perro. Veterinario Pathol. (1980) 17:496–500. doi: 10.1177/030098588001700412
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Hartmann HF, DE Oliveira MT, Feranti JPS, Coradini GP, Abati SL, Pierezan BZ, et al. Pericardiectomía toracoscópica asociada a catéter totalmente implantable mediante toracoscopia en el manejo del mesotelioma en una perra. J Vet Med Sci. (2019) 81:946–8. doi: 10.1292/jvms.17-0631
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Moberg HL, Gramer I, Schofield I, Blackwood L, Killick D, Priestnall SL, et al. Presentación clínica, tratamiento y evolución del mesotelioma maligno canino: estudio retrospectivo de 34 casos. Veterinario Comp Oncol. (2022) 20:304–12. doi: 10.1111/vco.12777
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Gallach RG, Mai W. Hallazgos de resonancia magnética cardíaca en un perro con mesotelioma pericárdico difuso y derrame pericárdico. J Am Anim Hosp Assoc. (2013) 49:398–402. doi: 10.5326/JAAHA-MS-5925
8. MacDonald KA, Cagney O, Magne ML. Caracterización ecocardiográfica y clinicopatológica del derrame pericárdico en perros: 107 casos (1985-2006). J Am Vet Med Assoc. (2009) 235:1456–61. doi: 10.2460/javma.235.12.1456
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Rivera PA, Borgarelli M. Imágenes cardiovasculares: pericarditis constrictiva y derrame tricavitario en un perro con mesotelioma pericárdico. J Vet Cardiol. (2020) 32:55–9. doi: 10.1016/j.jvc.2020.09.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Levi M, Parenti F, Muscatello LV, Battaia S, Santilli R, Perego M, et al. Hallazgos patológicos de pericarditis idiopática canina y mesoteliomas pericárdicos: correlación con datos clínicos y de supervivencia. Veterinaria Sci. (2021) 8:162. doi: 10.3390/vetsci8080162
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Lajoinie M, Chavalle T, Floch F, Sayag D, Lanore D, Ponce F, et al. Resultado de los perros tratados con quimioterapia para el mesotelioma: un estudio clínico retrospectivo en 40 casos y una revisión de la literatura. Veterinario Comp Oncol. (2022) 20:825–35. doi: 10.1111/vco.12843
12. Moore AS, Kirk C, Cardona A. Experiencia de quimioterapia intracavitaria con cisplatino con seis perros. J Veterinario Pasante Med. (1991) 5:227–31. doi: 10.1111/j.1939-1676.1991.tb00953.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Closa JM, Font A, Mascort J. Mesotelioma pericárdico en un perro: supervivencia a largo plazo después de la pericardiectomía en combinación con quimioterapia. J Pequeña Anim Pract. (1999) 40:383–6. doi: 10.1111/j.1748-5827.1999.tb03105.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Charney SC, Bergman PJ, McKnight A, Farrelly JC. Evaluación de mitoxantrona y carboplatino intracavitarios para el tratamiento de carcinomatosis, sarcomatosis y mesotelioma, con o sin derrames malignos: un análisis retrospectivo de 12 casos (1997–2002). Veterinario Comp Oncol. (2005) 3:171–81. doi: 10.1111/j.1476-5810.2005.00075.x*
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Seo K-W, Choi US, Jung Y-C, Hong SJ, Byeun YE, Kang MS, et al. Tratamiento paliativo intravenoso con cisplatino para el mesotelioma peritoneal y pleural concurrente en un perro. J Vet Med Sci. (2007) 69:201–4. doi: 10.1292/jvms.69.201
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. McMahon MB, Bear MD, Kulp SK, Pennell ML, Londres CA. Actividad biológica de la gemcitabina contra las líneas celulares de osteosarcoma canino in vitro. Am J Vet Res. (2010) 71:799–808. doi: 10.2460/ajvr.71.7.799
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Wouda RM, Miller ME, Chon E, Stein TJ. Efectos clínicos de la administración de vinorelbina en el tratamiento de varios tipos de tumores malignos en perros: 58 casos (1997-2012). J Am Vet Med Assoc. (2015) 246:1230–7. doi: 10.2460/javma.246.11.1230
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Iwano M, Sadahiro K, Maruo T, Kawarai S, Kayanuma H, Orito K. Concentración sérica y seguridad del goteo intravenoso versus administración subcutánea de carboplatino en perros. J Vet Med Sci. (2021) 83:775–9. doi: 10.1292/jvms.20-0653
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Konecny G, Untch M, Slamon D, Beryt M, Kahlert S, Felber M, et al. Interacciones medicamentosas y efectos citotóxicos de paclitaxel en combinación con carboplatino, epirrubicina, gemcitabina o vinorelbina en líneas celulares de cáncer de mama y muestras tumorales. Tratamiento del cáncer de mama. (2001) 67:223–33. doi: 10.1023/A:1017980411398
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Zhou XJ, Landi H, Breillout F, Rahmani R. Farmacocinética de la navelbina después de la administración oral en el perro y el mono. Medicamentos contra el cáncer. (1993) 4:511–5. doi: 10.1097/00001813-199308000-00014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Wittenburg LA, Weishaar K, Ramírez D, Gustafson DL. El área de doxorrubicina bajo la curva es un predictor importante de neutropenia en perros con cánceres naturales. Veterinario Comp Oncol. (2019) 17:147–54. doi: 10.1111/vco.12455
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Nair AB, Jacob S, A. Guía práctica simple para la conversión de dosis entre animales y humanos. J Basic Clin Pharm. (2016) 7:27–31. doi: 10.4103/0976-0105.177703
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Feller-Kopman D, Light R. Enfermedad pleural. N Engl J Med. (2018) 378:740–51. doi: 10.1056/NEJMra1403503
24. Stathopoulos GT, Kalomenidis I. Derrame pleural maligno: interacciones tumor-huésped desencadenadas. Am J Respir Crit Care Med. (2012) 186:487–92. doi: 10.1164/rccm.201203-0465PP
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Psallidas I, Kalomenidis I, Porcel JM, Robinson BW, Stathopoulos GT. Derrame pleural maligno: del banco a la cabecera del paciente. Eur Respir Rev. (2016) 25:189–98. doi: 10.1183/16000617.0019-2016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Mejor diputado, Frimberger AE. Carcinomatosis ovárica en una perra tratada con cirugía y quimioterapia intraperitoneal, sistémica e intrapleural utilizando puertos de acceso pleural permanentes. ¿Puede Vet J. (2017)58:493–7.
28. Yamamoto S, Fukushima R, Kobayashi M, Machida N. Forma mixta de mesotelioma pericárdico con diferenciación ósea en un perro. J Comp Pathol. (2013) 149:229–32. doi: 10.1016/j.jcpa.2013.01.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Coe SE, Garner MM, Kiupel M. Caracterización inmunohistoquímica del mesotelioma en 6 grandes felinos. J Vet Diagn Invest. (2021) 33:767–71. doi: 10.1177/10406387211015640
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Schlueter AH, Dehghanpir SD, Boudreaux B, Robinson C, Menk P, Lima JC. Mesotelioma felino: reporte de un caso y revisión de los hallazgos citológicos, inmunocitoquímicos, histopatológicos e histoquímicos inmunitarios. J Vet Diagn Invest. (2021) 33:753–7. doi: 10.1177/10406387211017489
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Duggan MA, Masters CB, Alexander F. Diferenciación inmunohistoquímica del mesotelioma maligno, la hiperplasia mesotelial y el adenocarcinoma metastásico en derrames serosos, utilizando la tinción para antígeno carcinoembrionario, queratina y vimentina. Acta Cytol. (1987) 31:807–14.
32. Porcel JM. Biomarcadores en el diagnóstico de enfermedades pleurales: una actualización de 2018. Ther adv respir dis. (2018) 12:1753466618808660. doi: 10.1177/1753466618808660
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Tsuta K, Kato Y, Tochigi N, Hoshino T, Takeda Y, Hosako M, et al. Comparación de diferentes clones (WT49 versus 6F-H2) de anticuerpos WT-1 para el diagnóstico inmunohistoquímico del mesotelioma pleural maligno. Appl Immunohistochem Mol Morphol. (2009) 17:126–30. doi: 10.1097/PAI.0b013e318187dd26
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Oji Y, Ogawa H, Tamaki H, Oka Y, Tsuboi A, Kim EH, et al. Expresión del gen tumoral WT1 de Wilms en tumores sólidos y su implicación en el crecimiento de células tumorales. Jpn J Cáncer Res. (1999) 90:194–204. doi: 10.1111/j.1349-7006.1999.tb00733.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Phikulsod P, Sukpanichnant S, Kunacheewa C, Chieochansin T, Junking M, Yenchitsomanus PT. Alta prevalencia de la expresión del tumor de Wilms 1 en mieloma múltiple y plasmocitoma: una cohorte de 142 muestras de pacientes asiáticos. Pathol Oncol Res. (2023) 29:1610844. doi: 10.3389/pore.2023.1610844
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Abd El-Hafez A. Ismail Hany HSED. La expresión citoplasmática del clon WT1 6F-H2 diferencia los tumores astrocíticos de la astrogliosis y se asocia con el grado tumoral, la histopatología, el estado de IDH1, los índices apoptóticos y proliferativos: un estudio de microarrays tisulares. Asian Pac J Cancer Prev. (2020) 21:2403–13. doi: 10.31557/APJCP.2020.21.8.2403
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Oji Y, Tatsumi N, Kobayashi J, Fukuda M, Ueda Tazu, Nakano E, et al. El gen tumoral WT1 de Wilms promueve la reparación del daño del ADN mediada por recombinación homóloga. Mol Carcinog. (2015) 54:1758–71. doi: 10.1002/mc.22248
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Jomgeow T, Oji Y, Tsuji N, Ikeda Y, Ito K, Tsuda A, et al. La isoforma WT1 17AA(-)/KTS(-) del gen tumoral de Wilms induce cambios morfológicos y promueve la migración e invasión celular in vitro. Cáncer Sci. (2006) 97:259–70. doi: 10.1111/j.1349-7006.2006.00169.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Tatsumi N, Oji Y, Tsuji N, Tsuda A, Higashio M, Aoyagi S, et al. El gen tumoral WT1-shRNA de Wilms como un potente agente inductor de la apoptosis para tumores sólidos. Int J Oncol. (2008) 32:701–11. doi: 10.3892/ijo.32.3.701
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Zamora-Ávila DE, Franco-Molina MA, Trejo-Ávila LM, Rodríguez-Padilla C, Reséndez-Pérez D, Zapata-Benavides P, et al. Melanoma Res. (1) 16:10–2007. doi: 17.341/CMR.8b10e1097efd0ae
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Plönes T, Fischer M, Höhne K, Sato H, Müller-Quernheim J, Zissel G. Vuelta atrás de la rueda: inducción de la transición mesenquimal a epitelial a través de la caída del tumor de Wilms 1 en líneas celulares de mesotelioma humano para influir en la proliferación, la invasividad y la quimiotaxis. Pathol Oncol Res. (2017) 23:723–30. doi: 10.1007/s12253-016-0181-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. King JE, Thatcher N, Pickering CAC, Hasleton PS. Sensibilidad y especificidad de los marcadores inmunohistoquímicos utilizados en el diagnóstico del mesotelioma epitelioide: un análisis sistemático detallado utilizando datos publicados. Histopatología. (2006) 48:223–32. doi: 10.1111/j.1365-2559.2005.02331.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Sakai O, Sakurai M, Sakai H, Kubo M, Hiraoka H, Baba K, et al. Clonación molecular del tumor de Wilms canino 1 para análisis inmunohistoquímico en tejidos caninos. J Vet Med Sci. (2017) 79:1272–7. doi: 10.1292/jvms.17-0229
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Milne EM, Piviani M, Hodgkiss-Geere HM, Piccinelli C, Cheeseman M, Cazzini P, et al. Comparación del bloqueo celular de derrame e inmunohistoquímica de biopsia en hiperplasia mesotelial, mesotelioma y carcinoma en perros. Veterinario Clin Pathol. (2021) 50:555–67. doi: 10.1111/vcp.13002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Escudo PW, Koivurinne K. El valor de la calretinina y la citoqueratina 5/6 como marcadores de mesotelioma en preparaciones de bloques celulares de derrames serosos. Cytopathology. (2008) 19:218–23. doi: 10.1111/j.1365-2303.2007.00482.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Hyun TS, Barnes M, Tabatabai ZL. Utilidad diagnóstica de D2-40, calretinina, CK5/6, desmina y MOC-31 en la diferenciación del mesotelioma del adenocarcinoma en la citología de derrame pleural. Acta Cytol. (2012) 56:527–32. doi: 10.1159/000339586
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Chu PeiguoG, Weiss LM. Expresión de citoqueratina 5/6 en neoplasias epiteliales: estudio inmunohistoquímico de 509 casos. Mod Pathol. (2002) 15:6–10. doi: 10.1038/modpathol.3880483
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Brower A, Herold LV, Kirby BM. Mesotelioma cardíaco canino con morfología de células granulares. Veterinario Pathol. (2006) 43:384–7. doi: 10.1354/vp.43-3-384
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Harbison ML, Godleski JJ. Mesotelioma maligno en perros urbanos. Veterinario Pathol. (1983) 20:531–40. doi: 10.1177/030098588302000504
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Stevens BJ, Montgomery SA, Phillips KL, Wester MW, Jennings SH. Patología en la práctica. Mesotelioma maligno en un perro. J Am Vet Med Assoc. (2014) 245:57–9. doi: 10.2460/javma.245.1.57
51. Inamoto T, Yamada T, Ohnuma K, Kina S, Takahashi N, Yamochi T, et al. Anticuerpo monoclonal anti-CD26 humanizado como tratamiento para tumores malignos de mesotelioma. Clin Cáncer Res. (2007) 13:4191–200. doi: 10.1158/1078-0432.CCR-07-0110
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Sato A, Arai T, Fusegi M, Ando A, Yano T, A. El derivado redox-inactivo del tocotrienol suprime el crecimiento tumoral de las células de mesotelioma en un modelo de xenoinjerto. Biol Pharm Bull. (2019) 42:1034–7. doi: 10.1248/bpb.b18-00924
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Brisson BA, Reggeti F, Bienzle D. Metástasis del sitio portal del mesotelioma invasivo después de la toracoscopia diagnóstica en un perro. J Am Vet Med Assoc. (2006) 229:980–3. doi: 10.2460/javma.229.6.980
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Colin DJ, Cottet-Dumoulin D, Faivre A, Germain S, Triponez F, Serre-Beinier V. Modelo experimental de mesotelioma maligno humano en ratones atímicos. Int J Mol Sci. (2018) 19:1881. doi: 10.3390/ijms19071881
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Abe S, Kaneko MK, Tsuchihashi Y, Izumi T, Ogasawara S, Okada N, et al. Efecto antitumoral del nuevo anticuerpo anti-podoplanina NZ-12 contra el mesotelioma pleural maligno en un modelo de xenoinjerto ortotópico. Cáncer Sci. (2016) 107:1198–205. doi: 10.1111/cas.12985
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Zauderer MG, Kass SL, Woo K, Sima CS, Ginsberg MS, Krug LM. Vinorelbina y gemcitabina como terapia de segunda o tercera línea para el mesotelioma pleural maligno. Cáncer de pulmón. (2014) 84:271–4. doi: 10.1016/j.lungcan.2014.03.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Reck M, Gatzemeier U. Combinación de pemetrexed y cisplatino en el mesotelioma. Experta Rev Anticancerígena Ther. (2005) 5:231–7. doi: 10.1586/14737140.5.2.231
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Li L, Razak ARA, Hughes A. Carboplatino y pemetrexed en el tratamiento del mesotelioma pleural maligno: ¿una opción de tratamiento realista? Cáncer de pulmón. (2009) 64:207–10. doi: 10.1016/j.lungcan.2008.08.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Poirier VJ, Burgess KE, Adams WM, Vail DM. Toxicidad, dosis y eficacia de vinorelbina (Navelbine) en perros con neoplasia espontánea. J Veterinario Pasante Med. (2004) 18:536–9. doi: 10.1111/j.1939-1676.2004.tb02581.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Grant IA, Rodríguez CO, Kent MS, Sfilgoi G, Gordon I, Davis G, et al. Participación en un ensayo clínico de fase II de vinorelbina en perros con tumores cutáneos de mastocitos. J Veterinario Pasante Med. (2008) 22:388–93. doi: 10.1111/j.1939-1676.2008.0051.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
61. Freise KJ, Martín-Jiménez T. Farmacocinética de la gemcitabina y su metabolito primario en perros después de la infusión intravenosa. J Vet Pharmacol Ther. (2006) 29:147–52. doi: 10.1111/j.1365-2885.2006.00726.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Elpiner AK, Brodsky EM, Hazzah TN, Post GS. Quimioterapia con gemcitabina en monoterapia en perros con carcinomas hepatocelulares. Veterinario Comp Oncol. (2011) 9:260–8. doi: 10.1111/j.1476-5829.2011.00262.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Kosarek CE, Kisseberth WC, Gallant SL, Couto CG. Evaluación clínica de gemcitabina en perros con neoplasias malignas espontáneas. J Veterinario Pasante Med. (2005) 19:81–6. doi: 10.1111/j.1939-1676.2005.tb02662.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Sato Y, Elbadawy M, Suzuki K, Tsunedomi R, Nagano H, Ishihara Y, et al. Establecimiento de un modelo experimental de cultivo de organoides de mesotelioma maligno canino mediante un método de cultivo tridimensional. Farmacia Biomédica. (2023) 162:114651. doi: 10.1016/j.biopha.2023.114651
Resumen de PubMed | Texto completo de CrossRef | Google Académico
65. Hazarika M, White RM, Johnson JR, Pazdur R. Resúmenes de aprobación de medicamentos de la FDA: pemetrexed (Alimta). Oncólogo. (2004) 9:482–8. doi: 10.1634/theoncologist.9-5-482
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. van Moorsel CJ, Pinedo HM, Veerman G, Bergman AM, Kuiper CM, Vermorken JB, et al. Mecanismos de sinergia entre cisplatino y gemcitabina en líneas celulares de cáncer de pulmón de ovario y de células no pequeñas. Hno. J Cáncer. (1999) 80:981–90. doi: 10.1038/sj.bjc.6690452
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Bergman AM, Ruiz van Haperen VW, Veerman G, Kuiper CM, Peters GJ. Interacción sinérgica entre cisplatino y gemcitabina in vitro. Clin Cáncer Res. (1996) 2:521–30.
68. Peters GJ, Bergman AM, Ruiz van Haperen VW, Veerman G, Kuiper CM, Braakhuis BJ. Interacción entre cisplatino y gemcitabina in vitro e in vivo. Semin Oncol. (1995) 22:72–9.
69. Besançon Besançon OG, Tytgat GAM, Meinsma R, Leen R, Hoebink J., Kalayda Ganna V, et al. Interacción sinérgica entre cisplatino y gemcitabina en líneas celulares de neuroblastoma y esferoides tumorales multicelulares. Cáncer Lett. (2012) 319:23–30. doi: 10.1016/j.canlet.2011.12.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Rose PG, Mossbruger K, Fusco N, Smrekar M, Eaton S, Rodriguez M. La gemcitabina revierte la resistencia al cisplatino: demostración de actividad en el carcinoma de ovario y peritoneal resistente al platino y a múltiples fármacos. Gynecol Oncol. (2003) 88:17–21. doi: 10.1006/gyno.2002.6850
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Reed E. Aducto de ADN de platino, reparación de escisión de nucleótidos y quimioterapia anticancerígena basada en platino. Cancer Treat Rev. (1998) 24:331–44. doi: 10.1016/S0305-7372(98)90056-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: mesotelioma pericárdico, canino, quimioterapia, carboplatino, gemcitabina, terapia combinada, cultivos primarios, xenoinjerto
Cita: Nabeta R, Kanaya A, Elbadawy M, Usui T, Furuya T, Suzuki K y Uchide T (2023) Quimiosensibilidad de tres cultivos primarios derivados de pacientes de mesotelioma pericárdico canino mediante tratamiento con agente único y combinado. Frente. Vet. Sci. 10:1267359. doi: 10.3389/fvets.2023.1267359
Recibido: 26 de julio de 2023; Aceptado: 10 de octubre de 2023;
Publicado: 02 Noviembre 2023.
Editado por:
Carlos Eduardo Fonseca-Alves, Universidad Paulista, Brasil
Revisado por:
Luíz Benevenuto, Universidad Estadual Paulista, Brasil Denner Santos Dos Anjos, Universidad Estadual Paulista, Brasil
Derechos de autor © 2023 Nabeta, Kanaya, Elbadawy, Usui, Furuya, Suzuki y Uchide. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Tsuyoshi Uchide, uchide@cc.tuat.ac.jp
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía