Inmunocastración con GnRH
Inmunocastración con GnRH: un método alternativo para la castración quirúrgica de animales machos
 Chun Wang1
Chun Wang1  Cuiting Yang1
Cuiting Yang1  Yutian Zeng1
Yutian Zeng1  Ming Zhang1,2,3*
Ming Zhang1,2,3*- 1Facultad de Ciencia y Tecnología Animal, Universidad Agrícola de Sichuan, Chengdu, China
- 2Laboratorio Clave de Multiómica Ganadera y Avícola, Ministerio de Agricultura y Asuntos Rurales, Facultad de Ciencia y Tecnología Animal, Universidad Agrícola de Sichuan, Chengdu, China
- 3Exploración e Innovación de Recursos Genéticos de Animales de Granja Laboratorio Clave de la Provincia de Sichuan, Facultad de Ciencia y Tecnología Animal, Universidad Agrícola de Sichuan, Chengdu, China
La castración de los animales machos tiene como objetivo producir carne animal de alta calidad, prevenir el sabor desagradable, reducir el comportamiento agresivo y controlar la reproducción excesiva. A lo largo de los años, se han empleado métodos tradicionales de castración mecánica y quirúrgica, pero no cumplen con los requisitos de bienestar animal debido al riesgo asociado de infección, dolor y estrés. La inmunocastración, específicamente la inmunocastración de la hormona liberadora de gonadotropina (GnRH), dirigida al eje hipotálamo-hipófisis-testículo (HPT), ha surgido como una alternativa amigable con los animales a la castración quirúrgica, abordando eficazmente estos problemas. Esta revisión busca resumir sistemáticamente los principios, el desarrollo, las aplicaciones actuales y los desafíos de la inmunocastración con GnRH, ofreciendo información sobre su papel en la promoción del bienestar animal.
1. Introducción
La producción de capón, una práctica antigua que se remonta a más de 3.000 años, persiste en todo el mundo (1-3). Si bien la producción de capón constituye un segmento modesto del mercado, tiene un potencial de crecimiento significativo debido a sus atributos sensoriales polvorientos apreciados por los consumidores (4-7). Los capones son pollos machos que se someten a castración quirúrgica antes de alcanzar la madurez sexual, una práctica que también se aplica a otros animales machos como jabalíes y carneros. Los objetivos son reducir los olores desagradables, aumentar la deposición de grasa intramuscular, mejorar la composición de la canal y la calidad de la carne. La castración conduce a la deficiencia de andrógenos, dificultando las características secundarias masculinas, como la cresta y el pelo de la carne, reduciendo las conductas agresivas y eliminando las peleas y los resoplidos (8). La energía consumida por el capón en la protección territorial, las peleas y los comportamientos de cortejo se reduce en gran medida en comparación con el gallo intacto, lo que hace que la utilización de la energía de su alimento sea más eficiente para el crecimiento y la deposición de grasa (9). En consecuencia, la castración aumenta los depósitos de grasa y el contenido de grasa intramuscular, elevando las cualidades sensoriales de la carne, como la ternura, la jugosidad y el sabor (7, 9-11). Sin embargo, la castración quirúrgica también tiene algunas limitaciones, como las complicaciones postoperatorias, el aumento de la susceptibilidad a las infecciones y los problemas de bienestar animal. Además, el procedimiento debe realizarse a una edad adecuada, y las altas exigencias en habilidades quirúrgicas y otros recursos rentables (12). Por el contrario, la inmunocastración con GnRH minimiza el estrés animal, reduce el riesgo de infección y las complicaciones asociadas con la cirugía, y mejora sustancialmente en gran medida el bienestar animal. Además, no presenta ningún riesgo de residuos de fármacos, lo que facilita su aplicación en la producción. En consecuencia, la inmunocastración con GnRH tiene el potencial de ser una alternativa segura a la castración quirúrgica.
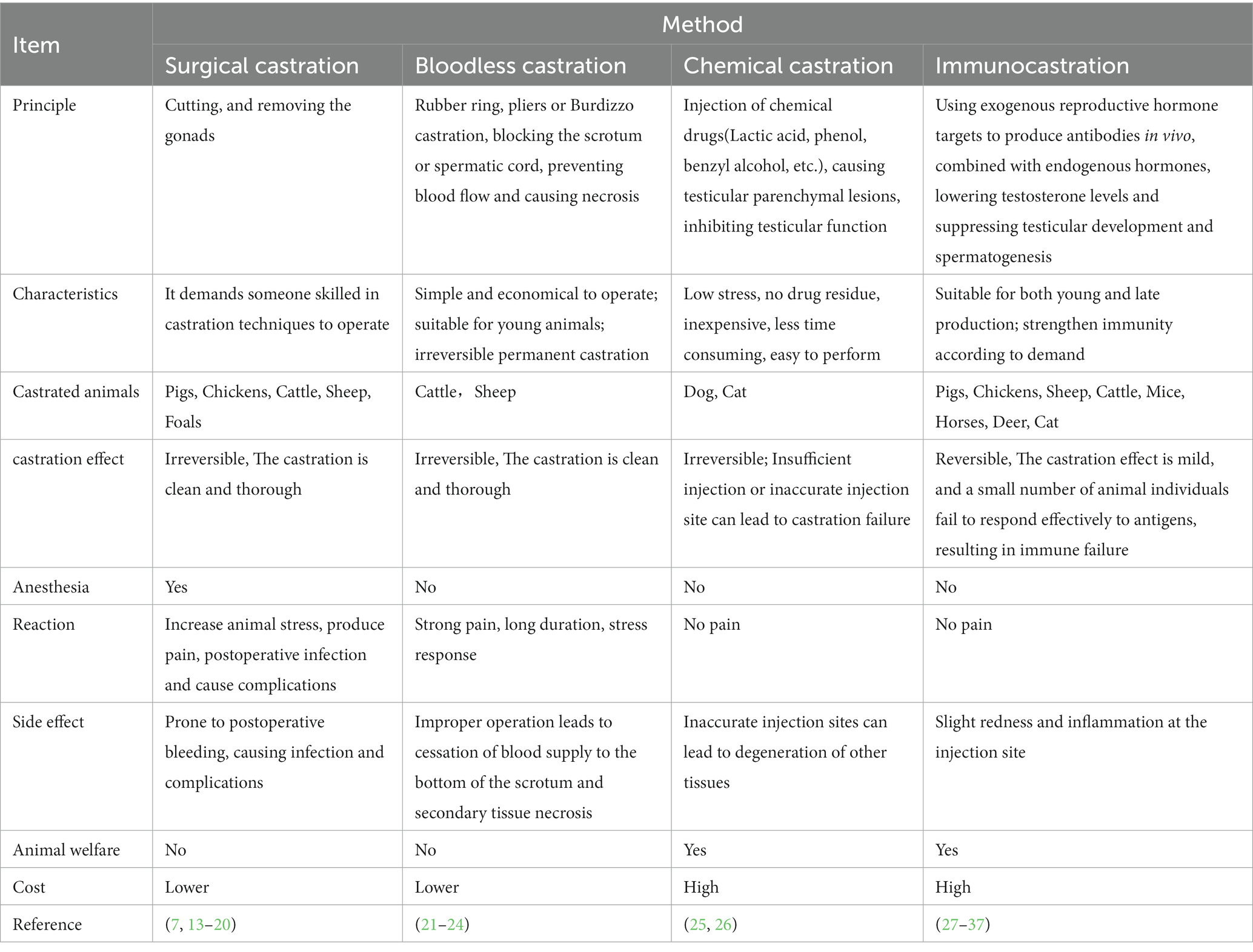
2. La comparación de diferentes técnicas de castración para animales machos
En la actualidad, existen diversas técnicas para castrar a los machos, como la castración química, la castración sin sangre, la castración quirúrgica y la inmunocastración (Tabla 1). A diferencia de los mamíferos, los testículos de gallo se encuentran en la cavidad abdominal, colgando ventrales en la parte anterior del riñón a través del mesangio y con la vena tibial posterior y la aorta a ambos lados, lo que hace que la castración aviar sea más desafiante que la de los mamíferos. En la industria avícola, la castración quirúrgica tradicional se realiza sin anestesia ni control analgésico, lo que provoca el sufrimiento de los gallos y viola los principios de bienestar animal (38). Aunque los castrados están prohibidos en la UE (Unión Europea) debido a la preocupación por el bienestar animal, todavía se utilizan en los sistemas agrícolas tradicionales, lo que representa un desprecio hacia las prácticas ancestrales (39). La castración quirúrgica también incurre en tasas de mortalidad que oscilan entre el 5 y el 20%, y a veces incluso hasta el 50% (39).
3. Principios de la inmunocastración con GnRH
La inmunocastración se dirige principalmente a las hormonas reproductivas dentro del eje HPT (Figura 1), alterando la hormona reproductiva dentro del eje HPT a través de medios inmunológicos para reducir la concentración de hormonas diana y lograr la castración (29, 40). La GnRH se localiza en el extremo superior del eje HPT, desempeña un papel fundamental iniciando y controlando las funciones fisiológicas de todo el eje reproductivo (41). Por lo tanto, la inmunización con GnRH es la más utilizada en la producción en comparación con otras inmunocastraciones hormonales dirigidas que implican La vacuna contra la GnRH se inocula con la vacuna GnRH, lo que provoca la producción de anticuerpos anti-GnRH específicos en el cuerpo, y una gran cantidad de anticuerpos anti-GnRH se unen a la GnRH endógena, inactivando continuamente la GnRH endógena. En consecuencia, la inmunización con GnRH conduce a una disminución de la secreción de la hormona luteinizante (LH) y de la hormona folículo estimulante (FSH). Eventualmente, esta inhibición de la función gonadal animal resulta en el logro de la castración (42).
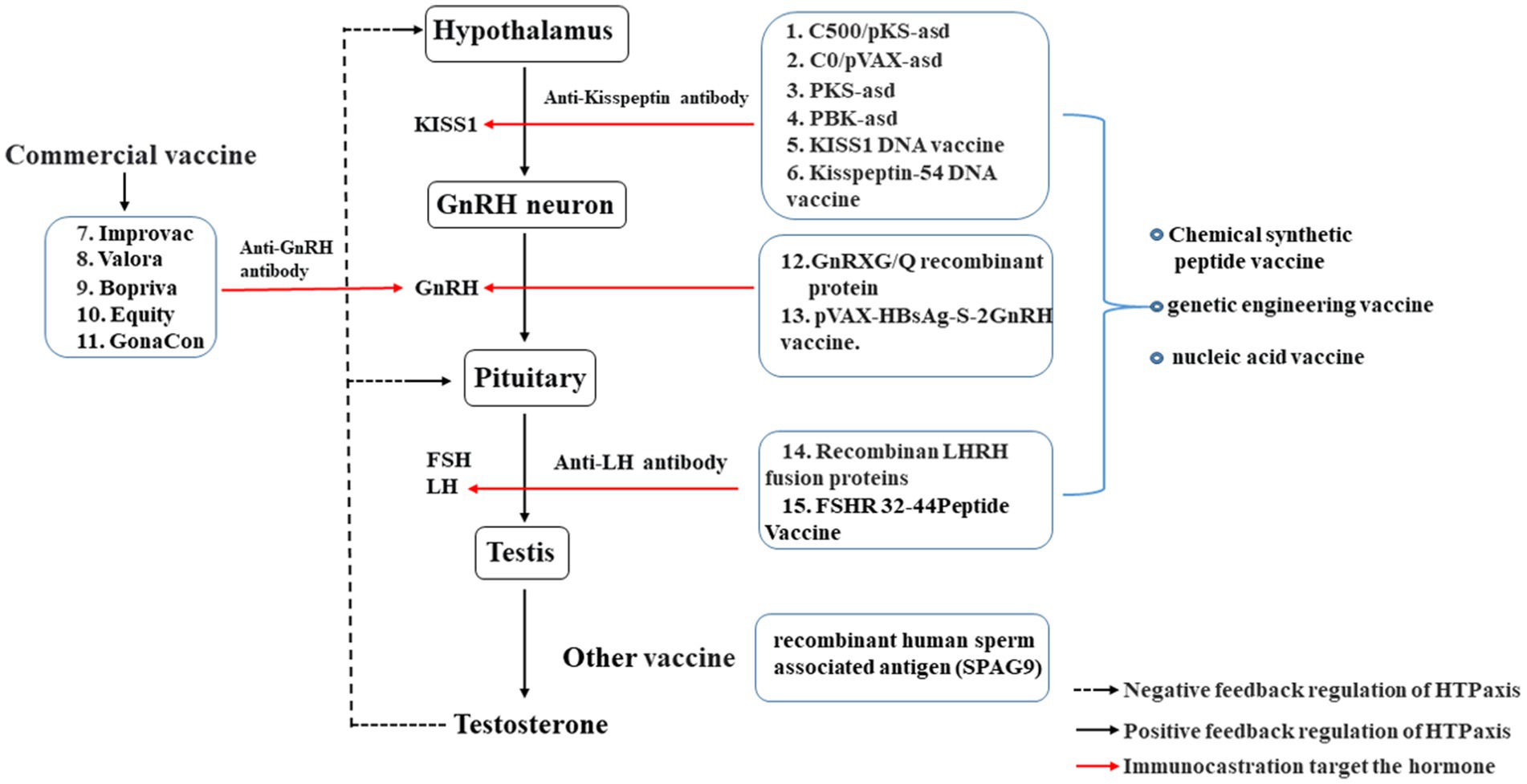 Figura 1. Efecto de la inmunocastración sobre el eje hipotálamo-hipófisis-testicular. Las vacunas: 1-6, vacuna de inmunocastración dirigida a la kisspeptina; 7–13, vacuna de inmunocastración dirigida a la GnRH; 14–15, Vacuna de inmunocastración dirigida a la LH.
Figura 1. Efecto de la inmunocastración sobre el eje hipotálamo-hipófisis-testicular. Las vacunas: 1-6, vacuna de inmunocastración dirigida a la kisspeptina; 7–13, vacuna de inmunocastración dirigida a la GnRH; 14–15, Vacuna de inmunocastración dirigida a la LH.
4. La inmunocastración con GnRH es un método de castración seguro y respetuoso con el bienestar animal
Las dosis fisiológicas de GnRH pueden aumentar significativamente los niveles de LH y aumentar ligeramente los niveles de FSH en plasma, llegando a las gónadas a través de la circulación portal hipofisaria, lo que estimula la síntesis y secreción de hormonas esteroides gonadales, promoviendo el desarrollo gonadal, la producción de gametos y la aparición y mantenimiento de caracteres sexuales secundarios. La inmunocastración de GnRH induce una gran cantidad de anticuerpos GnRH que neutralizan la GnRH endógena, y la producción del anticuerpo es un efecto biológico sostenido. Como resultado, la inmunocastración con GnRH inhibe consistentemente la función endocrina testicular u ovárica, reduciendo los niveles hormonales y la actividad reproductiva, y los olores asociados, principalmente escatol y androstenona (43-46). La inmunización con GnRH conduce a una disminución sustancial de la androstenediona y la testosterona en los animales machos (29, 32, 34, 47, 48). En consecuencia, los países europeos están abogando por la inmunocastración con GnRH como alternativa a la castración quirúrgica, mejorando el bienestar animal. La inmunocastración alivia el estrés animal, reduce el riesgo de infección y complicaciones asociadas con la castración quirúrgica, reduce el dolor y mejora el bienestar animal. La inmunocastración con GnRH se considera una alternativa relativamente segura a la castración quirúrgica.
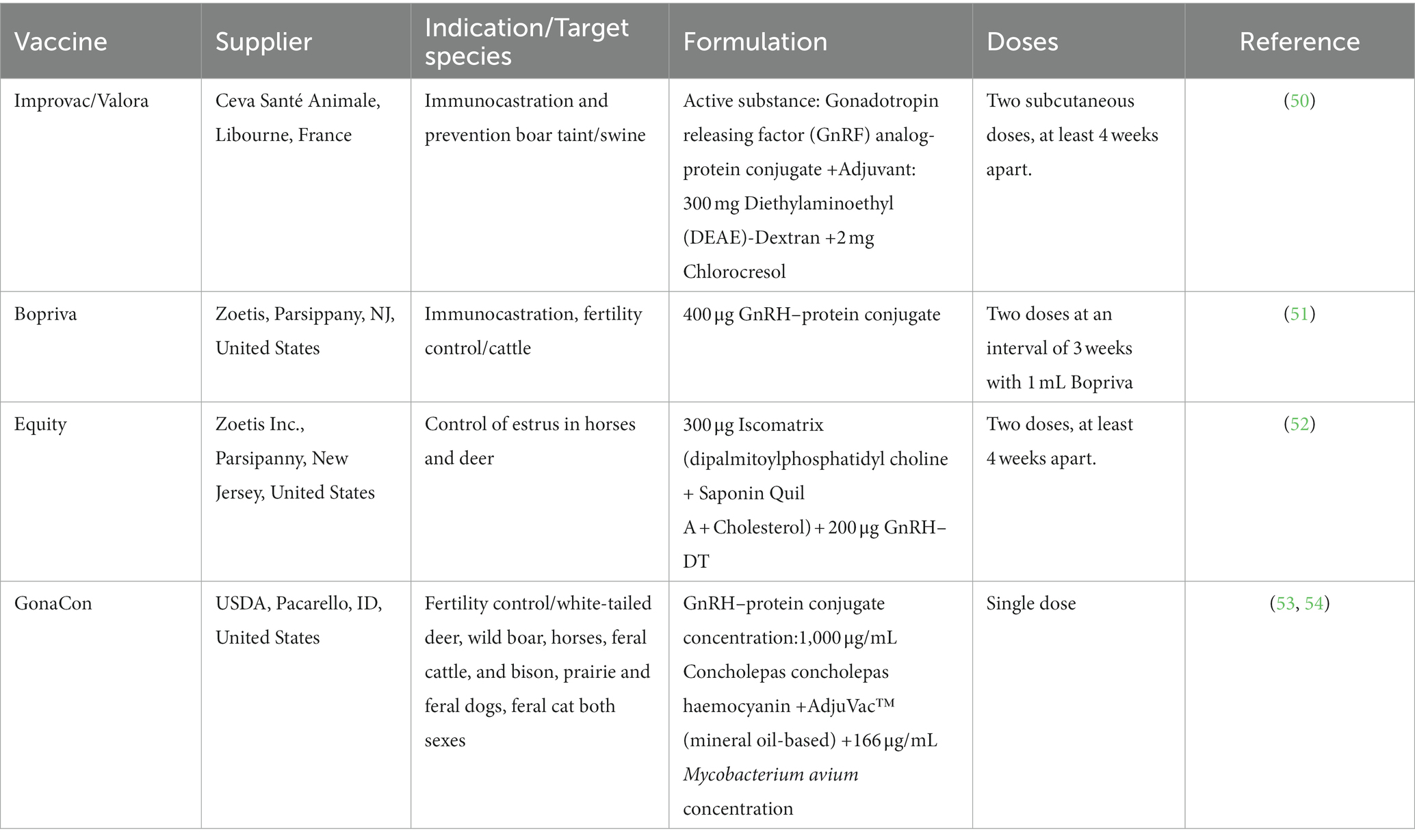
5. Aplicación actual de la vacuna de inmunocastración con GnRH
La inmunocastración no se limita a la producción de carne de cerdo, sino que también se emplea en otros animales de ganado como alternativa a la castración quirúrgica. Su principal ventaja radica en la eliminación del dolor, los riesgos de infección de heridas y las posibles pérdidas asociadas a la castración (49). En la actualidad, varios productos comerciales de inmunocastración se han aplicado en la producción animal (Tabla 2). Sin embargo, en Europa, Improvac es el único producto aprobado para uso comercial en cerdos, sin embargo, su cuota de mercado es solo del 2,8% de todos los cerdos machos, a pesar de la aprobación de la UE hace casi una década. Bélgica produce alrededor del 15% de la vacuna de castración en Europa, mientras que a nivel mundial, Brasil y Australia tienen una cuota de mercado de más del 50% (55, 56).
6. Retos actuales de la inmunocastración con GnRH en machos
La inmunocastración, a menudo administrada con la vacuna GnRH, ha sido objeto de una amplia investigación en mamíferos machos y aves (Figura 2) (43, 57-61). Los resultados varían según la especie animal, la edad del animal, la respuesta individual y la frecuencia de inmunización (62). La GnRH desempeña un papel crucial en la regulación del desarrollo y la función gonadal a través de la glándula pituitaria. La inmunocastración de GnRH disminuye significativamente el rendimiento reproductivo de los animales machos al inhibir el desarrollo de los testículos. Los estudios han confirmado que la inmunización de los animales machos con GnRH puede causar infertilidad, atrofia gonadal y cambios en la calidad de la carne al actuar directa o indirectamente de la testosterona (63).
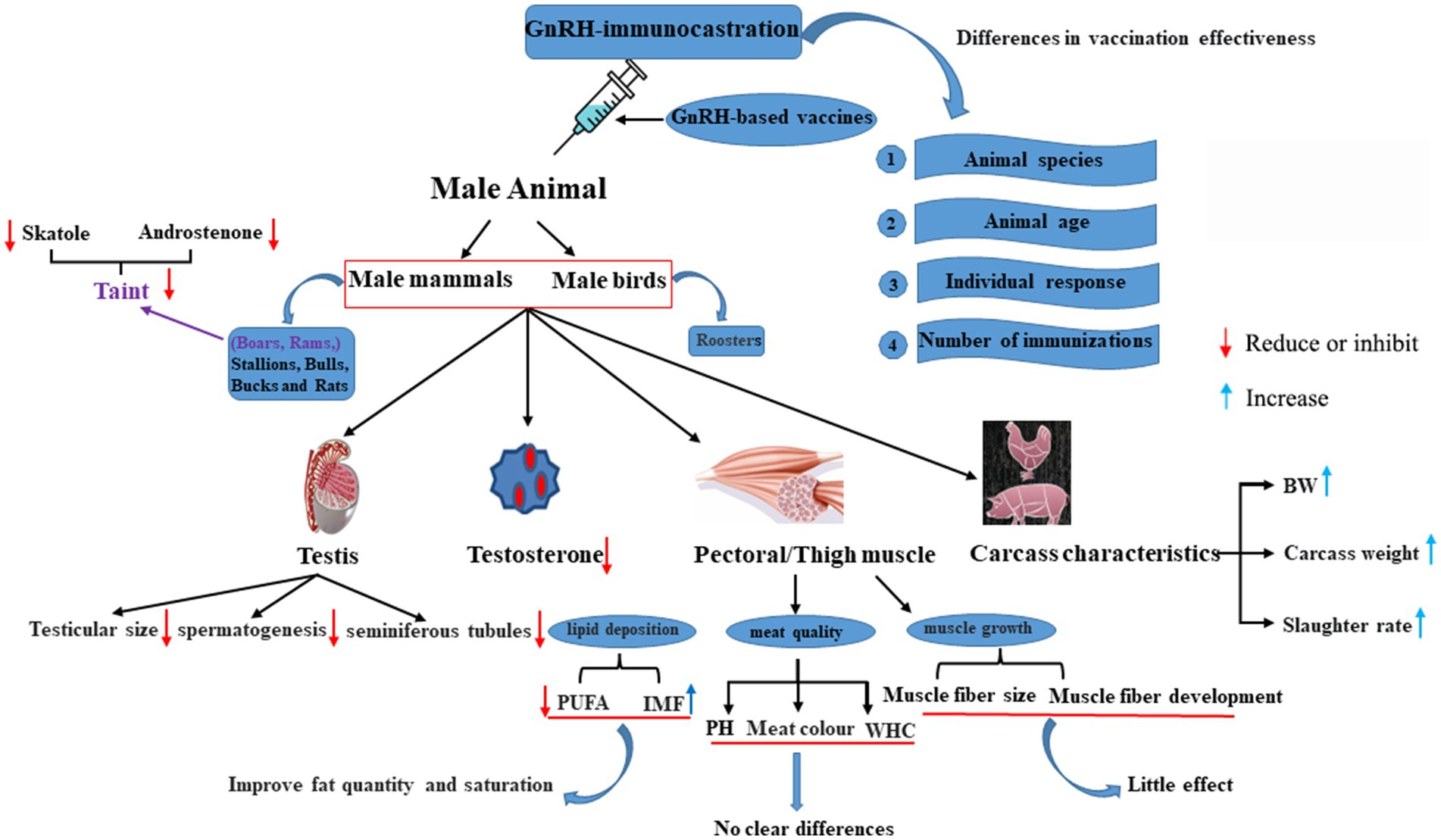 Figura 2. Efectos de la inmunocastración de GnRH en diversos animales. AGPI: ácidos grasos poliinsaturados; WHC: capacidad de retención de agua; PC: peso corporal; PH: Pondus hydrogenii.
Figura 2. Efectos de la inmunocastración de GnRH en diversos animales. AGPI: ácidos grasos poliinsaturados; WHC: capacidad de retención de agua; PC: peso corporal; PH: Pondus hydrogenii.
6.1. En mamíferos machos
En mamíferos, la mayor parte de la investigación sobre la inmunocastración con GnRH se ha centrado en animales machos, y la espermatogénesis se inhibe después de la inmunización con GnRH. Por ejemplo, la inmunización de animales machos como jabalíes, toros, sementales, carneros, ciervos y ratas con la vacuna GnRH conduce a la supresión del desarrollo testicular, epididimario y de los conductos deferentes. Esto da como resultado una reducción de la concentración de espermatozoides en los testículos con baja viabilidad, constricción de los túbulos seminíferos e inhibición de la producción de espermatogonias y espermatoblastos en el epitelio profundo (29, 59, 60, 64-68).
En la actualidad, la inmunocastración con GnRH es la más utilizada en verracos. La androstenona es una hormona masculina que se forma en las células de la Leydig y tiene un olor similar al de la orina (69). El escatol es un metabolito del aminoácido triptófano con olor fecal que se sintetiza por degradación microbiana en el colon (44, 70). Se ha demostrado que la inmunocastración previene eficazmente la acumulación de olor a verraco en el tejido adiposo al reducir la síntesis de hormonas esteroides en los testículos (45). Sin embargo, debido a la corta duración del efecto de castración, el control de la contaminación de los verracos requiere múltiples dosis de la vacuna GnRH, y la segunda vacunación a menudo se lleva a cabo de 4 a 6 semanas antes del sacrificio en producción, e incluso se requiere la tercera dosis de la vacuna para cerdos de sacrificio con mayor edad y peso para controlar el olor de los verracos. lo que aumenta el costo.
La calidad de la carne es cada vez más valorada por los consumidores, por lo que el ganado macho es castrado en la producción para mejorar la calidad de la carne. En la actualidad, un gran número de estudios se han centrado en la mejora de la calidad de la carne mediante la inmunocastración. La inmunocastración con GnRH reduce la acumulación de compuestos contaminantes en el tejido adiposo y mejora la calidad de la carne y las características de la canal en mamíferos machos (71). Sin embargo, el último estudio encontró que la tasa de sacrificio de los verracos inmunocastrados es menor que la de los verracos castrados quirúrgicamente y los verracos intactos, ya que los verracos inmunocastrados tienen hígado y riñones más pesados (72). El abdomen de los cerdos castrados inmunemente es más gordo que el de los verracos enteros, y la tasa de carne magra es similar a la de los cerdos castrados quirúrgicamente, los cuales son más bajos que los de los verracos enteros. Por lo tanto, hasta cierto punto, afectará a las elecciones de los consumidores. Los vientres de los cerdos inmunocastrados son más gordos y firmes que los de los verracos. Además, aunque la inmunocastración aumenta el contenido de grasa intramuscular y reduce los ácidos grasos poliinsaturados, el efecto de mejorar la grasa intramuscular aún no es tan efectivo como la castración quirúrgica, y los verracos que se someten a castración quirúrgica tienen menos ácidos grasos poliinsaturados (73). De manera similar, los estudios han demostrado que, en comparación con la castración quirúrgica, la inmunocastración con GnRH mejora el peso del ganado, pero no hay diferencias en el pH, el color, la cobertura de grasa, la pérdida de cocción o la terneza de la carne (74).
6.2. En aves macho
La utilización y evaluación de vacunas de inmunocastración en cerdos ha sido ampliamente reportada (34, 48, 75). Sin embargo, actualmente no existe una vacuna disponible comercialmente para pollos. Recientemente, solo tres estudios han investigado el uso de la vacuna GnRH para inmunizar a los gallos. Quaresma y sus colegas evaluaron los efectos de Improvac en el desarrollo corporal y óseo, el color de la carne y la composición de los gallos, y encontraron que los parámetros de color de las aves Improvac, como el brillo, el rojo y el ángulo de tono, estaban entre gallos y capones (5). Además, i.c. Antunes et al. encontraron que la inmunocastración tenía poco efecto sobre el perfil de ácidos grasos de los pollos de engorde, pero mejoró los marcadores lipídicos generales en la carne de pechuga y pierna hasta cierto punto, lo que podría permitir parcialmente la inmunización con GnRH (6). Estudios previos han demostrado que tanto la caponización como la ovariectomía probablemente mejoran la calidad de la carne del músculo mamario en función de los índices objetivos de IMF, apariencia (color), textura y cambio menor del perfil de ácidos grasos; La ovariectomía mejora los índices relacionados con el sabor (76). En nuestro estudio, encontramos que los gallos inoculados con Improvac tenían algún efecto sobre el desarrollo muscular, pero el efecto no fue completamente satisfactorio (77, 78).
7. Conclusiones y perspectiva
En la actualidad, la inmunocastración se enfrenta a desafíos relacionados con el fracaso de la inmunización. Estos desafíos incluyen variaciones significativas en las respuestas individuales entre los animales inmunizados, insensibilidad a los antígenos en algunos individuos, incapacidad para provocar una respuesta inmunitaria o una duración más corta del efecto inmunitario. Esta duración más corta conduce a un aumento de la concentración de testosterona durante el período de recuperación en comparación con la fase anterior, lo que resulta en un retorno gradual del comportamiento sexual. Son necesarias múltiples vacunas para contrarrestar este efecto, lo que a su vez aumenta los costos. Además, existen desventajas asociadas para los agricultores, como el aumento de los gastos de compra de productos y la gestión de la mano de obra, el riesgo de autoinyección accidental por parte de los trabajadores agrícolas y la incertidumbre con respecto a las actitudes de los consumidores hacia la carne de animales castrados farmacológicamente. Sin embargo, es importante tener en cuenta que la inmunocastración ofrece varias ventajas, como la reducción del estrés animal, la disminución del riesgo de infecciones y complicaciones asociadas con la castración quirúrgica, la mejora significativa del bienestar animal y la facilidad de implementación en entornos de producción. Por lo tanto, la inmunocastración puede seguir siendo una alternativa segura a la castración quirúrgica en el futuro.
En el desarrollo futuro de vacunas comerciales de castración, en particular vacunas de inmunocastración de GnRH para animales machos, debe haber una exploración de la construcción de inmunógenos, dosis de inmunitaria, estrategias inmunitarias y calendario. Se debe prestar atención a mejorar la eficacia y prolongar la duración de la respuesta inmunitaria de estas vacunas. Actualmente, la investigación sobre vacunas GnRH se centra principalmente en la síntesis química de polipéptidos, vacunas conjugadas duales, vacunas de ADN, vacunas conjugadas en tándem, entre otras. Sin embargo, estos enfoques tienen sus limitaciones. Teniendo en cuenta los desafíos existentes con las vacunas genéticas de GnRH, vale la pena considerar la investigación y el desarrollo de vacunas de ingeniería genética de GnRH y vacunas de adenovirus recombinantes de GnRH en el futuro. En resumen, el enfoque futuro del desarrollo de vacunas de inmunocastración girará en torno a la creación de productos con inmunogenicidad sostenida, fácil producción y efectos estables. Estos avances podrían ser la clave para el futuro de las vacunas de inmunocastración.
Contribuciones de los autores
CW: redacción del manuscrito. YZ y CY: suministro de material de estudio. MZ: conceptualización y supervisión. Todos los autores contribuyeron al artículo y aprobaron la versión enviada.
Financiación
Esta investigación contó con el apoyo de los Proyectos Nacionales Clave de Investigación y Desarrollo de China (2021YFD1600200).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Calik, J . Producción de capones: reproductores, métodos de castración y cría de gallos, y calidad de la carne: una revisión. Ann Anim Sci. (2014) 14:769–77. doi: 10.2478/aoas-2014-0050
2. Sokołowicz, Z, Krawczyk, J y Świątkiewicz, S. 4. Calidad de la carne de aves de corral de razas autóctonas de pollos: una revisión. Ann Anim Sci. (2016) 16:347–68. doi: 10.1515/aoas-2016-0004
3. Symeon, GK, Mantis, F, Bizelis, I, Kominakis, A y Rogdakis, E. Efectos de la caponización sobre el rendimiento del crecimiento, la composición de la canal y la calidad de la carne de los machos de una línea de ponedoras. Animal. (2012) 6:2023–30. doi: 10.1017/S1751731112001024
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Amorim, A, Rodrigues, S, Pereira, E, y Teixeira, A. Composición fisicoquímica y evaluación de la calidad sensorial de la carne de capón y gallo. Poult Sci. (2016) 95:1211–9. doi: 10.3382/ps/pev448
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Quaresma, MAG, Antunes, IC, Ribeiro, MF, Prazeres, S, Bessa, RJB y Da Costa, PM. Inmunocastración como alternativa a la caponización: evaluación de su efecto sobre el desarrollo corporal y óseo y sobre el color y composición de la carne. Poult Sci. (2017) 96:3608–15. doi: 10.3382/ps/pex191
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Antunes, IC, Quaresma, MAG, Ribeiro, MF, Alves, SP, Martins da Costa, P, y Bessa, RJB. Efecto de la inmunocastración y caponización sobre la composición de ácidos grasos de la carne de pollo macho. Poult Sci. (2019) 98:2823–9. doi: 10.3382/ps/pez034
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Calik, J, y Obrzut, J. Características fisicoquímicas de la carne de capones derivadas del cruce de gallinas de raza conservada y gallos de carne. Poult Sci. (2023) 102:102500. doi: 10.1016/j.psj.2023.102500
8. Mast, MG, Jordan, HC, y Macneil, JH. El efecto de la caponización parcial y completa sobre la tasa de crecimiento, el rendimiento y los atributos físicos y sensoriales seleccionados de los gallos1. Poult Sci. (1981) 60:1827–33. doi: 10.3382/ps.0601827
9. Cui, X, Cui, H, Liu, L, Zhao, G, Liu, R, Li, Q, et al. La disminución de los niveles de testosterona después de la caponización conduce a la deposición de grasa abdominal en los pollos. BMC Genómica. (2018) 19:19. doi: 10.1186/s12864-018-4737-3
10. Gesek, M, Murawska, D, Otrocka-Domagała, I, Michalska, K, y Zawacka, M. Efectos de la caponización y la edad en la histología, la localización de lípidos y el diámetro de las fibras en los músculos de los gallos de Livorno. Poult Sci. (2019) 98:1354–62. doi: 10.3382/ps/pey459
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Chen, KL, Chi, WT, Chu, C, Chen, RS y Chiou, PW. Efecto de la caponización y la implantación de testosterona sobre los lípidos hepáticos y las enzimas lipogénicas en pollos machos. Poult Sci. (2007) 86:1754–9. doi: 10.1093/ps/86.8.1754
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Windsor, PA, Lomax, S, y White, P. Progreso en el manejo del dolor para mejorar el bienestar de las granjas de pequeños rumiantes. Pequeña Rumin Res. (2016) 142:55–7. doi: 10.1016/j.smallrumres.2016.03.024
13. Miller, R, Grott, A, Patzkéwitsch, D, Döring, D, Abendschön, N, Deffner, P, et al. Comportamiento de lechones en un campo de observación antes y después de la castración quirúrgica con anestesia local. Animales (Basilea). (2023) 13:529. doi: 10.3390/ani13030529
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Tilo, JJG . Una revisión de la literatura realizada por la división de bienestar animal de la Asociación Americana de Medicina Veterinaria, que cubre los métodos de castración (quirúrgica e inmunocastración) de los cerdos de verraco, el control del dolor y las alternativas para prevenir el olor a verraco. Implicaciones de la castración porcina. (2023) 11:2.
15. Yoo, S, Beak, S-H, Kang, HJ, Jung, D, Fassah, D, Jeong, I, et al. Efecto de la castración con bisturí sobre la expresión de citoquinas leucocitarias e indicadores de estrés, dolor e inflamación en terneros de toros bovinos coreanos. Anim Biosci. (2023) 36:521–8. doi: 10.5713/ab.22.0368
16. Dustan, B . Realización de cirugía en cabras. Parte 2: técnicas quirúrgicas. En la práctica. (2023) 45:101–6. doi: 10.1002/inpr.294
17. Kongara, K, Corner-Thomas, R, Bruere, S, Lawrence, K, y Gates, M. Prácticas y opiniones de los ganaderos de ovejas de Nueva Zelanda hacia el manejo del dolor en corderos durante la castración y/o el corte de la cola. N Z Vet. (2023) 71:8–17. doi: 10.1080/00480169.2022.2135626
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Cognie, J, Freret, S, Lansade, L, Parias, C, Barriere, P, Gesbert, A, et al. Castración precoz en potros: consecuencias en el desarrollo físico y conductual. Veterinario Equino J. (2023) 55:214–21. doi: 10.1111/evj.13580
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Sellon, D, Sanz, M y Kopper, J. Protocolos perioperatorios de manejo del dolor de los veterinarios en los Estados Unidos para caballos sometidos a orquiectomía (castración) de rutina. PMC Europa (2023).
20. Ryad, HM, Yadav, SK, Bostami, MB, Sutradhar, BC y Das, B. Efecto de la caponización sobre el rendimiento del crecimiento y el parámetro sanguíneo en el gallo Fayoumi. GSC Adv Res Rev. (2022) 13:105–15. doi: 10.30574/gscarr.2022.13.1.0258
21. Ibrahim, A, Ali, MM, Abou-Khalil, NS y Ali, M. Evaluación de la castración química con cloruro de calcio frente a la castración quirúrgica en burros: testosterona como marcador final. BMC Vet Res. (2016) 12:1–9. doi: 10.1186/s12917-016-0670-3
22. Nurmi, H, Laaksonen, S, Häätylä, T, Valros, A, Sauvala, M, y Hänninen, L. El impacto de la castración con pinza en el comportamiento y la temperatura corporal del reno (Rangifer tarandus tarandus): efectos de la anestesia local y el fármaco antiinflamatorio no esteroideo. Appl Anim Behav Sci. (2022) 255:105719. doi: 10.1016/j.applanim.2022.105719
23. Boyle, LA, Conneely, M, Kennedy, E, O’Connell, N, O’Driscoll, K, y Earley, B. Investigación sobre el bienestar animal: progreso hasta la fecha y perspectivas futuras. Ir J Agric Food Res. (2022) 61:1–12. doi: 10.15212/ijafr-2020-0151
24. Saeed, IH, Alameen, AO y Abdelatif, A. Respuestas fisiológicas de cabras nubias adultas (Capra hircus) a la orquiectomía. Asian Res J Gynaecol Obstet. (2022) 7:28–46. Disponible en: https://www.sdiarticle5.com/review-history/85037
25. Spruijt, A, Kooistra, H, Oei, C, Vinke, C, Schaefers-Okkens, A, y De Gier, J. Función del eje hipófisis-testicular en perros antes y después de la castración quirúrgica o química con el agonista de la GnRH deslorelina. Reprod Domes Anim. (2023) 58:97–108. doi: 10.1111/rda.14266
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Hami, M, Veshkini, A, Jahandideh, A, Rafiee, SM y Mortazavi, P. Evaluación de la testosterona, los antioxidantes sanguíneos y los cambios histopatológicos después de la castración química con cloruro de calcio en ratas. Crescent J Med Biol Sci. (2022) 9:207–12. doi: 10.34172/cjmb.2022.34
27. Needham, T, Musa, AS, Kotrba, R, Ceacero, F, Hoffman, LC, Lebedová, N, et al. Rendimientos de canales y despojos de machos de eland común (Taurotragus oryx) de cría, afectados por la edad y la inmunocastración. Animales (Basilea). (2022) 12:2893. doi: 10.3390/ani12212893
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Pérez-Ciria, L, Ripoll, G, Sanz, MÁ, Blanco, M, Miana-Mena, FJ, y Latorre, MAJMS. Impacto de la inmunocastración de primerizas en las pérdidas de peso y características instrumentales y químicas del jamón curado de Teruel. Ciencia de la carne. (2023) 199:109125. doi: 10.1016/j.meatsci.2023.109125
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Ahmed, S, Bo, D, Zhao, J, Liu, G, Ding, Y, Jiang, X, et al. La inmunocastración con vacuna génica (KISS1) induce una respuesta inmunitaria mediada por células en el testículo carnero: una evaluación del transcriptoma. Reprod Domest Anim. (2022) 57:653–64. doi: 10.1111/rda.14106
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Ny, V, Needham, T, Bartoň, L, Bureš, D, Kotrba, R, Musa, AS, et al. Efectos de la inmunocastración y el nivel de alimentación suplementaria sobre el rendimiento y los marcadores bioquímicos sanguíneos de gamos de un año de granja (Dama dama). J Anim Physiol Anim Nutr (Berl). (2023) 107:1158–66. doi: 10.1111/jpn.13807
31. Kotula-Balak, M, Pawlicki, P, Gałuszka, A, Pardyak, L, Tuz, R, Dubniewicz, K, et al. Efecto de la inmunocastración con Improvac en la regulación de adiponectina y leptina en los testículos de verracos autóctonos. Med Weter. (2022) 77:1–6. doi: 10.21521/mw.6685
32. Pan, F, Du, H, Tian, W, Xie, H, Zhang, B, Fu, W, et al. Efecto de la inmunocastración de GnRH sobre la función inmune en ratas macho. Frente Immunol. (2022) 13:1023104. doi: 10.3389/fimmu.2022.1023104
33. Gautier, C, Kaps, M, Aurich, J y Aurich, C. Reanudación del comportamiento sexual y la función testicular en sementales de pony Shetland inmunocastrados después del tratamiento con un agonista de GnRH. Anim Reprod Sci. (2022) 247:107127. doi: 10.1016/j.anireprosci.2022.107127
34. Pawlicki, P, Galuszka, A, Pardyak, L, Tuz, R, Płachno, BJ, Malopolska, M, et al. Células de Leydig en testículos de cerdo autóctonos polacos inmunocastrados: estado de diferenciación y estado de expresión de enzimas esteroideas. Int J Mol Sci. (2022) 23:6120. doi: 10.3390/ijms23116120
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Chang, A-M, Chen, C-C, Lee, J-W, Hou, D-L, Huang, H-H y Ke, G. Efectos de una nueva vacuna recombinante contra la hormona liberadora de gonadotropina-1 en la función reproductiva de perros mestizos (Canis familiaris) en Taiwán. Vacuna. (2023) 41:2214–23. doi: 10.1016/j.vaccine.2023.02.061
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Font-I-Furnols, M, Claret, A, Guerrero, L, y Dalmau, A. Expectativas de los consumidores sobre la carne de cerdos ibéricos machos e hembras castrados quirúrgicamente o inmunocastrados. Animales. (2022) 12:468. doi: 10.3390/ani12040468
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Ochoa, JS, Favre, RN, García, MF, Stornelli, MC, Sangache, WC, Rearte, R, et al. Inmunocontracepción de gatos domésticos machos con la vacuna GnRH Improvac. Teriogenología. (2023) 198:211–6. doi: 10.1016/j.theriogenology.2022.12.020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. García, A, y McGlone, JJ. El bienestar animal y el reconocimiento de las diferencias culturales. Animales (Basilea). (2022) 12:474. doi: 10.3390/ani12040474
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Rikimaru, K, Takahashi, H y Nichols, MA. Un método eficiente de caponización temprana en pollos de tipo carne de crecimiento lento. Poult Sci. (2011) 90:1852–7. doi: 10.3382/ps.2010-01270
40. Van den Broeke, A, Aluwé, M, Kress, K, Stefanski, V, Škrlep, M, Batorek, N, et al. Efecto del nivel de energía de la dieta en la fase de engorde sobre el rendimiento, la calidad de la canal y de la carne en inmunocastrados y carretillas en comparación con cerdas jóvenes y cerdos machos enteros. Animal. (2022) 16:100437. doi: 10.1016/j.animal.2021.100437
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Tzoupis, H, Nteli, A, Androutsou, ME, y Tselios, T. Hormona liberadora de gonadotropina y receptor de GnRH: estructura, función y desarrollo de fármacos. Curr Med Chem. (2020) 27:6136–58. doi: 10.2174/0929867326666190712165444
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Kaprara, A, y Huhtaniemi, IT. El eje hipotálamo-hipófisis-gónada: Cuentos de ratones y hombres. Metabolismo. (2018) 86:3–17. doi: 10.1016/j.metabol.2017.11.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Kowalski, E, Vossen, E, Millet, S, Ampe, B, De Smet, S, y Aluwé, M. Efecto de la línea de toro terminal y el momento de la segunda vacunación sobre la efectividad de la inmunocastración, el rendimiento y la calidad de la canal y la carne. Ciencia de la carne. (2021) 175:108451. doi: 10.1016/j.meatsci.2021.108451
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Han, X, Zhou, M, Cao, X, Du, X, Meng, F, Bu, G, et al. Conocimiento mecanicista del papel de la inmunocastración en la eliminación del escatol en verracos. Teriogenología. (2019) 131:32–40. doi: 10.1016/j.theriogenology.2019.03.017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Lin-Schilstra, L, y Fischer, ARH. Consumidores paradójicos en cuatro países europeos: justificación del consumo de carne y disposición a pagar por carne de animales tratados con alternativas a la castración quirúrgica. Ciencia de la carne. (2022) 188:108777. doi: 10.1016/j.meatsci.2022.108777
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Lin-Schilstra, L, e Ingenbleek, PTM. Un análisis de escenarios para la implementación de la inmunocastración como solución única para la castración de lechones. Animales (Basilea). (2022) 12:12. doi: 10.3390/ani12131625
47. Nolan, MB, Bertschinger, HJ, Roth, R, Crampton, M, Martins, IS, Fosgate, GT, et al. Función ovárica después de la vacunación inmunoanticonceptiva de yeguas con vacunas nativas porcinas y recombinantes de la zona pelúcida formuladas con vacunas no adyuvantes de Freund y anti-GnRH. Teriogenología. (2018) 120:111–6. doi: 10.1016/j.theriogenology.2018.07.044
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Batorek-Lukač, N, Kress, K, Čandek-Potokar, M, Fazarinc, G, Škrlep, M, Poklukar, K, et al. Inmunocastración en verracos adultos como modelo de hipogonadismo de inicio tardío. Andrología. (2022) 10:1217–32. doi: 10.1111/andr.13219
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Borell, EV, Bonneau, M, Holinger, M, Prunier, A, Stefanski, V, Zöls, S, et al. Aspectos de bienestar de la cría de cerdos machos enteros e inmunocastrados. Animales (Basilea). (2020) 10:2140. doi: 10.3390/ani10112140
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Sjöqvist, E . Efecto de la vacunación contra el factor liberador de gonadotropina de cerdos machos sobre la calidad de la carne y la grasa. Ciencias de la Alimentación. (2023) 2023:1–29. Disponible en: https://stud.epsilon.slu.se/18649/1/sj%C3%B6qvist-e-230216.pdf
51. Goto, A, Yoshida, N, Nakada, K, Inoue, Y, Hisaeda, K, Inaba, T, et al. Eficacia de la inmunocastración con una vacuna de hormona liberadora de gonadotropina en toros criptorquídeos. J Vet Med Sci. (2023) 85:551–6. doi: 10.1292/jvms.22-0571
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Schwarzenberger, F, Krawinkel, P, Jeserschek, SM, Schauerte, N, Geiger, C, Balfanz, F, et al. Inmunocontracepción de jirafas machos y hembras con la vacuna GnRH Improvac®. Zoológico Biol. (2022) 41:50–64. doi: 10.1002/zoo.21651
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Gray, ME, y Cameron, EZ. ¿El tratamiento anticonceptivo en la vida silvestre produce efectos secundarios? Una revisión de la evidencia cuantitativa y anecdótica. Reproducción. (2010) 139:45–55. doi: 10.1530/REP-08-0456
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Massei, GJA . Control de la fertilidad de la fauna silvestre: una perspectiva europea. Animales (Basilea). (2023) 13:428. doi: 10.3390/ani13030428
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Mancini, MC, Menozzi, D, y Arfini, F. Inmunocastración: implicaciones económicas para la cadena de suministro de carne de cerdo y la percepción del consumidor. Una evaluación de la investigación existente. Livest Sci. (2017) 203:10–20. doi: 10.1016/j.livsci.2017.06.012
56. Čandek-Potokar, M, Škrlep, M, y Zamaratskaia, GJT. Inmunocastración como alternativa a la castración quirúrgica en cerdos. Teriogenología. (2017) 6:109–26. doi: 10.5772/intechopen.68650
57. Rocha, LF, Souza, RS, Santana, ALA, Macedo, DS, Santana, AMS, Silva, RCD, et al. Parámetros reproductivos de corderos inmunocastrados con vacuna anti-GnRH. Anim Reprod. (2021) 18:e20200237. DOI: 10.1590/1984-3143-AR2020-0237
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Doroteu, EM, Viana, JH, Ferreira Junior, JA, Macedo, JT, Oliveira, RA, y Pedroso, PM. Efecto de una o dos dosis de una vacuna anti-GnRH sobre las características morfofuncionales de los testículos en toros Nelore. Trop Anim Salud Prod. (2021) 53:1–8. DOI: 10.1007/S11250-021-02600-X
59. Birrell, JR, Schulman, ML, Botha, AE, Ganswindt, A, Fosgate, GT, y Bertschinger, HJ. Vacunación frente a la GnRH como antesala de la castración quirúrgica de caballos. Veterinario Equino J. (2021) 53:1141–9. doi: 10.1111/evj.13411
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Giriboni, J, Martínez-Nevado, E, García, J, Velázquez, R, Toledano-Díaz, A, Ungerfeld, R, et al. La inmunización única o repetida contra la GnRH no logra abolir completamente la espermatogénesis en los machos enanos (Capra hircus). Zoológico Biol. (2022) 42:364–70. doi: 10.1002/zoo.21743
61. Novak, S, Yakobson, B, Sorek, S, Morgan, L, Tal, S, Nivy, R, et al. Seguridad, inmunogenicidad y efectos reproductivos a corto plazo de la vacunación combinada con vacunas anti-GnRH (Gonacon) y antirrábicas en gatas salvajes. Front Vet Sci. (2021) 8:650291. doi: 10.3389/fvets.2021.650291
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Heyrman, E, Kowalski, E, Millet, S, Tuyttens, FAM, Ampe, B, Janssens, S, et al. Monitoreo del comportamiento, hormonas sexuales y compuestos de olor a verraco durante el programa de vacunación para inmunocastración en tres líneas de toros. Res Vet Sci. (2019) 124:293–302. doi: 10.1016/j.rvsc.2019.04.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Noya, A, Ripoll, G, Casasús, I, y Sanz, A. Efectos de la inmunocastración realizada a dos pesos vivos sobre la fisiología del crecimiento, el temperamento y el desarrollo testicular de toros de carne salvajes. Anim Sci J. (2020) 91:e13307. doi: 10.1111/asj.13307
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Mitjana, O, Bonastre, C, Tejedor, MT, Garza, L, Latorre, M, Moreno, B, et al. Inmunocastración de cerdos hembras y machos con vacuna anti-hormona liberadora de gonadotropina: estudios morfométricos, histopatológicos y funcionales del aparato reproductor. Anim Reprod Sci. (2020) 221:106599. doi: 10.1016/j.anireprosci.2020.106599
Resumen de PubMed | Texto completo de CrossRef | Google Académico
65. Xu, M, Xu, C, Liu, F, Shen, X, Meng, J, Chen, H, et al. Efectos de la inmunización activa con péptidos de GnRH recientemente modificados sobre la espermatogénesis y el rendimiento productivo de toros Holstein. Biol Reprod. (2018) 99:461–72. doi: 10.1093/biolre/iox176
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. Yao, Z, Si, W, Tian, W, Ye, J, Zhu, R, Li, X, et al. Efecto de la inmunización activa con una nueva vacuna GnRH sobre la función reproductiva en ratas. Teriogenología. (2018) 111:1–8. doi: 10.1016/j.theriogenology.2018.01.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Curtis, AK, Jones, DE, Kleinhenz, M, Montgomery, S, Martin, M, Weeder, M, et al. Administración de una vacuna de inmunocastración a través de un novedoso implante subcutáneo. Animales (Basilea). (2022) 12:2698. doi: 10.3390/ani12192698
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Rocha, LF, Santana, ALA, Souza, RS, Machado-Neves, M, Oliveira, JC, Dos Santos, ESC, et al. Morfometría testicular como herramienta para evaluar la eficacia de la inmunocastración en corderos. Anim Reprod. (2022) 19:e20210041. DOI: 10.1590/1984-3143-AR2021-0041
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Squires, EJ, Bone, C, y Cameron, J. Producción de carne de cerdo con machos enteros: instrucciones para el control del olor a verraco. Animales (Basilea). (2020) 10:1665. doi: 10.3390/ani10091665
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Aluwé, M, Heyrman, E, Kostyra, E, Żakowska-Biemans, S, Almeida, J, Citek, J, et al. Evaluación de la calidad de la carne de túmulos, inmunocastrados y verracos en seis países. Animal. (2022) 16:100455. doi: 10.1016/j.animal.2022.100455
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Lents, MP, Barbosa, LP, Santana, ALA, Pinheiro, EEG, Mugabe, LC, Biscarde, CEA, et al. Inmunocastración de cabras mediante vacuna anti-hormona liberadora de gonadotropina. Teriogenología. (2018) 114:7–13. doi: 10.1016/j.theriogenology.2018.03.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. Zomeño, C, Gispert, M, Čandek-Potokar, M, Mörlein, D, y Font, IFM. Una cuestión de peso corporal y tipo de sexo: composición química de la canal del cerdo y calidad de la carne de cerdo. Ciencia de la carne. (2023) 197:109077. doi: 10.1016/j.meatsci.2022.109077
Resumen de PubMed | Texto completo de CrossRef | Google Académico
73. Bee, G, Quiniou, N, Maribo, H, Zamaratskaia, G, y Lawlor, PG. Estrategias para satisfacer los requisitos nutricionales y reducir el olor a verraco en la carne de cerdos machos enteros e inmunocastrados. Animales (Basilea). (2020) 10:1950. doi: 10.3390/ani10111950
Resumen de PubMed | Texto completo de CrossRef | Google Académico
74. RH, P, Vidal, S, Larraín, R, y Saénz, L. Efectividad de una nueva vacuna recombinante antiGnRH para la inmunocastración en toros. Animales (Basilea). (2021) 11:11. doi: 10.3390/ani11051359
75. Argemí-Armengol, I, Villalba, D, Vall, L, Coma, R, Roma, J, y Álvarez-Rodríguez, J. Cultivos locales e inmunocastración en cerdos pesados de engorde: efectos sobre el rendimiento y el bienestar. Animales (Basilea). (2022) 12:1629. doi: 10.3390/ani12131629
Resumen de PubMed | Texto completo de CrossRef | Google Académico
76. Cui, X, Liu, R, Cui, H, Zhao, G, Zheng, M, Li, Q, et al. Efectos de la caponización y la ovariectomía sobre los índices objetivos relacionados con la calidad de la carne en pollos. Poult Sci. (2017) 96:770–7. doi: 10.3382/ps/pew346
Resumen de PubMed | Texto completo de CrossRef | Google Académico
77. Wang, C, Zeng, YT, Chen, XY, Wu, QY, Yang, LQ, Xu, L, et al. Improvac induce la inmunocastración al afectar los niveles de testosterona e interrumpir la espermatogénesis en pollos de engorde machos. Poult Sci. (2019) 98:6034–45. doi: 10.3382/ps/pez228
Resumen de PubMed | Texto completo de CrossRef | Google Académico
78. Zeng, YT, Wang, C, Zhang, Y, Xu, L, Zhou, GB, Zeng, CJ, et al. La inmunocastración Improvac afecta el desarrollo de los músculos de los muslos, pero no de los músculos pectorales en los pollos machos. Poult Sci. (2020) 99:5149–57. doi: 10.1016/j.psj.2020.06.040
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: inmunocastración, castración quirúrgica, macho, bienestar animal, GnRH
Cita: Wang C, Yang C, Zeng Y y Zhang M (2023) Inmunocastración de GnRH: un método alternativo para la castración quirúrgica de animales machos. Frente. Vet. Sci. 10:1248879. doi: 10.3389/fvets.2023.1248879
Recibido: 27 de junio de 2023; Aceptado: 10 de octubre de 2023;
Publicado: 31 de octubre de 2023.
Editado por:
Izhar Hyder Qazi, Universidad Shaheed Benazir Bhutto de Ciencias Veterinarias y Animales, Pakistán
Revisado por:
Waseem Ali Vistro, Universidad de Yangzhou, China
Derechos de autor © 2023 Wang, Yang, Zeng y Zhang. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Ming Zhang, zhangming@sicau.edu.cn
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía