Residuos tisulares de flunixina meglumina después de la administración intravenosa en cabras
Residuos tisulares de flunixina meglumina después de la administración intravenosa en cabras
 Claire B. Giles
Claire B. Giles  Farha Ferdous
Farha Ferdous  Jennifer L. Halleran
Jennifer L. Halleran  Jim L. Yeatts Ronald
Jim L. Yeatts Ronald  E. Baynes
E. Baynes  Danielle A. Mzyk*
Danielle A. Mzyk*- Departamento de Salud de la Población y Patología, Facultad de Medicina Veterinaria de la Universidad Estatal de Carolina del Norte, Raleigh, Carolina del Norte, Estados Unidos
Fondo: La flunixina se usa comúnmente en cabras de una manera fuera de la etiqueta, lo que indica una necesidad significativa de determinar los intervalos de extracción de los tejidos comestibles.
Objetivo: Los objetivos del presente estudio fueron investigar el agotamiento de la flunixina meglumina en varios tejidos caprinos, incluidos el hígado, el riñón, la grasa y el músculo.
Métodos: Se inscribieron veinte cabras bóer y se les administró una dosis intravenosa (2,2 mg/kg) de flunixina meglumina. Cinco animales fueron sacrificados aleatoriamente a las 24, 48, 72 o 96 h después de la dosificación. Todas las muestras se analizaron mediante cromatografía líquida de ultra rendimiento acoplada a espectrometría de masas.
Resultados: La concentración de flunixina en todos los tejidos disminuyó rápidamente, con las concentraciones medias más altas cuantificadas en los tejidos de riñón (0,137 ± 0,062 μg/g) e hígado (0,077 ± 0,029 μg/g) a las 24 h.
Conclusión: Dado que cualquier detección de residuos de flunixina en el sacrificio encontrados en tejidos de cabra se considera un residuo violatorio, se calculó un intervalo de retiro conservador de 17 días para garantizar que los niveles de flunixina cayeran por debajo de los límites reglamentarios de detección en hígado, riñón y tejidos musculares.
1 Introducción
La flunixina meglumina es un medicamento antiinflamatorio no esteroideo aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA, por sus siglas en inglés) para el tratamiento de afecciones inflamatorias en bovinos, equinos y porcinos. Aunque la flunixina transdérmica ha sido aprobada recientemente para controlar el dolor asociado con la pudrición de las patas en el ganado, no existe una etiqueta aprobada para su uso en ninguna especie de rumiantes pequeños. Para tratar eficazmente a las ovejas y cabras, los veterinarios a menudo deben usar o recetar productos que están etiquetados para otras especies. Cualquier uso de flunixina meglumina en cabras se considera uso de fármaco fuera de etiqueta. La Ley de Aclaración del Uso de Medicamentos para Animales de 1994 (AMDUCA, por sus siglas en inglés) en los Estados Unidos permite el uso fuera de la etiqueta de medicamentos aprobados por la FDA por o bajo la supervisión de un veterinario autorizado dentro de una relación veterinaria-cliente-paciente válida (1). AMDUCA permite a los veterinarios prescribir el uso de ciertos medicamentos aprobados para animales y humanos para animales destinados a la producción de alimentos en condiciones y limitaciones específicas (1).
El tiempo de espera (WDT) es el período posterior al último tratamiento con el fármaco durante el cual el animal no puede ofrecerse para el sacrificio (2). La duración del período de espera se basa en el tiempo necesario para que los residuos de medicamentos en el animal agoten los niveles que se ha demostrado que están por debajo de la tolerancia establecida por un organismo regulador (3). En países fuera de los Estados Unidos, el límite máximo de residuos (LMR) suele ser similar a la tolerancia de los Estados Unidos con respecto a su cálculo e interpretación (4). El WDT es el momento posterior a la administración de la dosis indicada en la etiqueta de un fármaco, tras el cual existe un 95% de confianza en que el 99% de los animales tratados en la población de referencia tendrán residuos tisulares inferiores a la tolerancia para ese fármaco, y su cálculo se conoce como método del límite de tolerancia (TLM) (5). Cada medicamento aprobado para el ganado tiene un tiempo de retiro aprobado, que solo se aplica cuando el medicamento se usa de acuerdo con las instrucciones de la etiqueta. Cuando un medicamento se utiliza de manera no indicada en la etiqueta para satisfacer las condiciones de AMDUCA, un intervalo de retiro extendido (WDI) debe tener una base científica. El WDI (en este contexto) es un período de retención recomendado científicamente derivado de la carne o los productos lácteos de animales después de la administración de un medicamento de manera no indicada en la etiqueta. Las tolerancias a la flunixina establecidas para los tejidos diana del ganado bovino (hígado y músculo) se basan en la evaluación del riesgo para la salud humana y en los datos sobre residuos de flunixina (3). En los pequeños rumiantes, la flunixina no tiene una tolerancia establecida, lo que significa que cualquier residuo detectado es violatorio.
La tolerancia de los EE.UU. a la flunixina es de 0,125 μg/g para el hígado y de 0,025 μg/g para el músculo en el ganado bovino. La cuantificación de los niveles de fármacos en los tejidos está determinada por el Servicio de Inspección y Seguridad Alimentaria de los Estados Unidos (FSIS, por sus siglas en inglés). Aunque no existe tolerancia a la flunixina en las cabras, el FSIS ha determinado el nivel mínimo de aplicabilidad (MLA) como el nivel más bajo en el que un método analítico ha sido validado con éxito para un residuo en cada matriz (tejido). También se refiere al nivel más bajo en el que se espera que un analista de laboratorio mantenga una competencia continua en el método (6). No se ha informado de MLA para flunixina en el hígado de cabra, pero el MLA para el músculo de cabra (0,0125 μg/g) es la mitad de la tolerancia permitida por los mismos tejidos en el ganado bovino (0,025 μg/g) (7). El MLA para los riñones de cabras es el mismo que el músculo (0,0125 μg/g), pero no se ha establecido tolerancia para los tejidos renales de bovinos.
La flunixina y los residuos relacionados han sido investigados previamente por otros en orina (8), plasma (8), suero (9) y leche (10, 11) de animales tratados. Actualmente, hay pocos datos publicados que describan la relación entre la concentración de flunixina en los músculos, los riñones, el hígado y la grasa de las cabras. Por lo tanto, el objetivo de este estudio fue determinar las concentraciones de flunixina en varios tejidos diana, incluidos el hígado, los músculos, los riñones y el tejido graso, en diferentes momentos para estimar un intervalo de abstinencia utilizando la TLM de la FDA.
2 Materiales y métodos
2.1 Animales y alojamiento
Este estudio fue aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Estatal de Carolina del Norte (Protocolo #20-497; 12 de noviembre de 2020). Se incluyeron en este estudio veinte cabras bóer (10 hembras y 10 hembras) de entre 5 y 8 meses de edad con pesos de 29,2 + 3,1 kg. La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA, por sus siglas en inglés) recomienda que se calcule la retirada del sacrificio de al menos 20 animales, con al menos cinco animales sacrificados en cuatro momentos distintos durante la fase de eliminación esperada del medicamento. Todos los animales fueron adquiridos de la Unidad de Educación de Pequeños Rumiantes de la Universidad Estatal de Carolina del Norte y transferidos a la Facultad de Medicina Veterinaria de la Universidad Estatal de Carolina del Norte, donde fueron alojados en corrales de alojamiento grupal. Las cabras fueron alimentadas con alimento comercial para cabras (Purina Animal Nutrition, Arden Hills, MN, Estados Unidos) dos veces al día y tuvieron libre acceso al agua y al heno de la hierba Bermuda costera ad libitum durante todo el estudio. Ninguno de los animales tenía ninguna enfermedad previa o antecedentes médicos o administración de medicamentos antiinflamatorios no esteroideos. Los exámenes físicos fueron realizados por un veterinario 24 horas antes de la administración para asegurarse de que no hubiera condiciones de enfermedad marcadas o signos clínicos anormales.
2.2 Administración de medicamentos
Veinticuatro horas antes del inicio del estudio, las cabras fueron inmovilizadas para el cateterismo intravenoso, y se colocó un catéter intravenoso de calibre 16 (MILA International, Inc., Florence, KY) en la vena yugular derecha utilizando la técnica estéril. Cada una de las cabras se pesó en una báscula digital la mañana del estudio para registrar su peso y determinar la dosis del medicamento. La flunixina inyectable se administró a una dosis única de 2,2 mg/kg por vía intravenosa (Flunixiject, 50 mg/mL, Henry Schein Animal Health, Dublin, OH).
2.3 Recolección de tejidos
Las cabras fueron seleccionadas para la eutanasia a las 24, 48, 72 y 96 h con base en un diseño de estudio aleatorizado. Cada cabra fue sacrificada mediante la administración intravenosa de 87 mg/kg de pentobarbital sódico y fenitoína sódica (Euthasol Euthanasia Solution (390 mg/mL); Virbac Animal Health, Inc. Westlake, TX, Estados Unidos) después de la sedación intravenosa con 0,5 mg/kg de xilacina (inyección de xilacina Rompun (100 mg/ml); Dechra Veterinary Products, Overland Park, KS, Estados Unidos). Se tomaron muestras de glúteobíceps, grasa subcutánea, hígado entero y ambos riñones de cada cabra post mortem para el análisis de la concentración del fármaco. Antes de la congelación, las muestras de hígado se colocaron de manera que se pudieran extraer dos punzones de aproximadamente 5 cm de diámetro de una sección transversal de cada lóbulo del hígado (caudado, cuadrado, lóbulos derecho e izquierdo) y congelar en bolsas Whirl-Pak (Whirl-Pack Filtration Group, Chicago, IL, Estados Unidos) para facilitar el procesamiento. Todo el tejido hepático restante también se congeló por separado para preservar el tejido restante. Los cuatro tipos de tejido se procesaron y almacenaron a -20 °C hasta el análisis. Las muestras de plasma se recolectaron como parte de un estudio separado que forma parte de un modelo más amplio basado en la población que estamos desarrollando y se evaluaron por separado.®®
2.4 Preparación de muestras de hígado, riñón, músculo y tejido adiposo
Todas las muestras de tejido se prepararon de la misma manera para ser analizadas por triplicado. Se tomaron muestras de hígado de los punzones circulares congelados preenvasados, se mezclaron y se pesaron en muestras de 0,2 g. Cada muestra de 0,2 g de tejido caprino se colocó en un tubo de molino de perlas de 2 ml y se centrifugó a 10.000 × g durante 30 s para colocar el tejido en el fondo del tubo. A continuación, las muestras se enriquecieron con 10 μL del patrón interno, flunixina-d3 (VETRANAL, MilliporeSigma, Burlington, MA, Estados Unidos), y se dejaron reposar durante 15 min; y se añadió 1 mL de acetonitrilo 85:15: agua ultrapura +0,2% de ácido fórmico a cada tubo que contenía las muestras (Acetonitrilo: Fisher Chemical, Fisher Scientific, ≥99,9% de pureza; Grado UHPLC de ácido fórmico: Fisher Chemical, Fisher Scientific, ≥99,9%). Los tubos se colocaron en un homogeneizador FisherBrand™ Bead Mill 24 (Thermo Fisher, Waltham, MA, Estados Unidos) y se programaron para funcionar a 5,00 m/s durante 15 s, tres veces, con un descanso de 10 s entre ciclos. Los tubos se sacaron del homogeneizador y se colocaron en una microcentrífuga a 10.000 × g durante 7 min. Después de la centrifugación, se cargaron 800 μL del sobrenadante en un cartucho MCX de 1 cc (30 mg) de Waters Oasis (Waters Corporation, Milford, MA, Estados Unidos) para la extracción en fase sólida (SPE). Cada muestra se lavó con 1 ml de ácido fórmico al 0,2 % en agua, seguido de un segundo lavado con 1 ml de metanol al 100 % (Optima LC/MS, Fisher Chemical, Fisher Scientific, >99,9 % de pureza). Se colocaron tubos de vidrio de borosilicato nuevos y limpios de 16 × 100 mm debajo de cada muestra antes de eluirlos con 1 ml de hidróxido de amonio al 5 % (certificado ACS Plus, Fisher Chemical, Fisher Scientific, ≥28-30 %; 14,8 N, pH 12) en metanol. Cada muestra se evaporó hasta la sequedad utilizando un evaporador de nitrógeno (RapidVap Vertex Evaporater, Labconco, Kansas City, MO, Estados Unidos) a 55 °C durante aproximadamente 10 min, reconstituido en 300 μL de acetonitrilo: agua ultrapura 1:1, en vórtice durante 30 s. Finalmente, todas las muestras se filtraron a través de dispositivos que contenían medios filtrantes de PVDF de 0,2 μm (filtros sin jeringa Whatman Mini-UniPrep™, Cytiva, Marlborough, MA, Estados Unidos) antes del análisis mediante cromatografía líquida de ultra rendimiento acoplada a espectrometría de masas (UPLC/MS).®®
2.5 Condiciones de validación y UPLC/MS
La validación del método se realizó de acuerdo con las Guías Bioanalíticas de la FDA (12). Las curvas estándar para cada análisis de tejido se prepararon fortificando el homogeneizado de tejido no tratado con el estándar de flunixina (Sigma-Aldrich, MilliporeSigma, 96,9% de pureza), que produjo un rango de concentración lineal de 1-500 ng/g con un coeficiente de correlación, R2 de 0,99. La recuperación, exactitud y precisión se determinaron mediante el análisis de cinco réplicas a concentraciones bajas, medias y altas dentro del rango de concentración de la curva para cada tejido. La precisión y exactitud intradía se obtuvieron mediante el análisis de tres concentraciones diferentes de flunixina repetidas cinco veces cada una en el mismo día. La precisión y exactitud entre días se obtuvo mediante el análisis de siete concentraciones diferentes en cinco días diferentes. La precisión y exactitud intra e interdía se muestran en los materiales complementarios. Se determinó que el límite de detección (LOD) para muestras de hígado, músculo y grasa era de 0,001 μg/g, y que el límite de cuantificación (LOQ) era de 0,002 μg/g para estos tejidos. Se determinó que el LOD para las muestras de riñón era de 0,002 μg/g, y el LOQ se determinó en 0,005 μg/g.
El análisis se realizó en un cromatógrafo líquido de ultra rendimiento de Waters acoplado a un detector de espectrómetro de masas Acquity Qda de Waters (Waters Corporation, Milford, MA, Estados Unidos). El instrumento se configuró para el registro de iones individuales de 297 m/z y 300 m/z para flunixin y flunixin-d3, respectivamente, utilizando ionización por electrospray en el modo de iones positivos (ESI+). El voltaje del cono era de 20V. Se utilizó una columna Waters Acquity UPLC BEH C18 de 1,7 μm (2,1 mm × 50 mm) con la correspondiente columna previa VanGuard™ (columna de 2,1 mm × 5 mm, Waters Corporation, Milford, MA, Estados Unidos) para todas las separaciones que afectaban al hígado. Para todos los demás tejidos, se utilizó una columna Waters Acquity UPLC BEH Phenyl de 1,7 μm (2,1 mm × 100 mm) con la correspondiente columna VanGuard™ Pre-column (2,1 mm × 5 mm). La fase móvil era un gradiente. El disolvente A1 era ácido fórmico al 0,1% en agua. El disolvente A2 era 90:10 agua ultrapura:acetonitrilo. El disolvente B1 fue ácido fórmico al 0,1% en acetonitrilo. El caudal fue de 0,40 mL/min. Para todos los tejidos, excepto el riñón, el gradiente se programó de la siguiente manera: De 0,00 a 1,00 min, la composición fue 70% A1:30% B1; de 1.00 a 2.50 min, la composición cambió linealmente a 10% A1:90% B1, luego se mantuvo hasta 3.50 min; finalmente, de vuelta al 70% A1:30% B1 a los 3,51 min y se mantuvo a los 5,00 min. Para el riñón, el gradiente se programó de la siguiente manera: De 0,00 a 0,50 min, la composición fue 70% A2:30% B1; de 0,50 a 4,00 min, la composición cambió linealmente a 10% A2:90% B1, luego se mantuvo hasta 4,50 min; finalmente, de vuelta al 70% A2:30% B1 a los 4,51 min y se mantuvo a los 6,00 min.
2.6 Cálculos de la vida media de eliminación de tejidos
La vida media de eliminación tisular se refiere a una estimación del tiempo en el que las concentraciones o la cantidad del fármaco en ese tejido en particular se reducirán exactamente a la mitad en la fase terminal de una curva concentración-tiempo. Aunque la vida media indica una reducción del 50% de la concentración de la droga cuando se ha alcanzado el pseudoequilibrio, no proporciona ninguna garantía de que la droga se esté eliminando del cuerpo; por lo tanto, estimar un IDM basado en la vida media será engañoso. Sin embargo, la vida media proporciona una comprensión de cuánto tiempo permanecerá el fármaco en el tejido o con qué frecuencia debe administrarse el fármaco para tener el nivel deseado de eficacia. Por lo tanto, para estimar la vida media de eliminación, la fórmula más utilizada es t1/2 = 0,693/k, donde k es la pendiente obtenida mediante el ajuste de un modelo de regresión lineal simple de log de concentraciones vs. tiempo a partir del conjunto de datos de concentraciones tisulares.
2.7 Cálculos del intervalo de retirada
El cálculo de TLM utiliza el método de mínimos cuadrados ordinarios para ajustar la regresión lineal simple del logaritmo de las concentraciones frente a los perfiles de tiempo de las concentraciones tisulares (5). Los supuestos, a saber, la especificación correcta del modelo de media, el supuesto de varianza homocedástica/igual, los errores no correlacionados y el supuesto de normalidad, deben satisfacerse para ajustarse al modelo de regresión lineal. Además, en función de los valores ajustados, se puede calcular el límite superior de tolerancia del 99 % con un 95 % de confianza en cualquier momento. Los valores de la concentración pronosticada en el nuevo punto de tiempo se comparan con la tolerancia objetivo. El tiempo con una concentración correspondiente menor o igual a la tolerancia especificada se notifica como tiempo de retirada. Aunque los cálculos para determinar el WDI para este estudio se basaron en el método regulatorio federal utilizado en los Estados Unidos, la administración de flunixina a cabras se considera fuera de la etiqueta y, por lo tanto, no tiene un tiempo de retiro aprobado por el gobierno federal. Para determinar un WDI utilizando el TLM, se asignó un límite de detección (sensibilidad del ensayo) a un nivel de tolerancia y se ingresó en el cálculo. Para determinar un WDI recomendado en los tejidos comestibles examinados, se evaluaron varios escenarios diferentes utilizando los LOD de nuestro laboratorio (FARAD, Food Animal Residue Avoidance Databank), FSIS MLA o la tolerancia en tejido de ganado por parte de la FDA. Las evaluaciones específicas de cada escenario se pueden ver en los materiales complementarios. Los parámetros finales para el modelo WDI utilizaron la sensibilidad del ensayo FARAD como LOD y la tolerancia para cada tejido (Tabla 1).
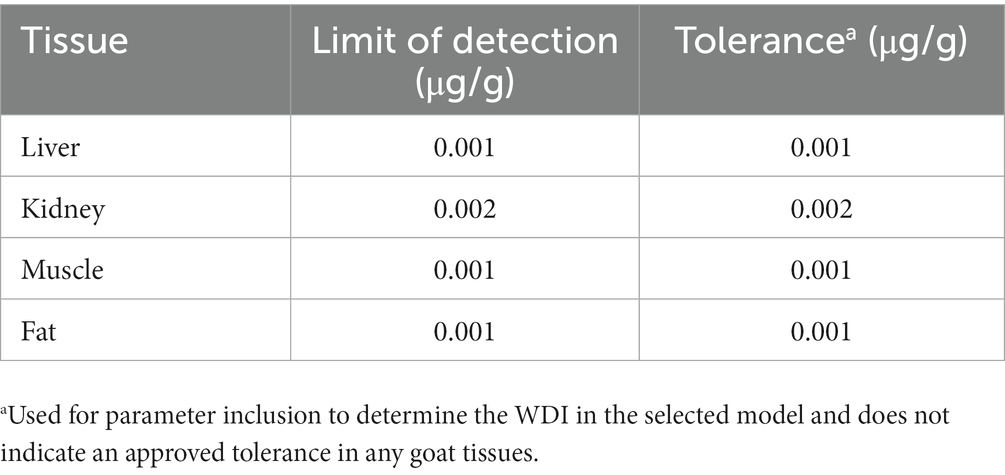 Tabla 1. Límite FARAD de niveles de detección/tolerancia para los cálculos del intervalo de retirada.
Tabla 1. Límite FARAD de niveles de detección/tolerancia para los cálculos del intervalo de retirada.
3 Resultados
3.1 Concentraciones tisulares y vidas medias de eliminación
A las 24 h después de la administración, la mayor concentración de flunixina se encontró en los tejidos renal (Figura 1A) e hígado (Figura 1B), seguidos de los tejidos grasos (Figura 1C) y musculares (Figura 1D). Los niveles de concentración tisular de flunixina disminuyeron rápidamente en los tejidos, con las concentraciones medias más altas observadas en el riñón (0,137 ± 0,062 μg/g) y en los tejidos hepáticos (0,077 ± 0,029 μg/g) a las 24 h después de la administración intravenosa. No se detectó flunixina en ningún tejido por encima de la tolerancia hepática/muscular bovina ni FSIS MLA a las 96 h. Las vidas medias de eliminación tisular de flunixina en cabras fueron más altas en el músculo (55,81 h), seguido de la grasa (36,15 h), el hígado (14,34 h) y el riñón (13,65 h).
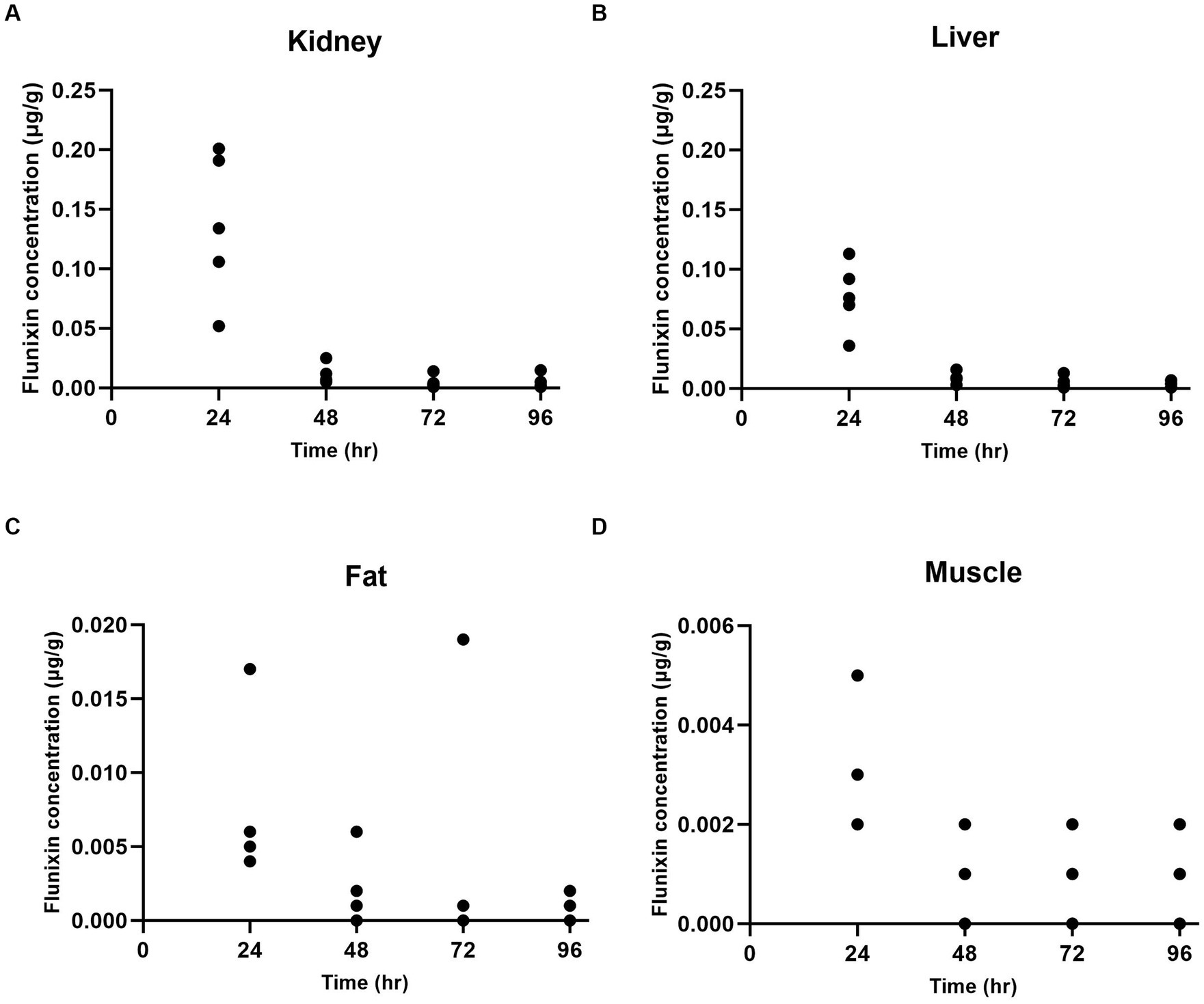 Figura 1. Concentraciones individuales de flunixina en cabras (n = 5) en cada punto de tiempo en los tejidos renal (A), hepático (B), graso (C) y muscular (D).
Figura 1. Concentraciones individuales de flunixina en cabras (n = 5) en cada punto de tiempo en los tejidos renal (A), hepático (B), graso (C) y muscular (D).
3.2 Intervalo de espera
Utilizando el LOD validado para cada tejido caprino en nuestro laboratorio (Tabla 1), la tolerancia para las concentraciones permitidas en tejidos caprinos se fijó en 0,001 μg/g (hígado, músculo y grasa) y 0,002 μg/g para riñón. Para los cálculos de WDI, se incluyeron en los cálculos todos los puntos de datos que estaban por encima del LOD de laboratorio de FARAD para cada tejido. A partir de estos valores, se realizó una regresión semilineal y se determinó el IDM más largo en tejido adiposo (46 días; Figura 2A), seguido del músculo (17 días; Figura 2B), riñón (15 días; Figura 2C) e hígado (8 días; Figura 2D). Todos los valores de WDI se redondearon al número entero más cercano.
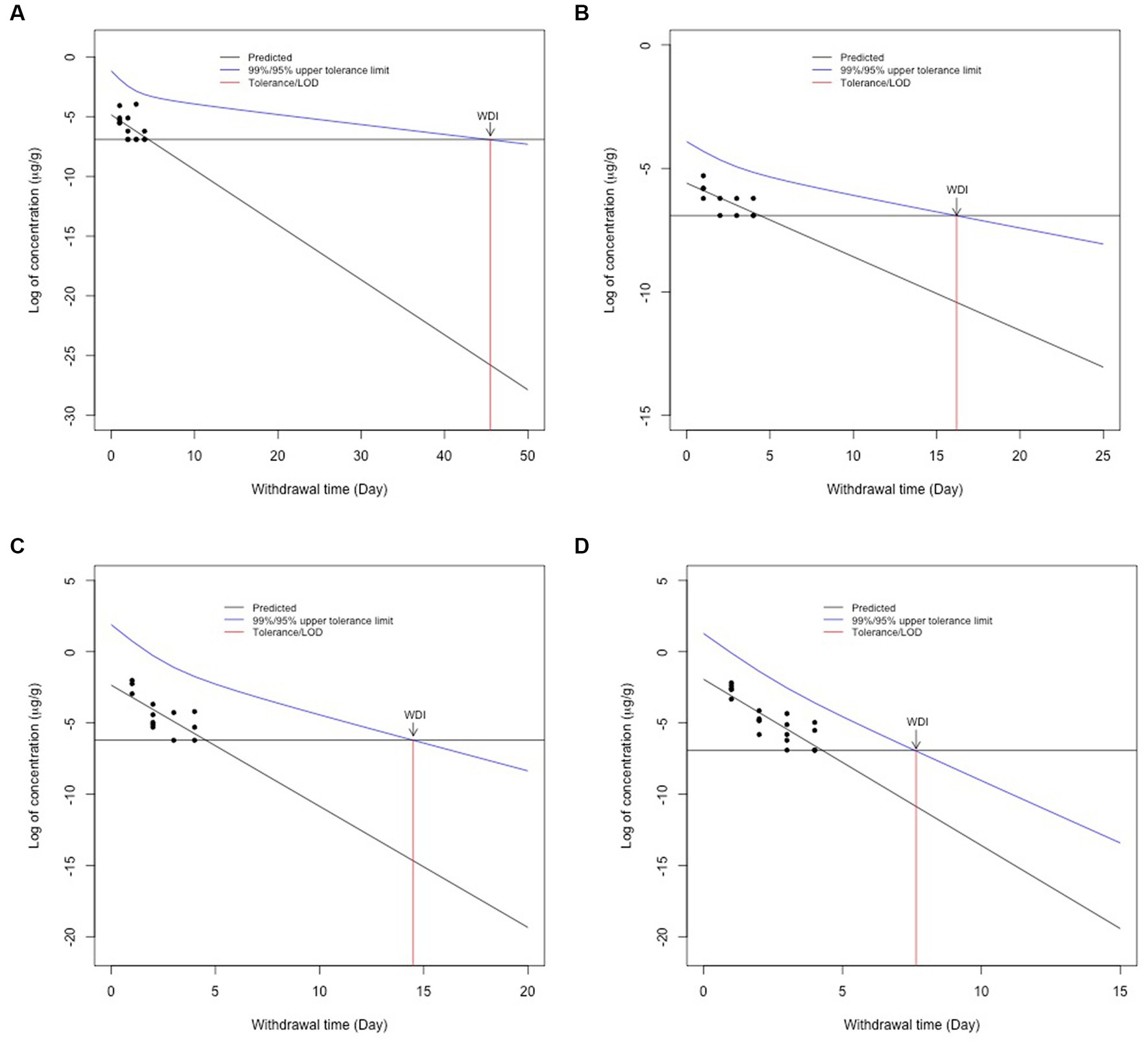 Figura 2. Cálculos del intervalo de retirada para la grasa (A), el músculo (B), el riñón (C) y el hígado (D) siguiendo el método del límite de tolerancia de la FDA después de 2,2 mg/kg de flunixina intravenosa. Los puntos negros representan las concentraciones de flunixina de animales individuales en cada punto de tiempo. La línea azul representa el intervalo de confianza del 95% para cuando el 99% de la población tiene una concentración del fármaco por debajo de una concentración objetivo determinada. La línea roja representa el WDI para cada tejido cuando la concentración cae por debajo del límite de detección FARAD para cada tejido.
Figura 2. Cálculos del intervalo de retirada para la grasa (A), el músculo (B), el riñón (C) y el hígado (D) siguiendo el método del límite de tolerancia de la FDA después de 2,2 mg/kg de flunixina intravenosa. Los puntos negros representan las concentraciones de flunixina de animales individuales en cada punto de tiempo. La línea azul representa el intervalo de confianza del 95% para cuando el 99% de la población tiene una concentración del fármaco por debajo de una concentración objetivo determinada. La línea roja representa el WDI para cada tejido cuando la concentración cae por debajo del límite de detección FARAD para cada tejido.
4 Discusión
Este estudio se realizó para establecer un WDI en cabras de carne después de la administración de una dosis intravenosa única de 2,2 mg/kg de flunixina meglumina utilizando el TLM de la FDA. Las concentraciones de flunixina encontradas en el hígado y el músculo de todas las cabras se cuantificaron por debajo del límite de tolerancia establecido por la FDA para la flunixina en el ganado bovino y en el hígado (0,125 μg/g) y el músculo (0,025 μg/g) de las vacas adultas en todos los puntos temporales. Las concentraciones medias de flunixina en los riñones fueron los niveles más altos de todos los tejidos analizados a las 24 h después de la administración (0,137 μg/g). A pesar de que el tejido adiposo no tiene un MLA establecido por el FSIS, evaluamos las concentraciones en función del nivel de prueba confirmatoria para el riñón y el músculo. Se detectó flunixina en dos muestras de grasa por encima de 0,0125 μg/g a las 24 y 72 h. Es probable que esto se deba a la variabilidad de la distribución del fármaco y de la unión y eliminación de tejidos en cada cabra.
De acuerdo con la Guía para la Industria de la FDA, la TLM considera la tasa de agotamiento y la variabilidad entre animales individuales para determinar el intervalo de confianza del 95% para cuando el 99% de la población tendrá una concentración del fármaco por debajo de una concentración objetivo determinada (5). El límite de detección para el ensayo de FARAD fue mucho más bajo que la sensibilidad reportada por el MLA del FSIS. El MLA para la grasa no está disponible en el FSIS (comunicación personal con askFSIS) y, por lo tanto, no se pudo determinar ningún IDM utilizando la sensibilidad del ensayo de los métodos de prueba del FSIS. Dado que la flunixina administrada por vía intravenosa a la dosis del ganado ganadería indicada en la etiqueta se considera un uso fuera de la etiqueta, es imperativo reconocer que cualquier detección de residuos de flunixina en el momento del sacrificio en los tejidos de las cabras se considera un residuo violatorio, por lo que se necesita un intervalo de retirada más conservador. Las vidas medias de eliminación determinadas en el ganado bovino fueron más largas en el hígado (34,2 h) y el riñón (29,6 h) en comparación con los valores determinados en los tejidos caprinos. Las diferencias informadas entre la sensibilidad del ensayo FARAD o el límite de la detección y el MLA del FSIS para cada tejido pueden contribuir a las diferencias observadas entre los cálculos del intervalo de retirada. Se ha descrito que la vida media de eliminación es la más susceptible a la sensibilidad del método analítico (13). La vida media de eliminación de tejido muscular determinada en cabras a partir de este estudio (55,81) es aproximadamente dos veces más larga que la observada previamente en bovinos (14). Se ha demostrado que el método analítico con un límite de detección más bajo afecta a la parte terminal de la curva de depleción tisular porque las concentraciones pueden detectarse con mayor precisión durante períodos más largos. El aumento de la sensibilidad del método en nuestro estudio, además de la menor tolerancia seleccionada (basada en LOD) en comparación con el MLA del FSIS, probablemente contribuyó a una vida media de eliminación más larga en el tejido muscular y al intervalo de retiro informado.
La administración de dosis múltiples de flunixina por una vía distinta de la IV puede requerir la ampliación del IDM para los tejidos diana a fin de garantizar que no se detecten residuos infractores en las cabras tratadas. También debe tenerse en cuenta que estas cabras estaban sanas, y el metabolismo de la flunixina podría diferir mucho en un animal enfermo, y nuestras estimaciones proporcionadas aquí pueden no ser aplicables a las cabras no sanas (14, 15).
El método del límite de tolerancia de la FDA utiliza el modelo de regresión lineal basado en el cual se calcula la tolerancia del 99% con un 95% de confianza utilizando la distribución t no central. Por lo tanto, para ajustarse al modelo de regresión lineal, el conjunto de datos que involucra el logaritmo de concentraciones y tiempo debe satisfacer los supuestos, a saber, la especificación correcta del modelo de media, la homocedasticidad, los errores no correlacionados y la normalidad. La violación de estos supuestos conduce a la eliminación de algunos puntos de datos para que se puedan satisfacer los supuestos, lo que conduce a la exclusión de información importante de todos los datos. Si excluimos las concentraciones que eran inferiores a los límites de detección del FSIS para los tejidos de cabra, solo 15 de cada 100 muestras (incluidos todos los tejidos de las 20 cabras) se habrían incluido en el análisis. Es importante tener en cuenta que la eliminación de los puntos por debajo de la tolerancia, el límite de detección del ensayo y/o el MLA puede disminuir las estimaciones del tiempo de retirada, como se indica con el WDI calculado utilizando los MLA del FSIS. Al eliminar los puntos de tiempo que más disminuyen la linealidad, también se puede disminuir el WDI. Otro problema potencial es que al eliminar los puntos de datos, el IDM también podría aumentar debido a un cambio en el grado de libertad de los datos, lo que aumenta el tamaño del intervalo de confianza que rodea la distribución t de la población calculada. Además, los límites de detección cambian a medida que mejoran los métodos analíticos y pueden afectar a los cálculos futuros del intervalo de retirada.
Este estudio proporciona nuevos datos sobre el agotamiento tisular tras el uso de una dosis única de flunixina por vía intravenosa en cabras bóer. Estos datos se han utilizado para crear una recomendación de WDI para el sacrificio de al menos 17 días para el tejido muscular, hepático y renal, que es fundamental para proteger el suministro de alimentos después del uso de medicamentos fuera de la etiqueta en cabras. A pesar de que no existe un método de prueba reglamentario actual para detectar flunixina en el tejido adiposo, se recomienda un intervalo de extracción más largo (46 días) para la grasa debido a la variabilidad en los residuos encontrados en las cabras. Este estudio reporta diferencias importantes en los cálculos de WDI basados en las sensibilidades del ensayo en diferentes tejidos. Se deben realizar estudios adicionales que investiguen las concentraciones de flunixina en animales enfermos a los que se les administró flunixina para determinar si las concentraciones tisulares y las tasas de eliminación difieren en cabras sanas frente a cabras clínicamente enfermas.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Estatal de Carolina del Norte. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
CG: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición. FF: Curación de datos, Análisis formal, Visualización, Redacción – borrador original, Redacción – revisión y edición. JH: Curación de datos, Análisis formal, Investigación, Metodología, Supervisión, Redacción, revisión y edición. JY: Análisis formal, Validación, Redacción – revisión y edición. RB: Conceptualización, Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Recursos, Supervisión, Validación, Visualización, Redacción – revisión y edición. DM: Conceptualización, Curación de datos, Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Supervisión, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio fue realizado por el programa Food Animal Residue Databank (FARAD) y fue financiado por las subvenciones USDA 2020-41480-32520 y 2021-41480-35270.
Reconocimientos
Los autores desean agradecer al personal de Recursos para Animales de Laboratorio de la Facultad de Medicina Veterinaria de la Universidad Estatal de Carolina del Norte por su ayuda con este estudio.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1341779/full#supplementary-material
Abreviaturas
AMDUCA, Ley de Aclaración del Uso de Medicamentos para Animales de 1994; FARAD, Banco de Datos para la Prevención de Residuos de Animales destinados a la Alimentación; FDA, Administración de Alimentos y Medicamentos de los Estados Unidos; FSIS, Servicio de Inocuidad e Inspección de los Alimentos de los Estados Unidos; LOD: Límite de detección; MLA, Nivel mínimo de aplicabilidad; LMR: Límite máximo de residuos; TLM, Método del límite de tolerancia; UPLC/MS, cromatografía líquida de ultra rendimiento acoplada a espectrometría de masas; WDI: Intervalo de retirada; WDT, Tiempo de retirada.
Referencias
1. Administración de Alimentos y Medicamentos, Departamento de Salud y Servicios Humanos, 21 C.F.R. § 520 (1996). Disponible en: https://www.ecfr.gov/current/title-21/part-530.
2. Administración de Alimentos y Medicamentos, Centro de Medicina Veterinaria. (1993). Guía de política de cumplimiento, sección 615.20: uso adecuado de medicamentos y evitación de residuos por parte de personas que no son veterinarios. Disponible en: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/cpg-sec-615200-proper-drug-use-and-residue-avoidance-non-veterinarians.
3. Administración de Alimentos y Medicamentos, Departamento de Salud y Servicios Humanos, 21 C.F.R. § 556 (2019). Disponible en: https://www.ecfr.gov/current/title-21/part-556.
4. Reglamento n.º 470/2009 del Parlamento Europeo y del Consejo, de 6 de mayo de 2009. Por el que se establecen procedimientos comunitarios para la fijación de los límites de residuos de sustancias farmacológicamente activas en los alimentos de origen animal. Disponible en: http://data.europa.eu/eli/reg/2009/470/oj.
5. Administración de Alimentos y Medicamentos, Centro de Medicina Veterinaria. (2022). Guía para la industria #3. Principios generales para la evaluación de la inocuidad de los compuestos utilizados en animales destinados a la producción de alimentos. Disponible en: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/cvm-gfi-3-general-principles-evaluating-human-food-safety-new-animal-drugs-used-food-producing.
6. Departamento de Agricultura de los Estados Unidos, Servicio de Inocuidad e Inspección de los Alimentos. Cribado y confirmación de residuos de medicamentos para animales mediante UHPLC-MS-MS. CLG-MRM3. Revisión: 04. Vigencia: 28/02/23. Disponible en: https://www.fsis.usda.gov/sites/default/files/media_file/documents/CLG-MRM3.04.pdf (Consultado en agosto de 2023).
7. Departamento de Agricultura de los Estados Unidos, Servicio de Inocuidad e Inspección de Alimentos. Cribado y confirmación de residuos de medicamentos para animales mediante UHPLC-MS-MS. CLG-MRM1.08. Revisión: 08. Vigencia: 11/05/18. Disponible en: https://www.fsis.usda.gov/sites/default/files/media_file/2020-09/clg-mrm1.Pdf (Consultado en agosto de 2023).
8. Bublitz, CM, Mzyk, DA, Mays, T, Fajt, VR, Hairgrove, T y Baynes, RE. Concentraciones plasmáticas y urinarias comparativas de Flunixin y meloxicam en cabras. Pequeña Rumin Res. (2019) 174:40–6. doi: 10.1016/j.smallrumres.2019.01.013
9. Smith, JS, Marmulak, TL, Angelos, JA, Lin, Z, Rowe, JD, Carlson, JL, et al. Parámetros farmacocinéticos e intervalos estimados de retirada de leche para cabras domésticas (Capra Aegagrus Hircus) después de la administración de dosis únicas y múltiples intravenosas y subcutáneas de flunixina meglumina. Front Vet Sci. (2020) 7:213. doi: 10.3389/fvets.2020.00213
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Feely, WF, Chester-Yansen, C, Thompson, K, Campbell, JW, Boner, PL, Liu, DW, et al. Residuos de flunixina en la leche después del tratamiento intravenoso del ganado lechero con (14)C-flunixina. J Agric Food Chem. (2002) 50:7308–13. doi: 10.1021/jf0258609
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. EbdS, M, Wiloch, EE, Nixon, E, Yeatts, JL, Sheela, FF, Smith, GW, et al. La farmacocinética de la flunixina transdérmica en cabras lecheras lactantes. J Lácteos Sci. (2022) 105:549–59. doi: 10.3168/jds.2021-20460
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Administración de Alimentos y Medicamentos. (2021). Guía para la industria: validación de métodos bioanalíticos. Disponible en: http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM070107.pdf (consultado el 8 de diciembre de 2023).
13. Toutain, PL y Bousquet-Mélou, A. Vida media terminal del plasma. J Vet Pharmacol Ther. (2004) 27:427–39. doi: 10.1111/j.1365-2885.2004.00600.x
14. Kissell, LW, Leavens, TL, Baynes, RE, Riviere, JE, y Smith, GW. Comparación de la farmacocinética de flunixina y la eliminación de leche en vacas sanas y vacas con mastitis. J Am Vet Med Assoc. (2015) 246:118–25. doi: 10.2460/javma.246.1.118
15. Wu, H, Baynes, RE, Tell, LA, y Riviere, JE. Predicción de las concentraciones de residuos tisulares de flunixina en hígados de bovinos enfermos. Toxicol químico alimentario. (2013) 62:876–9. doi: 10.1016/j.fct.2013.10.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: flunixina, cabra, residuos, método límite de tolerancia, intervalo de retirada, tiempo de retirada
Cita: Giles CB, Ferdous F, Halleran JL, Yeatts JL, Baynes RE y Mzyk DA (2024) Residuos tisulares de flunixina meglumina después de la administración intravenosa en cabras. Frente. Vet. Sci. 10:1341779. doi: 10.3389/fvets.2023.1341779
Recibido: 20 de noviembre de 2023; Aceptado: 18 de diciembre de 2023;
Publicado: 09 Enero 2024.
Editado por:
Dapeng Peng, Universidad Agrícola de Huazhong, China
Revisado por:
Cengiz Gokbulut, Universidad de Balıkesir, Türkiye
Aneliya Milanova, Universidad de Trakia, Bulgaria
Derechos de autor © 2024 Giles, Ferdous, Halleran, Yeatts, Baynes y Mzyk. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Danielle A. Mzyk, dalindqu@ncsu.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía


