Respuesta del microbioma ruminal al suplemento de bolo mineral de liberación sostenida con forrajes de baja y alta calidad

Respuesta del microbioma ruminal al suplemento de bolo mineral de liberación sostenida con forrajes de baja y alta calidad
 Jed O. Eberly1*,
Jed O. Eberly1*,  Samuel A. Wyffels2,
Samuel A. Wyffels2,  Tanner J. Carlisle2 y
Tanner J. Carlisle2 y  Timothy DelCurto2
Timothy DelCurto2- 1Central Agricultural Research Center, Montana State University, Moccasin, MT, Estados Unidos
- 2Department of Animal and Range Sciences, Montana State University, Bozeman, MT, Estados Unidos
Introducción: La cantidad y calidad limitadas de forraje son desafíos que enfrentan los sistemas de producción ganadera en los pastizales semiáridos del oeste de los Estados Unidos, particularmente cuando el ganado enfrenta factores estresantes como el clima frío o tiene mayores requisitos nutricionales, como durante el embarazo y la lactancia. Para satisfacer las necesidades nutricionales del ganado, los productores con frecuencia proporcionan nutrición suplementaria, sin embargo, existe un conocimiento limitado sobre los efectos de estas prácticas en el microbioma ruminal en estos entornos.
Métodos: Se realizó un estudio para evaluar los cambios en el microbioma ruminal en respuesta a forraje de alta y baja calidad con bolos minerales de liberación sostenida. El estudio consistió en 16 vacas black angus ruminalmente canuladas de 2 a 3 años alimentadas con heno de alfalfa de hierba de alta calidad o heno de hierba de baja calidad con un bolo mineral de liberación sostenida de 90 o 180 días. Las muestras de rumen se recolectaron antes de la alimentación y 8 horas después de la alimentación y se secuenciaron amplicones bacterianos del gen 16S rRNA del líquido ruminal.
Resultados: La diversidad alfa medida por el índice de diversidad de Shannon disminuyó significativamente con el tiempo (p<0.01) y promedió 5.6 antes de la alimentación y 5.4 después de la alimentación y no fue significativamente diferente entre forrajes de alta y baja calidad o entre tipos de bolos minerales (p>0.05). El análisis de coordenadas principales (PCoA) de la matriz de disimilitud de Bray-Curtis mostró una agrupación distinta por calidad y tiempo de alimentación, pero no por tipo de bolo mineral. Bacteroidetes y Firmicutes fueron los filos dominantes en todos los tratamientos y se observaron aumentos significativos (p<0,05) en la abundancia relativa de la familia Lachnospiraceae y el género Prevotella en dietas forrajeras de alta calidad. Rumen VFA y NH3Las concentraciones de N también se asociaron fuertemente con la dieta forrajera de alta calidad. El perfil funcional predictivo indicó que las funciones asociadas con la metanogénesis se correlacionaron negativamente con la calidad del alimento.
Discusión: Los resultados de este estudio sugieren que es poco probable que el tipo de bolo mineral afecte la estructura o función de la comunidad bacteriana ruminal, mientras que la calidad del forraje puede alterar significativamente la estructura de la comunidad y las funciones predichas asociadas con la metanogénesis y la producción de AGV.
Introducción
Los sistemas de producción ganadera en pastizales semiáridos en el oeste de los Estados Unidos se ven desafiados por la cantidad y calidad limitadas de forraje. Las temporadas de crecimiento más cortas en las latitudes del norte y las áreas de gran elevación requieren depender del forraje cosechado para mantener al ganado durante el invierno. La calidad del forraje es particularmente importante cuando el ganado se enfrenta a factores estresantes como el clima frío o tiene mayores requisitos nutricionales, como durante el embarazo y la lactancia. Además, las deficiencias de minerales traza son comunes en los rumiantes durante la lactancia (Zhao et al., 2022). Para satisfacer las necesidades nutricionales del ganado, los productores complementan el forraje de baja calidad (bajo contenido de proteína cruda) con suplementos proteicos y minerales (DelCurto et al., 2000). Los productores tienen acceso a una variedad de sistemas de entrega de minerales para satisfacer los requisitos de nutrientes, pero a menudo estos sistemas tienen limitaciones. Los sistemas autoalimentados a menudo están limitados por una variación extrema en la ingesta, mientras que los sistemas de administración de dosis única tienen tasas rápidas de respuesta sérica y hepática, pero un efecto a corto plazo que requiere múltiples tratamientos para satisfacer las necesidades de nutrientes del animal (Arthington y Swensont, 2004; Jackson et al., 2020).
Trabajos anteriores han evaluado el uso de bolos minerales de liberación sostenida en el rendimiento del ganado (Sprinkle et al., 2006; Jackson y otros, 2020; Sprinkle et al., 2021). Los resultados han demostrado que la suplementación con un bolo mineral traza de acción prolongada disminuyó el intervalo de parto y aumentó el peso del destete de terneros del ganado pastoreado en un entorno de pastizales (Sprinkle et al., 2021). Hay pocos estudios que caractericen las tasas de degradación de los bolos minerales de liberación sostenida y los factores que afectan las tasas de degradación (Carlisle et al., 2021) y se sabe poco sobre la interacción de los bolos minerales y la calidad del forraje en la estructura y función de la comunidad microbiana ruminal.
El perfil nutricional dietético, la calidad del forraje y la disponibilidad de minerales son cruciales para dar forma a la estructura y función de la comunidad microbiana ruminal. El rumen contiene un complejo consorcio microbiano que coloniza y degrada el material vegetal ingerido. Los productos finales de la degradación anaeróbica de materias primas celulolíticas y hemicelulolíticas complejas son principalmente ácidos grasos volátiles (AGV) que consisten predominantemente en acetato, propionato y butirato (Newbold y Ramos-Morales, 2020). Los cambios dietéticos en la disponibilidad de nutrientes pueden alterar la composición de la comunidad microbiana ruminal y las funciones asociadas, como la degradación de la fibra y la hidrogenación de ácidos grasos (Newbold y Ramos-Morales, 2020). Los estudios también han demostrado que el ganado alimentado con dietas altas en concentrados tiende a tener mayores abundancias de Prevotella ruminicola, P. brevis, P. bryantii y P. albensis, mientras que el ganado alimentado con forraje tenía mayores abundancias de Fibrobacter y una mayor diversidad microbiana según las métricas de diversidad alfa y diversidad beta de Simpson (Henderson et al., 2015; Tapio et al., 2017). La investigación que compara diferentes fuentes de forraje con proteínas y minerales suplementarios ha demostrado que el ganado alimentado con una dieta a base de heno de alfalfa tenía una mayor diversidad alfa microbiana que el ganado alimentado con una dieta basada en paja de triticale (Kong et al., 2010; Petri et al., 2018). La disponibilidad de minerales puede afectar la fermentación. El selenio puede alterar la composición del microbioma ruminal y el contenido de AGV (Hendawy et al., 2021) y la suplementación mineral se ha relacionado con una mayor abundancia de bacterias productoras de propionato (Liu et al., 2017). En contraste, otros estudios han mostrado ningún efecto o un efecto negativo sobre la fermentación ruminal en respuesta a la suplementación con manganeso y zinc, aunque la respuesta varió según la fuente mineral (Liu et al., 2017; Vigh et al., 2023).
Si bien numerosos estudios han evaluado los efectos de la calidad de la dieta en la estructura y función de la comunidad microbiana ruminal, pocos han evaluado la calidad del forraje junto con bolos minerales de liberación sostenida en el ganado de carne. Anteriormente encontramos que la calidad de la dieta afectaba las tasas de degradación de los bolos minerales de liberación sostenida (Carlisle et al., 2021). El objetivo de este estudio fue caracterizar el efecto de la calidad del forraje en conjunto con dos bolos de suplementos minerales de liberación prolongada diferentes sobre la estructura y función del microbioma ruminal. Planteamos la hipótesis de eso; 1) La diversidad microbiana ruminal sería mayor en vacas alimentadas con forraje de alta calidad y 2) el prototipo de bolo mineral alteraría la estructura o función de la comunidad microbiana ruminal.
Materiales y métodos
Todos los protocolos y procedimientos fueron aprobados por el Comité de Cuidado y Uso de Animales Agrícolas de la Universidad Estatal de Montana (#2019-AA12). Todos los animales utilizados en este estudio fueron proporcionados por la Estación Experimental de Agricultura de Montana. Este estudio se realizó en la granja Bozeman Agriculture Research and Teaching en la Universidad Estatal de Montana en Bozeman, MT, EE.
Las muestras utilizadas en este estudio se obtuvieron en un experimento previo (Carlisle et al., 2021). Brevemente, se estableció un estudio de calidad de la dieta y bolo mineral con 16 vacas cruzadas Angus ruminalmente canuladas (edad 2 – 3 años, peso promedio 644 kg). El estudio se realizó como un diseño completamente aleatorizado con una disposición factorial de 2 × 2 de tratamientos. Los tratamientos consistieron en dietas forrajeras de alta o baja calidad y un bolo mineral de liberación sostenida de 90 días o 180 días. El forraje de baja calidad tenía > 600 g/kg de fibra detergente neutra y < base de materia seca de 80 g/kg de proteína cruda, mientras que el forraje de alta calidad tenía < 500 g/kg de fibra detergente neutra y > 150 g/kg de proteína cruda, base de materia seca (Carlisle et al., 2021). El forraje de alta calidad consistía en heno de pasto de alfalfa, mientras que el forraje de baja calidad era heno de pasto de trigo maduro. El tratamiento de baja calidad fue suplementado con proteína suplementada con suplemento de harina de canola que contenía 463 g / kg de proteína cruda (PC) a una tasa diaria de 0,91 kg / hd para cumplir con los requisitos de mantenimiento de vacas de carne maduras, no lactantes, según los requisitos de NRC. La ingesta diaria promedio en el tratamiento de alta calidad fue de 14.24 kg / d (2.5 kg CP / d), mientras que el ganado en el grupo de baja calidad consumió un promedio de 13.86 kg / d (1.4 kg CP / d) (Carlisle et al., 2021). Esto resultó en un promedio de 78% mayor ingesta de PC por parte del ganado en la dieta de mayor calidad. El análisis de nutrientes del heno de alta calidad y baja calidad se muestra en la Tabla 1 y la composición de nutrientes de los bolos minerales de liberación sostenida se muestra en la Tabla 2. El ganado se adaptó a las dietas basales durante 14 días antes de iniciar el período de ingesta y digestión. Esto fue seguido con un período de ingesta y digestión de 15-d para cuantificar los efectos de la calidad del forraje en las características de ingesta, digestión y fermentación ruminal de vacas individuales. El período seleccionado para el muestreo se basó en una evaluación previa de la cinética de la degradación del bolo (Carlisle et al., 2021). Los animales fueron asignados aleatoriamente a corrales individuales de acuerdo con la dieta y el tratamiento en bolo (Carlisle et al., 2021). Las muestras de rumen (100 ml) se recolectaron con un colador de succión antes de la alimentación (0 horas) y 8 horas después de la alimentación para el análisis de la comunidad microbiana. Las muestras recolectadas a las 0 horas representaron una línea de base antes de la alimentación, y se seleccionaron 8 horas después de la alimentación en función de la evaluación del contenido ruminal que mostró que las concentraciones máximas de AGV se alcanzaron en este punto de tiempo (Carlisle et al., 2021). Las muestras se almacenaron a -80 ° C antes de enviarlas para la secuenciación del ADN.
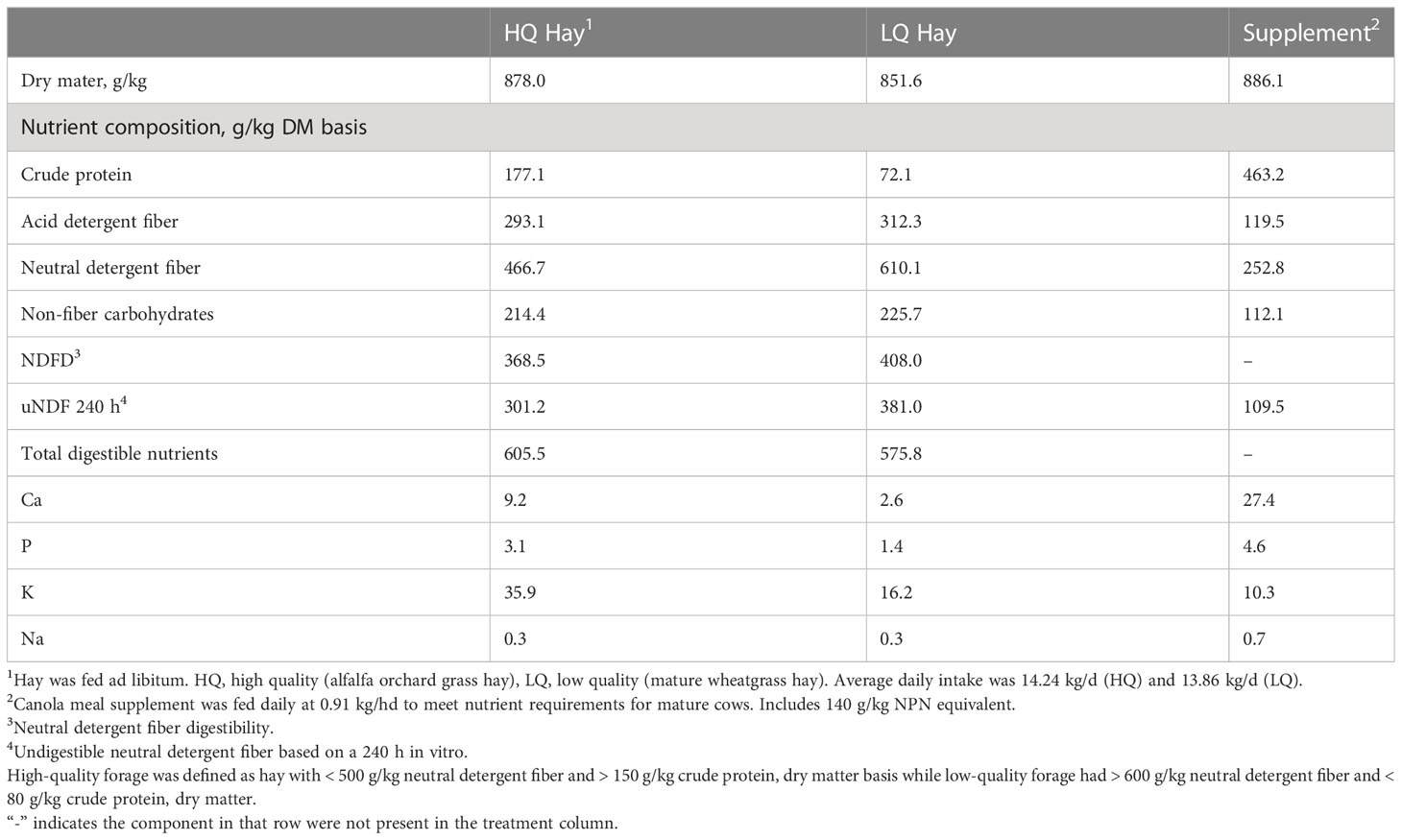 Cuadro 1 Análisis de nutrientes de heno de alta calidad, heno de baja calidad y suplemento ofrecido a vacas de carne canuladas.
Cuadro 1 Análisis de nutrientes de heno de alta calidad, heno de baja calidad y suplemento ofrecido a vacas de carne canuladas.
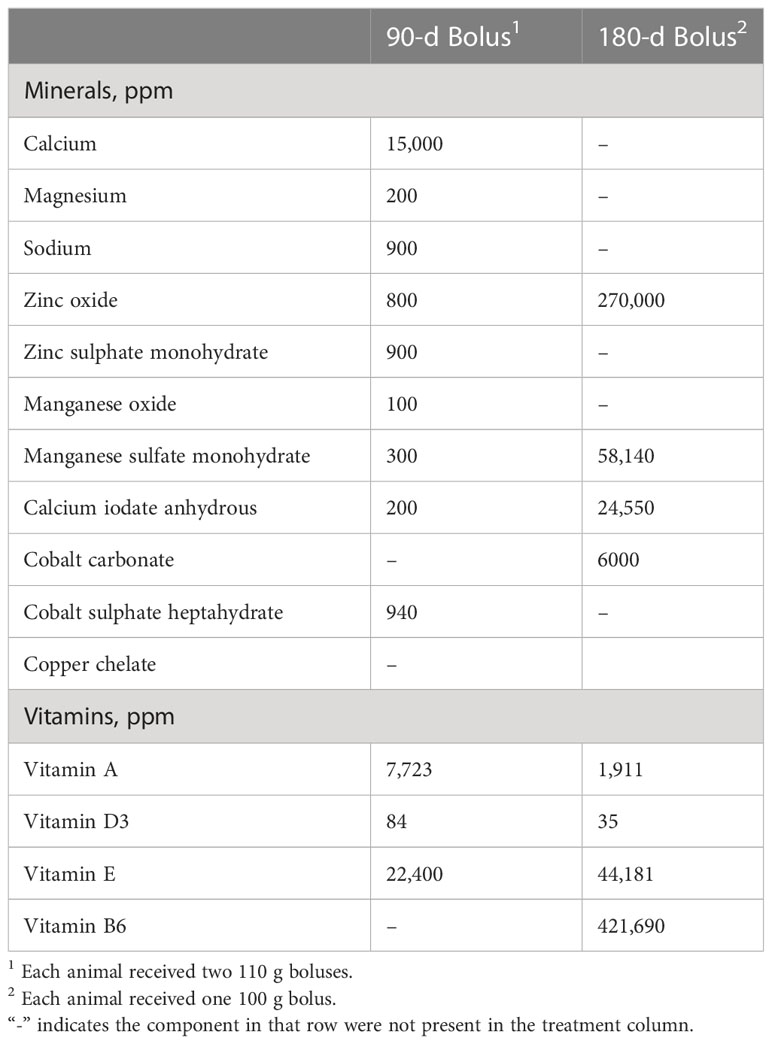 Cuadro 2 Composición de nutrientes y dosis de bolos minerales de liberación sostenida, administrados a vacas de carne cruzadas Angus encanuladas ruminadas. .
Cuadro 2 Composición de nutrientes y dosis de bolos minerales de liberación sostenida, administrados a vacas de carne cruzadas Angus encanuladas ruminadas. .
Secuenciación de comunidades bacterianas
La extracción y secuenciación de ADN fueron realizadas por Zymo Research (Irvine, CA, EUA) en la plataforma Illumina MiSeq (Illumina, San Diego, CA). La región universal V3V4 del gen 16S fue el objetivo de la amplificación bacteriana de un kit de reactivo Illumina v3 (2 x 300 pb). El ZymoBIOMIC Microbial Community DNA Standard (Zymo Research, Irvine, CA) se utilizó como control positivo. Se incluyeron controles negativos para evaluar la contaminación. La biblioteca final fue secuenciada en la plataforma Illumina MiSeq (Illumina, San Diego, CA).®
Bioinformática
El control de calidad y el procesamiento de lecturas de secuencia se realizaron utilizando la tubería de bioinformática QIIME2 (Bolyen et al., 2019). Las secuencias demultiplexadas se recortaron en 5 bases en la posición inicial y se truncaron utilizando un umbral de puntuación Q de 30, lo que resultó en lecturas hacia adelante y hacia atrás truncadas a 280 pb y 250 pb respectivamente. Después del filtrado de calidad y la eliminación de quimeras, las lecturas finales emparejadas se ensamblaron en variantes de secuencia de amplicón corregidas por errores (ASV) utilizando DADA2 (Callahan et al., 2016). La asignación taxonómica se realizó utilizando un clasificador Bayes ingenuo previamente entrenado en la base de datos ponderada Silva 138 con un umbral de identidad del 99% (Quast et al., 2013).
Los archivos generados en QIIME2 se importaron a R 4.1.3 (Team, 2021) utilizando el paquete Qiime2R (Bisanz, 2018) y los análisis estadísticos y la visualización de datos se realizaron utilizando paquetes phyloseq, MicroViz, ggplot2, ggpubr y vegan (McMurdie y Holmes, 2013; Wickham, 2016; Okansen y otros, 2019; Barnett et al., 2021). Los recuentos de ASV se transformaron según lo recomendado para los datos de composición (Gloor et al., 2017) utilizando el paquete R phyloseq (McMurdie y Holmes, 2013). El análisis de diversidad alfa se realizó utilizando el índice de diversidad de Shannon, un indicador de la diversidad de especies.
La varianza de la diversidad beta se visualizó con abundancias transformadas composicionalmente utilizando la matriz de disimilitud de Bray-Curtis y se agrupó utilizando el análisis de coordenadas principales (PCoA) con elipses dibujadas en el intervalo de confianza del 95%. La relación entre la estructura de la comunidad bacteriana ruminal y la calidad del forraje y los factores de contenido ruminal se analizó mediante análisis de redundancia (RDA) con gráficos generados en MicroViz (Barnett et al., 2021). Después de la eliminación de variables redundantes, se seleccionaron 11 factores forrajeros y ruminales para RDA.
Las pruebas de abundancia diferencial a través de la calidad del forraje y el tiempo antes y 8 horas después de la alimentación se realizaron con el paquete de metacodificador R (Foster et al., 2017) utilizando la prueba de suma de rangos de Wilcoxon y FDR corregido para comparaciones múltiples. Las comparaciones de árboles de calor incorporan árboles filogenéticos que proporcionan una comparación más informativa de la estructura de la comunidad que los diagramas de barras solos (Foster et al., 2017). La razón Log2 de proporciones medianas de taxones se trazó a nivel de familia y los nombres de los taxones se mostraron solo para taxones que eran significativamente diferentes entre los tratamientos (p<0.05, FDR corregido).
Perfilado funcional predictivo
Para evaluar los cambios funcionales inducidos por el tratamiento en el rumen, se predijeron funciones potenciales en comunidades bacterianas utilizando Anotación funcional de taxones procariotas (FAPROTAX) (Louca et al., 2016a; Louca et al., 2016b) tal como se implementa en el paquete Microeco R (Liu et al., 2021). Se generó un mapa de calor de correlación para mostrar la correlación de Spearman entre las funciones más abundantes y la calidad del forraje, el tipo de bolo mineral y el tiempo de muestreo. Se utilizó un enfoque de tamaño del efecto de análisis discriminante lineal (LDA) (LEfSe) para identificar vías funcionales que eran discriminatorias entre tratamientos (Segata et al., 2011). La LDA se realizó utilizando el paquete microeco R (Liu et al., 2021). Sólo se graficaron las funciones con una puntuación LDA superior a 3 y diferencias significativas (p<0,05, FDR corregido) entre los tratamientos.
Análisis estadístico
Se utilizó regresión lineal con modelos de efectos mixtos para explorar las relaciones entre la diversidad alfa y los tratamientos. La calidad del forraje, el tipo de bolo mineral, el tiempo y las interacciones entre ellos se incluyeron como efectos fijos con la replicación como un efecto aleatorio en el modelo de efectos mixtos. La comparación post-hoc de Tukey se utilizó para evaluar las diferencias en las medias entre los tratamientos. Los análisis de regresión se realizaron utilizando el paquete lme4 R (Bates et al., 2015). La función betadisper en el paquete vegano se utilizó para evaluar el supuesto de dispersión homogénea para realizar un análisis permutacional de varianza (PERMANOVA). PERMANOVA se realizó utilizando distancias UniFrac ponderadas en QIIME2 para probar las diferencias de comunidad entre la calidad del alimento, el tipo de bolo mineral y el tiempo de muestreo. Este enfoque utiliza estadísticas de prueba pseudo-F, para proporcionar valores de probabilidad pseudo-F (valores p) y valores q para corregir pruebas de hipótesis múltiples, basadas en la tasa de descubrimiento falso (FDR) (Storey, 2003).
Resultados
Composición de la comunidad bacteriana
Después del filtrado de calidad, la eliminación de bimeras y la construcción de la tabla de características con DADA2 (Callahan et al., 2016), se retuvieron un total de 405,185 variantes de secuencia de amplicón bacteriano (ASV) con una frecuencia media de 12,662 por muestra para su posterior análisis. La diversidad alfa disminuyó significativamente (p < 0,01) desde la prealimentación hasta las 8 horas posteriores a la alimentación (Figura 1). La diversidad alfa medida por el índice de diversidad de Shannon promedió 5.6 antes de la alimentación y 5.4 después de la alimentación y no fue significativamente diferente entre los forrajes de alta y baja calidad y tampoco fue significativamente diferente entre los tipos de bolo mineral (p>0.05). El análisis de la diversidad beta mostró que Bacteroidota y Firmicutes fueron los filos predominantes en todos los tratamientos y representaron alrededor del 80% de la abundancia relativa de la comunidad ruminal (Figura S1). El análisis PERMANOVA de la comunidad bacteriana β-diversidad mostró diferencias significativas en respuesta a la calidad del forraje y el tiempo de muestreo, pero no en respuesta al tipo de bolo mineral (Tabla 3). Las interacciones calidad del forraje x tiempo de muestreo, corregidas para comparaciones múltiples, también fueron significativas (p = 0,027), mientras que las interacciones calidad del forraje x tipo de bolo mineral solo fueron significativas (p<0,05) cuando se consideraron las diferencias en la calidad del forraje. Las interacciones calidad del forraje x tiempo x bolo no fueron significativas (p=0,918) y, por lo tanto, no se incluyeron en la Tabla 3.
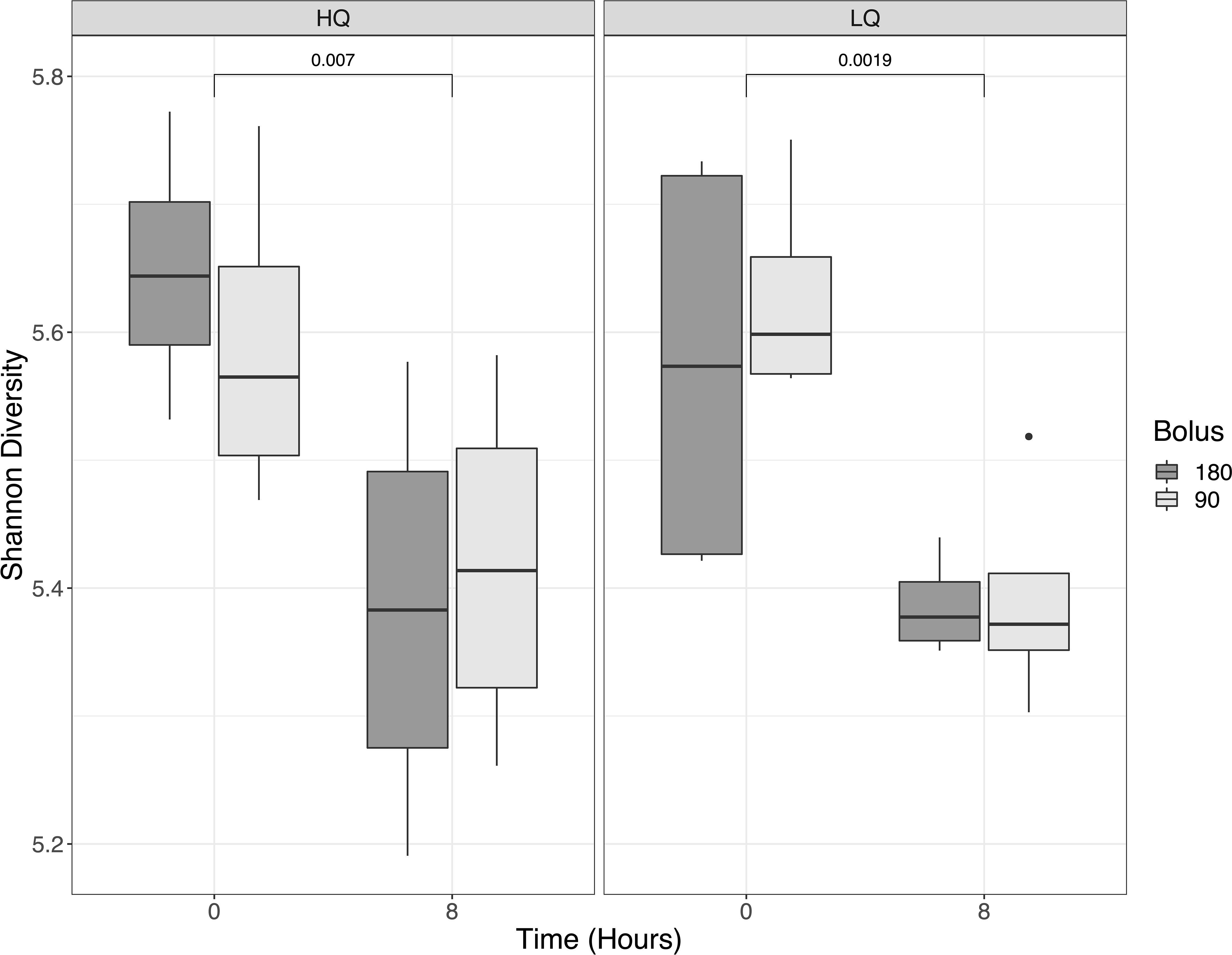 Figura 1 Diversidad alfa ruminal, medida por el índice de diversidad de Shannon, comparación de forrajes de baja y alta calidad y tipo de bolo (90 días vs 180 días). Las muestras se recogieron antes de la alimentación (0 horas) y 8 horas después de la alimentación. Las diferencias en la diversidad de Shannon fueron significativas antes y después de la alimentación, pero no entre la calidad del alimento o el tipo de bolo.
Figura 1 Diversidad alfa ruminal, medida por el índice de diversidad de Shannon, comparación de forrajes de baja y alta calidad y tipo de bolo (90 días vs 180 días). Las muestras se recogieron antes de la alimentación (0 horas) y 8 horas después de la alimentación. Las diferencias en la diversidad de Shannon fueron significativas antes y después de la alimentación, pero no entre la calidad del alimento o el tipo de bolo.
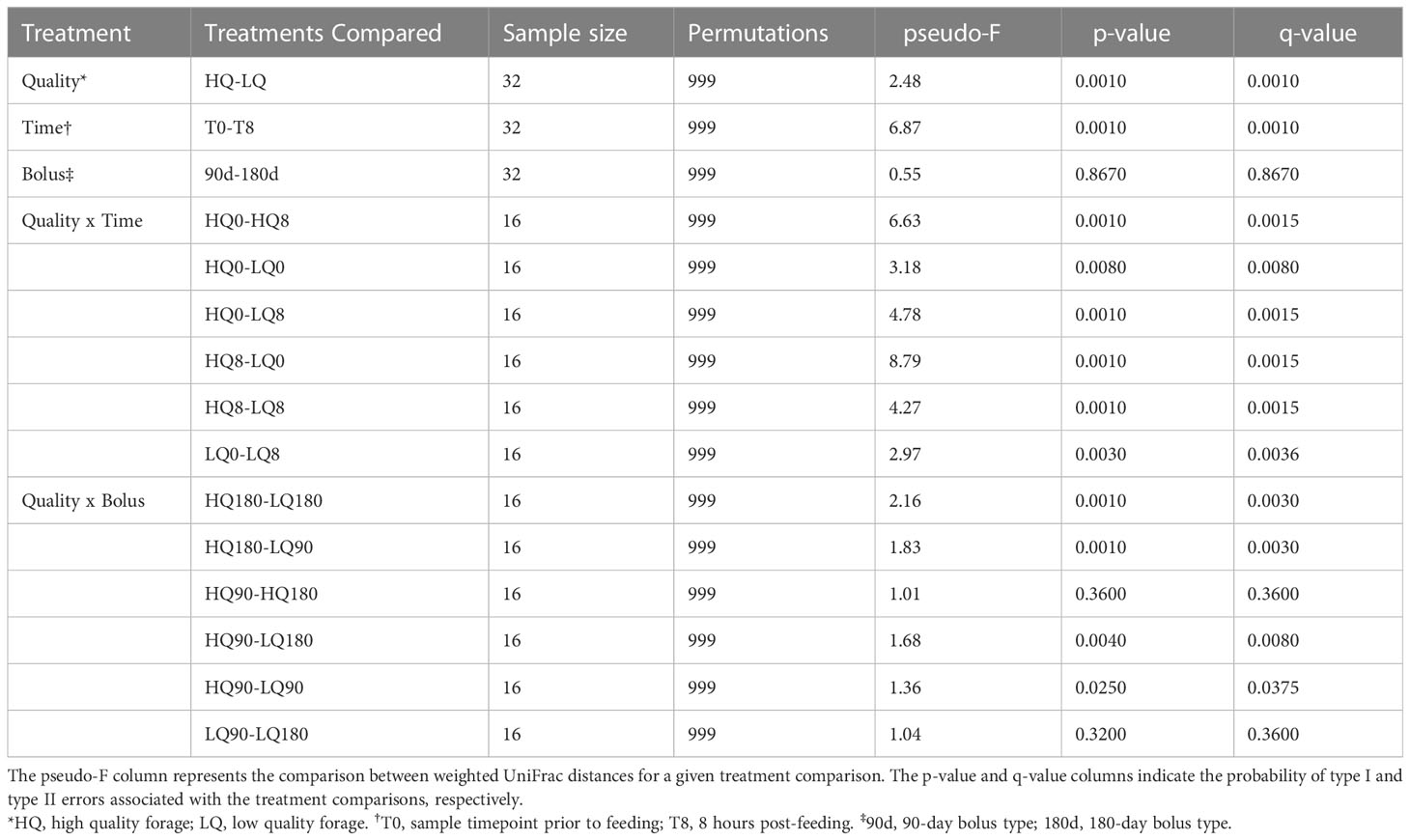 Cuadro 3 Estructura de la comunidad (β-diversidad) basada en el cálculo de permanova por pares de distancias UniFrac ponderadas.
Cuadro 3 Estructura de la comunidad (β-diversidad) basada en el cálculo de permanova por pares de distancias UniFrac ponderadas.
El análisis de coordenadas principales (PCoA) basado en la matriz de disimilitud de Bray-Curtis reveló que el 45% de la variación entre las comunidades bacterianas se explicaba por los dos primeros componentes principales. Se observaron diferencias claras entre las comunidades basadas tanto en la calidad del alimento como en el tiempo antes y después de la alimentación (Figura 2). El análisis de redundancia reveló que la estructura de la comunidad bacteriana estaba asociada con materia seca forrajera, ácidos grasos volátiles (AGV) del rumen y pH y NH del rumen3-N (Figura 3). Los AGV totales, el ácido propiónico, el ácido butírico y el ácido isovalérico se correlacionaron significativamente (p<0,05, FDR corregido) con la estructura de la comunidad. La abundancia relativa de Prevotella se correlacionó positivamente (p<0.05, FDR corregido) con una dieta forrajera de alta calidad 8 horas después de la alimentación, mientras que Ruminococcus, Rickenellaceae_RC9_gut_group y varios géneros mal definidos se asociaron fuertemente con la dieta forrajera de baja calidad (p<0.05, FDR corregido) (Figura 3).
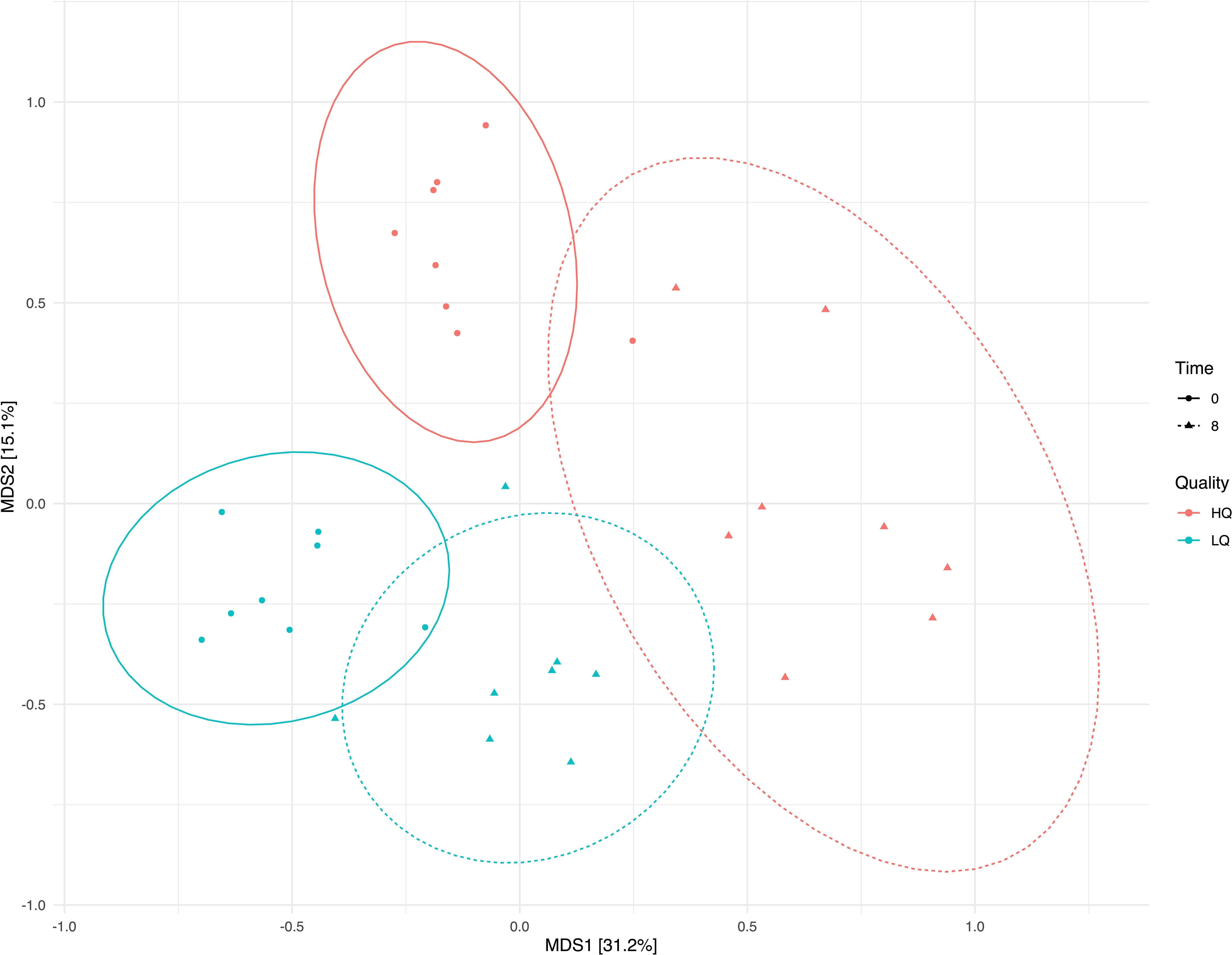 Figura 2 Análisis de coordenadas principales (PCoA) de la matriz de disimilitud de Bray-Curtis que muestra la agrupación de muestras por calidad y tiempo de alimentación. El color indica la calidad del alimento y la forma indica el tiempo de muestreo; prealimentación (0) y 8 horas después de la alimentación (8). Las elipses muestran intervalos de confianza del 95%.
Figura 2 Análisis de coordenadas principales (PCoA) de la matriz de disimilitud de Bray-Curtis que muestra la agrupación de muestras por calidad y tiempo de alimentación. El color indica la calidad del alimento y la forma indica el tiempo de muestreo; prealimentación (0) y 8 horas después de la alimentación (8). Las elipses muestran intervalos de confianza del 95%.
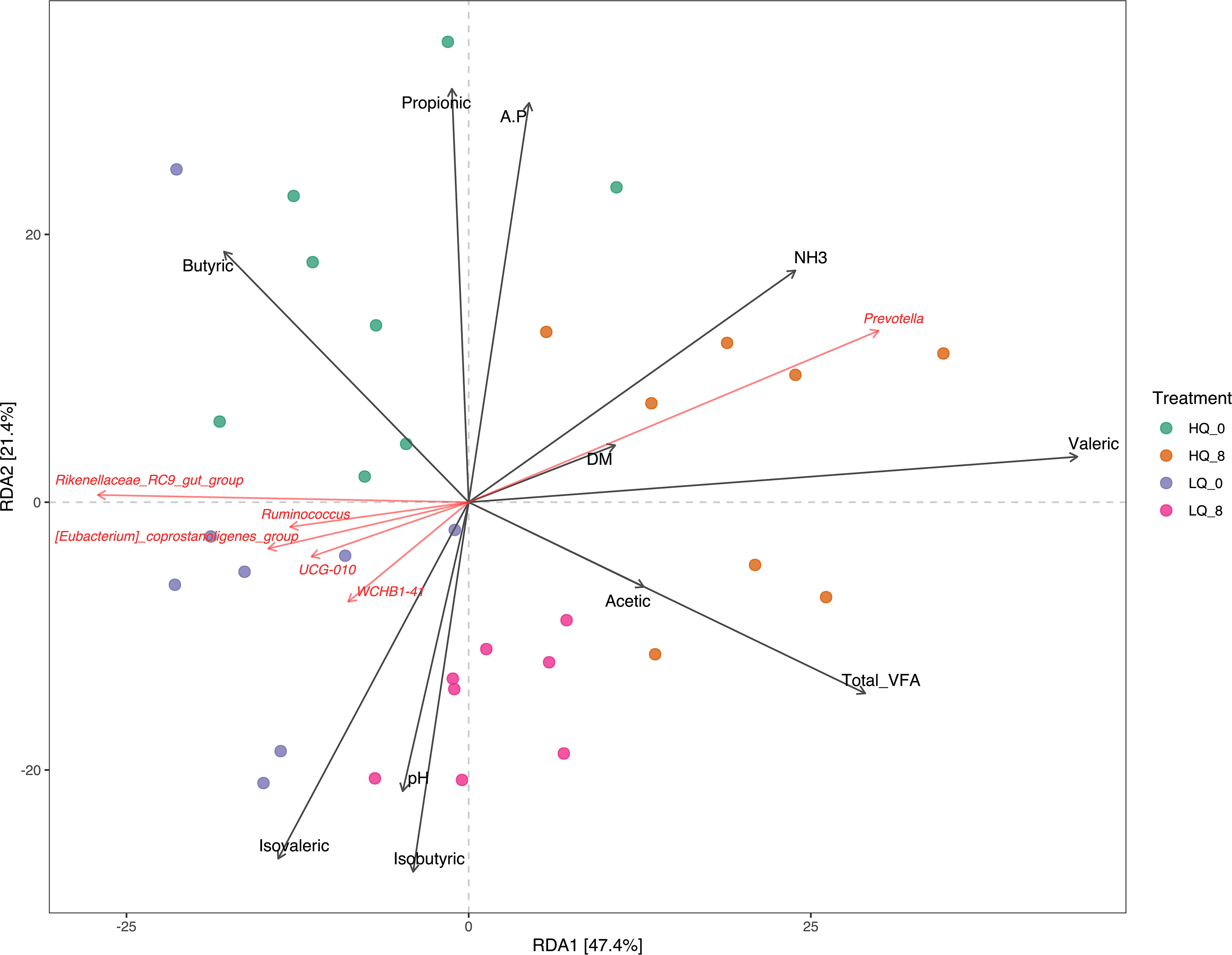 Figura 3 Análisis de redundancia (RDA) que muestra las relaciones entre taxones ruminales y AGV, materia seca forrajera, NH3, y pH. A.P: relación acetato:propionato; DM: materia seca forrajera. Los taxones se muestran a nivel de género.
Figura 3 Análisis de redundancia (RDA) que muestra las relaciones entre taxones ruminales y AGV, materia seca forrajera, NH3, y pH. A.P: relación acetato:propionato; DM: materia seca forrajera. Los taxones se muestran a nivel de género.
Se utilizó el análisis de abundancia diferencial a nivel familiar para identificar taxones con diferencias significativas en la abundancia relativa entre tratamientos (p<0.05, FDR corregido). El análisis mostró una abundancia relativa significativamente mayor (p<0.05, FDR corregida) de Desulfovibrionaceae 8 horas después de la alimentación en comparación con la prealimentación (Figura 4). En general, los miembros del filo Actinobacteria fueron más abundantes antes de la alimentación que 8 horas después de la alimentación. Las familias Defluviitaleaceae, Saccharimonadaceae y Selenomonadaceae fueron significativamente (p<0.05, FDR corregido) más abundantes en la dieta forrajera de alta calidad en comparación con la baja calidad, 8 horas después de la alimentación, mientras que Anaerovoracaceae y Streptococcaceae fueron significativamente más bajas (p<0.05, FDR corregido). El filo Desulfobacterota también fue más abundante (p<0.05, FDR corregido) en la dieta forrajera de alta calidad en comparación con la baja calidad, 8 horas después de la alimentación.
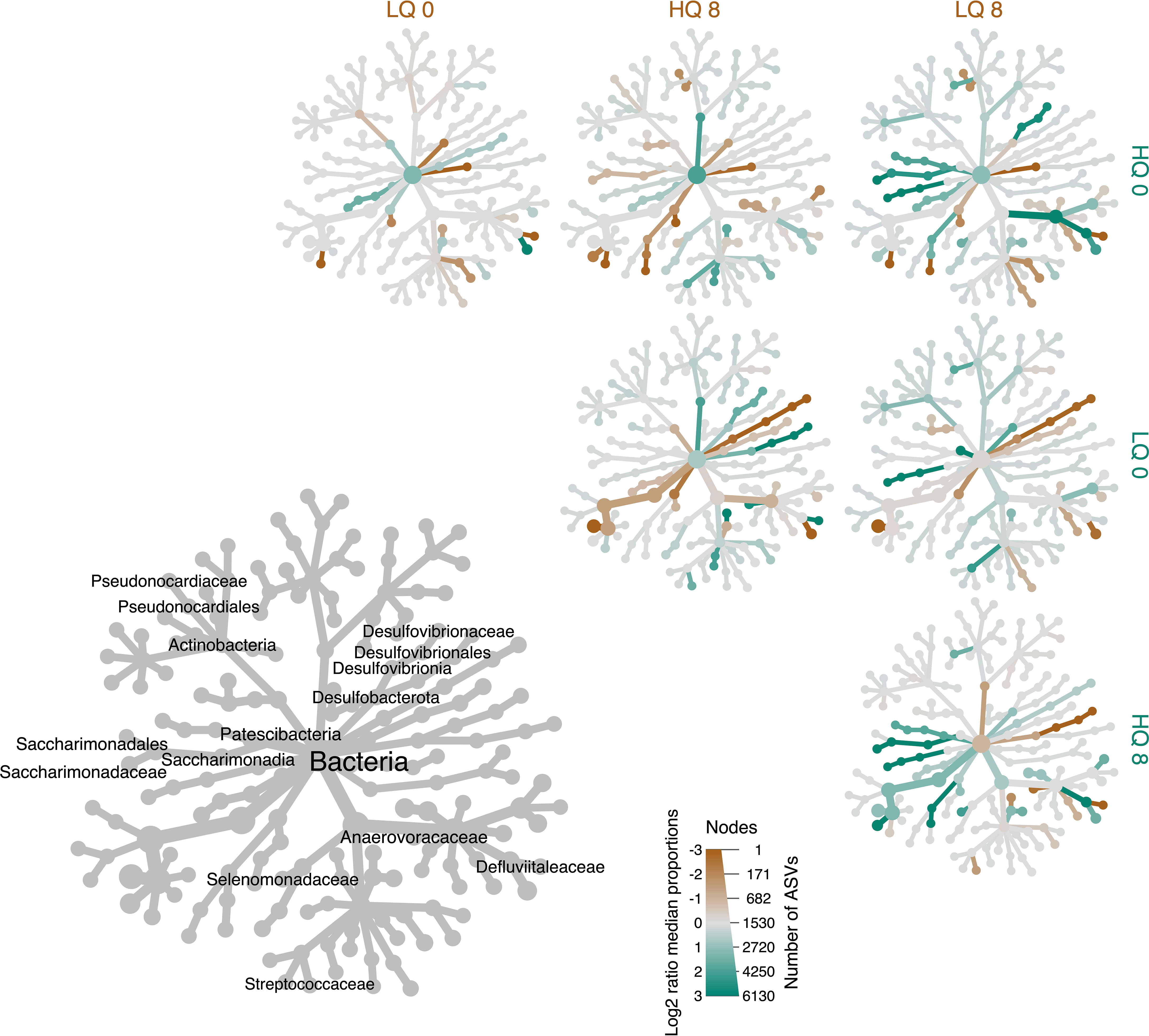 Figura 4 Árbol de calor que muestra la abundancia diferencial de taxones a nivel familiar entre dietas y tiempo de alta calidad (HQ) y baja calidad (LQ); prealimentación (0) y 8 horas después de la alimentación (8). El diámetro de los nodos indica el número de ASV, mientras que el color representa la relación Log2 de proporciones medianas. El árbol gris en la parte inferior izquierda es una referencia taxonómica para los árboles más pequeños sin etiquetar que comparan la calidad del forraje y el tiempo. Los nombres de los taxones se muestran solo para los taxones que fueron significativamente diferentes entre los tratamientos (p<0.05, FDR corregido).
Figura 4 Árbol de calor que muestra la abundancia diferencial de taxones a nivel familiar entre dietas y tiempo de alta calidad (HQ) y baja calidad (LQ); prealimentación (0) y 8 horas después de la alimentación (8). El diámetro de los nodos indica el número de ASV, mientras que el color representa la relación Log2 de proporciones medianas. El árbol gris en la parte inferior izquierda es una referencia taxonómica para los árboles más pequeños sin etiquetar que comparan la calidad del forraje y el tiempo. Los nombres de los taxones se muestran solo para los taxones que fueron significativamente diferentes entre los tratamientos (p<0.05, FDR corregido).
El análisis discriminante lineal identificó 31 géneros con una puntuación LDA > 3 que fueron significativamente (p < 0,05, FDR corregido) discriminatorios entre los tratamientos (Figura 5). Dieciocho taxones fueron discriminatorios para el tratamiento de forraje de baja calidad, mientras que 13 taxones fueron discriminatorios para el tratamiento de forraje de alta calidad. Los taxones pertenecientes al filo Firmicutes representaron el 50% de los taxones discriminatorios para los tratamientos forrajeros de baja y alta calidad (Figura 5A). Dentro de este filo, todos menos un taxón pertenecían a la clase Clostridia en el tratamiento de forraje de alta calidad. Otros taxones que fueron discriminatorios para el tratamiento forrajero de alta calidad incluyeron miembros de los filos Actinobacteria, Elusimicrobiota, Proteobacteria y Mycoplasmatota. Methanosphaera, un género metanogénico del filo de arqueas Euryarchaeota, también fue discriminatorio por el tratamiento forrajero de alta calidad. Los taxones que fueron discriminatorios para el tratamiento de forraje de baja calidad incluyeron miembros de los filos Actinobacteria, Bacteroidota, Lentisphaerae y Spirochaetota. La familia Methanobacteriaceae del filo de arqueas Euryarchaeota, también fue discriminatoria por el tratamiento forrajero de baja calidad.
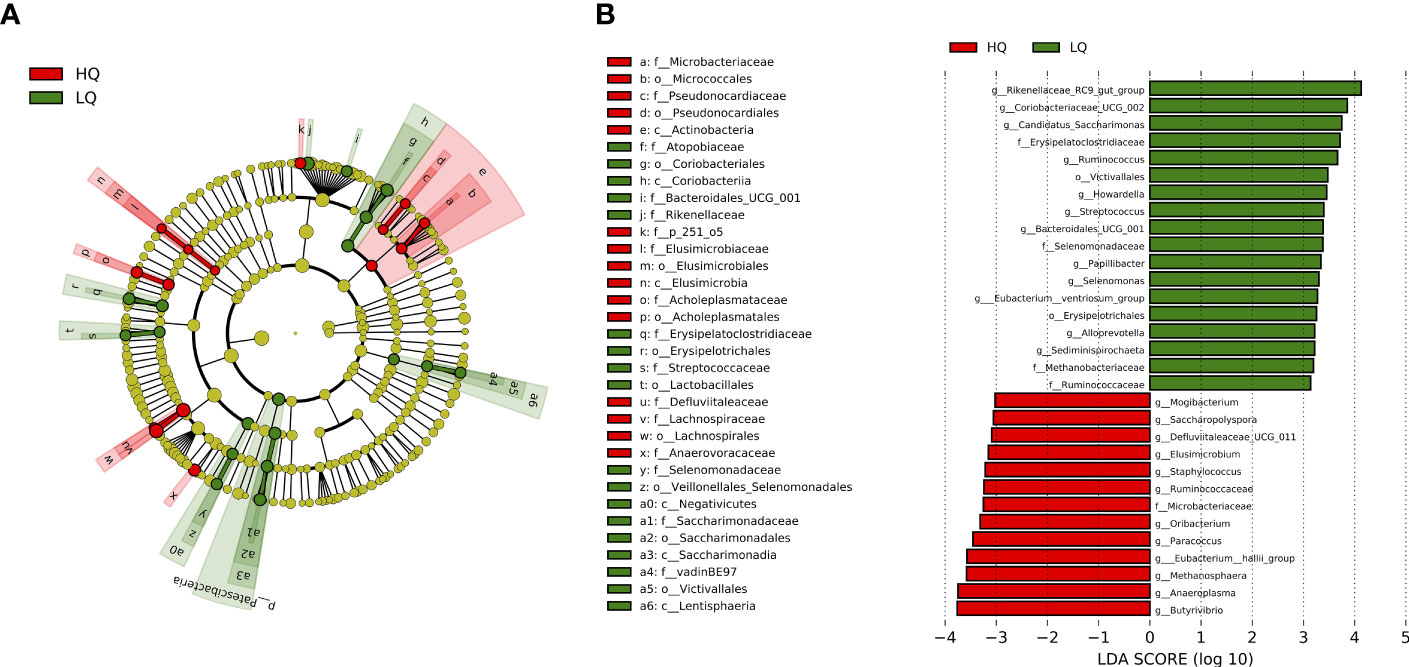 Figura 5 Visualización de filos únicos en cada tratamiento identificados mediante un análisis lineal discriminante del tamaño del efecto (LEfSe). (A) clateograma de taxones diferencialmente abundantes significativos (p <0.01). (B) Histograma de las puntuaciones LDA calculadas para géneros diferencialmente abundantes entre los tratamientos clasificados por tamaño del efecto. Solo se mostraron taxones que cumplían con una puntuación LDA de >3,0. Las variantes de secuencia que no se identificaron a nivel de género se muestran a nivel de familia u orden.
Figura 5 Visualización de filos únicos en cada tratamiento identificados mediante un análisis lineal discriminante del tamaño del efecto (LEfSe). (A) clateograma de taxones diferencialmente abundantes significativos (p <0.01). (B) Histograma de las puntuaciones LDA calculadas para géneros diferencialmente abundantes entre los tratamientos clasificados por tamaño del efecto. Solo se mostraron taxones que cumplían con una puntuación LDA de >3,0. Las variantes de secuencia que no se identificaron a nivel de género se muestran a nivel de familia u orden.
Perfilado funcional predictivo
El análisis de correlación mostró una correlación de Spearman negativa significativa (p<0,05) entre la calidad del forraje y las vías funcionales predichas asociadas con la metanogénesis (R = -0,5) y una correlación positiva con las funciones asociadas con la quimioheterotrofia anaeróbica (R = 0,6) y la fermentación (R = 0,5) (Figura 6). El tipo de bolo mineral no se correlacionó significativamente con ninguna función. El tiempo de muestreo se correlacionó negativamente con la metilotrofia (R = -0,5) y se correlacionó positivamente con la acetogénesis reductora (R = 0,6). El análisis discriminante lineal (LDA) identificó 9 vías funcionales predichas que eran significativamente discriminatorias (p < 0,05, FDR corregido) entre los tratamientos (Figura 7). Las vías metabólicas asociadas con la quimioheterotrofia aeróbica, la metanogénesis, la reducción de nitratos y la ureólisis fueron discriminatorias para las dietas de alta calidad. Las vías asociadas con la quimioheterotrofia, la quimioheterotrofia anaeróbica y la fermentación fueron discriminatorias para las dietas de baja calidad.
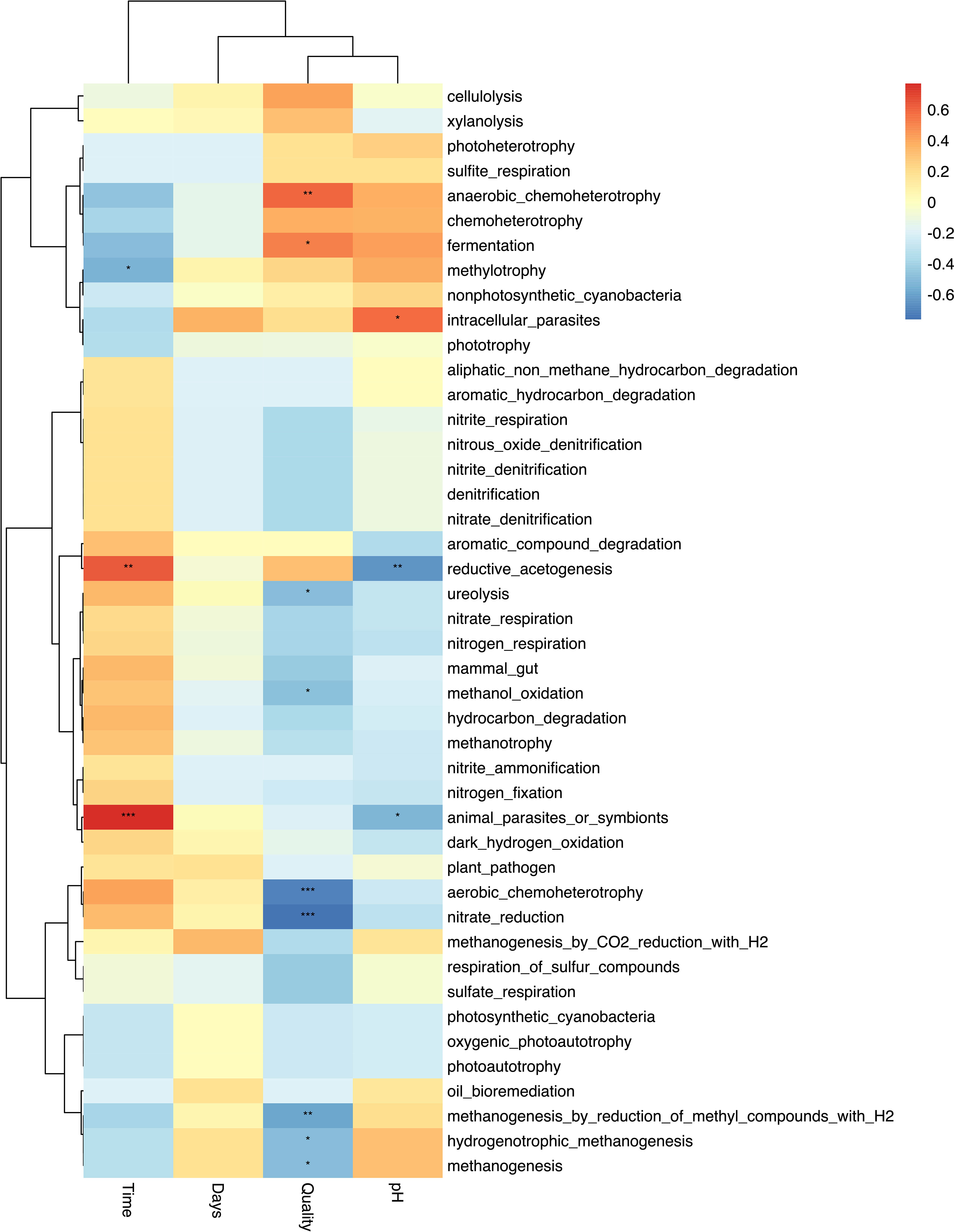 Figura 6 Mapa de calor de correlación de las funciones predichas correlacionadas con la calidad de la dieta (calidad), el tiempo de muestreo (tiempo), el tipo de bolo (días) y el pH. * indica que las diferencias fueron significativas a la p<0,05; ** indica que las diferencias fueron significativas en p<0,01; indica que las diferencias fueron significativas en p<0,001.
Figura 6 Mapa de calor de correlación de las funciones predichas correlacionadas con la calidad de la dieta (calidad), el tiempo de muestreo (tiempo), el tipo de bolo (días) y el pH. * indica que las diferencias fueron significativas a la p<0,05; ** indica que las diferencias fueron significativas en p<0,01; indica que las diferencias fueron significativas en p<0,001.
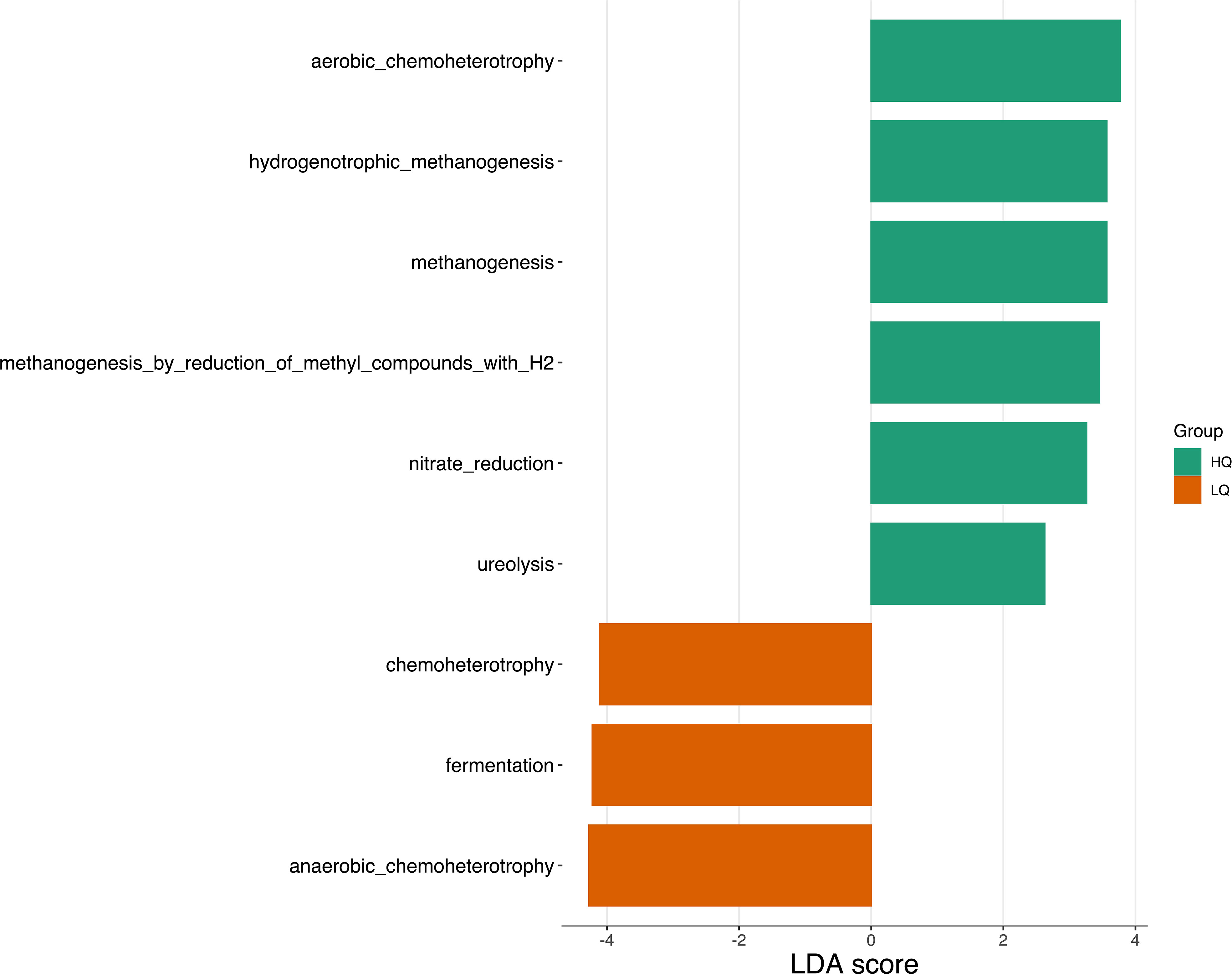 Figure 7 LEfSe analysis of metabolic pathways between high quality (HQ) and low quality (LQ) diets and time; pre-feeding (0) and 8 hours post-feeding (8). Only features with significant (p<0.01, FDR adjusted) differences between treatments and an LDA score > 2.5 are shown.
Figure 7 LEfSe analysis of metabolic pathways between high quality (HQ) and low quality (LQ) diets and time; pre-feeding (0) and 8 hours post-feeding (8). Only features with significant (p<0.01, FDR adjusted) differences between treatments and an LDA score > 2.5 are shown.
RDA revealed that the predicted microbial functions were influenced by forage dry matter, rumen volatile fatty acids (VFAs), and rumen pH and NH3-N (Figure 8). After removal of the redundant variables, 11 forage and rumen factors were selected for RDA. Of these factors, Total VFAs, propionic acid, butyric acid, and isovaleric acid were significantly (p<0.05, FDR corrected) correlated to predicted bacterial functions. Functions associated with chemoheterotrophy, anaerobic chemoheterotrophy, and fermentation were highly correlated with butyric acid within the low-quality forage diet treatments. Functions associated with animal parasites or symbionts were also correlated with total VFAs in the high-quality forage diet 8 hours post-feeding.
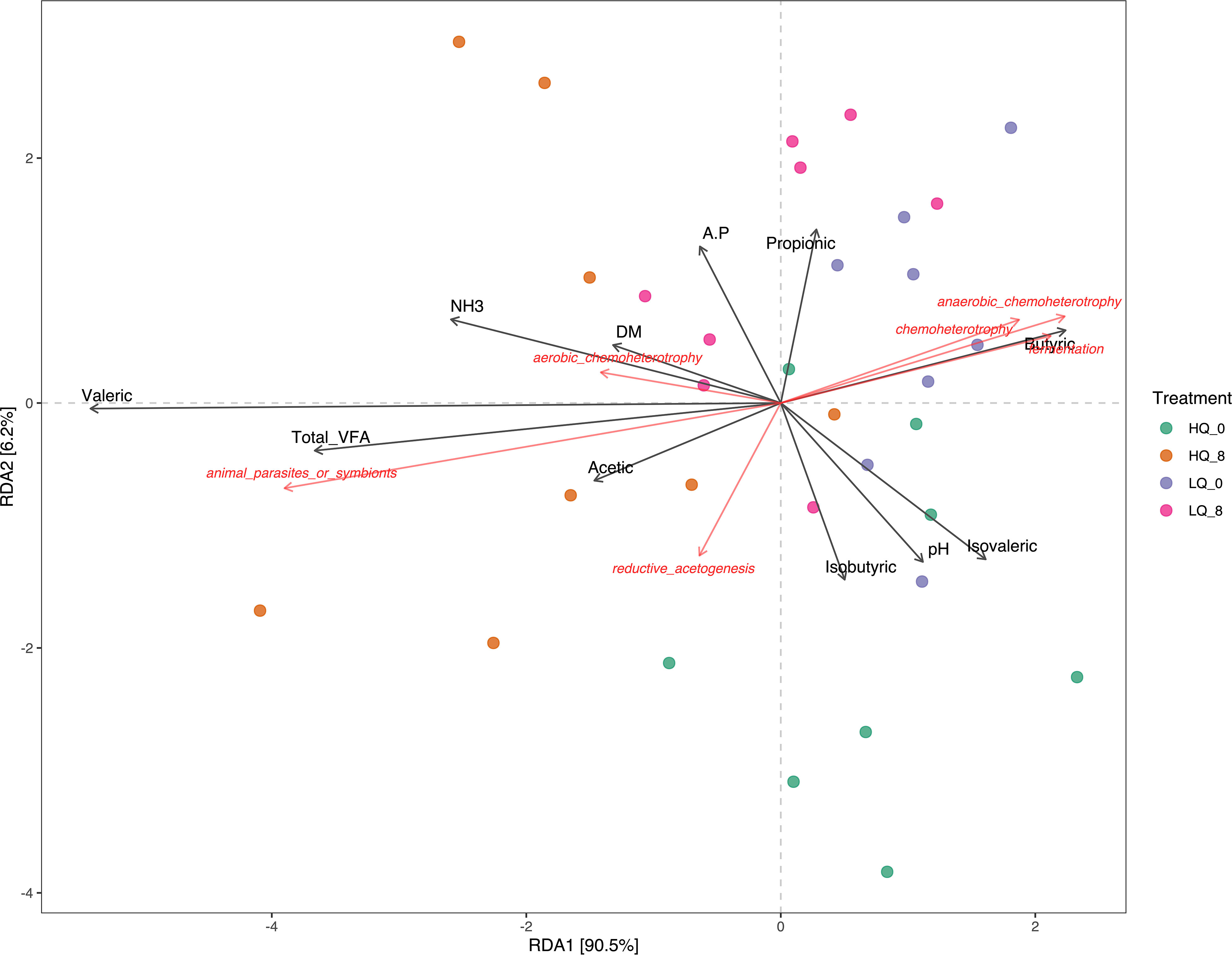 Figure 8 Redundancy analysis (RDA) showing the relationships between predicted rumen functions and VFAs, forage dry matter, NH3, and pH. A.P, acetate:propionate ratio; DM, forage dry matter.
Figure 8 Redundancy analysis (RDA) showing the relationships between predicted rumen functions and VFAs, forage dry matter, NH3, and pH. A.P, acetate:propionate ratio; DM, forage dry matter.
Discussion
En este estudio investigamos los efectos de las dietas que consisten en heno de pasto de alfalfa o heno de pasto de trigo maduro junto con suplementos de bolo mineral de liberación sostenida en el microbioma ruminal en ganado de carne. Anteriormente encontramos que la calidad del forraje afectaba las tasas de degradación de los bolos minerales de liberación sostenida (Carlisle et al., 2021). Aunque se observaron diferencias, la digestibilidad neutra de la fibra detergente (NDFD) para el heno de mezcla de alfalfa fue menor que la NDFD del heno de pasto de trigo y los niveles de carbohidratos sin fibra fueron similares, lo que sugiere que el contenido de hemicelulosa fue mayor en la dieta de baja calidad. Las diferencias en la respuesta ruminal pueden relacionarse con la baja digestibilidad de los tallos en las leguminosas en comparación con los tallos en las gramíneas (Soest, 1994) y la ingesta y la digestión total del tracto para ambas dietas pueden haber estado limitadas por la tasa de digestión de fibra y las limitaciones de llenado ruminal (Galyean y Defoor, 2003). A pesar del NDFD más bajo, los ácidos grasos volátiles ruminales y el amoníaco difirieron entre las dos dietas, lo que sugiere diferentes ambientes ruminales que se hipotetizó que estaban relacionados con el microbioma ruminal (Carlisle et al., 2021). Los resultados de este trabajo mostraron que la estructura y función de la comunidad bacteriana ruminal fue alterada significativamente por la calidad del forraje, pero no se vieron afectadas por el tipo de bolo mineral de liberación sostenida. Rumen VFA y NH3Las concentraciones de N son marcadores importantes de la función ruminal (Wei et al., 2019). El análisis de redundancia mostró que los AGV totales se asociaron con forraje de alta calidad 8 horas después de la alimentación, lo que sugiere que el forraje de alta calidad contribuyó a una mayor tasa de fermentación en el rumen (Wei et al., 2019). Los AGV son una fuente de energía importante que contribuye al rendimiento de producción de los rumiantes (Wang et al., 2020), por lo tanto, es importante comprender cómo la calidad del forraje y los suplementos afectan a los microorganismos asociados con la producción de AGV.
El tipo de bolo mineral no se asoció con cambios en la composición de la comunidad bacteriana ni con ningún parámetro ruminal. Nuestros resultados son consistentes con estudios que han demostrado que la suplementación mineral no alteró significativamente la abundancia bacteriana en novillos lecheros (Son et al., 2023) y yak (Bos grunniens) (Zhao et al., 2022). En contraste, otros estudios han demostrado una respuesta a minerales específicos. El cobre (Cu), el manganeso (Mn) y el zinc (Zn) se han relacionado con una mayor actividad enzimática microbiana (Vigh et al., 2023). La adición de (Cu) a las dietas de las vacas lecheras se asoció con un aumento de las poblaciones de los géneros Rumminococcus y Fibrobacter (Wang et al., 2021). Otro estudio no informó cambios en la abundancia bacteriana en respuesta a la suplementación con Cu de 0 a 60 mg / kg de DM, pero redujo la abundancia a concentraciones más altas (Hernández-Sánchez et al., 2019). Otros estudios han demostrado que los suplementos de selenio (Se) conducen a una reducción en el total de bacterias en vacas lecheras y una mayor abundancia de los géneros Rumminococcus, Fibrobacter y Butyrivibrio en toros lecheros (Du et al., 2019; Liu et al., 2019; Zhang et al., 2020). Nuestros resultados no mostraron diferencias en la composición de la comunidad bacteriana entre los bolos minerales y, por lo tanto, no es probable que afecten la función ruminal o compensen el forraje de baja calidad.
Las comunidades bacterianas ruminales fueron predominadas por miembros de los filos Bacteriodota y Fermicutes, lo que es consistente con otros estudios (Myer et al., 2015; Liu et al., 2016; Gharechahi y otros, 2021; Zhou et al., 2021). El género Prevotella, un miembro del filo Bacteriodota, se asoció fuertemente con la dieta forrajera de alta calidad 8 horas después de la alimentación (Figura 3). Se han observado resultados similares en ganado lechero donde el heno de alfalfa aumentó la abundancia de Prevotella y Selenomonas en comparación con las vacas alimentadas con tallos de maíz (Zhang et al., 2014). Prevotella es uno de los géneros ruminales más abundantes y es crucial para la degradación y utilización de polisacáridos y proteínas (Bohra et al., 2019). El forraje de alta calidad tenía un mayor contenido de proteínas que puede haber contribuido a la mayor abundancia de Prevotella. Esto contrasta con otros estudios que han encontrado que Prevotella es el género dominante independientemente de la dieta (Myer et al., 2015; Cristóbal-Carballo et al., 2021). Estos estudios previos no consideraron los cambios temporales en la abundancia de Prevotella con mediciones recolectadas antes de la alimentación (Cristóbal-Carballo et al., 2021) o al final del experimento de alimentación (Myer et al., 2015), lo que puede explicar por qué no se observó un efecto asociado a la dieta. Trabajos anteriores han demostrado que las poblaciones de Prevotella alcanzan su punto máximo en la superficie de la fibra dentro de las seis horas posteriores a la entrada del material en el rumen (Liu et al., 2016). Nuestros resultados son consistentes con este hallazgo y sugieren que la calidad del forraje puede tener un efecto significativo pero transitorio sobre la abundancia de Prevotella.
Múltiples funciones predichas se correlacionaron con factores ruminales (Figura 8). Una limitación de este estudio es que las predicciones funcionales se limitaron a la resolución a nivel de género de los datos de secuenciación. La función microbiana puede variar incluso a nivel de especie o cepa y el perfil funcional predictivo no puede resolver las variaciones del nivel de cepa o identificar funciones si las anotaciones de la vía son deficientes (Langille et al., 2013). Las funciones predichas asociadas con la metanogénesis se correlacionaron negativamente con la calidad del forraje. Esto es consistente con hallazgos previos que reportaron un mayor metano asociado con alimentos de baja calidad (Johnson y Johnson, 1995).
La nutrición de precisión y/o la optimización de la función ruminal dependen de un mayor conocimiento de la respuesta del microbioma ruminal a la composición de nutrientes de la dieta. Aunque investigaciones anteriores han demostrado que la metanogénesis se correlaciona negativamente con la calidad de la dieta (Johnson y Johnson, 1995; Chagunda et al., 2010), la mayor parte de la investigación hasta la fecha se limita a comparaciones de dietas concentradas y basadas en forraje. Del mismo modo, el presente estudio encontró que la metanogénesis se correlaciona negativamente con la calidad del forraje. Además, en este estudio, el microbioma ruminal reflejó el entorno nutricional donde la ingesta de proteína cruda fue un 78% mayor en la dieta de alta calidad y Prevotella se asoció fuertemente con la dieta de heno de pasto de alfalfa más alta en proteínas, y Ruminococcus se asoció fuertemente con el heno de pasto de trigo maduro más bajo en proteínas y alto contenido de fibra. Estos resultados son consistentes con la literatura ya que numerosas cepas de Prevotella están asociadas con la digestión de proteínas y polisacáridos, mientras que los miembros del género Ruminococcus están asociados con la degradación de la celulosa y la hemicelulosa (Griswold et al., 1999; Zhang et al., 2014; Wei et al., 2021). Sin embargo, dado que solo se obtuvo la identificación taxonómica a nivel de género en nuestro estudio, estas funciones no pueden correlacionarse definitivamente con la presencia de estos géneros. La adición de proteínas suplementarias a las dietas altas en fibra deficientes en proteínas probablemente mejora la microbiota de digestión de la fibra en el rumen, como Ruminococcus (DelCurto et al., 2000) lo que sugiere la necesidad de proporcionar proteínas suplementarias al ganado que pasta vegetación senesced latente o que consume dietas deficientes en proteínas altas en fibra (paja o heno maduro). No hubo respuesta de la comunidad bacteriana a los bolos de minerales traza, lo que sugiere que los minerales traza no eran limitantes en los ambientes reticulares del rumen tanto para la hierba de alfalfa como para las dietas maduras a base de heno de pasto de trigo.
La suplementación de las dietas para vacas de carne con diferentes tipos de bolo mineral de liberación sostenida no dio lugar a ningún cambio en la composición del microbioma ruminal o la función prevista. En contraste, la calidad del forraje alteró la composición de la comunidad bacteriana ruminal y la función prevista. Estos hallazgos sugieren que los administradores de ganado que usan minerales suplementarios para aumentar el rendimiento del ganado de carne en los sistemas de pastizales pueden hacerlo con un impacto mínimo en la comunidad bacteriana ruminal. Sin embargo, estos suplementos minerales no pueden sustituir la baja calidad del forraje, que afecta la composición y función del microbioma ruminal. Los resultados de esta investigación subrayan la necesidad de evaluar la calidad del forraje para detectar posibles impactos en la composición y función de la comunidad microbiana ruminal. La optimización del ambiente reticular ruminal puede mejorar la función de la comunidad microbiana, lo que resulta en un uso más eficiente de los forrajes y nutrientes disponibles para el animal huésped.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres del repositorio / repositorios y los números de acceso se pueden encontrar a continuación: https://www.ncbi.nlm.nih.gov/, PRJNA945870.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité de Cuidado y Uso de Animales Agrícolas de la Universidad Estatal de Montana (#2019-AA12).
Contribuciones del autor
JE: Investigación, Curación de datos, Visualización, Escritura- borrador original, Redacción- revisión y edición. SW: Conceptualización, metodología, recolección de datos, redacción, revisión y edición. TC: Metodología, Recolección de datos, Redacción-revisión y edición. TD: Conceptualización, Metodología, Supervisión, Recursos, Redacción, revisión y edición. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Los fondos y el apoyo fueron generosamente proporcionados por Cargill Animal Nutrition, Montana State University Nancy Cameron Endowment, Bair Ranch Foundation, Montana Stockgrowers Association y Montana Agriculture Experiment Station.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fanim.2023.1188874/full#supplementary-material
Referencias
Arthington J. D., Swensont C. K. (2004). Efectos de la fuente de minerales traza y el método de alimentación en la productividad de las vacas braford de pastoreo1. Prof. Anim. Científico 20 (2), 155–161. doi: 10.15232/S1080-7446(15)31290-0
Barnett D., Arts I., Penders J. (2021). microViz: un paquete r para la visualización de datos de microbioma y estadísticas. J. Software de código abierto 6 (63), 3201. doi: 10.21105/joss.03201
Bates D., Mächler M., Bolker B., Walker S. (2015). Ajuste de modelos lineales de efectos mixtos utilizando lme4. J. Stat. Software 67 (1), 1–48. doi: 10.18637/jss.v067.i01
Bisanz J. E. (2018) qiime2R: importación de artefactos QIIME2 y datos asociados en sesiones r v0.99. Disponible en: https://github.com/jbisanz/qiime2R.
Bohra V., Dafale N. A., Purohit H. J. (2019). Comprender la alteración en el microbioma ruminal y el perfil de CAZymes con la dieta y el huésped a través del enfoque metagenómico comparativo. Arch. Microbiol. 201 (10), 1385–1397. DOI: 10.1007/S00203-019-01706-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Bolyen E., Rideout J. R., Dillon M. R., Bokulich N. A., Abnet C. C., Al-Ghalith G. A., et al. (2019). Ciencia de datos de microbiomas reproducible, interactiva, escalable y extensible utilizando QIIME 2. Nat. Biotechnol. 37 (8), 852–857. DOI: 10.1038/S41587-019-0209-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Callahan B. J., McMurdie P. J., Rosen M. J., Han A. W., Johnson A. J., Holmes S. P. (2016). DADA2: inferencia de muestras de alta resolución a partir de datos de amplificadores de iluminación. Métodos 13 (7), 581–583. DOI: 10.1038/NMETH.3869
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Carlisle T. J., Wyffels S. A., Stafford S. D., Taylor A. R., Van Emon M. L., DelCurto T. (2021). Evaluación de bolos minerales de liberación sostenida como método de entrega de nutrientes a largo plazo para ganado vacuno. Anim. Feed Sci. Technol. 279, 115028. doi: 10.1016/j.anifeedsci.2021.115028
Chagunda M. G. G., Flockhart J. F., Roberts D. J. (2010). El efecto de la calidad del forraje en la producción de metano entérico previsto de las vacas lecheras. Int. J. Agric. Sustainability 8 (4), 250–256. DOI: 10.3763/ijas.2010.0490
Cristobal-Carballo O., McCoard S. A., Cookson A. L., Laven R. A., Ganesh S., Lewis S. J., et al. (2021). Efecto de los regímenes de alimentación divergentes durante los primeros años de vida sobre la microbiota ruminal en terneros. Frente. Microbiol. 12, 711040. DOI: 10.3389/fmicb.2021.711040
Resumen de PubMed | Texto completo de CrossRef | Google Académico
DelCurto T., Hess B. W., Huston J. E., Olson K. C. (2000). Estrategias óptimas de suplementación para el ganado de carne que consume forrajes de baja calidad en el oeste de los Estados Unidos. J. Anim. 77 (E-Suppl), 1–16. doi: 10.2527/jas2000.77E-Suppl1v
Du H. S., Wang C., Wu Z. Z., Zhang G. W., Liu Q., Guo G., et al. (2019). Efectos de la suplementación con ácido fólico protegido del rumen y selenito de sodio protegido del rumen sobre el rendimiento de la lactancia, la digestión de nutrientes, la fermentación ruminal y los metabolitos sanguíneos en vacas lecheras. J. Sci. Food Agric. 99 (13), 5826–5833. DOI: 10.1002/JSFA.9853
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Foster Z. S., Sharpton T. J., Grunwald N. J. (2017). Metacoder: un paquete r para la visualización y manipulación de datos de diversidad taxonómica de la comunidad. PloS Comput. Biol. 13 (2), E1005404. doi: 10.1371/journal.pcbi.1005404
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Galyean M. L., Defoor P. J. (2003). Efectos de la fuente de forraje y el nivel sobre la ingesta por el ganado de engorde1. J. Anim. 81 (14_suppl_2), E8–E16. DOI: 10.2527/2003.8114_suppl_2E8x
Gharechahi J., Vahidi M. F., Bahram M., Han J. L., Ding X. Z., Salekdeh G. H. (2021). El análisis metagenómico revela un microbioma dinámico con funciones adaptativas diversificadas para utilizar forrajes lignocelulósicos con alto contenido en el rumen bovino. ISME J. 15 (4), 1108–1120. DOI: 10.1038/S41396-020-00837-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Gloor G. B., Macklaim J. M., Pawlowsky-Glahn V., Egozcue J. J. (2017). Los conjuntos de datos del microbioma son composicionales: y esto no es opcional. Frente. Microbiol. 8, 2224. doi: 10.3389/fmicb.2017.02224
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Griswold K. E., White B. A., Mackie R. I. (1999). Diversidad de actividades proteolíticas extracelulares entre especies de prevotella del rumen. Curr. Microbiol. 39 (4), 187–194. doi: 10.1007/s002849900443
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Hendawy A. O., Sugimura S., Sato K., Mansour M. M., Abd El-Aziz A. H., Samir H., et al. (2021). Efectos de la suplementación con selenio sobre la microbiota ruminal, la fermentación ruminal y la digestibilidad aparente de nutrientes de animales rumiantes: una revisión. Fermentación 8 (1). DOI: 10.3390/fermentación8010004
Henderson G., Cox F., Ganesh S., Jonker A., Young W., Global Rumen Census C., et al. (2015). La composición de la comunidad microbiana del rumen varía con la dieta y el huésped, pero se encuentra un microbioma central en un amplio rango geográfico. 5, 14567. DOI: 10.1038/SEP14567
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Hernandez-Sanchez D., Cervantes-Gomez D., Ramirez-Bribiesca J. E., Cobos-Peralta M., Pinto-Ruiz R., Astigarraga L., et al. (2019). La influencia de los niveles de cobre en la fermentación ruminal in vitro, el crecimiento bacteriano y la producción de metano. J. Sci. Food Agric. 99 (3), 1073–1077. DOI: 10.1002/JSFA.9274
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Jackson T. D., Carmichael R. N., Deters E. L., Messersmith E. M., VanValin K. R., Loy D. D., et al. (2020). Comparación de múltiples productos minerales traza de dosis de legumbres de un solo uso proporcionados como inyectable, empapado oral, pasta oral o bolo en concentraciones de minerales traza circulantes e hepáticas de novillos de carne. Appl. Anim. Sci. 36 (1), 26–35. DOI: 10.15232/AAS.2019-01856
Johnson K. A., Johnson D. E. (1995). Emisiones de metano del ganado. J. Anim. 73 (8), 2483–2492. doi: 10.2527/1995.7382483x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Kong Y., Teather R., Forster R. (2010). Composición, distribución espacial y diversidad de las comunidades bacterianas en el rumen de vacas alimentadas con diferentes forrajes. FEMS Microbiol. Ecol. 74 (3), 612–622. doi: 10.1111/j.1574-6941.2010.00977.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Langille M. G. I., Zaneveld J., Caporaso J. G., McDonald D., Knights D., Reyes J. A., et al. (2013). Perfil funcional predictivo de comunidades microbianas utilizando secuencias de genes marcadores de ARNr 16S. Nat. Biotecnología. 31 (9), 814–821. DOI: 10.1038/NBT.2676
Liu C., Cui Y., Li X., Yao M. (2021). Microeco: un paquete r para la minería de datos en ecología de comunidades microbianas. FEMS Microbiol. Ecol. 97 (2), FIAA255. DOI: 10.1093/femsec/fiaa255
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Liu C., Li X. H., Chen Y. X., Cheng Z. H., Duan Q. H., Meng Q. H., et al. (2017). Respuesta relacionada con la edad de la microbiota ruminal a la sal mineral y efectos de sus interacciones sobre las emisiones entéricas de metano en el ganado. Microb. Ecol. 73 (3), 590–601. DOI: 10.1007/S00248-016-0888-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Liu Y., Wang C., Liu Q., Guo G., Huo W., Zhang Y., et al. (2019). Efectos de la adición de selenito de sodio sobre la fermentación ruminal, la microflora y la excreción urinaria de derivados de purina en toros lecheros Holstein. J. Anim. Physiol. Anim. Nutr. (Berl) 103 (6), 1719–1726. doi: 10.1111/jpn.13193
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Liu J., Zhang M., Xue C., Zhu W., Mao S. (2016). Caracterización y comparación de la dinámica temporal de la microbiota bacteriana ruminal colonizando paja de arroz y heno de alfalfa dentro de rumiantes. J. Dairy Sci. 99 (12), 9668–9681. DOI: 10.3168/JDS.2016-11398
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Louca S., Jacques S. M. S., Pires A. P. F., Leal J. S., Srivastava D. S., Parfrey L. W., et al. (2016a). Alta variabilidad taxonómica a pesar de la estructura funcional estable en las comunidades microbianas. Nat. Ecol. Evol. 1 (1), 15. DOI: 10.1038/S41559-016-0015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Louca S., Parfrey L. W., Doebeli M. (2016b). Función de desacoplamiento y taxonomía en el microbioma oceánico global. Science 353 (6305), 1272–1277. doi: 10.1126/science.aaf4507
Resumen de PubMed | Texto completo de CrossRef | Google Académico
McMurdie P. J., Holmes S. (2013). Phyloseq: un paquete r para análisis interactivos reproducibles y gráficos de datos censales de microbiomas. PloS One 8 (4), e61217. doi: 10.1371/journal.pone.0061217
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Myer P. R., Smith T. P., Wells J. E., Kuehn L. A., Freetly H. C. (2015). Microbioma ruminal de novillos que difieren en la eficiencia de la alimentación. PloS One 10 (6), e0129174. doi: 10.1371/journal.pone.0129174
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Newbold C. J., Ramos-Morales E. (2020). Revisión: microbioma ruminal y metaboloma microbiano: efectos de la dieta y huésped rumiante. Animal 14 (S1), s78–s86. doi: 10.1017/S1751731119003252
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Okansen J., Blanchet F. G., Friendly M., Kindt R., Legendre P., McGlinn D., et al. (2019). Vegano: paquete de ecología comunitaria (Paquete R). Disponible en: https://CRAN.R-project.org/package=vegan.
Petri R. M., Kleefisch M. T., Metzler-Zebeli B. U., Zebeli Q., Klevenhusen F. (2018). Cambios en la microbiota epitelial ruminal del ganado bovino y la expresión génica del huésped en respuesta a alteraciones en la composición de carbohidratos de la dieta. Aplicación. Entorno. Microbiol. 84 (12), 105–115. doi: 10.1128/AEM.00384-18
Quast C., Pruesse E., Yilmaz P., Gerken J., Schweer T., Yarza P., et al. (2013). El proyecto de base de datos de genes de ARN ribosómico SILVA: procesamiento de datos mejorado y herramientas basadas en la web. Ácidos nucleicos res. 41, D590–D596. doi: 10.1093/nar/gks1219
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Segata N., Izard J., Waldron L., Gevers D., Miropolsky L., Garrett W. S., et al. (2011). Descubrimiento y explicación de biomarcadores metagenómicos. Genoma Biol. 12 (6), R60. DOI: 10.1186/GB-2011-12-6-R60
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Hijo A. R., Islam M., Kim S. H., Lee S. S., Lee S. S. (2023). Influencia de los minerales traza orgánicos dietéticos en las emisiones entéricas de metano y la microbiota ruminal de novillos lecheros estresados por calor. J. Anim. Sci. Technol. 65 (1), 132–148. doi: 10.5187/jast.2022.e100
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sprinkle J. E., Cuneo S. P., Frederick H. M., Enns R. M., Schafer D. W., Carstens G. E., et al. (2006). Efectos de un bolo de reticulorumen de mineral traza de acción prolongada sobre la productividad de las vacas de rango y los perfiles de minerales traza1. J. Anim. 84 (6), 1439–1453. doi: 10.2527/2006.8461439x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sprinkle J. E., Schafer D. W., Cuneo S. P., Tolleson D. R., Enns R. M. (2021). Efectos de un bolo ruminal de mineral traza de acción prolongada sobre la productividad de las vacas de rango. Trad. Anim. 5 (1), TXAA232. doi: 10.1093/tas/txaa232
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Storey J. D. (2003). La tasa positiva de falso descubrimiento: una interpretación bayesiana y el valor q. Ann. Stat 31 (6), 2013–2035. doi: 10.1214/aos/1074290335
Tapio I., Fischer D., Blasco L., Tapio M., Wallace R. J., Bayat A. R., et al. (2017). Abundancia de taxones, diversidad, co-ocurrencia y análisis de red de la microbiota ruminal en respuesta a cambios dietéticos en vacas lecheras. PloS One 12 (7), e0180260. doi: 10.1371/journal.pone.0180260
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Equipo, R. C (2021). R: un lenguaje y entorno para la computación estadística. r Foundation for statistical computing (Viena, Austria: R Foundation for Statistical Computing). Disponible en: https://www.R-project.org/.
Vigh A., Criste A., Gragnic K., Moquet L., Gerard C. (2023). Solubilidad ruminal y biodisponibilidad de fuentes de minerales traza inorgánicos y efectos sobre la actividad de fermentación medida in vitro. Agricultura 13 (4), 879. DOI: 10.3390/agricultura13040879
Wang C., Han L., Zhang G. W., Du H. S., Wu Z. Z., Liu Q., et al. (2021). Efectos del sulfato de cobre y la adición de sulfato de cobre recubierto sobre el rendimiento de la lactancia, la digestibilidad de nutrientes, la fermentación ruminal y los metabolitos sanguíneos en vacas lecheras. Fr. J. Nutr. 125 (3), 251–259. doi: 10.1017/S0007114520002986
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Wang L., Zhang G., Li Y., Zhang Y. (2020). Efectos de la dieta alta en forraje/concentrado sobre la producción de ácidos grasos volátiles y los microorganismos implicados en la producción de AGV en el rumen de vaca. (Basilea) 10 (2), 223. DOI: 10.3390/ANI10020223
Wei J. Y., Wang J., Liu W., Zhang K. Z., Sun P. (2019). Comunicación corta: efectos de diferentes suplementos de selenio sobre la fermentación ruminal y la aparente digestibilidad de nutrientes y selenio de vacas lecheras de lactancia media. J. Dairy Sci. 102 (4), 3131–3135. DOI: 10.3168/JDS.2018-15455
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Wei Z., Xie X., Xue M., Valencak T. G., Liu J., Sun H. (2021). Los efectos del contenido de carbohidratos sin fibra y el tipo de forraje en el microbioma ruminal de las vacas lecheras. (Basilea) 11 (12). doi: 10.3390/ani11123519
Wickham H. (2016). ggplot2: gráficos elegantes para el análisis de datos (Nueva York: Springer-Verlag).
Zhang Z. D., Wang C., Du H. S., Liu Q., Guo G., Huo W. J., et al. (2020). Efectos del selenito de sodio y el selenito de sodio recubierto sobre el rendimiento de la lactancia, la digestión total de nutrientes del tracto y la fermentación ruminal en vacas lecheras Holstein. Animal 14 (10), 2091–2099. doi: 10.1017/S1751731120000804
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Zhang R., Zhu W., Zhu W., Liu J., Mao S. (2014). Efecto de las fuentes forrajeras dietéticas sobre la microbiota ruminal, la fermentación ruminal y las aminas biógenas en vacas lecheras. J. Sci. Food Agric. 94 (9), 1886–1895. doi: 10.1002/jsfa.6508
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Zhao Z. W., Ma Z. Y., Wang H. C., Zhang C. F. (2022). Efectos del suministro de minerales traza de bolos de liberación sostenida del rumen sobre los rendimientos y componentes de la leche, la fermentación ruminal y las bacterias ruminales en yaks lactantes (Bos grunniens). Anim. Feed Sci. Technol. 283, 115184. doi: 10.1016/j.anifeedsci.2021.115184
Zhou M., O’Hara E., Tang S., Chen Y., Walpole M. E., Gorka P., et al. (2021). Acceso a los efectos dietéticos en el microbioma ruminal: diferentes métodos de secuenciación cuentan diferentes historias. Vet. 8 (7), 138. doi: 10.3390/vetsci8070138
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: microbioma, rumen, bolo mineral, calidad del alimento, forrajes
Cita: Eberly JO, Wyffels SA, Carlisle TJ y DelCurto T (2023) Respuesta del microbioma ruminal al suplemento de bolo mineral de liberación sostenida con forrajes de baja y alta calidad. Frente. Anim. Sci. 4:1188874. doi: 10.3389/fanim.2023.1188874
Recibido: 17 de marzo de 2023; Aprobado: 09 Junio 2023;
Publicado: 23 junio 2023.
Editado por:
Bianca Castiglioni, Consiglio Nazionale delle Ricerche (CNR), Italia
Revisado por:
Tao Ran, Universidad de Lanzhou, China
Brittany Davis, Departamento de Agricultura de los Estados Unidos (USDA), Estados Unidos
Derechos de autor © 2023 Eberly, Wyffels, Carlisle y DelCurto. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Jed O. Eberly, jed.eberly@montana.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

