Protección inmune inducida por la glicoproteína recombinante E2 del virus de la diarrea viral bovina en un modelo murino

Protección inmune inducida por la glicoproteína recombinante E2 del virus de la diarrea viral bovina en un modelo murino
 Ninnet Gómez-Romero1,
Ninnet Gómez-Romero1,  Carlos F. Arias2,
Carlos F. Arias2,  Antonio Verdugo-Rodríguez3,
Antonio Verdugo-Rodríguez3,  Susana López2,
Susana López2,  Luis Fernando Valenzuela-Moreno4,
Luis Fernando Valenzuela-Moreno4,  Carlos Cedillo-Peláez4 y
Carlos Cedillo-Peláez4 y  Francisco Javier Basurto-Alcántara1*
Francisco Javier Basurto-Alcántara1*- 1Laboratorio de Vacunología, Departamento de Microbiología e Inmunología, Facultad de Medicina Veterinaria y Zootecnia-Universidad Nacional Autónoma de México, Ciudad de México, México
- 2Departamento de Genética del Desarrollo y Fisiología Molecular, Instituto de Biotecnología, Universidad Nacional Autónoma de México, Cuernavaca, Morelos, México
- 3Laboratorio de Microbiología Molecular, Departamento de Microbiología e Inmunología, Facultad de Medicina Veterinaria y Zootecnia-Universidad Nacional Autónoma de México, Ciudad de México, México
- 4Laboratorio de Inmunología Experimental, Instituto Nacional de Pediatría, Ciudad de México, México
El virus de la diarrea viral bovina (BVDV) se considera el patógeno viral más importante en rumiantes en todo el mundo debido a la amplia gama de manifestaciones clínicas que muestran los animales infectados. Por lo tanto, la infección por BVDV conduce a graves pérdidas económicas en las industrias de carne y lácteos de varios países. La vacunación previene el fracaso reproductivo y los trastornos gastrointestinales y respiratorios causados por la infección por BVDV. Sin embargo, teniendo en cuenta sus limitaciones, se han aplicado vacunas convencionales como virus vivos, atenuados y muertos. Por lo tanto, diferentes estudios han descrito las vacunas de subunidades como una alternativa efectiva y segura para la protección del BVDV. Por lo tanto, en este estudio, el ectodominio de la glicoproteína E2 (E2e) de la cepa NADL BVDV se expresó en células de mamíferos y se utilizó en dos formulaciones de vacunas para evaluar la inmunogenicidad y la protección contra BVDV conferidas en un modelo murino. Las formulaciones consistieron en glicoproteína E2e sola y glicoproteína E2e emulsionadas en el adyuvante ISA 61 VG. Cinco grupos de 6 ratones de 6 a 8 semanas de edad fueron inmunizados tres veces en los días 1, 15 y 30 por inyección intraperitoneal con las formulaciones y controles mencionados. Para evaluar la protección conferida contra BVDV, los ratones fueron desafiados seis semanas después de la tercera inmunización. Además, se evaluó la respuesta inmune humoral después de la vacunación y el desafío. Los grupos de ratones inoculados con E2e solo y E2e + ISA 61 VG mostraron títulos neutralizantes; sin embargo, los títulos de anticuerpos E2 en el grupo E2e + ISA 61 VG fueron significativamente más altos que el grupo de ratones inmunizados con la glicoproteína E2e sola. Además, la inmunización con E2e + ISA 61 VG evita que los animales desarrollen lesiones graves en los tejidos estudiados. Además, este grupo adquirió protección contra el desafío BVDV, evidenciado por una reducción significativa de la tinción positiva para el antígeno BVDV en los pulmones, el hígado y el cerebro entre los grupos experimentales. Nuestros hallazgos demostraron que el uso de E2e + ISA 61 VG induce una mayor protección del BVDV mediante una respuesta humoral temprana y reduce las lesiones histopatológicas y la detección del antígeno BVDV en los órganos afectados, lo que indica que la formulación de la subunidad E2e + ISA 61 VG puede considerarse como un candidato a vacuna putativo contra BVDV. La eficacia y seguridad de esta vacuna candidata en bovinos requiere más investigación.
Introducción
El virus de la diarrea viral bovina (BVDV) es un patógeno importante en el ganado asociado con fallas reproductivas como abortos, momificaciones, mortinatos y el nacimiento de animales persistentemente infectados (IP) y también trastornos respiratorios y entéricos que causan graves pérdidas económicas. El BVDV es el agente causal de la enfermedad viral bovina (BVD), que se considera una de las enfermedades bovinas económicamente más importantes del mundo (1). BVDV es un virus de ARN monocatenario perteneciente al género Pestivirus dentro de la familia Flaviviridae. Actualmente, las tres especies anteriores de virus BVDV-1, BVDV-2 y similares a HoBi ahora se conocen como Pestivirus A, Pestivirus B y Pestivirus H, respectivamente (2). Además, los análisis filogenéticos han segregado aún más estos tres pestivirus en subgenotipos en al menos 21 subgenotipos dentro de BVDV-1, cuatro subgenotipos BVDV-2 (a-d) y cuatro subgenotipos de virus similares a HoBi (a-d) (3). La diversidad genética del BVDV y su distribución se han demostrado previamente en varias regiones del mundo. Los estudios epidemiológicos del BVDV en ganado bovino mexicano revelaron que BVDV-1a, 1b y 1c y BVDV-2a, sin evidencia de pestivirus similares a HoBi, son los subgenotipos prevalentes (4). En México, las vacunas vivas inactivadas/muertas y modificadas (MLV) contra el BVDV están autorizadas y se determinan principalmente para prevenir los signos clínicos y controlar las infecciones por BVDV. Sin embargo, algunas desventajas del uso de estos inmunógenos han sido previamente descritas. Las vacunas MLV pueden causar trastornos reproductivos como infección fetal, inmunosupresión, recombinación con cepas de campo del BVDV, desarrollo de enfermedad de la mucosa en ganado infectado persistentemente y BVD atribuible a la contaminación de la vacuna (5-8). Por el contrario, durante el proceso de inactivación de las vacunas muertas, se reduce la inmunogenicidad del antígeno viral; Por lo tanto, la formulación con adyuvantes es necesaria. Además, las vacunas muertas inducen respuestas inmunes a corto plazo; Por lo tanto, se requieren dosis de refuerzo de vacunas inactivadas para conferir una respuesta inmune protectora (9, 10).
Recientemente, se han estudiado candidatos a vacunas de subunidades basadas en la glicoproteína BVDV E2; sin embargo, el sistema de expresión E2, la dosis, las formulaciones y las especies animales objetivo utilizadas siguen siendo un tema de evaluación y discusión (11-14). La proteína E2 de la envoltura es la glicoproteína estructural inmunodominante del BVDV que contiene epítopos de células T CD8 fuertemente neutralizantes (15, 16). Además, los anticuerpos neutralizantes inducidos en animales infectados y vacunados se dirigen principalmente a la proteína E2 (15, 17). Por lo tanto, debido a la respuesta inmunológica provocada por el uso de la proteína E2 como una vacuna de subunidad, esta glicoproteína BVDV sigue siendo un objetivo importante para el diseño de vacunas.+
En este estudio, evaluamos la eficacia protectora de dos formulaciones de una vacuna recombinante basada en la glicoproteína E2 en ratones. Estudios previos han revelado que los ratones son susceptibles a la infección por BVDV, lo que hace que el modelo murino sea una opción adecuada para estudiar la infección por BVDV (18, 19). Además, investigaciones recientes han demostrado que la eficacia de compuestos con propiedades antivirales contra BVDV se ha probado utilizando este modelo (20, 21). Además, se reportan lesiones comparables entre ratones y bovinos (22-24).
Una de las formulaciones evaluadas en este estudio consistió en la proteína E2 emulsionada en Montanide? ISA (SEPPIC, París, Francia) para la optimización de vacunas. ¿La Montanide ISA? es un adyuvante a base de aceite mineral de agua en aceite (W/O) utilizado para mejorar la inmunogenicidad de los antígenos y estimular fuertes respuestas inmunes contra varios antígenos virales aplicados en el ganado y otras especies. Se ha demostrado que las vacunas para veterinarios que contienen Montanide ISA 61 VG estimulan una respuesta inmune celular y humoral acelerada. Además, el uso de Montanide ISA 61 VG resultó en títulos más altos de anticuerpos e IFN-gamma, descomposición lenta de anticuerpos y protección a largo plazo en comparación con otros adyuvantes (25-27). En este estudio, evaluamos la protección del BVDV conferida utilizando dos formulaciones experimentales de proteína BVDV E2 recombinante en un modelo murino.
Materiales y métodos
Declaración ética
Todos los protocolos experimentales para ensayos con animales fueron aprobados por el Subcomité de Cuidado y Uso de Animales de Experimentación de la Facultad de Medicina Veterinaria de la Universidad Nacional Autónoma de México (FMVZ-UNAM).
Determinación de la cepa del BVDV y del título del virus
El BVDV-1a VR-534 (ATCC, Manassas, VA, EUA) se cultivó para la clonación de genes y la producción de vacunas y se utilizó como cepa de desafío. La cepa viral se replicó en células MDBK utilizando el Medio Esencial Mínimo (DMEM) de Dulbecco (Gibco™, Thermo Fisher Scientific, Waltham, MA, EUA) suplementado con suero equino al 10% (ATCC, Manassas, VA, EUA). La titulación viral se realizó en las células de MDBK en placas de 96 pocillos utilizando diluciones quíntuples de 10 veces, y el título se calculó utilizando el método de Reed y Muench (28).
Clonación y expresión de la glicoproteína BVDV E2
El gen que codifica la cepa E2 glicoproteína BVDV NADL (~1.030 pb) con el dominio transmembrana eliminado fue amplificado utilizando cebadores previamente reportados por Donofrio et al. (29) (Tabla 1) y clonado en el plásmido pSecTag2/Hygro A (Invitrogen, Carlsbad, CA, EUA) utilizando enzimas de restricción HindIII y XhoI (New England BioLabs Inc., Massachusetts, EUA). La construcción del plásmido recombinante pSecTag2E2 se confirmó mediante secuenciación para establecer la precisión. Después de eso, se realizó la transfección en HEK293T utilizando el reactivo lipofectamina 3000 (Thermo Fisher Scientific, Waltham, MA, EUA). Las células transfectadas se seleccionaron con higrogicina (200 ug/mL) (Thermo Fisher Scientific, Waltham, MA, EUA). Luego, las células sobrevivientes se recuperaron en 125 cm.®®2 matraces con 40 ml de medio modificado de Dulbecco suplementado con un 10% de FBS (Gibco™, Thermo Fisher Scientific, Waltham, MA, EUA) y utilizado para producir proteína E2e recombinante. Se recolectó el sobrenadante celular y se realizó la purificación de proteínas utilizando perlas de Ni-NTA (Qiagen, Alameda, CA, EUA) de acuerdo con las indicaciones del fabricante.
 Tabla 1. Imprimadores utilizados en este estudio para la amplificación de E2 y la detección de BVDV en muestras de tejido de ratones.
Tabla 1. Imprimadores utilizados en este estudio para la amplificación de E2 y la detección de BVDV en muestras de tejido de ratones.
SDS-PAGE y Western blot
La expresión de una proteína recombinante llamada E2e fue evaluada por SDS-PAGE y Western blot. Por lo tanto, la proteína purificada se diluyó en tampón de carga de muestras para SDS-PAGE y se hirvió a 100 ° C durante 5 min. La proteína recombinante se visualizó en SDS-PAGE teñida con azul brillante de Coomassie. Además, la proteína recombinante se transfirió a una membrana de nitrocelulosa (Millipore Darmstadt, Alemania) y se probó con un anticuerpo monoclonal anti-His tag (Invitrogen, Carlsbad, CA, EUA), un anticuerpo monoclonal anti-myc (Invitrogen, Carlsbad, CA, EUA) o un anticuerpo monoclonal de ratón anti-BVDV-E2 (VMRD, Pullman, WA, EUA), seguido de un anticuerpo IgG anti-ratón conjugado con peroxidasa de rábano picante secundario (Sigma Aldrich, Saint Louis, MO, USA), y visualizado por quimioluminiscencia (Thermo Fisher Scientific, Waltham, MA, USA).
Preparación de vacunas
La emulsificación de la proteína E2e recombinante se preparó 1 día antes de la inmunización utilizando un adyuvante de agua en aceite a base de aceite mineral, conocido comercialmente como Montanide™ ISA 61 VG (SEPPIC, París, Francia), como se describió anteriormente (31). La vacuna candidata se formuló mezclando proteína E2e recombinante purificada y Montanide™ ISA 61 VG para obtener una concentración final de 50-ug de 500 ul por dosis. A continuación, se realizó la emulsificación de los controles negativos utilizando PSS + Montanide™ ISA 61 VG.
Animales, inmunización y desafío viral
El estudio se realizó en ratones hembra BALB/c libres de patógenos específicos de 6-8 semanas de edad (n = 6) obtenidos del Instituto de Biotecnología-Universidad Nacional Autónoma de México (IBt-UNAM). Todos los animales fueron mantenidos en condiciones libres de patógenos y manejados en estricto apego a los lineamientos y protocolos aprobados por el Subcomité de Cuidado y Uso de Animales de Experimentación de la Facultad de Medicina Veterinaria y Zootecnia-Universidad Nacional Autónoma de México (FMVZ-UNAM). Los ratones tuvieron un período de aclimatación de 7 días antes del inicio del ensayo. Todos los procedimientos de vacunación y provocación del BVDV se realizaron en contenciones de nivel 2 del Laboratorio de Bioseguridad Animal.
Después del período de aclimatación, seis ratones de 7-9 semanas de edad fueron asignados aleatoriamente a cada uno de los cinco grupos de tratamiento e inmunizados intraperitonealmente de la siguiente manera: el Grupo 1 fue inmunizado tres veces con 50 μg de proteína E2e recombinante del BVDV; el grupo 2 fue inmunizado tres veces con 50 μg de proteína recombinante E2e del BVDV formulada en Montanide™ ISA 61 VG; el grupo 4 fue inoculado tres veces con solución salina fisiológica (PSS) emulsionada con Montanide™ ISA 61 VG; y el grupo 5 fue inoculado con PSS y sirvió como grupo control negativo. La inmunización se realizó los días 1, 15 y 30. Además, el grupo 3 se incluyó como un control positivo para el desafío BVDV. Posteriormente, 6 semanas después de la tercera inmunización, cada ratón de los grupos 1-4 fue desafiado con 1 × 106.2 TCID 50/ml de la cepa BVDV NADL (ATCC VR-534) administración por vía orogástrica utilizando una cánula de alimentación recta de acero inoxidable No. 8 (Cadence Science, Inc. USA). En los días 7 y 21 post-desafío (días 79 y 94 del ensayo), la mitad de los animales de cada grupo fueron sacrificados con CO2 gas para recoger muestras de sangre y tejidos (Figura 1). Después del desafío viral, los ratones fueron monitoreados diariamente para detectar signos clínicos.
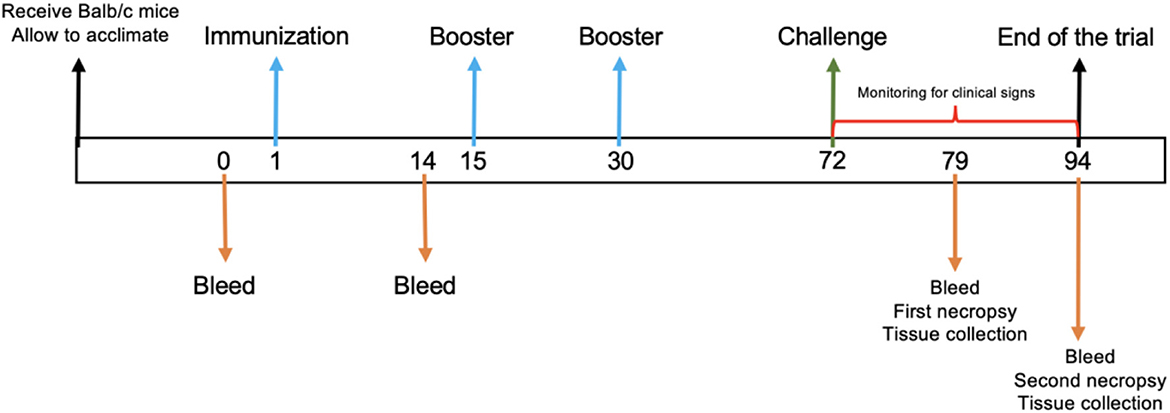 Figura 1. Línea de tiempo experimental. Un diagrama esquemático del protocolo de inmunización. Los números indican los días durante el juicio. Las flechas indican el procedimiento del juicio.
Figura 1. Línea de tiempo experimental. Un diagrama esquemático del protocolo de inmunización. Los números indican los días durante el juicio. Las flechas indican el procedimiento del juicio.
Recogida de muestras
En determinados momentos, los ratones fueron sangrados a través del seno retroorbital recolectando muestras de sangre de 250-300 μl en tubos de 1,5 ml sin un anticoagulante. El suero se recuperó de la sangre después de la centrifugación a 4.000 rpm durante 10 min y se conservó a -20 ° C hasta su uso. El suero de ratones se recolectó en los días 0, 1, 79 y 94 (Figura 1) para el ensayo de neutralización del virus y RT-PCR. Además, los ratones fueron sacrificados en los días 7 y 21 después del desafío viral, y el pulmón, el estómago, el hígado, el bazo, el intestino, el riñón y el cerebro se extirparon en la necropsia para su posterior análisis.
Reacción en cadena de la polimerasa con transcriptasa inversa
El ARN total de muestras de pulmón, estómago, hígado, bazo, intestino, riñón y cerebro se extrajo utilizando el reactivo TRIzol de acuerdo con las instrucciones del fabricante. El ARN obtenido de cada muestra se sometió a RT-PCR. La detección del BVDV en muestras de tejido por RT-PCR se realizó utilizando cebadores 5UTR/STAR como se describió previamente en el estudio de Mahony et al. (30).
Titulación neutralizante del virus
Se realizó una prueba estándar de neutralización del virus (VNT) para detectar anticuerpos contra BVDV utilizando el suero de ratones recolectados en los días 1 y 15 del ensayo de inmunización y los días 7 y 21 después del desafío. En resumen, se sometió a VNT un grupo de suero de ratones de cada grupo experimental. Los títulos de neutralización de anticuerpos se determinaron utilizando la cepa viral citopática BVDV-1a (ATCC VR-534) utilizada en el ensayo de provocación. Los sueros de piscina se inactivaron a 56 ° C durante 1 h y se diluyeron con DMEM y se ejecutaron por triplicado utilizando diluciones seriadas de 2 veces de 1: 4 a 1: 32,768 en placas de 96 pocillos. En resumen, 200 TCID50 de la cepa viral se añadió a cada pocillo y se incubó a 37°C en una atmósfera humidificada de 5% de CO2. Después de 1 h de incubación, 2 × 104 Se incluyeron células MDBK por pocillo. Se utilizaron pocillos celulares sin el virus para cada muestra de suero como controles negativos. Las placas se incubaron durante 96 h y los puntos finales de concentración de anticuerpos se obtuvieron mediante la evaluación microscópica de la monocapa de MDBK para el efecto citopático. Los títulos de los criterios de valoración se calcularon mediante el método de Spearman-Kärber (32). Los títulos se expresaron como el recíproco de la dilución más alta que neutralizó la infectividad viral.
Evaluación clínica
Los exámenes clínicos fueron realizados por un veterinario diariamente después del desafío BVDV. Además, se monitorizó el desarrollo de signos clínicos durante el período posterior al desafío.
Histopatología e inmunohistoquímica
Se recolectaron muestras de tejido en la necropsia de todos los animales encuestados en este estudio, incluidos el pulmón, el estómago, el hígado, el bazo, el intestino, los riñones y el cerebro. Los tejidos se fijaron en formalina tamponada al 10% después de al menos 48-72 h. Los bloques embebidos en parafina se seccionaron en 4 μm, se tiñeron con hematoxilina y eosina, y se examinaron las lesiones mediante microscopía óptica. Los hallazgos histopatológicos en los ratones después del desafío BVDV fueron evaluados por un patólogo que estaba cegado al régimen de tratamiento. Se utilizó un sistema de puntuación de clasificación para evaluar las lesiones histopatológicas. El sistema de clasificación fue el siguiente: –/+ indicó incipiente, + indicó leve, +/–++ indicó leve/moderado, ++ indicó moderado, ++/+++ indicó moderado/severo y +++ indicó severo.
Los tejidos fijos se sometieron a inmunohistoquímica (IHC) para la detección del antígeno BVDV. En el estudio, las secciones de tejido incrustadas en parafina de 4 μm de espesor se desparafinaron e hidrataron a través de series graduales de alcohol. El anticuerpo primario fue un anticuerpo monoclonal IgG1 anti-BVDV llamado 3.12F1 (VRMD) diluido en una proporción de 1:2.000 en solución tamponada con fosfato (PBS)-Tween 20 y utilizado de acuerdo con las instrucciones del fabricante. El anticuerpo secundario utilizado fue el antimultiespecie biotinilado (Invitrogen). La estreptavidina-peroxidasa de rábano picante y la betazoide diaminobencidina (DAB) se utilizaron para desarrollar la reacción de color. Posteriormente, las secciones de tejido fueron enjuagadas, contrateñidas, montadas, examinadas por microscopía óptica y fotografiadas. Las secciones de tejido se incubaron con PBS-Tween 20 en lugar del anticuerpo primario antes del tratamiento con anticuerpos secundarios que se utilizaron como controles negativos. La tinción inmunohistoquímica del BVDV se clasificó y evaluó mediante un sistema de puntuación de intensidad semicuantitativa: –: sin antígeno detectable del BVDV; –/+: detección débil o débil del antígeno BVDV; +: detección mínima del antígeno BVDV; ++: detección moderada del antígeno BVDV ++/+++: detección moderada a intensa del antígeno BVDV; y +++: detección intensa del antígeno BVDV.
Análisis estadístico
Los resultados de la RT-PCR se clasificaron utilizando el análisis de conglomerados jerárquicos de agrupamiento bidireccional (TWCHA) y un método estadístico que clasifica los resultados en grupos en función de sus similitudes (33). Los resultados están organizados en una matriz de dimensiones N x M. N es el número de grupos experimentales, y M son los valores porcentuales positivos para BVDV obtenidos de los tejidos evaluados utilizando los resultados de RT-PCR. Los datos se estandarizaron sólidamente y el método de vinculación completa definió las métricas de distancia entre los grupos. Los resultados del análisis de conglomerados se presentan como dendrogramas. El orden de los grupos se utiliza para reordenar las columnas y filas de un mapa de calor que muestra el porcentaje de resultados positivos para BVDV por RT-PCR por tejido.
Después de la inmunización, la importancia de las diferencias en el título de anticuerpos neutralizantes se estimó mediante la prueba t de Student realizada en la versión 6.0 del software GraphPad (GraphPad Prism, Software Inc., La Jolla, CA). La diferencia significativa en la inmunopositividad tisular entre los grupos inmunizados y control se determinó mediante un análisis unidireccional de varianza (ANOVA) seguido de la prueba de comparación múltiple de Tukey realizada en la versión 11 del software JMP. La significación estadística se informó de la siguiente manera, y un valor de p de < 0,05 indicó una diferencia estadísticamente significativa.
Resultados
Expresión y purificación de la glicoproteína BVDV E2
Evaluamos la expresión y purificación de la glicoproteína E2e recombinante del BVDV obtenida de sobrenadantes de células HEK-293T transfectadas por Western blotting. Las proteínas misceláneas se eliminaron mediante purificación. La expresión correcta de proteínas y la purificación se confirmaron mediante la detección de una proteína con una masa molecular de ~ 53 kDa, como se muestra en la Figura 2.
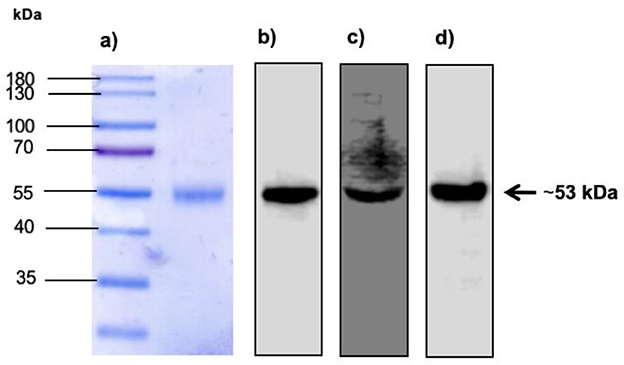 Figura 2. Expresión de la proteína recombinante BVDV E2 en SDS-PAGE y Western blot. (A) Carril 1: Marcador de peso molecular. Carril 2: Expresión de la proteína recombinante E2e recuperada y purificada del sobrenadante de células transfectadas HEK-293T. (B) Detección de la proteína recombinante E2e por Western blot utilizando anticuerpos monoclonales anti-His tag diluidos 1:1.000. (C) Detección de proteína recombinante E2e por Western blot utilizando anticuerpos anti-BVDV diluidos 1:1.000. (D) Detección de la proteína recombinante E2e por Western blot utilizando anticuerpos monoclonales anti-myc tag diluidos 1:1.000.
Figura 2. Expresión de la proteína recombinante BVDV E2 en SDS-PAGE y Western blot. (A) Carril 1: Marcador de peso molecular. Carril 2: Expresión de la proteína recombinante E2e recuperada y purificada del sobrenadante de células transfectadas HEK-293T. (B) Detección de la proteína recombinante E2e por Western blot utilizando anticuerpos monoclonales anti-His tag diluidos 1:1.000. (C) Detección de proteína recombinante E2e por Western blot utilizando anticuerpos anti-BVDV diluidos 1:1.000. (D) Detección de la proteína recombinante E2e por Western blot utilizando anticuerpos monoclonales anti-myc tag diluidos 1:1.000.
Evaluación clínica
No se registraron signos clínicos de enfermedad o cambios de comportamiento en ratones utilizados durante este estudio.
RT-PCR a partir de muestras de tejido y TWHCA
Realizamos RT-PCR para detectar ARN BVDV en muestras de tejido. Además, los resultados positivos del BVDV de la RT-PCR se analizaron utilizando TWCHA, lo que resultó en la agrupación de grupos experimentales en función de su capacidad para albergar la replicación del BVDV. En consecuencia, se distinguieron tres grupos principales (1-3) en el análisis de TWCHA (Figura 3). El grupo 1 comprende solo el grupo experimental 2 de ratones inmunizados con E2e + ISA 61 VG. Los grupos 3 y 4, utilizados como control positivo del desafío del BVDV y la inmunización, se agruparon dentro del Grupo 2. Finalmente, el Cluster 3 incluyó el grupo experimental 1 de ratones inmunizados con glicoproteína recombinante E2e sola (Figura 3).
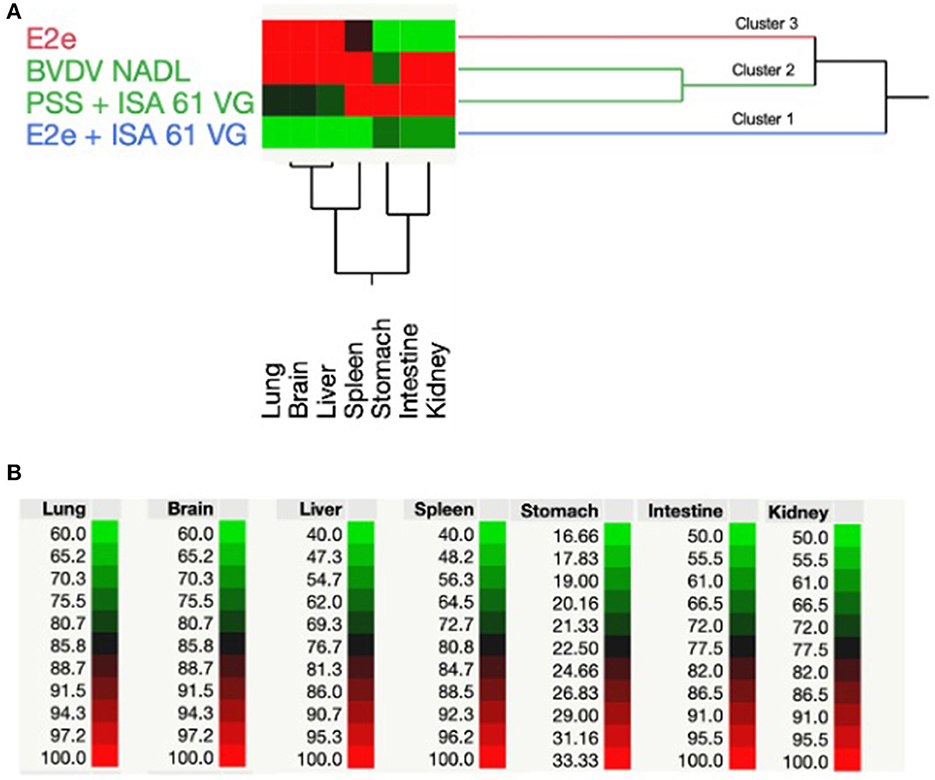 Figura 3. Análisis jerárquico bidireccional de conglomerados basado en resultados positivos de RT-PCR de detección de BVDV. (A) El dendrograma muestra el patrón de agrupación de la detección positiva de ARN del BVDV en los pulmones, el cerebro, el hígado, el bazo, el estómago, el intestino y los riñones de grupos experimentales de ratones utilizados en este estudio. (B) El espectro de colores entre verde y rojo muestra la intensidad de correlación entre el tratamiento de cada grupo experimental y los valores porcentuales positivos para BVDV obtenidos de tejidos de ratones evaluados utilizando resultados de RT-PCR.
Figura 3. Análisis jerárquico bidireccional de conglomerados basado en resultados positivos de RT-PCR de detección de BVDV. (A) El dendrograma muestra el patrón de agrupación de la detección positiva de ARN del BVDV en los pulmones, el cerebro, el hígado, el bazo, el estómago, el intestino y los riñones de grupos experimentales de ratones utilizados en este estudio. (B) El espectro de colores entre verde y rojo muestra la intensidad de correlación entre el tratamiento de cada grupo experimental y los valores porcentuales positivos para BVDV obtenidos de tejidos de ratones evaluados utilizando resultados de RT-PCR.
Al comparar los grupos, se encontró que el Grupo 2 tenía el porcentaje promedio más alto de detección de BVDV a través de RT-PCR en la mayoría de los tejidos examinados. Por lo tanto, el Cluster 2 se asoció con una mayor replicación de la cepa de desafío del BVDV. Por el contrario, los ratones inmunizados con glicoproteína recombinante E2e sola y E2e + ISA 61 VG, ratones de los grupos experimentales 1 y 2, respectivamente, mostraron el porcentaje más bajo de detección de BVDV en los tejidos evaluados. Curiosamente, en comparación con el Grupo 3, el Grupo 1 mostró resultados positivos más bajos para BVDV, lo que sugiere que los ratones inmunizados con la formulación E2e + ISA 61 VG ayudaron a reducir la replicación del BVDV en los tejidos mencionados por la respuesta inmune provocada.
Titulación neutralizante del virus
Para evaluar la respuesta humoral después de la vacunación, medimos la concentración de anticuerpos neutralizantes del BVDV en el suero de ratones desafiados. Los ratones vacunados de los grupos 1 y 2 se seroconvirtieron después de la primera inoculación del tratamiento. Por el contrario, los ratones de los grupos 3-5 permanecieron seronegativos hasta el final del estudio. Se detectaron anticuerpos neutralizantes específicos del BVDV en el suero recolectado durante los tres períodos de muestreo en los días 15, 79 y 94 posteriores a la inmunización. Curiosamente, se observaron diferencias obvias en los niveles de anticuerpos entre los grupos después de la primera inmunización (Figura 4). En particular, los niveles de anticuerpos continuaron aumentando en los grupos inmunizados a lo largo del experimento. Por ejemplo, 2 semanas después de la primera inmunización, los grupos E2e y E2e + ISA 61 VG mostraron títulos de VN que variaron de 8 a 16 y de 8 a 128, respectivamente; Por lo tanto, estos grupos experimentales tenían niveles de anticuerpos más altos que los grupos control 3 y 4 (p < 0,05 y p < 0,001, respectivamente).
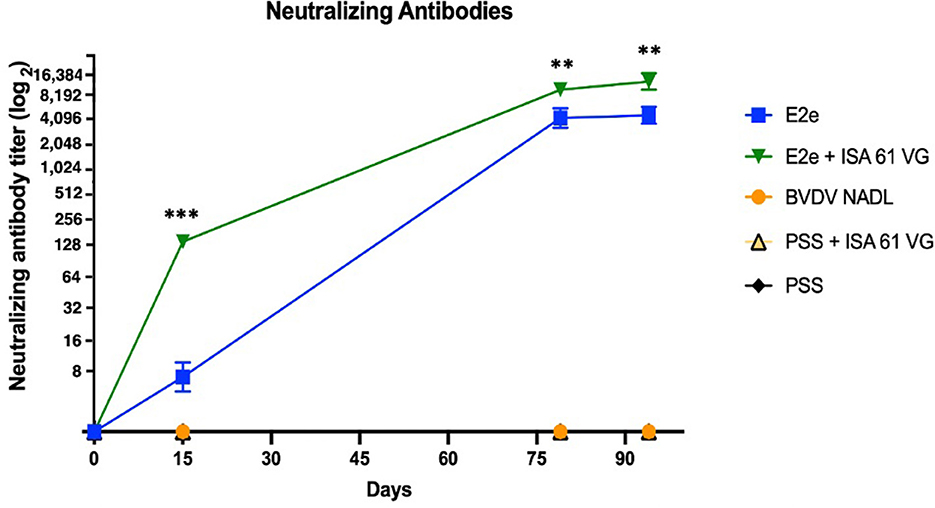 Figura 4. Título de anticuerpos neutralizantes. Comparación del título de neutralización viral de cada grupo experimental. Los anticuerpos neutralizantes fueron detectados por VNT. Los títulos se expresan como el recíproco de la dilución más alta que neutralizó la infectividad viral. p < 0,001, **p < 0,01.
Figura 4. Título de anticuerpos neutralizantes. Comparación del título de neutralización viral de cada grupo experimental. Los anticuerpos neutralizantes fueron detectados por VNT. Los títulos se expresan como el recíproco de la dilución más alta que neutralizó la infectividad viral. p < 0,001, **p < 0,01.
Además, la actividad neutralizante de los sueros del grupo 2 se estimó en 8.192 a los 7 días después del desafío viral y hasta 16.384 a los 21 días después del desafío viral. Por lo tanto, los títulos de VN fueron significativamente mayores en el grupo 2 que en el grupo 1 (p < 0,01), lo que indujo títulos de VN entre 2.048 y 4.096 en esos períodos de muestreo. En particular, aunque los grupos control 3 y 4 no provocaron ninguna actividad neutralizante detectable durante todo el ensayo de inmunización, el desafío viral del BVDV podría implicar el aumento del título de VNT en los grupos 1 y 2.
Ambos grupos inmunizados desarrollaron una respuesta humoral neutralizante más fuerte que el grupo control positivo 4 (p < 0,001). Cabe destacar que la vacunación con E2e + ISA 61 VG provocó un nivel de anticuerpos neutralizantes significativamente mayor en un corto período que el grupo 1 (p < 0,001). No se encontraron diferencias significativas entre los grupos 3 y 4. El análisis de los datos reveló una actividad de neutralización significativamente más fuerte en los grupos 1 y 2 en comparación con el grupo de control de BVDV NADL. No se detectó actividad de neutralización viral en el grupo control negativo.
Histopatología e inmunohistoquímica
Para evaluar la protección inmune contra el desafío al BVDV inducido por el protocolo de inmunización en los cuatro grupos experimentales de este estudio, se realizaron exámenes histopatológicos en los pulmones, el estómago, el hígado, el bazo, el intestino, los riñones y el cerebro a los 7 y 21 días después del desafío. Todos los animales desafiados con la cepa BVDV mostraron lesiones histopatológicas leves a graves, mientras que los ratones infectados simulados no mostraron lesiones. Se describen las lesiones histopatológicas encontradas en ratones después del desafío viral. Los pulmones de ratones inoculados con la cepa de referencia BVDV exhibieron neumonía intersticial leve a grave e hiperplasia leve de tejido linfoide asociado a bronquios (BALT). Del mismo modo, los pulmones de PPS + ISA 61 mostraron neumonía intersticial moderada a grave. Por el contrario, el grupo 2 no mostró cambios patológicos graves, mientras que el grupo 1 tuvo neumonía intersticial moderada.
El intestino de ratones inoculados con cepa de referencia BVDV y PPS + ISA 61 mostró una infiltración linfoide más severa que los de los grupos inmunizados. Los hígados de ratones infectados con cepas de referencia del BVDV mostraron necrosis coagulativa moderada. En contraste, solo un ratón del grupo E2e + ISA 61 mostró necrosis coagulativa leve, mientras que los hígados de ratones inmunizados con E2e mostraron necrosis coagulativa leve a moderada en hígados. Además, también se registró infiltración linfocítica leve a moderada (Figura 5). Además, se observó encefalitis leve a moderada y necrosis neural en los grupos de control positivo; sin embargo, en ratones inmunizados con E2e, no se observaron lesiones cerebrales, mientras que se observaron encefalitis incipiente a leve y necrosis neural en un ratón del grupo 3 a los 21 días posteriores al desafío. Se observó una depleción linfoide leve a moderada en el bazo de los grupos de control positivo, similar a los de ratones inmunizados con E2e; por el contrario, solo se observó una depleción linfoide leve en el grupo E2e + ISA 61.
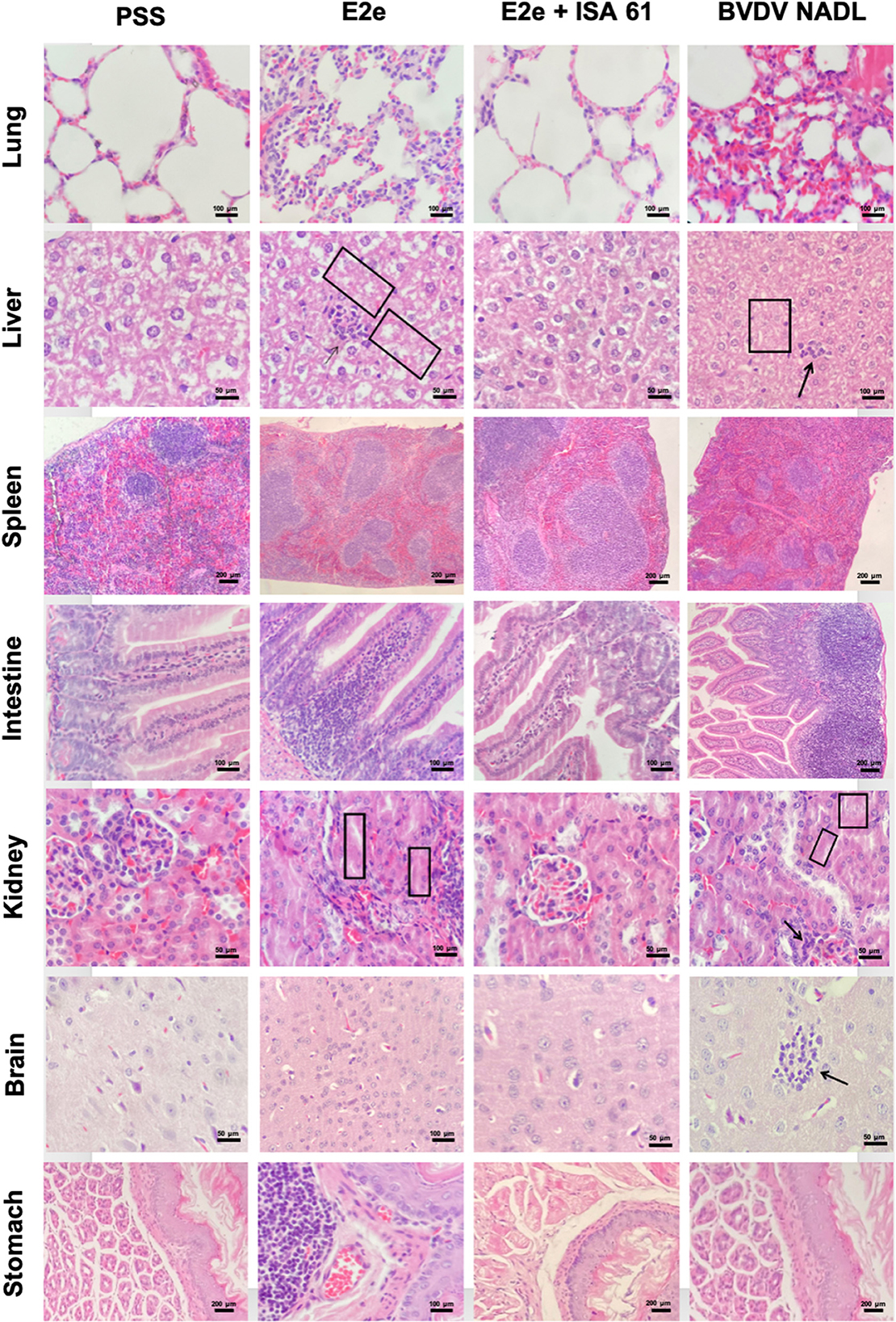 Figura 5. Características histopatológicas representativas de las secciones de pulmón, hígado, bazo, intestino, riñón, cerebro y estómago de ratones inmunizados y desafiados de los grupos experimentales 1-3. El Grupo 5 (PSS) se incluyó como control negativo y el Grupo 3 como control positivo. En comparación con el grupo de control negativo 5, los ratones inmunizados con formulación E2e sola y cepa BVDV NADL mostraron necrosis coagulativa e infiltración linfocítica en el hígado (cuadrados y flechas negras en el tejido hepático, respectivamente). Del mismo modo, los ratones de los grupos 1 y 3 exhibieron glomerulitis leve a moderada y necrosis tubular (flechas negras y cuadrados en los tejidos renales, respectivamente).
Figura 5. Características histopatológicas representativas de las secciones de pulmón, hígado, bazo, intestino, riñón, cerebro y estómago de ratones inmunizados y desafiados de los grupos experimentales 1-3. El Grupo 5 (PSS) se incluyó como control negativo y el Grupo 3 como control positivo. En comparación con el grupo de control negativo 5, los ratones inmunizados con formulación E2e sola y cepa BVDV NADL mostraron necrosis coagulativa e infiltración linfocítica en el hígado (cuadrados y flechas negras en el tejido hepático, respectivamente). Del mismo modo, los ratones de los grupos 1 y 3 exhibieron glomerulitis leve a moderada y necrosis tubular (flechas negras y cuadrados en los tejidos renales, respectivamente).
Los riñones de los dos grupos de control positivo exhibieron nefritis leve a moderada, glomerulitis y necrosis tubular. Los ratones inmunizados con E2e mostraron nefritis leve a moderada, glomerulitis y necrosis tubular, mientras que, en ratones inmunizados con E2e + ISA 61, no se encontraron lesiones en los riñones. Además, se observó hiperplasia moderada al tejido linfoide asociado al intestino (GALT) en los estómagos de ratones inoculados con PSS + ISA 61. Esta lesión también se encontró en los estómagos de ratones en el grupo E2e, mientras que no se encontraron lesiones en los estómagos de ratones en el grupo E2e + ISA 61 (Figura 5).
Para evaluar los efectos inmunoprotectores de E2e y los candidatos E2e + ISA 61, realizamos inmunohistoquímica (IHC) para evaluar la carga de antígenos del BVDV en los tejidos mencionados. Se detectó tinción positiva para el antígeno BVDV en cada tejido evaluado en ratones de los grupos BVDV NADL y PSS + ISA 61. No se detectó antígeno BVDV en el grupo control negativo. Se observaron diferencias significativas en los pulmones, el hígado y el cerebro entre los grupos experimentales. El antígeno BVDV se detectó prominentemente menos en los pulmones del grupo E2e + ISA 61 en comparación con los grupos E2e y PSS + ISA 61. Además, se detectó un aumento de la inmunopositividad en hígados de los grupos E2e, BVDV NADL y PSS + ISA 61 en comparación con el grupo E2e + ISA 61. Del mismo modo, se observó una tinción más intensa en los tejidos cerebrales del grupo E2e, BVDV NADL y PSS + ISA 61, mientras que, en el grupo E2e + ISA 61, solo un ratón mostró una detección mínima del antígeno BVDV (Figura 6).
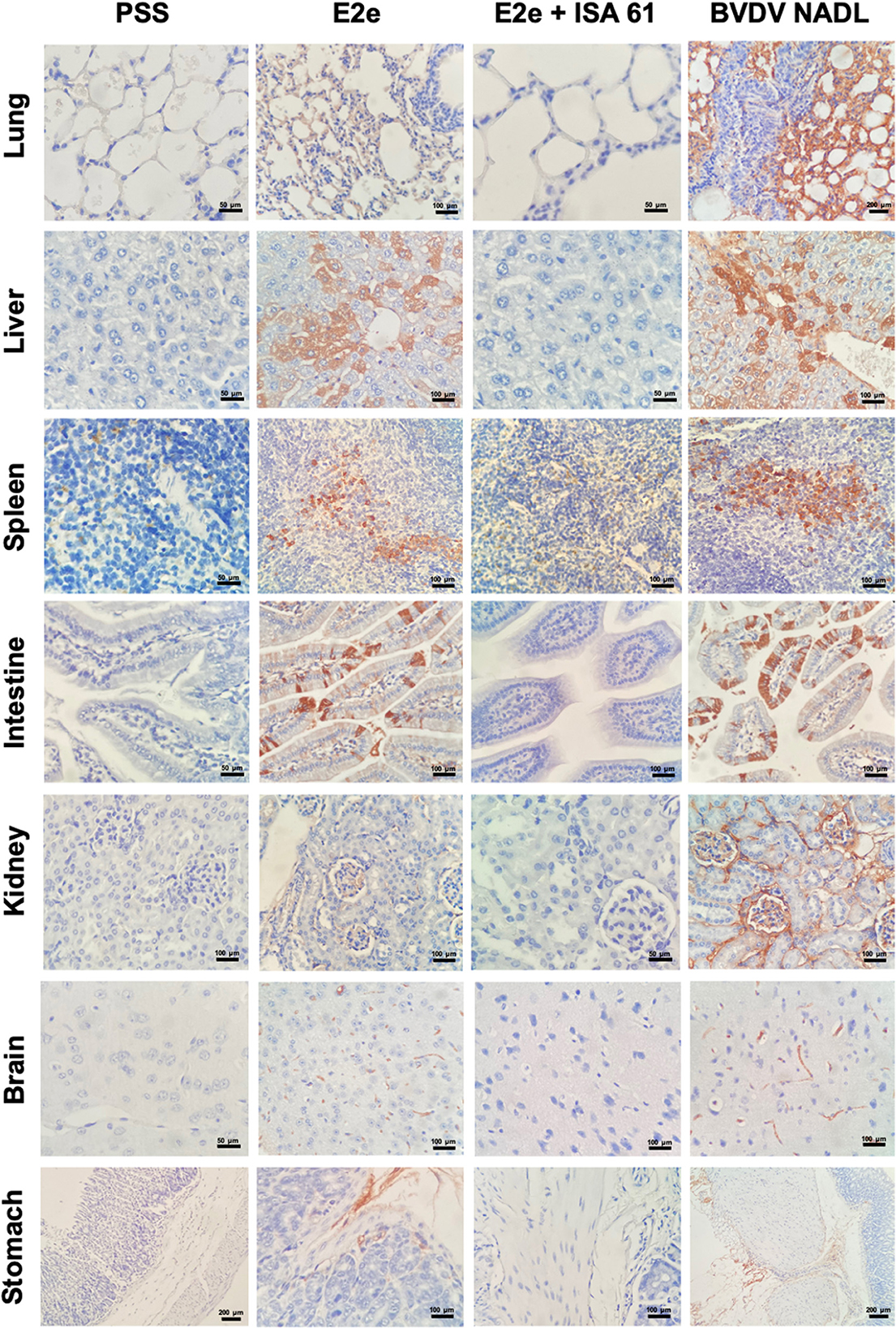 Figura 6. Tinción inmunohistoquímica del BVDV en tejidos de ratones inmunizados y desafiados. El antígeno BVDV se detectó en los pulmones, hígado, bazo, intestino, riñones, cerebro y estómago de ratones con inmunopositividad variable en los grupos experimentales 1-3, mientras que el grupo 5 (PSS) se incluyó como control negativo.
Figura 6. Tinción inmunohistoquímica del BVDV en tejidos de ratones inmunizados y desafiados. El antígeno BVDV se detectó en los pulmones, hígado, bazo, intestino, riñones, cerebro y estómago de ratones con inmunopositividad variable en los grupos experimentales 1-3, mientras que el grupo 5 (PSS) se incluyó como control negativo.
Discusión
El BVDV es prevalente en todo el mundo y es responsable de una combinación compleja de manifestaciones clínicas e inmunosupresión. Además, la infección por BVDV de ganado preñado con BVDV puede causar abortos, mortinatos y el nacimiento de animales inmunotolerantes al BVDV llamados animales persistentemente infectados (PI) (34). Por lo tanto, la infección por BVDV es una causa de pérdida económica sustancial para la industria ganadera (1). Actualmente, las medidas preventivas como la vacunación contra el BVDV no han logrado conferir una amplia protección contra las infecciones por BVDV; por lo tanto, la prevalencia del BVDV no se ha reducido (35). Además, a pesar de la disponibilidad de vacunas convencionales contra el BVDV, pueden ocurrir efectos no deseados, cuando se usan incorrectamente, como trastornos reproductivos como infecciones in utero, aborto y mortinatos en ganado preñado, recombinación con cepas de campo, desarrollo de la presentación de enfermedades de la mucosa en animales IP e inmunosupresión (36–38). Debido a los riesgos significativos de la aplicación de la vacuna contra el BVDV a animales susceptibles, el desarrollo de vacunas candidatas mejoradas, eficaces y seguras es vital para prevenir su aparición y transmisión. La glicoproteína BVDV E2 es altamente inmunogénica, contiene epítopos de células T dentro de los tres dominios antigénicos (39, 40); Por lo tanto, se describe como la proteína de la envoltura viral inmunodominante que contiene epítopos neutralizantes (41). Por lo tanto, los anticuerpos neutralizantes y la respuesta de las células T dirigida contra la glicoproteína E2 pueden conferir protección (42, 43).
Recientemente, se ha informado del desarrollo de varias formulaciones de vacunas que utilizan el gen E2 o la glicoproteína E2. Se describe la eficacia de la glicoproteína recombinante E2 utilizada como vacunas de subunidades en varias formulaciones. Estas formulaciones incluyen la emulsificación con nuevas plataformas adyuvantes, con preparaciones que combinan la glicoproteína recombinante E2 con BVDV inactivado, una combinación de glicoproteína recombinante E2 con vacuna de ADN que codifica glicoproteína E2, partículas similares a virus que expresan la glicoproteína E2. La versión truncada C-terminal de la glicoproteína recombinante E2 se utilizó como vacuna de subunidad. La eficacia de estas vacunas candidatas contra el BVDV se ha evaluado en modelos animales como cabras, conejillos de indias, bovinos y modelos de ratones con resultados prometedores. Dependiendo del estudio, la protección conferida contra la infección por BVDV se evidenció por una reducción en los signos clínicos como linfopenia y falta de pirexia, reducción en la diseminación viral, títulos de neutralización de anticuerpos y un aumento en los linfocitos CD4 y CD8 junto con los niveles de citoquinas para las respuestas inmunes humorales y celulares (12, 44-49).++
El modelo murino se ha utilizado para estudiar la patogénesis de otras enfermedades bovinas y las actividades de agentes antimicrobianos e inmunomoduladores para controlar las enfermedades bovinas (50, 51). Además, estudios previos realizados por Seong et al. (18) describieron lesiones histopatológicas como atrofia del glomérulo, engrosamiento de la pared alveolar, necrosis linfocitaria dentro del nódulo linfático y agotamiento de linfocitos en el bazo, además de linfopenia, leucopenia y trombocitopenia después de la infección por BVDV CP (18, 19). Del mismo modo, la infección aguda por BVDV en el ganado se caracteriza por neumonía intersticial con engrosamiento del tabique alveolar, agotamiento de linfocitos en los ganglios linfáticos, glomerulonefritis y linfopenia (22-24). Por lo tanto, la semejanza en alteraciones y lesiones tisulares causadas por la infección por BVDV hace que el modelo murino sea adecuado para la evaluación preliminar de candidatos vacunales.
En este estudio, evaluamos la respuesta inmune humoral y la protección contra la infección por BVDV en ratones, conferida por dos formulaciones de vacunas candidatas que incluían la proteína E2 recombinante del BVDV (E2e) sola y E2e con el adyuvante Montanide ISA 61 VG. Encontramos que la inmunización con E2e + ISA 61 provocó una respuesta inmune más fuerte y una mayor protección contra BVDV que los ratones inmunizados con E2e solos.
Los resultados obtenidos por RT-PCR indicaron que el ARN del BVDV podría detectarse fácilmente en la mayoría de los tejidos de ratones de los grupos BVDV NADL y PSS + ISA 61. Además, estos grupos mostraron un mayor porcentaje de positividad al BVDV. Por el contrario, los resultados de los grupos E2e y E2e + ISA 61 evidenciaron una menor detección de ARN del BVDV, siendo E2e + ISA 61 el grupo con un mayor porcentaje de negatividad del BVDV demostrada. El bajo nivel de detección puede atribuirse a una capacidad reducida del BVDV para infectar, replicar y distribuir en tejidos diana en ratones después de que el desafío BVDV se asoció con el uso de la vacuna candidata Descrita E2e + ISA 61.
La evaluación de las respuestas de anticuerpos neutralizantes provocadas por la inmunización es un criterio importante para determinar la eficacia de la vacuna. Estudios previos en ganado inmunizado han sugerido que se requiere un título mínimo de 216 para evitar el desarrollo de BVD clínica grave manifestada por fiebre, leucopenia, trombocitopenia y diarrea (52). Por el contrario, los estudios realizados por Beer et al. indicaron que los títulos de anticuerpos > 512 indican protección contra la infección por BVDV evidenciada por la falta de leucopenia y sin aislamiento viral del ganado con problemas (53). La seroconversión se detectó en ambos grupos inmunizados después de la primera inmunización; en particular, los títulos de VN continuaron aumentando en estos grupos y se mantuvieron durante todo el período experimental. Después de la primera inmunización, detectamos diferencias significativas en los títulos de anticuerpos de los grupos inmunizados debido a que la respuesta humoral provocada por el grupo E2e fue más débil que la inducida por el grupo E2e + ISA 61. Cabe destacar que, después del refuerzo, los títulos de VN 7 y 21 después del desafío siguen siendo más altos en el grupo E2e + ISA 61 que la respuesta estimulada en el grupo E2e. Por lo tanto, en general, el protocolo de inmunización con el grupo E2e + ISA 61 indujo una respuesta humoral temprana y más alta, suficiente para proporcionar protección. Esto último es sugerido por la reducción del ARN del BVDV y la detección de antígenos en los tejidos evaluados, ya que es probable que los niveles de anticuerpos se correlacionen positivamente con el nivel de protección (15). Curiosamente, no se detectó actividad neutralizante de anticuerpos en los grupos BVDV NADL y PSS + ISA 61. Esto es consistente con los resultados obtenidos por Ren et al., donde no se evidenció detección de anticuerpos 28 días después de la inoculación con la cepa de referencia BVDV NADL (54). En contraste, el ganado inmunizado puede mostrar altos títulos de anticuerpos neutralizantes del BVDV a partir de los 15 días posteriores a la inoculación del BVDV (55).
Posteriormente, se analizaron los efectos protectores de las vacunas candidatas mediante la evaluación de los cambios histopatológicos y la detección del antígeno BVDV en tejidos de ratones después del desafío viral. Los pulmones, el hígado y el cerebro de ratones en los grupos E2e, E2e + ISA 61, BVDV NADL y PSS + ISA 61 se dañaron en diferentes grados después del desafío BVDV. Sin embargo, el grupo E2e + ISA 61 exhibió daños menores entre los grupos. Del mismo modo, este grupo obtuvo un grado sustancialmente reducido de detección del antígeno BVDV en comparación con los otros grupos. Estos resultados son consistentes con los obtenidos en RT-PCR y VNT, lo que indica que el uso de la formulación E2e + ISA 61 como candidato a vacuna limitó la replicación del BVDV en ratones.
Por el contrario, la inmunopositividad y un mayor nivel de lesiones en los tejidos sugirieron una mayor replicación del BVDV; por lo tanto, se indujo una disminución de la protección cuando se utilizó E2e. Del mismo modo, la inmunización de ratones con proteína E2e recombinante provocó títulos de VN más altos; sin embargo, la respuesta inmune humoral desarrollada no confirió protección después del desafío BVDV. Esto fue apoyado por la detección del antígeno BVDV y el examen histopatológico, donde no se observaron diferencias significativas en comparación con las obtenidas en los grupos control positivos.
Se han descrito previamente varios estudios basados en la vacunación con glicoproteína E2 expresada en diferentes sistemas (44, 56–58); sin embargo, el uso de la glicoproteína E2 BVDV emulsionada aún no se ha descrito en el modelo de ratones. Además, nuestros hallazgos mostraron que, el uso de adyuvantes, como ISA 61 VG, confiere una mayor eficacia en la respuesta inmune; por lo tanto, esto constituye una alternativa interesante con un gran potencial para su uso en el control de BVD. Además, el uso de esta vacuna candidata podría ser una herramienta valiosa en los programas de control del BVDV para diferenciar entre animales vacunados e infectados (59).
Sin embargo, una de las limitaciones de nuestro estudio fue la falta de caracterización de la respuesta inmune celular en ratones inmunizados o la detección de marcadores moleculares para definir el perfil de respuesta inmune provocado por las formulaciones utilizadas en este estudio. Además, otros indicadores de protección inmune, como la viremia, la diseminación viral, la linfopenia y la trombocitopenia, deben considerarse para análisis adicionales.
En resumen, nuestros resultados indicaron que la emulsificación de la proteína E2e con la estrategia adyuvante y de refuerzo ISA 61 promueve una fuerte inmunidad humoral, que proporciona protección contra el desafío del BVDV en ratones que la inmunización E2e sola. Por lo tanto, la formulación E2e + ISA 61 representa un candidato a vacuna viable para la especie objetivo. Sin embargo, es necesario realizar estudios en el ganado bovino para evaluar su seguridad y eficacia y su posterior aplicación en las estrategias de control del BVDV. Además, es necesario realizar una comparación y correlación de la respuesta inmune inducida en ratones y bovinos utilizando la vacuna candidata de subunidades descrita aquí.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
El estudio en animales fue revisado y aprobado por el Subcomité de Cuidado y Uso de Animales de Experimentación (SICUAE) de la Facultad de Medicina Veterinaria de la Universidad Nacional Autónoma de México (FMVZ-UNAM).
Contribuciones del autor
NG-R, FB-A, AV-R, CA y SL participaron en el diseño, supervisión y análisis del estudio. NG-R realizó los experimentos y escribió el manuscrito. NG-R, LV-M y CC-P realizaron el ensayo inmunohistoquímico. LV-M y CC-P realizaron análisis histopatológicos e inmunohistoquímicos. La adquisición de fondos fue obtenida por FB-A, CA y SL. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este proyecto fue financiado por el Programa de Apoyo a Proyecto de Investigación e Innovación Tecnológica (PAPIIT) Proyecto No. IN217919 de la Facultad de Medicina Veterinaria de la Universidad Nacional Autónoma de México (FMVZ-UNAM).
Reconocimientos
Agradecemos a DVM Adolfo Ortiz-Rico por su asistencia con el cuidado y alojamiento de animales en la Unidad de Desafío Microbiológico de la Facultad de Medicina Veterinaria de la Universidad Nacional Autónoma de México (UNIDESMIC-FMVZ-UNAM).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Houe H. Impacto económico de la infección por BVDV en lecherías. Productos biológicos. (2003) 31:137–43. doi: 10.1016/S1045-1056(03)00030-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Smith DB, Meyers G, Bukh J, Gould EA, Monath T, Muerhoff AS, et al. Propuesta de revisión de la taxonomía del género pestivirus, familia flaviviridae. J Gen Virol. (2017) 98:2106–12. DOI: 10.1099/jgv.0.000873
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Yeşilbag K, Alpay G, Becher P. Variabilidad y distribución global de subgenotipos del virus de la diarrea viral bovina. Virus. (2017) 9:128. DOI: 10.3390/V9060128
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Gómez-Romero N, Basurto-Alcántara FJ, Verdugo-Rodríguez A, Bauermann FV, Ridpath JF. Diversidad genética del virus de la diarrea viral bovina en bovinos de México. J Vet Diagn Invest. (2017) 29:362–5. doi: 10.1177/1040638717690187
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Orban S, Liess B, Hafez SM, Frey HR, Blindow H, Sasse-Patzer B, et al. Estudios sobre la transmisibilidad transplacentaria de un virus de la vacuna contra la diarrea por virus bovino (BVD). I Inoculación de vacas preñadas 15 a 90 días antes del parto (190º a 265º día de gestación). Zentralbl Veterinarmed B. (1983) 30:619–34. doi: 10.1111/j.1439-0450.1983.tb01888.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Liess B, Orban S, Frey HR, Trautwein G, Wiefel W, Blindow H, et al. Estudios sobre la transmisibilidad transplacentaria de un virus de la vacuna contra la diarrea del virus bovino (BVD) en bovinos. II Inoculación de vacas gestantes sin anticuerpos neutralizantes detectables contra el virus BVD 90-229 días antes del parto (51º a 190º día de gestación). Zentralbl Veterinarmed. (1984) 31:669–81. doi: 10.1111/j.1439-0450.1984.tb01350.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Fritzemeier J, Haas L, Liebler E, Moennig V, Greiser-Wilke I. El desarrollo de la enfermedad de la mucosa de inicio temprano vs. tardío es una consecuencia de dos mecanismos patogénicos diferentes. Arco Virol. (1997) 142:1335–50. DOI: 10.1007/S007050050164
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Gogorza LM, Morán PE. «Vacunación y respuesta inmune del ganado contra la diarrea viral bovina», en Front. Immunol. Resumen de la conferencia: IMMUNOCOLOMBIA2015 – 11º Congreso de la Asociación Latinoamericana de Inmunología – 10o. Congreso de la Asociación Colombiana de Alergia, Asma e Inmunología (2015).
9. Reber AJ, Tanner M, Okinaga T, Woolums AR, Williams S, Ensley DT, et al. Evaluación de múltiples parámetros inmunes después de la vacunación con vacunas modificadas contra el virus de la diarrea viral bovina viva o muerta. Comp Immunol Microbiol Infect Dis. (2006) 229:61–77. doi: 10.1016/j.cimid.2006.01.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Kelling CL. Capítulo 50 – enfermedades virales del feto. En:Youngquist RS, Threlfall WR, , editores. Current Therapy in Large Animal Theriogenology, 2nd edn. Filadelfia: W.B. Saunders (2007). págs. 399–408.
11. Bolin SR, Ridpath JF. La glicoproteína E2 del virus de la diarrea viral bovina expresada en células de insectos proporciona a los terneros una protección limitada contra la infección sistémica y la enfermedad. Arco Virol. (1996) 141:1463–77. doi: 10.1007/BF01718248
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Chung YC, Cheng LT, Zhang JY, Wu YJ, Liu SS, Chu CY, et al. La proteína E2 recombinante mejora la eficacia protectora de la vacuna inactivada contra el virus de la diarrea viral bovina 2 en un modelo de cabra. BMC Vet Res. (2018) 14:194. DOI: 10.1186/S12917-018-1520-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Pecora A, Aguirreburualde MS, Aguirreburualde A, Leunda MR, Odeon A, Chiavenna S, et al. Seguridad y eficacia de una vacuna de subunidad de glicoproteína E2 producida en células de mamíferos para prevenir la infección experimental con el virus de la diarrea viral bovina en bovinos. Vet Res Commun. (2012) 36:157–64. DOI: 10.1007/S11259-012-9526-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Snider M, Garg R, Brownlie R, van den Hurk JV, van Drunen Littel-van den Hurk S. La proteína E2 del virus de la diarrea viral bovina formulada con un nuevo adyuvante induce respuestas inmunes fuertes y equilibradas y proporciona protección contra el desafío viral en el ganado. Vacuna. (2014) 32:6758–64. doi: 10.1016/j.vaccine.2014.10.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Ridpath JF. Inmunología de las vacunas contra el BVDV. Productos biológicos. (2013) 41:14–9. doi: 10.1016/j.biologicals.2012.07.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Sangewar N, Waghela SD, Yao J, Sang H, Bray J, Mwangi W, et al. Nuevos epítopos de células T CD8 inductores de IFN γ conservados entre diversas cepas del virus de la diarrea viral bovina. J Immunol. (2021) 206:1709–18. doi: 10.4049/jimmunol.2001424+
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Bolin SR. Especificidad viral y de proteínas virales de anticuerpos inducidos en vacas infectadas persistentemente con virus de la diarrea viral bovina no citopática después de la vacunación con virus de la diarrea viral bovina citopática. Am J Vet Res. (1988) 49:1040–4.
18. Seong G, Oem JK, Lee KH, Choi KS. Infección experimental de ratones con el virus de la diarrea viral bovina. Arco Virol. (2015) 160:1565–71. DOI: 10.1007/S00705-015-2412-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Seong G, Lee JS, Lee KH, Choi KS. La infección experimental con el virus de la diarrea viral bovina citopática en ratones induce megacariopoyesis en el bazo y la médula ósea. Arco Virol. (2016) 161:417–24. DOI: 10.1007/S00705-015-2649-Y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Quintana ME, Barone LJ, Trotta MV, Turco C, Mansilla FC, Capozzo AV, et al. In-vivo activity of IFN-λ and IFN-α against bovine-viral-diarrhea virus in a mouse model. Front Vet Sci. (2020) 7:45. DOI: 10.3389/FVETS.2020.00045
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Liu Y, Wu C, Chen N, Li Y, Fan C, Zhao S, et al. El bloqueo de PD-1 restaura la proliferación de linfocitos de sangre periférica e inhibe la apoptosis linfocitaria en un modelo de ratón BALB/c de infección aguda CP BVDV. Frente Immunol. (2021) 12:727254. doi: 10.3389/fimmu.2021.727254
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Risalde MA, Molina V, Sánchez-Cordón PJ, Romero-Palomo F, Pedrera M, Garfia B, et al. Mecanismos patogénicos implicados en la coagulación intravascular en los pulmones de terneros infectados por BVDV desafiados con BHV-1. Vet Res. (2013) 44:20. DOI: 10.1186/1297-9716-44-20
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Trang NT, Hirai T, Nabeta R, Fuke N, Yamaguchi R. Membranoproliferative glomerulonephritis in a calf with nephrotic syndrome. J Comp Pathol. (2014) 151:162–5. doi: 10.1016/j.jcpa.2014.05.001
24. Brodersen BW. Bovine viral diarrhea virus infections: manifestations of infection and recent advances in understanding pathogenesis and control. Vet Pathol. (2014) 51:453–64. doi: 10.1177/0300985813520250
25. Khorasani A, Madadgar O, Soleimanjahi H, Keyvanfar H, Mahravani H. Evaluation of the efficacy of a new oil-based adjuvant ISA 61 VG FMD vaccine as a potential vaccine for cattle. Iran J Vet Res. (2016) 17:8–12.
26. Hua RH, Huo H, Li YN, Xue Y, Wang XL, Guo LP, et al. Generation and efficacy evaluation of recombinant classical swine fever virus E2 glycoprotein expressed in stable transgenic mammalian cell line. PLoS ONE. (2014) 9:e106891. doi: 10.1371/journal.pone.0106891
27. Risk SA, El-Din WMG, Mahdy SE, Ibrahim EES, Fakhry HM. Gamma unterferon sssay for cellular immune response in cattle vaccinated with FMD vaccine adjuvanted with different montanide oils. Global J Med Res. (2015) 15:1.
28. Reed JL, Muench H. A simple method of estimating fifty percent endpoints. Am J Hyg. (1938) 27:493. doi: 10.1093/oxfordjournals.aje.a118408
29. Donofrio G, Bottarelli E, Sandro C, Flammini CF. Expression of bovine viral diarrhea virus glycoprotein E2 as a soluble secreted form in a Mammalian cell line. Clin Vaccine Immunol. (2006) 13:698–701. doi: 10.1128/CVI.00071-06
30. Mahony TJ, McCarthy FM, Gravel JL, Corney B, Young PL, Vilcek S, et al. Genetic analysis of bovine viral diarrhoea viruses from Australia. Vet Microbiol. (2005) 106:1–6. doi: 10.1016/j.vetmic.2004.10.024
31. Gurung RB, Purdie AC, Whittington RJ, Begg DJ. Cellular and humoral immune responses in sheep vaccinated with candidate antigens MAP2698c and MAP3567 from Mycobacterium avium subspecies paratuberculosis. Front Cell Infect Microbiol. (2014) 4:93. doi: 10.3389/fcimb.2014.00093
32. Finney DJ. Statistical Method in Biological Assay. 3rd ed. High Wycombe: Oxford University Press (1978).
33. Mooi E, Sarsted M. Cluster Analysis. Springer –Verlag Berlin Heidelberg editions A concise guide to market research (2011). p. 237–83.
34. Ridpath JF. Bovine viral diarrhea virus: global status. Vet Clin North Am Food Anim Pract. (2010) 26:105–21. doi: 10.1016/j.cvfa.2009.10.007
35. O’Rourke K. BVDV: 40 years of effort and the disease still has a firm hold. J Am Vet Med Assoc. (2002) 220:1770–3.
36. Becher P, Orlich M, Thiel HJ. RNA recombination between persisting pestivirus and a vaccine strain: generation of cytopathogenic virus and induction of lethal disease. J Virol. (2001) 75:6256–64. doi: 10.1128/JVI.75.14.6256-6264.2001
37. Thierauf P. Untersuchungen zur Epidemiologie, Diagnose und Immunprophylaxe von BVD/MD-Virusinfektionen in Milchviehzuchtbetrieben. (Thesis). München, Germany, LMU (1993).
38. Roth JA, Kaeberle ML. Suppression of neutrophil and lymphocyte function induced by a vaccinal strain of bovine viral diarrhea virus with and without the administration of ACTH. Am J Vet Res. (1983) 44:2366–72.
39. Deregt D, Bolin SR, van den Hurk J, Ridpath JF, Gilbert SA. Mapping of a type 1-specific and a type-common epitope on the E2 (gp53) protein of bovine viral diarrhea virus with neutralization escape mutants. Virus Res. (1998) 153:81–90. doi: 10.1016/S0168-1702(97)00129-9
40. Paton DJ, Lowings JP, Barrett AD. Epitope mapping of the gp53 envelope protein of bovine viral diarrhea virus. Virology. (1992) 190:763–72. doi: 10.1016/0042-6822(92)90914-B
41. Lokhandwala S, Fang X, Waghela SD, Bray J, Njongmeta LM, Herring A, et al. Preparación de la inmunidad específica del virus de la diarrea viral bovina de protección cruzada utilizando antígenos en mosaico vectorizados vivos. PLoS ONE. (2017) 12:E0170425. doi: 10.1371/journal.pone.0170425
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. van Oirschot JT, Bruschke CJ, van Rijn PA. Vacunación del ganado bovino contra la diarrea viral bovina. Veterinario Microbiol. (1999) 64:169–83. doi: 10.1016/S0378-1135(98)00268-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Deregt D, Dubovi EJ, Jolley ME, Nguyen P, Burton KM, Gilbert SA, et al. Mapeo de dos dominios antigénicos sobre la proteína NS3 del virus pestivirus de la diarrea viral bovina. Veterinario Microbiol. (2005) 108:13–22. doi: 10.1016/j.vetmic.2005.02.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Thomas C, Young NJ, Heaney J, Collins ME, Brownlie J. Evaluación de la eficacia de las vacunas candidatas a vacuna de subunidades E2 expresadas en mamíferos y baculovirus para el virus de la diarrea viral bovina. Vacuna. (2009) 27:2387–93. doi: 10.1016/j.vaccine.2009.02.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Pecora A, Malacari DA, Perez Aguirreburualde MS, Bellido D, Nuñez MC, Dus Santos MJ, et al. Desarrollo de una vacuna multivalente basada en E2 dirigida a APC contra el virus de la diarrea viral bovina tipos 1 y 2. Vacuna. (2015) 33:5163–71. doi: 10.1016/j.vaccine.2015.07.106
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Sadat SM, Snider M, Garg R, Brownlie R. Local innate responses and protective immunity after intradermal immunization with bovine viral diarrhea virus E2 protein formulado with a combination adjuvant in bovino. Vacuna. (2017) 35:3466–73. doi: 10.1016/j.vaccine.2017.05.029
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Cai D, Song Q, Duan C, Wang S, Wang J, Zhu Y, et al. Respuestas inmunes mejoradas a la proteína E2 y al ADN formulado con ISA 61 VG administrado como un régimen de refuerzo de proteína principal de ADN contra el virus de la diarrea viral bovina. Vacuna. (2018) 36:5591–9. doi: 10.1016/j.vaccine.2018.07.054
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Katsura M, Fukushima M, Kameyama KI, Kokuho T, Nakahira Y, Takeuchi K, et al. Las nuevas vacunas candidatas a vacuna de partículas similares al virus de la diarrea viral bovina (BVDV) que presentan la proteína E2 utilizando el sistema SpyTag / SpyCatcher inducen una respuesta robusta de anticuerpos neutralizantes en ratones. Arco Virol. (2023) 168:49. DOI: 10.1007/S00705-022-05653-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Lo YT, Ryan MD, Luke GA, Chang WC, Wu HC. Inmunogenicidad de una forma secretada, truncada C-terminalmente, de glicoproteína E2 del virus de la diarrea viral bovina como candidato potencial en el desarrollo de vacunas de subunidades. (2023) 13:296. DOI: 10.1038/S41598-022-26766-Y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Notebaert S, Meyer E. Modelos de ratón para estudiar la patogénesis y el control de la mastitis bovina. Una revisión. Veterinario Q. (2006) 28:2–13. doi: 10.1080/01652176.2006.9695201
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Bouté M, Carreras F, Rossignol C, Doz E, Winter N, Epardaud M, et al. El modelo de ratón C3HeB/FeJ recapitula el sello distintivo de las lesiones pulmonares de tuberculosis bovina después de la infección por Mycobacterium bovis aerogénea. Vet Res. (2017) 48:73. DOI: 10.1186/S13567-017-0477-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Bolin SR, Ridpath JF. Evaluación de la protección contra la infección sistémica o la enfermedad proporcionada por títulos bajos a intermedios de anticuerpos neutralizantes adquiridos pasivamente contra el virus de la diarrea viral bovina en terneros. Am J Vet Res. (1995) 56:755–9.
53. Beer M, Hehnen HR, Wolfmeyer A, Poll G, Kaaden OR, Wolf G, et al. Una nueva vacuna inactivada contra el VHBD de genotipo I y II. Un estudio de inmunización y desafío con BVDV genotipo I. Vet Microbiol. (2000) 77: 195-208. doi: 10.1016/S0378-1135(00)00276-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Ren X, Zhang S, Gao X, Guo X, Xin T, Zhu H, et al. La inmunización experimental de ratones con una vacuna recombinante de enterovirus bovino que expresa la proteína BVDV E0 provoca una respuesta serológica duradera. Virol J. (2020) 17:88. DOI: 10.1186/S12985-020-01338-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Alpay G, Yesilbag K. Neutralizing antibody titers against field strains of bovine viral diarrhea virus after vaccination with three commercial vaccines. Turco J Vet Anim Sci. (2019) 43:2. DOI: 10.3906/VET-1803-43
56. Loy JD, Gander J, Mogler M, Vander Veen R, Ridpath J, Harris DH, et al. Desarrollo y evaluación de una vacuna de partículas replicón que exprese la glicoproteína E2 del virus de la diarrea viral bovina (BVDV) en bovinos. Virol J. (2013) 10:35. doi: 10.1186/1743-422X-10-35
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Rosas CT, König P, Beer M, Dubovi EJ, Tischer BK, Osterrieder N, et al. Evaluación del potencial vacunal de un vector del herpesvirus equino tipo 1 que expresa proteínas estructurales del virus de la diarrea viral bovina. J Gen Virol. (2007) 88:748–57. doi: 10.1099/vir.0.82528-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Donofrio G, Sartori C, Franceschi V, Capocefalo A, Cavirani S, Taddei S, et al. Estrategia de doble inmunización con un péptido quimérico secretado por BoHV-4-vectorializado BVDV-E2/BoHV-1-gD. Vacuna. (2008) 126:6031–42. doi: 10.1016/j.vaccine.2008.09.023
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Chimeno Zoth S, Taboga O. ELISA recombinante múltiple para la detección de anticuerpos contra el virus de la diarrea viral bovina en sueros bovinos. J Virol Métodos. (2006) 138:99–108. doi: 10.1016/j.jviromet.2006.07.025
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cita: Gómez-Romero N, Arias CF, Verdugo-Rodríguez A, López S, Valenzuela-Moreno LF, Cedillo-Peláez C y Basurto-Alcántara FJ (2023) Protección inmune inducida por la glicoproteína recombinante E2 del virus de la diarrea viral bovina en un modelo murino. Frente. Vet. Sci. 10:1168846. doi: 10.3389/fvets.2023.1168846
Recibido: 20 de febrero de 2023; Aprobado: 30 de mayo de 2023;
Publicado: 22 junio 2023.
Editado por:
Rajeev Ranjan, ICAR-Instituto Nacional de la Fiebre Aftosa, India
Revisado por:
Giulia Franzoni, Instituto Zooprofiláctico Experimental de Cerdeña (IZS), Italia
Lisanework Ayalew, Universidad de la Isla del Príncipe Eduardo, Canadá
Pavulraj Selvaraj, Universidad Estatal de Luisiana, Estados Unidos
Copyright © 2023 Gómez-Romero, Arias, Verdugo-Rodríguez, López, Valenzuela-Moreno, Cedillo-Peláez y Basurto-Alcántara. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Francisco Javier Basurto-Alcántara, basurto@unam.mx
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

