Rinotraqueítis bovina infecciosa: causas, signos y opciones de control
Rinotraqueítis bovina infecciosa: causas, signos y opciones de control
- Adam Martin analiza los signos clínicos, el diagnóstico y las estrategias de prevención, incluidos los protocolos de vacunación, de una enfermedad grave y endémica que afecta al ganado británico.
El herpesvirus bovino tipo uno (BHV-1) se identificó y notificó por primera vez como la causa de la rinotraqueítis infecciosa bovina (IBR) a principios de la década de 1950.
Desde entonces, se ha descubierto que el BHV-1 es responsable de una amplia gama de afecciones, incluidas enfermedades reproductivas (vulvovaginitis pustulosa infecciosa en vacas, balanopostitis pustulosa infecciosa en toros), aborto, infertilidad, mastitis, conjuntivitis, enteritis, encefalitis, der
En parte, el tipo de enfermedad depende de la cepa de BHV-1 que infecte a un animal enfermo. El patógeno causa una pérdida económica considerable y tiene un grave impacto en el bienestar de un animal individual. A pesar de esto, el IBR y otras enfermedades causadas por el VHB-1 son endémicas en el Reino Unido y en la mayor parte del mundo.
Presentación más común
IBR es la presentación clínica más común de BHV-1. La IBR es una enfermedad de las vías respiratorias superiores que afecta a los bovinos generalmente de seis meses o más.
Puede presentarse como una enfermedad relativamente leve, causando pirexia transitoria con o sin conjuntivitis, causando una ligera caída en el apetito o en el rendimiento de leche. En brotes más graves, la tos es común y suele durar de dos a tres semanas antes de disminuir. Sin embargo, en casos graves, los animales pueden morir de una neumonía grave complicada por una infección bacteriana secundaria.
Vale la pena señalar que la IBR puede afectar a los terneros jóvenes, causando encefalitis, enteritis y neumonía, aunque esto es raro. Si los terneros se ven afectados de esta manera, la mortalidad es alta.
Después de que los animales han sufrido una infección primaria por el VHB-1, se convierten en portadores latentes de por vida del virus. Esta latencia generalmente se establece en el ganglio trigémino o en las amígdalas faríngeas, aunque los ganglios sacros son el sitio de latencia después de la infección genital. Los animales infectados latentemente no necesitan eliminar el virus, aunque, en todos los casos, pero en muy raros, producen anticuerpos contra el virus.
Periódicamente, el virus latente se reactivará y la eliminación se reanudará. En estas circunstancias, puede producirse transmisión viral. La reactivación del virus suele ocurrir en animales estresados (mal tiempo, mala cría) o después de eventos estresantes (pantorcimiento, transporte, mezcla de grupos de animales). Se ha demostrado que el tratamiento de animales infectados latentemente con corticosteroides provoca la pérdida viral.

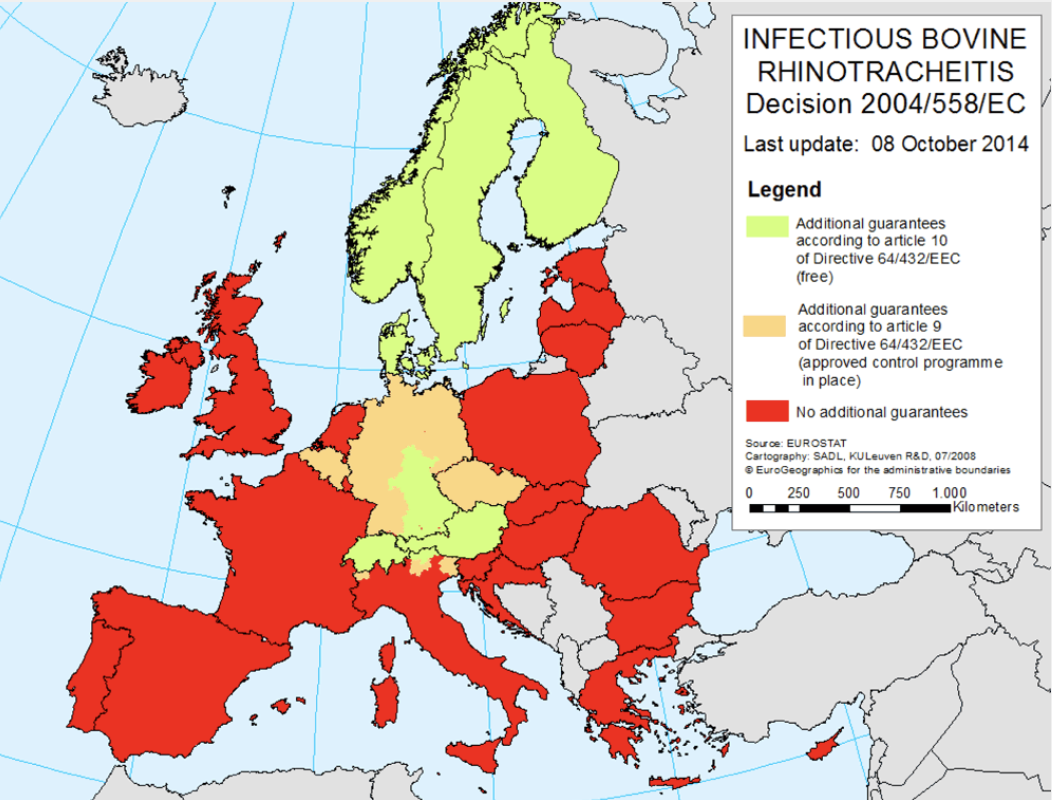
Prevalencia del IBR en Europa y el Reino Unido
Se ha encontrado que la prevalencia a nivel de rebaño de BHV-1 en el Reino Unido varía entre el 43 % y el 84 %, dependiendo de la región y la clase de ganado encuestado. Seis países de Europa (Austria, Dinamarca, Finlandia, Noruega, Suecia y Suiza) han logrado erradicar el BHV-1 de sus poblaciones de ganado tras la introducción de programas de control en la década de 1980. Las regiones de Alemania e Italia también están libres de BHV-1.
En varios otros estados europeos se están llevando a cabo programas de control voluntario u obligatorio. Los países con programas de erradicación en vigor reciben garantías adicionales con respecto al comercio intracomunitario, que tiene el potencial de tener un grave impacto en los mercados de exportación de otros Estados miembros. Por ejemplo, antes de que Bélgica introdujera un programa de erradicación, la República de Irlanda exportaba 20 877 cabezas de ganado allí. En los 12 meses posteriores a la concesión de garantías adicionales en 2014, el número cayó a 405, una reducción del 98 %. En consecuencia, el control del BHV-1 tiene importantes consecuencias económicas.
Muchos de los factores de riesgo de infección por BHV-1 son similares a muchos de las enfermedades infecciosas. El aumento de la edad aumenta el tiempo de riesgo de exposición al patógeno, por lo que la seropositividad BHV-1 aumenta a medida que los animales envejecen. Curiosamente, el tiempo pico para la seroconversión parece ser en animales menores de dos años, lo que podría estar relacionado con las prácticas de manejo. Los toros suelen tener una seroprevalencia más alta que las vacas. Se cree que esto es el resultado de una mayor mezcla con los animales.
Aumento de la seroprevalencia
En general, también se ha demostrado que el aumento del tamaño del rebaño está asociado con un aumento de la seroprevalencia. La razón de esto es que cada animal tiene un mayor número de contactos de transmisión. Además, trabajos anteriores, no específicos del BHV-1, han demostrado que el tamaño del rebaño es con frecuencia una medida indirecta de otros factores de riesgo de enfermedad, como el estrés, otros patógenos y el aumento de la compra de animales. Como era de esperar, el contacto directo con animales de otros rebaños es un factor de riesgo. Sin embargo, el número de rebaños, la distancia entre los rebaños adyacentes y la densidad de ganado en cualquier área también afectan al riesgo de seropositividad al BHV-1. Esto se ha reconocido en algunos de los planes de control con sede en el Reino Unido, donde se requiere una doble cerca para reducir el potencial de contacto entre heredales.
Transmisión
El BHV-1 sobrevive relativamente mal en el medio ambiente, por lo que la mayoría de la infección se produce después del contacto directo de animales o fluidos animales, por ejemplo, moco o semen. Si bien se considera que el BHV-1 es patógeno exclusivamente para el ganado, algunas pruebas muestran que otros rumiantes pueden ser infectados por el virus y eliminarlo. No se cree que otras especies además del ganado desempeñen un papel en la epidemiología de la enfermedad. Sin embargo, se sabe que se encuentran virus herpes similares que comparten una serie de antígenos en otras especies.
Serológicamente, es imposible determinar la diferencia entre el BHV-1 y los virus del herpes estrechamente relacionados de otras especies, por ejemplo, el herpesvirus caprino tipo uno o el herpesvirus de alces uno.
También han surgido problemas en los programas de control cuando las especies no bovinas han dado positivo para anticuerpos BHV-1, especialmente si el resultado positivo representa una infección activa por BHV-1 o si representa un virus del herpes relacionado adaptado a otra especie.
Opciones de control
Esencialmente, se utilizan dos estrategias principales para controlar el VHB-1: una prueba de infección y una estrategia de sacrificio o una estrategia basada en la vacunación. Si la prevalencia en una población es relativamente baja, la estrategia más eficaz para la erradicación de la enfermedad es analizar a los animales y sacrificar los positivos. Fundamental para esta estrategia es la idea de que se desarrolle un grupo libre de animales reproductores de enfermedades y, por lo tanto, se proteja de la enfermedad a medida que los animales seropositivos sean sacrificados del rebaño y los seronegativos los reemplacen.

Sin embargo, los esquemas de erradicación están lejos de ser perfectos. El peligro siempre existe de que un animal seronegativo infectado latente permanezca en la población y propague la enfermedad. Un estudio investigó cómo era posible e identificó que la infección latente era posible en animales jóvenes que habían sido vacunados pasivamente contra el IBR como terneros.
Vacunación
La estrategia alternativa de vacunación está dirigida más adecuadamente a las poblaciones con una alta prevalencia del virus, o donde hay una baja prevalencia, pero la población está en riesgo de infectarse. Por lo tanto, a pesar de una baja prevalencia del VHB-1 en la granja, la vacunación puede seguir siendo una medida de control adecuada si el riesgo de exposición al virus es alto.
La capacidad del BHV-1 para volverse latente inicialmente causó problemas al diferenciar entre los animales vacunados seropositivos que no tenían la capacidad de eliminar el virus y los animales infectados con virus salvajes que sí lo tenían. Sin embargo, durante muchos años se han dispondido de «vacunas de marcadores» que permiten diferenciar los grupos infectados vacunados y salvajes.
La diferenciación entre estos grupos es posible, ya que la vacuna contiene cepas virales de las que se han eliminado una o más glicoproteínas en comparación con la cepa salvaje. Esto significa que la infección salvaje de la cepa BHV-1 da lugar a una respuesta de anticuerpos a las glicoproteínas que no están presentes en la cepa vacunada. Esta respuesta se puede medir mediante pruebas de diagnóstico, como los ELISA.
Si bien el desarrollo de vacunas marcadoras ha ayudado enormemente al control del BHV-1, vale la pena señalar que la diferenciación entre animales infectados vacunados y salvajes solo se puede hacer si se realiza la serología. Las pruebas de diagnóstico realizadas en la leche, como el control de muestras de leche a granel, no hacen diferenciación entre el ganado infectado vacunado y el salvaje, lo cual es problemático.
Además, al igual que con todos los ELISA de diagnóstico, se han asignado umbrales de diagnóstico (recortes) a cada diagnóstico. Con estos valores de corte vienen las sensibilidades y especificidades asociadas entre las pruebas. Estos pueden variar considerablemente, algo que dificulta la vigilancia y evaluación efectivas de las poblaciones vacunadas.
Desprendimiento viral
La vacunación contra el IBR no impide la eliminación del virus de los animales que estaban infectados latentemente con él antes de la vacunación. Sin embargo, la vacunación de animales infectados latentemente reduce la desprendimiento viral cuando se desafía a los animales infectados.
Los estudios controlados y los estudios de campo han demostrado que los brotes importantes de IBR siguen siendo posibles, y ocurren, en rebaños vacunados, aunque, por lo general, las vacunas son eficaces para controlar el IBR, independientemente de si se ha utilizado una vacuna viva o atenuada.
Vale la pena destacar, sin embargo, las vacunas son, en general, extremadamente eficaces para controlar la enfermedad y las vacunas marcadoras siempre deben tenerse en cuenta al abordar un problema IBR.
En el Reino Unido, varios laboratorios ofrecen un servicio de acreditación de pruebas y estándares de certificación de ganado (CHeCS). Las pruebas y la acreditación como libres de BHV-1 son un objetivo al que los productores de reproductores del Reino Unido deberían aspirar definitivamente. Además, también deben considerar una serie de requisitos de cría, como la doble cerca de los campos con ganado contiguo y la cuarentena de nuevos animales antes de que entren en un rebaño.
La acreditación CHeCS de un rebaño comienza una vez que se descubre que todos los animales mayores de 12 meses son negativos en dos pruebas realizadas con no menos de cuatro semanas y con no más de un año de diferencia. Después de esto, el estado libre de enfermedad se mantiene a través de pruebas regulares combinadas con pruebas específicas de animales, incluidos los que han abortado o han dado a luz a un ternero nacido muerto, animales clínicamente enfermos que puedan haber tenido IBR o cualquier animal comprado. El sistema CHeCS permite que las granjas sean acreditadas como «BHV-1 erradicada del rebaño» o como «vacunadas supervisadas libres». Se considera que el primero tiene el estado de salud más alto.
Los beneficios a corto plazo de la erradicación del BHV-1 pueden no ser evidentes de inmediato, o pueden no existir, para todos los agricultores. Sin embargo, es probable que el costo a largo plazo sea mucho menor que las pérdidas, especialmente porque el comercio internacional estará cada vez más vinculado al estatus de IBR.
Resumen
El IBR es una enfermedad grave y endémica en el Reino Unido. Un número cada vez mayor de socios comerciales en Europa han iniciado programas nacionales de control y erradicación de enfermedades. Si bien estos programas pueden ser complicados y enfrentarse a dificultades, no cabe duda de que mejorarán la salud y el bienestar del ganado en estos países. Si se puede mantener el estatus de libre de enfermedades una vez que se haya logrado, también resultará beneficioso desde el punto de vista financiero.
Se espera que la creciente presión de Europa, además de una creciente comprensión de los beneficios y la importancia de la erradicación de enfermedades, signifique que un número creciente de agricultores progresistas comiencen a controlar el IBR.
Referencias
- Straub OC (2001). Avances en la investigación BHV-1 (IBR), Deutsche Tierärtzliche Wochenschrift 108(10): 419-422.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

