Seguimiento de la transmisión del virus porcino en embriones derivados de ovocitos de mataderos comerciales
Seguimiento de la transmisión del virus porcino en embriones derivados de ovocitos de mataderos comerciales
 Brent Pepin1*
Brent Pepin1*  Paula Rodríguez-Villamil2
Paula Rodríguez-Villamil2  Lauren Sammel3
Lauren Sammel3  Jie Yin3
Jie Yin3  Brian Dacken1
Brian Dacken1- 1Cytotheryx, Inc., Rochester, MN, Estados Unidos
- 2Recombinetics, Inc., Eagan, MN, Estados Unidos
- 3Sustainable Swine Resources LLC, Watertown, WI, Estados Unidos
Los cerdos son fundamentales en la agricultura y la investigación biomédica y son prometedores para los xenotrasplantes. Los rebaños libres de patógenos específicos (SPF, por sus siglas en inglés) son esenciales para la producción porcina comercial y las instalaciones de investigación de xenotrasplantes. Los rebaños comerciales tienen como objetivo salvaguardar la salud, el bienestar y la productividad de los animales, y las instalaciones de investigación requieren el estado de SPF para proteger a los pacientes inmunodeprimidos. Los embriones de transferencia nuclear de células somáticas (SCNT, por sus siglas en inglés) son la norma para producir animales clonados y editados genéticamente. Los ovocitos para la reconstrucción embrionaria se obtienen más convenientemente de mataderos comerciales con estados de enfermedad poco claros. Sin embargo, la investigación sobre la eliminación viral de los ovocitos de donantes durante la reconstrucción embrionaria sigue siendo limitada. Se ha demostrado previamente que la SCNT reduce la transmisión del virus del síndrome respiratorio y reproductivo porcino, el virus de la diarrea viral bovina, el circovirus porcino tipo 2 y el parvovirus porcino. Aun así, carece de otros patógenos, incluidos los virus endógenos. Este proyecto contiene dos estudios preliminares que investigan la detección por ensayo de reacción en cadena de la polimerasa (PCR) de virus porcinos comunes a través de las fases de producción de embriones partenogénicos y SCNT. Los patógenos exógenos detectados en el tejido donante de ovocitos o en los medios de maduración de ovocitos no se detectaron en los embriones producidos. El retrovirus endógeno porcino tipo C (PERVC) no se eliminó mediante la activación del embrión partenogénico y se detectó en 1 de los 2 embriones SCNT analizados reconstruidos utilizando una línea celular PERVC negativa. La SCNT y la construcción de embriones partenogénicos redujeron de manera similar la detección de virus exógenos. La construcción de embriones SCNT ayudó a reducir la detección de virus endógenos. Este proyecto demuestra la importancia del cribado de embriones para virus endógenos y muestra la utilidad de los embriones partenogénicos en futuros estudios de eliminación de virus exógenos.
1 Introducción
Mantener un alto estado de salud en la producción comercial de carne de cerdo es vital para mejorar el bienestar animal, optimizar la utilización de los alimentos, reducir los costos de producción y minimizar el uso de antibióticos (1-3). A medida que avanza la tecnología de edición de genes, existe un creciente interés en la SCNT junto con la edición de genes para producir animales resistentes a enfermedades o de mayor producción (1-3). Esta tecnología también ofrece un medio para preservar la valiosa genética animal (4-7). Los cerdos modificados genéticamente son prometedores para los xenotrasplantes al reducir la tasa de rechazo de órganos y facilitar el desarrollo de modelos biomédicos (4-7). Sin embargo, el uso de órganos porcinos en el trasplante corre el riesgo de transmisión de enfermedades zoonóticas a huéspedes inmunodeprimidos, incluso con patógenos que no suelen estar asociados con enfermedades humanas (8-11).
Se ha demostrado que la cría de cerdos en instalaciones de SPF y el uso de SCNT para producir cerdos minimizan la exposición a patógenos (9-11). Sin embargo, los mataderos comerciales son la fuente común de recolección de ovocitos y reciben cerdos con estados de enfermedad desconocidos, lo que representa un riesgo de exposición a las instalaciones de SPF a través de la contaminación o infección de ovocitos (10, 12). La SCNT ha demostrado una reducción de la transmisión del virus del síndrome respiratorio y reproductivo porcino (PRRSV), el virus de la diarrea viral bovina (BVDV), el circovirus porcino tipo 2 (PCV2) y el parvovirus porcino (PPV) cuando los ovocitos se lavan adecuadamente después de la recolección, pero los datos sobre otros virus son limitados (10, 12, 13).
Los virus porcinos citados como una posible preocupación para el xenotrasplante incluyen el circovirus porcino tipo 1 (PCV1), el PCV2, el circovirus porcino tipo 3 (PCV3), el citomegalovirus porcino (PCMV), el virus de la hepatitis E porcina (VHE), el virus de la encefalomielitis hemaglutinante porcina (PHEV), el herpesvirus linfotrópico porcino 1, 2 y 3 (PLH1, PLH2, PLH3) y el PERVC (12, 14–16). Además, otros virus, aunque potencialmente no son relevantes para los xenotrasplantes, pueden afectar la salud y la producción de las instalaciones de SPF, incluidos el virus de la influenza A (IAV), el PPV, el virus de la diarrea endémica porcina (PEDV), el virus de la gastroenteritis transmisible (TGEV), el coronavirus delta porcino (PDCoV), el rotavirus porcino A, B y C (ROTA, ROTB, ROTC) y el virus del Valle de Séneca (SVV).
Los embriones partenogénicos pueden aumentar el número de embriones para la evaluación sin completar el complicado proceso de reconstrucción del SCNT (17, 18). Los embriones partenogénicos son ovocitos no fertilizados que se activan en embriones que no pueden progresar más allá de las primeras etapas de desarrollo y no producen embarazos a término (17, 18). Los embriones partenogénicos pueden permitir una alternativa más accesible a la clonación de SCNT a la hora de detectar el riesgo viral potencial de los ovocitos para la reconstrucción embrionaria al aumentar el número de embriones disponibles para las pruebas diagnósticas.
Las normas actuales para las pruebas de ovocitos o embriones para la clonación de SCNT dentro de las piaras de cerdos SPF requieren el desarrollo y el acuerdo dentro de la industria. Este proyecto tiene como objetivo ampliar el conocimiento de la industria mediante la prueba piloto de embriones partenogénicos como método de detección de virus preocupantes. Además, el proyecto busca rastrear virus tanto exógenos como endógenos desde la recolección de ovocitos hasta la reconstrucción embrionaria.
Este proyecto comprende dos estudios preliminares diseñados para evaluar los posibles puntos de prueba y evaluar el riesgo de transmisión de la enfermedad desde ovocitos recogidos en mataderos comerciales hasta embriones reconstruidos. El estudio 1 se centra en la activación de embriones partenogenéticos para determinar su idoneidad para los estudios de eliminación de virus, mientras que el estudio 2 utiliza embriones clonados con SCNT, representativos del proceso de clonación. Ambos estudios emplean ensayos de PCR para detectar patógenos virales porcinos en varias etapas de la recolección de ovocitos hasta la formación de embriones, con la intención de mitigar los riesgos potenciales para los recibos de xenotrasplantes y la producción de rebaños de SPF.
2 Materiales y métodos
2.1 Preparación de los medios
Las soluciones madre de los medios de maduración A (MMA) y B (MMB) se prepararon siguiendo los métodos descritos anteriormente (19). En resumen, la MMA se forma combinando 500 ml de Medium 199 (MilliporeSigma, St. Louis, MO, Estados Unidos) con 0,5 g de alcohol polivinílico, 0,15 g de bicarbonato de sodio y 10 μg/ml de gentamicina. El MMB se prepara combinando 100 mL de MMA, 0,055 g de glucosa y 0,001 g de piruvato de sodio (19).
El medio de maduración de ovocitos (OMM) se formó a partir de una solución madre de MMB utilizando métodos descritos anteriormente (19). En resumen, 40 mL de MMB se combinan con 10 ng/mL de factor de crecimiento epidérmico, 0,5 μg/mL de hormona luteinizante, 0,5 μg/mL de hormona folículo estimulante, 0,57 mM de L-cisteína, 40 ng/mL de factor de crecimiento de fibroblastos 2 y 20 ng/mL de factor inhibidor de la leucemia y luego se incuban a 38,5 °C.
Los medios de retención y los medios de lavado fueron una solución HEPES (MilliporeSigma, St. Louis, MO, Estados Unidos) modificada utilizando métodos descritos anteriormente (19). En resumen, se combinaron 2,383 g de solución HEPES con 6,663 g de NaCl, 0,239 g de KCl, 0,168 g de NaHCO3, 0,041 g NaH2PO4, 1,868 g de lactato de sodio, 0,102 g de MgCl2·2H2O, 0,294 g CaCl2·2H2O, 0,1 g de alcohol polivinílico, 2,186 g de sorbitol, 0,022 g de piruvato de sodio, 10 μg/ml de gentamicina y 0,01 g de rojo de fenol, seguido de filtrado a través de un filtro de 0,22 μM (19).
2.2 Proceso de recolección de ovocitos
Los ovocitos se recolectaron y prepararon en mataderos de Abbyland y Watertown, Wisconsin, a partir de los ovarios derivados de cerdas después de la eutanasia en un matadero local bajo procedimientos de procesamiento estándar. Brevemente, los ovarios recién obtenidos se transportaron a las instalaciones del laboratorio in situ e inmediatamente se lavaron en solución salina fisiológica calentada que contenía 10 μg/ml de gentamicina. Los folículos ováricos (de 3 a 5 mm de diámetro) se aspiraron con una aguja de calibre 18 unida a una jeringa de 10 ml. Los aspirados se colocaron en un tubo cónico de 50 mL y se dejaron reposar en un baño de agua a 38,5 °C. Después de desechar el sobrenadante de líquido folicular, el gránulo se resuspendió 1:1 (v/v) en un medio de retención para su lavado. Este paso de lavado se repitió tres veces antes de transferir el líquido folicular limpio a una placa de Petri de 100 mm y se buscó con un microscopio de disección. Los ovocitos con un citoplasma de color homogéneo y al menos dos capas de células cúmulos se transfirieron mediante una pipeta de denudación y manipulación (CooperSurgical, Inc., Trumbull, CT) a una placa de Petri de 35 mm de medios de retención antes de ser colocados en OMM equilibrados a 38,5 °C y 5% de CO2. Los complejos ovocitos del cúmulo se transfirieron a tubos de 1,5 mL que contenían un OMM equilibrado. Los tubos se sellaron con parafilm antes de ser enviados durante la noche a Recombinetics, Inc. en Eagan, Minnesota, en una incubadora de transporte que puede contener todos los tubos a una temperatura constante de 38,5 °C.
2.3 Estudio 1: embriones partenogénicos
El estudio 1 analizó múltiples patógenos en OMM, ovocitos de donantes y embriones partenogénicos activados de esos ovocitos. Los patógenos que se analizaron fueron BVDV, PRRSV, PCV1, PCV2, PCV3, PPV, PCMV, PDCoV, TGEV, PEDV, SVV, HEV, IAV, PERVC, PHEV, PLH1, PLH2, PLH3, ROTA, ROTB y ROTC. Estos patógenos fueron seleccionados dada su prevalencia en piaras porcinas comerciales o, en el caso del BVDV, la preocupación por la investigación de xenotrasplantes.
Los ovocitos (n = 300) fueron transportados a 38,5°C en OMM (OMM-1 para muestreo). Después de 24 h, los ovocitos se lavaron y se transfirieron a pocillos de 500 μL de OMM fresco (OMM-2 para muestreo) durante 18 h. Después de su uso, se recolectó una muestra de 3 ml de OMM-1 y OMM-2 para pruebas diagnósticas.
Después de 18 h, 60 ovocitos fueron separados y sometidos a pruebas diagnósticas, y el resto de los ovocitos maduros (n = 200) fueron activados químicamente, como se describió anteriormente, para producir embriones partenogénicos (17). En resumen, los ovocitos se expusieron a 5 μM de ionomicina tamponado con HEPES suplementado con albúmina sérica bovina y se incubaron durante 4 h, seguido de un cultivo en medio PZM-3 durante 7 días (17). Después de una evaluación de 7 días, se recolectaron 150 embriones partenogénicos y se enviaron para la detección de patógenos. Todas las muestras se enviaron al Laboratorio de Diagnóstico Veterinario de la Universidad de Minnesota, un laboratorio totalmente acreditado por la Asociación Americana de Diagnosticadores de Laboratorios Veterinarios, y se analizaron mediante ensayos de diagnóstico por PCR de acuerdo con los procedimientos de diagnóstico estándar del laboratorio utilizando los puntos de corte del umbral de ciclo (ct) proporcionados por el laboratorio. Se consideró positiva una tomografía axial interauricular <35. El PHEV fue positivo con CT <36, sospechoso a ≥36 pero <45. PRRSV, PEDV, TGEV y PDCoV fueron positivos en la ct <40. Los VPH se analizaron mediante PCR por electroforesis en gel estándar con resultados positivos o negativos. Todos los demás virus fueron positivos con ct <36, sospechoso a ≥36 pero <40.
2.4 Estudio 2: Embriones producidos por SCNT
En el estudio 2 se probaron PCV2, PCV3, PCMV y PERVC mediante ensayos de PCR durante todo el proceso de recolección de ovocitos en embriones reconstruidos con SCNT. Se realizaron diagnósticos por PCR en el tejido de la cerda donante, el líquido ovárico acumulado durante la recolección, el líquido folicular de los ovarios, los ovocitos, la línea celular donante de ADN para clonación con el procedimiento SCNT y los embriones reconstruidos. Aproximadamente 1 cm3Se recogieron muestras de pulmón y bazo de los mismos animales de los que se obtuvieron los ovarios para la obtención de ovocitos. Las muestras de pulmón y bazo se agruparon diariamente durante 3 días (75-100 cerdas por día, con un total de 275 cerdas representadas). Las muestras de pulmón y bazo se homogeneizaron utilizando un mezclador estándar con solución salina fría igual. Se recogieron cinco muestras diarias de 5 mL (5 muestras de tejido de donante de ovocitos al día, 15 muestras en total). Los ovarios de cada cerda se compilaron en un recipiente limpio y separado. Se enviaron cinco muestras de 5 mL del líquido acumulado en el recipiente de recolección de los ovarios para pruebas diagnósticas (5 muestras de líquido ovárico acumuladas por día, 15 muestras en total). El líquido folicular se recolectó extrayendo 10 muestras de 2 mL de la parte superior de los tubos de líquido folicular (10 muestras de líquido folicular por día, 30 muestras en total). Después de la enucleación y el lavado, como se describió anteriormente, se recolectaron cinco grupos de 20 ovocitos cada uno (5 grupos de ovocitos por día, 15 muestras en total) (18). Las líneas celulares donantes para la reconstrucción embrionaria SCNT se sometieron a pruebas diagnósticas. De los embriones SCNT terminados producidos como se describió anteriormente, 40 fueron separados en los primeros 2 días de muestreo para pruebas diagnósticas (2 muestras en total) (18). Los patógenos analizados se seleccionaron teniendo en cuenta la prevalencia esperada de estas enfermedades en las piaras porcinas comerciales y su relevancia para la investigación de xenotrasplantes. Se eligieron pulmón y bazo de animales donantes debido a su facilidad de recolección en una línea de producción de matadero y su albergamiento documentado de los patógenos seleccionados en este estudio.
Todas las muestras se enviaron al Laboratorio de Diagnóstico Veterinario de la Universidad Estatal de Iowa, un laboratorio totalmente acreditado por la Asociación Estadounidense de Diagnosticadores de Laboratorio Veterinario, para la extracción de ADN. El Laboratorio de Diagnóstico Veterinario de la Universidad Estatal de Iowa analizó cada muestra mediante PCR para PCV2, PCV3 y PCMV. Las muestras de ADN extraídas se enviaron al Laboratorio de Diagnóstico Veterinario de la Universidad de Minnesota para realizar pruebas de PCR PERVC. Todas las pruebas diagnósticas y de extracción de ADN se realizaron de acuerdo con los procedimientos diagnósticos estándar del laboratorio. El PCMV se consideró positivo con TC < 35, y los PCV fueron positivos con TC < 37 en el Laboratorio de Diagnóstico Veterinario de la Universidad Estatal de Iowa.
3 Resultados
3.1 Estudio 1
Como se observa en la Tabla 1, se detectaron BVDV, PCMV y PERVC con valores de tc positivos o sospechosos en el OMM1 y OMM2. Los ovocitos fueron positivos para BVDV y se detectaron en niveles sospechosos de SVV. Los ovocitos no pudieron ser analizados para detectar nueve virus debido a la presencia insuficiente de muestras para reservar suficientes ovocitos para producir embriones partenogénicos para analizar todos los patógenos. Los embriones fueron positivos para PERVC pero negativos para todos los demás virus.
3.2 Estudio 2
Como se observa en la Tabla 2, el PCMV fue negativo en todas las muestras. Se detectaron PCV2 y PCV3 en todas las muestras de tejido de cerdas donantes y en el 53-80% de las muestras de líquido ovárico acumuladas. La PCV2 y la PCV3 fueron negativas en todo el líquido folicular, ovocitos y embriones reconstruidos. Se detectó PERVC en el 100% de las muestras de tejido de cerda donante, líquido ovárico acumulado, líquido folicular y ovocitos. La línea celular donante para la reconstrucción embrionaria SCNT fue negativa para PERVC en todas las pruebas.
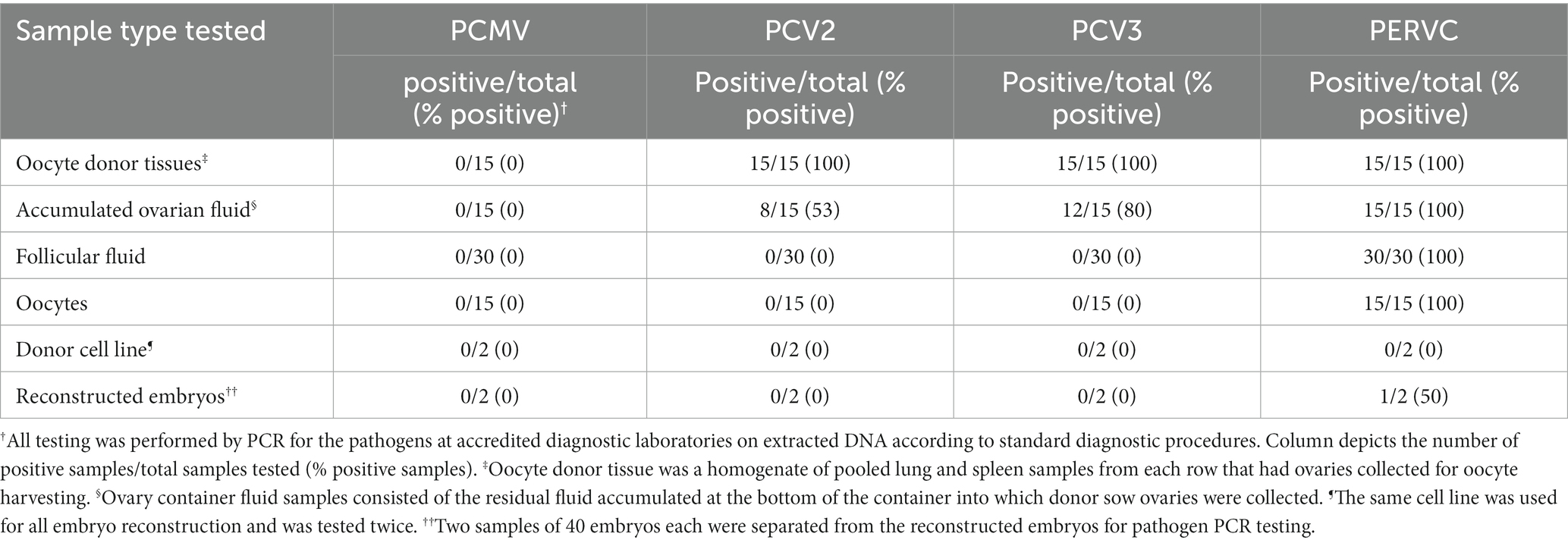 Tabla 2. Detección de patógenos desde las etapas de recolección de ovocitos hasta la reconstrucción embrionaria SCNT.
Tabla 2. Detección de patógenos desde las etapas de recolección de ovocitos hasta la reconstrucción embrionaria SCNT.
4 Discusión
Según el conocimiento de los autores, este proyecto es el primero en intentar la detección de BVDV, PCV1, PCV3, PCMV, IAV, PEDV, TGEV, PDCoV, ROTA, ROTB, ROTC y PERVC en varias etapas, desde la recolección de ovocitos en matadero hasta la partenogénesis embrionaria o la formación de embriones SCNT en cerdos. Trabajos anteriores han demostrado una reducción en la transmisión de PRRSV, BVDV, PCV2 y PPV cuando los ovocitos se lavan adecuadamente después de la recolección para SCNT, pero no exploraron el uso potencial de embriones partenogenéticos a través de la reconstrucción para pruebas de patógenos (10, 12, 13).
El estudio preliminar 1 reveló el potencial para detectar BVDV y PCMV en OMM (Tabla 1). El ganado vacuno es el huésped natural de BVDV; sin embargo, la prevalencia del BVDV en las piaras porcinas comerciales se ha demostrado en diversos grados (20). Previamente se había demostrado un bajo riesgo de transferencia del BVDV a embriones bovinos de SCNT, pero no se había examinado en cerdos (13). Nuestro estudio sugiere que la transferencia del BVDV también es de bajo riesgo en las reconstrucciones de embriones porcinos, pero necesita confirmación con embriones de cerdos construidos con SCNT. El PCMV es altamente prevalente en rebaños comerciales y detectable por varios tipos de muestras, por lo que su detección es esperada (21). El VVS se detectó en niveles sospechosos de tc en los ovocitos, pero no en los medios de comunicación. La posibilidad de la transmisión vertical del VVS ha sido sugerida, pero no confirmada, por lo que la interpretación del hallazgo del VVS en los ovocitos pero no en los medios no está clara (22). Es posible que el VVS en los medios estuviera demasiado diluido para proporcionar una detección sospechosa o positiva, pero estaba en una concentración mayor en la muestra directa de ovocitos.
En particular, no se detectaron BVDV, PCMV y SVV en los embriones partenogénicos, lo que respalda la evidencia de que el lavado de ovocitos y el proceso de formación de embriones ayudan a reducir el riesgo de transferencia de virus exógenos. Sin embargo, esto debe repetirse en un estudio sólido para su confirmación, ya que el tamaño de la muestra fue muy limitado en este estudio preliminar de prueba de concepto. La ausencia de detección de los otros patógenos del estudio 1 probablemente refleja una muestra de animales negativos, la prevención de la contaminación fecal o el tropismo tisular de esos patógenos. Este estudio preliminar de prueba de concepto destaca la posible eliminación de virus exógenos, subrayando el uso de embriones partenogénicos para ahorrar costos y aumentar el tamaño de la muestra embrionaria para el diagnóstico en futuros estudios de eliminación viral.
El estudio preliminar 2 mostró una alta tasa de detección de PCV2 y PCV3 en tejidos de donantes de ovocitos y en el líquido ovárico acumulado (Tabla 2). Las altas tasas de detección son esperables, dada la alta prevalencia de los virus en los rebaños comerciales (23). La PCV2 y la PCV3 son detectables por PCR en el suero y en varios tejidos y se sabe que infectan a los fetos (23, 24). A diferencia de un estudio previo que encontró ovocitos infectados con PCV2 y embriones SCNT infectados, nuestro estudio no detectó PCV2 o PCV3 en fluido folicular, ovocitos o embriones reconstruidos (25). Esta discrepancia puede deberse a las diferencias regionales de cepas, ya que el estudio anterior utilizó una cepa no patógena de un matadero chino frente a la cepa de los Estados Unidos en el estudio actual (25). Las posibles diferencias en la descontaminación de ovocitos y las prácticas de reconstrucción de SCNT también pueden contribuir a las diferencias en la detección de PCV2 en los embriones y ovocitos (13). En el estudio 2, no se detectó PCMV en las cerdas donantes, lo que impidió la confirmación del estudio 1, que detectó PCMV en los medios de maduración. La falta de detección del PCMV en las cerdas donantes fue inesperada, ya que está bien documentado como un virus común en cerdos domésticos y puede detectarse tanto en muestras de bazo como de pulmón mediante PCR (21). Sin embargo, el PCMV, al igual que otros herpesvirus, puede entrar en una etapa latente, especialmente en animales adultos, lo que dificulta la detección en el tejido debido a que la carga viral está por debajo de los límites de detección (21). También se ha demostrado que la distribución del PCMV varía en animales individuales (21). Es necesario seguir investigando la transmisión de la enfermedad del PCMV a partir de ovocitos recogidos de cerdas positivas a embriones SCNT reconstruidos. En estudios futuros, es posible que se justifique la realización de anticuerpos anti-PCMV o de pruebas de órganos más variadas para confirmar la presencia en animales donantes.
En cuanto a la PERVC, está ampliamente distribuida en los genomas de los cerdos (26). En el estudio 1, el núcleo no se extrae de los ovocitos para el desarrollo de embriones partenogénicos, lo que significa que un ovocito positivo para PERVC seguiría siendo un embrión positivo para PERVC. En la producción de embriones SCNT es necesaria la extirpación del núcleo ovocito (13). Se esperaría que la extracción del núcleo de un ovocito positivo para PERVC proporcionara un embrión negativo para PERVC si la línea celular donante utilizada para las reconstrucciones de SCNT fuera negativa para PERVC. Sin embargo, en el estudio 2, solo 1 de los 2 embriones SCNT analizados fueron negativos para PERVC después de reemplazar el núcleo del ovocito con una línea celular donante negativa para PERVC. La enucleación incompleta de los ovocitos es la razón probable del embrión positivo para PERVC (27). Este estudio enfatiza la importancia de analizar los embriones o lechones resultantes para garantizar la eliminación exitosa de patógenos para virus capaces de integrar el genoma. Las limitaciones del proyecto actual incluyen el pequeño tamaño de la muestra, la necesidad de un muestreo más riguroso, la escasez de ovocitos para completar todas las pruebas en el estudio 1 y la imposibilidad de confirmar el estado de PCMV de los animales donantes en el estudio 2.
5 Conclusión
En conclusión, este proyecto explora dos métodos diferentes de construcción embrionaria y la detección de virus en varias etapas de construcción para analizar la eliminación de patógenos en el producto embrionario final. Es probable que los patógenos que requieren monitoreo varíen según las piaras porcinas específicas, las instalaciones, el tejido porcino de interés y los objetivos de producción. A excepción de PERVC, los virus detectados en las primeras etapas del proceso no se observaron en los embriones del producto final. Estos estudios sugieren que los embriones construidos a partir de ovocitos recolectados en mataderos comerciales tienen un bajo riesgo de enfermedad para transferir virus exógenos cuando se lavan adecuadamente. El tamaño de la muestra y las réplicas en ambos estudios son demasiado pequeñas para sacar conclusiones sólidas, pero este riesgo aparentemente mínimo se alinea con estudios previos sobre virus exógenos seleccionados (10, 12, 13). Los estudios futuros sobre la eliminación de virus exógenos en la reconstrucción embrionaria pueden beneficiarse del uso de embriones partenogenéticos para aumentar el material disponible para las pruebas sin las complicaciones de la SCNT. El uso de embriones partenogénicos del estudio 1 para el diagnóstico aún requiere confirmación en un estudio más extenso y robusto con réplicas apropiadas.
En el caso de los patógenos virales exógenos, este proyecto sugiere que el manejo adecuado de los ovocitos para la SCNT y la construcción de embriones partenogénicos ayuda a reducir el riesgo potencial de transmisión viral por transferencia embrionaria. Esta posible reducción del riesgo es alentadora para el uso de SCNT en rebaños SPF para reducir la amenaza de enfermedades zoonóticas en rebaños de investigación de xenotrasplantes y para patógenos que pueden afectar significativamente la producción animal en rebaños comerciales. Sin embargo, enfatiza que para virus endógenos como PERVC, se puede recomendar la prueba de los embriones o lechones resultantes para confirmar que no se produjo la transferencia viral a la descendencia. Incluso con una línea celular de donante negativa, la enucleación incompleta de los ovocitos puede dar lugar a un embrión endógeno positivo para el virus.
Estos pequeños estudios preliminares subrayan la necesidad de investigaciones más exhaustivas con métodos de recolección de muestras más robustos para la eliminación de patógenos desde la recolección de ovocitos hasta la reconstrucción embrionaria, especialmente para patógenos endógenos. El pequeño tamaño de la muestra y la falta de confirmación de la infección por PCMV en los animales donantes limitan la interpretación e impiden el análisis estadístico de los resultados del estudio.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
No se requirió aprobación ética para los estudios con animales de acuerdo con la legislación local y los requisitos institucionales porque este estudio no implicaba el uso de ningún animal vivo para su finalización, y el producto era solo la creación de embriones. Se recolectaron muestras de animales que ya habían sido sacrificados en un matadero comercial bajo las prácticas de procesamiento estándar actuales de la instalación. El centro recolecta regularmente muestras, como ovocitos, como parte de sus prácticas estándar. Ningún animal vivo fue dañado o utilizado en la finalización de este proyecto, y ningún animal fue sacrificado específicamente para este proyecto. No se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio porque los animales estaban en el punto de recolección bajo la propiedad de Sustainable Swine Resources, que son autores contribuyentes de este artículo, y fueron ellos quienes recolectaron las muestras de ovocitos y tejidos de los animales ya sacrificados en su matadero.
Contribuciones de los autores
BP: Conceptualización, Curación de datos, Investigación, Metodología, Administración de proyectos, Supervisión, Redacción – borrador original, Redacción – revisión y edición. PR-V: Conceptualización, Curación de datos, Investigación, Metodología, Administración de proyectos, Supervisión, Redacción, revisión y edición. LS: Curación de datos, Investigación, Metodología, Redacción, revisión y edición. JY: Curación de datos, investigación, metodología, redacción, revisión y edición. BD: Conceptualización, Metodología, Redacción – Revisión y Edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este proyecto fue financiado internamente por Cytotheryx, Inc. y Recombinetics, Inc.
Conflicto de intereses
BP y BD fueron empleados por Cytotheryx, Inc. PR-V fue empleado por Recombinetics, Inc. LS y JY fueron empleados por Sustainable Swine Resources LLC.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Wu, G, y Bazer, FW. Aplicación de nuevas biotecnologías para la mejora de la nutrición porcina y la producción porcina. J Anim Sci Biotechnol. (2019) 10:28. doi: 10.1186/s40104-019-0337-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Singh, P, y Ali, SA. Impacto de la ingeniería genómica basada en CRISPR-Cas9 en animales de granja. Veterinaria Sci. (2021) 8:122. doi: 10.3390/vetsci8070122
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Whitworth, KM, y Prather, RS. Tecnologías de edición genómica para mejorar la investigación, la reproducción y la producción en cerdos. Mol Reprod Dev. (2017) 84:1012–7. doi: 10.1002/mrd.22812
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Klymiuk, N, Aigner, B, Brem, G, y Wolf, E. Modificación genética de cerdos como donantes de órganos para xenotrasplantes. Mol Reprod Dev. (2010) 77:209–21. doi: 10.1002/mrd.21127
5. Lunney, JK, Van Goor, A, Walker, KE, Hailstock, T, Franklin, J y Dai, C. Importancia del cerdo como modelo biomédico humano. Sci Transl Med. (2021) 13:13eabd5758. doi: 10.1126/scitranslmed.abd5758
6. Cowan, PJ, y Tector, AJ. El resurgimiento de los xenotrasplantes. Am J Trasplante. (2017) 17:2531–6. doi: 10.1111/ajt.14311
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Tanihara, F, Hirata, M, y Otoi, T. Estado actual de la aplicación de la edición genética en cerdos. J Reprod Dev. (2021) 67:177–87. doi: 10.1262/jrd.2021-025
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Boneva, RS, Folks, TM, y Chapman, LE. Problemas de enfermedades infecciosas en xenotrasplantes. Clin Microbiol Rev. (2001) 14:1–14. doi: 10.1128/CMR.14.1.1-14.2001
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Noordergraaf, J, Schucker, A, Martin, M, Schuurman, HJ, Ordway, B, Cooley, K, et al. Eliminación y prevención de patógenos dentro de una piara porcina cerrada regulada y designada como libre de patógenos para la cría y producción a largo plazo de materiales de xenotrasplante. Xenotrasplantes. (2018) 25:e12428. doi: 10.1111/xen.12428
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Gregg, K, Xiang, T, Arenivas, SS, Hwang, E, Arenivas, F, Chen, SH, et al. Evaluación del riesgo de transmisión del virus del síndrome respiratorio y reproductivo porcino (PRRSV) a través de la producción de embriones por transferencia nuclear de células somáticas (SCNT) utilizando ovocitos de mataderos comerciales. Anim Reprod Sci. (2011) 125:148–57. doi: 10.1016/j.anireprosci.2011.04.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Tucker, A, Belcher, C, Moloo, B, Bell, J, Mazzulli, T, Humar, A, et al. La producción de cerdos transgénicos para su uso potencial en xenotrasplantes clínicos: evaluación microbiológica. Xenotrasplantes. (2002) 9:191–202. doi: 10.1034/j.1399-3089.2002.01050.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Denner, J. Riesgo de transmisión de virus patógenos por transferencia nuclear de células somáticas: implicaciones para el xenotrasplante. Biol Reprod. (2022) 107:717–22. doi: 10.1093/biolre/ioac120
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Gregg, K, Gosch, G, Guerra, T, Chen, SH, Xiang, T, Broek, D, et al. Evaluación del riesgo in vivo a gran escala de la transmisión del virus de la diarrea viral bovina (BVDV) a través de la transferencia de embriones bovinos producidos mediante transferencia nuclear de células somáticas (SCNT). Teriogenología. (2010) 74:1264–70. doi: 10.1016/j.theriogenology.2010.05.032
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Denner, J. Sistemas de detección sensibles para agentes infecciosos en xenotrasplantes. Xenotrasplantes. (2020):E12594. doi: 10.1111/xen.12594
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Denner, J y Mankertz, A. Circovirus porcinos y xenotrasplantes. Virus. (2017) 9:83. doi: 10.3390/v9040083
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Denner, J. Seguridad viral de los xenotrasplantes. Virus. (2022) 14:1926. doi: 10.3390/v14091926
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Ongaratto, FL, Rodríguez-Villamil, P, Bertolini, M, y Carlson, DF. Influencia de la selección de ovocitos, la activación con un quelante de zinc y la inhibición de histonas desacetilasas en el embrión porcino clonado y en el desarrollo de ovocitos activados químicamente. Cigoto. (2020) 28:286–90. doi: 10.1017/S0967199419000856
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. García-Mengual, E, Alfonso, J, Salvador, I, Duque, CC, y Silvestre, MA. Procedimientos de activación ovocitaria e influencia del suero en la maduración de ovocitos porcinos y posterior desarrollo embrionario partenogenético y de transferencia nuclear. Cigoto. (2008) 16:279–84. doi: 10.1017/S0967199408004796
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Redel, BK, Spate, LD y Prather, RS. Maduración in vitro, fertilización y cultivo de ovocitos y embriones de cerdo En: JR Herrick, editor. Cultivo comparativo de embriones: métodos y protocolos. Nueva York, NY: Humana (2006). 93–103.
20. Choe, S, Lim, SI, Park, GN, Song, S, Shin, J, Kim, KS, et al. Prevalencia de infecciones por el virus de la diarrea viral bovina en cerdos en la isla de Jeju, Corea del Sur, entre 2009 y 2019 e infección experimental de cerdos con cepas de BVDV aisladas de bovinos. Veterinaria Sci. (2022) 9:146. doi: 10.3390/vetsci9030146
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Halecker, S, Hansen, S, Krabben, L, Ebner, F, Kaufer, B, y Denner, J. Cómo, dónde y cuándo detectar citomegalovirus porcino (PCMV) en cerdos donantes para xenotrasplantes. Sci Rep. (2022) 12:21545. doi: 10.1038/s41598-022-25624-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Zhang, J, Li, C, Meng, Y, Xie, Y, Shi, N, Zhang, H, et al. Patogenicidad del virus del Valle de Séneca en cerdos y detección en Culicoides de una granja porcina infectada. Virol J. (2021) 18:209. DOI: 10.1186/s12985-021-01679-w
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Wang, Y, Noll, L, Lu, N, Porter, E, Stoy, C, Zheng, W, et al. Diversidad genética y prevalencia de circovirus porcino tipo 3 (PCV3) y tipo 2 (PCV2) en el Medio Oeste de EE. UU. durante 2016-2018. Transbound Emerg Dis. (2020) 67:1284–94. doi: 10.1111/tbed.13467
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Tochetto, C, de Lima, DA, Varela, APM, Ortiz, LC, Loiko, MR, Scheffer, CM, et al. Investigación sobre circovirus porcino tipo 3 en suero de cerdas en parto con mortinatos. Microb Pathog. (2020) 149:104316. doi: 10.1016/j.micpath.2020.104316
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Weng, XG, Liu, Y, Zhou, SH, Zhang, YT, Shao, YT, Xu, QQ, et al. Evaluación de la producción in vitro de la infección por circovirus porcino tipo 2 utilizando ovocitos infectados de forma natural. Teriogenología. (2019) 126:75–80. doi: 10.1016/j.theriogenology.2018.12.009
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Kaulitz, D, Mihica, D, Adlhoch, C, Semaan, M y Denner, J. Mejora del cribado de donantes de cerdos, incluidas las variantes recientemente identificadas del retrovirus-C endógeno porcino (PERV-C). Arch Virol. (2013) 158:341–8. doi: 10.1007/s00705-012-1490-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Maeng, G, Gong, W, Das, S, Yannopoulos, D, Garry, DJ y Garry, MG. Los embriones porcinos nulos de ETV2 sobreviven hasta la postimplantación después de una enucleación incompleta. Reproducción. (2020) 159:539–47. doi: 10.1530/REP-19-0382
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: circovirus porcino, citomegalovirus porcino, retrovirus endógeno porcino, SCNT, xenotrasplante, enfermedad infecciosa, embrión partenogénico, clonación
Cita: Pepin B, Rodriguez-Villamil P, Sammel L, Yin J y Dacken B (2024) Monitoreo de la transmisión del virus porcino en embriones derivados de ovocitos de mataderos comerciales. Frente. Vet. Sci. 11:1336005. doi: 10.3389/fvets.2024.1336005
Recibido: 09 de noviembre de 2023; Aceptado: 19 de enero de 2024;
Publicado: 02 Febrero 2024.
Editado por:
Michael Kogut, Servicio de Investigación Agrícola, Departamento de Agricultura de los Estados Unidos, Estados Unidos
Revisado por:
Alex Pasternak, Universidad de Purdue, Estados Unidos Caroline Gomes Lucas, Universidad de Missouri, Estados
Unidos
Derechos de autor © 2024 Pepín, Rodríguez-Villamil, Sammel, Yin y Dacken. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Brent Pepin, Brent.pepin@cytotheryx.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía