Seguridad y eficacia de las células madre mesenquimales derivadas del tejido gonadal canino
 Soyoung Jeung1,2
Soyoung Jeung1,2 Ju-Hyun Anç3
Ju-Hyun Anç3 Sung-soo Kim1,2
Sung-soo Kim1,2 Hwa-joven Youn2*
Hwa-joven Youn2*- 1Centro Médico Animal VIP, Seúl, República de Corea
- número arábigoLaboratorio de Medicina Interna Veterinaria, Instituto de Investigación de Ciencias Veterinarias y Facultad de Medicina Veterinaria, Universidad Nacional de Seúl, Seúl (República de Corea)
- 3Laboratorio de Urgencias Veterinarias y Cuidados Intensivos, Departamento de Ciencias Clínicas Veterinarias, Facultad de Medicina Veterinaria, Universidad Nacional de Kangwon, Chuncheon, Gangwon-do, República de Corea
Introducción: Este estudio exploró la eficacia y seguridad potenciales de la terapia con células madre mesenquimales (MSC) derivadas del tejido gonadal para abordar la etapa temprana de la enfermedad de la válvula mitral mixomatosa (MMVD), la afección cardíaca predominante en los perros.
Métodos: Dieciséis perros diagnosticados con MMVD B1 se inscribieron en este ensayo y se asignaron a un grupo de control (grupo de control, n = 10) o a un grupo que recibió MSC derivado de tejido gonadal (grupo de tratamiento, n = 6). En el grupo de tratamiento, se administraron MSC alogénicas derivadas del tejido gonadal (1 × 106 células/kg) por vía intravenosa a intervalos mensuales durante cinco o más sesiones. Los datos se compararon al inicio y en los intervalos de 1 año del criterio de valoración. La eficacia se evaluó mediante ecocardiografía, radiografía torácica, NT-proBNP y la duración desde el diagnóstico de B1 hasta la transición de B2 para evaluar su efecto en la progresión del estadio MMVD. La seguridad se evaluó mediante exámenes físicos, análisis de sangre, estudios de imagen y seguimiento de eventos adversos.
Resultados: Después de 1 año de observación, el grupo control mostró un deterioro de los parámetros ecocardiográficos, mientras que el grupo de tratamiento no mostró diferencias sustanciales entre las mediciones basales y finales. En particular, se observó una disparidad estadísticamente significativa en el diámetro de la aurícula izquierda (p < 0,05) y la velocidad de la onda E (p < 0,05) entre los dos grupos, lo que indica un impacto favorable de las MSC derivadas del tejido gonadal sobre la presión de la aurícula izquierda. Además, en contraste con el grupo control, el grupo de tratamiento demostró una progresión tardía al estadio B2 de MMVD, lo que les permitió prolongar la duración de su enfermedad sin necesidad de medicación cardíaca (p = 0,038). En las métricas de calidad de vida (QoL) después del tratamiento con MSC, el apetito mostró una mejora estadísticamente significativa, aumentando de 4 a 4,83 (p < 0,05).
Discusión: El tratamiento con MSC derivadas de tejido gonadal retrasó significativamente la progresión de la etapa MMVD, lo que pone de manifiesto el amplio potencial de las MSC derivadas del tejido gonadal para el tratamiento de afecciones veterinarias complejas.
1 Introducción
La valvulopatía degenerativa crónica afecta predominantemente a la válvula mitral en perros pequeños y es la cardiopatía canina más común, representando aproximadamente el 75% de todos los casos cardíacos (1-3). Esta enfermedad degenerativa causa engrosamiento de las valvas, fibrosis y prolapso que conducen a regurgitación sanguínea (4). La sobrecarga de volumen posterior puede dar lugar a cambios morfológicos en el corazón, que finalmente conducen a insuficiencia cardíaca y edema pulmonar (2).
La enfermedad mixomatosa de la válvula mitral (MMVD) se clasifica en cuatro etapas: Etapa A para diagnosticar razas predispuestas sin cambios estructurales evidentes en el corazón, Etapa B para el remodelado morfológico del corazón, Etapa C para signos clínicos y Etapa D para resistencia a los tratamientos estándar (3). El estadio B de la MMVD se caracteriza por la ausencia de signos clínicos. El estadio B se divide a su vez en B1 y B2, donde el B1 indica cambios morfológicos que no cumplen con los criterios clínicos y el B2 indica cambios morfológicos más graves y regurgitación de la válvula mitral, lo que conduce a problemas hemodinámicos (3). El estadio B2 se define por un grado de intensidad del soplo de 3 o superior, una puntuación cardíaca vertebral superior a 10,5, una relación LA:AO de 1,6 o superior y un diámetro interno del ventrículo izquierdo en diástole de 1,7 o superior (3).
Aproximadamente el 30% de las MMVD progresan a insuficiencia cardíaca (5). En el estudio EPIC, Boswood et al. recomendaron la administración de un único medicamento oral (pimobendan) en la fase MMVD B2 para prevenir la aparición de insuficiencia cardíaca (6). La insuficiencia cardíaca causa signos clínicos de leves a graves, que incluyen letargo, anorexia, tos, intolerancia al ejercicio, colapso y dificultad para respirar (3). El tratamiento de la insuficiencia cardíaca requiere el uso coordinado de múltiples fármacos, incluidos los diuréticos, los fármacos inotrópicos positivos, los fármacos vasodilatadores, los inhibidores de la enzima convertidora de angiotensina, los bloqueadores beta-adrenérgicos o los fármacos antiarrítmicos (3, 7). Aun así, los medicamentos son las opciones estándar para controlar los signos clínicos, pero se pueden intentar otros tratamientos de apoyo.
La terapia con células madre mesenquimales implica la autorrenovación, la regeneración de tejidos, la antiinflamación y la inmunomodulación (8-11). Con el aumento del envejecimiento de la población humana, se produce un aumento correspondiente en el número de animales ancianos en medicina veterinaria. En consecuencia, existe una creciente demanda de tratamientos que aborden diversas enfermedades intratables, afecciones crónicas que requieren tratamiento a largo plazo y problemas de salud complejos en animales de edad avanzada. Las células madre mesenquimales (MSC) están emergiendo como una solución terapéutica prometedora para estos desafíos. Las células madre mesenquimales pueden derivarse de varios tejidos, como la médula ósea, el tejido adiposo y la placenta (12). Sin embargo, los procedimientos quirúrgicos adicionales necesarios para obtener la fuente del donante pueden generar problemas importantes con respecto al costo, el tiempo y la salud. Además, la criopreservación de las propias células madre mesenquimales de un animal a una edad temprana ofrece la ventaja de recibir potencialmente la terapia MSC en el futuro con efectos secundarios inmunogénicos reducidos. Por lo tanto, investigamos el potencial de reutilizar el tejido gonadal, que normalmente se desecha durante los procedimientos de castración, como una fuente innovadora de terapia con MSC.
En medicina veterinaria, se utiliza principalmente para tratar afecciones en los perros, como enfermedades musculoesqueléticas, neuromusculares y renales. En gatos, se han reportado efectos terapéuticos significativos en casos de lesión renal aguda isquémica, enfermedad renal crónica, gingivoestomatitis, asma experimental y enteropatía crónica (13, 14). Varios estudios de medicina veterinaria han explorado las terapias con células madre mesenquimales para diversas afecciones cardíacas. Las células madre alogénicas intracoronarias derivadas de la cardiosfera muestran inicialmente una mejoría parcial en perros con miocardiopatía dilatada (MCD). El acortamiento fraccional (FS), que es un marcador de la función cardíaca, continuó disminuyendo en el grupo control. Por el contrario, la terapia con células madre mesenquimales preservó de manera robusta el FS% en el grupo de tratamiento, compuesto por respondedores y no respondedores al tratamiento con células madre derivadas de la cardiosfera. Se observaron tendencias similares para el porcentaje de grosor de la pared, que también sirve como marcador de la función cardíaca (15). En los casos de miocardiopatía crónica de Chagas en caninos, se observó una mejoría significativa de la función cardíaca, indicada por la velocidad máxima del flujo aórtico, tras la implantación de células madre mesenquimales autólogas derivadas de la médula ósea en las arterias coronarias derecha e izquierda (16). Los estudios sobre el tratamiento con MSC para la valvulopatía crónica canina se han centrado principalmente en pacientes con estadios C y D de MMVD. Además, Petchdee et al. trasplantaron perros por vía intravenosa con células madre alogénicas de dientes deciduos de cachorro (pDSC). En comparación con el grupo de control que recibió el tratamiento estándar, el grupo de terapia MSC mostró mejoras significativas en la fracción de eyección del ventrículo izquierdo, la relación entre la aurícula izquierda y la raíz aórtica, el estadio ACVIM y las puntuaciones de calidad de vida hasta 60 días después de la administración de MSC (17). Por el contrario, Yang et al. encontraron que la inyección intravenosa de células madre mesenquimales derivadas de la jalea de Wharton en perros con insuficiencia cardíaca congestiva secundaria a MMVD no resultó en mejoras significativas en la función cardíaca, el tiempo de supervivencia prolongado o los efectos terapéuticos de la dosificación de diuréticos (18). Este estudio tuvo como objetivo evaluar la efectividad de la terapia con células madre mesenquimales en caninos diagnosticados con enfermedad cardíaca en etapa temprana (MMVD, ACVIM etapa B1).
2 Materiales y métodos
2.1 Población de estudio
Los pacientes propiedad de los clientes con MMVD en etapa temprana (etapa B1) que visitaron el VIP Animal Medical Center fueron evaluados a intervalos anuales. Los pacientes se dividieron en los grupos de tratamiento con MSC derivado del tejido gonadal (n = -6) y control (n = 10). Las historias clínicas de los pacientes se revisaron utilizando un programa de historias clínicas electrónicas (E-friends, pnV Co., Ltd., Seúl, Corea). Este estudio retrospectivo fue aprobado por el Comité Institucional de Cuidado y Uso de Animales (IACUC) del Centro Médico Animal VIP (protocolo no. VIP-0006-SC).
2.1.1 Criterios de inclusión y exclusión
De marzo de 2019 a diciembre de 2022, los pacientes propiedad de clientes con MMVD en etapa temprana (etapa B1) que fueron diagnosticados en el VIP Animal Medical Center se dividieron en dos grupos. El «grupo control» (n = 10) consistió en pacientes que solo fueron monitoreados, mientras que el «grupo MSC» (n = 6) incluyó pacientes que comenzaron la terapia con MSC derivada del tejido gonadal dentro de 1 año después del diagnóstico. Sin embargo, se excluyeron del análisis final los pacientes con otras enfermedades graves o que no acudieron al hospital durante el período de evaluación.
2.2 Recolección de tejidos y preparaciones celulares
Se obtuvieron tejidos gonadales femeninos (ovarios) que fueron descartados durante la cirugía de castración en el VIP Animal Medical Center con el consentimiento de los propietarios. Los donantes fueron examinados minuciosamente para detectar enfermedades infecciosas y no mostraron hallazgos anormales en los exámenes de sangre o de imágenes. Este estudio fue aprobado por el Comité Institucional de Cuidado y Uso de Animales (IACUC) del Centro Médico Animal VIP (Protocolo nro. VIP-0004-SC). Las células madre mesenquimales se aislaron de la siguiente manera. El tejido derivado del donante se extrajo de un recipiente estéril utilizando pinzas esterilizadas y se transfirió a un tubo que contenía 20 mL de solución salina tamponada con fosfato de Dulbecco (DPBS; Thermo Fisher Scientific, Massachusetts, EE. UU.) para un lavado a fondo. Este proceso se repitió tres veces. Después del lavado, el tejido se transfirió a una placa de Petri nueva y se cortó meticulosamente en secciones de aproximadamente 1 a 2 mm con tijeras esterilizadas. Posteriormente, se sometió a digestión enzimática en una solución diluida con colagenasa al 1% (Sigma-Aldrich, St. Louis, EE. UU.) junto con medio MEM-alfa (α-MEM; Sigma-Aldrich, St. Louis, EE.UU.) durante 2 h a 37°C en baño maría. Posteriormente, la suspensión celular se filtró primero utilizando un filtro celular de 100 μm (de SPL Life Sciences Co., Gyeonggi-do, Corea) seguido de un filtro de 40 μm. La suspensión celular resultante se centrifugó a 700 g durante 10 min a temperatura ambiente. El pellet se lavó al menos tres veces con DPBS. Posteriormente, las células se resuspendieron en 1 mL de medio de cultivo. El medio de cultivo consistió en medio esencial mínimo α (MEM-α) suplementado con 10% de suero fetal bovino (FBS) y 1% de penicilina/estreptomicina. A continuación, las células resuspendidas se transfirieron a una placa de cultivo de 100 mm que contenía 9 mL de medio de cultivo y se incubaron a 37 °C con 5% de CO2. El medio de cultivo se cambió diariamente hasta eliminar las impurezas no MSC, después de lo cual se cambió cada 2 días.
2.3 Caracterización celular
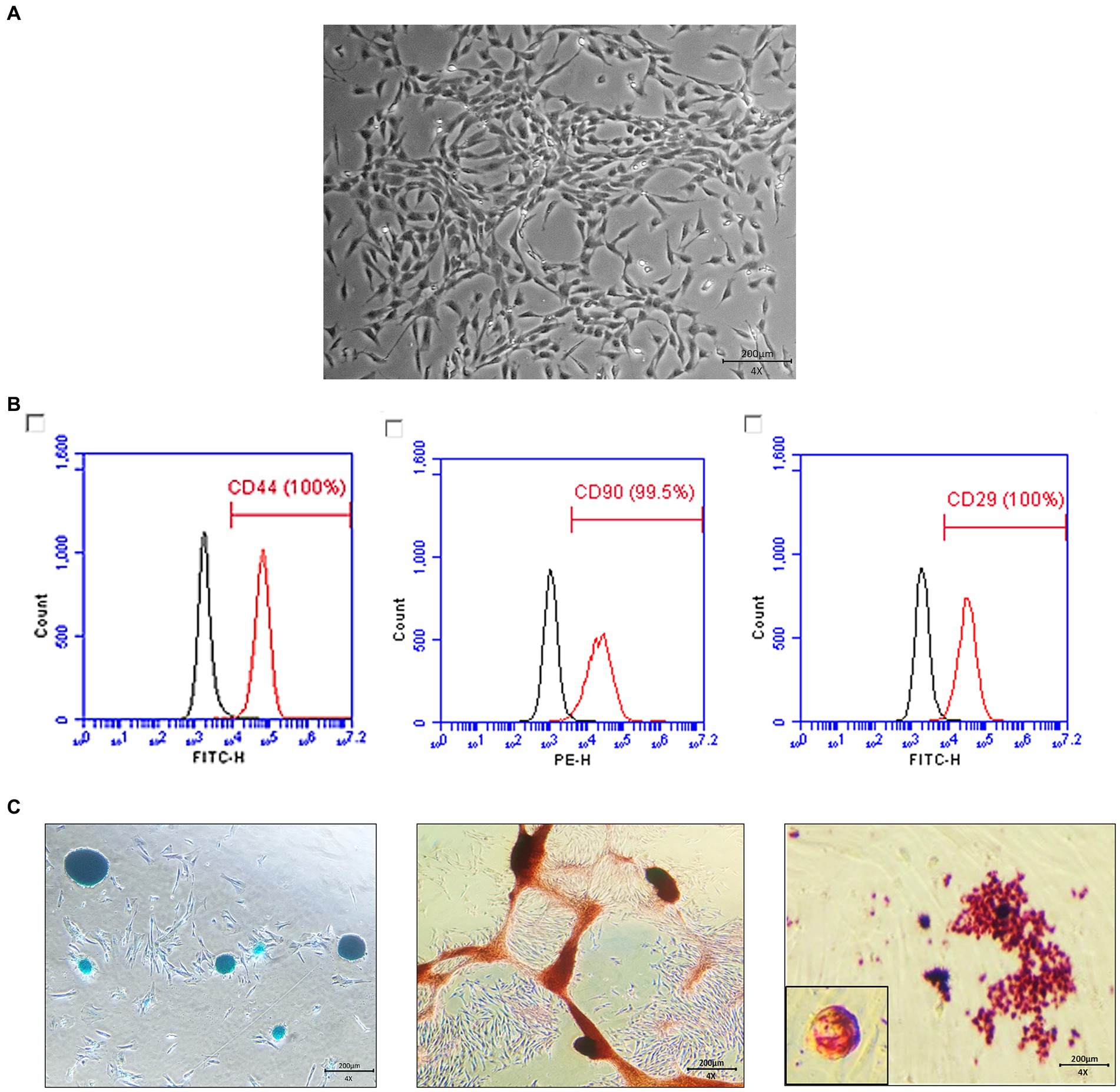
Para caracterizar las MSCs, el inmunofenotipado se realizó mediante citometría de flujo (BD Accuri™ C6 Plus, BD Biosciences, Franklin Lakes, New Jersey, USA). La mayoría de las células fueron positivas para CD 29 (FITC) y CD 44 (FITC); sin embargo, algunos fueron negativos para CD90 (PE). CD29 conjugado por FITC (clon de anticuerpo MEM-101A; Invitrogen, Massachusetts, EE.UU.) y CD44 conjugado por FITC (clon de anticuerpos IM7; Invitrogen) se utilizaron como MSCs caninos. CD90 conjugado con PE (clon de anticuerpos YKIX337.217; Invitrogen, Carlsbad, CA, EE.UU.) se utilizó para las MSC caninas.
Las MSC se diferenciaron utilizando kits comerciales durante 2 semanas y se identificaron mediante tinción para adipocitos (con Oil Red O), osteocitos (con Alizarin Red S) y condrocitos (con azul alcián) (kits StemPro Adipogenesis, Osteogenesis, and Chondrogenesis Differentiation, Thermo Fisher Scientific, Massachusetts, EE. UU.).
2.4 Terapia con células madre mesenquimales
Las MSC alogénicas derivadas del tejido gonadal (1 × 106 células/kg) se administraron por vía intravenosa a intervalos mensuales durante cinco o más sesiones. La inyección intravenosa (IV) se administró durante aproximadamente 20-30 min a una velocidad de 0,5-1 mL/min o menos, y la jeringa se enrolló suavemente para asegurar que las células diluidas se dispersaran completamente antes de la inyección. La dosis y el régimen de tratamiento para la terapia con células madre se determinaron con base en estudios previos (17, 19-21).
Para mitigar las preocupaciones sobre posibles reacciones inmunitarias adversas, administramos inyecciones de antihistamínicos antes del tratamiento, siguiendo las recomendaciones de la literatura previa (22, 23). Antes de la terapia alogénica con células madre mesenquimales, se administraron maleato de clorfeniramina 0,2 mg/kg, SC (Histamina, SAMU MEDIAN Co., Ltd., Seúl, Corea) 30 min antes del tratamiento para prevenir reacciones inmunitarias. Se administró fluidoterapia durante 30 min antes y después de la terapia celular. Los principales tipos de líquido utilizados fueron suero fisiológico al 0,9% y la velocidad se mantuvo en 2,5 mL/kg/h.
Los pacientes fueron monitoreados durante más de una hora para detectar reacciones de hipersensibilidad antes de regresar a casa. El paciente regresó para la evaluación de la respuesta al tratamiento o los efectos secundarios de acuerdo con el programa de monitoreo.
2.5 Evaluación de la respuesta a la terapia MSC
Los pacientes en el grupo de terapia con células madre mesenquimales se evaluaron comparando los datos desde el inicio hasta el criterio de valoración (1 año después del tratamiento). El grupo de control estaba compuesto por pacientes diagnosticados con MMVD en el plazo de 1 año, que fueron evaluados comparando los datos de los exámenes regulares de monitorización cardíaca a intervalos anuales. El día de la terapia con MSC, se controló la temperatura corporal de los pacientes. Los cambios de peso se evaluaron a intervalos anuales. Para evaluar la seguridad del tratamiento con MSC, controlamos el estado del paciente comparando los resultados antes y después del tratamiento, incluidos los hemogramas completos, la química sérica y los electrolitos. Los resultados de la ecocardiografía se analizaron en el grupo de tratamiento con MSC antes del inicio de la terapia con células madre mesenquimales (línea de base) y en la evaluación de seguimiento de 1 año (criterio de valoración). El grupo control se comparó 1 año después del diagnóstico en pacientes con MMVD en estadio B1. Los pacientes con MMVD fueron diagnosticados con estadio B tras la identificación de remodelación cardíaca sin signos clínicos. Específicamente, se diagnosticó el estadio B2 si más de tres especialistas en imágenes confirmaron una relación aurícula-aorta izquierda de 1,6 o más y un diámetro interno del ventrículo izquierdo en diástole de 1,7 o más. Si no se cumplían estos criterios, el paciente era diagnosticado con estadio B1. Además, se revisaron la prescripción y el momento de administración de pimobendan, un medicamento indicado para el estadio B2 de MMVD, a través de las historias clínicas del paciente.
Realizamos evaluaciones de calidad de vida (CV) tanto en el grupo experimental como en el grupo control, utilizando como referencia la Encuesta de Calidad de Vida Relacionada con la Salud Canina (CHQLS-21) (24). Cada ítem obtuvo una puntuación de 1 a 5, donde las puntuaciones más altas indican resultados más positivos.
2.6 Análisis estadístico
Los análisis estadísticos se realizaron utilizando GraphPad Prism versión 9 (GraphPad Inc., La Jolla, CA, USA). Los datos numéricos se presentaron como media ± desviación estándar. En la ecocardiografía, los valores basales y de valoración se compararon a intervalos anuales para cada grupo mediante pruebas t pareadas, no paramétricas y de Wilcoxon. La comparación entre los grupos de tratamiento con MSC y control involucró la prueba t pareada, no paramétrica y de Mann-Whitney. Los valores de p se indican con *p < 0,05 y **p < 0,01 y se consideraron estadísticamente significativos.
3 Resultados
3.1 Caracterización y diferenciación de MSC
Las MSC derivadas del tejido gonadal exhibieron una morfología en forma de huso, similar a la de un fibroblasto (Figura 1A). Las MSC gonadales caninas se tiñeron para detectar marcadores esenciales positivos para MSC (CD29, CD44 y CD90) utilizando varios antígenos. Los niveles de expresión de estos marcadores superaron sistemáticamente el 95% (Figura 1B). Las MSC fueron inducidas a diferenciarse en condrocitos, osteoblastos y adipocitos, y los resultados de la tinción fueron positivos (Figura 1C).
3.2 Animales de estudio
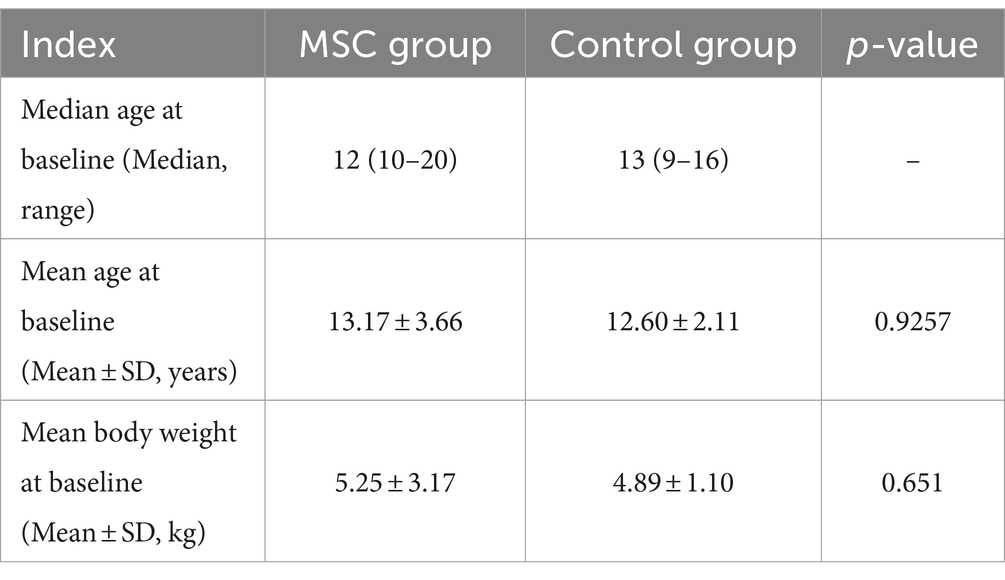
Se recogieron datos de 16 perros con MMVD (estadio B1 de ACVIM), con seis perros en el grupo de terapia MSC y 10 en el grupo control (Tabla 1). La mediana de edad de los grupos tratamiento con MSC y control fue de 12 y 13 años, respectivamente, sin diferencia estadísticamente significativa (p = 0,9257). Del mismo modo, los pesos de los dos grupos no fueron significativamente diferentes (p = 0,651) (Tabla 2).

Tabla 1. Información de los pacientes.
El grupo de terapia MSC consistió en cuatro hembras esterilizadas y dos machos castrados, mientras que el grupo de control incluyó cuatro hembras esterilizadas y seis machos castrados. En el grupo de tratamiento con MSC, el tiempo promedio desde el diagnóstico de MMVD ACVIM en estadio B1 hasta el inicio de la terapia con células madre mesenquimales fue de 395,17 ± 257,00 días.
3.3 Análisis ecocardiográfico
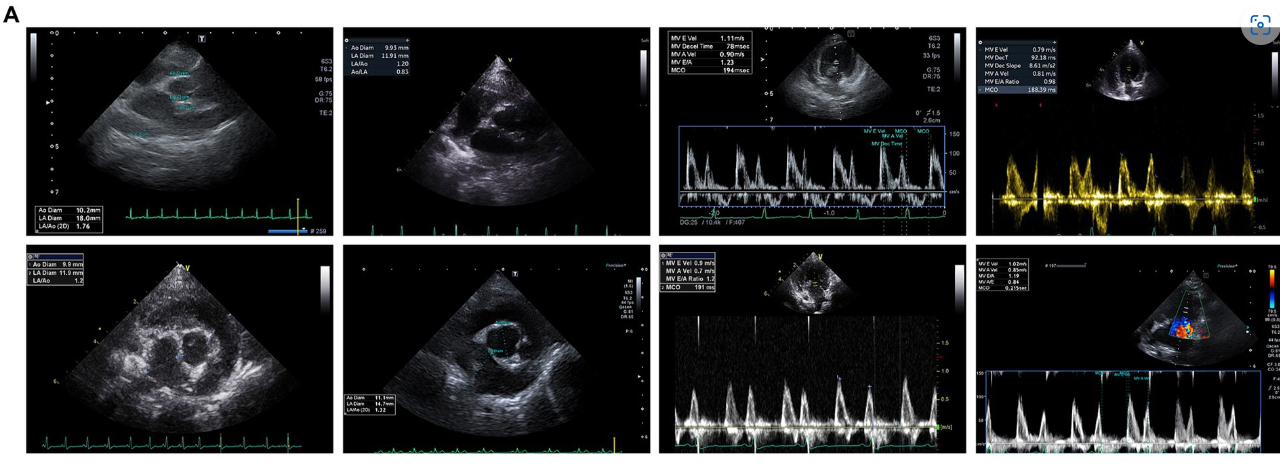
Al inicio del estudio, no se observaron diferencias estadísticamente significativas en los parámetros ecocardiográficos y radiográficos entre el grupo MSC y el grupo control (Tabla 3). Los cambios en los parámetros ecocardiográficos se calcularon restando las mediciones basales de las mediciones de los puntos finales. El grupo control demostró un deterioro estadísticamente significativo en la LA (p = 0,0078), la relación LA/AO (p = 0,0117), la LVIDDN (p = 0,0098), la velocidad E (valor p = 0,0391) y la VHS (p = 0,0312) desde el inicio hasta el punto final a intervalos anuales. Por el contrario, el grupo de terapia MSC no mostró cambios significativos en las mediciones ecocardiográficas durante el mismo período. Aunque no fue estadísticamente significativo, el grupo MSC mostró una mejora en la LA y la velocidad E (Tabla 4). En la Figura 2A se presentan las características ecocardiográficas de las MSC y de los grupos control. Un paciente en el grupo MSC mostró una disminución en la AI de 18 mm a 11,9 mm después del tratamiento con células madre mesenquimales, con una mejor relación LA/AO de 1,8 a 1. Además, el E-peak mejoró de 1,1 m/s a 0,8 m/s. Para un paciente en el grupo de control, la AI aumentó de 11,9 mm a 14,7 mm en un intervalo de 1 año, y la relación LA/AO progresó de 1,2 a 1,3. Además, el pico E empeoró de 0,9 m/s a 1 m/s. Las comparaciones se establecieron restando los valores basales de los valores finales de cada parámetro, y se realizaron evaluaciones ecocardiográficas a intervalos anuales (Tabla 5). Los cambios en los valores se calcularon restando las mediciones de referencia de las mediciones de punto final. Para el diámetro del LA, se observaron diferencias con -0,48 ± 2,86 mm en el grupo MSC y 2,97 ± 2,38 mm en el grupo control (p < 0,05) (Figura 2B). En cuanto a la velocidad E, los cambios fueron de -0,08 ± 0,16 m/s en el grupo MSC y de 0,26 ± 0,30 m/s en el grupo control (p < 0,05) (Figura 2C).
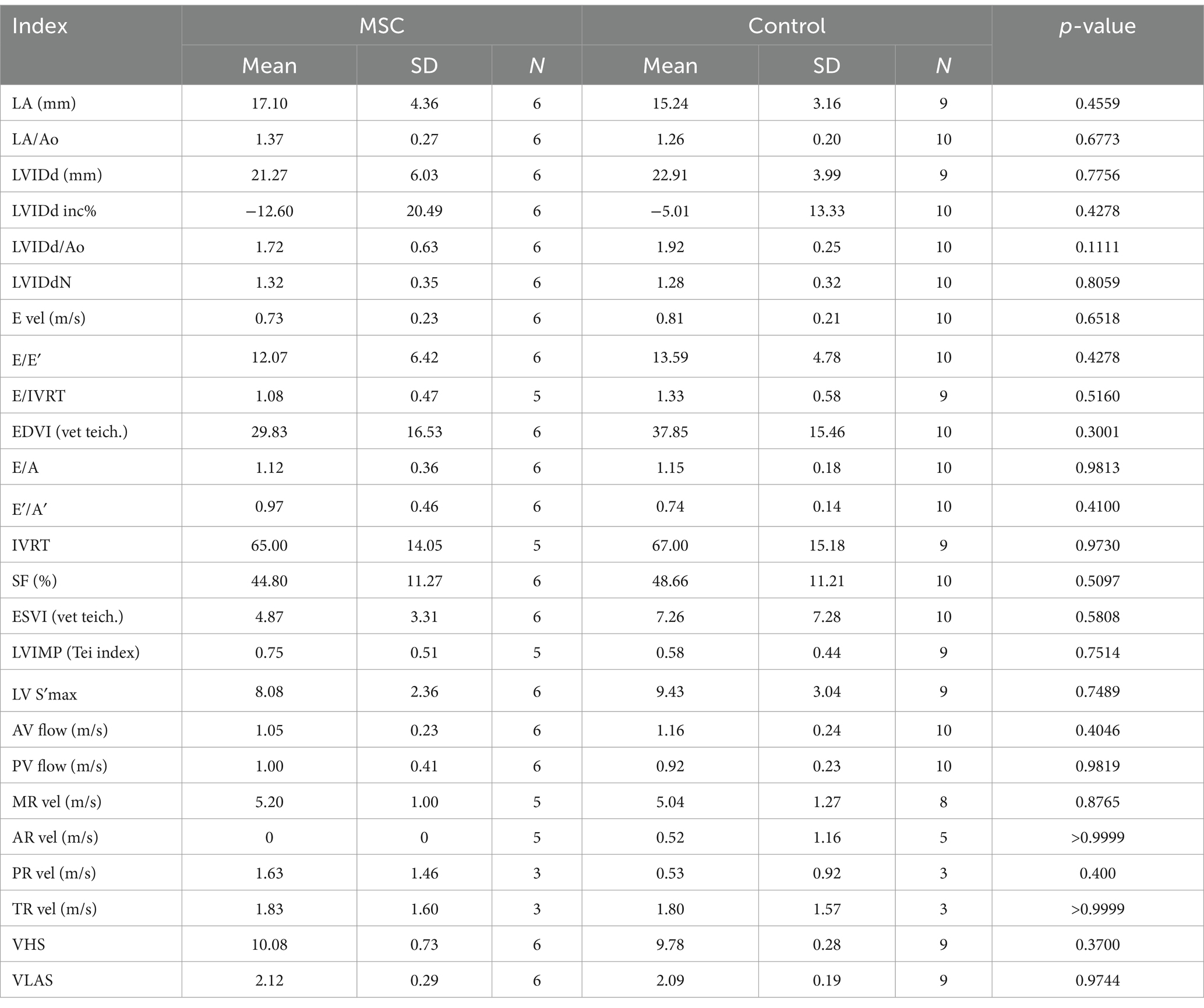
Tabla 3. Comparaciones de los parámetros ecocardiográficos y radiográficos entre las MSC y los grupos control al inicio del estudio.
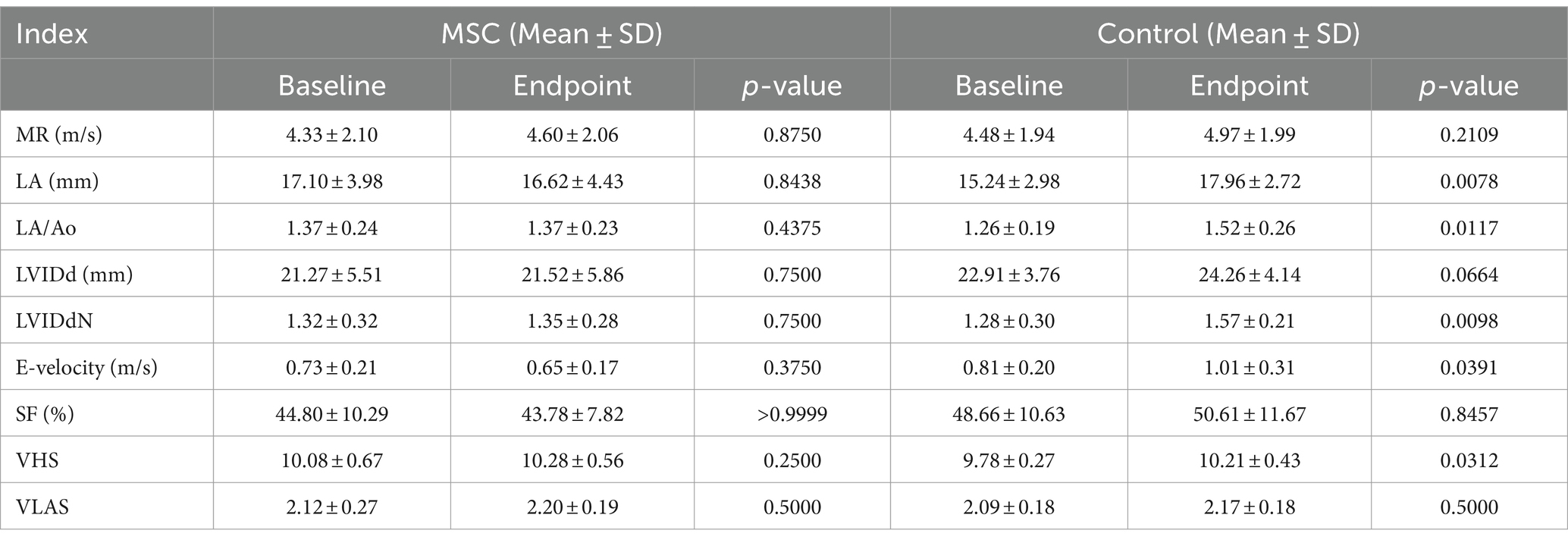
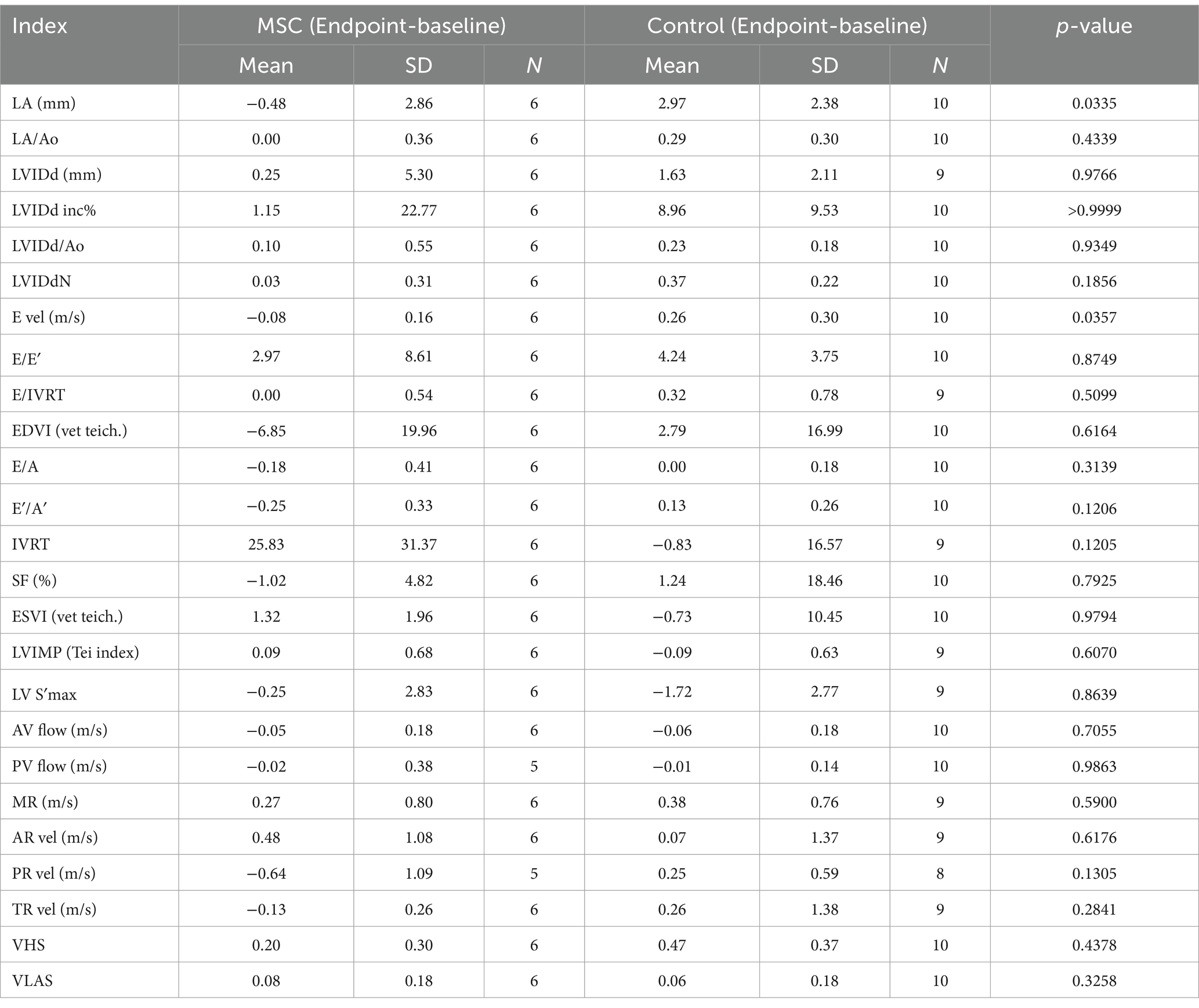
Tabla 4. Cambios en los parámetros ecocardiográficos y radiográficos entre el criterio de valoración y el inicio en los grupos respectivos.
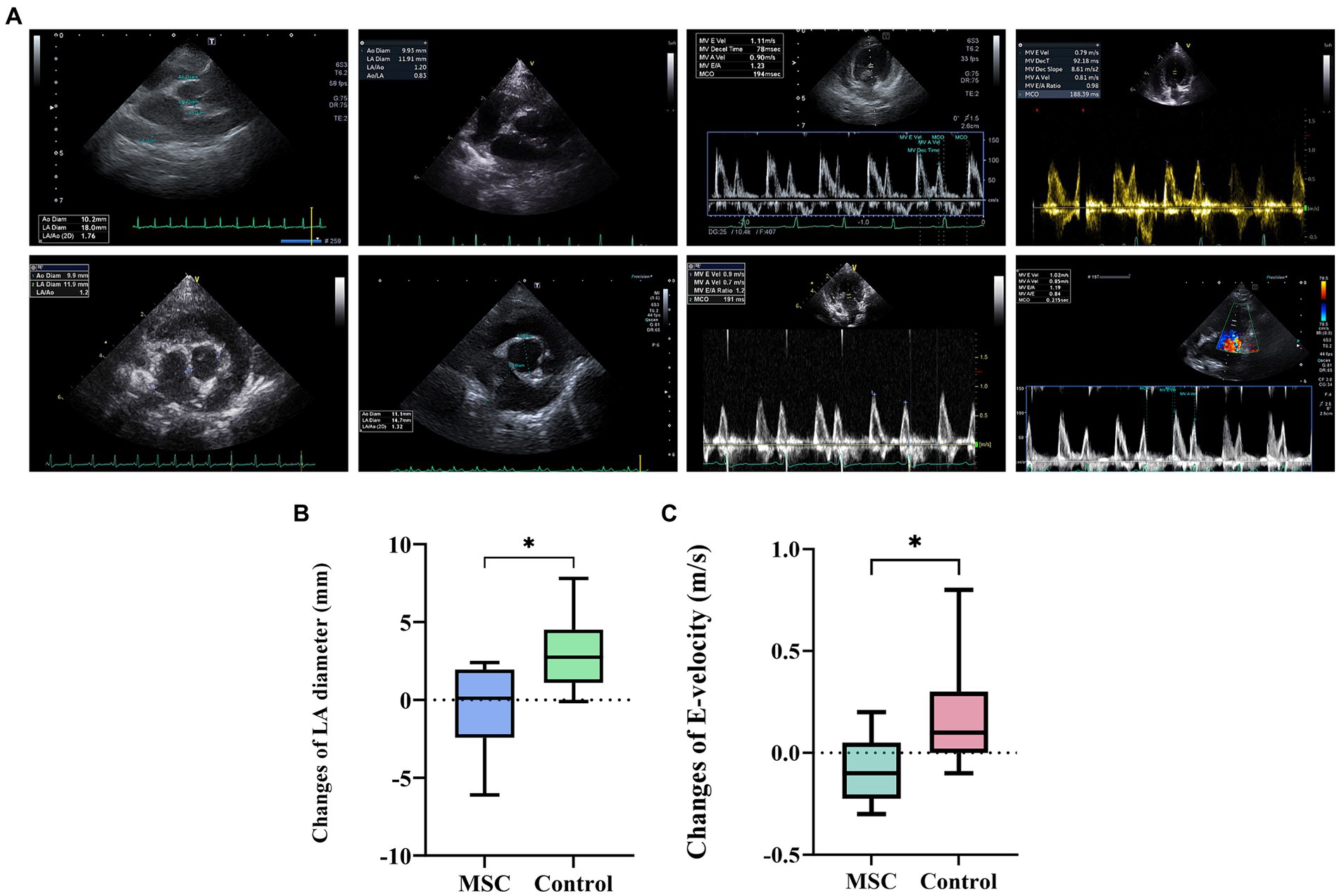
Figura 2. Análisis comparativo de los cambios ecocardiográficos en el MSC y en los grupos control. Comparación de los cambios en la ecocardiografía entre el criterio de valoración y el basal en el MSC y en los grupos control (A). El paciente A1 demostró una mejoría de 18 mm a 11,9 mm en el diámetro de la AI antes (basal) y después (final) del tratamiento con células madre, respectivamente, con una disminución del pico E de 1,1 m/s a 0,8 m/s después del tratamiento. Por el contrario, el paciente B3, parte del grupo control, mostró un aumento en el diámetro de LA de 11,9 mm a 14,7 mm después de 1 año, con un aumento de la velocidad E de 0,9 m/s a 1 m/s. Los cambios en el diámetro de la aurícula izquierda entre el punto final y el basal después del tratamiento con MSC derivadas del tejido gonadal canino, mostraron diferencias de 0,48 ± 2,86 mm en el grupo MSC y 2,97 ± 2,38 mm en el grupo control, lo que indica una diferencia estadísticamente significativa (p < 0,05) (B). Los cambios en la velocidad E entre el punto final y el basal después de la terapia con MSC derivadas del tejido gonadal canino, con los cambios en la velocidad E de -0,08 ± 0,16 m/s en el grupo MSC y 0,26 ± 0,30 m/s en el grupo control, mostrando una diferencia estadísticamente significativa entre ellos (p < 0,05) (C). *P < 0,05.
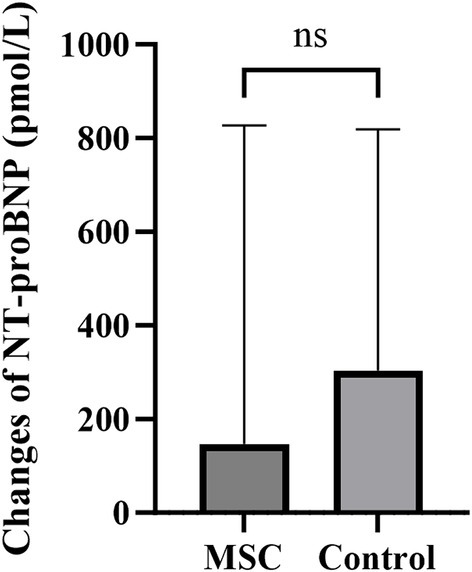
3.4 Comparaciones de los cambios en NT-proBNP entre el criterio de valoración y el valor basal en los grupos de tratamiento y control de MSC
Las mediciones de NT-proBNP se realizaron anualmente al inicio y al final. El cambio en los valores se calculó restando las mediciones de referencia de las mediciones de punto final. Los cambios medios en el NT-proBNP sérico fueron de 146,80 ± 608,72 pmol/L y de 304,14 ± 476,75 pmol/L para los grupos MSC y control, respectivamente. No se observaron diferencias significativas entre los grupos control y MSC (Figura 3).
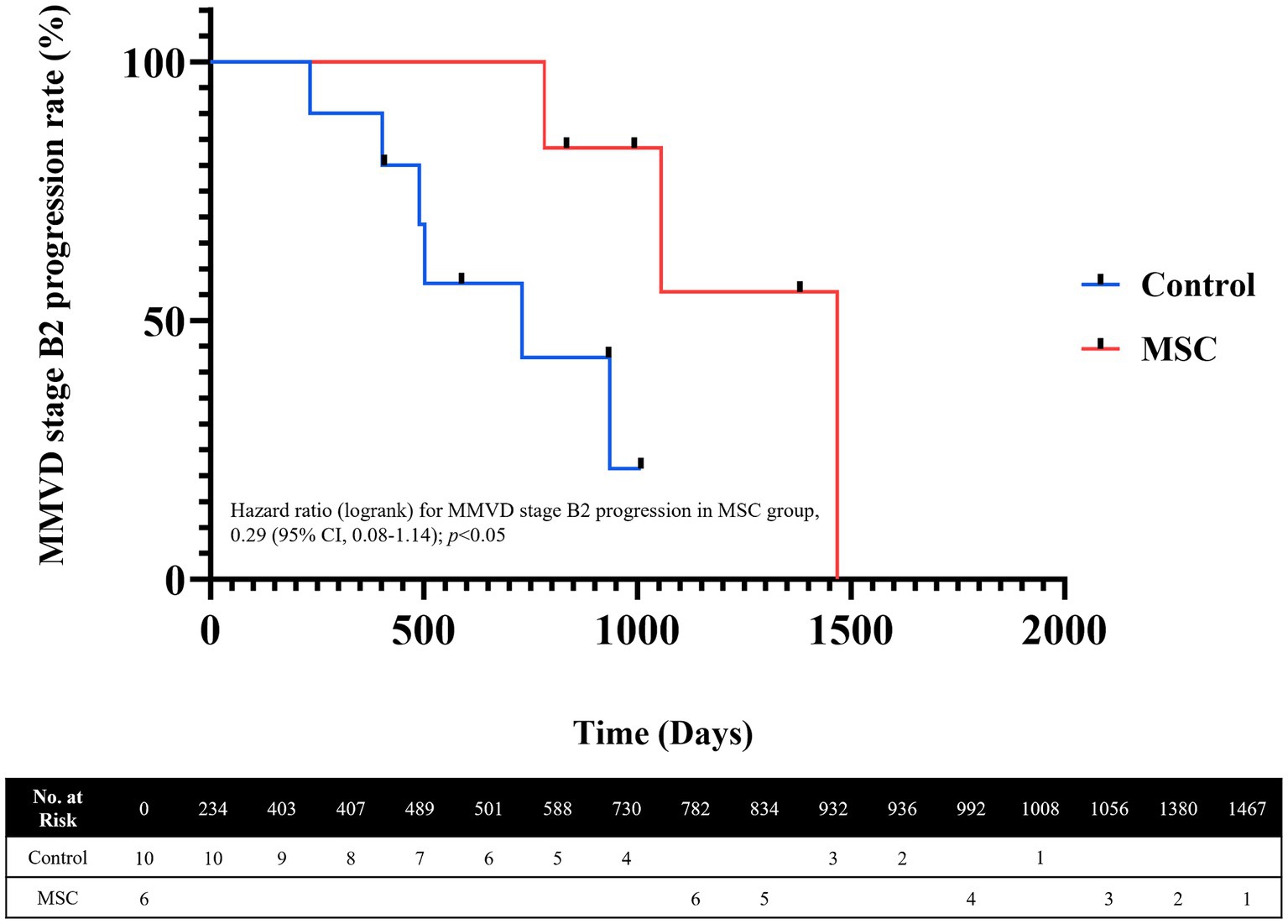
3.5 Análisis de la progresión del estadio MMVD ACVIM mediante la curva de Kaplan-Meier
Entre los seis perros en el grupo de terapia MSC, tres progresaron de MMVD B1 a B2 durante el período de monitoreo de 1 año. Por el contrario, entre los 10 perros del grupo control que fueron monitoreados durante 1 año, cinco progresaron de MMVD B1 a B2 (Tabla 6). La duración media desde el diagnóstico de B1 hasta la transición a B2 fue de 1101,67 ± 344,78 días en el grupo de tratamiento con MSC y de 548,83 ± 248,59 días en el grupo control. La mediana de la duración de la progresión de MMVD (de B1 a B2) fue de 730 días en el grupo control y de 1.467 días para el grupo MSC, respectivamente (p = 0,038) (Figura 4).
3.6 Evaluación de la puntuación de la calidad de vida
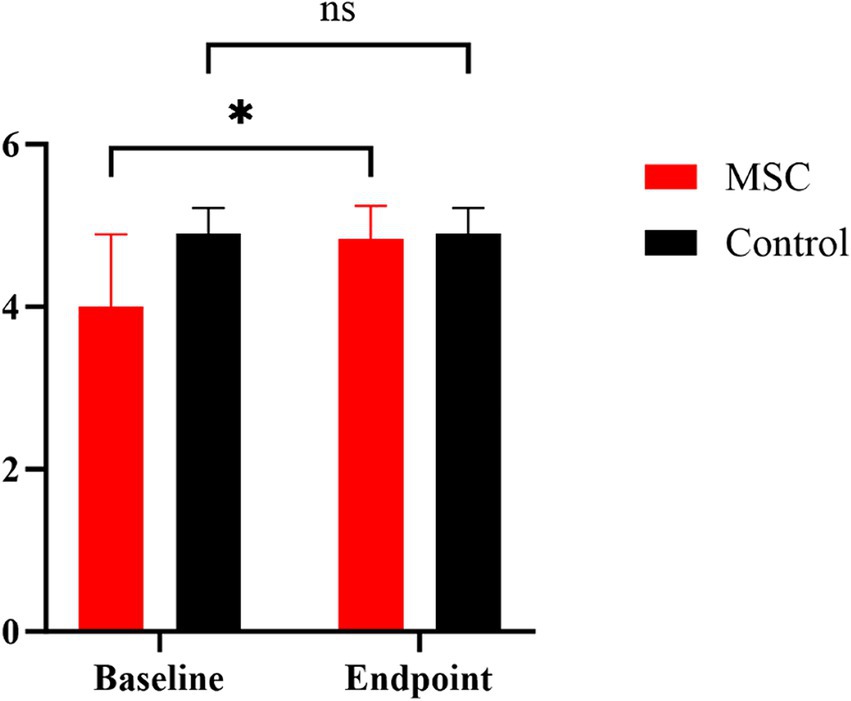
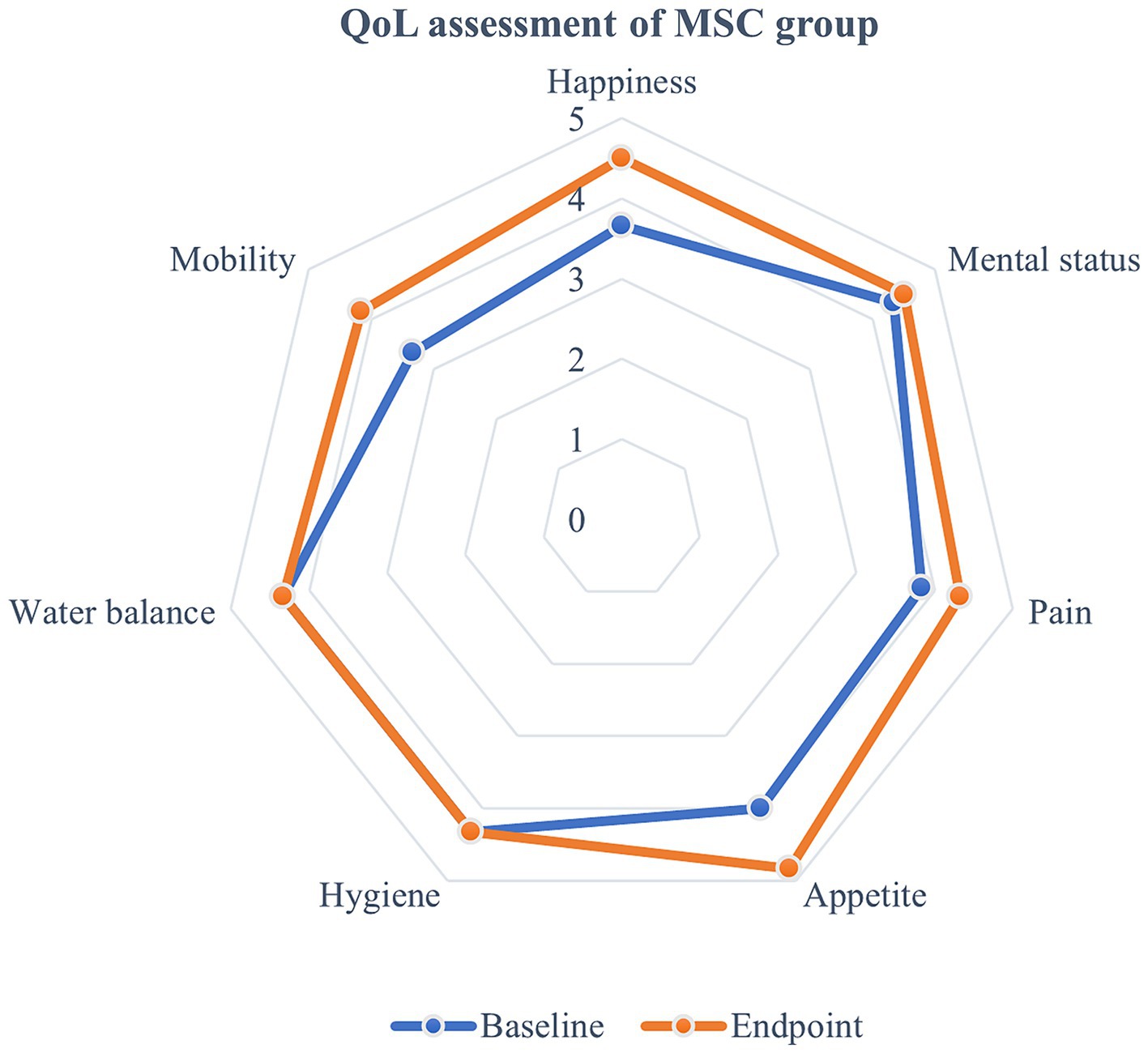
Se evaluaron las métricas de la calidad de vida (QoL) antes y después del tratamiento con células madre mesenquimales (MSC), demostrando mejoras estadísticamente significativas después del tratamiento. La felicidad aumentó de un promedio de 3,67 al inicio del estudio a 4,5 al final, y el estado mental mejoró de 4,33 a 4,5. Los niveles de dolor disminuyeron, con puntuaciones que aumentaron de 3,83 a 4,33, y el apetito mostró una mejoría estadísticamente significativa, aumentando de 4 a 4,83 (p < 0,05) (Figura 5). Aunque otros parámetros de la CV, como la higiene, el balance hídrico y la movilidad, también mostraron cambios (la movilidad, por ejemplo, mejoró de 3,33 a 4,17), estos cambios no fueron estadísticamente significativos (Figura 6). La puntuación general de la CV aumentó de 27,83 al inicio del estudio a 31 al final, lo que sugiere una mejora en la calidad de vida de los pacientes después del tratamiento con MSC. En el grupo control, no se observaron diferencias estadísticamente significativas en los ítems de evaluación de la CV en el transcurso de 1 año.
3.7 Prescripción de medicamentos para la MMVD
Durante el período de evaluación, se prescribió pimobendan a pacientes que progresaban a MMVD estadio B2 en ambos grupos (Tabla 6).
3.8 Análisis de la seguridad de la terapia con MSCs
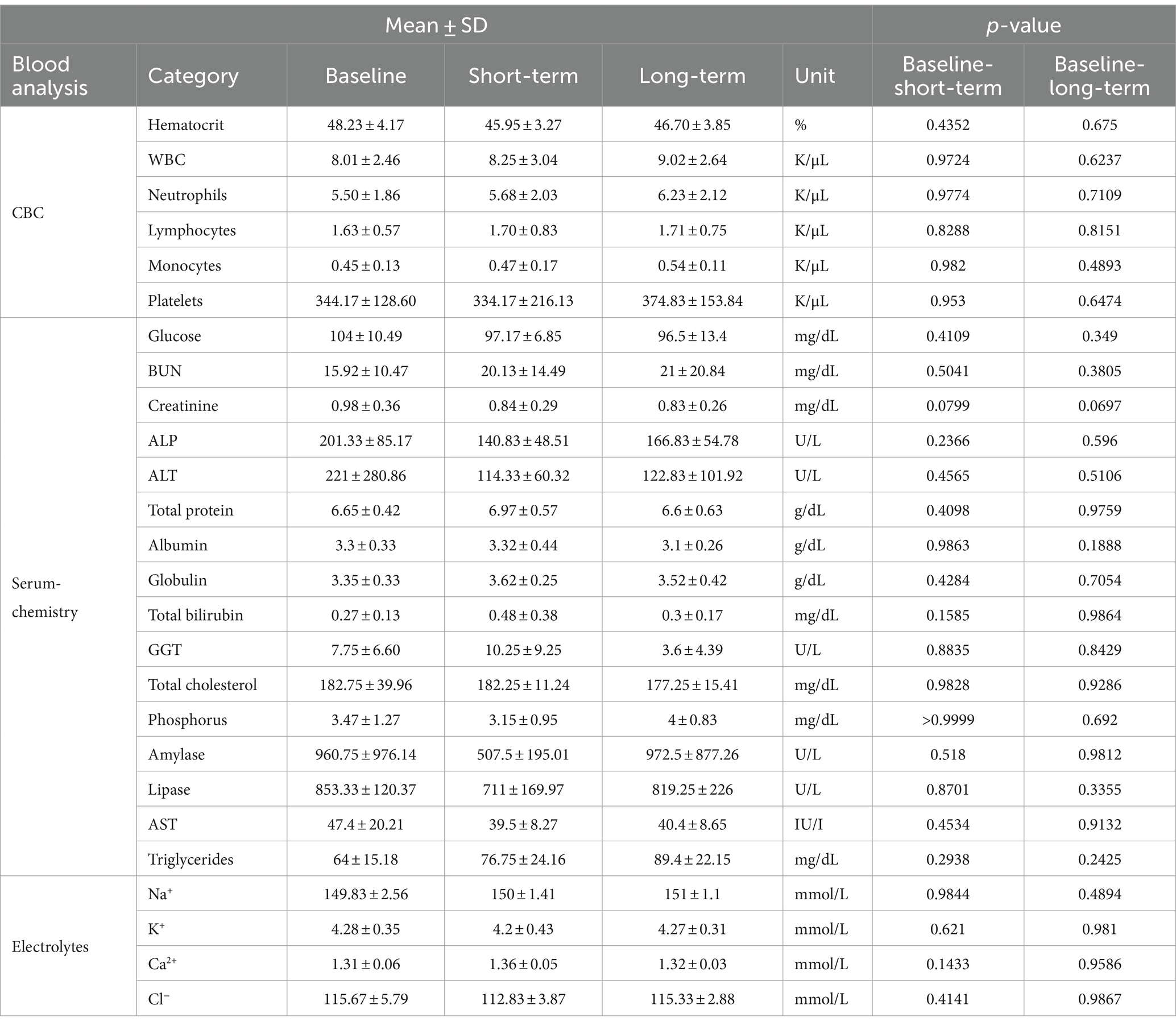
Los pesos se midieron a intervalos anuales en el grupo de terapia MSC. Al inicio del estudio, el peso se registró entre 5,25 ± 3,17 kg, y al final fue de 5,38 ± 3,32 kg, lo que indica un aumento de peso en el período de 1 año. En el grupo control, los pesos basales y finales fueron de 4,89 ± 1,10 kg y de 4,76 ± 1,17 kg, respectivamente, mostrando una tendencia a la pérdida de peso a lo largo del año. Sin embargo, no hubo diferencias estadísticamente significativas en los cambios de peso entre el inicio y el criterio de valoración dentro de cada grupo (grupo de terapia MSC, p = 0,3125; grupo control, p = 0,3672) (Figuras 7A,B). Tampoco hubo diferencias estadísticamente significativas en los cambios de peso (criterio final-referencial) entre los grupos de tratamiento con MSC (0,14 ± 0,22 kg) y control (0,00 ± 0,25) (p = 0,1369) (Figura 7C). En el grupo de tratamiento con MSC, los resultados de los análisis de sangre para el hemograma completo y la química sérica (glucosa, nitrógeno ureico en sangre, creatinina, ALP, ALT, proteína total, albúmina, globulina, relación albúmina/globulina, bilirrubina total, GGT, colesterol total, fósforo, amilasa, lipasa, AST y TG) y electrolitos (Na+, K+, Ca2+ y Cl–.) se compararon al inicio y a corto plazo (3 meses) y a largo plazo (12 meses). No se observaron diferencias estadísticamente significativas entre los resultados de los análisis de sangre a corto y largo plazo antes y después del tratamiento con células madre mesenquimales (Tabla 7). Durante el período de seguimiento en el grupo de tratamiento con MSC, la radiografía torácica y la ecografía abdominal no revelaron evidencia de formación de tumores. No se observaron reacciones adversas a corto o largo plazo después de la terapia con células madre mesenquimales.

4 Discusión
Tanto el grupo de tratamiento con MSCs como el grupo control correspondieron al estadio B1 de MMVD. Este estudio tuvo como objetivo evaluar la seguridad y eficacia de la terapia con células madre mesenquimales derivadas del tejido gonadal en pacientes caninos con MMVD canina en etapa temprana. El grupo de tratamiento con MSC recibió cinco o más inyecciones intravenosas consecutivas y la monitorización cardíaca se realizó a intervalos anuales. Los efectos del tratamiento se evaluaron mediante comparación con un grupo control en función de la progresión a MMVD estadio B2 y los indicadores ecocardiográficos. Se observó una disparidad estadísticamente significativa en el diámetro de la aurícula izquierda (0,48 ± 2,86 mm en el grupo MSC y 2,97 ± 2,38 mm en el grupo control) y la velocidad E (−0,08 ± 0,16 m/s en el grupo MSC y 0,26 ± 0,30 m/s en el grupo control) entre los dos grupos (p < 0,05), lo que indica un impacto favorable de la MSC derivada del tejido gonadal sobre la presión auricular izquierda. Además, la mediana de la duración de la progresión hasta el estadio B2 de MMVD fue de 730 días para el grupo de control y de 1.467 días para el grupo MSC. El grupo de tratamiento demostró una progresión tardía (p = 0,038), lo que les permitió prolongar la duración de su enfermedad sin necesidad de medicación cardíaca. Este estudio reveló efectos terapéuticos positivos en el grupo de tratamiento con MSC en pacientes con MMVD B1, sin que se observaran eventos adversos significativos en el seguimiento a corto o largo plazo de los indicadores sanguíneos y las reacciones.
La MMVD implica la aparición de degeneración mixomatosa en las válvulas mitrales, lo que conduce a fibrosis valvular, cambios morfológicos y el inicio de regurgitación sanguínea, lo que finalmente resulta en insuficiencia cardíaca (25). Diego et al. analizaron los perfiles proinflamatorios e inmunológicos para dilucidar los mecanismos fisiopatológicos de la MMVD canina. Descubrieron que las células Treg desempeñaban un papel en el mantenimiento de la tolerancia periférica, y los niveles de TNF-α, IL-1β e IL-6 aumentaban significativamente con la gravedad de la enfermedad en MMVD. Una correlación positiva entre la IL-6 y el volumen diastólico del ventrículo izquierdo sugiere que la activación inflamatoria puede estar involucrada en la remodelación cardíaca relacionada con la sobrecarga volumétrica progresiva en la MMVD (26). Además, un estudio indicó que la señalización del factor de crecimiento transformante-β (TGF-β) y las especies reactivas de oxígeno contribuyen significativamente a la expresión génica profibrótica en las válvulas mitrales mixomatosas. Sugirieron que las terapias dirigidas a la reducción de la activación del TGF-β y el estrés oxidativo en la MMVD temprana podrían ayudar a desacelerar su progresión (4).
Las células madre mesenquimales son conocidas por su capacidad para regenerar tejidos dañados y demuestran importantes efectos antiinflamatorios y antifibróticos. En particular, la terapia con células madre mesenquimales suprime los genes profibróticos en modelos experimentales de fibrosis hepática al inhibir la liberación de TGF-β (27). Al aprovechar los sistemas redox, la terapia con células madre mesenquimales ha demostrado su potencial como intervención antifibrótica para resistir el estrés oxidativo inducido por especies reactivas de oxígeno (28). Los pacientes con infarto agudo de miocardio demuestran protección miocárdica a través de la terapia con células madre mesenquimales, que reduce notablemente la inflamación, estimula la diferenciación de las células miocárdicas y la angiogénesis en las áreas de infarto, aumenta la resistencia a la apoptosis y dificulta la fibrosis (29). Una limitación de este estudio es la imposibilidad de realizar pruebas ELISA para marcadores antiinflamatorios y antifibróticos en muestras de suero de pacientes reales. Por lo tanto, las investigaciones futuras deben apuntar a abordar este problema.
En este estudio, observamos un deterioro de los indicadores en el grupo control a partir de la ecocardiografía realizada anualmente, mientras que el grupo de terapia con células madre mesenquimales mostró un mantenimiento general de los indicadores. Las diferencias estadísticas observadas en el diámetro de la AI y el pico E en comparación con el grupo control sugieren un efecto positivo sobre la presión de la aurícula izquierda. Se ha planteado la hipótesis de que la terapia con células madre mesenquimales en la MMVD alivia la inflamación y la fibrosis de la válvula, lo que disminuye el grado de reflujo sanguíneo y, posteriormente, la presión auricular izquierda. En última instancia, se sugiere que estos efectos conducen a un retraso en la progresión a la etapa B2 debido a la aplicación de la terapia con células madre mesenquimales en las primeras etapas de la MMVD.
La administración de células madre mesenquimales a pacientes con MMVD en etapa temprana ofrece dos beneficios clave. En primer lugar, no se prescribe ningún tratamiento específico, incluida la medicación, para el estadio B1 de la MMVD; Se recomienda principalmente un seguimiento regular (6). Por el contrario, sobre la base de la investigación con pimobendan en pacientes con MMVD estadio B2, se puede esperar una disminución de la presión de la aurícula izquierda con el tratamiento farmacológico recomendado (6). Por lo tanto, la terapia con células madre mesenquimales puede considerarse como un tratamiento preventivo para los pacientes que aún no han sido tratados.
La terapia con MSC, cuando se administra durante las primeras etapas de la MMVD, retrasa eficazmente la progresión de la enfermedad. Esta intervención es prometedora, ya que potencialmente evita los efectos secundarios asociados con la terapia con múltiples medicamentos, incluidos los diuréticos utilizados en la insuficiencia cardíaca. Los diuréticos son esenciales en los pacientes con insuficiencia cardíaca. Sin embargo, también pueden provocar enfermedad renal. Insuficiencia cardíaca en etapa tardía, incluso pueden desencadenar una crisis llamada síndrome cardiorrenal (SRC) (30, 31). Los veterinarios se enfrentan a un dilema de tratamiento cuando manejan las enfermedades cardíacas y renales, que a menudo resultan en una mayor probabilidad de mortalidad (32). Al retrasar la progresión de la enfermedad cardíaca y, por lo tanto, reducir la dependencia de los medicamentos para el corazón, la terapia MSC presenta una vía prometedora para mejorar la calidad de vida y prolongar el tiempo de supervivencia de los pacientes con MMVD.
Las terapias con células madre mesenquimales de alto costo pueden ser inalcanzables para el estadio B1 de MMVD que no requiere un tratamiento extenso. Sin embargo, la administración intravenosa de MSC es una opción adecuada para tratar múltiples afecciones crónicas debido a la capacidad de las MSC para diseminarse por todo el cuerpo (30). Para los animales adultos mayores con varias enfermedades, la terapia con células madre mesenquimales ofrece no solo beneficios relacionados con el corazón, sino también mejoras potenciales en diferentes enfermedades. Los participantes en este estudio tenían múltiples comorbilidades, y se consideró la terapia con células madre mesenquimales por su potencial eficacia. Los tratamientos repetidos con MSC son seguros para los perros mayores con múltiples problemas de salud, incluidas las enfermedades cardíacas.
La determinación de una vía de administración adecuada es crucial en la terapia con células madre mesenquimales en función de las características de la enfermedad (33). Se han estudiado varias vías, como la intracoronaria, la inyección intramiocárdica, la vía intravenosa y las formas de parche, para las aplicaciones de las células madre mesenquimales en las enfermedades cardíacas (15, 34-37). Sin embargo, las rutas demasiado agresivas pueden no ser aconsejables debido a las preocupaciones sobre el deterioro cardíaco debido a la anestesia o el estrés en pacientes con enfermedades cardíacas (38, 39). Demostramos que un enfoque menos invasivo, como la administración intravenosa, puede ofrecer beneficios terapéuticos a los pacientes. Aunque la administración intravenosa puede tener tasas de injerto más bajas que los métodos más agresivos, se presume que tiene efectos positivos sobre el corazón debido a los efectos paracrinos del secretoma de células madre mesenquimales (18). En otro estudio, las células madre mesenquimales que migraron a los pulmones de pacientes con infarto de miocardio se redistribuyeron al tejido cardíaco dañado a través de efectos de guiado (34).
Estudios previos sobre la terapia intravenosa con MSC en pacientes con MMVD encontraron dificultades para observar mejoras a largo plazo en la función cardíaca (17, 18). Un estudio mostró una disminución en los resultados a los 60 días en comparación con los 30 días de la terapia con células madre mesenquimales, lo que genera preocupaciones sobre las bajas tasas de supervivencia de las células madre mesenquimales (17). En nuestro estudio, la terapia intravenosa con células madre mesenquimales se llevó a cabo a intervalos de 1 mes durante más de cinco sesiones, y algunos pacientes recibieron hasta 12 sesiones, lo que resultó en mejoras en los indicadores ecocardiográficos y un retraso en la progresión al estadio B2. Esto sugiere que múltiples sesiones de tratamiento a lo largo del tiempo podrían ser más beneficiosas que un solo tratamiento para los pacientes con MMVD.
Una de las principales ventajas de las MSC derivadas del tejido gonadal es que pueden utilizar el tejido desechado durante la cirugía de castración en animales jóvenes y sanos. Mediante la recolección de tejidos de animales jóvenes y el aislamiento de células madre mesenquimales autólogas conservadas mediante criopreservación, se puede establecer una operación de citobancos. Esto permite el uso futuro de estas células madre mesenquimales derivadas del tejido gonadal cuando los animales alcancen una edad más avanzada, cuando se desarrollen enfermedades crónicas. Jeung et al. informaron sobre la seguridad de la terapia MSC derivada del tejido gonadal en perros geriátricos con enfermedades crónicas. Además, su estudio indicó que estos resultados respaldan el potencial de las MSC derivadas del tejido gonadal como una opción terapéutica eficaz (40). A través del proceso de caracterización de las MSCs, confirmamos que el tejido gonadal es una fuente de MSCs. Demostramos su seguridad y eficacia en pacientes con MMVD en estadios tempranos.
Aunque este estudio incluyó solo seis perros en el grupo de terapia MSC, se necesitan futuros estudios a gran escala que comparen los efectos de la terapia con células madre mesenquimales en diferentes etapas de MMVD para evaluar su eficacia. Además, debido a la naturaleza retrospectiva del estudio, que se basó en los registros de tratamiento de los pacientes, no se pudo rastrear la migración de células madre mesenquimales ni las biopsias postmortem.
En nuestro estudio, el grupo control incluyó pacientes con MMVD B1 que recibieron tratamiento estándar sin intervención farmacológica hasta la progresión a B2. Debido a la naturaleza retrospectiva del estudio, no fue posible implementar un tratamiento con placebo para controlar los posibles sesgos. Sin embargo, los parámetros de imagen no mostraron diferencias significativas entre los dos grupos al inicio del estudio, lo que indica que eran comparables antes del tratamiento. Las diferencias observadas en el criterio de valoración sugieren que la influencia potencial de los efectos psicológicos se minimizó.
Estudios previos en humanos han demostrado que la terapia con MSC proporciona beneficios económicos en el tratamiento de enfermedades crónicas y graves. En particular, estos estudios destacan que la terapia con MSC puede ser rentable al retrasar la progresión de la enfermedad, mejorar la calidad de vida y la supervivencia, reducir la mortalidad hospitalaria y aumentar las tasas de alta (41-43). Si bien las evaluaciones económicas de la terapia con MSC se han llevado a cabo en estudios en humanos, ninguna investigación ha explorado aún sus beneficios económicos en la MMVD canina, lo que subraya la necesidad de más investigación en esta área.
En conclusión, el tratamiento con MSCs derivadas del tejido gonadal retrasó significativamente la progresión de la MMVD al mantener la etapa temprana durante un período más largo. Por lo tanto, la terapia con MSC se considera un tratamiento seguro y eficaz para los pacientes con MMVD en estadio B1 que se manejan sin tratamiento. Además, la amplia aplicabilidad de las células madre mesenquimales en condiciones complejas sugiere su amplio potencial en medicina veterinaria.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán facilitados por los autores, sin reservas indebidas.
Declaración ética
Los estudios en animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) del Centro Médico Animal VIP. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
SJ: Redacción – borrador original, Redacción – revisión y edición, Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Visualización. J-HA: Redacción – revisión y edición, Conceptualización, Metodología, Análisis formal, Supervisión, Visualización, Redacción – borrador original. S-SK: Redacción – revisión y edición, Curación de datos, Investigación, Metodología, Redacción – borrador original. H-YY: Redacción – revisión y edición, Análisis formal, Supervisión, Redacción – borrador original.
Financiación
El/los autor/es declara(n) que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1404607/full#supplementary-material
Abreviaturas
MSC: Célula madre mesenquimatosa; MMVD: Enfermedad mixomatosa de la válvula mitral; ACVIM, Colegio Americano de Medicina Interna Veterinaria; IACUC, Comité Institucional de Cuidado y Uso de Animales; SVF: fracción vascular estromal; LA, Aurícula izquierda; AO, Aorta; LVIDDN: Diámetro interno telediastólico del ventrículo izquierdo corregido; para el peso corporal; VHS: Tamaño del corazón vertebral; NT-proBNP: péptido natriurético N-terminal pro-tipo B; BUN, Nitrógeno ureico en sangre; ALP: fosfatasa alcalina; ALT: alanina aminotransferasa; GGT: Gamma-glutamil transferasa; Relación A/G, relación albúmina/globulina (A/G); TNF-α, Factor de Necrosis Tumoral alfa; TGF-β, Transformando el factor de crecimiento-β; IL-1β, interleucina-1 beta; IL-6: Interleucina 6; ROS: Especies reactivas de oxígeno; MCD: Miocardiopatía dilatada; FS: Acortamiento fraccionado; pDSCs, células madre de dientes deciduos de cachorro.
Referencias
1. Atkins, C, Bonagura, J, Ettinger, S, Fox, P, Gordon, S, Haggstrom, J, et al. Pautas para el diagnóstico y tratamiento de la valvulopatía crónica canina. J Veterinario Pasante Med. (2009) 23:1142–50. doi: 10.1111/j.1939-1676.2009.0392.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Kim, H-T, Han, S-M, Song, W-J, Kim, B, Choi, M, Yoon, J, et al. Estudio retrospectivo de la valvulopatía mitral degenerativa en perros de raza chica: supervivencia y variables pronósticas. J Vet Sci. (2017) 18:369–76. doi: 10.4142/jvs.2017.18.3.369
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Keene, BW, Atkins, CE, Bonagura, JD, Fox, PR, Häggström, J, Fuentes, VL, et al. Directrices de consenso de Acvim para el diagnóstico y tratamiento de la enfermedad mixomatosa de la válvula mitral en perros. J Veterinario Pasante Med. (2019) 33:1127–40. doi: 10.1111/jvim.15488
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Hagler, MA, Hadley, TM, Zhang, H, Mehra, K, Roos, CM, Schaff, HV, et al. La señalización de Tgf-Β y las especies reactivas de oxígeno impulsan la fibrosis y la remodelación de la matriz en las válvulas mitrales mixomatosas. Cardiovasc Res. (2013) 99:175–84. doi: 10.1093/cvr/cvt083
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Borgarelli, M, y Haggstrom, J. Enfermedad degenerativa mixomatosa de la válvula mitral canina: historia natural, presentación clínica y tratamiento. Vet Clin North Am Pequeño Anim Pract. (2010) 40:651–63. doi: 10.1016/j.cvsm.2010.03.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Boswood, A, Häggström, J, Gordon, SG, Wess, G, Stepien, RL, Oyama, MA, et al. Efecto de pimobendan en perros con enfermedad preclínica de la válvula mitral mixomatosa y cardiomegalia: el estudio Epic, un ensayo clínico aleatorizado. J Veterinario Pasante Med. (2016) 30:1765–79. doi: 10.1111/jvim.14586
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Swedberg, K, Cleland, J, Dargie, H, Drexler, H, Follath, F, Komajda, M, et al. Directrices para el diagnóstico y tratamiento de la insuficiencia cardíaca crónica: resumen ejecutivo (actualización 2005): grupo de trabajo para el diagnóstico y tratamiento de la insuficiencia cardíaca crónica de la Sociedad Europea de Cardiología. Eur Corazón J. (2005) 26:1115–40. doi: 10.1093/eurheartj/ehi204
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Kolf, CM, Cho, E y Tuan, RS. Células estromales mesenquimales: biología de las células madre mesenquimales adultas: regulación del nicho, autorrenovación y diferenciación. artritis res ther. (2007) 9:204. DOI: 10.1186/AR2116
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Zhang, R, Liu, Y, Yan, K, Chen, L, Chen, X-R, Li, P, et al. Mecanismos antiinflamatorios e inmunomoduladores del trasplante de células madre mesenquimales en el traumatismo craneoencefálico experimental. J Neuroinflamación. (2013) 10:871. doi: 10.1186/1742-2094-10-106
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Wang, M, Yuan, Q y Xie, L. Inmunomodulación basada en células madre mesenquimales: propiedades y aplicación clínica. Células Madre Int. (2018) 2018:3057624–12. doi: 10.1155/2018/3057624
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Jin, Q-H, Kim, H-K, Na, J-Y, Jin, C y Seon, J-K. Los efectos antiinflamatorios de los medios condicionados con células madre mesenquimales inhibieron la activación de los macrófagos in vitro. Sci Rep. (2022) 12:4754. doi: 10.1038/s41598-022-08398-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Berebichez-Fridman, R, y Montero-Olvera, PR. Fuentes y aplicaciones clínicas de las células madre mesenquimales: revisión del estado del arte. Sultán Qaboos Univ Med J. (2018) 18:E264–77. doi: 10.18295/squmj.2018.18.03.002
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Voga, M, Adamic, N, Vengust, M y Majdic, G. Células madre en medicina veterinaria: estado actual y opciones de tratamiento. Frente Vet Sci. (2020) 7:278. doi: 10.3389/fvets.2020.00278
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Quimby, JM, y Borjesson, DL. Terapia con células madre mesenquimales en gatos: conocimiento actual y potencial futuro. J Feline Med Surg. (2018) 20:208–16. doi: 10.1177/1098612×18758590
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Hensley, MT, Tang, J, Woodruff, K, Defrancesco, T, Tou, S, Williams, CM, et al. Las células madre alogénicas intracoronarias derivadas de la cardiosfera son seguras para su uso en perros con miocardiopatía dilatada. J Cell Mol Med. (2017) 21:1503–12. doi: 10.1111/jcmm.13077
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Sousa, MG, Paulino-Junior, D, Pascon, JP, Pereira-Neto, GB, Carareto, R, Champion, T, et al. Función cardíaca en perros con miocardiopatía crónica de Chagas sometidos a trasplante autólogo de células madre en las arterias coronarias. ¿Puede Vet J. (2011) 52:869–74.
17. Petchdee, S y Sompeewong, S. Administración intravenosa de células madre de dientes deciduos de cachorro en la enfermedad valvular degenerativa. Mundo Veterinario. (2016) 9:1429–34. doi: 10.14202/vetworld.2016.1429-1434
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Yang, VK, Meola, DM, Davis, A, Barton, B y Hoffman, AM. Administración intravenosa de células madre mesenquimales alogénicas derivadas de la gelatina de Wharton para el tratamiento de perros con insuficiencia cardíaca congestiva secundaria a la enfermedad mixomatosa de la válvula mitral. Am J Vet Res. (2021) 82:487–93. doi: 10.2460/ajvr.82.6.487
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Kabat, M, Bobkov, I, Kumar, S y Grumet, M. Tendencias en los ensayos clínicos con células madre mesenquimales 2004-2018: ¿es la eficacia óptima en un rango de dosis estrecho? Células Madre Transl Med. (2020) 9:17–27. doi: 10.1002/sctm.19-0202
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Penha, EM, Meira, CS, Guimarães, ET, Mendonça, MV, Gravely, FA, Pinheiro, CM, et al. Uso de células madre mesenquimales autólogas derivadas de la médula ósea para el tratamiento de la médula espinal naturalmente lesionada en perros. Células Madre Int. (2014) 2014:437521:1–8. doi: 10.1155/2014/437521
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Vikartovska, Z, Kuricova, M, Farbakova, J, Liptak, T, Mudronova, D, Humenik, F, et al. Tratamiento con medio condicionado con células madre para la lesión medular canina: estudio piloto de factibilidad. Int J Mol Sci. (2020) 21:5129. doi: 10.3390/ijms21145129
22. Rhew, SY, Park, SM, Li, Q, An, JH, Chae, HK, Lee, JH, et al. Eficacia y seguridad de la terapia alogénica con células madre mesenquimales derivadas del tejido adiposo canino para la diabetes mellitus insulinodependiente en cuatro perros: un estudio piloto. J Vet Med Sci. (2021) 83:592–600. doi: 10.1292/jvms.20-0195
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Connick, P, Kolappan, M, Crawley, C, Webber, DJ, Patani, R, Michell, AW, et al. Células madre mesenquimales autólogas para el tratamiento de la esclerosis múltiple secundaria progresiva: un estudio abierto de prueba de concepto de fase 2a. Lanceta Neurol. (2012) 11:150–6. doi: 10.1016/s1474-4422(11)70305-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Lavan, RP. Desarrollo y validación de una encuesta para la evaluación de la calidad de vida de los propietarios de perros sanos. Veterinario J. (2013) 197:578–82. doi: 10.1016/j.tvjl.2013.03.021
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Oyama, MA, Elliott, C, Loughran, KA, Kossar, AP, Castillero, E, Levy, RJ, et al. Patología comparada de la degeneración de la válvula mitral mixomatosa humana y canina: mecanismos de 5ht y Tgf-Β. Cardiovasc Pathol. (2020) 46:107196. doi: 10.1016/j.carpath.2019.107196
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Piantedosi, D, Musco, N, Palatucci, AT, Carriero, F, Rubino, V, Pizzo, F, et al. Perfil proinflamatorio e inmunológico de perros con valvulopatía mixomatosa mitral. Veterinario Sci. (2022) 9:326. doi: 10.3390/vetsci9070326
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Hermansyah, D, Putra, A, Muhar, AM, Retnaningsih, WK y Dirja, BT. Las células madre mesenquimales suprimen la liberación de Tgf-Β para disminuir la expresión de Α-Sma en la mejora de la fibrosis hepática inducida por Ccl4. Med Arch. (2021) 75:16–22. doi: 10.5455/medarh.2021.75.16-22
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Kumar, S, Verma, R, Tyagi, N, Gangenahalli, G, y Verma, YK. Efecto terapéutico de las células estromales mesenquimales en los daños inducidos por especies reactivas de oxígeno. Célula humeante. (2022) 35:37–50. doi: 10.1007/s13577-021-00646-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Guo, Y, Yu, Y, Hu, S, Chen, Y y Shen, Z. El potencial terapéutico de las células madre mesenquimales para las enfermedades cardiovasculares. Muerte celular Dis. (2020) 11:349. doi: 10.1038/s41419-020-2542-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Chen, J, Luo, L, Tian, R y Yu, C. Una revisión y actualización de los estudios clínicos registrados de células madre para enfermedades no tumorales y no hematológicas. Terapia Regenerativa. (2021) 18:355–62. doi: 10.1016/j.reth.2021.09.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Casu, G, y Merella, P. Terapia diurética en la insuficiencia cardíaca: enfoques actuales. Eur Cardiol. (2015) 10:42–7. doi: 10.15420/ECR.2015.10.01.42
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Taveira Gomes, T, Santos Araujo, C, Valente, F, Bernardo, F, Seabra Carvalho, D, Bodegard, J, et al. Síndrome cardiorrenal y riesgo de muerte en pacientes con insuficiencia cardíaca o enfermedad renal crónica: ¿una necesidad cardiorrenal insatisfecha? Eur Corazón J. (2021) 42:819. doi: 10.1093/eurheartj/ehab724.0819
33. Caplan, H, Olson, SD, Kumar, A, George, M, Prabhakara, KS, Wenzel, P, et al. Administración terapéutica de células estromales mesenquimales: desafíos traslacionales para la aplicación clínica. Frente Immunol. (2019) 10:10. doi: 10.3389/fimmu.2019.01645
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Campbell, NG y Suzuki, K. Rutas de entrega de células para la terapia con células madre al corazón: enfoques actuales y futuros. J Cardiovasc Transl Res. (2012) 5:713–26. doi: 10.1007/s12265-012-9378-3
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Yagyu, T, Yasuda, S, Nagaya, N, Doi, K, Nakatani, T, Satomi, K, et al. Resultados a largo plazo del trasplante intracardíaco de células madre mesenquimales en pacientes con miocardiopatía. Circ J. (2019) 83:1590–9. DOI: 10.1253/circj. CJ-18-1179
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Wang, QL, Wang, HJ, Li, ZH, Wang, YL, Wu, XP y Tan, YZ. El parche cardíaco cargado con células madre mesenquimales promueve la activación epicárdica y la reparación del miocardio infartado. J Cell Mol Med. (2017) 21:1751–66. doi: 10.1111/jcmm.13097
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Lee, K, Xue, Y, Lee, J, Kim, HJ, Liu, Y, Tebon, P, et al. Un parche de depósito de microagujas híbridas desmontables para la administración localizada de células madre mesenquimales en la terapia de regeneración. adv funnt mater. (2020) 30:2000086. doi: 10.1002/adfm.202000086
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Froehlich, JB, y Eagle, KA. La anestesia y el paciente cardíaco: el paciente frente al procedimiento. Corazón. (2002) 87:91–6. doi: 10.1136/corazón.87.1.91
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Hughes, JML. Anestesia para el perro y el gato geriátricos. Ir Vet J. (2008) 61:380–7. doi: 10.1186/2046-0481-61-6-380
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Jeung, S-Y, An, J-H, Kim, S-S y Youn, H-Y. Seguridad de la terapia con células madre mesenquimales derivadas de tejido gonadal en perros geriátricos con enfermedades crónicas. Animales. (2024) 14:2134. doi: 10.3390/ani14142134
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Suh, K, Cole, BJ, Gomoll, A, Lee, SM, Choi, H, Ha, CW, et al. Rentabilidad de las células madre mesenquimales alogénicas derivadas de la sangre del cordón umbilical en pacientes con artrosis de rodilla. Política de salud de Appl Health Econ. (2023) 21:141–52. doi: 10.1007/s40258-022-00762-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Barry, LE, Crealey, GE, Cockwell, P, Elliman, SJ, Griffin, MD, Maxwell, AP, et al. Terapia con células estromales mesenquimales comparada con inhibidores de Sglt2 y cuidados habituales en el tratamiento de la enfermedad renal diabética: un análisis de coste-efectividad. PLoS Uno. (2022) 17:e0274136. doi: 10.1371/journal.pone.0274136
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Thavorn, K, van Katwyk, S, Krahn, M, Mei, SHJ, Stewart, DJ, Fergusson, D, et al. Valor de la terapia con células madre mesenquimales para pacientes con shock séptico: una evaluación económica temprana de la salud. Int J Tecnol Evaluar la atención de la salud. (2020) 36:525–32. doi: 10.1017/S0266462320000781
Palabras clave: ACVIM estadio B1, canino, estadio temprano, tejido gonadal, cardiopatía, células madre mesenquimales, enfermedad mixomatosa de la válvula mitral, medicina regenerativa
Cita: Jeung S, An J-H, Kim S-S y Youn H-Y (2024) Seguridad y eficacia de las células madre mesenquimales derivadas del tejido gonadal canino para la enfermedad mixomatosa temprana de la válvula mitral. Frente. Vet. Sci. 11:1404607. doi: 10.3389/fvets.2024.1404607
Recibido: 21 de marzo de 2024; Aceptado: 18 de septiembre de 2024;
Publicado: 02 de octubre de 2024.
Editado por:
Scott J. Roberts, Real Colegio Veterinario, Reino Unido
Revisado por:
Luca Melotti, Universidad de Padua, Italia
Chen Chen, Universidad de Zhejiang, China
Derechos de autor © 2024 Jeung, An, Kim y Youn. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Atribución (CC BY).
*Correspondencia: Hwa-Young Youn, hyyoun@snu.ac.kr
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía