Susceptibilidad antimicrobiana de estafilococos de muestras de leche bovina en análisis rutinarios de mastitis microbiológica
 Susceptibilidad antimicrobiana de estafilococos de muestras de leche bovina en análisis rutinarios de mastitis microbiológica en Finlandia
Susceptibilidad antimicrobiana de estafilococos de muestras de leche bovina en análisis rutinarios de mastitis microbiológica en Finlandia
 Suvi Taponen*
Suvi Taponen*  Heikki-Tapio Tölli
Heikki-Tapio Tölli  Päivi J. Rajala-Schultz
Päivi J. Rajala-Schultz- Departamento de Medicina Animal de Producción, Facultad de Medicina Veterinaria, Universidad de Helsinki, Saarentaus, Finlandia
La razón más frecuente para el uso de antimicrobianos en los rebaños lecheros es la mastitis y el conocimiento sobre los patógenos causantes de mastitis y su susceptibilidad antimicrobiana debe guiar las decisiones de tratamiento. El objetivo general de este estudio fue evaluar la resistencia a los antimicrobianos (RAM) de los estafilococos en muestras de leche mastítica en Finlandia. MALDI-ToF MS identificó un total de 504 aislados de Staphylococcus (260 S. aureus y 244 estafilococos no áureos, NAS) procedentes de muestras de leche mastítica bovina. La susceptibilidad fenotípica frente a cefoxitina, ceftiofur, enrofloxacino, gentamicina, oxacilina, penicilina y tetraciclina se evaluó mediante el método de difusión en disco y la presencia de genes blaZ, mecA y mecC investigada por PCR. La prueba de nitrocefina evaluó la producción de betalactamasas de estos aislados. Las especies NAS más comunes fueron S. simulans, S. epidermidis, S. chromogenes y S. haemolyticus. En total, el 26,6% de los aislados (18,5% de S. aureus y 35,2% de todos los NAS) portaban el gen blaZ. La resistencia a la penicilina, basada en la difusión del disco, fue menor: el 18,8% de todos los aislamientos (9,3% de S. aureus y 28,9% de todos los NAS) fueron resistentes. Según la prueba de nitrocefina, el 21,5% de los aislados produjeron betalactamasa (11,6% de S. aureus y 32,0% de todos los NAS). Entre las especies de Staphylococcus, la proporción de aislados resistentes a la penicilina varió, siendo más baja en S. simulans y más alta en S. epidermidis. La resistencia a los antimicrobianos distintos de la penicilina fue rara. De los ocho aislados de NAS portadores del gen mecA, seis eran S. epidermidis. Un aislado de S. aureus portaba el gen mecC. La concordancia más allá del azar, evaluada por el coeficiente kappa, entre las pruebas de resistencia fenotípica y genotípica, fue de moderada a sustancial. Algunos estafilococos fenotípicamente susceptibles a la penicilina portaban el gen blaZ, pero los aislados sin genes blaZ o mec rara vez mostraron resistencia, lo que sugiere que la opción de tratamiento más confiable puede depender de las pruebas genotípicas de RAM. Nuestros resultados apoyan hallazgos anteriores de que la resistencia a la penicilina es la única forma significativa de resistencia a los antimicrobianos entre los estafilococos causantes de mastitis en Finlandia.
Introducción
La razón más frecuente para el uso de antimicrobianos en rebaños lecheros es la mastitis (1). El diagnóstico microbiológico y el conocimiento de la susceptibilidad antimicrobiana de los patógenos constituyen la base para el tratamiento eficaz de las infecciones intramamarias. La resistencia a los antimicrobianos ha sido una preocupación mundial creciente durante las últimas décadas (2, 3), con soluciones para combatir el problema que requieren esfuerzos conjuntos dentro de la medicina humana y veterinaria, en un verdadero espíritu de Una Salud (4, 5). El uso de antimicrobianos puede conducir a cepas resistentes, y los mecanismos de resistencia pueden transmitirse de una especie bacteriana o cepa a otra a través de elementos genéticos móviles (6). El monitoreo de la resistencia antimicrobiana de los patógenos causantes de mastitis es importante para garantizar la disponibilidad continua de tratamientos eficaces.
En Finlandia, se siguen pautas prudentes de uso de antimicrobianos para la terapia de mastitis: el análisis bacteriológico de muestras de leche antes del inicio del tratamiento antimicrobiano es una práctica común y la penicilina es el fármaco de elección en la mastitis causada por bacterias Gram-positivas (7). Además, siempre se ha implementado la terapia selectiva de vacas secas (SDCT), con solo aproximadamente una cuarta parte de las vacas que reciben tratamiento antibiótico con vacas secas al final de la lactancia (8). Desde 2010, un diagnóstico de mastitis en Finlandia se ha basado predominantemente en la metodología de PCR después de que la principal cooperativa lechera del país cambiara a PCR en su laboratorio de mastitis. Más tarde, también un laboratorio privado de diagnóstico veterinario y el laboratorio clínico del Departamento de Medicina Animal de Producción de la Universidad de Helsinki adoptaron esta tecnología. Los veterinarios ocasionalmente usan cultivos bacterianos y placas selectivas de agar en sus laboratorios clínicos para lograr un diagnóstico bacteriano rápido durante los fines de semana y el trabajo de guardia. El kit de PCR comercial (PathoProof™ Complete-16 PCR Assay, Thermo Fisher Scientific, Waltham, MA, Estados Unidos) utilizado en estos laboratorios de diagnóstico se dirige a los 15 principales patógenos de mastitis más el gen blaZ estafilocócico que codifica la producción de betalactamasa. Russi et al. (9) reportaron una discrepancia entre un hallazgo del gen blaZ y la resistencia fenotípica a la penicilina, un fenómeno también observable en el laboratorio clínico del Hospital de Animales de Producción, Facultad de Medicina Veterinaria, Universidad de Helsinki. Después de adoptar la metodología de PCR, el laboratorio ha utilizado pruebas de producción de betalactamasas tanto PCR como fenotípicas para determinar la susceptibilidad antimicrobiana de los estafilococos. Las discrepancias en los resultados hacen que las decisiones de tratamiento sean un desafío.
Staphylococcus spp. son los agentes causales más prevalentes de infecciones intramamarias en Finlandia, constituyendo aproximadamente el 64% de todos los patógenos aislados de IMI (10). La resistencia de los estafilococos contra antimicrobianos distintos de los betalactámicos se controla con poca frecuencia en Finlandia, ya que la penicilina es el fármaco de elección para el tratamiento de infecciones causadas por cocos grampositivos. En el diagnóstico de rutina, las especies estafilocócicas, excepto Staphylococcus aureus, no se identifican más allá del nivel de género en los diagnósticos de mastitis basados en PCR, aunque algunos estudios han mostrado diferencias entre las especies en la susceptibilidad antimicrobiana (11, 12).
La resistencia a la meticilina codificada por los genes mecA y mecC es de gran preocupación tanto en medicina humana como veterinaria, debido a la naturaleza zoonótica y el papel de S. aureus tanto en infecciones adquiridas en la comunidad como nosocomiales (13, 14). Aunque la resistencia a la meticilina es rara en estafilococos aislados de mastitis bovina (12, 15, 16), S. aureus resistente a la meticilina (SARM) ha aparecido con bastante frecuencia en la producción porcina (17, 18), en caballos y en animales de compañía (19-21).
El objetivo principal de este estudio fue evaluar la susceptibilidad antimicrobiana de los estafilococos causantes de mastitis frente a los agentes antimicrobianos más utilizados en el tratamiento de la mastitis bovina y otras enfermedades infecciosas del ganado. Los otros objetivos fueron estimar la prevalencia de resistencia a la meticilina y comparar la resistencia genotípica y fenotípica a la betalactamasa en estos estafilococos.
Materiales y métodos
Muestras de leche
El material del estudio comprendía muestras de leche presentadas para análisis bacteriológico al laboratorio de mastitis de la principal empresa láctea finlandesa Valio Ltd. La compañía es una cooperativa propiedad de agricultores con miembros en todo el país; procesa aproximadamente el 80% de toda la leche producida en Finlandia. Los productores lecheros y veterinarios finlandeses envían con frecuencia muestras de leche de casos clínicos de mastitis a ese laboratorio para su análisis bacteriológico. Por lo general, reciben los resultados electrónicamente al día siguiente por mensaje de texto, por correo electrónico o a través de un programa de salud del rebaño de la cooperativa lechera. Además, las muestras de leche de cuartos con alto SCC infectados subclínicamente a menudo se recolectan antes del tratamiento, por ejemplo, en el secado, para garantizar la selección del tratamiento más apropiado y efectivo. Para su diagnóstico de mastitis, el laboratorio Valio utiliza PathoProof™ Complete-16 PCR Assay (Thermo Fisher Scientific), que se dirige a 15 especies microbianas causantes de mastitis y al gen blaZ estafilocócico. Cada semana entre agosto y noviembre de 2017, el personal del laboratorio guardó y congeló muestras de leche que, según el ensayo de PCR, contenían cantidades sustanciales de ADN de S. aureus (umbral del ciclo, valor de Ct ≤30.0) o estafilococos no áureos, NAS (valor de Ct ≤31.0) para su posterior cultivo y pruebas de susceptibilidad antimicrobiana.
Suponiendo que el 20% de S. aureus era resistente a la penicilina (17), la calculadora de Epitools, utilizando 80% de potencia y 5% de nivel de significación, proporcionó un tamaño de muestra de 246 aislados de S. aureus para estimar la proporción de S. aureus resistente a la penicilina con una precisión del 5% (22). Nuestro objetivo era recolectar el mismo número de aislados de NAS. Solo se incluyó un aislado de cualquier especie estafilocócica detectada en un rebaño en el análisis de los datos, para garantizar la independencia epidemiológica de las observaciones. Sin embargo, si las especies estafilocócicas diferían entre sí, pueden haberse incluido múltiples muestras y aislados de la misma vaca o de la misma granja,
Aislar el cultivo y la especiación
En el laboratorio del Departamento de Medicina Animal de Producción, Facultad de Medicina Veterinaria, Universidad de Helsinki, las muestras de leche se descongelaron, y 10 μL de leche se rayaron en placas de agar de sangre de oveja (Oxoid, Thermo Fisher) y se incubaron durante 24 h a +37 ° C. Se identificaron posibles colonias estafilocócicas basadas en la morfología de la colonia y la hemólisis y luego MALDI-ToF MS (Bruker Maldi Biotyper, Bruker Daltonics Scandinavia AB, Solna, Suecia) determinó la especie por el método de transferencia directa (23). El ensayo de PCR identifica NAS solo a nivel de grupo. Sin embargo, si MALDI-ToF MS identificó más de una especie de NAS en una muestra, se consideraron aislados de diferentes especies para el estudio. Del mismo modo, si una muestra contenía tanto S. aureus como NAS, ambos fueron considerados en el estudio. Sin embargo, las muestras positivas para diferentes especies y el gen blaZ se excluyeron del estudio, porque no es posible saber qué especies portaban el gen blaZ. Las muestras con >2 tipos diferentes de colonias fueron excluidas del estudio.
Pruebas de sensibilidad
La susceptibilidad antimicrobiana a cefoxitina, ceftiofur, enrofloxacina, gentamicina, oxacilina, penicilina y tetraciclina se evaluó mediante el método de difusión en disco. Los discos (Oxoid, Thermo Fisher) contenían cefoxitina 30 μg, ceftiofur 30 μg, enrofloxacino 5 μg, gentamicina 10 μg, oxacilina 1 μg, penicilina 10 μg y tetraciclina 30 μg. Para los valores de corte/punto de interrupción utilizados y sus fuentes, véase la Tabla 1. Los valores de corte epidemiológico (ECOFF) para la susceptibilidad de las especies estafilocócicas se utilizaron cuando estaban disponibles (24). Para ceftiofur, los valores fueron puntos de corte clínicos CLSI para mastitis en bovinos (25). Para la bencilpenicilina, los valores de corte epidemiológico existen solo para discos de 1 μg, mientras que se utilizaron discos de 10 μg y, por lo tanto, se utilizó un valor de punto de corte clínico CLSI para estafilococos humanos. La producción de betalactamasas de los aislados se probó mediante el uso de nitrocefina líquida preparada a partir de polvo de nitrocefina según lo recomendado por el fabricante (Nitrocefin Solution, Oxoid, Thermo Fisher).
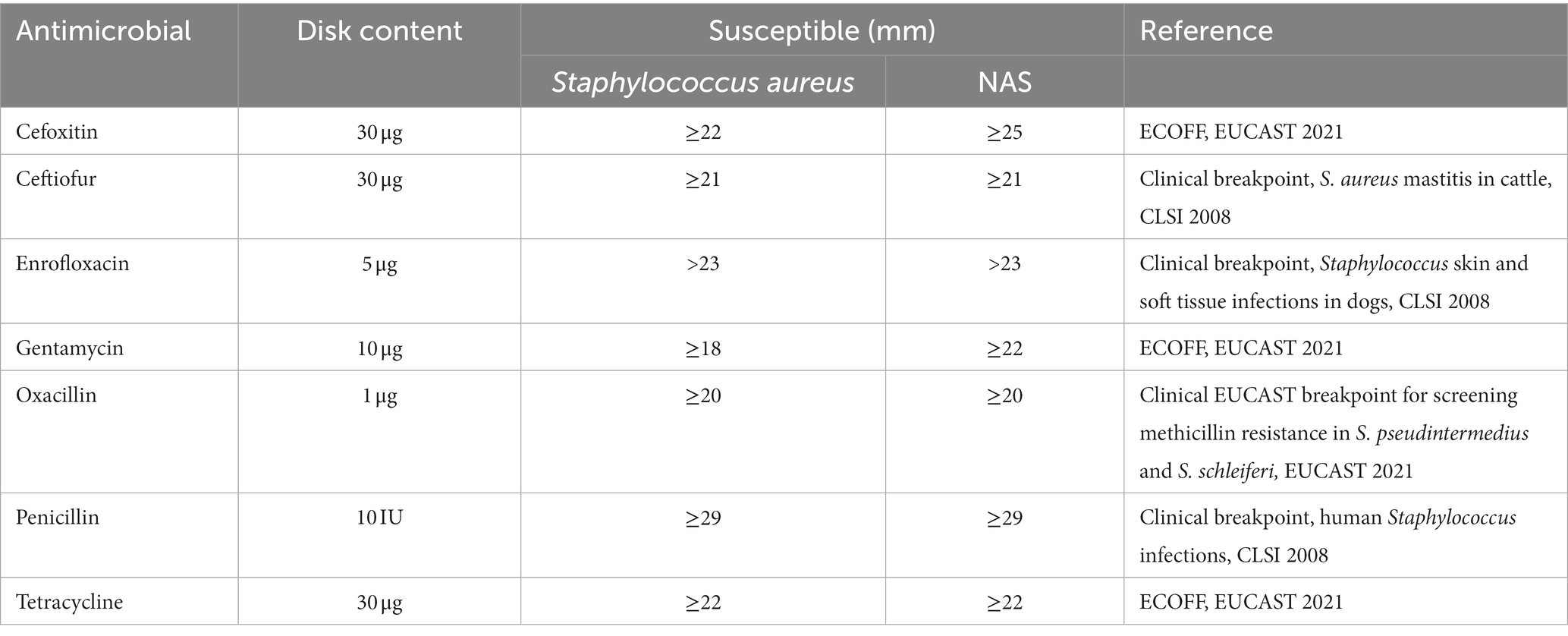 Tabla 1. Valores de corte epidemiológico y de punto de corte clínico (mm) para categorizar aislados bacterianos como susceptibles o resistentes en la prueba de difusión en disco.
Tabla 1. Valores de corte epidemiológico y de punto de corte clínico (mm) para categorizar aislados bacterianos como susceptibles o resistentes en la prueba de difusión en disco.
Análisis por PCR de los genes mecA y mecC
La presencia de los genes mecA o mecC se analizó por PCR en 158 aislados con zona de inhibición de oxacilina ≤20 mm o zona de inhibición de cefoxitina ≤28 mm, para asegurar la detección de todos los aislados positivos para mecA o mecC. La PCR para la detección de mecA o mecC se realizó como se describe en los protocolos alimentarios de la DTU (Universidad Técnica de Dinamarca) recomendados por el EURL-AR (26). Los cebadores para los análisis fueron mecA1(P4) 5′-TCC AGA TTA CAA CTT CAC CAG G-3′, mecA2(P7) 5′-CCA CTT CAT ATC TTC TAA CG-3′, mecC1(MultiFP) 5′-GAA AAA AAG GCT TAG AAC GCC TC-3′, y mecC2(MultiRP) 5′-GAA GAT CTT TTC CGT TTT CAG C-3′ (Metabion international AG, Steinkirchen, Alemania). El S. aureus ATCC 43300 (162 pb) positivo para mecA y el S. aureus CCUG 63582 (138 pb) positivos para mecC sirvieron como cepas de control. El agua destilada sirvió como control negativo.
Análisis estadísticos
Las estadísticas descriptivas (diámetros mediana, mínima y máxima de la zona inhibitoria y proporciones de aislados resistentes para cada fármaco antimicrobiano) se calcularon por separado para S. aureus, para las cuatro especies de NAS más prevalentes y para las otras especies de NAS juntas como un grupo. Se calcularon las proporciones de las bacterias portadoras de los genes blaZ o mec. La concordancia más allá del azar entre la resistencia fenotípica (basada en un método de difusión en disco y prueba de nitrocefina) y genotípica (portador del gen blaZ) a la penicilina se evaluó mediante el coeficiente kappa. Los análisis estadísticos se realizaron con el Statistical Analysis System, v. 9.4 (SAS Inst Inc., Cary, NC, Estados Unidos) y Epitools Calculator (22).
Resultados
Se evaluó la susceptibilidad antimicrobiana de 504 aislados y se incluyó en el análisis de los datos. Estos aislados se originaron a partir de 497 muestras de cuarto de leche de 466 vacas en 396 rebaños. De estos aislamientos, 260 eran S. aureus y 244 pertenecían al grupo NAS. En total, se detectaron 21 especies diferentes de NAS, incluidos seis aislados de tres especies previamente incluidas en el género Staphylococcus: S. lentus (2), S. sciuri (3) y S. vitulinus (1), que recientemente han sido reasignadas a un nuevo género, Mammaliicoccus (27). Las especies de NAS más comunes fueron S. simulans, S. epidermidis, S. chromogenes y S. haemolyticus, que representan aproximadamente el 74% (180/244) de todos los NAS detectables (Tabla 2). Los aislados identificados como S. haemolyticus pueden haber incluido algunos aislados de una nueva especie, S. borealis, porque MALDI-ToF MS no diferencia entre ellos (28). De 28 muestras con más de una especie estafilocócica, seis contenían cada una S. aureus y una especie NAS, y dos tenían tres especies diferentes de NAS; el resto, 20 muestras, cada una tenía dos especies diferentes de NAS. De las 28 muestras, en 21, el gen blaZ también era detectable, y estas muestras fueron excluidas, porque, según el ensayo comercial de PCR utilizado, era imposible distinguir qué especies bacterianas portaban el gen blaZ. Cinco muestras blaZ-negativas contenían dos especies diferentes de NAS, una contenía S. aureus y una NAS, y una muestra tenía tres especies diferentes de NAS. Todas las demás muestras tenían solo una especie cada una.
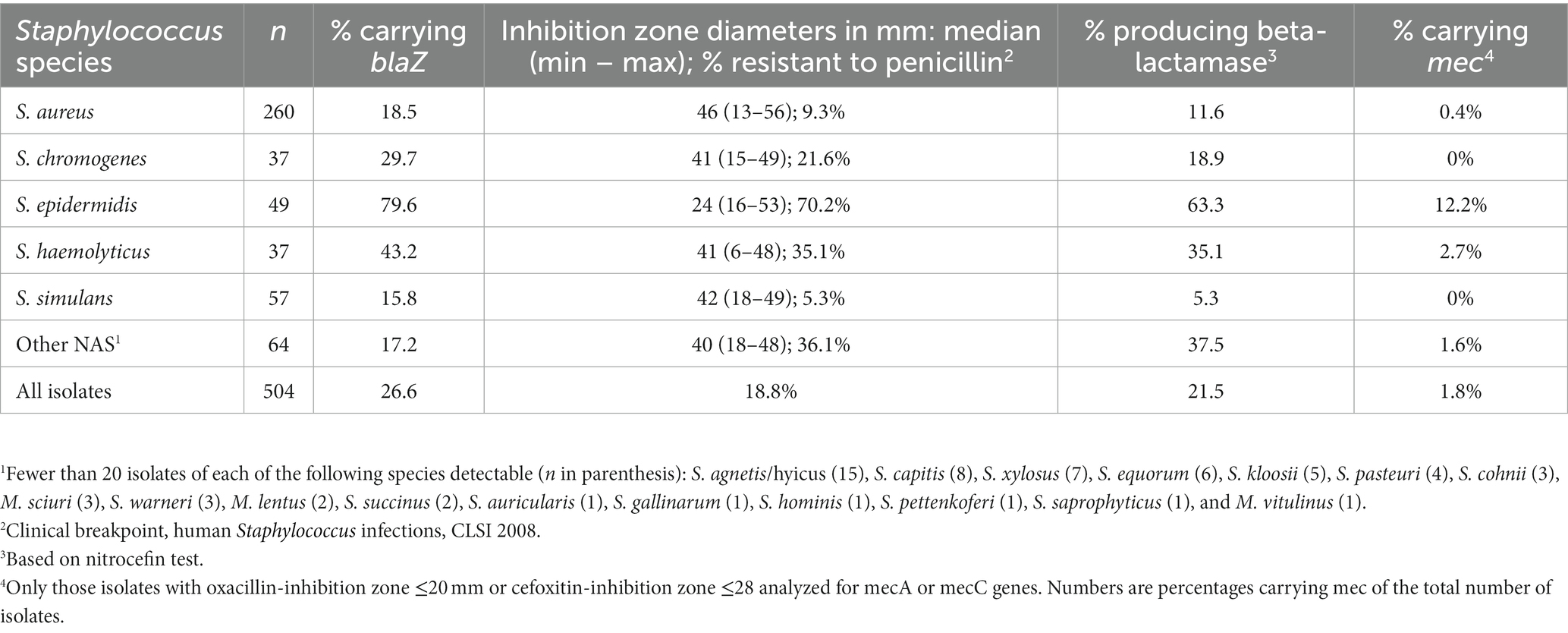 Tabla 2. Porcentajes de aislados portadores del gen blaZ que codifica la producción de betalactamasa, y diámetros de inhibición de zona para la penicilina en las especies estafilocócicas más comunes que causan infecciones intramamarias en vacas lecheras.
Tabla 2. Porcentajes de aislados portadores del gen blaZ que codifica la producción de betalactamasa, y diámetros de inhibición de zona para la penicilina en las especies estafilocócicas más comunes que causan infecciones intramamarias en vacas lecheras.
Resistencia a los betalactámicos
Según la detección del gen blaZ en el ensayo PathoProof™ Complete-16, de los 504 aislados estafilocócicos, 134 (26,6%), que constituyen el 8,5% de S. aureus y el 35,2% de todos los NAS, portaban el gen blaZ. Por lo tanto, estos podrían considerarse resistentes a la penicilina. La resistencia a la penicilina fue menor en función de la difusión en disco: de todos los aislamientos, el 18,8% (9,3% de S. aureus y 28,9% de todos los NAS) eran resistentes a la penicilina.
Los diámetros de la zona de inhibición (mediana, mín. y máxima) de penicilina, cefoxitina, ceftiofur y oxacilina para S. aureus, para las cuatro especies de NAS más prevalentes, y para el resto del grupo NAS se encuentran en las Tablas 2, 3. La resistencia a la penicilina basada en pruebas de difusión en disco fue más común en S. epidermidis, de los cuales el 70,2% eran resistentes. La proporción de aislados de S. epidermidis blaZ positivos fue aún mayor, 79,6% (Tabla 2). La distribución de las zonas de inhibición de la penicilina, tanto para S. aureus como para todas las especies de NAS, fue bimodal, y la distribución de aislados de tipo salvaje (aislados sin resistencia adquirida) y resistentes estuvo en gran medida de acuerdo con la ocurrencia del gen blaZ (Figuras 1, 2). En contraste con las zonas de inhibición de penicilina, la distribución de las zonas de inhibición de cefoxitina y oxacilina para todas las especies estafilocócicas fue unimodal, y los portadores del gen blaZ fueron en gran medida susceptibles, especialmente a la cefoxitina (Figuras 3, 4). Según la prueba de nitrocefina, el 21,6% de los aislados produjeron betalactamasa (11,6% de S. aureus y 32,0% de todos los NAS; Tabla 2).
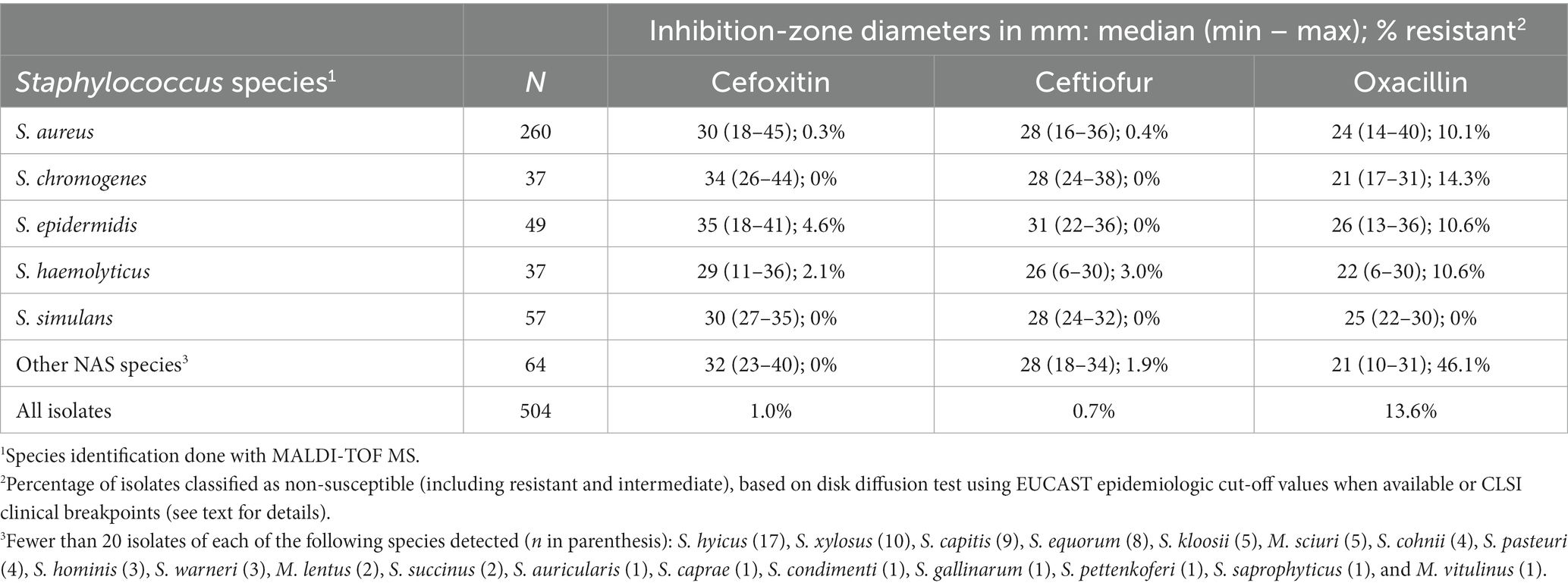 Tabla 3. Diámetros de inhibición de zonas para cefoxitina, ceftiofur y oxacilina en las especies estafilocócicas más comunes1 en infecciones intramamarias de vaca lechera.
Tabla 3. Diámetros de inhibición de zonas para cefoxitina, ceftiofur y oxacilina en las especies estafilocócicas más comunes1 en infecciones intramamarias de vaca lechera.
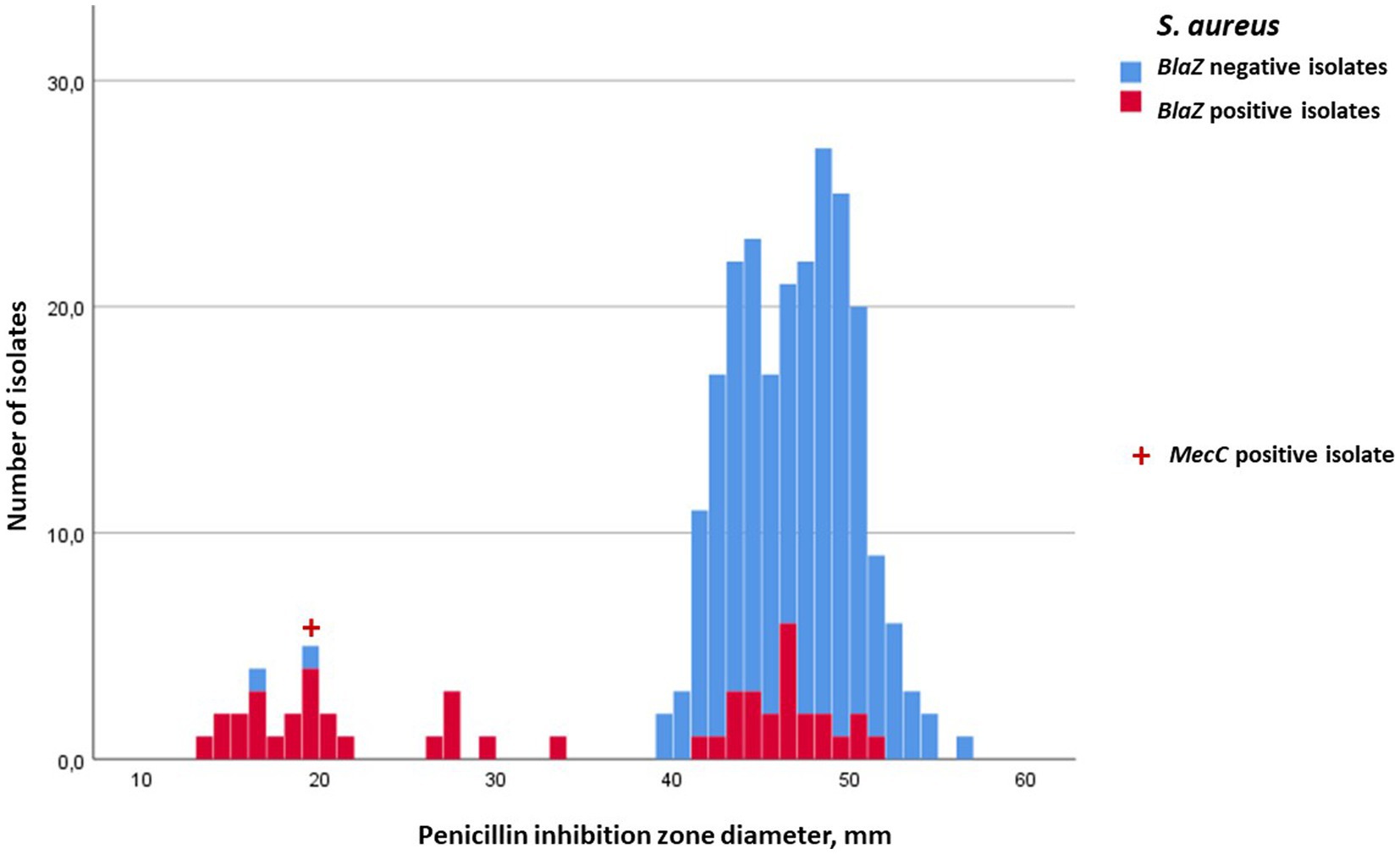 Figura 1. Distribución de frecuencia de las zonas de inhibición de la penicilina para Staphylococcus aureus, aparición del gen blaZ (no = azul; sí = rojo) y porte del gen mecC (indicado con +). El punto de corte para la resistencia a la penicilina en la prueba de difusión del disco fue de 29 mm. Ningún S. aureus portaba el gen mecA.
Figura 1. Distribución de frecuencia de las zonas de inhibición de la penicilina para Staphylococcus aureus, aparición del gen blaZ (no = azul; sí = rojo) y porte del gen mecC (indicado con +). El punto de corte para la resistencia a la penicilina en la prueba de difusión del disco fue de 29 mm. Ningún S. aureus portaba el gen mecA.
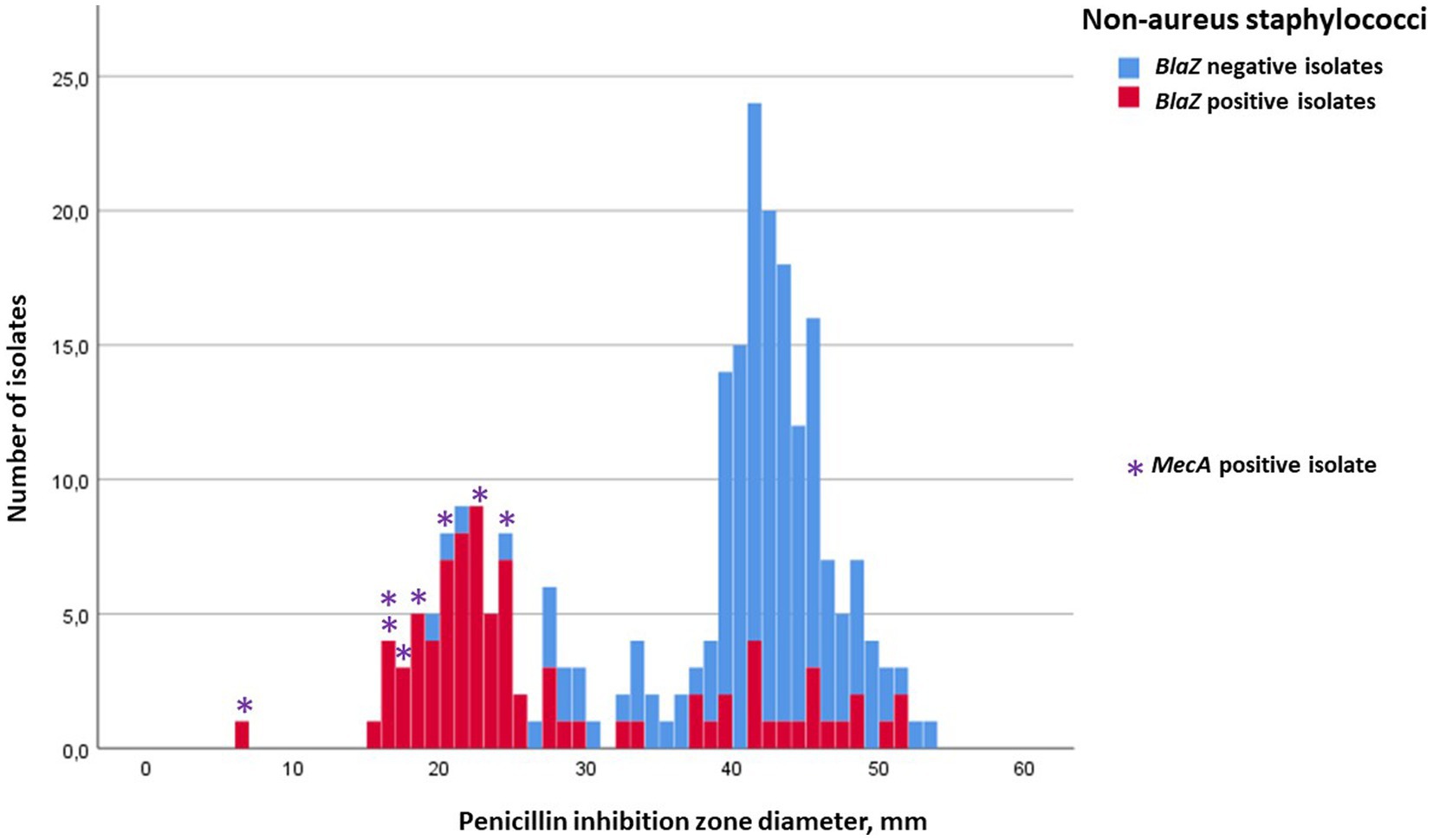 Figura 2. Distribución de frecuencia de las zonas de inhibición de la penicilina para estafilococos no áureos (NAS), aparición del gen blaZ (no = azul; sí = rojo) y porte del gen mecA (indicado con ). El punto de corte para la resistencia a la penicilina en la prueba de difusión en disco fue de 29 mm. Ningún aislado de NAS portaba el gen mecC.*
Figura 2. Distribución de frecuencia de las zonas de inhibición de la penicilina para estafilococos no áureos (NAS), aparición del gen blaZ (no = azul; sí = rojo) y porte del gen mecA (indicado con ). El punto de corte para la resistencia a la penicilina en la prueba de difusión en disco fue de 29 mm. Ningún aislado de NAS portaba el gen mecC.*
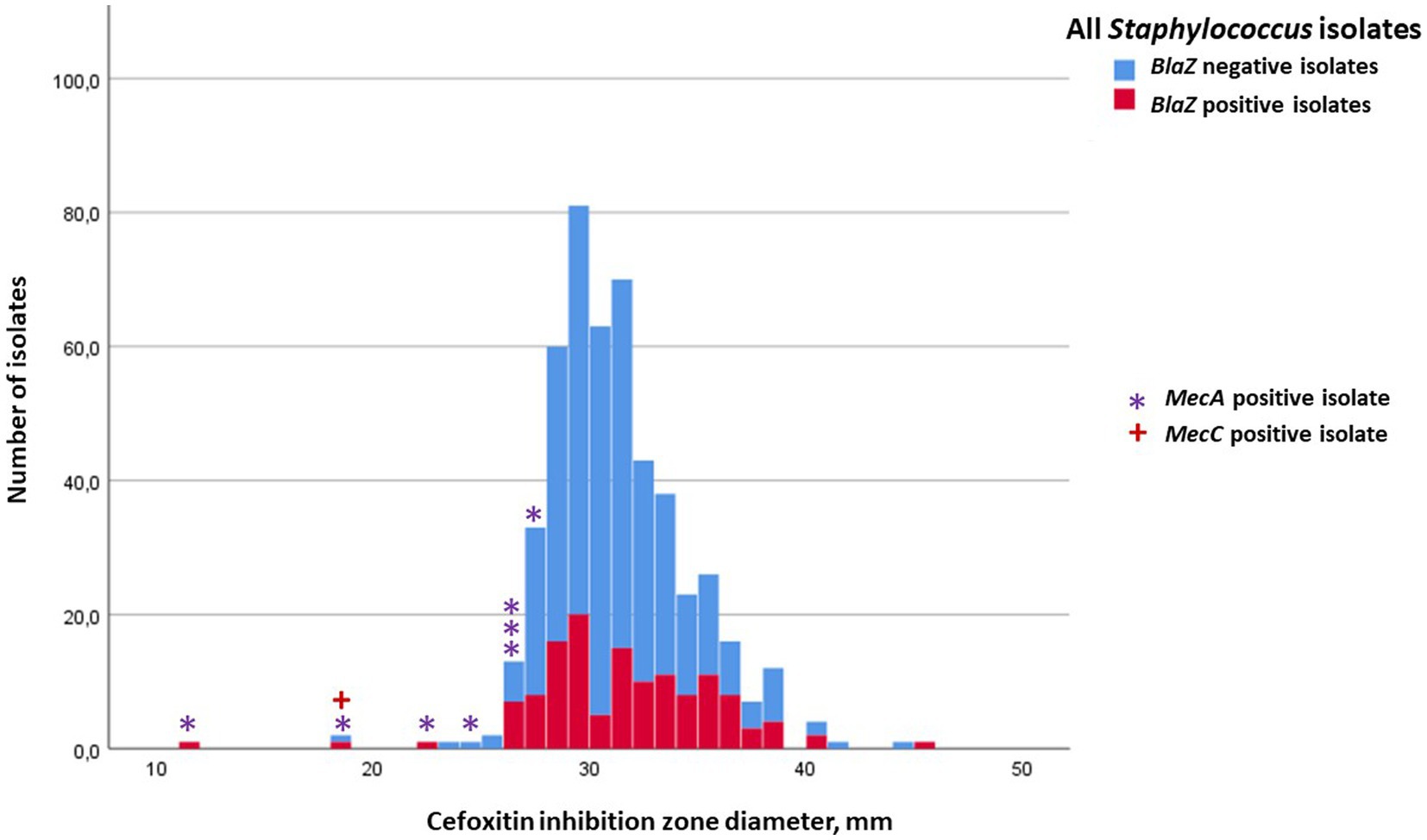 Figura 3. Distribución de frecuencia de las zonas de inhibición de cefoxitina para todos los aislados estafilocócicos, aparición del gen blaZ (no = azul; sí = rojo) y porte del gen mecA (indicado con *) o mecC (indicado con +). El punto de corte para la resistencia a cefoxitina en la prueba de difusión en disco fue de 22 mm para S. aureus y 25 mm para estafilococos no aureus.
Figura 3. Distribución de frecuencia de las zonas de inhibición de cefoxitina para todos los aislados estafilocócicos, aparición del gen blaZ (no = azul; sí = rojo) y porte del gen mecA (indicado con *) o mecC (indicado con +). El punto de corte para la resistencia a cefoxitina en la prueba de difusión en disco fue de 22 mm para S. aureus y 25 mm para estafilococos no aureus.
 Figura 4. Distribución de frecuencia de las zonas de inhibición de oxacilina para todos los aislados estafilocócicos, aparición del gen blaZ (no = azul; sí = rojo) y porte del gen mecA (indicado con *) o mecC (indicado con +). El punto de corte para la resistencia a la oxacilina en la prueba de difusión en disco fue de 20 mm.
Figura 4. Distribución de frecuencia de las zonas de inhibición de oxacilina para todos los aislados estafilocócicos, aparición del gen blaZ (no = azul; sí = rojo) y porte del gen mecA (indicado con *) o mecC (indicado con +). El punto de corte para la resistencia a la oxacilina en la prueba de difusión en disco fue de 20 mm.
Sólo tres aislados fueron resistentes al ceftiofur (0,6%), uno de S. aureus, S. haemolyticus y M. lentus. Cinco aislamientos (1,0%) fueron resistentes a la cefoxitina (dos S. epidermidis, un S. aureus, un S. haemolyticus y un S. pettenkoferi). Sobre la base del valor umbral para el cribado de la resistencia a la meticilina en S. pseudintermedius y S. schleiferi (24), 68 aislados (13,9%) se clasificaron como resistentes a la oxacilina.
genes mecA o mecC y concordancia entre diferentes pruebas de resistencia a betalactámicos
En total, se analizaron 158 aislados estafilocócicos (84 S. aureus y 74 NAS) para el transporte de mecA y mecC. Ocho de los aislados de NAS portaban mecA, seis de ellos eran S. epidermidis, uno S. haemolyticus y un M. lentus (Tabla 2). Ningún aislado de S. aureus portaba mecA, pero uno era mecC positivo. Las zonas de inhibición de penicilina de los aislados de NAS mecA positivos variaron de 6 a 24 mm, lo que indica resistencia a la penicilina (Figura 2), pero existía mucha variabilidad en las zonas de inhibición de cefoxitina y oxacilina. Todos los aislamientos mec-positivos fueron clasificados como resistentes a la penicilina en la prueba de difusión en disco (Figuras 1, 2). De los ocho aislados positivos para mecA, cuatro, y también el aislado positivo para mecC, fueron resistentes a la cefoxitina (Figura 3). El transporte mec de los otros cuatro aislados no se habría detectado si el cribado se hubiera basado únicamente en la difusión del disco de cefoxitina y los valores de corte recomendados (24).
De los nueve aislados mec-positivos, ocho fueron resistentes a la oxacilina (Figura 4), y por lo tanto sólo un aislado mecA positivo permaneció sin ser detectado por la difusión del disco de oxacilina y el valor de corte recomendado. Por otro lado, de los 68 aislados clasificados como resistentes a la oxacilina, solo nueve eran positivos para el gen mec. Por lo tanto, 59 aislamientos se clasificaron como resistentes a la oxacilina en función de la difusión en disco, pero fueron mec negativos. De los ocho aislados de NAS mecA positivos, siete también portaban el gen blaZ, detectable por el ensayo PathoProof™ Complete-16. El aislado de S. aureus mecC positivo no llevaba blaZ, pero su zona de inhibición para la penicilina fue de 19 mm, para ceftiofur de 16 mm, para cefoxitina de 18 mm y para oxacilina de 14 mm, todo lo cual indica que es resistente a todos los antimicrobianos betalactámicos.
De todos los aislamientos, 12 fueron blaZ PCR negativos pero fenotípicamente resistentes a la penicilina (zonas de inhibición ≤28 mm). Dos de ellos portaban el gen mecA o el gen mecC, pero 10 eran negativos para el gen mec. Por el contrario, 50 aislados blaZ positivos tenían zonas de inhibición de penicilina ≥29 mm, que variaban de 29 a 51 mm, lo que indica susceptibilidad a la penicilina. Cinco de estos aislados tenían diámetros de zona de inhibición de oxacilina ≤19 mm, variando de 14 a 18 mm (Figura 4).
La concordancia más allá del azar entre la resistencia fenotípica a la penicilina basada en la prueba de difusión en disco y la aparición del gen blaZ fue moderada para S. aureus (kappa = 0,56) y fue sustancial para las especies de NAS (kappa = 0,67), así como para todas las especies estafilocócicas evaluadas conjuntamente (kappa = 0,64; Tabla 4). La proporción de acuerdo negativo (que varió de 0,89 a 0,94) fue generalmente mayor que la proporción de acuerdo positivo. La concordancia más allá del azar entre la ocurrencia de blaZ y el resultado de la prueba de nitrocefina fue moderada (kappa = 0,62); El 35,8% de los aislados blaZ positivos fueron negativos para la prueba de nitrocefina, y el 6,2% de los aislados negativos para blaZ fueron positivos para la prueba de nitrocefina. En general, los aislados genotípicamente resistentes (aquellos que portaban genes blaZ o mec) eran fenotípicamente susceptibles que los aislados genotípicamente susceptibles (aquellos sin genes blaZ o mec) eran fenotípicamente resistentes. Las pruebas genotípicas pueden ser más confiables que las pruebas fenotípicas, especialmente cuando uno está eligiendo opciones de tratamiento.
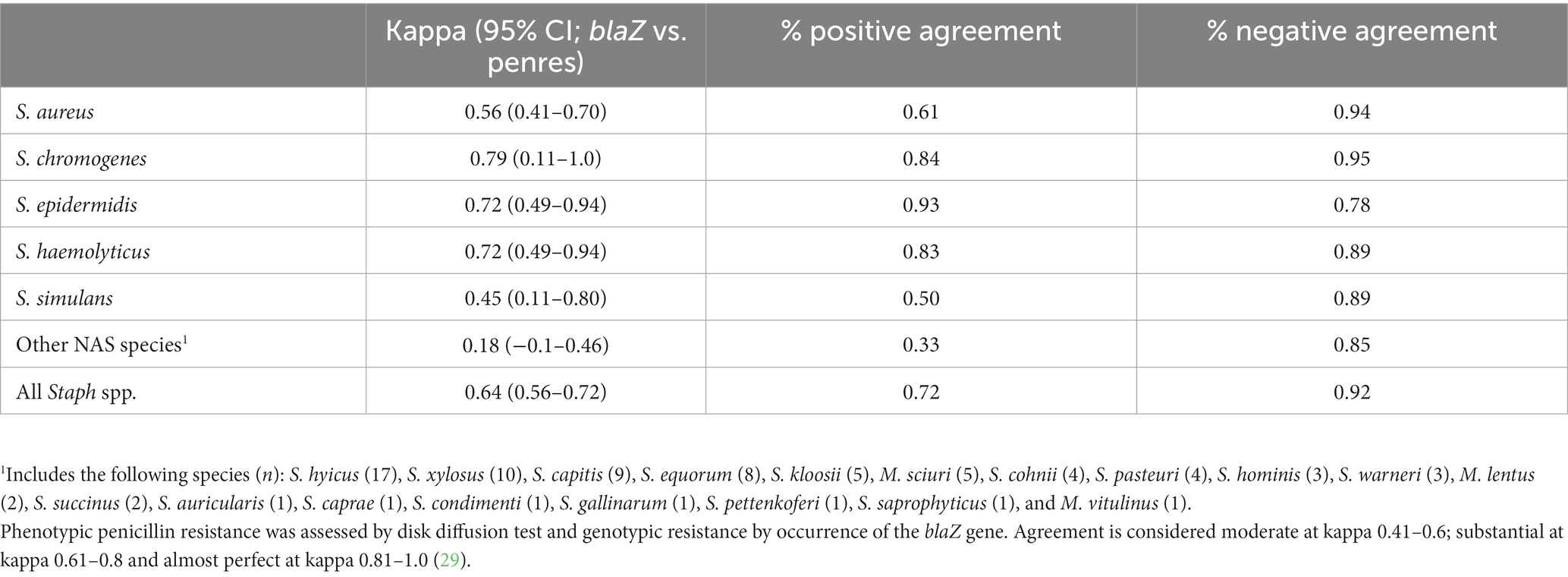 Tabla 4. Acuerdo más allá del azar entre la resistencia fenotípica y genotípica a la penicilina entre los estafilococos causantes de mastitis.
Tabla 4. Acuerdo más allá del azar entre la resistencia fenotípica y genotípica a la penicilina entre los estafilococos causantes de mastitis.
Resistencia a otros antimicrobianos
La resistencia a otros antimicrobianos distintos de los betalactámicos fue rara (Tabla 5). Ninguno de los aislados fue resistente a la gentamicina. La resistencia a la tetraciclina fue detectable en sólo seis aislados (1,2%), de los cuales tres eran mecA positivos para S. epidermidis, uno era S. kloosii, uno S. simulans y un S. xilosus. La resistencia a la enrofloxacina fue detectable en tres aislados (0,6%): S. simulans, un S. haemolyticus mecA positivo y un M. lentus mecA positivo. En general, los nueve aislados mec-positivos fueron los más resistentes. Los tres aislados resistentes al ceftiofur (S. aureus, S. haemolyticus y M. lentus) eran portadores del gen mec. Además de la resistencia a los betalactámicos, tres de los aislados mec-positivos fueron resistentes a la tetraciclina (todos los S. epidermidis) y dos a la enrofloxacina (S. haemolyticus, M. lentus).
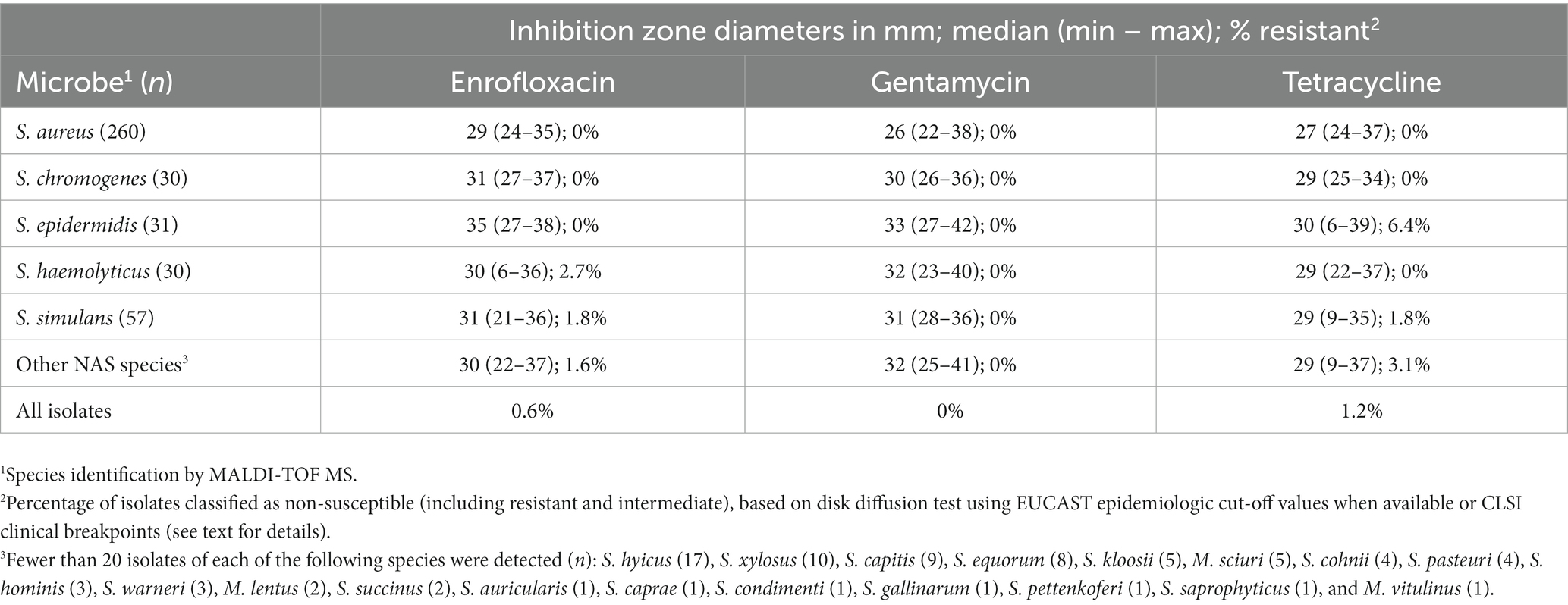 Tabla 5. Diámetros de inhibición de zonas para enrofloxacina, gentamicina y tetraciclina entre las especies estafilocócicas más comunes1 aislado de leche bovina.
Tabla 5. Diámetros de inhibición de zonas para enrofloxacina, gentamicina y tetraciclina entre las especies estafilocócicas más comunes1 aislado de leche bovina.
Discusión
Nuestro estudio de la resistencia a los antibióticos de los estafilococos causantes de mastitis en vacas lecheras encontró que la forma más común de resistencia era la resistencia a la penicilina. Esto es de importancia práctica porque en Finlandia, la penicilina es el fármaco de elección en los tratamientos de mastitis. Cuando la mastitis resulta de estafilococos resistentes a la penicilina, se usa el tratamiento intramamario con cloxacilina (7), pero el tratamiento antimicrobiano de la mastitis estafilocócica resistente a la penicilina, especialmente con S. aureus, generalmente no se recomienda debido a la baja tasa de curación (30-32). La resistencia a la penicilina de todos los aislados basada en la difusión del disco fue del 18,8%, si se basó en una prueba de nitrocefina fue del 21,5%, pero cuando se basó en el gen blaZ el transporte fue mayor, del 26,6%. La Autoridad Alimentaria Finlandesa monitoreó la resistencia a los antimicrobianos de estafilococos aislados de muestras de leche mastítica en 2005 y 2012 (15, 33). En 2005, el 25% de S. aureus y en 2012, el 23% de S. aureus y el 36% de NAS produjeron betalactamasa, por lo que parece que la resistencia antimicrobiana de los estafilococos causantes de mastitis en Finlandia ha disminuido ligeramente.
Se han detectado tasas más bajas o similares de resistencia a la penicilina como en el estudio actual en otros tres países nórdicos (Noruega, Suecia y Dinamarca). En Suecia, según la producción de betalactamasa, el 3% de los aislados de S. aureus y el 30% de los aislados de NAS de casos clínicos de mastitis fueron resistentes a la penicilina; las cifras basadas en los valores de CMI fueron similares o superiores: 3% para S. aureus y 38% para NAS (16). En otro estudio sueco, el 34% de los aislados de NAS de mastitis subclínica fueron positivos para betalactamasas (34). En Noruega, el 5% de S. aureus y el 23% de los aislados de NAS eran resistentes a la penicilina según la difusión del disco (12). En Dinamarca, el 18% de S. aureus y el 22% de los aislados de NAS eran resistentes a la penicilina según los valores de CMI (35). Los niveles de resistencia a la penicilina para NAS, basados en los valores de MIC, fueron más bajos en Canadá, 10% (36), y en Corea, 14% (37). En algunos otros países, también se han detectado mayores proporciones de estafilococos resistentes a la penicilina aislados de la leche bovina. En Francia, de casi 7.000 aislados de Staphylococcus coagulasa positivos (principalmente S. aureus) recolectados durante 2006-2016, el 40% eran resistentes a la penicilina según la difusión del disco (38). En Brasil, el 36% de los aislados de Staphylococcus de mastitis bovina, principalmente S. aureus, fueron blaZ positivos (39). En Sudáfrica, el 63% de los 142 aislados de NAS de mastitis subclínica bovina fueron resistentes a la penicilina según la difusión del disco (40).
Sin embargo, vale la pena señalar que es difícil una comparación directa de los resultados entre los estudios, ya que las poblaciones de estudio, la recolección de muestras y las fuentes de los aislados y los métodos para las pruebas de susceptibilidad antimicrobiana difieren. Otro factor explicativo de las diferencias en las cifras de resistencia a la penicilina puede estar relacionado con la distribución de las especies de NAS. En un estudio sueco realizado por Nyman et al. (34), S. epidermidis fue la especie más común, involucrando el 26% de los 783 aislados de NAS; de manera similar, en nuestro estudio, S. epidermidis comprendía aproximadamente el 20% de todas las especies de NAS. En contraste, en un estudio canadiense, donde la resistencia a la penicilina reportada fue menor, solo el 4% de los más de 1700 aislados de NAS fueron S. epidermidis, y las tres especies más prevalentes: S. chromogenes, S. simulans y S. xylosus cubrieron el 70% de todos los aislamientos (36).
Las enormes diferencias en la resistencia a la penicilina entre las especies de Staphylococcus fueron detectables tanto en nuestro estudio como en otros. En nuestro estudio, la proporción más baja de aislados resistentes a la penicilina fue en S. simulans, y la más alta en S. epidermidis, según la difusión del disco, la producción de nitrocefina y el transporte de blaZ. Muchos otros estudios también han demostrado que S. simulans es principalmente susceptible a la penicilina y ha demostrado que S. epidermidis es la especie estafilocócica más resistente a la penicilina y a varios otros antimicrobianos (12, 36, 37). La resistencia a múltiples fármacos también ha sido más común en S. epidermidis (11, 40). Además, S. epidermidis es la especie de Staphylococcus que más comúnmente lleva el gen mecA que codifica la resistencia a la meticilina (11, 36, 37), y consistentemente, de los ocho aislados positivos para mecA en el estudio actual, seis eran S. epidermidis.
La prevalencia de aislamientos mec-positivos fue baja en S. aureus (0,4%) y ligeramente mayor (3,3%) en NAS. En el monitoreo de resistencia antimicrobiana de FINRES-Vet en 2012, ningún S. aureus pero cinco NAS (5.7%) portaban el gen mecA (15). En el estudio de Gindonis et al. (41) que utilizó tres muestreos finlandeses diferentes de estafilococos de mastitis bovina de estudios previos, el 1,5% de S. aureus y el 1,8-5,2% de los aislados de NAS fueron positivos para el gen mec. Aunque en Finlandia la resistencia a la meticilina en los estafilococos causantes de mastitis es baja, puede, en casos raros, causar problemas en el trabajo clínico. La aparición de los genes mec no se prueba rutinariamente en casos de mastitis. Algunos aislados blaZ-negativos pueden ser mec positivos y, por lo tanto, resistentes a la penicilina. El único aislado de S. aureus mecC positivo en nuestro estudio fue blaZ negativo y se clasificó incorrectamente como susceptible a la penicilina. El tratamiento con penicilina de estos casos habría llevado al fracaso del tratamiento.
Además de resultar en tratamientos ineficaces, los estafilococos resistentes a la meticilina pueden transferirse de las vacas a los humanos. En general, aunque los linajes estafilocócicos son específicos del huésped, pueden ocurrir cambios de huésped (42, 43). Actualmente, la resistencia a la meticilina de los estafilococos no es un problema en la producción láctea finlandesa, pero en la producción porcina ha surgido MRSA. En una encuesta de un año de duración en 2016-2017, MRSA surgió en el 77% de los lotes de sacrificio (17). En el mismo período de tiempo, las infecciones por SARM causadas por el CC398 asociado al ganado han surgido en los criadores de cerdos finlandeses (44). Algunos de los aislados mecA positivos en nuestro estudio también fueron resistentes a la tetraciclina o enrofloxacina. Aunque en Finlandia la tetraciclina no es el fármaco de elección para la terapia de la mastitis, se usa comúnmente para tratar otras enfermedades infecciosas del ganado, especialmente enfermedades respiratorias. La enrofloxacina es, entre los antimicrobianos, el fármaco de elección en Finlandia para la mastitis coliforme grave.
La prueba de difusión de disco de oxacilina indicó mejor el transporte de mecA que la prueba de difusión de disco de cefoxitina. Sin embargo, muchos de los resultados de la prueba de difusión del disco de oxacilina fueron falsos positivos, es decir, aislados mec negativos que mostraban resistencia a la oxacilina. Sin embargo, ninguna de las pruebas fue perfecta para detectar el porte del gen mec. El Comité Europeo de Pruebas de Susceptibilidad Antimicrobiana (EUCAST) y el Instituto de Estándares Clínicos y de Laboratorio (CLSI) recomiendan el disco de cefoxitina para el cribado de la resistencia betalactámica mediada por mecA en Staphylococcus aureus y NAS (25, 45), pero en nuestro estudio no detectó posibles aislados positivos para mecA de manera muy efectiva. Se informa que el disco de cefoxitina funciona mejor para la detección de mecC que el disco de oxacilina (46, 47). El único aislado de S. aureus mecC positivo en nuestro estudio fue detectable por ambos métodos. No realizamos pruebas para la variante del gen mecB recientemente detectada mecB (48), y también pueden existir otros mecanismos de resistencia, como mutaciones en el gen gdpP (49).
En Finlandia, los veterinarios eligen un fármaco antimicrobiano para el tratamiento de la mastitis estafilocócica basándose en gran medida en el resultado blaZ en la prueba de PCR (PathoProof™ Complete-16 PCR Assay). Después de comprar el equipo para analizar muestras de leche con la metodología q-rt PCR, el laboratorio clínico del Departamento de Medicina Animal de Producción de la Universidad de Helsinki, analizó muestras de leche tanto con PCR como con cultivo convencional y detección de producción de betalactamasas en estafilococos (prueba de nitrocefina, ThermoFisher Scientific). La discrepancia entre estos resultados ha llevado a un desafío en la toma de decisiones con respecto al manejo de un caso de IMI: ¿cuál es la probabilidad de curación y qué antimicrobiano elegir, si el caso se trata con antimicrobianos? ¿O es preferible secar el cuarto infectado o incluso sacrificar a la vaca? La discrepancia entre el transporte del gen blaZ y la resistencia fenotípica a la penicilina detectada en nuestro y otros estudios en medicina veterinaria (9, 50) y humana (51, 52) es un fenómeno interesante. Los aislados de S. aureus BlaZ negativos pero fenotípicamente resistentes a la penicilina son escasos (9), pero comúnmente existen aislados blaZ positivos que son fenotípicamente sensibles a la penicilina (9, 50, 51). En nuestro estudio, el gen blaZ se identificó con PathoProof™ Complete-16 PCR Assay (Thermo Fisher Scientific) directamente de la leche, no de aislados cultivados. Por lo tanto, excluimos del estudio las muestras positivas para más de una especie estafilocócica y el gen blaZ, ya que en muestras con más de una especie no fue posible distinguir qué especies bacterianas portaban el gen blaZ.
Diferentes pruebas típicamente muestran diferentes sensibilidades para la detección de la producción de beta-lactamasa. Pitkälä et al. (53) compararon seis pruebas, utilizando la PCR blaZ como método de referencia. Al menos un método siempre fue positivo, apoyando el potencial para la producción de betalactamasas de los aislados blaZ-positivos. Algunos autores informan que las pruebas basadas en la detección de la producción de betalactamasa (por ejemplo, prueba de nitrocefina, prueba de hoja de trébol) se correlacionan mejor con la aparición del gen blaZ que el método de dilución de agar (54). Otros han reportado sensibilidades más bajas para estas pruebas (51, 55). Los resultados de los métodos de dilución en agar y CMI dependen de los valores de corte establecidos. En nuestro estudio, la concordancia más allá del azar entre la resistencia fenotípica a la penicilina basada en la prueba de difusión en disco y la aparición del blaZ fue de moderada a sustancial, dependiendo de la especie de Staphylococcus. Una posible razón para los aislados fenotípicamente susceptibles a la penicilina pero blaZ positivos es la función deteriorada del blaZ o sus reguladores, los genes blaI y blaR, debido a mutaciones de secuencia (56). Queda por resolver si todos los aislados blaZ-positivos producen betalactamasa in vivo. Mientras tanto, los resultados blaZ positivos deben interpretarse como originados a partir de aislados potencialmente resistentes a la penicilina. En la práctica, la posible discrepancia entre la aparición del gen blaZ y la susceptibilidad a la penicilina puede causar problemas en el tratamiento antimicrobiano de la mastitis.
La resistencia a la enrofloxacina, gentamicina y tetraciclina fue poco frecuente para nosotros, de manera similar a los hallazgos en la mayoría de los otros estudios. Ninguno de nuestros aislados era resistente a la gentamicina, y la mayoría de los pocos aislados resistentes a la enrofloxacina o tetraciclina portaban el gen mecA. Fergestad et al. (12) encontraron, entre 100 aislados de Staphylococcus de mastitis clínica en Noruega, solo tres aislados resistentes a gentamicina y tres aislados resistentes a tetraciclina. Duse et al. (16) no encontraron resistencia a la gentamicina en los aislados suecos de mastitis bovina. Todos sus aislados de NAS eran susceptibles a la enrofloxacina y la tetraciclina, y la resistencia a la tetraciclina también era rara para S. aureus (16). Chehabi et al. (35) no encontraron resistencia a la gentamicina entre 63 aislados daneses de S. aureus, y solo un aislado es resistente a la tetraciclina. De 49 aislados daneses de NAS, uno era resistente a la gentamicina y 5 aislados (10%) eran resistentes a la tetraciclina. El nivel de resistencia entre las especies de NAS varía considerablemente. Nobrega et al. (36) reportaron una resistencia a la tetraciclina del 10% para todo su grupo de NAS en Canadá, pero el porcentaje de aislados resistentes de sus especies de NAS más comunes varió del 2% en S. chromogenes al 31% en S. xylosus y al 32% en S. epidermidis. Entre hallazgos similares en Corea del Sur por Kim et al. (37) se encuentran la resistencia a la tetraciclina en el 4% de los cromogenes S. y en el 26% de S. epidermidis.
Conclusión
Nuestros resultados apoyan hallazgos anteriores de que la resistencia a la penicilina es la única forma significativa de resistencia a los antimicrobianos entre los estafilococos causantes de mastitis en Finlandia, y la proporción de aislados resistentes no ha aumentado. Según el transporte del gen blaZ, menos de un tercio de todos los aislados de Staphylococcus eran resistentes a la penicilina, y en las pruebas fenotípicas, la resistencia a la penicilina fue aún menor. La diferencia en las proporciones de resistencia a la penicilina entre las especies de Staphylococcus, sin embargo, fue considerable, más baja en S. simulans y más alta en S. epidermidis. La resistencia a la meticilina fue rara, excepto en S. epidermidis, de los cuales el 12% fueron mecA positivos. Algunos estafilococos fenotípicamente susceptibles a la penicilina portaban el gen blaZ, pero los aislados sin genes blaZ o mec rara vez mostraron resistencia, lo que sugiere que la opción de tratamiento más confiable puede depender de las pruebas genotípicas de RAM. El fármaco de elección para los tratamientos de mastitis en Finlandia es la penicilina y la resistencia a los antimicrobianos distintos de la penicilina fue rara. Con decisiones de tratamiento dirigidas, basadas en el conocimiento sobre patógenos causantes de infecciones, es posible mantener bajos los niveles de resistencia a los antimicrobianos.
Declaración de disponibilidad de datos
Los datos brutos que apoyan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Contribuciones del autor
PRS planificó el estudio. PRS y ST, y H-TT contribuyeron a la organización de datos y análisis estadísticos. ST escribió el primer borrador del manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
El trabajo fue apoyado por la Fundación Walter Ehrström.
Reconocimientos
Los autores agradecen a Valio Ltd. por proporcionar muestras de leche para la investigación. Taina Rahkonen es reconocida por su excelente trabajo de laboratorio.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Jamali, H , Barkema, HW , Jacques, M , Lavallée-Bourget, E-M , Malouin, F , Saini, V, et al. Revisión invitada: incidencia, factores de riesgo y efectos de la recurrencia clínica de la mastitis en vacas lecheras. J Dairy Sci. (2018) 101:4729–46. DOI: 10.3168/JDS.2017-13730
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Organización Mundial de Sanidad Animal de la OIE Estrategia de la OIE sobre la resistencia a los antimicrobianos y el uso prudente de los antimicrobianos. (2016). Disponible en: https://www.woah.org/fileadmin/Home/eng/Media_Center/docs/pdf/PortailAMR/EN_OIE-AMRstrategy.pdf (consultado el 16 de enero de 2023).
3. Organización Mundial de la Salud de la OMS Superando la resistencia a los antimicrobianos. Informe de la OMS sobre enfermedades infecciosas 2000. WHO/CDS/2000.2. 67 p. (2000) Disponible en: https://apps.who.int/iris/handle/10665/66672 (consultado el 16 de enero de 2023).
4. Collignon, PJ , y McEwen, SA . Una salud: su importancia para ayudar a controlar mejor la resistencia a los antimicrobianos. Trop Med Infect Dis. (2019) 4:22. doi: 10.3390/tropicalmed4010022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Hu, XY , Logue, M , y Robinson, N . La resistencia a los antimicrobianos es un problema global, una perspectiva del Reino Unido. Eur J Integr Med. (2020) 36:101136. doi: 10.1016/j.eujim.2020.101136
6. Perdiz, S.A. , Kwong, SM , Firth, N , y Jensen, SO . Elementos genéticos móviles asociados con la resistencia a los antimicrobianos. Clin Microbiol Rev. (2018) 31:E00088–97. doi: 10.1128/CMR.00088-17
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Rajala-Schultz, P , Nødtvedt, A , Halasa, T , y Persson, WK . Uso prudente de antibióticos en vacas lecheras: el enfoque nórdico para la salud de la ubre. Front Vet Sci. (2021) 8:623998. DOI: 10.3389/FVETS.2021.623998
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Niemi, R , Hovinen, M , y Rajala-Schultz, P . Efecto de la terapia selectiva de vacas secas sobre la producción de leche y el recuento de células somáticas: un estudio de cohorte retrospectivo. J Dairy Sci. (2002) 105:1387–401. DOI: 10.3168/JDS.2021-20918
9. Russi, N , Maito, J , Dieser, SA , Renna, MS , Signorini, ML , Camussone, C, et al. Comparación de pruebas fenotípicas para detectar resistencia a la penicilina G con presencia del gen blaZ en Staphylococcus aureus aislado de infecciones intramamarias bovinas. J Dairy Res. (2015) 82:317–21. doi: 10.1017/S0022029915000242
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Vakkamäki, J , Taponen, S , Heikkilä, A-M , y Pyörälä, S . Etiología bacteriológica y tratamiento de la mastitis en rebaños lecheros finlandeses. Acta Vet Scand. (2017) 59:33. DOI: 10.1186/S13028-017-0301-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Taponen, S , Nykäsenoja, S , Pohjanvirta, T , Pitkälä, A , y Pyörälä, S . Distribución por especies y susceptibilidad antimicrobiana in vitro de estafilococos coagulasa negativos aislados de leche mastítica bovina. Acta Vet Scand. (2016) 58:12. DOI: 10.1186/S13028-016-0193-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Fergestad, ME , De Visscher, A , L’Abee-Lund, T , Ngassam Tchamba, C , Mainil, JG , Thiry, D, et al. Características de resistencia antimicrobiana y virulencia en 3 colecciones de estafilococos de muestras de leche bovina. J Dairy Sci. (2021) 104:10250–67. DOI: 10.3168/JDS.2020-19988
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Graffunder, EM , y Venezia, RA . Factores de riesgo asociados con la infección nosocomial por Staphylococcus aureus resistente a la meticilina (SARM), incluido el uso previo de antimicrobianos. J Quema antimicrobiana. (2002) 49:999–1005. DOI: 10.1093/JAC/DKF009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Springer, B , Orendi, U , mucho, p , Hoger, G , Ruppitsch, W , Krziwanek, K, et al. Staphylococcus aureus resistente a la meticilina: ¿un nuevo agente zoonótico? Wien Klin Wochenschr. (2009) 121:86–90. DOI: 10.1007/S00508-008-1126-Y
15. FINRES-Vet (2016–2017). Monitorización de la resistencia a los antimicrobianos veterinarios finlandeses y consumo de agentes antimicrobianos. Publicaciones Evira 5/2018. Autoridad finlandesa de seguridad alimentaria Evira, Helsinki, Finlandia. Disponible en: https://www.ruokavirasto.fi/globalassets/viljelijat/elaintenpito/elainten-laakitseminen/evira_publications_5_2018.pdf (consultado el 16 de diciembre de 2022).
16. Duse, A , Persson-Waller, K , y Pedersen, K . Etiología microbiana, susceptibilidad a antibióticos y factores de riesgo específicos de patógenos para patógenos de ubres de mastitis clínica en vacas lecheras. Animales. (2021) 11:2113. doi: 10.3390/ani11072113
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. FINRES-Vet (2010–2012). Monitorización de la resistencia a los antimicrobianos veterinarios finlandeses y consumo de agentes antimicrobianos. Publicaciones Evira 2/2015. Autoridad finlandesa de seguridad alimentaria Evira, Helsinki, Finlandia. Disponible en: https://www.ruokavirasto.fi/globalassets/viljelijat/elaintenpito/elainten-laakitseminen/antibioottiresistenssin_seuranta/finres_vet_070515.pdf (consultado el 16 de diciembre de 2022)
18. Feld, L , Bahía, H , Angen, Ø , Larsen, AR , y Madsen, AM . Supervivencia de LA-MRSA en polvo de granjas porcinas. Ann Work Expo Health. (2018) 62:147–56. doi: 10.1093/annweh/wxx108
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Maddox, TW , Scantlebury, CE , Clegg, PD , Dawson, S , Pinchbeck, GL , y Williams, NJ . Una revisión de las características y el tratamiento del Staphylococcus aureus resistente a la meticilina (SARM) en el caballo y una serie de casos de infección por SARM en cuatro caballos. Veterinario Equino Educ. (2010) 22:91–102. doi: 10.1111/j.0957-7730.2009.00026.x
20. Petinaki, E , y Spiliopoulou, I . Colonización por Staphylococcus aureus resistente a la meticilina y riesgos de infección de animales de compañía: perspectivas actuales. Vet Med Res Rep. (2015) 6:373–82. doi: 10.2147/VMRR. S91313
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. FINRES-Vet (2020). Monitorización de la resistencia a los antimicrobianos veterinarios finlandeses y consumo de agentes antimicrobianos. Publicaciones de la autoridad alimentaria finlandesa 6/2021. Autoridad alimentaria finlandesa, Helsinki, Finlandia. Disponible en: https://www.ruokavirasto.fi/globalassets/viljelijat/elaintenpito/elainten-laakitseminen/antibioottiresistenssin_seuranta/finnish_food_authority_publications_6_2021_finres-vet_2020.pdf (consultado el 16 de diciembre de 2022).
22. Sargento ESG Epitools Epidemiological Calculators. Ausvet. (2018) Disponible en: http://epitools.ausvet.com.au (consultado el 1 de diciembre de 2021)
23. Cameron, M , Barkema, HW , De Buck, J , De Vliegher, S , Chaffer, M , Lewis, J, et al. Identificación de estafilococos coagulasa negativos asociados a bovinos mediante espectrometría de masas de tiempo de vuelo de desorción/ionización láser asistida por matriz utilizando un protocolo de transferencia directa. J Dairy Sci. (2017) 100:2137–47. DOI: 10.3168/JDS.2016-12020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. EUCAST Comité Europeo sobre Pruebas de Sensibilidad a los Antimicrobianos Sociedad Europea de Microbiología Clínica y Enfermedades Infecciosas (2021). Disponible en: https://www.eucast.org/ (consultado el 21 de marzo de 2022).
25. CLSI Clinical and Laboratory Standard Institute Normas de rendimiento para el disco antimicrobiano y las pruebas de susceptibilidad a la dilución para bacterias aisladas de animales. VET08, 4ª ed. (2008). Disponible en: www.clsi.org
26. DTU Food, National Food Institute, Technical University of Denmark Protocol for PCR amplification of mecA, mecC, spa and pvl. (2012). Recomendado por la EURL-AR. 2ª versión, septiembre de 2012. Disponible en: https://www.eurl-ar.eu/CustomerData/Files/Folders/21-protocols/279_pcr-spa-pvl-meca-mecc-sept12.pdf (consultado el 22 de febrero de 2022).
27. Madhaiyan, M , Wirth, JS , y Saravanan, VS . Los análisis filogenómicos de la familia Staphylococcaceae sugieren la reclasificación de cinco especies dentro del género Staphylococcus como sinónimos heterotípicos, la promoción de cinco subespecies a nuevas especies, la reasignación taxonómica de cinco especies de Staphylococcus a Mammaliicoccus gen. Nov., y la asignación formal de Nosocomiicoccus a la familia Staphylococcaceae. Int J Syst Evol Microbiol. (2020) 70:5926–36. doi: 10.1099/ijsem.0.004498
28. Dolor, M , Wolden, R , Jaén-Luchoro, D , Salvà-Serra, F , Piñeiro Iglesias, B , Karlsson, R, et al. Staphylococcus borealis sp. nov., aislado de piel y sangre humana. Int J Syst Evol Microbiol. (2020) 70:6067–78. doi: 10.1099/ijsem.0.004499
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Dohoo, IR , Martin, W , y Stryhn, H . Investigación Epidemiológica Veterinaria. 2ª ed. Charlottetown: Universidad de la Isla del Príncipe Eduardo (2014).
30. Sol, J , Sampimon, OC , Barkema, HW , y Schukken, YH . Factores asociados con la curación después de la terapia de mastitis clínica causada por Staphylococcus aureus. J Dairy Sci. (2000) 83:278–84. DOI: 10.3168/JDS. S0022-0302(00)74875-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Taponen, S , Jantunen, A , Pyörälä, E , y Pyörälä, S . Eficacia del tratamiento parenteral e intramamario combinado dirigido de 5 días de la mastitis clínica causada por Staphylococcus aureus susceptible a la penicilina o resistente a la penicilina. Acta Vet Scand. (2003) 44:53–62. DOI: 10.1186/1751-0147-44-53
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Barkema, HW , Schukken, YH , y Zadoks, RN . Revisión invitada: el papel de la vaca, el patógeno y el régimen de tratamiento en el éxito terapéutico de la mastitis bovina por Staphylococcus aureus. J Dairy Sci. (2006) 89:1877–95. DOI: 10.3168/JDS. S0022-0302(06)72256-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. FINRES-Vet 2005-2006 (2022). Monitorización de la resistencia a los antimicrobianos veterinarios finlandeses y consumo de agentes antimicrobianos. Publicaciones Evira 22/2007. Autoridad finlandesa de seguridad alimentaria Evira, Helsinki, Finlandia. Disponible en: https://www.ruokavirasto.fi/globalassets/viljelijat/elaintenpito/elainten-laakitseminen/antibioottiresistenssin_seuranta/finres_vet_22_2007.pdf (consultado el 16 de diciembre de 2022).
34. Nyman, A-K , Fasth, C , y Persson, WK . Infecciones intramamarias con diferentes estafilococos no áureos en vacas lecheras. J Dairy Sci. (2018) 101:1403–18. DOI: 10.3168/JDS.2017-13467
35. Chehabi, CN , Nonnemann, B , Astrup, LB , Farre, M , y Pedersen, K . Resistencia antimicrobiana in vitro de agentes causales a mastitis clínica en vacas lecheras danesas. Foodborne Pathog Dis. (2019) 16:562–72. DOI: 10.1089/FPD.2018.2560
36. Nobrega, DB , Naushad, S , Naqvi, SA , Condas, LAZ , Saini, V , Kastelic, JP, et al. Prevalencia y bases genéticas de la resistencia a los antimicrobianos en estafilococos no áureos aislados de rebaños lecheros canadienses. Microbiol frontal. (2018) 9:256. DOI: 10.3389/fmicb.2018.00256
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Kim, S-J , Luna, DC , Parque, S-C , Kang, HY , Na, SY , y Lim, S-K . Resistencia antimicrobiana y caracterización genética de estafilococos coagulasa negativos de muestras de leche de mastitis bovina en Corea. J Dairy Sci. (2019) 102:11439–48. DOI: 10.3168/JDS.2019-17028
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Boireau, C , Cazeau, G , Jarrige, N , Calavas, D , Madec, J-Y , Leblond, A, et al. Resistencia a los antimicrobianos en bacterias aisladas de mastitis en ganado lechero en Francia, 2006-2016. J Dairy Sci. (2018) 101:9451–62. DOI: 10.3168/JDS.2018-14835
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Lúcio, ÉC , Gouveia, GV , da Costa, MM , de Oliveira, JMB , Mota, RA , y Pinheiro, JWJ . Características fenotípicas y genotípicas y perfil de resistencia de Staphylococcus spp. de mastitis bovina. Acta Sci Vet. (2020) 48:1759. doi: 10.22456/1679-9216.103434
40. Phophi, L , Petzer, MI , y Qekwana, DN . Patrones de resistencia a los antimicrobianos y formación de biopelículas de especies de Staphylococcus coagulasa negativas aisladas de mastitis subclínica Muestras de leche de vaca enviadas al laboratorio de leche de Onderstepoort. BMC Vet Res. (2019) 15:420. DOI: 10.1186/S12917-019-2175-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Gindonis, V , Taponen, S , Myllyniemi, A-M , Pyörälä, S , Nykäsenoja, S , Salmenlinna, S, et al. Aparición y caracterización de estafilococos resistentes a la meticilina a partir de muestras de leche de mastitis bovina en Finlandia. Acta Vet Scand. (2013) 55:61. doi: 10.1186/1751-0147-55-61
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Jaglic, Z , Michu, E , Holasova, M , Vlkova, H , Babak, V , Kolar, M, et al. Epidemiología y caracterización de aislados de Staphylococcus epidermidis de humanos, leche cruda bovina y una planta lechera. Epidemiol Infect. (2010) 138:772–82. doi: 10.1017/S0950268809991002
43. Sakwinska, O , Giddey, M , Moreillon, M , Morisset, D , Waldvogel, A , y Moreillon, P . Rango de hospedadores de Staphylococcus aureus y cambio de hospedador humano-bovino. Aplicación Environ Microbiol. (2011) 77:5908–15. doi: 10.1128/AEM.00238-11
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Salmenlinna, S , Raulo, S , Lindholm, L , Marttila, H , Myllyniemi, A-L , Nykäsenoja, S, et al. MRSA CC398 en personas: ¿debe prevenirse la propagación de la resistencia a los antimicrobianos zoonóticos? (en finés, MRSA CC398 ihmisillä: Tulisiko zoonottisen mikrobilääkeresistenssin leviäminen estää?). Lääkärilehti. (2021) 76:1813–8.
45. EUCAST European Committee on Antimicrobial Susceptibility Testing (2017). Detección de mecanismos de resistencia. Comité europeo de pruebas de sensibilidad a los antimicrobianos. Disponible en: https://www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/Resistance_mechanisms/EUCAST_detection_of_resistance_mechanisms_170711.pdf (consultado el 22 de febrero de 2022)
46. Skov, R , Varga, A , Matuschek, E , Åhman, J , Bemis, D , Bengtsson, B, et al. EUCAST disc diffusion criteria for the detection of mecA-mediated b-lactam resistance in Staphylococcus pseudintermedius: oxacillin versus cefoxitin. Clin Microbiol Infect. (2020) 26:122.e1–6. doi: 10.1016/j.cmi.2019.05.002
47. Kriegeskorte, A , Idelevich, EA , Schlattman, A , capa, F , Strommenger, B , Denis, O, et al. Comparación de diferentes enfoques fenotípicos para detectar y detectar Staphylococcus aureus resistente a la meticilina que alberga mecC. J Clin Microbiol. (2018) 56:E00826–917. doi: 10.1128/JCM.00826-17
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Becker, K , van Alen, S , Idelevich, EA , Schleimer, N , Seggewiß, J , Mellmann, A, et al. Resistencia a la meticilina mediada por mecB transferible codificada por plásmidos en Staphylococcus aureus. Emerg infectar dis. (2018) 24:242–8. DOI: 10.3201/EID2402.171074
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Sommer, A , Fuchs, S , capa, F , Schaudinn, C , Weber, RE , Richard, H, et al. Las mutaciones en el gen gdpP son un mecanismo clínicamente relevante para la resistencia a los β-lactámicos en Staphylococcus aureus resistente a la meticilina que carece de determinantes mec. Género Microb. (2021) 7:623. DOI: 10.1099/mgen.0.000623
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Ruegg, PL , Oliveira, L , Jin, W , y Okwumabua, O . Susceptibilidad antimicrobiana fenotípica y aparición de genes de resistencia seleccionados en patógenos de mastitis grampositiva aislados de vacas lecheras de Wisconsin. J Dairy Sci. (2015) 98:4521–34. DOI: 10.3168/JDS.2014-9137
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. El Feghaly, RE , Stamm, JE , Fritz, SA , y Burnham, C-AD . Presencia del gen blaZ beta-lactamasa en aislados de Staphylococcus aureus que aparecen susceptibles a la penicilina por métodos fenotípicos convencionales. Diagn Microbiol Infect Dis. (2012) 74:388–93. doi: 10.1016/j.diagmicrobio.2012.07.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Ferreira, AM , Martins, KB , da Silva, VR , Mondelli, AL , y Cunha, (2017). Correlación de pruebas fenotípicas con la presencia del gen blaZ para la detección de betalactamasa. Braz J Microbiol 48:159–166. doi: 10.1016/j.bjm.2016.10.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Pitkälä, A , Salmikivi, L , Bredbacka, P , Myllyniemi, A-L , y Koskinen, MT . Comparación de pruebas para la detección de estafilococos productores de β-lactamasa. J Clin Microbiol. (2007) 45:2031–3. doi: 10.1128/JCM.00621-07
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Haveri, M , Suominen, S , Rantala, L , Honkanen-Buzalski, T , y Pyörälä, S . Comparación de la detección fenotípica y genotípica de la resistencia a la penicilina G de Staphylococcus aureus aislado de la infección intramamaria bovina. Veterinario Microbiol. (2005) 106:97–102. doi: 10.1016/j.vetmic.2004.12.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Kaase, M , Lenga, S , Friedrich, S , Szabados, F , Sakinc, T , Kleine, B, et al. Comparación de métodos fenotípicos para la detección de penicilinasa en Staphylococcus aureus. Clin Microbiol Infect. (2008) 14:614–6. doi: 10.1111/j.1469-0691.2008.01997.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Tasara, T , Cernela, N , y Stephan, R . Mutaciones que alteran la función en los genes blaZ y blaR de cepas de Staphylococcus aureus sensibles a la penicilina aisladas de mastitis bovina. Schweiz Arco Tierheilkd. (2013) 155:359–63. DOI: 10.1024/0036-7281/A000471
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: Staphylococcus aureus , estafilococos no áureos, NAS, mastitis bovina, resistencia antimicrobiana, penicilina, blaZ, mec
Cita: Taponen S, Tölli H-T y Rajala-Schultz PJ (2023) Susceptibilidad antimicrobiana de estafilococos de muestras de leche bovina en análisis de mastitis microbiológica de rutina en Finlandia. Frente. Vet. Sci. 10:1235417. doi: 10.3389/fvets.2023.1235417
Recibido: 06 Junio 2023; Aprobado: 02 Agosto 2023;
Publicado: 17 agosto 2023.
Editado por:
Yasser Mahmmod, Escuelas Superiores de Tecnología, Emiratos Árabes Unidos
Revisado por:
Mihaela Niculae, Universidad de Ciencias Agrícolas y Medicina Veterinaria de Cluj-Napoca, Rumania
Svenja Woudstra, Universidad de Copenhague, Dinamarca
Derechos de autor © 2023 Taponen, Tölli y Rajala-Schultz. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Suvi Taponen, suvi.taponen@helsinki.fi
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

