Técnica ecográfica para evaluar la función testicular en carneros

Aplicación de la técnica ecográfica para evaluar la función testicular y su correlación con la calidad del esperma tras diferentes frecuencias de recogida en carneros
 Rafael Montes-Garrido1,2†,
Rafael Montes-Garrido1,2†,  Marta F. Riesco1,3†,
Marta F. Riesco1,3†,  Luis Anel-López1,4*,
Luis Anel-López1,4*,  Marta Neila-Montero1,2,
Marta Neila-Montero1,2,  Cristina Palacín-Martínez1,2,
Cristina Palacín-Martínez1,2,  Juan Carlos Boixo1,2,
Juan Carlos Boixo1,2,  Paulino de Paz1,3,
Paulino de Paz1,3,  Cristina Ortega-Ferrusola5,
Cristina Ortega-Ferrusola5,  Mohamed A. A. Hassan6,
Mohamed A. A. Hassan6,  Luis Anel1,2 y
Luis Anel1,2 y  Mercedes Álvarez1,2
Mercedes Álvarez1,2- 1Investigación en Técnicas de Reproducción Asistida – Universidad de León, Instituto de Desarrollo Ganadero y Sanidad Animal, Universidad de León, León, España
- 2Reproducción Animal y Obstetricia, Departamento de Medicina Veterinaria, Cirugía y Anatomía, Universidad de León, León, España
- 3Biología Celular, Departamento de Biología Molecular, Universidad de León, León, España
- 4Anatomía, Departamento de Veterinaria, Cirugía y Anatomía, Universidad de León, León, España
- 5Laboratorio de Reproducción Equina y Espermatología Equina, Hospital Veterinario Docente, Universidad de Extremadura, Cáceres, España
- 6Departamento de Anatomía y Embriología, Facultad de Medicina Veterinaria, Universidad de Sohag, Sohag, Egipto
La frecuencia de recolección de semen es un factor crucial a considerar en el entrenamiento del rendimiento de los carneros dentro de los centros de cría. Para evaluar este factor, la evaluación de la solidez reproductiva podría incluir la evaluación de la calidad del esperma y nuevas herramientas predictivas y no invasivas, como la técnica de ultrasonido. En este trabajo, se utilizó una tecnología avanzada de ecografía, que analiza el volumen testicular, la ecotextura y la función vascular, en tres frecuencias diferentes de recolección de semen (frecuencia de abstinencia, FA; frecuencia estándar, SF; y frecuencia intensiva, IF). Las muestras de semen se enfriaron (15◦C, 6 h) y se evaluaron en términos de producción, motilidad, viabilidad, apoptosis y contenido de especies reactivas de oxígeno. Se calcularon coeficientes de correlación entre las mediciones ecográficas de ecotextura y flujo sanguíneo y los parámetros de calidad del esperma. Nuestros resultados mostraron un aumento en la ecotextura testicular cuando se intensificó la frecuencia de recolección de semen. Los parámetros Doppler (PSV, RI, PI, TABF) aumentaron (P ≤ 0,05) cuando se intensificó la frecuencia de recolección de semen. La motilidad y funcionalidad de los espermatozoides disminuyó en las muestras de FI (P ≤ 0,05), evidenciando la frecuencia de influencia de la recolección de semen. Además, se establecieron correlaciones positivas moderadas entre la ecotextura y diferentes parámetros Doppler con parámetros de motilidad en SF. Además, se analizó la influencia de los días de abstinencia en el éxito de la IA en un ensayo de campo. Las tasas de fertilidad más altas se obtuvieron cuando los hombres tenían de dos a cinco días de abstinencia. Para concluir, la frecuencia de recolección de semen podría verse influenciada en términos de cantidad de semen y calidad de espermatozoides, mostrando cambios en la ecotextura del parénquima y la vascularización testicular. La frecuencia estándar de recolección de semen fue la opción más adecuada. Además, la ecografía puede ser una herramienta predictiva para estimar variaciones en la calidad espermática de carneros donantes sometidos a diferentes frecuencias de recolección de semen en centros de reproducción.
Introducción
El rendimiento reproductivo es el parámetro más importante que afecta la rentabilidad de la parvada (1), y la capacidad reproductiva de los carneros juega un papel clave (2). MacLaren (3) sugiere que el 50% del potencial reproductivo de una bandada es proporcionado por el carnero (3). Las evaluaciones de testículos se realizan para evaluar la capacidad potencial general de los carneros para servir e impregnar a las ovejas, también conocida como evaluación de la solidez de la cría (EEB) (2). Una EEB puede incluir exámenes anatómicos y estructurales y evaluación del estado de salud, puntuación de condición corporal (BCS), mediciones testiculares, calidad del esperma y libido (4). En este contexto, el comportamiento sexual y las características del semen son los principales parámetros que limitan la eficiencia reproductiva masculina, y ambos están muy influenciados por la frecuencia de recolección de semen. Las variaciones en la frecuencia de la eyaculación inducen cambios en el proceso de maduración de los espermatozoides, las características funcionales de los espermatozoides, la composición iónica y la actividad enzimática del plasma seminal (5, 6). En un estudio previo, Ollero et al. (5) documentaron que diferentes períodos de abstinencia podrían afectar la calidad del esperma en términos de viabilidad, motilidad e integridad acrosómica en las especies ovinas. Hasta donde sabemos, no hay estudios en un gran número de carneros que evalúen el efecto de la frecuencia de recolección de semen en la capacidad reproductiva masculina, la producción de semen y la calidad empleando técnicas innovadoras y predictivas.
Los métodos tradicionales, como la medición de la circunferencia escrotal y la libido o la palpación y manipulación de los órganos genitales, se han utilizado para evaluar la capacidad reproductiva potencial de los carneros (3, 7, 8). En los últimos años, se han utilizado varias herramientas nuevas, incluida la ecografía, para predecir variaciones en las características del semen y la capacidad reproductiva del carnero en centros de reproducción y parvadas (9, 10). Específicamente, la ecografía es una técnica no invasiva, no ionizante y no dañina y una herramienta indispensable en las clínicas de reproducción que proporciona información en tiempo real y secuencial sobre el rendimiento reproductivo masculino (11, 12). El ultrasonido en modo B se ha utilizado en diferentes especies de animales domésticos como una herramienta válida para estimar el volumen testicular (13-15), estimar la ecotextura del parénquima (16-18) e identificar hallazgos clínicos inciertos, como etapas tempranas de procesos patológicos macroscópicos o monitoreo de cambios en las lesiones (12). La ecografía Doppler en color y pulso se ha empleado para caracterizar y cuantificar el flujo sanguíneo de los testículos en diferentes especies, como sementales (19) y perros (20). Esta tecnología también se ha utilizado para evaluar trastornos escrotales en perros (14) y camélidos (21) y correlacionarlos con la calidad del esperma. Varios estudios han evaluado el uso de ultrasonido en modo B en condiciones fisiológicas y patológicas (12, 22-24), y la relación entre la pubertad y los cambios en la ecogenicidad del parénquima (25-28) en la andrología ovina. Además, se dispone de varios estudios sobre el uso de la ecografía Doppler para la evaluación del flujo sanguíneo testicular en carneros (9, 10, 26, 29) que consideran la influencia de este parámetro en la función testicular. El flujo sanguíneo testicular es la ruta principal a través de la cual todos los nutrientes requeridos, oxígeno, hormonas reguladoras y productos secretores se regulan e intercambian hacia y desde los testículos (30). En este sentido, diferentes estudios han evidenciado una asociación entre el flujo sanguíneo testicular y la calidad del esperma en varias especies como humanos (31), sementales (13, 32) o carneros (9, 10), y utilizaron parámetros Doppler para diagnosticar las tasas de fertilidad en camélidos (21) o perros (14). Debido a esto, planteamos la hipótesis de que la frecuencia de recolección de semen podría ser un factor crucial que causa cambios testiculares en aquellos parámetros detectados por ultrasonido y en la calidad del esperma.
Teniendo en cuenta la importancia del manejo de los carneros en términos de rendimiento dentro de un centro de cría, el primer objetivo de este estudio es investigar los efectos de la frecuencia de recolección de semen en el rendimiento reproductivo masculino, incluida la función testicular, y la cantidad y calidad del semen empleando un enfoque multiparamétrico basado en la morfometría testicular, la ecotextura y la vascularización, el nivel de testosterona en sangre, libido, y motilidad de los espermatozoides y parámetros de funcionalidad. En segundo lugar, el estudio pretende abordar la posible asociación entre los parámetros de calidad espermática y las mediciones ecográficas en las diferentes frecuencias de recogida de semen. Como tercer objetivo, estudiamos las consecuencias directas de las diferentes frecuencias de extracción de semen en términos de calidad espermática y fertilidad en un ensayo de campo.
Materiales y métodos
Animales
Twent-cinco sexualmente maduros (rango de edad 2-7 años) carneros Assaf se utilizaron durante la temporada de reproducción en el estudio actual. Todos los carneros fueron examinados previamente y no tenían ninguna enfermedad. Los animales fueron alojados agrupados (cinco animales por cada grupo) en corrales cerrados con acceso a un área abierta en el Centro de Selección y Reproducción de Animales de la Junta de Castilla y León (CENSYRA) (Villaquilambre, León, España), donde fueron alimentados con una dieta equilibrada estándar. El presente estudio se realizó de acuerdo con las Directrices del Consejo de la Unión Europea (2010/63/UE), siguiendo la normativa española (RD/1201/2005, derogado por el RD/53/2013) para el uso de animales de laboratorio. Todos los experimentos fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de León (ÉTICA-ULE-013-2018).
Diseño experimental
Experimento 1: Evaluación de diferentes frecuencias de recolección de semen
Los carneros Assaf sexualmente maduros se utilizaron durante la temporada de reproducción. Todos los carneros se inscribieron en la frecuencia de recolección de semen (FA) de abstinencia donde los machos descansaron sexualmente y el semen no se recolectó durante 1 mes. Al final de este período, se evaluaron el volumen testicular, la ecotextura testicular y los parámetros Doppler. Después de la evaluación del animal, se recolectaron y mezclaron dos eyaculados consecutivos por carnero, midiendo los siguientes parámetros: volumen de eyaculación, concentración de espermatozoides y producción total de espermatozoides. Se analizaron los eyaculados, incluidos los parámetros de motilidad y fisiología de los espermatozoides (detallados en la sección «Evaluación de espermatozoides»). Luego, todos los carneros se inscribieron en la frecuencia estándar de recolección de semen (SF) durante 1 mes: dos eyaculaciones consecutivas por día / dos días de recolección por semana. Al final de este período, se repitieron todas las mediciones ultrasonográficas y, después de la evaluación del animal, se recolectaron, mezclaron y analizaron dos eyaculaciones consecutivas por carnero. Para concluir este experimento, los 25 carneros se inscribieron en la frecuencia de recolección intensiva de semen (IF): dos eyaculaciones consecutivas por día / cinco días de recolección por semana (de lunes a viernes). Nuevamente, 1 mes después, se repitieron todas las mediciones ultrasonográficas. En este escenario, después de 2 días de abstinencia durante el fin de semana, se recolectaron y analizaron dos eyaculaciones consecutivas por carnero el lunes (IFM) y, después de cinco días consecutivos de recolección de semen, se recolectaron y analizaron dos eyaculaciones consecutivas por carnero el viernes (IFF). El diseño experimental se muestra en la Figura 1.
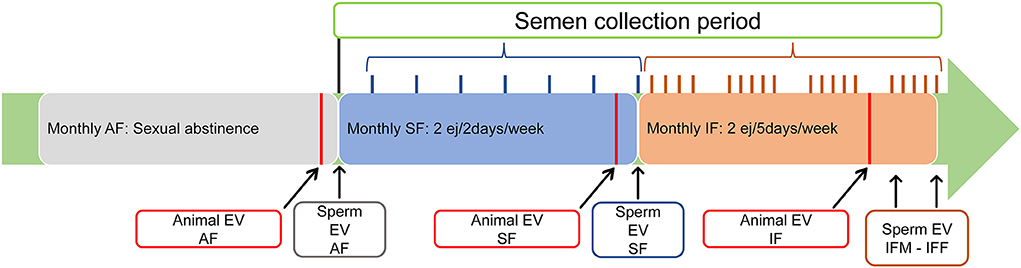 Figura 1. Diseño experimental. Las tres frecuencias de recolección de semen se extendieron por 1 mes. Evaluación en animales (EV animal): el examen clínico (inspección y palpación de los genitales externos, la libido y la recolección de sangre) y la evaluación por ecografía (volumen testicular, ecotextura y flujo sanguíneo) se llevaron a cabo al menos 24 h antes de la recolección experimental de semen). Evaluación de espermatozoides (Sperm EV): la producción, motilidad y fisiología de los espermatozoides se realizaron al final de la frecuencia de recolección de semen evaluada. FA: frecuencia de recolección de semen de abstinencia; SF: frecuencia estándar de recolección de semen; IFM, frecuencia de recolección intensiva de semen el lunes; IFF, frecuencia de recolección intensiva de semen el viernes.
Figura 1. Diseño experimental. Las tres frecuencias de recolección de semen se extendieron por 1 mes. Evaluación en animales (EV animal): el examen clínico (inspección y palpación de los genitales externos, la libido y la recolección de sangre) y la evaluación por ecografía (volumen testicular, ecotextura y flujo sanguíneo) se llevaron a cabo al menos 24 h antes de la recolección experimental de semen). Evaluación de espermatozoides (Sperm EV): la producción, motilidad y fisiología de los espermatozoides se realizaron al final de la frecuencia de recolección de semen evaluada. FA: frecuencia de recolección de semen de abstinencia; SF: frecuencia estándar de recolección de semen; IFM, frecuencia de recolección intensiva de semen el lunes; IFF, frecuencia de recolección intensiva de semen el viernes.
Experimento 2: Rendimiento de Ram y rendimiento de esperma: un ensayo de campo
En esta parte del experimento, tratamos de extrapolar nuestros hallazgos al ensayo de campo. En una simulación de centro de reproducción, los eyaculados obtenidos de nuestros carneros experimentales (25 machos) en el experimento 1 se clasificaron siguiendo los criterios del centro de reproducción en válidos (volumen de eyaculación > 0,5 ml, motilidad de masa > 3, concentración de espermatozoides > 3.000 × 106 espermatozoides/ml) y eyaculaciones no válidas (algunos de los criterios por debajo del valor mínimo) como se describió anteriormente Neila-Montero et al. (33). Luego, se evaluó la calidad del esperma, incluida la motilidad y la citometría, en ambos grupos experimentales.
Para el ensayo de fertilidad, los grupos experimentales se clasificaron por período de abstinencia masculina antes de la recolección de semen para inseminación: el intervalo estándar de fertilidad (SI), cuando se obtuvieron dosis seminales de varones con dos a cinco días de abstinencia antes de la recolección de semen para AI; el intervalo alto de fertilidad (HI), cuando se obtuvieron dosis seminales de varones con al menos 10 días de abstinencia antes de la recolección de semen para la IA; el intervalo bajo de fertilidad (LI), cuando se obtuvieron dosis seminales de varones con recolección de semen el día anterior para AI; la fertilidad anual (AN), fertilidad promedio anual de la Asociación Nacional de Criadores de la Raza Ovina Assaf (ASSAF. E). Se realizó un ensayo descriptivo para evaluar el efecto del período de abstinencia de la recolección de semen sobre la fertilidad AI.
Para este propósito, 357 dosis seminales (400 × 106 esperma/dosis) de 10 carneros Assaf maduros alojados en el Centro de Selección y Mejora Genética de Ovejas y Cabras de Castilla y León (Ovigén; Villalazán, Junta de Castilla y León, España) se utilizaron durante la época de cría. Los eyaculados se diluyeron a 1.600 × 106 esperma/ml con INRA 96 y enfriado a razón de -0,5 °C/min desde 30 °C hasta 15 °C mediante un baño maría programable (CC-K8, Huber, Alemania). Un total de 357 ovejas adultas de Assaf de seis granjas comerciales fueron inseminadas 6-8 h después de la recolección de semen. Las hembras fueron sometidas a tratamiento para la inducción y sincronización del estro utilizando esponjas intravaginales con 20 mg de acetato de fluorogestona (Chronogest, MSD, Kenilworth, NJ, EUA) durante 14 días. Se retiraron las esponjas y se trató a las ovejas con 500 UI de eCG intramuscular (Folligon, MSD, Bogotá, Colombia). Las inseminaciones artificiales cervicales (54 ± 1 h después de la extracción de las esponjas) fueron realizadas por dos veterinarios experimentados de ASSAF.E. El éxito reproductivo se evaluó en términos de fertilidad (ovejas paridas/ovejas inseminadas (%) según los nacimientos registrados a los 137-154 días posteriores a la inseminación).®®
Examen clínico previo
Antes de ser incluido en el estudio, cada hombre se sometió a un examen clínico general, inspección visual del escroto y palpación testicular para la evaluación de la consistencia, simetría, movilidad y sensibilidad de los testículos. El epidídimo y el plexo pampiniforme también se palparon para garantizar que no se reenviara ninguna patología macroscópica observable en los genitales externos. Luego, los carneros fueron ligeramente sedados con xilazina (0.05 mg / kg), administrados por vía intramuscular y restringidos en posición de pie usando un bastidor de contención. La lana a ambos lados del escroto estaba afeitada.
Niveles de testosterona
Después de todas las medidas clínicas, se recogieron muestras de sangre en un tubo vacutainer sin anticoagulante de la vena yugular. Las muestras se refrigeraron a 5 ° C, y el suero sanguíneo se recogió y almacenó a -20 ° C hasta su análisis. Se utilizó un kit ELISA comercial que utiliza el sistema de inmunoensayo Immulite 2000 XPi (Siemens, Eschborn, Alemania) para determinar la testosterona sérica. De acuerdo con las instrucciones del fabricante, la sensibilidad fue de 0,15 ng/ml, y los coeficientes de variación intra e interensayo fueron de 5,1 y 7,2% cuando las muestras promedio fueron de 9,91 ng/ml.
Evaluación de la libido
La libido se categorizó subjetivamente (puntuación de cero a 10). Calculamos el tiempo transcurrido desde el contacto con un señuelo femenino hasta la eyaculación en ambas colecciones diarias de semen. Se utilizaron intervalos de tiempo para calificar a los carneros. Si la eyaculación ocurrió en 1 minuto o menos, el hombre obtuvo la puntuación máxima (10). Si la eyaculación ocurrió en 1-2 minutos, el hombre obtuvo una puntuación de nueve. Si la eyaculación ocurrió en 2-3 minutos, el hombre obtuvo una puntuación de ocho, etc. Cuando la eyaculación ocurrió después de más de 10 minutos, el macho obtuvo una puntuación de cero. Se calculó la puntuación media de las dos eyaculaciones.
Volumen testicular
Todas las mediciones ultrasonográficas fueron realizadas por el mismo técnico. Todos los exámenes se realizaron utilizando un escáner de ultrasonido en tiempo real, EXAPAD (IMV, Francia), equipado con una matriz lineal de 7,5 MHz. El transductor se cubrió con una gran cantidad de gel para facilitar las imágenes ultrasonográficas. El escaneo se realizó sin presión para evitar una distorsión de la forma testicular. Se obtuvieron imágenes del eje caudocraneal, lateral-lateral y ventrodorsal de los testículos. El ancho, la altura y la longitud testicular se midieron utilizando calibradores electrónicos integrados en la máquina de ultrasonido. Los cursores se colocaron en los bordes de la túnica albugínea. Las mediciones se realizaron por triplicado de tres imágenes diferentes (réplicas técnicas). También se evaluó la ecogenicidad, homogeneidad y superficie del contenido escrotal. El volumen testicular fue calculado utilizando la fórmula descrita por Hedia et al. (9): L × H × W × 0,71.
Manipulación inicial del semen
La recolección de semen se realizó durante la temporada de cría. En todos los tiempos de muestreo, el volumen de eyaculado, la concentración de espermatozoides y la producción total de espermatozoides (volumen de eyaculación × concentración de espermatozoides) se calcularon inmediatamente después de la recolección. Los eyaculados fueron recolectados por vagina artificial a 40°C (IMV Technologies, L’Aigle, Francia) en presencia de un señuelo femenino, y los tubos se mantuvieron a 30°C antes de enfriarse. Todas las recogidas de semen fueron realizadas por el mismo investigador. El volumen de eyaculación se estimó recolectándolos en tubos de recolección de semen graduado tipo Falcon. La concentración de espermatozoides se evaluó mediante un contador celular (NucleoCounter SP-100, ChemoMetec, Allerod, Dinamarca). Los eyaculados se diluyeron 1:1 (v/v) con INRA 96. Las muestras se refrigeraron utilizando una velocidad de -0,5 ° C / min desde 30 ° C hasta 15 ° C. Después de eso, la concentración final se ajustó a 1.600 × 10®6 esperma / ml y las muestras se envasaron en pajitas de plástico de 0,25 ml. Las dosis seminales se almacenaron a 15°C. La evaluación de los espermatozoides se realizó 6-8 h después de la recolección del semen.
Evaluación ecográfica de la función testicular
Para la función de evaluación testicular, todos los exámenes fueron realizados por el mismo técnico. Las mediciones se realizaron utilizando el mismo ecógrafo en tiempo real equipado con una matriz lineal de 7,5 MHz y transductores de matriz lineal de alta frecuencia de 10 MHz para evaluar la ecotextura testicular y el flujo sanguíneo testicular, respectivamente.
Ecotextura testicular
La sonda se colocó presionando transversalmente el centro del testículo, y se midieron al menos tres clips por testículo (réplicas técnicas). El software Ecotext (HUMECO; Huesca, España) se utilizó para analizar la ecotextura del parénquima. Se midieron los siguientes parámetros: Ecotexto 1 (EC1: número de píxeles negros), Ecotexto 2 (EC2: número de píxeles blancos), Ecotexto 3 (EC3: nivel medio de gris de píxeles), la densidad tubular (densidad de túbulos/cm®2), el diámetro tubular [diámetro medio (μm) de la luz de los túbulos seminíferos] y el área tubular [proporción (%) del área total ocupada por la luz de los túbulos en el parénquima].
Flujo sanguíneo testicular
Los parámetros Doppler se midieron en la arteria supratesticular localizada en la región del cordón espermático, y el transductor se colocó en un punto medio entre el anillo inguinal y el testículo (34). Para distinguir entre una arteria testicular y una vena mediante análisis Doppler, una arteria, por ejemplo, tendrá una forma de onda en el gráfico espectral que refleja el pulso arterial en cada ciclo cardíaco (sístole y diástole). Sin embargo, el flujo en una vena es casi constante, es decir, sin pulso. Se midieron al menos tres formas de onda consecutivas por testículo (réplicas técnicas), y los parámetros Doppler se calcularon automáticamente mediante el paquete de software provisto con la máquina de ultrasonido. Se midió la velocidad sistólica máxima (PSV) y los índices Doppler estudiados fueron índice resistivo [RI = (velocidad máxima-velocidad mínima)/velocidad máxima] e índice de pulsatilidad [PI = (velocidad máxima-velocidad mínima)/velocidad media]. Además, se calculó el flujo sanguíneo arterial total (TABF) [velocidad media × A; A (sección transversal de la arteria): πr2]. Según estudios previos (11, 19, 35), el ángulo entre el eje largo del vaso y el haz Doppler fue de 20 a 60 grados en la dirección del flujo sanguíneo. Además, la puerta Doppler se mantuvo constante a 1 mm. Para minimizar las variaciones en las mediciones, los ajustes de ultrasonido (enfoque, ganancias, brillo y contraste) se estandarizaron, fijaron y usaron por igual para todos los exámenes como otros autores (9).
Evaluación de espermatozoides
Motilidad y parámetros cinéticos de CASA
Los parámetros de motilidad y cinética se evaluaron mediante el Assisted Sperm Analysis (CASA) (Sperm Class Analyzer -SCA- software V 6.3.0.59; Microptic S.L., Barcelona, España). El ajuste de parámetros se estableció para capturar a 100 fotogramas/s un total de 50 fotogramas y partículas con un área de 20-70 μm2 se consideraron compatibles con el área de la cabeza. Las alícuotas de cada eyaculación se diluyeron a 25 × 106 esperma/ml en un extensor (TES-Tris-fructosa y yema de huevo al 1%) y templado en una placa de 37°C durante 5 min. Después de eso, se colocó una gota de 5 μl en una cámara de celdas de conteo de Makler (10 μm de profundidad; Sefi Medical Instruments, Haifa, Israel). Las muestras se examinaron con un objetivo de contraste de fase negativo de × 10 en un microscopio equipado con una etapa calentada a 38 °C (Eclipse E400, Nikon, Tokio, Japón). Se capturaron y analizaron al menos 400 espermatozoides de cuatro campos diferentes seleccionados al azar. Los parámetros cinéticos reportados fueron la velocidad según la trayectoria recta (VSL, μm/s); la amplitud del desplazamiento lateral de la cabeza del espermatozoide (ALH, μm); la frecuencia de pulsación cruzada de la cabeza (BCF, Hz); la motilidad total (TM), definida como el porcentaje de espermatozoides con VCL (velocidad curvilínea) >15 μm/s; la motilidad progresiva (PM), definida como el porcentaje de espermatozoides con VCL >45 μm/s; y la motilidad progresiva rápida (RAP PM), definida como el porcentaje de espermatozoides con VCL >75 μm/s. Todos los parámetros fueron descritos previamente por Palacín-Martínez et al. (36).
Funcionalidad de los espermatozoides por citometría de flujo
Tinción para la determinación de viabilidad, actividad de caspasas 3 y 7 y funcionalidad mitocondrial
La sonda de fluorescencia Zombie Violet Fixable™ Viability Kit se adquirió de BioLegend (San Diego, CA, EUA), y CellEvent™ Caspasa-3/7 Green Detection Reagent y CellROX™ Deep Red Reagent se suministraron de ThermoFisher (Invitrogen, Eugene, Oregon, EUA).
Para la tinción se utilizó un protocolo previamente descrito por Riesco et al. (37). Las muestras de esperma se diluyeron en PBS a una concentración de 2 × 106 esperma/ml para lavar las células mediante centrifugación corta (15″; MiniSpin plus, Eppendorf, Hamburgo, Alemania) con la eliminación del sobrenadante. Luego, las células se incubaron a temperatura ambiente y en la oscuridad durante 30 minutos con 96 μl de Zombie Violet™ (dilución final 1:1,000), 2 μl de CellEvent™ Caspasa-3/7 (concentración final de 4 μM) y 2 μl de CellROX™ (concentración final de 5 μM). Después de eso, se realizó un nuevo lavado para detener la tinción celular y evitar un efecto de sobretinción, y el pellet se resuspendió en 1 ml de PBS, realizando inmediatamente el análisis por citometría de flujo.
La combinación Zombie Violet™ Fixable Viability Kit, CellEvent™ Caspasa-3/7 Green Detection Reagent y CellROX™ Deep Red se utilizó para determinar simultáneamente la viabilidad a través de la integridad de la membrana plasmática, la actividad de las caspasas 3 y 7 como marcador de apoptosis y la función mitocondrial a través del contenido de especies reactivas de oxígeno (ROS), respectivamente.
Análisis de citometría de flujo
Los análisis de citometría de flujo se realizaron en el citómetro de flujo MACSQuant Analyzer 10 (Miltenyi Biotech, Bergisch Gladbach, Alemania) equipado con tres láseres que emiten a 405, 488 y 635 nm (violeta, azul y rojo, respectivamente) y 10 tubos fotomultiplicadores. La fluorescencia violeta se detectó en V1 (excitación 405 nm, emisión 450/50 nm), la fluorescencia verde se detectó en B1 (excitación 488 nm, emisión 525/50 nm) y la fluorescencia roja se detectó en R1 [excitación 635 nm, emisión 655–730 nm (655 LP + split 730)]. Las muestras se adquirieron utilizando el software MACS Quantify (Miltenyi Biotech, Bergisch Gladbach, Alemania), registrando un total de 40.000 células por muestra a un caudal de 200-300 células/s. Los datos fueron analizados utilizando FlowJo V 10.2 (Ashland, Wilmington, DE, EUA). Las subpoblaciones de espermatozoides de interés evaluadas se graficaron de la siguiente manera: espermatozoides viables (Zombie Violet™ de baja intensidad -vivos-), espermatozoides apoptóticos (CellEvent™ Caspasa 3/7 positivo) y espermatozoides con alta actividad mitocondrial (CellROX™ positivo).
Análisis estadísticos
Los datos fueron analizados con el paquete estadístico SAS/STAT versión 9.1 (SAS Institute, Cary, NC, USA). Los datos fueron analizados por un modelo lineal mixto (procedimiento MIXTO), considerando el efecto masculino como un factor aleatorio. La libido se analizó mediante la prueba de Kruskal-Wallis (procedimiento NPAR1WAY). Las relaciones entre los parámetros de calidad del esperma y las mediciones de ecografía se estudiaron mediante la correlación de Pearson. Los resultados se muestran como la media ± error estándar de la media (SEM). Las diferencias fueron estadísticamente significativas en P ≤ 0,05.®
Resultados
Rendimiento testicular
Se encontraron diferencias significativas (P ≤ 0,05) entre todas las frecuencias de recolección de semen en los niveles séricos de testosterona (Figura 2A), con los niveles más altos en el FI. La libido fue significativamente mayor (P ≤ 0,05) en las colecciones intensivas de semen (IFM e IFF; Figura 2B) en comparación con FA y SF. En cuanto a las mediciones testiculares, se observó un aumento significativo en el volumen en el FI en comparación con la FA (P ≤ 0,05; Figura 2C). De acuerdo con la producción de espermatozoides, el volumen de eyaculado disminuyó significativamente (P ≤ 0,05) en SF e IFF en comparación con FA, pero se encontraron diferencias no significativas (P > 0,05) entre ambos (Figura 2D). La concentración de espermatozoides disminuyó tanto en las evaluaciones de espermatozoides de FI (Figura 2E), como en la producción de espermatozoides fue gradualmente menor (P ≤ 0,05) con una intensidad creciente de la frecuencia de recolección de semen. Sin embargo, se revelaron diferencias no significativas en cuanto a la producción de espermatozoides entre SF e IFM (P > 0,05; Figura 2F).
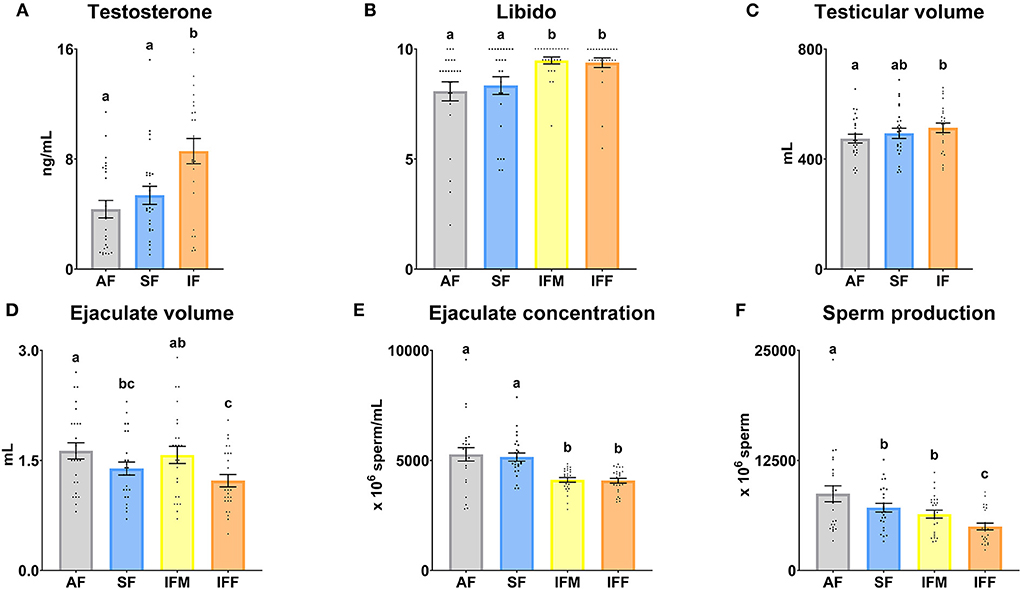 Figura 2. Valores reproductivos de carnero según las frecuencias de recolección de semen. (A) Testosterona, niveles séricos de testosterona (ng/ml); (B) Libido, evaluación subjetiva (cero a 10); (C) Volumen testicular (ml); (D) Volumen de eyaculación (ml); E) Concentración de la eyaculación (× 106 espermatozoides/ml); F) Producción de esperma (× 106 espermatozoides). Los mismos 25 varones fueron analizados en cada grupo experimental (FA, frecuencia de recolección de semen de abstinencia; SF: frecuencia estándar de recolección de semen; IFM, frecuencia de recolección intensiva de semen el lunes; e IFF, frecuencia de recolección intensiva de semen el viernes). Los puntos del gráfico representan valores masculinos individuales [gráficos (A-C)] y eyaculados [gráficos (D-F)]. Se muestran las medias (±SEM). Diferentes letras minúsculas superíndices (a-c) indican diferencias (P ≤ 0,05) entre las frecuencias de recolección de semen.
Figura 2. Valores reproductivos de carnero según las frecuencias de recolección de semen. (A) Testosterona, niveles séricos de testosterona (ng/ml); (B) Libido, evaluación subjetiva (cero a 10); (C) Volumen testicular (ml); (D) Volumen de eyaculación (ml); E) Concentración de la eyaculación (× 106 espermatozoides/ml); F) Producción de esperma (× 106 espermatozoides). Los mismos 25 varones fueron analizados en cada grupo experimental (FA, frecuencia de recolección de semen de abstinencia; SF: frecuencia estándar de recolección de semen; IFM, frecuencia de recolección intensiva de semen el lunes; e IFF, frecuencia de recolección intensiva de semen el viernes). Los puntos del gráfico representan valores masculinos individuales [gráficos (A-C)] y eyaculados [gráficos (D-F)]. Se muestran las medias (±SEM). Diferentes letras minúsculas superíndices (a-c) indican diferencias (P ≤ 0,05) entre las frecuencias de recolección de semen.
Evaluación ecográfica de la función testicular
Los testículos derecho e izquierdo no mostraron diferencias significativas con respecto a los parámetros de ecotextura y Doppler (datos no mostrados). Por lo tanto, se utilizaron las medias de los testículos derecho e izquierdo para un análisis posterior.
Los resultados de la ecotextura testicular se muestran en la Figura 3. La CE1, el área tubular y el diámetro tubular disminuyeron significativamente (P ≤ 0,05) cuando aumentó la frecuencia de recolección de semen. Sin embargo, EC2 y EC3 aumentaron significativamente (P ≤ 0,05) en las mismas condiciones. La densidad tubular fue similar entre las frecuencias de recolección de semen (P > 0,05).
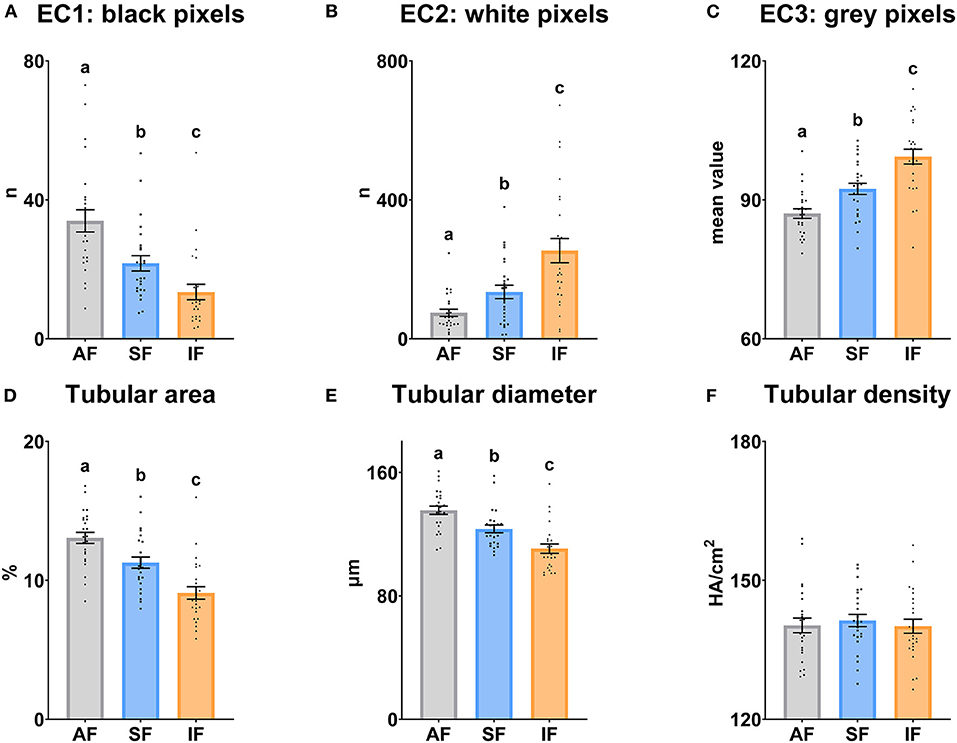 Figura 3. Características de ecotextura de los testículos de carnero según las frecuencias de recolección de semen. (A) EC1, Ecotexto 1 (píxeles negros); b) EC2, Ecotexto 2 (píxeles blancos); C) EC3, Ecotexto 3 (valor medio de píxeles grises); D) Área tubular, proporción (%) del área total correspondiente a la luz de los túbulos seminíferos; (E) Diámetro tubular, diámetro medio (μm) de la luz de los túbulos seminíferos; (F) Densidad tubular, la densidad de áreas hipoecogénicas por cm2 correspondiente con los túbulos seminíferos. Los mismos 25 varones fueron analizados en cada grupo experimental (FA, frecuencia de recolección de semen de abstinencia; SF: frecuencia estándar de recolección de semen; SI, frecuencia de recolección intensiva de semen). Los puntos del gráfico representan valores masculinos individuales. Se muestran las medias (±SEM). Diferentes letras minúsculas superíndices (a-c) indican diferencias (P ≤ 0,05) entre las frecuencias de recolección de semen.
Figura 3. Características de ecotextura de los testículos de carnero según las frecuencias de recolección de semen. (A) EC1, Ecotexto 1 (píxeles negros); b) EC2, Ecotexto 2 (píxeles blancos); C) EC3, Ecotexto 3 (valor medio de píxeles grises); D) Área tubular, proporción (%) del área total correspondiente a la luz de los túbulos seminíferos; (E) Diámetro tubular, diámetro medio (μm) de la luz de los túbulos seminíferos; (F) Densidad tubular, la densidad de áreas hipoecogénicas por cm2 correspondiente con los túbulos seminíferos. Los mismos 25 varones fueron analizados en cada grupo experimental (FA, frecuencia de recolección de semen de abstinencia; SF: frecuencia estándar de recolección de semen; SI, frecuencia de recolección intensiva de semen). Los puntos del gráfico representan valores masculinos individuales. Se muestran las medias (±SEM). Diferentes letras minúsculas superíndices (a-c) indican diferencias (P ≤ 0,05) entre las frecuencias de recolección de semen.
Los resultados de la vascularización testicular se muestran en las Figuras 4, 5. El parámetro PSV fue significativamente mayor (P ≤ 0,05) en SF e IF con respecto a AF. En relación a los parámetros RI y TAPF, ambos aumentaron significativamente (P ≤ 0,05) en el FI en comparación con la FA y el SF. Además, hubo diferencias significativas entre todas las frecuencias de recolección de semen en IP (P ≤ 0,05).
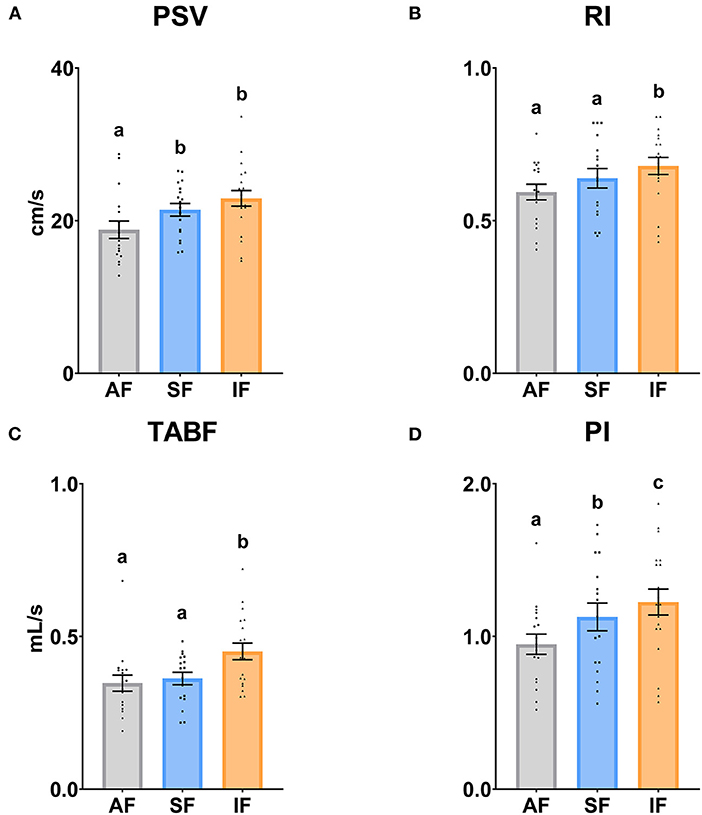 Figura 4. Parámetros Doppler de la arteria supratesticular Ram según las frecuencias de recolección de semen. (A) PSV: velocidad sistólica máxima (cm/s); (B) IR: índice resistivo; (C) TABF: flujo sanguíneo arterial total (ml/min); (D) PI: índice de pulsatividad. Los mismos 17 varones fueron analizados en cada grupo experimental (FA, frecuencia de recolección de semen de abstinencia; SF: frecuencia estándar de recolección de semen; SI, frecuencia de recolección intensiva de semen). Los puntos del gráfico representan valores masculinos individuales. Se muestran las medias (±SEM). Diferentes letras minúsculas superíndices (a-c) indican diferencias (P ≤ 0,05) entre las frecuencias de recolección de semen.
Figura 4. Parámetros Doppler de la arteria supratesticular Ram según las frecuencias de recolección de semen. (A) PSV: velocidad sistólica máxima (cm/s); (B) IR: índice resistivo; (C) TABF: flujo sanguíneo arterial total (ml/min); (D) PI: índice de pulsatividad. Los mismos 17 varones fueron analizados en cada grupo experimental (FA, frecuencia de recolección de semen de abstinencia; SF: frecuencia estándar de recolección de semen; SI, frecuencia de recolección intensiva de semen). Los puntos del gráfico representan valores masculinos individuales. Se muestran las medias (±SEM). Diferentes letras minúsculas superíndices (a-c) indican diferencias (P ≤ 0,05) entre las frecuencias de recolección de semen.
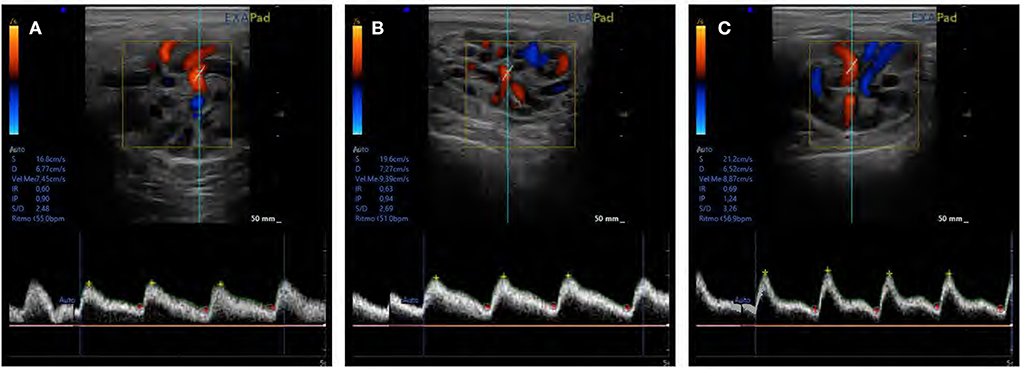 Figura 5. Una evaluación del flujo sanguíneo testicular en la arteria supratesticular mediante ecografía Doppler de pulso en (A) abstinencia, (B) estándar y (C) frecuencias intensivas de recolección de semen.
Figura 5. Una evaluación del flujo sanguíneo testicular en la arteria supratesticular mediante ecografía Doppler de pulso en (A) abstinencia, (B) estándar y (C) frecuencias intensivas de recolección de semen.
Evaluación de la calidad del esperma
Motilidad y parámetros cinéticos
Los parámetros de motilidad de los espermatozoides se muestran en la Figura 6. Hubo diferencias significativas entre FA e IFF en TM (P ≤ 0,05), disminuyendo cuando la intensidad de recolección de semen aumentó. Del mismo modo, la MT fue significativamente mayor (P ≤ 0,05) en SF en comparación con IFF (Figura 6A). En cuanto a la PM RAP, el mayor porcentaje se observó en FA (P ≤ 0,05; Figura 6C). PM, VSL y ALH fueron significativamente mayores (P ≤ 0,05) en FA y SF en comparación con IFM e IFF (Figuras 6B, D, E). El BCF fue significativamente mayor (P ≤ 0,05) en FA en comparación con IFM e IFF. Del mismo modo, el SF fue significativamente mayor (P ≤ 0,05) que el IFF (Figura 6F).
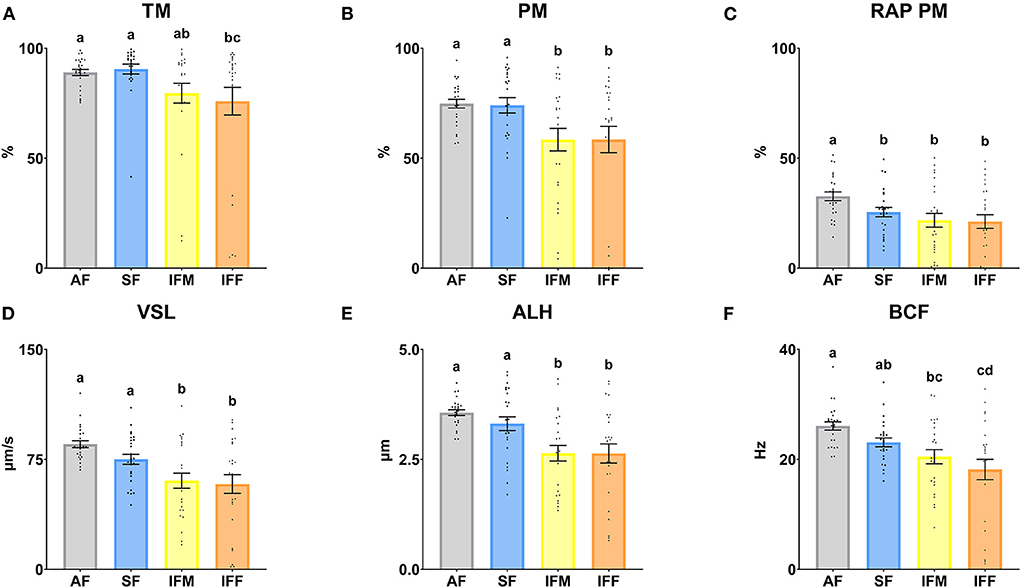 Figura 6. Motilidad de los espermatozoides de carnero según las frecuencias de recolección de eyaculado. (A) TM: motilidad total (%); (B) PM: motilidad progresiva (%); (C) RAP PM, motilidad progresiva rápida (%); (D) VSL, velocidad en línea recta (μm/s); (E) ALH, amplitud lateral de la cabeza (μm); (F) BCF, frecuencia de latido (Hz). Los mismos 25 varones fueron analizados en cada grupo experimental (FA, frecuencia de recolección de semen de abstinencia; SF: frecuencia estándar de recolección de semen; IFM, frecuencia de recolección intensiva de semen el lunes; e IFF, frecuencia de recolección intensiva de semen el viernes). Los puntos del gráfico representan valores masculinos individuales. Se muestran las medias (±SEM). Diferentes letras minúsculas superíndices (a-d) indican diferencias (P ≤ 0,05) entre las frecuencias de recolección de semen.
Figura 6. Motilidad de los espermatozoides de carnero según las frecuencias de recolección de eyaculado. (A) TM: motilidad total (%); (B) PM: motilidad progresiva (%); (C) RAP PM, motilidad progresiva rápida (%); (D) VSL, velocidad en línea recta (μm/s); (E) ALH, amplitud lateral de la cabeza (μm); (F) BCF, frecuencia de latido (Hz). Los mismos 25 varones fueron analizados en cada grupo experimental (FA, frecuencia de recolección de semen de abstinencia; SF: frecuencia estándar de recolección de semen; IFM, frecuencia de recolección intensiva de semen el lunes; e IFF, frecuencia de recolección intensiva de semen el viernes). Los puntos del gráfico representan valores masculinos individuales. Se muestran las medias (±SEM). Diferentes letras minúsculas superíndices (a-d) indican diferencias (P ≤ 0,05) entre las frecuencias de recolección de semen.
Funcionalidad del esperma
Atendiendo al análisis de citometría de flujo, la viabilidad total fue significativamente menor (P ≤ 0,05) en IFM con respecto a FA y SF (Figura 7A). El porcentaje de espermatozoides apoptóticos, con caspasas activas 3 y 7, fue significativamente mayor (P ≤ 0,05) en IFF en comparación con los otros grupos experimentales. Además, este parámetro también fue significativamente mayor (P ≤ 0,05) en SF con respecto a AF (Figura 7B). Finalmente, el porcentaje de espermatozoides con alta actividad mitocondrial mostró las mismas diferencias estadísticamente significativas que el parámetro anterior analizado (Figura 7C) pero con una tendencia opuesta.
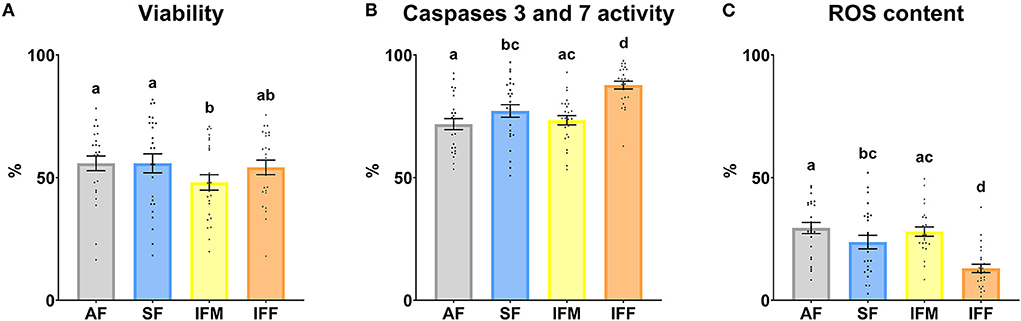 Figura 7. Funcionalidad de los espermatozoides de carnero de acuerdo con las frecuencias de recolección de eyaculados. a) Viabilidad, violeta™ zombi (%); (B) Actividad Caspasas 3 y 7, CellEvent™ Caspasa-3/7 Verde (%); (C) Contenido de ROS, CellROX™ Deep Red (%). Los mismos 25 varones fueron analizados en cada grupo experimental (FA, frecuencia de recolección de semen de abstinencia; SF: frecuencia estándar de recolección de semen; IFM, frecuencia de recolección intensiva de semen el lunes; e IFF, frecuencia de recolección intensiva de semen el viernes). Los puntos del gráfico representan valores masculinos individuales. Se muestran las medias (±SEM). Diferentes letras minúsculas superíndices (a-d) indican diferencias (P ≤ 0,05) entre las frecuencias de recolección de semen.
Figura 7. Funcionalidad de los espermatozoides de carnero de acuerdo con las frecuencias de recolección de eyaculados. a) Viabilidad, violeta™ zombi (%); (B) Actividad Caspasas 3 y 7, CellEvent™ Caspasa-3/7 Verde (%); (C) Contenido de ROS, CellROX™ Deep Red (%). Los mismos 25 varones fueron analizados en cada grupo experimental (FA, frecuencia de recolección de semen de abstinencia; SF: frecuencia estándar de recolección de semen; IFM, frecuencia de recolección intensiva de semen el lunes; e IFF, frecuencia de recolección intensiva de semen el viernes). Los puntos del gráfico representan valores masculinos individuales. Se muestran las medias (±SEM). Diferentes letras minúsculas superíndices (a-d) indican diferencias (P ≤ 0,05) entre las frecuencias de recolección de semen.
Correlaciones entre los parámetros de la ecografía y la calidad del esperma
Las correlaciones entre los parámetros de la ecografía y la calidad del esperma se muestran en las Figuras 8-10, relacionadas con FA, SF e IF, respectivamente. La mayor correlación entre la ecografía y la calidad del esperma en FA se encontró entre la densidad tubular y RAP PM (R2 = −0,408; Figura 8). En cuanto al SF, el índice de pulsatilidad presentó la mayor correlación con RAP PM (R2 = 0,637). Además, RI, TABF, Área y Diámetro mostraron correlaciones positivas moderadas significativas con los parámetros de motilidad (Figura 9). Atendiendo al IF, los índices Doppler (RI y PI) se correlacionaron fuerte y positivamente con C3&7A. Sin embargo, los mismos índices Doppler mostraron fuertes correlaciones negativas con ROS (P ≤ 0,05). Todas las correlaciones estudiadas se incluyen en una matriz de correlación (Figura 10).
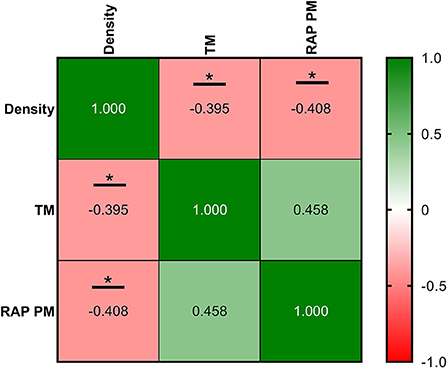 Figura 8. Coeficientes de correlación entre las mediciones de ecografía y los parámetros de calidad espermática en la frecuencia de recolección de semen (FA) de abstinencia. Densidad, la densidad de áreas hipoecogénicas por cm2 correspondiente con los túbulos seminíferos; TM: motilidad total (%); RAP PM: motilidad progresiva rápida (%). Los mismos 25 machos fueron analizados en cada parámetro. El valor R cuadrado entre dos parámetros se representa en cada celda y gráfico. En la matriz de correlación, el color verde indica correlaciones positivas y el color rojo indica relaciones negativas. La intensidad del color representa la fuerza de la correlación entre dos parámetros. Los asteriscos muestran correlaciones significativas (P ≤ 0,05) entre las mediciones de ecografía y los parámetros de calidad del esperma.
Figura 8. Coeficientes de correlación entre las mediciones de ecografía y los parámetros de calidad espermática en la frecuencia de recolección de semen (FA) de abstinencia. Densidad, la densidad de áreas hipoecogénicas por cm2 correspondiente con los túbulos seminíferos; TM: motilidad total (%); RAP PM: motilidad progresiva rápida (%). Los mismos 25 machos fueron analizados en cada parámetro. El valor R cuadrado entre dos parámetros se representa en cada celda y gráfico. En la matriz de correlación, el color verde indica correlaciones positivas y el color rojo indica relaciones negativas. La intensidad del color representa la fuerza de la correlación entre dos parámetros. Los asteriscos muestran correlaciones significativas (P ≤ 0,05) entre las mediciones de ecografía y los parámetros de calidad del esperma.
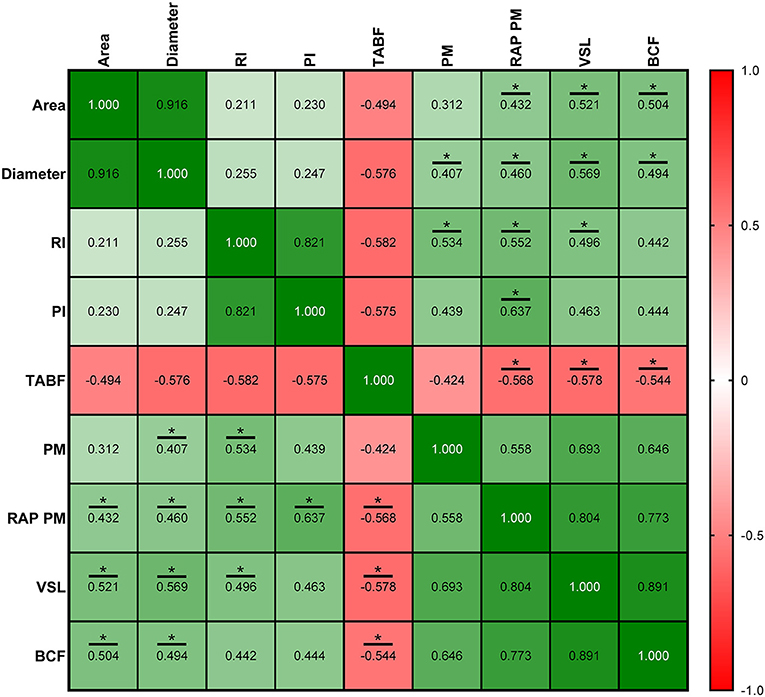 Figura 9. Coeficientes de correlación entre las mediciones de la ecografía y los parámetros de calidad espermática en la frecuencia estándar de recolección de semen (SF). Área, proporción (%) del área total correspondiente a la luz de los túbulos seminíferos; Diámetro, diámetro medio (μm) de la luz de los túbulos seminíferos; IR: índice resistivo; IP: índice de pulsatiliedad; TABF: flujo sanguíneo arterial total (ml/min); PM: motilidad progresiva (%); RAP PM: motilidad progresiva rápida (%); VSL: velocidad en línea recta (μm/s); BCF: frecuencia de latido (Hz). Los mismos 25 machos fueron analizados en cada parámetro. El valor R cuadrado entre dos parámetros se representa en cada celda y gráfico. En la matriz de correlación, el color verde indica correlaciones positivas y el color rojo indica relaciones negativas. La intensidad del color representa la fuerza de la correlación entre dos parámetros. Los asteriscos muestran correlaciones significativas (P ≤ 0,05) entre las mediciones de ecografía y los parámetros de calidad del esperma.
Figura 9. Coeficientes de correlación entre las mediciones de la ecografía y los parámetros de calidad espermática en la frecuencia estándar de recolección de semen (SF). Área, proporción (%) del área total correspondiente a la luz de los túbulos seminíferos; Diámetro, diámetro medio (μm) de la luz de los túbulos seminíferos; IR: índice resistivo; IP: índice de pulsatiliedad; TABF: flujo sanguíneo arterial total (ml/min); PM: motilidad progresiva (%); RAP PM: motilidad progresiva rápida (%); VSL: velocidad en línea recta (μm/s); BCF: frecuencia de latido (Hz). Los mismos 25 machos fueron analizados en cada parámetro. El valor R cuadrado entre dos parámetros se representa en cada celda y gráfico. En la matriz de correlación, el color verde indica correlaciones positivas y el color rojo indica relaciones negativas. La intensidad del color representa la fuerza de la correlación entre dos parámetros. Los asteriscos muestran correlaciones significativas (P ≤ 0,05) entre las mediciones de ecografía y los parámetros de calidad del esperma.
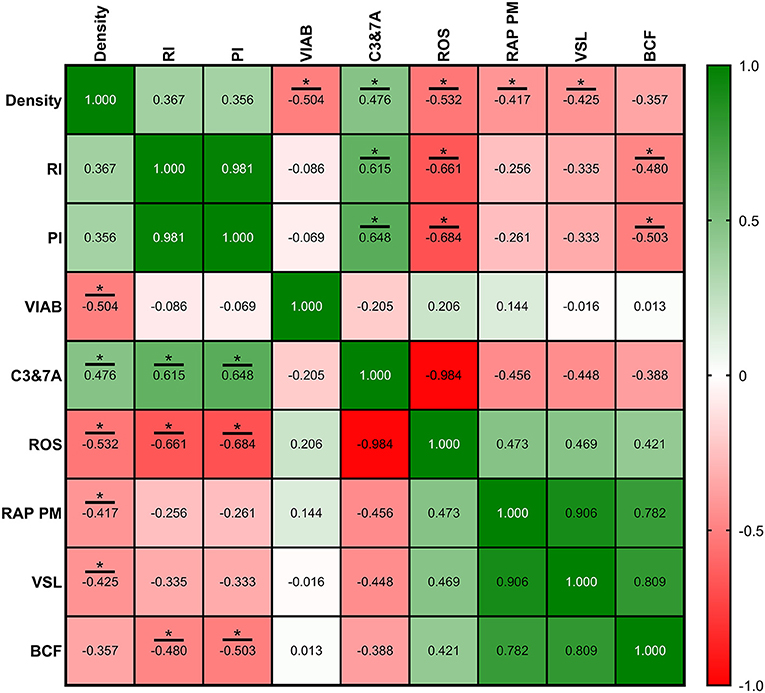 Figura 10. Coeficientes de correlación entre las mediciones de la ecografía y los parámetros de calidad espermática en la frecuencia de recolección intensiva de semen (IF). Los parámetros de calidad del esperma utilizados se midieron el viernes (correspondiente con IRF). Densidad, densidad de áreas hipoecogénicas por cm2 correspondiente con los túbulos seminíferos; IR: índice resistivo; IP: índice de pulsatiliedad; VIAB: viabilidad (%); C3&7A, actividad de las caspasas 3 y 7 (%); ROS, contenido de ROS (%); RAP PM: motilidad progresiva rápida (%); VSL: velocidad en línea recta (μm/s); BCF: frecuencia de latido (Hz). Los mismos 25 machos fueron analizados en cada parámetro. El valor R cuadrado entre dos parámetros se representa en cada celda y gráfico. En la matriz de correlación, el color verde indica correlaciones positivas y el color rojo indica relaciones negativas. La intensidad del color representa la fuerza de la correlación entre dos parámetros. Los asteriscos muestran correlaciones significativas (P ≤ 0,05) entre las mediciones de ecografía y los parámetros de calidad del esperma.
Figura 10. Coeficientes de correlación entre las mediciones de la ecografía y los parámetros de calidad espermática en la frecuencia de recolección intensiva de semen (IF). Los parámetros de calidad del esperma utilizados se midieron el viernes (correspondiente con IRF). Densidad, densidad de áreas hipoecogénicas por cm2 correspondiente con los túbulos seminíferos; IR: índice resistivo; IP: índice de pulsatiliedad; VIAB: viabilidad (%); C3&7A, actividad de las caspasas 3 y 7 (%); ROS, contenido de ROS (%); RAP PM: motilidad progresiva rápida (%); VSL: velocidad en línea recta (μm/s); BCF: frecuencia de latido (Hz). Los mismos 25 machos fueron analizados en cada parámetro. El valor R cuadrado entre dos parámetros se representa en cada celda y gráfico. En la matriz de correlación, el color verde indica correlaciones positivas y el color rojo indica relaciones negativas. La intensidad del color representa la fuerza de la correlación entre dos parámetros. Los asteriscos muestran correlaciones significativas (P ≤ 0,05) entre las mediciones de ecografía y los parámetros de calidad del esperma.
Resultados de campo: Rendimiento de semen, calidad del esperma y ensayos de fertilidad
En cuanto al rendimiento de la eyaculación, se registró un mayor porcentaje de eyaculaciones válidas en SF (76%) en comparación con el AI (60%) (Figura 11A). En términos de rendimiento de la eyaculación, el porcentaje de números de espermatozoides válidos y las dosis fueron mayores en SF en comparación con el AI (Figura 11C). Los parámetros de motilidad registraron diferencias significativas (P ≤ 0,05) entre SF e FI en eyaculados válidos en términos de MT, PM y RAP PM, siendo menores en el FI. Por otro lado, se encontraron diferencias significativas entre eyaculados válidos y no válidos en FI con respecto a MT y PM (P ≤ 0,05; Figura 11B). Los análisis de citometría mostraron que la apoptosis fue significativamente menor en los eyaculados válidos en SF en comparación con los eyaculados válidos en IF (P ≤ 0,05). Contrariamente a esto, la actividad mitocondrial fue mayor en los eyaculados válidos en SF con respecto a los eyaculados válidos en IF (P ≤ 0,05). En cuanto a la comparación de eyaculados válidos, hubo diferencias significativas (P ≤ 0,05) en viabilidad, apoptosis y actividad mitocondrial en SF (Figura 11D).
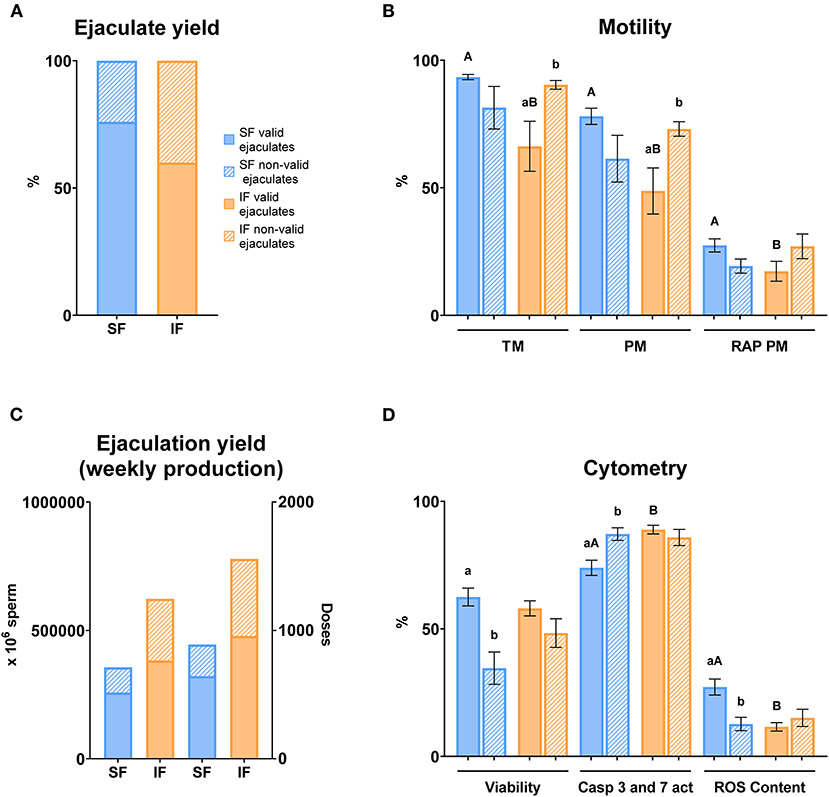 Figura 11. Rendimiento de semen y calidad de esperma en eyaculados válidos y no válidos. Criterios de eyaculación válida: volumen de eyaculación >0,5 ml, motilidad de masa >3, concentración de espermatozoides > 3.000 × 106 espermatozoides/ml. Eyaculaciones no válidas: algunos de los criterios descritos anteriormente por debajo del valor mínimo. (A) Rendimiento de eyaculado: % de eyaculados válidos y no válidos en dos frecuencias de recolección de semen (SF, frecuencia estándar de recolección de semen; SI, frecuencia de recolección intensiva de semen correspondiente a IFF; Viernes); (B) Motilidad: muestras de esperma de SF (columnas azules) e IF (columnas naranjas); TM: motilidad total (%); PM: motilidad progresiva (%); RAP PM: motilidad progresiva rápida (%); (C) Rendimiento de eyaculación (producción semanal): número de espermatozoides y dosis producidas semanalmente en dos frecuencias de recolección de semen (SF y IF); (D) Citometría: muestras de semen de SF (columnas azules) e IF (columnas naranjas); Viabilidad, violeta™ zombi (%); Actividad Caspasas 3 y 7, CellEvent™ Caspasa-3/7 Verde (%); Contenido de ROS, CellROX™ Deep Red (%). Los mismos 25 machos fueron analizados en cada grupo experimental. Diferentes letras minúsculas superíndices (a,b) indican diferencias (P ≤ 0,05) para cada punto de evaluación entre eyaculados válidos y no válidos. Diferentes letras mayúsculas minúsculas (A,B) indican diferencias (P ≤ 0,05) para cada punto de evaluación entre las frecuencias de recogida de semen.
Figura 11. Rendimiento de semen y calidad de esperma en eyaculados válidos y no válidos. Criterios de eyaculación válida: volumen de eyaculación >0,5 ml, motilidad de masa >3, concentración de espermatozoides > 3.000 × 106 espermatozoides/ml. Eyaculaciones no válidas: algunos de los criterios descritos anteriormente por debajo del valor mínimo. (A) Rendimiento de eyaculado: % de eyaculados válidos y no válidos en dos frecuencias de recolección de semen (SF, frecuencia estándar de recolección de semen; SI, frecuencia de recolección intensiva de semen correspondiente a IFF; Viernes); (B) Motilidad: muestras de esperma de SF (columnas azules) e IF (columnas naranjas); TM: motilidad total (%); PM: motilidad progresiva (%); RAP PM: motilidad progresiva rápida (%); (C) Rendimiento de eyaculación (producción semanal): número de espermatozoides y dosis producidas semanalmente en dos frecuencias de recolección de semen (SF y IF); (D) Citometría: muestras de semen de SF (columnas azules) e IF (columnas naranjas); Viabilidad, violeta™ zombi (%); Actividad Caspasas 3 y 7, CellEvent™ Caspasa-3/7 Verde (%); Contenido de ROS, CellROX™ Deep Red (%). Los mismos 25 machos fueron analizados en cada grupo experimental. Diferentes letras minúsculas superíndices (a,b) indican diferencias (P ≤ 0,05) para cada punto de evaluación entre eyaculados válidos y no válidos. Diferentes letras mayúsculas minúsculas (A,B) indican diferencias (P ≤ 0,05) para cada punto de evaluación entre las frecuencias de recogida de semen.
Se llevó a cabo un ensayo de fertilidad considerando un período de abstinencia antes de la recolección de semen para IA (Figura 12A). De acuerdo con esto, las mayores tasas de fecundidad se obtuvieron con SI de recolección de semen (P ≤ 0,05). Sin embargo, cuando los varones fueron sometidos a intervalos altos o bajos (HI y LI, respectivamente), las tasas de fecundidad disminuyeron significativamente (P ≤ 0,05), siguiendo la misma tendencia con respecto al SI y AN. Además, no hubo identificación de diferencias entre ellos. Además, la fecundidad anual fue significativamente inferior al SI (P ≤ 0,05). Con respecto al estudio descriptivo por varón, observamos la misma tendencia en la mayoría de ellos.
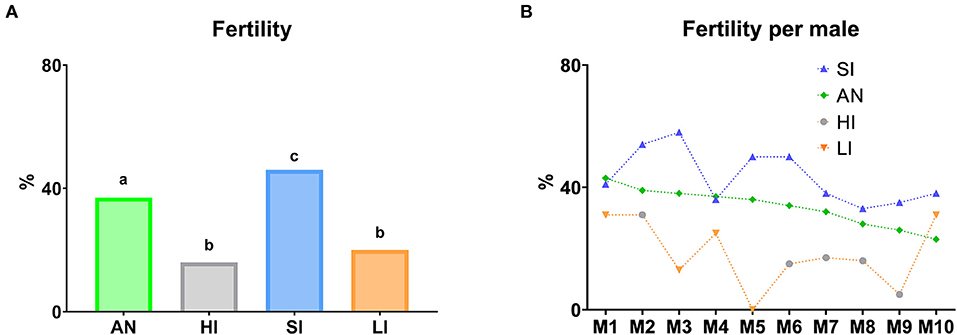 Figura 12. Fertilidad según diferentes frecuencias de recolección de semen. (A) Fertilidad por grupo según los días de abstinencia antes de la recolección de semen para AI. (B) Estudio descriptivo de la fecundidad por varón según los días de abstinencia antes de la recolección de semen para IA. AN (fertilidad anual), media anual de ovejas paridas/ovejas inseminadas (%); HI (Fertility high interval), fertilidad con dosis seminales obtenidas de varones con al menos 10 días de abstinencia; SI (intervalo estándar de fertilidad), fertilidad con dosis seminales obtenidas de varones con dos a cinco días de abstinencia; LI (Fertility low interval), fertilidad con dosis seminales obtenidas de varones con recogida de semen el día anterior. En el gráfico (A), diferentes letras minúsculas superíndices (a-c) indican diferencias (P ≤ 0,05) para cada punto de evaluación entre las proporciones de recolección de semen debido a la abstinencia días antes de la recolección de semen para la IA. En el gráfico (B), los puntos del gráfico representan machos individuales.
Figura 12. Fertilidad según diferentes frecuencias de recolección de semen. (A) Fertilidad por grupo según los días de abstinencia antes de la recolección de semen para AI. (B) Estudio descriptivo de la fecundidad por varón según los días de abstinencia antes de la recolección de semen para IA. AN (fertilidad anual), media anual de ovejas paridas/ovejas inseminadas (%); HI (Fertility high interval), fertilidad con dosis seminales obtenidas de varones con al menos 10 días de abstinencia; SI (intervalo estándar de fertilidad), fertilidad con dosis seminales obtenidas de varones con dos a cinco días de abstinencia; LI (Fertility low interval), fertilidad con dosis seminales obtenidas de varones con recogida de semen el día anterior. En el gráfico (A), diferentes letras minúsculas superíndices (a-c) indican diferencias (P ≤ 0,05) para cada punto de evaluación entre las proporciones de recolección de semen debido a la abstinencia días antes de la recolección de semen para la IA. En el gráfico (B), los puntos del gráfico representan machos individuales.
De acuerdo con esto, la mayoría de los hombres presentaron mayores tasas de fertilidad con SI de recolección de semen. Sin embargo, cuando los hombres se presentaron a intervalos altos o bajos (HI o LI, respectivamente), las tasas de fertilidad disminuyeron siguiendo la misma tendencia (Figura 12B).
Discusión
La mejora de los carneros donantes de semen en términos de calidad y rendimiento de semen en centros de reproducción es una alternativa factible para aumentar los resultados de la inseminación artificial (IA). En este contexto, la frecuencia de recolección de semen es un factor común estudiado en varias especies como carnero (38), jabalí (39), semental (40), paloma (41) o humano (42). En nuestro estudio, la producción de espermatozoides y los parámetros de calidad disminuyeron cuando aumentó la frecuencia de recolección de semen. Estas evidencias están de acuerdo con los hallazgos de otros estudios realizados en carneros (6) o humanos (43), donde también se informó que el aumento de la frecuencia de recolección de semen tuvo un impacto negativo en el recuento de espermatozoides. Nuestros hallazgos actuales fueron consistentes con los de un informe de Ollero et al. (5), donde se obtuvo aproximadamente un 27% menos de volumen de eyaculación después de 1 o 2 días de abstinencia que después de la abstinencia durante 3 días, y la concentración de espermatozoides disminuyó significativamente a medida que disminuyó el período de abstinencia. En nuestro estudio, 72 h de abstinencia sexual (fin de semana) fueron suficientes para una recuperación parcial del volumen eyaculado y la producción de espermatozoides, lo que nos permitió descartar un fenómeno de pérdida de funcionalidad testicular. Vinculado a nuestros hallazgos sobre la cantidad de espermatozoides, la motilidad de los espermatozoides, que se utiliza en la evaluación rutinaria de los espermatozoides (5), mostró una disminución significativa (P ≤ 0,05) en el FI, lo que demuestra la influencia de la frecuencia de recolección de semen en los parámetros de motilidad de los espermatozoides. Nuestros hallazgos en especies ovinas son consistentes con los reportados para carneros (6) y jabalíes (39). En cuanto a la funcionalidad de los espermatozoides, no hubo diferencias significativas (P > 0,05) en la viabilidad. En contraste, los parámetros de citometría más avanzados en la preservación de espermatozoides mostraron cambios interesantes. La actividad Caspases 3 y 7 presentó el mayor valor en IF. Estas caspasas son proteasas específicas de cisteinil aspartato que ejecutan la descomposición de proteínas estructurales y ADN (44). Por esta razón, este hallazgo se relacionó con cambios apoptóticos, que podrían comprometer la capacidad de fertilizar el ovocito (45, 46). Además, el porcentaje más bajo de contenido de ROS se encontró en IF. El contenido de ROS medido por la sonda CellROX en espermatozoides refleja principalmente una intensa actividad mitocondrial en lugar de estrés oxidativo (47-50). Por lo tanto, una alta frecuencia de recolección de semen podría reducir la actividad mitocondrial de los espermatozoides de carnero. Contrariamente a nuestros hallazgos, los parámetros de citometría en humanos no se vieron afectados significativamente después de un período de 2 semanas de eyaculación diaria, aunque también se observó una tendencia decreciente en la producción intracelular de ROS (43). Más interesante aún, después de un corto período de recuperación (3 días de abstinencia durante el fin de semana) en el modelo FI, la apoptosis y la actividad mitocondrial mejoraron significativamente. Los hallazgos actuales obtenidos en la calidad del esperma están de acuerdo con las observaciones de Ihukwumere y Okere (51) y podrían ocurrir porque los espermatozoides pueden necesitar un tiempo mínimo de almacenamiento en el epidídimo de la cauda. Varios componentes del epidídimo han colaborado en la capacidad fertilizante y la motilidad de los espermatozoides debido a cambios e interacciones bioquímicas y biofísicas (52). Por ejemplo, la clusterina, que es la proteína más abundante del líquido del epidídimo de la cauda en los carneros (53), participa en la maduración de los espermatozoides, el transporte de lípidos (54) y la remodelación de la membrana espermática; actúa como acompañante (55); y previene el daño peroxidativo (56).
Para completar la EEB se han utilizado métodos tradicionales como la libido y los exámenes clínicos (3, 7, 8) o la ecografía básica, incluido el volumen testicular (26). En nuestro estudio, se detectó un aumento del volumen testicular (P ≤ 0,05) en el FI en comparación con la FA, lo que podría explicarse por una alta demanda de producción de espermatozoides que provoca una hipertrofia testicular temporal y compensatoria (57). Otra posible explicación parcial al aumento observado del volumen testicular es el avance de la temporada de reproducción (9) ya que la duración del experimento fue de 2 meses. Como era de esperar, la testosterona sérica y la libido fueron mayores (P ≤ 0,05) en el AI en relación con los otros grupos experimentales. Esto podría estar relacionado con la temporada y el sobreesfuerzo testicular, que podría desencadenar la activación de diferentes vías del eje hipotálamo-hipófisis, provocando el aumento de testosterona. Algunos autores demostraron este efecto cuando aplicaron varios tratamientos para mejorar el rendimiento reproductivo, como la buserelina (58) o la eCG (59).
En este tipo de estudios, nuevos parámetros y estudios integradores sobre evaluación ecográfica podrían ser más predictivos y reforzar la optimización del manejo reproductivo actual del carnero para obtener una alta calidad espermática y fertilidad. En consecuencia, se realizó un test de ecotextura testicular utilizando Ecotext y una evaluación de vascularización testicular utilizando parámetros Doppler en combinación con algunos análisis de calidad espermática, incluyendo motilidad y fisiología espermática, para analizar sus posibles correlaciones. Según la literatura publicada, esta es la primera vez que un factor masculino (frecuencia de recolección de semen) se utiliza de manera integradora dentro de la EEB de carnero: desde la evaluación ultrasonográfica, como el predictor de la capacidad reproductiva del carnero, hasta la medición hasta los análisis de calidad del esperma.®
Los parámetros de ecotextura revelaron cambios en la estructura del parénquima, aumentando la ecogenicidad a medida que se intensifica la frecuencia de recolección de semen. Observamos una disminución significativa en el número de píxeles negros (EC1), área tubular y diámetro tubular con la intensificación de la recolección de semen; Todos ellos podrían estar relacionados con la luz de los túbulos seminíferos. También observamos un aumento significativo en el número de píxeles blancos (EC2) y el nivel de gris medio de píxeles (EC3); ambos podrían deberse a diferentes tipos de células lumínicas, lo que fue demostrado por Giffin et al. (25). Estos investigadores correlacionaron los atributos ecotexturales testiculares con el tipo celular predominante (la ecotextura inferior con el mayor grado de diferenciación celular) en la luz de los túbulos seminíferos en las especies ovinas. Así, nuestros hallazgos podrían explicarse por la alteración sufrida en la composición de las células lumen bajo diferentes frecuencias de recogida de semen. Además, en un estudio realizado por Camela et al. (26), los carneros peripuberales mostraron menor lumen de los túbulos seminíferos y, por lo tanto, una mayor ecotextura testicular que los carneros postpuberales. Estos hallazgos en carneros peripuberales podrían estar de acuerdo con los cambios ecotexturales cuando la intensidad de la frecuencia de recolección de semen aumentó, mostrando áreas menos hipoecogénicas relacionadas con la luz de los túbulos seminíferos. Por otro lado, la densidad de áreas hipoecogénicas por cm2 no mostró cambios entre regímenes. Esto podría deberse a que, en los machos adultos, la cantidad relativa de túbulos seminíferos permanece estable cuando los machos alcanzan la madurez sexual (60). A pesar de esto, en FA, se encontraron correlaciones negativas entre Densidad y TM y RAP PM. Esto podría sugerir que los varones con más túbulos seminíferos tienen poca motilidad de los espermatozoides en una frecuencia de recolección de semen de abstinencia. Aunque una gran cantidad de espermatozoides podría almacenarse en el epidídimo en hombres con más túbulos seminíferos, durante períodos prolongados de abstinencia, los espermatozoides están expuestos a varios factores inhibidores de la motilidad de los espermatozoides [pH ácido y una alta proporción de potasio a sodio en el líquido epididimario (61, 62)], lo que puede afectar negativamente su motilidad futura después de la eyaculación (63).
Tras la evaluación integral de la capacidad reproductiva de los carneros basada en la evaluación ecográfica, se describió el modo Pulse-Doppler como un indicador de funcionalidad testicular en condiciones estándar en carnero (9, 10), perro (14), semental (32) o humano (64). Sin embargo, los parámetros Doppler no se habían investigado en diferentes frecuencias de recolección de semen correlacionando estos análisis con los ensayos de calidad del esperma. En primer lugar, PSV e IP aumentaron significativamente (P ≤ 0,05), y RI y TABF no variaron significativamente (P > 0,05) en SF en comparación con FA. Esto podría explicarse debido a que la PSV y la IP pueden ser predictores tempranos de cambios en la perfusión sanguínea testicular, como describieron Jolly et al. (65). Además, la IR se altera cuando se producen trastornos más graves (64). Los perros infértiles tenían un PSV más bajo que los perros fértiles sin RI variable porque la resistencia del lecho vascular depende de múltiples factores como el diámetro y la tortuosidad de los vasos (66). Aunque no se ha descrito previamente, observamos correlaciones positivas entre algunos parámetros de ultrasonografía (área, diámetro, IR y PI) y la motilidad de los espermatozoides (PM, RAP PM, VSL y BCF). En este sentido, otros parámetros de calidad del esperma, como los espermatozoides vivos y la concentración de espermatozoides, se correlacionaron positivamente con algunos antioxidantes plasmáticos seminales como SOD, GPx y GSH (67). Además, Hedia et al. (67) confirmaron correlaciones positivas entre los antioxidantes plasmáticos seminales presentados en muestras de espermatozoides de alta calidad y los índices Doppler, conectando con nuestras correlaciones positivas en SF. Por otro lado, todos los índices (RI, PI y TABF) aumentaron significativamente en FI con respecto a SF. Este hallazgo podría indicar un aumento en la resistencia al flujo sanguíneo, pulsatilidad en las oscilaciones de la forma de onda y flujo sanguíneo por minuto como consecuencia del estrés testicular por la frecuencia de recolección intensiva de semen. La baja tensión de oxígeno en los túbulos seminíferos es esencial para la espermatogénesis (68); por lo tanto, los espermatozoides de mala calidad en el AI podrían justificarse por un aumento del flujo sanguíneo con una mayor tensión de oxígeno. Recientemente, Ntemka et al. (29) correlacionaron negativamente los índices Doppler (IR y PI) con anomalías espermáticas. En nuestro trabajo, encontramos, por primera vez, que estos índices Doppler se correlacionaban negativamente con la funcionalidad de los parámetros de espermatozoides medidos por citometría de flujo en consonancia con Hedia et al. (9) y Ntemka et al. (29). Sin embargo, para encontrar estas correlaciones, planteamos la hipótesis de que es necesario ejercer demasiado el testículo. Un estudio reciente realizado por Brito et al. (69) que comparó perros jóvenes y seniles reveló una menor calidad de esperma en perros seniles y no detectó diferencias significativas en la evaluación ultrasonográfica en modo B (70). En este sentido, las características vasculares de los testículos pueden representar los factores causales que subyacen a los cambios en la espermatogénesis y, como consecuencia, afectan negativamente a la calidad espermática de los carneros donantes en una frecuencia intensiva de recolección de semen. Con base en nuestros resultados, los estudios sofisticados de ecotextura testicular y evaluación vascular medidos por software específico y modo Doppler, respectivamente, son cruciales en la evaluación de la ecografía reproductiva de los hombres.
IEn la segunda parte del documento, llevamos a cabo una prueba de campo para demostrar la importancia de las frecuencias de recolección de semen en el éxito de la IA. Se ha demostrado que la fertilidad se ve afectada por muchos factores (intrínsecos y extrínsecos) relacionados con la hembra, como la edad de la oveja, el intervalo parto-IA o el número acumulado de indoveja/oveja; la granja, como las condiciones ambientales, el estado sanitario o la manipulación reproductiva; la técnica en sí; y el varón, como la estacionalidad, la calidad del esperma o la conservación del esperma (71-73). Dentro de los factores masculinos, la frecuencia de recolección de semen no se ha relacionado previamente con las tasas de fertilidad. Aunque los eyaculados se consideraron válidos según los criterios de los centros de reproducción (33), cuando realizamos análisis más avanzados como la motilidad y funcionalidad de los espermatozoides, detectamos diferencias significativas en varios parámetros (TM, PM, RAP PM, actividad de Caspasas 3 y 7 y contenido de ROS) y, por lo tanto, pensamos que la fertilidad podría verse alterada. En nuestros resultados de campo, el intervalo estándar de abstinencia sexual, de 2 a 5 días, representó las tasas de fertilidad más altas. Además, en un ensayo descriptivo, pudimos observar la misma tendencia en las tasas de fertilidad en la mayoría de los varones evaluados comparando diferentes días de abstinencia antes de la recolección de semen para la IA. Como mencionamos anteriormente, este hecho podría deberse a la influencia del tiempo de almacenamiento en el epidídimo de la cauda (53). Este trabajo allana el camino para saber cuál sería la frecuencia óptima de recolección de semen para cada carnero. Sería muy beneficioso agrupar a los machos en diferentes frecuencias de recolección de semen para obtener el máximo rendimiento reproductivo de cada carnero y aumentar su fertilidad. Para lograr esto, se debe incluir una evaluación ultrasonográfica compleja en la EEB del carnero para predecir la capacidad reproductiva del carnero individual y optimizar el manejo reproductivo de los machos.
Declaración de disponibilidad de datos
Los datos brutos que apoyan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Contribuciones del autor
RM-G: conceptualización, metodología, análisis formal, investigación, escritura: borrador original, curación de datos y visualización. MR: conceptualización, metodología, análisis formal, investigación, supervisión, curación de datos, redacción, revisión y edición, y visualización. LA-L y MA: conceptualización, metodología, investigación, recursos, curación de datos, redacción, revisión y edición, visualización y adquisición de fondos. MN-M, CP-M, CO-F y MH: conceptualización, metodología e investigación. PP: análisis formal, investigación, recursos, curación de datos, redacción: revisión y edición, visualización, supervisión y adquisición de fondos. LA: conceptualización, recursos, curación de datos, redacción: revisión y edición, visualización, supervisión, administración de proyectos y adquisición de fondos. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este trabajo ha sido apoyado en parte por el Ministerio de Ciencia e Innovación (PID2021-122470OB-I00), el MINECO (AGL2017-83098-R) y la Junta de Castilla y León (LE253P18). RM-G contó con el apoyo de la Junta de Castilla y León (a través de la Consejería de Educación y FSE PO 1420 – CyL, beca ORDEN EDU/556/2019), MN-M contó con el apoyo de MEC (beca FPU17/04142), y CP-M contó con el apoyo del MINECO (PRE2018-086400).
Reconocimientos
Los autores agradecen a Ainoa Jordán Esteban, Cecilia Pérez Caso y Pedro de Vega Álvarez por su ayuda en la adquisición y análisis de las muestras, y a ASSAF. E, y el personal de Ovigén y CENSYRA de León.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Pardos L, Maza MT, Fantova E, Sepúlveda W. La diversidad de los sistemas de producción ovina en Aragón (España): caracterización y tipificación de explotaciones ovinas cárnicas. Español J Agric Res. (2008) 6:497–507. doi: 10.5424/SJAR/2008064-344
2. Mozo R, Galeote AI, Alabart JL, Fantova E, Folch J. Evaluación de la capacidad reproductiva de los carneros reproductores en el noreste de España mediante el examen clínico del cuerpo y los genitales externos. BMC Vet Res. (2015) 11:1–11. DOI: 10.1186/S12917-015-0600-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. MacLaren APC. Fertilidad de carnero en el suroeste de Escocia. H. Veterinario J. (1988) 144:45–54. DOI: 10.1016/0007-1935(88)90151-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Kimberling CV, Parsons GA. Evaluación de la solidez de la cría y esterilización quirúrgica del carnero. En:Youngquist RS, Threlfall, WR, , editores. Current Therapy in Large Animal Theriogenology, 2nd ed. Amsterdam: Elsevier Inc. (2006). págs. 620–8. doi: 10.1016/B978-072169323-1.50088-X
5. Ollero M, Muiño-Blanco T, López-Pérez MJ, Cebrián-Pérez JA. Viabilidad de los espermatozoides de carnero en relación con el período de abstinencia y las eyaculaciones sucesivas. Int J Androl. (1996) 19:287–92. doi: 10.1111/j.1365-2605.1996.tb00477.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Kaya A, Aksoy M, Tekeli T. Influencia de la frecuencia de la eyaculación en las características de los espermatozoides, composición iónica y actividad enzimática del plasma seminal en carneros. Pequeño Rumin Res. (2002) 44:153–8. doi: 10.1016/S0921-4488(02)00051-2
7. Tulley D, Burfening PJ. Libido y circunferencia escrotal de los carneros afectados por la estación del año y fotoperiodo alterado. Teriogenología. (1983) 20:435–48. doi: 10.1016/0093-691X(83)90203-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Fthenakis GC, Karagiannidis A, Alexopoulos C, Brozos C, Saratsis P, Kyriakis S. Clinical and epidemiological findings during ram examination in 47 flocks in southern Greece. Prev Vet Med. (2001) 52:43–52. doi: 10.1016/S0167-5877(01)00238-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Hedia MG, El-Belely MS, Ismail ST, Abo El-Maaty AM. Cambios mensuales en la dinámica del flujo sanguíneo testicular y su asociación con el volumen testicular, el perfil de hormonas esteroides plasmáticas y las características del semen en carneros. Teriogenología. (2019) 123:68–73. doi: 10.1016/j.theriogenology.2018.09.032
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Batissaco L, Celeghini ECC, Pinaffi FLV, de Oliveira BMM, de Andrade AFC, Recalde ECS, et al. Correlaciones entre la hemodinámica testicular y las características de los espermatozoides en carneros. Brazilian J Vet Res Anim Sci. (2014) 50:384. doi: 10.11606/issn.2318-3659.v50i5p384-395
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Ortega-Ferrusola C, Gracia-Calvo L, Ezquerra J, Pena F. Use of colour and spectral Doppler ultrasonography in stallion andrology. Reprod Domest Anim. (2014) 49:88–96. DOI: 10.1111/RDA.12363
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Gouletsou PG. Examen ultrasonográfico del contenido escrotal en carneros. Pequeño Rumin Res. (2017) 152:100–6. doi: 10.1016/j.smallrumres.2016.12.022
13. Pozor MA, Nolin M, Roser J, Runyon S, Macpherson ML, Kelleman A. Índices Doppler de impedancia vascular como indicadores de disfunción testicular en sementales. J Equine Vet Sci. (2014) 34:38–9. doi: 10.1016/j.jevs.2013.10.021
14. Zelli R, Troisi A, Elad Ngonput A, Cardinali L, Polisca A. Evaluación del flujo sanguíneo de la arteria testicular por ecografía Doppler como predictor de espermatogénesis en el perro. Res Vet Sci. (2013) 95:632–7. doi: 10.1016/j.rvsc.2013.04.023
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Brito LF, Silva AED, Barbosa RT, Kastelic JP. Termorregulación testicular en toros Bos indicus, cruzados y Bos taurus: relación con la morfología escrotal, cono vascular testicular y testicular, y efectos sobre la calidad del semen y la producción de esperma. Teriogenología. (2004) 61:511–28. doi: 10.1016/S0093-691X(03)00231-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Abecia JA, Carvajal-Serna M, Casao A, Palacios C, Pulinas L, Keller M, et al. La presencia continua de ovejas en celo en primavera influye en el volumen testicular, la ecogenicidad testicular y la concentración de testosterona, pero no en la pulsatilidad de LH en carneros. Animal. (2020) 14:2554–61. doi: 10.1017/S1751731120001330
17. Giffin JL, Franks SE, Rodriguez-Sosa JR, Hahnel A, Bartlewski PM, A. study of morphological and haemodynamic determinants of testicular echotexture characteristics in the ram. Exp Biol Med. (2009) 234:794–801. doi: 10.3181/0812-RM-364
18. Brito LFC, Silva AEDF, Barbosa RT, Unanian MM, Kastelic JP. Effects of scrotal insulation on sperm production, semen quality, and testicular echotexture in Bos indicus and Bos indicus x Bos taurus bulls. Anim Reprod Sci. (2003) 79:1–15. doi: 10.1016/S0378-4320(03)00082-4
19. Pozor MA, McDonnell SM. Color Doppler ultrasound evaluation of testicular blood flow in stallions. Theriogenology. (2004) 61:799–810. doi: 10.1016/S0093-691X(03)00227-9
20. Bumin A, Kaya M, Kaya Ü, Kibar M, Alkan Z. Gray-scale, colour and power Doppler sonography of scrotal disorders in dogs. Revue Méd Vét. (2007) 158:128–33.
21. Kutzler M, Tyson R, Grimes M, Timm K. Determination of testicular blood flow in camelids using vascular casting and color pulsed-wave Doppler ultrasonography. Vet Med Int. (2011) 2011:1–7. doi: 10.4061/2011/638602
22. Gouletsou PG, Fthenakis GC. Clinical evaluation of reproductive ability of rams. Small Rumin Res. (2010) 92:45–51. doi: 10.1016/j.smallrumres.2010.04.005
23. Gouletsou PG, Amiridis GS, Cripps PJ, Lainas T, Deligiannis K, Saratsis P, et al. Ultrasonographic appearance of clinically healthy testicles and epididymides of rams. Theriogenology. (2003) 59:1959–72. doi: 10.1016/S0093-691X(02)01259-1
24. Andrade AKG, Soares AT, Freitas FF, Silva S V, Peña-Alfaro CE, Batista AM, et al. Testicular and epididymal ultrasonography in Santa Inês lambs raised in Brazil. Anim Reprod. (2014) 11:110–8.
25. Giffin JL, Bartlewski PM, Hahnel AC. Correlations among ultrasonographic and microscopic characteristics of prepubescent ram lamb testes. Exp Biol Med. (2014) 239:1606–18. doi: 10.1177/1535370214543063
26. Camela ESC, Nociti RP, Santos VJC, Macente BI, Murawski M, Vicente WRR, et al. Changes in testicular size, echotexture, and arterial blood flow associated with the attainment of puberty in Dorper rams raised in a subtropical climate. Reprod Domest Anim. (2019) 54:131–7. doi: 10.1111/rda.13213
27. Bartlewski PM, Giffin JL, Oluwole OA, Hahnel AC. Prospective ultrasonographic and endocrine predictors of spermatogenic onset in ram lambs. Anim Reprod Sci. (2017) 179:44–8. doi: 10.1016/j.anireprosci.2017.01.015
28. Chandolia RK, Bartlewski PM, Omeke BC, Beard AP, Rawlings NC, Pierson RA. Ultrasonography of the developing reproductive tract in ram lambs: effects of a GnRH agonist. Theriogenology. (1997) 48:99–117. doi: 10.1016/S0093-691X(97)00194-5
29. Ntemka A, Kiossis E, Boscos C, Theodoridis A, Kourousekos G, Tsakmakidis I. Effects of testicular hemodynamic and echogenicity changes on ram semen characteristics. Reprod Domest Anim. (2018) 53:50–5. doi: 10.1111/rda.13279
30. Samir H, Radwan F, Watanabe G. Advances in applications of color Doppler ultrasonography in the andrological assessment of domestic animals: a review. Theriogenology. (2021) 161:252–61. doi: 10.1016/j.theriogenology.2020.12.002
31. Biagiotti G, Cavallini G, Modenini F, Vitali G, Gianaroli L. Spermatogenesis and spectral echo-colour Doppler traces from the main testicular artery. BJU Int. (2002) 90:903–8. doi: 10.1046/j.1464-410X.2002.03033.x
32. Ortiz-Rodriguez JM, Anel-Lopez L, Martin-Munõz P, Lvarez M, Gaitskell-Phillips G, Anel L, et al. Pulse Doppler ultrasound as a tool for the diagnosis of chronic testicular dysfunction in stallions. PLoS ONE. (2017) 12:e0175878. doi: 10.1371/journal.pone.0175878
33. Neila-Montero M, Riesco MF, Montes-Garrido R, Palacin-Martinez C, Chamorro C, de Paz P, et al. An optimized centrifugation protocol for ram sperm ensuring high sample yield, quality and fertility. Theriogenology. (2022) 191:179–91. doi: 10.1016/j.theriogenology.2022.08.006
34. Hassan MAA, Sayed RKA, Abdelsabour-Khalaf M, Abd-Elhafez EA, Anel-Lopez L, Riesco MF, et al. Morphological and ultrasonographic characterization of the three zones of supratesticular region of testicular artery in Assaf rams. Sci Rep. (2022) 12:1–12. doi: 10.1038/s41598-022-12243-z
35. Samir H, Sasaki K, Ahmed E, Karen A, Nagaoka K, El Sayed M, et al. Effect of a single injection of gonadotropin-releasing hormone (GnRH) and human chorionic gonadotropin (hCG) on testicular blood flow measured by color doppler ultrasonography in male Shiba goats. J Vet Med Sci. (2015) 77:549–56. doi: 10.1292/jvms.14-0633
36. Palacin-Martinez C, Alvarez M, Montes-Garrido R, Neila-Montero M, Anel-Lopez L, de Paz P, et al. Frequency of semen collection affects ram sperm cryoresistance. Animals. (2022) 12:1492. doi: 10.3390/ani12121492
37. Riesco MF, Anel-Lopez L, Neila-Montero M, Palacin-Martinez C, Montes-Garrido R, Alvarez M, et al. ProAKAP4 as novel molecular marker of sperm quality in ram: an integrative study in fresh, cooled and cryopreserved sperm. Biomolecules. (2020) 10:1046. doi: 10.3390/biom10071046
38. Aguirre V, Orihuela A, Vázquez R. Effect of semen collection frequency on seasonal variation in sexual behaviour, testosterone, testicular size and semen characteristics of tropical hair rams (Ovis aries). Trop Anim Health Prod. (2007) 39:271–7. doi: 10.1007/s11250-007-9010-8
39. Frangeî R, Gider T, Kosec M, FrangeŽ R, Gider T, Kosec M. Frequency of boar ejaculate collection and its influence on semen quality, pregnancy rate and litter size. Acta Vet Brno. (2005) 74:265–73. doi: 10.2754/avb200574020265
40. Gamboa S, Francisco M, Gomes P, Mendes C, Machado-Faria M, Ramalho-Santos J. Level of glycolyzable substrates in stallion semen: effect of ejaculation frequency on sperm survival after cool storage during the nonbreeding season. J Equine Vet Sci. (2011) 31:109–15. doi: 10.1016/j.jevs.2010.12.011
41. Klimowicz M, Łukaszewicz E, Dubiel A. Effect of collection frequency on quantitative and qualitative characteristics of pigeon (Columba livia) semen. Br Poult Sci. (2005) 46:361–5. doi: 10.1080/00071660500098210
42. AlAwlaqi A, Hammadeh ME. Sexual abstinence and sperm quality. Int J Women’s Heal Reprod Sci. (2017) 5:11–7. doi: 10.15296/ijwhr.2017.03
43. Mayorga-Torres BJM, Camargo M, Agarwal A, du Plessis SS, Cadavid ÁP, Cardona Maya WD. Influence of ejaculation frequency on seminal parameters. Reprod Biol Endocrinol. (2015) 13:1–7. doi: 10.1186/s12958-015-0045-9
44. Martí E, Pérez-Pé R, Muiño-Blanco T, Cebrián-Pérez JA. Comparative study of four different sperm washing methods using apoptotic markers in ram spermatozoa. J Androl. (2006) 27:746–53. doi: 10.2164/jandrol.106.000109
45. Said T, Agarwal A, Grunewald S, Rasch M, Baumann T, Kriegel C, et al. Selection of nonapoptotic spermatozoa as a new tool for enhancing assisted reproduction outcomes: an in vitro model. Biol Reprod. (2006) 74:530–7. doi: 10.1095/biolreprod.105.046607
46. Dogan S, Mason MC, Govindaraju A, Belser L, Kaya A, Stokes J, et al. Interrelationships between apoptosis and fertility in bull sperm. J Reprod Dev. (2013) 59:18–26. doi: 10.1262/jrd.2012-068
47. Plaza Davila M, Martin Muñoz P, Tapia JA, Ortega Ferrusola C, Balao da Silva CC, Peña FJ, et al. Inhibition of mitochondrial complex I leads to decreased motility and membrane integrity related to increased hydrogen peroxide and reduced ATP production, while the inhibition of glycolysis has less impact on sperm motility. PLoS ONE. (2015) 10:e0138777. doi: 10.1371/journal.pone.0138777
48. Riesco MF, Alvarez M, Anel-Lopez L, Neila-Montero M, Palacin-Martinez C, Montes-Garrido R, et al. Estudio multiparamétrico del efecto antioxidante en la criopreservación de espermatozoides de carnero, desde ensayos de campo hasta banco de investigación. Animales. (2021) 11:283. DOI: 10.3390/ANI11020283
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Anel-Lopez L, Riesco MF, Montes-Garrido R, Neila-Montero M, Boixo JC, Chamorro C, et al. Comparando el efecto de diferentes antibióticos en espermatozoides de carnero congelados-descongelados: ¿es posible evitar su adición? Front Vet Sci. (2021) 8:656937. DOI: 10.3389/fvets.2021.656937
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Martin Muñoz P, Ortega-Ferrusola C, Anel-Lopez L, del Petre C, Alvarez M, de Paz P, et al. La actividad de la caspasa 3 y el estado lipoperoxidativo en el semen crudo predicen el resultado de la criopreservación de los espermatozoides de sementales. Biol Reprod. (2016) 95:53. doi: 10.1095/biolreprod.116.139444
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Ihukwumere FC, Okere C. Efectos de las eyaculaciones frecuentes en las características del semen de los carneros Yankasa nigerianos. Pequeño Rumin Res. (1990) 3:77–83. doi: 10.1016/0921-4488(90)90034-4
52. Dacheux J-L, Gatti JL, Dacheux F. Contribución de proteínas secretoras del epidídimo para la maduración de los espermatozoides. Microsc Res Tech. (2003) 61:7–17. DOI: 10.1002/jemt.10312
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. van Tilburg M, Sousa S, Lobo MDP, Monteiro-Azevedo ACOM, Azevedo RA, Araújo AA, et al. Mapeo del proteoma principal de los fluidos reproductivos y las membranas espermáticas de los carneros: desde el epidídimo de la cauda hasta la eyaculación. Teriogenología. (2021) 159:98–107. doi: 10.1016/j.theriogenology.2020.10.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Tenniswood MP, Guenette RS, Lakins J, Mooibroek M, Wong P, Welsh JE. Muerte celular activa en tejidos dependientes de hormonas. (1992) 11:197–220. doi: 10.1007/BF00048064
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Humphreys DT, Carver JA, Easterbrook-Smith SB, Wilson MR. La clusterina tiene una actividad similar a la de la chaperona similar a la de las pequeñas proteínas de choque térmico. J Biol Chem. (1999) 274:6875–81. DOI: 10.1074/JBC.274.11.6875
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Reyes-Moreno C, Boilard M, Sullivan R, Sirard M-A. Caracterización e identificación de los factores epidídicos que protegen los espermatozoides eyaculados de bovino durante el almacenamiento in vitro. Biol Reprod. (2002) 66:159–66. doi: 10.1095/biolreprod66.1.159
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Gaudino R, Cavarzere P, Camilot M, Teofoli F, Zampieri N, Tatò L. Prepubertal serum inhibin B in cryptorchid infants and in monorchid boys with compensatory testicular hypertrophy. Esterilidad fertilizante. (2008) 90:2217–21. doi: 10.1016/j.fertnstert.2007.10.017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. El-Shalofy AS, Hedia MG. Effects of buserelin administration on testicular blood flow and plasma concentration of testosterone and estradiol-17( in rams. Domest Anim Endocrinol. (2021) 77:106646. doi: 10.1016/j.domaniend.2021.106646
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Beracochea F, Manes J, Viera MN, Santiago-Moreno J, Ungerfeld R. Administración de gonadotropina corionónica equina (eCG) a carneros para mejorar el rendimiento reproductivo durante la temporada no reproductiva. Livest Sci. (2020) 240:104125. doi: 10.1016/j.livsci.2020.104125
60. Steger K, Wrobel KH. Desarrollo postnatal de túbulos seminíferos ovinos: un estudio microscópico y morfométrico electrónico. Ana Anat. (1996) 178:201–13. doi: 10.1016/S0940-9602(96)80048-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
61. Iwamoto T, Gagnon C. Una proteína plasmática seminal humana bloquea la motilidad de los espermatozoides humanos. J Urol. 1988;140(5 PARTE I):1045–8. doi: 10.1016/S0022-5347(17)41923-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Skandhan KP. Hipótesis: el epidídimo inhibe la motilidad de los espermatozoides dentro del tracto reproductor masculino. Hipótesis Med. (2004) 62:146–50. doi: 10.1016/S0306-9877(03)00238-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Ayad BM, Van der Horst G, du Plessis SS. Short abstinence: a potential strategy for the improvement of sperm quality. Oriente Medio Fertil Soc J. (2018) 23:37–43. doi: 10.1016/j.mefs.2017.07.005
64. Pinggera G-M, Mitterberger M, Bartsch G, Strasser H, Gradl J, Aigner F, et al. Evaluación del índice resistivo intratesticular mediante mediciones de ecografía Doppler color como predictor de espermatogénesis. BJU Int. (2008) 101:722–6. doi: 10.1111/j.1464-410X.2007.07343.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
65. Jolly TAD, Bateman GA, Levi CR, Parsons MW, Michie PT, Karayanidis F. Detección precoz de cambios microestructurales en la sustancia blanca asociados a la pulsatilidad arterial. Frontal Hum Neurosci. (2013) 7:782. doi: 10.3389/fnhum.2013.00782
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. de Souza MB, England GCW, Mota Filho AC, Ackermann CL, Sousa CVS, de Carvalho GG, et al. Calidad del semen, ultrasonido testicular en modo B y Doppler, y concentraciones séricas de testosterona en perros con infertilidad establecida. Teriogenología. (2015) 84:805–10. doi: 10.1016/j.theriogenology.2015.05.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Hedia MG, El-Belely MS, Ismail ST, El-Maaty AMA. Variación estacional en la dinámica del flujo sanguíneo testicular y su relación con biomarcadores oxidantes/antioxidantes sistémicos y testiculares y andrógenos en carneros. Reprod Domest Anim. (2020) 55:861–9. DOI: 10.1111/RDA.13696
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Bergh A, Damber J-E. Controles vasculares en fisiología testicular. En:de Kretse D, , editor. Biología molecular del sistema reproductor masculino. Ámsterdam: Elsevier (1993). págs. 439–68. doi: 10.1016/B978-0-08-091764-1.50017-9
69. Brito MM, da Rosa Filho RR, Losano JDA, Vannucchi CI. El envejecimiento cambia el flujo sanguíneo de los testículos y el epidídimo sin alterar la biometría y la ecodensidad en perros. Anim Reprod Sci. (2021) 228:106745. doi: 10.1016/j.anireprosci.2021.106745
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Brito MM, Angrimani DSR, Rui BR, Kawai GKV, Losano JDA, Vannucchi CI. Efecto de la senescencia sobre las características morfológicas, funcionales y oxidativas de espermatozoides caninos frescos y criopreservados. Envejecimiento masculino. (2020) 23:279–86. doi: 10.1080/13685538.2018.1487931
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Anel L, Kaabi M, Abroug B, Alvarez M, Anel E, Boixo JC, et al. Factores que influyen en el éxito de la inseminación artificial vaginal y laparoscópica en ovejas churra: un ensayo de campo. Teriogenología. (2005) 63:1235–47. doi: 10.1016/j.theriogenology.2004.07.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. Anel L, Alvarez M, Martinez-Pastor F, Garcia-Macias V, Anel E, De Paz P. Improvement strategies in ovine artificial insemination. Reprod Domest Anim. (2006) 41:30–42. doi: 10.1111/j.1439-0531.2006.00767.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
73. Alvarez M, Anel-Lopez L, Boixo JC, Chamorro C, Neila-Montero M, Montes-Garrido R, et al. Desafíos actuales en la inseminación artificial ovina: una visión particular. Reprod Domest Anim. (2019) 54(Suplemento 4):32–40. DOI: 10.1111/RDA.13523
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: Doppler, fertilidad, ovino, frecuencia de recolección de semen, calidad del esperma, ecografía
Cita: Montes-Garrido R, Riesco MF, Anel-Lopez L, Neila-Montero M, Palacin-Martinez C, Boixo JC, de Paz P, Ortega-Ferrusola C, Hassan MAA, Anel L y Alvarez M (2022) Aplicación de la técnica de ultrasonido para evaluar la función testicular y su correlación con la calidad del esperma después de diferentes frecuencias de recolección en carneros. Frente. Vet. Sci. 9:1035036. doi: 10.3389/fvets.2022.1035036
Recibido: 02 Septiembre 2022; Aprobado: 11 de noviembre de 2022;
Publicado: 25 de noviembre de 2022.
Editado por:
Federica Turri, Instituto de Biología Agrícola y Biotecnología (CNR), Italia
Revisado por:
Jordi Miró, Universitat Autónoma de Barcelona, España
Hassan Hussein, Universidad de Assiut, Egipto
Copyright © 2022 Montes-Garrido, Riesco, Anel-Lopez, Neila-Montero, Palacin-Martinez, Boixo, de Paz, Ortega-Ferrusola, Hassan, Anel y Alvarez. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Luis Anel-Lopez, lanel@unileon.es
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

