Tomografía de impedancia eléctrica en pollos anestesiados (Gallus domesticus)
Tomografía de impedancia eléctrica en pollos anestesiados (Gallus domesticus)
 Adrián M. Wong1
Adrián M. Wong1  Hei Y. Lum1
Hei Y. Lum1  Gabrielle C. Musk1,2
Gabrielle C. Musk1,2  Timothy H. Hyndman1
Timothy H. Hyndman1  Andreas D. Waldmann3
Andreas D. Waldmann3  Deborah J. Monjes4
Deborah J. Monjes4  Ross S. Bowden1
Ross S. Bowden1  Martina Mosing1,5*
Martina Mosing1,5*- 1Facultad de Medicina Veterinaria, Universidad Murdoch, Perth, WA, Australia
- 2Servicios de Cuidado de Animales, Universidad de Australia Occidental, Perth, WA, Australia
- 3Departamento de Anestesiología y Medicina Intensiva, Centro Médico de la Universidad de Rostock, Rostock, Alemania
- 4Servicio Veterinario de Aves y Exóticos de Brisbane, Brisbane, QLD, Australia
- 5Anestesiología y Cuidados Intensivos Perioperatorios, Universidad de Medicina Veterinaria, Viena, Austria
Se desconoce la aplicabilidad de la tomografía de impedancia eléctrica (EIT) en aves. El objetivo de este estudio fue evaluar el uso de EIT en pollos anestesiados en decúbito recuino. Cuatro pollos Hyline adultos fueron anestesiados con isoflurano en oxígeno e intubados endotraquealmente para tomografía computarizada (TC). Se colocó un cinturón de goma alrededor del celoma caudal hasta la articulación del hombro. Se construyó un modelo de elementos finitos (FE) específico para pollos, que es esencial para generar imágenes de EIT funcionales anatómicamente precisas para su análisis, basado en las imágenes de TC obtenidas a nivel de cinturón. Otros diez pollos fueron anestesiados con el mismo protocolo. Se colocó una cinta de electrodos EIT en el mismo lugar. Los pollos respiraban espontáneamente y se colocaban en decúbito dorsal, ventral, lateral derecho e izquierdo en un orden aleatorio. Para cada decúbito, se recogieron datos brutos del EIT durante 2 minutos después de 13 minutos de estabilización. Los datos se reconstruyeron en imágenes funcionales del EIT. Variables de EIT que incluyen la variación de la impedancia tidal (TIV), el centro de ventilación de derecha a izquierda (CoVRL) y de ventral a dorsal (CoV)VD), se analizó la relación derecha-izquierda (RL), el cambio de impedancia (ΔZ) y ocho cambios de impedancia regional que incluyen las regiones dorsal, central-dorsal, centro-ventral y ventral de las regiones derecha e izquierda. Se observaron cuatro patrones respiratorios (BrP) y se categorizaron en función de la curva espiratoria. Se utilizó un modelo lineal mixto para comparar las variables de la EIT entre las cunetas. Se utilizó la prueba exacta de Fisher para comparar las frecuencias de los patrones de respiración para cada decúbito. La ΔZ observada fue sincrónica con la ventilación y representó el volumen corriente de los sacos de aire craneal confirmado por TC. Se encontraron diferencias significativas en el CoVVD y los cambios de impedancia regional entre las decúbilas dorsal y ventral (P < 0,05), y en CoVRL, la relación RL y los cambios de impedancia regional entre las decúbito derecho e izquierdo (P < 0,05), lo que sugiere una tendencia a que la distribución de la ventilación se desplace hacia sacos de aire no dependientes. No se encontraron diferencias para la TIV y la frecuencia respiratoria entre los cucúbitos. La decúbito tuvo un efecto significativo en las frecuencias de cada uno de los cuatro BrP (P = 0,001). La EIT puede monitorizar la magnitud y la distribución de la ventilación de los sacos de aire craneal en diferentes decúbidos en pollos anestesiados.
1 Introducción
La anestesia general es un aspecto esencial de la medicina aviar y se utiliza de forma rutinaria con fines diagnósticos debido a su naturaleza no distensiva, y para procedimientos quirúrgicos para producir inconsciencia, relajación muscular y analgesia para mantener el bienestar del paciente frente a las estimulaciones nociceptivas (1). Sin embargo, la anestesia general se asocia con tasas de mortalidad más altas (2, 3) que las reportadas en perros, gatos, conejos y caballos (4, 5).
La depresión del sistema respiratorio durante la anestesia general de las aves se ha propuesto como un factor de riesgo de morbimortalidad relacionada con la anestesia, ya que tienen altos requerimientos metabólicos que requieren un intercambio gaseoso eficiente (6). Las alteraciones de la gasometría sanguínea como la hipercapnia y la hipoxemia pueden provocar alteraciones ácido-base e hipoxia tisular, respectivamente. Por lo tanto, la monitorización perianestésica del sistema respiratorio es crucial para permitir el reconocimiento de las complicaciones y las intervenciones oportunas para minimizar la morbimortalidad de los pacientes (7). En los mamíferos, la monitorización del sistema respiratorio durante la anestesia suele lograrse con el uso de capnografía, oximetría de pulso, gasometría y, ocasionalmente, espirometría. Sin embargo, se ha demostrado que la precisión de la capnografía es variable en las aves (8), los oxímetros de pulso no están calibrados para las aves (1) y la espirometría rara vez se utiliza en un entorno clínico. Se carece de técnicas para evaluar con precisión el sistema respiratorio aviar.
La tomografía por impedancia eléctrica (EIT) es una modalidad de imagen no invasiva en tiempo real que ha ganado un interés considerable en la medicina veterinaria para la monitorización respiratoria durante la última década (9). Se coloca un cinturón con 16 a 32 electrodos equidistantes alrededor del tórax y se aplica una corriente alterna (CA) no perceptible al cuerpo a través de pares de electrodos con el voltaje medido por el resto. Como el aire y los tejidos tienen una conductividad diferente, la impedancia del tórax cambia a lo largo del ciclo respiratorio. Las señales obtenidas por EIT se denominan cambio de impedancia (ΔZ) y se miden en unidades arbitrarias (AU).
Los datos de EIT obtenidos por las mediciones de voltaje límite se pueden reconstruir en imágenes funcionales, utilizando un modelo de elementos finitos (FE) específico de la especie (10, 11). Un modelo de FE se construye a partir de una imagen transversal del tórax nivelada en la posición propuesta del cinturón, normalmente mediante tomografía computarizada (TC). Dentro de la imagen tomográfica, los contornos de órganos específicos, como los pulmones y la silueta cardíaca, se pueden segmentar digitalmente como regiones de interés (ROI). Los contornos de estos ROI se utilizan para generar el modelo de elementos finitos. Al mapear la anatomía torácica precisa de las especies de interés, se pueden generar imágenes anatómicamente precisas de EIT (12). Con estas imágenes funcionales de EIT, la distribución de la ventilación dentro de los pulmones se puede cuantificar en tiempo real de respiración a respiración (13-16); una característica distinta a otras tecnologías de monitorización respiratoria. Además, la EIT puede estimar el volumen corriente en función de su relación lineal con ΔZ (17-20), también denominada variación de la impedancia tidal (TIV) (21). Para obtener más información sobre los antecedentes técnicos y la aplicación veterinaria de la IET, consulte la Declaración de consenso veterinario de la EIT torácica (9).
Existen diferencias sustanciales entre los sistemas respiratorios de las aves y los mamíferos. La principal diferencia es que en las aves existe una separación funcional entre la ventilación y el intercambio de gases. Los sacos de aire compatibles no participan en el intercambio de gases. Son responsables de generar un flujo de marea que mantiene el flujo de aire unidireccional a través de los parabronquios (bronquios terciarios) tanto en la inspiración como en la espiración. Desde los parabronquios, el aire se mueve a través de las aurículas, el infundíbulo y los capilares de aire, donde se produce la mayor parte del intercambio gaseoso (6, 22). Cuando se hace referencia al pulmón aviar, se debe hacer referencia al componente de intercambio gaseoso del sistema respiratorio aviar, que no incluye los sacos de aire. Durante la inspiración, la presión negativa dentro de los sacos de aire craneales expandidos impulsa el flujo de aire a través de los parabronquios no conformes, y durante la espiración, la presión positiva dentro de los sacos de aire caudal nuevamente impulsa el flujo de aire unidireccionalmente a través de los parabronquios (6, 22) (Figura 1). Esta disposición permite una extracción de oxígeno mucho más eficiente en comparación con los mamíferos, manteniendo su tasa metabólica innatamente alta (1, 23, 24).
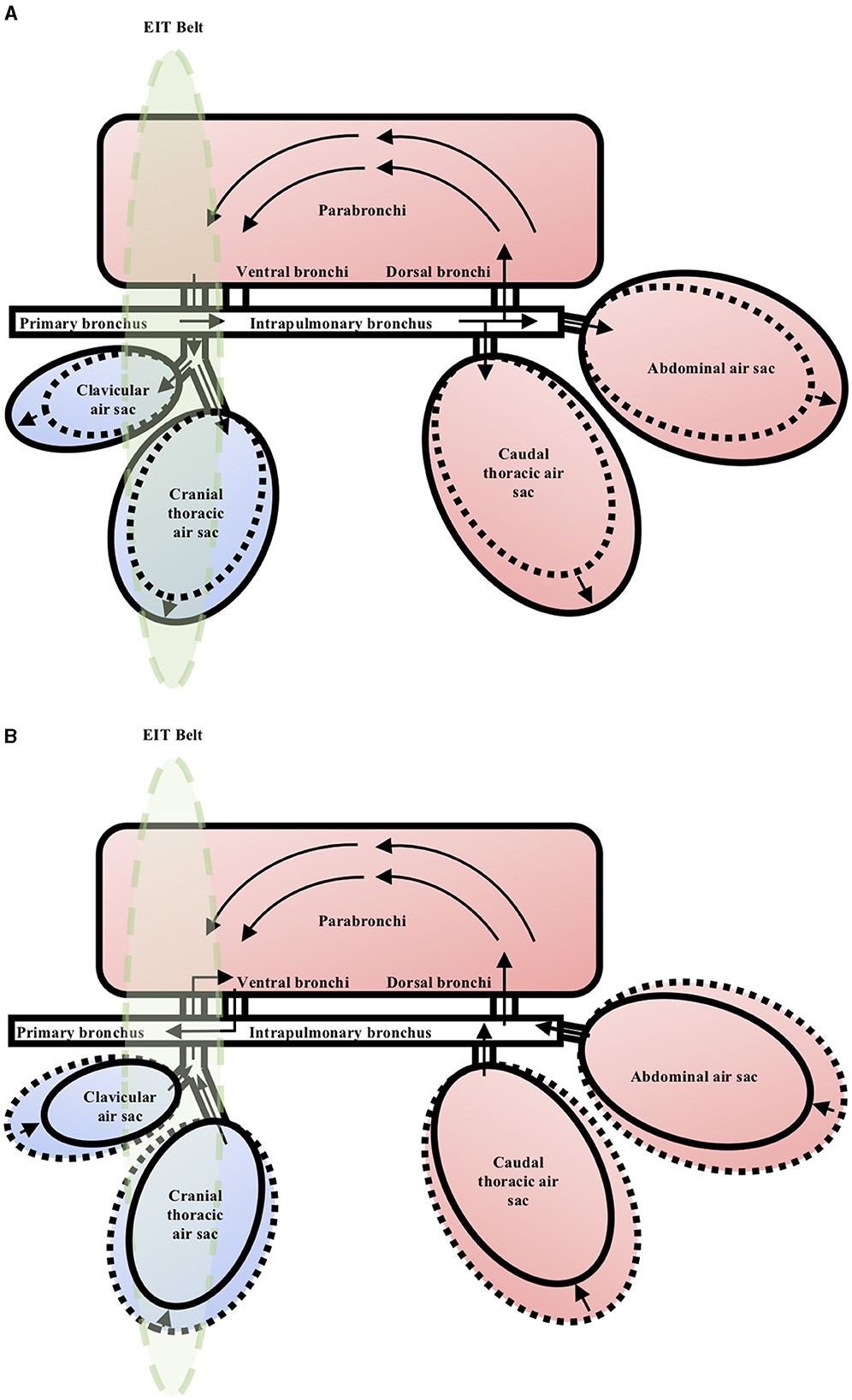 Figura 1. Representación esquemática del sistema respiratorio en el pollo durante el ciclo respiratorio. Las flechas indican la dirección del flujo de gas. La elipse verde representa el área del celoma cuyos datos serán capturados por el cinturón del EIT. a) Inspiración. Los sacos de aire se expanden y se llenan con el gas de las mareas durante la inspiración. La presión negativa dentro de los sacos de aire craneales expandidos impulsa el flujo de gas a través de los parabronquios unidireccionalmente. (b) Caducidad. Los sacos de aire se contraen y vacían el gas mareomotriz durante la espiración. La presión positiva dentro de los sacos de aire caudal impulsa el flujo de gas a través de los parabronquios unidireccionalmente.
Figura 1. Representación esquemática del sistema respiratorio en el pollo durante el ciclo respiratorio. Las flechas indican la dirección del flujo de gas. La elipse verde representa el área del celoma cuyos datos serán capturados por el cinturón del EIT. a) Inspiración. Los sacos de aire se expanden y se llenan con el gas de las mareas durante la inspiración. La presión negativa dentro de los sacos de aire craneales expandidos impulsa el flujo de gas a través de los parabronquios unidireccionalmente. (b) Caducidad. Los sacos de aire se contraen y vacían el gas mareomotriz durante la espiración. La presión positiva dentro de los sacos de aire caudal impulsa el flujo de gas a través de los parabronquios unidireccionalmente.
Se ha propuesto que ΔZ en el pulmón de mamíferos representa el estiramiento y la deformación de las células epiteliales, la sangre, los capilares y los vasos sanguíneos extracapilares secundarios a la expansión alveolar, en lugar del volumen de gas ganado durante la inspiración (25, 26). Por el contrario, en las aves, los sacos aéreos están finamente revestidos con células epiteliales escamosas simples y contienen vasos sanguíneos mínimos (27). Por lo tanto, no se sabe con certeza si ΔZ está presente en los sacos aéreos de las aves.
Dadas las diferencias anatómicas y fisiológicas en el sistema respiratorio de mamíferos y aves, se desconoce si la EIT puede utilizarse para monitorizar el sistema respiratorio de las aves. Este estudio será el primero en documentar la aplicación de la EIT en esta clase de vertebrados.
El objetivo principal de este estudio fue evaluar la viabilidad de la EIT para monitorizar la ventilación en pollos. El primer objetivo fue comprobar que el ΔZ se puede medir y es sincrónico con la respiración. El segundo objetivo fue identificar las estructuras anatómicas que generan el ΔZ. El tercer objetivo fue evaluar su capacidad para detectar diferencias en las variables de la EIT ante el desafío de un cambio en la decúbito. Se planteó la hipótesis de que la EIT puede medir ΔZ en sincronía con la ventilación en los sacos de aire, pero no en los pulmones, y que la EIT puede detectar diferencias en las variables de la EIT cuando los pollos se colocan en diferentes decúbitos. El objetivo secundario del estudio fue reportar las variables del EIT en las cuatro decúbitas. Se planteó la hipótesis de que las decúbidos afectarán significativamente a las variables del IET.
2 Materiales y métodos
2.1 Aprobación ética
Este estudio fue aprobado por el comité de ética animal de la Universidad de Murdoch (permiso número R3074/18).
2.2 Animales
En este estudio se incluyeron catorce pollos Hyline hembras adultas de 14 meses de edad. El peso corporal medio (±DE) fue de 1,89 kg ± 0,36 kg.
El cálculo del tamaño de la muestra no fue posible ya que no se disponía de datos previos, debido a la novedad del tema en aves. Además, la población reclutada fue una muestra por conveniencia. Estos pollos participaron inicialmente en un estudio observacional no relacionado en el mismo instituto y se incluyeron en este estudio después de terminar el estudio inicial, pero antes de la eutanasia. Los pollos fueron alojados en una instalación de almacenamiento dedicada, con acceso a comida y agua hasta la noche anterior al estudio. El bienestar general de los pollos fue evaluado y confirmado por un veterinario una vez al día en función del comportamiento general, la apariencia (por ejemplo, la forma de andar, el estado de las plumas y la piel), la ingesta de alimentos y la producción de huevos y heces.
2.3 Anestesia
Cada pollo fue inmovilizado en una toalla y colocado en decúbito esternal. La anestesia se indujo con isoflurano (ajuste del vaporizador al 5%) (IsoFlo, Zoetis, Australia) en oxígeno administrado a través de una máscara facial. El flujo de gas fresco con oxígeno al 100% se fijó en 3 L/min. A continuación, se realizó la intubación orotraqueal mediante un tubo endotraqueal de 3,5 mm de diámetro interno con manguito, una vez que los pollos estaban adecuadamente anestesiados. En este estudio se utilizaron tubos endotraqueales con manguito para evitar fugas de gas y, por lo tanto, para facilitar la retención inspiratoria de la TC. Cabe señalar que los tubos sin manguito suelen recomendarse para las aves debido a sus anillos traqueales completos y al riesgo asociado de daño mucoso y traqueal (6). El tubo endotraqueal se conectó a un sistema de respiración pediátrica para los pollos que se sometieron a TC, y a un sistema Mapleson D sin reinhalación (sistema Bain) para los pollos que se sometieron al protocolo del estudio. La anestesia se mantuvo con isoflurano (ajuste del vaporizador al 2%) en oxígeno al 100% con un caudal de gas fresco de 1-2 L/min. Las gallinas respiraron espontáneamente. Variables fisiológicas estándar que incluyen frecuencia cardíaca (FC), frecuencia respiratoria (RR), dióxido de carbono al final de la espiración lateral (ETCO2), saturación periférica de hemoglobina de oxígeno (SPO2), y la temperatura cloacal (T), fueron monitorizadas continuamente por un coinvestigador dedicado durante la anestesia utilizando un monitor multiparamétrico (SurgiVet Advisor Vital Signs Multi-parameter Monitor, Smiths Medical, NSW, Australia).
Al final del período de estudio, cada pollo anestesiado fue sacrificado con pentobarbitol 160 mg/kg (Valabarb, Jurox, NSW, Australia) administrado directamente en la vena braquial. La asistolia se confirmó por auscultación.
2.4 Construcción de los modelos CT y FE
Cuatro de los catorce pollos se sometieron a una tomografía computarizada (Aquilion Lightning 80, Canon Medical Systems) del celoma en decúbito dorsal. Se colocó un cinturón EIT simulado que consistía en un tubo de goma caudal a 5 cm de la entrada torácica, en el punto craneal del esternón, detrás de la articulación del hombro y debajo de las alas.
Las imágenes de TC (Ajustes: corte de 0,5 mm, 120 kV, mA dinámico, paso 0,813) se obtuvieron durante el período inspiratorio final y espiratorio final. Las imágenes inspiratorias finales se obtuvieron durante la retención inspiratoria, cerrando manualmente la válvula limitadora de presión ajustable y apretando suavemente la bolsa de reinhalación a una presión positiva de 5 cmH2O. Después de la retención inspiratoria, los pollos entraban constantemente en un período temporal de apnea, lo que facilitaba la obtención de las imágenes al final de la espiración. Después de la tomografía computarizada, los pollos fueron sacrificados como se describe.
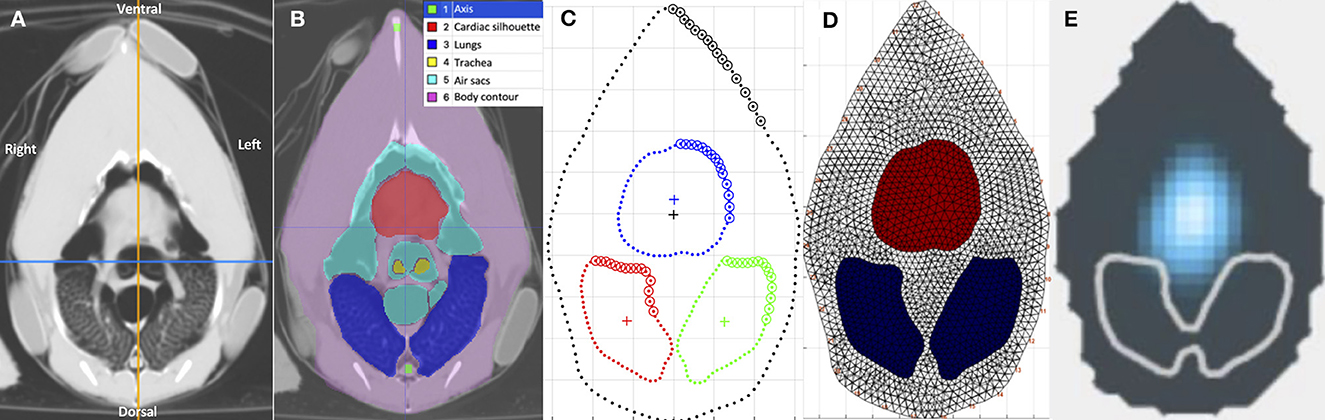
Para cada pollo, se utilizó la imagen tomográfica de fin de inspiratoria a nivel del cinturón simulado como referencia para la segmentación inicial del ROI (Figura 2A). El contorno externo del cuerpo, los pulmones, la silueta cardíaca, los sacos aéreos, la bifurcación de la tráquea y el esófago se identificaron como ROI utilizando un software específico (ITK-SNAP) (28) (Figura 2B). Con base en la técnica descrita en mamíferos, se construyó el modelo de elementos finitos (FE) específico de pollo utilizando los contornos medios del contorno externo, los pulmones y la silueta cardíaca como ROI de los cuatro pollos (Figuras 2C, D), utilizando un software de programación (Matlab 2017b, Mathworks) (29, 30). La adaptación para incluir los sacos aéreos craneales en el modelo se consideró imposible debido a la compleja superposición de los sacos aéreos y la silueta cardíaca entre la inspiración y la espiración (Figuras 3A, B).
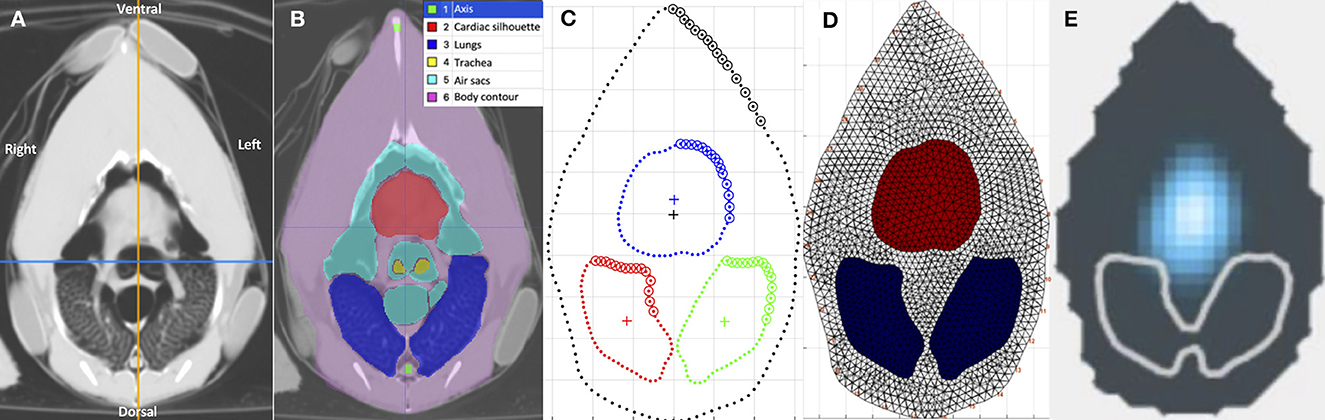 Figura 2. Imágenes tomográficas del celoma a nivel del cinturón del EIT, en varios formatos. Las imágenes están en orden secuencial de izquierda a derecha, (A-E) detallando el proceso de generación de una imagen EIT funcional específica para pollos. Todas las imágenes están alineadas en la misma orientación que la etiquetada en (A). (A) Imagen tomográfica computarizada (TC) del celoma a nivel del cinturón del EIT. (B) Segmentación de las regiones de interés (ROI), incluyendo la silueta cardíaca, los sacos aéreos, los pulmones, la bifurcación traqueal y el contorno corporal, utilizando el software ITK-SNAP. Cada una de las estructuras segmentadas está sombreada con su respectivo color como se indica en la leyenda. (C) Modelo del celoma utilizando los contornos medios de las segmentaciones de las imágenes de TC. El azul delinea la silueta cardíaca, el rojo delinea el pulmón derecho y el verde delinea el pulmón izquierdo. (D) El modelo de elementos finitos (FE) específico para pollos, creado con el software Matlab. El área roja representa la silueta cardíaca y la azul representa los pulmones. (E) Imagen funcional del EIT, después de la aplicación del modelo FE en los datos brutos del EIT, durante la inspiración en un pollo. El azul representa el cambio de impedancia, el gris delinea el contorno externo y el blanco delinea el ROI de los pulmones. No se observó ningún cambio de impedancia en el ROI de los pulmones. Se observaron señales de impedancia en el área de los sacos aéreos y la silueta cardíaca.
Figura 2. Imágenes tomográficas del celoma a nivel del cinturón del EIT, en varios formatos. Las imágenes están en orden secuencial de izquierda a derecha, (A-E) detallando el proceso de generación de una imagen EIT funcional específica para pollos. Todas las imágenes están alineadas en la misma orientación que la etiquetada en (A). (A) Imagen tomográfica computarizada (TC) del celoma a nivel del cinturón del EIT. (B) Segmentación de las regiones de interés (ROI), incluyendo la silueta cardíaca, los sacos aéreos, los pulmones, la bifurcación traqueal y el contorno corporal, utilizando el software ITK-SNAP. Cada una de las estructuras segmentadas está sombreada con su respectivo color como se indica en la leyenda. (C) Modelo del celoma utilizando los contornos medios de las segmentaciones de las imágenes de TC. El azul delinea la silueta cardíaca, el rojo delinea el pulmón derecho y el verde delinea el pulmón izquierdo. (D) El modelo de elementos finitos (FE) específico para pollos, creado con el software Matlab. El área roja representa la silueta cardíaca y la azul representa los pulmones. (E) Imagen funcional del EIT, después de la aplicación del modelo FE en los datos brutos del EIT, durante la inspiración en un pollo. El azul representa el cambio de impedancia, el gris delinea el contorno externo y el blanco delinea el ROI de los pulmones. No se observó ningún cambio de impedancia en el ROI de los pulmones. Se observaron señales de impedancia en el área de los sacos aéreos y la silueta cardíaca.
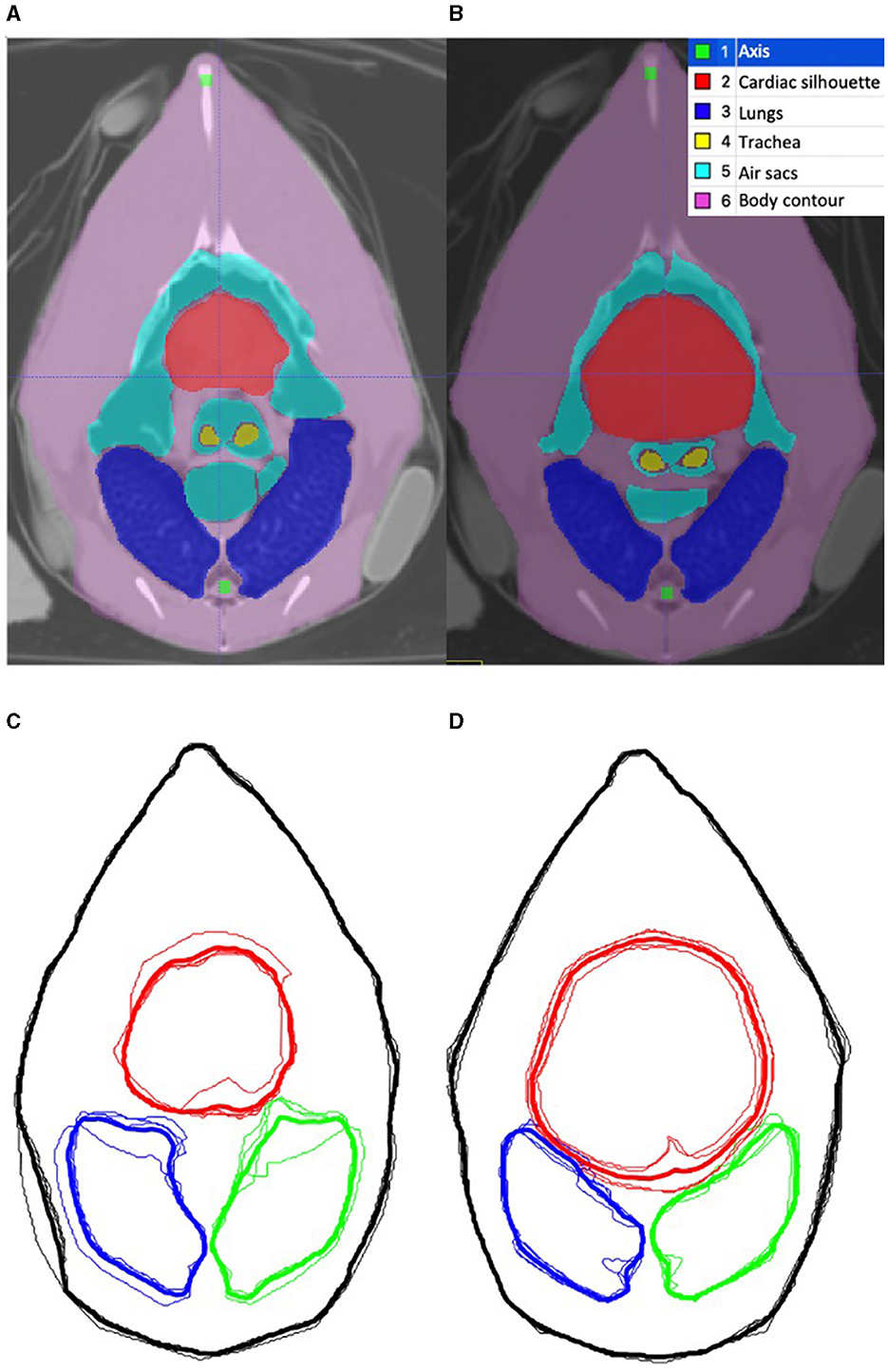 Figura 3. Imágenes tomográficas del celoma a nivel del cinturón durante la inspiración y la espiración. (A, B) son imágenes tomográficas computarizadas del celoma en un pollo durante la inspiración y la espiración, respectivamente. La región segmentada de intereses (ROI) se etiqueta en la leyenda. (C, D) son el contorno correspondiente del ROI basado en los cuatro pollos que se sometieron a TC durante la inspiración y la espiración, respectivamente. La línea delgada representa a cada pollo individual y la línea gruesa representa el contorno medio. El rojo delinea la silueta cardíaca, el azul delinea el pulmón derecho y el verde delinea el pulmón izquierdo. El contorno corporal y las estructuras esqueléticas permanecieron estáticas en tamaño. El área de los sacos aéreos aumenta durante la inspiración y disminuye durante la espiración. El área de la silueta cardíaca aumenta durante la espiración y disminuye durante la inspiración.
Figura 3. Imágenes tomográficas del celoma a nivel del cinturón durante la inspiración y la espiración. (A, B) son imágenes tomográficas computarizadas del celoma en un pollo durante la inspiración y la espiración, respectivamente. La región segmentada de intereses (ROI) se etiqueta en la leyenda. (C, D) son el contorno correspondiente del ROI basado en los cuatro pollos que se sometieron a TC durante la inspiración y la espiración, respectivamente. La línea delgada representa a cada pollo individual y la línea gruesa representa el contorno medio. El rojo delinea la silueta cardíaca, el azul delinea el pulmón derecho y el verde delinea el pulmón izquierdo. El contorno corporal y las estructuras esqueléticas permanecieron estáticas en tamaño. El área de los sacos aéreos aumenta durante la inspiración y disminuye durante la espiración. El área de la silueta cardíaca aumenta durante la espiración y disminuye durante la inspiración.
De acuerdo con la convención, los contornos medios del contorno externo del cuerpo, la silueta cardíaca y los pulmones de los cuatro pollos se calcularon y alinearon para construir el modelo FE medio correspondiente utilizando un software de programación (Matlab 2017b, Mathworks) (Figura 2D).
Además, se evaluó el movimiento y los cambios de los órganos dentro del celoma durante el ciclo respiratorio mediante tomografía computarizada. El proceso de segmentación descrito se repitió para las imágenes tomográficas espiratorias del celoma. Los contornos medios durante la inspiración y los contornos medios durante la espiración se superpusieron gráficamente, lo que permitió la comparación visual de los cambios en los contornos ROI dentro del celoma durante el ciclo respiratorio. Los cambios se analizaron descriptivamente.
2.5 Recopilación de datos
Diez de los catorce pollos reclutados se sometieron al protocolo de estudio con el cinturón de electrodos EIT. El cinturón EIT fue construido para un estudio previo en corderos (31). El cinturón incluía 32 electrodos colocados equidistantemente en una banda elástica tejida (Figura 4A). Cada electrodo tenía 12 matrices de clavijas chapadas en oro para permitir un contacto adecuado con la piel (Figura 4B).
 Figura 4. (A) El cinturón EIT utilizado en el estudio, con 32 electrodos equidistantes colocados en un cinturón elástico. Cada electrodo constaba de 12 matrices de clavijas chapadas en oro. (B) Imagen fotográfica de un pollo en el protocolo experimental, colocado en decúbito dorsal, con una banda circunferencial de plumas removida y el cinturón EIT colocado justo caudal a los hombros.
Figura 4. (A) El cinturón EIT utilizado en el estudio, con 32 electrodos equidistantes colocados en un cinturón elástico. Cada electrodo constaba de 12 matrices de clavijas chapadas en oro. (B) Imagen fotográfica de un pollo en el protocolo experimental, colocado en decúbito dorsal, con una banda circunferencial de plumas removida y el cinturón EIT colocado justo caudal a los hombros.
Primero se retiró una banda circunferencial de plumas de ~4 cm de ancho desde el tórax caudal hasta la articulación del hombro, a nivel del esternón craneal (Figura 4B). Se aplicó generosamente un gel de ultrasonido de baja conductividad en cada electrodo y en la piel del tórax antes de colocar el cinturón alrededor del tórax. El cinturón se colocó 5 cm caudal a la entrada torácica, en el punto craneal del esternón, detrás de las articulaciones de los hombros y debajo de las alas. Se colocó una sutura de soporte en el punto craneal del esternón para evitar que el cinturón se deslizara durante los cambios de decúbito. Se comprobó manualmente que el cinturón tuviera una tensión adecuada alrededor del celoma para minimizar la interferencia en la respiración, observando el inflado y desinflado adecuados del celoma durante la ventilación de marea. También se garantizó un contacto suficiente con la piel entre la cinta y el celoma, utilizando la función incorporada del software EIT que destaca el contacto adecuado con el electrodo y la falla del contacto (BB Vet SW, SenTec, Suiza).
Los pollos se colocaron en las cuatro posiciones de decúbito (dorsal, ventral, lateral derecho y lateral izquierdo) en orden aleatorio. Los pollos permanecieron en cada posición de decúbito durante 15 minutos: 13 minutos de estabilización seguidos de 2 minutos de registro de datos de EIT utilizando el software EIT (BB Vet SW, SenTec, Suiza). El sistema EIT aplica una corriente alterna de 192 kHz a una amplitud de 5 mA, en una secuencia giratoria a 48 fotogramas por segundo. Variables de monitorización (HR, RR, ETCO2, SPO2, T) se registraron manualmente al comienzo de cada grabación del EIT.
2.6 Análisis de datos post-hoc
Los análisis de los datos del EIT se realizaron utilizando un software analítico del EIT (Ibex, Sentec AG, sucursal del EIT, Suiza). Los datos brutos de la EIT se reconstruyeron en imágenes de la EIT funcionales anatómicamente precisas utilizando el modelo de la FE del pollo, que se construyó de acuerdo con el algoritmo de reconstrucción de consenso de Graz modificado para la EIT (GREIT) (10, 11).
Se analizaron los datos de EIT de seis a diez respiraciones consecutivas sin artefactos a partir del registro de 2 minutos durante cada posición de decúbito.
Después del análisis inicial de los datos de la EIT, se hizo evidente que, a diferencia de los mamíferos, no aparecieron cambios de impedancia entre la inspiración y la espiración dentro de la ROI pulmonar. En cambio, las señales ΔZ se localizaron en el área ventral al ROI pulmonar, que correspondía al área de los sacos aéreos craneales y la silueta cardíaca según la TC. Dado que no fue posible adaptar el modelo de elementos finitos, se calcularon los análisis de las siguientes variables del IET utilizando únicamente el contorno exterior del modelo de elementos finitos inicial:
1. El centro de ventilación (CoV) (%), que describe el punto focal geométrico de la ventilación global como un porcentaje, de derecha a izquierda (CoV)RL) o la dirección ventral a dorsal (CoV)VD). el porcentaje de CoV representa la extensión de la ventilación hacia la dirección respectiva. por ejemplo, CoVRL de 0% indica que la ventilación ocurrió predominantemente en el celoma derecho, y 100% indica que la ventilación ocurrió predominantemente en la región izquierda. CoVVD del 0% indica que la ventilación se produjo predominantemente en la parte ventral del celoma, y el 100% indica que la ventilación se produjo predominantemente en la dorsal (9).
2. La relación derecha-izquierda (relación RL), describe los cambios de impedancia asociados con la derecha (ΔZVR) y la izquierda (ΔZVL) del celoma. A continuación, la relación se calcula como ΔZVR/ΔZVL (9).
3. Distribución de la ventilación dentro de las regiones (%). el contorno exterior global se separa en cuatro regiones escalonadas de área tanto en el lado izquierdo como en el derecho: dorsal (ΔZRD, ΔZLD), central-dorsal (ΔZRCD, ΔZLCD), centro-ventral (ΔZRCV, ΔZLCV) y ventral (ΔZRV, ΔZLV) para el lado izquierdo (L) y derecho (R). cada región se expresa como un porcentaje del total de ΔZ, donde la suma de las ocho regiones es el 100% (9).
4. Variación de la impedancia tidal (TIV) en unidades arbitrarias (UA), un sustituto del volumen corriente en mamíferos. Representa el ΔZ global medido entre el inicio y el final de la inspiración. Por lo tanto, el TIV se calcula restando la impedancia al final de la inspiración de la impedancia al comienzo de la inspiración (9).
5. Tiempo(s) inspiratorio(s). Este parámetro se calcula por la diferencia de tiempo en segundos entre el inicio y el final de la inspiración de la misma respiración.
Durante la recolección de datos, se observaron patrones de respiración distintivos cuando los pollos fueron colocados en diferentes decúbitos. En ciertas posiciones, algunos pollos demostraron una pausa temporal durante el proceso de exhalación. Esta distinción entre diferentes patrones se pudo identificar en la extremidad espiratoria de la curva de impedancia. La pausa temporal durante la exhalación es paralela a una meseta momentánea en la señal de impedancia.
Con base en estas observaciones, los patrones respiratorios (BrP) se clasificaron en cuatro categorías (BrP1-4) según la forma de la extremidad espiratoria de la curva de impedancia, la presencia de la pausa y el momento de la pausa durante la espiración se detallan en la Figura 5. Cada pollo solo se clasificó para tener un BrP específico en cada posición de decúbito específico cuando al menos el 95% de todos los alientos analizados cayeron en una de las cuatro categorías definidas.
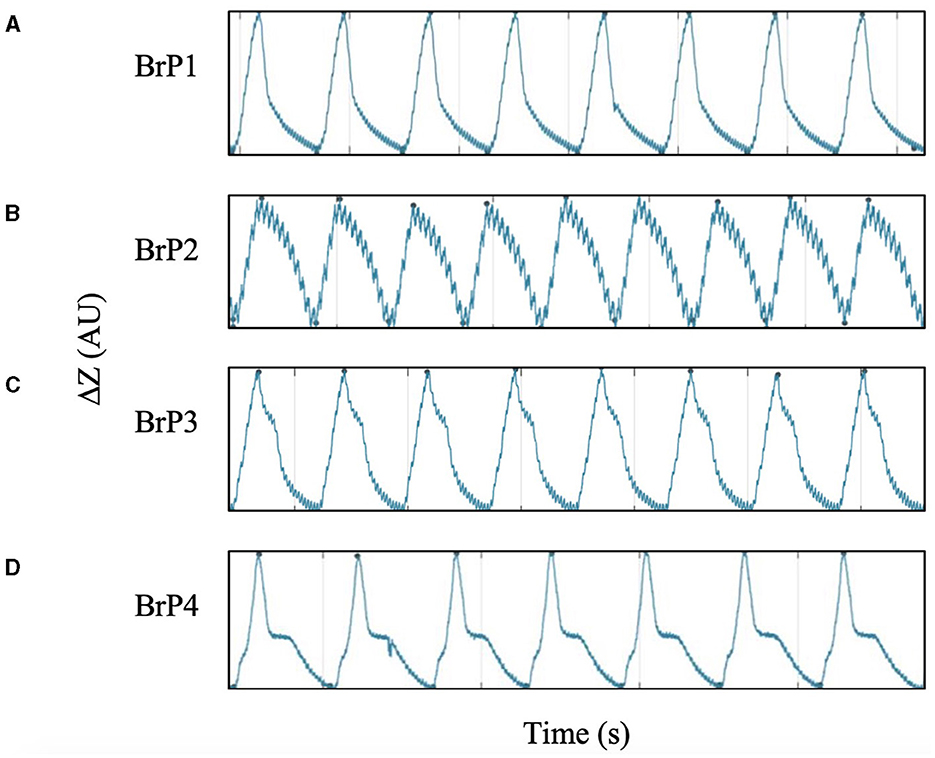 Figura 5. Curva de tiempo de impedancia para las cuatro categorías de patrón respiratorio (BrP), definida por la forma de la curva espiratoria. Todos los pollos demostraron uno de los cuatro BrP de manera uniforme durante la recolección de datos. Se pueden observar señales de aleteo diminutas superpuestas a la curva de tiempo de impedancia. (A) BrP1 tiene una curva espiratoria cóncava-lineal sin pausa de impedancia. (B) BrP2 tiene una curva espiratoria convexo-lineal sin pausa de impedancia. (C) BrP3 con un evento de pausa de impedancia caracterizado por un punto de inflexión distinto en la fase temprana de la espiración, cuando el cambio de impedancia se mantuvo >50%. (D) BrP4 con un evento de pausa de impedancia caracterizado por un punto de inflexión distinto en la fase tardía de la espiración, cuando el cambio de impedancia fue ≤ 50%.
Figura 5. Curva de tiempo de impedancia para las cuatro categorías de patrón respiratorio (BrP), definida por la forma de la curva espiratoria. Todos los pollos demostraron uno de los cuatro BrP de manera uniforme durante la recolección de datos. Se pueden observar señales de aleteo diminutas superpuestas a la curva de tiempo de impedancia. (A) BrP1 tiene una curva espiratoria cóncava-lineal sin pausa de impedancia. (B) BrP2 tiene una curva espiratoria convexo-lineal sin pausa de impedancia. (C) BrP3 con un evento de pausa de impedancia caracterizado por un punto de inflexión distinto en la fase temprana de la espiración, cuando el cambio de impedancia se mantuvo >50%. (D) BrP4 con un evento de pausa de impedancia caracterizado por un punto de inflexión distinto en la fase tardía de la espiración, cuando el cambio de impedancia fue ≤ 50%.
2.7 Estadísticas
Los datos fueron analizados con Stata (versión 16.1, StataCorp). La normalidad de las variables de resultado se evaluó mediante la prueba de Shapiro-Wilks. Los valores medios de las variables de resultado, incluido el CoV.RL, CoVVD, relación RL, regiones de ventilación (ΔZRD, ΔZRCD, ΔZRCV, ΔZRV, ΔZLD, ΔZLCD, ΔZLCV, ΔZLV) en porcentaje relativo a la ΔZ total, la TIV, el tiempo inspiratorio y la frecuencia respiratoria en cada decúbito se incluyeron en los análisis estadísticos. Las variables de resultado se inspeccionaron visualmente en busca de valores atípicos. No se encontró ninguno.
Para cada variable de resultado, excepto para ΔZLCV, se ajustó a los datos un modelo lineal mixto con una intersección aleatoria específica para pollos. Los gráficos de la función de autocorrección de los residuos confirmaron que no había ningún patrón autorregresivo en los datos. Para ΔZLCV, se utilizó un modelo lineal de efectos fijos (ya que una prueba de razón de verosimilitud confirmó que no había diferencias con un modelo lineal mixto) y no se requirió la adición de una estructura de correlación autorregresiva a los residuos. Las cuatro posiciones de decúbito se incluyeron como covariables para todas las variables de resultado. Se utilizó una prueba de razón de verosimilitud para confirmar que no era necesario incluir como covariable la posición de decúbito anterior de cada pollo. El modelo mixto lineal final para cada variable de resultado utilizó la estimación de máxima verosimilitud restringida (REML). Se utilizaron gráficos cuantil-normales para evaluar la normalidad de la distribución de los residuos una vez ajustados los modelos para cada variable de resultado. Se utilizaron gráficos que comparaban los residuos del modelo estandarizado con los valores ajustados para inspeccionar visualmente los valores observados altamente influyentes; No se encontró ninguno. Se utilizaron pruebas de Wald para comparar las posiciones de decúbito para cada parámetro. No se realizaron ajustes en los valores p. P ≤ 0,05 se consideró estadísticamente significativo.
Para el análisis de los patrones respiratorios, se contó el número de pollos que mostraban cada una de las cuatro categorías, en cada decúbito. Se utilizó la prueba exacta de Fisher para comparar el número de pollos por categoría entre las decúbitas. P ≤ 0,05 se consideró estadísticamente significativo.
3 Resultados
Los catorce pollos reclutados completaron sus respectivos procedimientos: TC (n = 4) y protocolo de estudio EIT (n = 10). La anestesia general para todos los pollos transcurrió sin complicaciones. En un pollo, se excluyeron los datos de EIT de decúbito lateral izquierdo, ya que no se registraron datos debido a la interferencia artefactual de la señal. Por lo tanto, se disponía de diez conjuntos de datos para la decúbito dorsal, ventral y lateral derecho, y de nueve conjuntos de datos para la decúbito lateral izquierdo. No se encontraron problemas en la aplicación física del cinturón EIT. No se observaron daños ni irritación en la piel por la colocación del cinturón ni por el uso de gel de ultrasonido de baja conductividad.
Los resultados de todas las variables fisiológicas registradas durante el protocolo de estudio de la EIT se presentan en la Tabla 1 como medianas y rangos intercuartílicos.
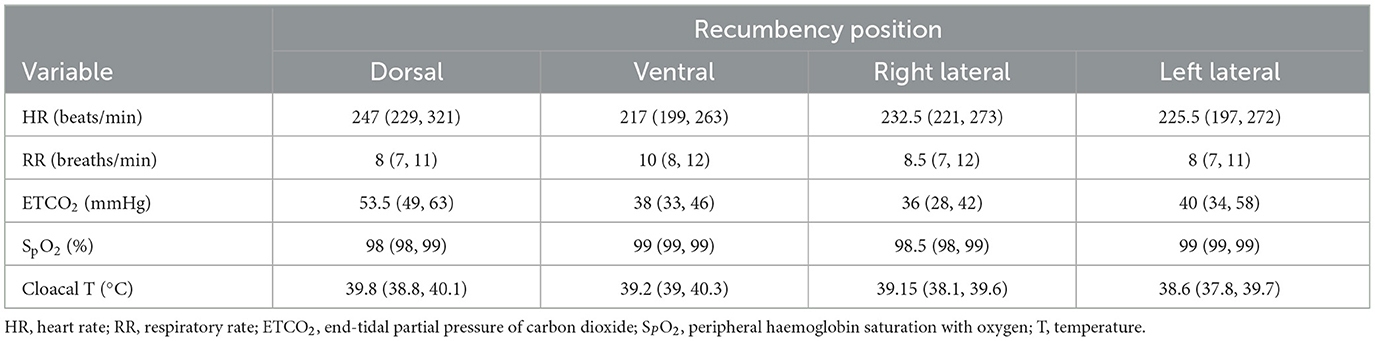 Tabla 1. Variables fisiológicas (presentadas como medianas y rangos intercuartílicos) de los pollos anestesiados con isoflurano en decúbito dorsal, ventral, lateral derecho e izquierdo.
Tabla 1. Variables fisiológicas (presentadas como medianas y rangos intercuartílicos) de los pollos anestesiados con isoflurano en decúbito dorsal, ventral, lateral derecho e izquierdo.
3.1 Análisis de TC
El corte de la imagen tomográfica correspondió al nivel del cinturón simulado (Figura 6). Los órganos transaccionados a este nivel se identificaron visualmente e incluyeron la silueta cardíaca, los pulmones, el grupo de sacos aéreos craneales que a su vez comprendía el saco aéreo clavicular y el saco aéreo torácico craneal pareado bilateral, la bifurcación traqueal y el esófago (32).
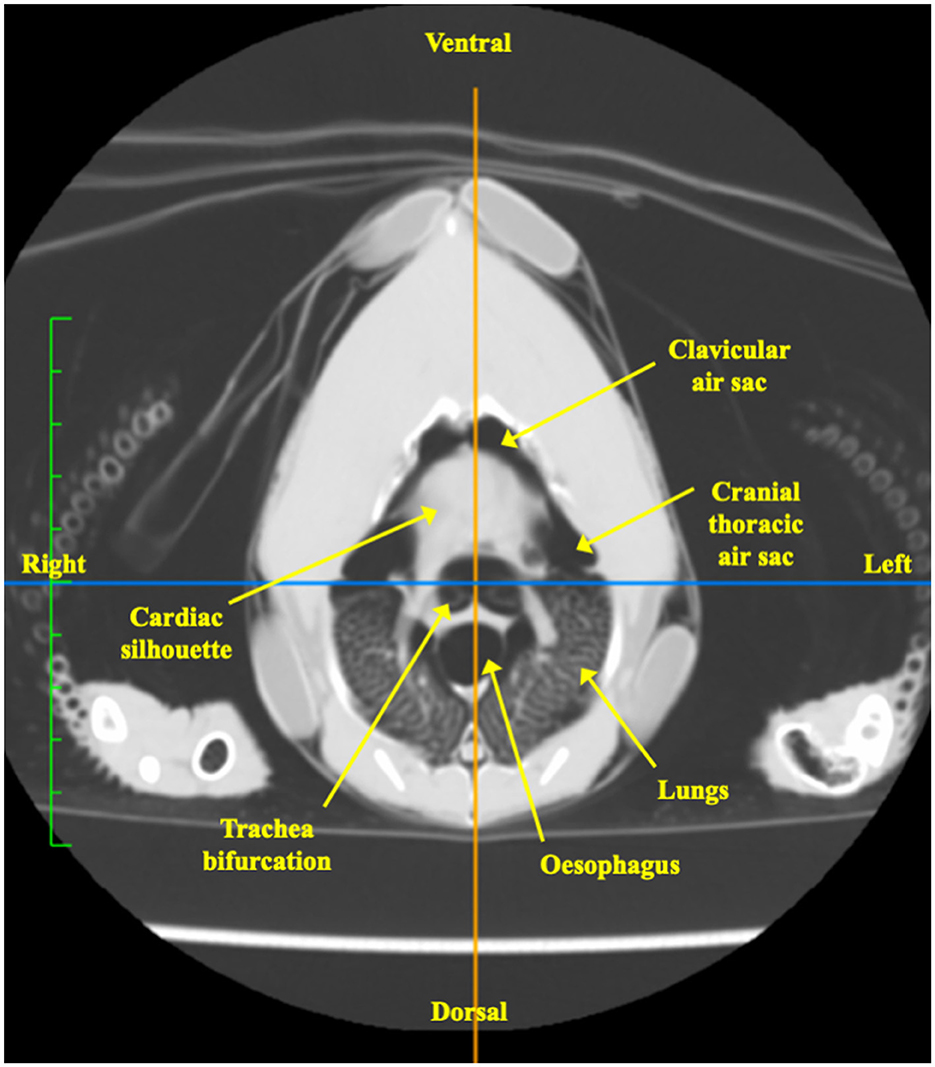 Figura 6. Imagen tomográfica computarizada en el plano transversal de un pollo a nivel de la faja del EIT, inmediatamente caudal a las articulaciones del hombro. Los órganos seccionados a nivel del cinturón incluyen la silueta cardíaca, los pulmones, el saco aéreo clavicular, el saco aéreo craneorácico, las bifurcaciones traqueales y el esófago.
Figura 6. Imagen tomográfica computarizada en el plano transversal de un pollo a nivel de la faja del EIT, inmediatamente caudal a las articulaciones del hombro. Los órganos seccionados a nivel del cinturón incluyen la silueta cardíaca, los pulmones, el saco aéreo clavicular, el saco aéreo craneorácico, las bifurcaciones traqueales y el esófago.
Durante la comparación visual de las fases inspiratoria y espiratoria, el contorno corporal y las estructuras esqueléticas permanecieron estáticos en posición y tamaño (Figuras 3A, B). El área media de los pulmones fue un 7,7% más grande durante la inspiración que durante la espiración, según lo medido por una calculadora de área en línea (SketchAndCal, Icalc Inc). El área de los sacos aéreos también aumentó en la inspiración en comparación con la espiración. El área de la silueta cardíaca disminuyó en la inspiración en comparación con la espiración. Esta observación fue consistente en los cuatro pollos.
3.2 Análisis de la señal EIT
La aplicación de EIT para el monitoreo de la ventilación en tiempo real en pollos fue posible cuando se utilizó el cinturón de electrodos especialmente diseñado y el software EIT. En la inspección visual, el cambio de impedancia a lo largo del tiempo trazado por el software EIT fue sincrónico con la inspiración y la frecuencia respiratoria registrada manualmente. Por lo tanto, se determinó que la ΔZ registrada se debía a la ventilación y representaba la TIV. Estos cambios cíclicos en ΔZ se observaron para todas las respiraciones en todos los pollos. Se observaron pequeñas señales de aleteo superpuestas a la curva de impedancia-tiempo en todos los pollos (Figura 3). La frecuencia de estas señales era sincrónica con la frecuencia cardíaca y representaba señales relacionadas con el corazón. Estas señales relacionadas con el corazón fueron minúsculas en magnitud y no afectaron el reconocimiento de la TIV por el software EIT durante el análisis.
Los datos de la EIT se reconstruyeron con éxito en imágenes tomográficas funcionales anatómicamente precisas utilizando el contorno exterior del modelo de FE específico para pollos. En estas imágenes funcionales, no se observó ninguna señal ΔZ en el ROI pulmonar durante todo el ciclo respiratorio. Sobre la base de la comparación entre las imágenes de EIT utilizando el modelo FE y las imágenes de TC correspondientes, las señales de EIT situadas en el área ventral al ROI pulmonar representaron ΔZ en el área de los sacos aéreos craneales y la silueta cardíaca en su lugar (Figura 2E). Como las señales relacionadas con el corazón eran mínimas, la ΔZ registrada representaba predominantemente la TIV de los sacos aéreos craneales.
3.3 Distribución de la ventilación
El uso de EIT en pollos demostró una buena capacidad de respuesta a los cambios de decúbito, detectándose cambios significativos en la distribución de la ventilación. Todos los resultados y cambios significativos entre las cuatro decúbidos se presentan en la Tabla 2.
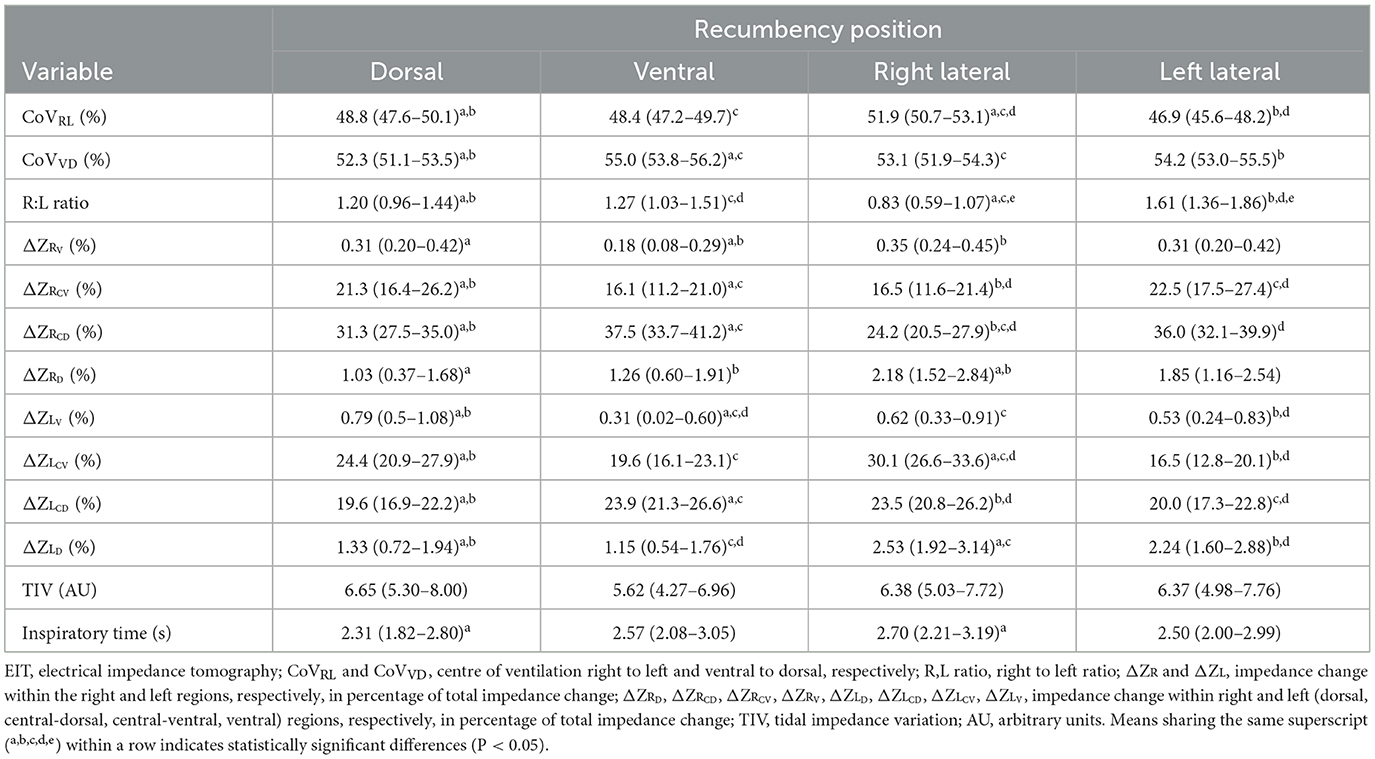 Tabla 2. Variables de tomografía de impedancia eléctrica (media e intervalo de confianza del 95%) del celoma en pollos anestesiados con isoflurano en decúbito dorsal, ventral, lateral derecho e izquierdo.
Tabla 2. Variables de tomografía de impedancia eléctrica (media e intervalo de confianza del 95%) del celoma en pollos anestesiados con isoflurano en decúbito dorsal, ventral, lateral derecho e izquierdo.
3.4 Variación de la impedancia de marea, frecuencia respiratoria y tiempo inspiratorio
No se encontraron diferencias significativas en la TIV y la RR en las cuatro decúbidos (Tablas 1, 2). No se encontraron diferencias significativas en el tiempo inspiratorio entre las depresiones dorsal y ventral, ni entre las decubiciones laterales derecha e izquierda. El tiempo inspiratorio en decúbito dorsal fue significativamente mayor que en decúbito lateral derecho (P = 0,006).
3.5 Patrón respiratorio
Todos los pollos mostraron solo una de las cuatro categorías de BrP (Figura 5) a lo largo de los 2 minutos de recolección de datos mientras estaban en una posición particular de decúbito. El número de pollos con un BrP particular en cada decúbito fue significativamente diferente a la frecuencia esperada (P = 0,001) (Figura 7).
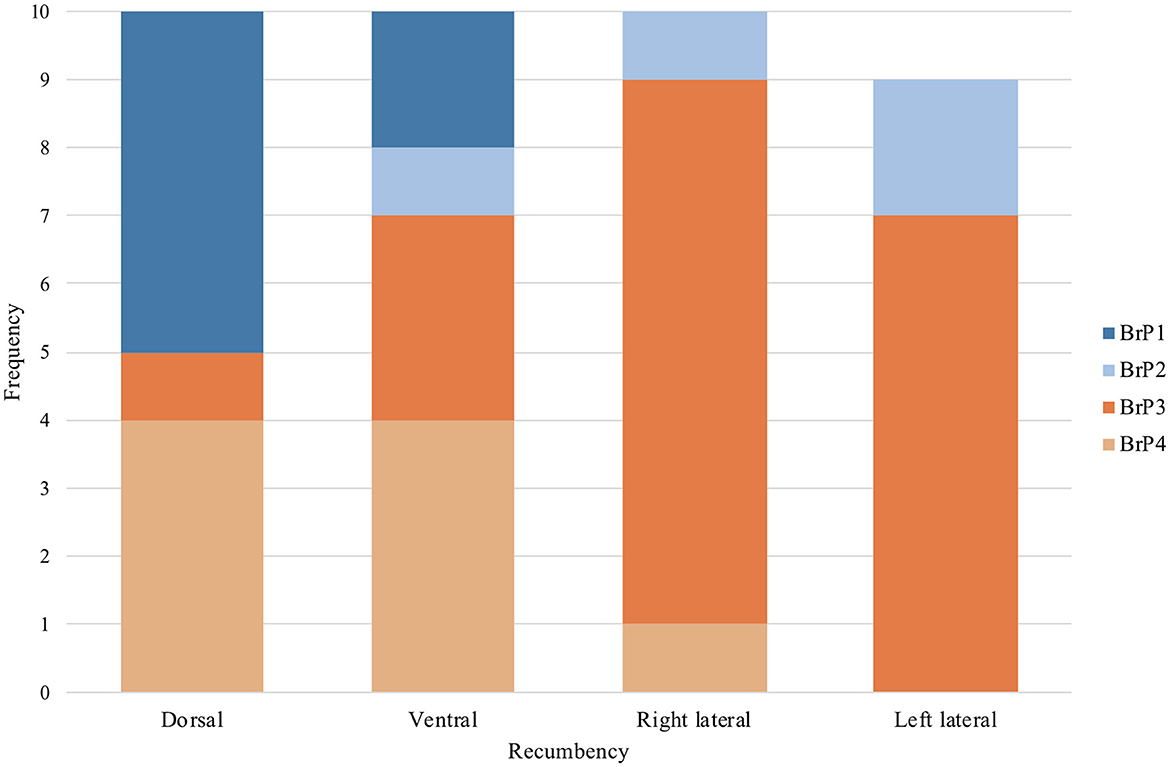 Figura 7. La frecuencia de sujetos que demostraron cada una de las cuatro categorías de patrón respiratorio (BrP), definidas por la forma de la curva de tiempo de impedancia espiratoria, en decúbito dorsal, ventral, lateral derecho e izquierdo, en los diez pollos anestesiados con isoflurano incluidos en el protocolo del estudio. Se excluyó un pollo en decúbito lateral izquierdo debido a la falta de datos de interferencia de la señal artefactual.
Figura 7. La frecuencia de sujetos que demostraron cada una de las cuatro categorías de patrón respiratorio (BrP), definidas por la forma de la curva de tiempo de impedancia espiratoria, en decúbito dorsal, ventral, lateral derecho e izquierdo, en los diez pollos anestesiados con isoflurano incluidos en el protocolo del estudio. Se excluyó un pollo en decúbito lateral izquierdo debido a la falta de datos de interferencia de la señal artefactual.
En decúbito dorsal, la mayoría de los pollos tenían BrP1 (5/10) o BrP4 (4/10), con un pollo mostrando BrP3. En decúbito ventral, la mayoría de los pollos tenían BrP4 (4/10) o BrP3 (3/10), con dos pollos mostrando BrP1 y un pollo con BrP2.
En ambas decúbito lateral, la mayoría de los pollos tenían BrP3 (15/19). En decúbito lateral derecho, un pollo mostró BrP2 y BrP4 cada uno, mientras que el resto tuvo BrP3 (7/9). En decúbito lateral izquierdo, dos pollos tenían BrP2, y el resto mostraba BrP3 (8/10).
4 Discusión
4.1 Resumen de los resultados
Este estudio ha demostrado que la tecnología de EIT es aplicable en pollos para monitorizar la ventilación de los sacos de aire craneales. Cambios significativos en las variables EIT de distribución de la ventilación (CoVRL, CoVVD, la relación RL y los ΔZ regionales) se detectaron cuando se cambió la posición. Se observaron cambios significativos en el patrón respiratorio cuando los pollos se movieron a diferentes posiciones de decúbito. Sin embargo, no se encontraron diferencias significativas en TIV y RR entre las posiciones de decúbito.
4.2 Viabilidad y consideraciones prácticas
Este es el primer estudio que prueba y demuestra la aplicación de la EIT en aves. Las decisiones prácticas elegidas para el diseño del estudio se basaron en experiencias previas en mamíferos. En el pasado, los datos de EIT se obtenían con el uso de almohadillas de electrodos individuales en neonatos y perros (33, 34), esto ha sido reemplazado por el uso de un cinturón de electrodos en medicina veterinaria como el enfoque convencional que garantiza convenientemente la colocación uniforme de electrodos en todos los sujetos del estudio (9). En este estudio, la colocación del cinturón se inspeccionó visualmente en todo momento para garantizar que no se produjera ninguna deformación del cuerpo inducida por el cinturón que pudiera interferir con la ventilación. También se ha demostrado que el uso de un cinturón textil EIT proporciona un uso adecuado y a largo plazo sin causar molestias ni angustia en los recién nacidos prematuros (35).
La correa EIT utilizada estaba equipada con matrices de pasadores chapados en oro (31). Se ha demostrado que los electrodos de oro proporcionan la menor impedancia de contacto con la piel debido a su alta conductividad eléctrica en comparación con los electrodos a base de zinc (36). Los electrodos de matriz de clavijas eran ideales para que los pollos se adaptaran a su circunferencia torácica relativamente pequeña. Si bien el daño en la piel causado por electrodos clavados o con púas es una preocupación teórica, esto no se observó en este estudio y no se informó en estudios anteriores en perros y novillos (33, 36). Sin embargo, el peso del animal y los factores de decúbito pueden contribuir al riesgo potencial de daños en la piel. La viabilidad de otros tipos de electrodos en aves debe investigarse en estudios futuros.
La optimización de las señales de EIT se llevó a cabo mediante múltiples estrategias. En primer lugar, las plumas se depilaron para maximizar el contacto entre el electrodo y la piel. Del mismo modo, el corte de pelo se ha documentado en estudios caninos anteriores (33). En segundo lugar, la aplicación de gel de ultrasonidos de baja conductividad también ayuda al contacto entre el electrodo y la piel al abolir las bolsas de aire entre el electrodo y la piel. Es importante destacar que también estimula la penetración de la corriente en la piel y el tórax, y evita que la corriente de derivación se conduzca a la superficie de la piel entre los electrodos, lo que de otro modo podría ocurrir con un gel de alta conducción (9). En tercer lugar, se utilizaron suturas de tirantes para mantener la posición del cinturón y evitar interferencias relacionadas con el movimiento. Sin embargo, esta no es una práctica rutinaria en otras especies veterinarias. Futuros estudios deberían evaluar la viabilidad de la EIT en aves sin necesidad de colocar suturas de soporte y depilación de plumas, para mejorar su accesibilidad para las aves propiedad de los clientes. En última instancia, se recogieron buenas señales de datos en todos los pollos, excepto en uno, mientras estaban en decúbito lateral izquierdo. Un estudio equino previo reportó artefactos eléctricos secundarios al uso de electrocauterización, pero esto no se utilizó en este estudio (19). En este caso, se desconoce la causa exacta de la interferencia de la señal.
4.3 Origen de las señales de impedancia
Las señales de impedancia que se originaron en los sacos de aire se observaron claramente en los pollos de este estudio. Existe controversia sobre el origen de las señales de impedancia. En mamíferos, se ha argumentado que ΔZ podría ser el resultado del estiramiento y la deformación del tejido y la sangre secundaria a la expansión alveolar, en lugar de un aumento en el volumen de gas (25, 26). Sin embargo, en este estudio se demostró que la detección por EIT de ΔZ bien definida dentro de los sacos aéreos delgados y poco vascularizados era posible (27). Esto apoya que la señal ΔZ podría generarse a partir de un cambio en el volumen de gas en lugar de derivarse únicamente del estiramiento de tejido y sangre (37).
4.4 Señales de impedancia en el modelo aviar
La imagen tomográfica del tórax fue esencial para identificar las estructuras anatómicas seccionadas a nivel del cinturón del EIT. La imagen mostró que tanto los sacos de aire clavicular no apareados como los sacos torácicos craneales pareados estaban claramente incluidos. Por el contrario, es poco probable que la afectación del saco aéreo cervical se incluya en la imagen, ya que la mayor parte del saco aéreo cervical se encuentra craneal a la tercera vértebra torácica (32). De todos modos, el saco cervical contribuye mínimamente a la ventilación y su exclusión no debe afectar el análisis de la ventilación de los sacos craneales (6).
Los contornos de la ROI pulmonar se definieron claramente en la imagen tomográfica sin que se superpusieran los órganos principales, lo que permitió que la segmentación se realizara con precisión utilizando el software dedicado (28). No se detectó ΔZ dentro del ROI del pulmón. La falta de señal es consistente con la fisiología respiratoria aviar, donde el intercambio de gases y la ventilación están funcionalmente separados. Tanto durante la inspiración como durante la espiración, los flujos de gas son impulsados a través de los pulmones de manera unidireccional por los sacos de aire compatibles. Los pulmones, donde se produce el intercambio gaseoso, se consideran no distensibles y, por lo tanto, seguirían siendo isovolumétricos (6, 38). Como no hay diferencia en el volumen de gas dentro de los parabronquios entre el inicio de la inspiración y el final de la inspiración, se deduce que no se detectaría ΔZ. En este estudio, se observó que el área de los pulmones era más grande durante la inspiración que en la espiración en las imágenes de TC. Si bien esto es inconsistente con el consenso de que los pulmones permanecen estáticos en tamaño, está de acuerdo con un estudio previo en patos que utilizó marcadores de tantalio y radiografías para mostrar que el grosor pulmonar fluctuaba cíclicamente durante la ventilación (39). Además, el movimiento de las vísceras dentro del celoma puede haber contribuido a esta discrepancia en el área pulmonar entre la inspiración y la espiración, a pesar de que el cinturón estaba atado a la pared torácica externa. Un fenómeno similar se ha descrito en perros en los que el movimiento de los órganos dentro del tórax y el abdomen bajo el cinturón de la EIT puede haber contribuido a las variaciones en las variables de la EIT (14).
A diferencia de los pulmones, no fue posible lograr la segmentación de los sacos aéreos como un ROI independiente para el modelo FE. La superposición dinámica de la silueta cardíaca y las áreas de los sacos aéreos entre la inspiración y la espiración hizo imposible la segregación independiente de estas dos estructuras. Cabe señalar que, mientras que la imagen de TC transversal representa un corte bidimensional, la imagen del EIT en realidad representa un corte tridimensional en forma de lente a nivel del cinturón, con un grosor creciente en la región central del corte (Figura 1). El aislamiento y la eliminación de la silueta cardíaca del área de interés excluiría una proporción considerable de las señales de impedancia que se originan en los alvéolos.
En las imágenes de TC, la silueta cardíaca fue empujada caudalmente durante la inspiración por el inflado de los sacos de aire craneales, hacia los límites caudales del corte en forma de lente. Este hallazgo fue demostrado consistentemente por el corte transversal de la TC inspiratoria final en el que el área de la silueta cardíaca era más pequeña (Figura 3). Convenientemente, los sacos de aire craneales se ubicaron en la parte más gruesa del corte de EIT durante la inspiración. Por lo tanto, se maximizaron la calidad y la amplitud de la TIV, con una contribución mínima de las señales relacionadas con el corazón hacia la ΔZ total registrada. Sobre la base de esta observación, la combinación de los sacos de aire craneal y la silueta cardíaca como un solo ROI puede ser una opción posible. Un ROI específico de los sacos craneales permitiría una evaluación más localizada de la distribución de la ventilación dentro de regiones específicas de los sacos craneales. La utilización del contorno global como se realiza en este estudio incluirá inadvertidamente áreas con señales de impedancia no relacionadas, y puede disminuir la especificidad de los cambios en la distribución de la ventilación (9).
4.5 Distribución de la ventilación
Los resultados de este estudio confirmaron la primera hipótesis de que la EIT puede detectar cambios ventilatorios sutiles entre diferentes posiciones de decúbito. Los resultados también confirmaron la segunda hipótesis de que la decúbito afecta significativamente a las variables del EIT. Al mismo tiempo, también se proporciona información sobre los efectos del cambio de decúbito en la ventilación y su distribución. Se observó un desplazamiento constante de la ventilación hacia el área no dependiente. En decúbito dorsal, el CoVVD, ΔZRCD y ΔZLCD fueron significativamente menores que en decúbito ventral. En las decúbito laterales, la ventilación tendió a desplazarse hacia las regiones centrales no dependientes, como lo indica el ΔZR significativamente menorCD y ΔZRCV en decúbito lateral derecho que en el lateral izquierdo, y un ΔZL significativamente mayorCD y ΔZLCV en el lateral derecho que en el lateral izquierdo (Tabla 2). Se han reportado fenómenos similares en especies de mamíferos, incluyendo perros (14) y rinocerontes (40) durante la ventilación espontánea. Si bien los mamíferos no tienen sacos aéreos, cada alvéolo de mamíferos es conceptualmente comparable, pero funcionalmente distinto a los sacos aéreos, ya que ambos representan las estructuras distensibles que se expanden y contraen durante el ciclo ventilatorio. Estos cambios en la ventilación pueden explicarse por los cambios en la distensibilidad de los sacos aéreos, atribuidos a factores como la falta de diafragma, las compresiones de los órganos viscerales, la alteración de la forma de la pared corporal y la relajación de los músculos respiratorios que influyen en la capacidad residual funcional dentro de los sacos aéreos.
En los mamíferos, los cambios dinámicos en la distensibilidad pulmonar se explican mejor mediante una curva presión-volumen, que traza el volumen en el sistema pulmonar en puntos específicos de presión de las vías respiratorias. La curva es típicamente de forma sigmoidal: a una presión de expansión normal de -5 a -10 cmH2O presión durante la ventilación espontánea, la pendiente de la curva es pronunciada, lo que indica un buen cumplimiento; En los extremos de baja y alta presión, el gradiente de la curva es plano, lo que indica un bajo cumplimiento (41). Es probable que en la posición reclinada, la parte dependiente de los sacos de aire se desplace de la parte distensible empinada de la curva de inflado presión-volumen a la parte inferior plana no distensible de la curva, lo que permite que la parte no dependiente de los sacos de aire se llene preferentemente. Sin embargo, en un estudio canino de EIT, la decúbito afectó a la distribución de la ventilación solo cuando los perros estaban anestesiados, no cuando estaban conscientes (14). Nuestro estudio apoya que la anestesia general, tal vez a través de la relajación muscular, altera la distribución de la ventilación en las aves de manera comparable a la observada en los mamíferos.
4.6 Variación de la impedancia de marea
El parámetro TIV (AU) se ha utilizado como sustituto del volumen corriente en función de su relación lineal que se ha observado en múltiples especies domésticas (17-20). Del mismo modo, el TIV también debe representar el volumen de los sacos de aire craneal en las aves, tal como lo capta el EIT en forma de lente en este estudio. Los resultados de este estudio demostraron que no había diferencias en la TIV de los sacos de aire craneal entre las cuatro decúbitas. Esto indicó que el volumen total de gas en los sacos de aire craneal no se vio influenciado por un cambio en la decúbito, a pesar de las diferencias en la distribución de la ventilación descritas anteriormente.
Se han documentado alteraciones en el volumen total de los sacos aéreos y en el volumen corriente secundarias a cambios en la decúbito (42-44). Se han reportado disminuciones de hasta un 40%-50% en el volumen corriente en pollos cuando se cambia de decúbito a decúbito dorsal (42), postulándose que se debe a la compresión de los sacos de aire por los órganos viscerales. Esto ha llevado a recomendaciones clínicas para evitar la decúbito dorsal en aves (1, 6). Por el contrario, un estudio refutó esta noción como un volumen corriente significativamente mayor y un mayor PunO2 se encontró en decúbito dorsal que en decúbito lateral derecho, en halcones de cola roja anestesiados (44). Otros autores también sugieren evitar la decúbito ventral para minimizar la restricción del movimiento de la quilla (42, 43, 45, 46). En el presente estudio, solo se investigaron los sacos aéreos craneales. Estudios previos han implicado que los sacos aéreos caudales se ven afectados preferentemente durante los cambios de decúbito, debido a la presencia de vísceras como el tracto reproductor en el celoma caudal (6, 42). Sin embargo, el impacto de la compresión de los sacos aéreos caudales en el volumen corriente total puede variar entre las diferentes especies de aves, ya que la capacidad relativa de los sacos aéreos individuales varía ampliamente entre especies (22). Sin embargo, los cambios específicos en los sacos aéreos caudales no se investigaron en el presente estudio. Se requieren estudios adicionales para verificar el efecto de la decúbito en la ventilación de los sacos caudales y la ventilación total de las mareas. El uso adicional de la espirometría también sería útil para medir el volumen corriente y compararlo con la ventilación de los sacos aéreos craneales y caudales.
4.7 Patrón respiratorio
El uso de la EIT permitió cuantificar objetivamente los cambios en el patrón respiratorio. En este estudio, el método de categorización de la BrP utilizando la morfología de la curva de impedancia espiratoria se basó en el reportado en estudios de EIT en rinocerontes y caballos (40, 47). Fue interesante notar que tanto en la decúbito lateral derecho como en el izquierdo, la mayoría de los pollos demostraron contención de la respiración espiratoria temprana (BrP3). En comparación, se observó una variedad más amplia de BrP cuando los pollos estaban en decúbito dorsal o ventral. Los mecanismos que explican por qué cambian estos patrones respiratorios no están claros. Previamente se había sugerido que las alteraciones en los patrones respiratorios eran un mecanismo compensatorio para el autoreclutamiento de tejidos pulmonares colapsados en caballos y rinocerontes (40, 48). Un mecanismo compensatorio similar es posible en las aves para preservar la capacidad de los sacos de aire para mantener un flujo adecuado a través de los parabronquios tanto durante la inspiración como durante la espiración.
Alternativamente, es posible que estos cambios en los patrones respiratorios fueran consecuencias directas del posicionamiento. La inspiración y la espiración son procesos activos en las aves, por lo que la acción de los músculos respiratorios implicados durante la espiración puede verse comprometida cuando los pollos están en decúbito distinto de la posición erguida. La compresión de la pared del celoma dependiente y los cambios en la distensibilidad de los sacos de aire pueden afectar los patrones de flujo a través de los parabronquios al aumentar la resistencia al flujo (49-51). Además, se ha teorizado que el flujo espiratorio de los sacos de aire craneales contribuye de manera importante a la valvulación funcional que crea el flujo unidireccional, junto con otros factores como las variables de flujo de gas y la geometría estructural entre los sacos de aire y las vías respiratorias (52). Por lo tanto, la alteración del flujo espiratorio es lógica cuando se cambia la decúbito, ya que la capacidad de generar el flujo prototípico se ve comprometida.
4.8 Limitaciones y estudios futuros
Una limitación de este estudio fue la incapacidad de producir un ROI específico para los sacos aéreos craneales, por lo que el análisis de los datos se realizó utilizando solo el contorno externo global en su lugar. Por lo tanto, la distribución de la ventilación dentro de regiones específicas puede estar ocupada e influenciada por áreas no respiratorias relacionadas con el celoma. El desarrollo de un ROI de sacos aéreos craneales proporcionaría información más precisa sobre la distribución de la ventilación. Como se mencionó anteriormente, el desarrollo de un ROI que incorpore tanto los sacos de aire craneales como la silueta cardíaca puede ser una solución factible, ya que las señales relacionadas con el corazón contribuyeron mínimamente a la ΔZ global.
Otra limitación de este estudio es que solo se reclutó una población homogénea de pollos. La inclusión de pollos de otras razas, grupos de edad y sexo permitiría una mayor investigación sobre la utilidad de la EIT en pollos. Las aves muestran una inmensa biodiversidad en su forma y función. Por lo tanto, actualmente se desconoce la viabilidad de aplicar el EIT a otras aves.
En este estudio solo se investigaron los sacos aéreos craneales. Los estudios futuros deben investigar el uso de la EIT en los sacos aéreos caudales. Se deben considerar técnicas como el uso de EIT de dos planos para la detección simultánea de la ventilación de los sacos caudales. Se ha descrito el uso de EIT de dos planos en caballos, lo que permite capturar más tejidos en el eje longitudinal, a diferencia de un solo corte transversal con EIT estándar de un plano como se utiliza en este estudio. Las señales de impedancia obtenidas por el EIT de dos planos pueden reconstruirse en imágenes tridimensionales del tórax (53). La medición de los sacos aéreos craneales y caudales será importante para permitir una evaluación global de todo el sistema ventilatorio aviar. Por ejemplo, se ha demostrado que los grupos de sacos aéreos craneales y caudales contribuyen igualmente a la ventilación mareal en patos anestesiados (46).
Se investigaron los efectos de la decúbito sobre la ventilación con variables de la EIT como resultado secundario. Sin embargo, el impacto que tuvo la decúbito en el intercambio gaseoso estuvo fuera del alcance del estudio. Variables fisiológicas, como ETCO2 se registró principalmente para la monitorización estándar durante la anestesia. En este estudio, se utilizó un capnógrafo de flujo lateral y un sistema Mapleson D, sin reinhalación, para el protocolo de estudio de la EIT. Como el adaptador del capnógrafo se colocó junto al flujo de salida de gas fresco, el alto flujo de oxígeno requerido para evitar la reinhalación puede inducir turbulencias y dilución de la lectura de capnografía, lo que hace que ETCO2 no representativo de PunCO2 (54 y 55). El acuerdo entre ETCO2 y PaCO2 se ha demostrado que es poco fiable en aves anestesiadas ventiladas con un sistema sin reinhalación (8). Por lo tanto, se decidió no explorar estadísticamente el ETCO2 para evitar interpretaciones engañosas del efecto que la decúbito tiene sobre la ventilación.
Todavía no se ha determinado la posición óptima de decúbito para el sistema respiratorio durante la anestesia aviar. En la práctica clínica, el decúbito asignado depende principalmente de la naturaleza del procedimiento para optimizar el acceso quirúrgico y, en menor medida, del impacto sobre el sistema cardiorrespiratorio. En estudios futuros, la evaluación del intercambio gaseoso mediante análisis de gases arteriales; evaluación del sistema cardiovascular mediante la medición del gasto cardíaco; y la evaluación concurrente de los sacos aéreos caudales, deben considerarse para determinar la posición óptima de decúbito en aves bajo anestesia general.
También se debe explorar la monitorización cardiovascular mediante EIT. La medición de la frecuencia del pulso fue posible utilizando señales relacionadas con el corazón en caballos (56). Además, se ha demostrado que las señales hemodinámicas de la aorta proporcionan información sobre la precarga y la capacidad de respuesta a los líquidos en cerdos anestesiados (57). Estas funciones también pueden ser posibles en pollos, ya que en este estudio se observaron señales claras relacionadas con el corazón en la curva de impedancia-tiempo. Se requiere más investigación para desarrollar algoritmos que filtren y analicen estas señales relacionadas con el corazón.
También debe considerarse la aplicación práctica de la EIT para la monitorización respiratoria clínica en aves. La capacidad única de la EIT para evaluar la ventilación en tiempo real es ventajosa en la práctica clínica aviar, ya que la monitorización suele ser limitada. Los temas futuros de investigación incluyen el desarrollo de un cinturón más ergonómico y robusto que se adapte a varios tamaños de aves, métodos para mejorar el contacto de los electrodos y la detección de señales que no requieran el uso de suturas de soporte y desplume de plumas. Será necesario desarrollar más modelos de FE específicos para cada especie de aves.
5 Conclusión
La EIT se puede utilizar en pollos para controlar la ventilación mediante la detección de señales de impedancia que son sincrónicas con la ventilación. También se puede utilizar para detectar cambios en las variables del EIT cuando se cambia la posición de la decúbito. La EIT puede proporcionar información valiosa sobre la distribución de la ventilación y también una medida sustitutiva del volumen corriente en los sacos de aire craneales. La decúbito afectó la distribución de la ventilación, con tendencia a desplazarse hacia los sacos aéreos no dependientes. La decúbito influyó significativamente en la BrP, pero no afectó a los sacos aéreos craneales, a la TIV ni a la frecuencia respiratoria. Se requieren más estudios para investigar su utilidad para la práctica clínica.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
El estudio en animales fue aprobado por el Comité de Ética Animal de la Universidad de Murdoch. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
MM, HL y GM diseñaron la investigación y realizaron experimentos. AMW, HL, ADW, RB, TH y MM analizaron los datos. RB y TH realizaron el análisis estadístico. AMW y MM redactaron el manuscrito. Todos los autores interpretaron los resultados, editaron, revisaron y aprobaron la versión final del manuscrito.
Conflicto de intereses
DM era empleado de la empresa Brisbane Bird and Exotics Veterinary Service.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Speer B. Anestesia básica. En:Chitty J, Deborah M, , editores. Manual de Práctica Aviar de Bsava: Un Manual Básico. Inglaterra: Asociación Británica de Veterinarios de Pequeños Animales (2018). págs. 232-41.
2. Dobbs P, Moittié S, Liptovszky M. Mortalidad relacionada con la anestesia aviar y los factores de riesgo asociados en una colección zoológica del Reino Unido. Veterinario Anaesth Analg. (2021) 48:922–9. doi: 10.1016/j.vaa.2021.04.012
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Seamon AB, Hofmeister EH, Divers SJ. Evolución tras anestesia inhalatoria en aves en un hospital veterinario de referencia: 352 casos (2004-2014). J Am Vet Med Assoc. (2017) 251:814–7. doi: 10.2460/javma.251.7.814
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Brodbelt DC, Blissitt KJ, Hammond RA, Neath PJ, Young LE, Pfeiffer DU, et al. El riesgo de muerte: la investigación confidencial sobre las muertes perioperatorias de pequeños animales. Veterinario Anaesth Analg. (2008) 35:365–73. doi: 10.1111/j.1467-2995.2008.00397.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Johnston GM, Eastment JK, Wood J, Taylor PM. La investigación confidencial sobre las muertes perioperatorias de equinos (Cepef): resultados de mortalidad de las fases 1 y 2. Veterinario Anaesth Analg. (2002) 29:159–70. doi: 10.1046/j.1467-2995.2002.00106.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Ludders JW. Anestesia y analgesia en aves. En:Fish RE, Brown MJ, Danneman PJ, Karas AZ, , editores. Anestesia y Analgesia en Animales de Laboratorio, 2ª Edn. San Diego, CA: Academic Press (2008). págs. 481-500.
7. Nevarez JG. Monitorización durante la anestesia de aves y mascotas exóticas. Seminarios Aviar Exótica Pet Med. (2005) 14:277–83. doi: 10.1053/j.saep.2005.09.011
8. Desmarchelier M, Rondenay Y, Fitzgerald G, Lair S. Monitoreo del estado ventilatorio de aves rapaces anestesiadas mediante el uso de dióxido de carbono al final de la espiración medido con un capnómetro de microcorriente. J Zoo Wildl Med. (2007) 38:1–6. doi: 10.1638/05-033.1
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Brabant OA, Byrne DP, Sacks M, Moreno Martínez F, Raisis AL, Araos JB, et al. Tomografía de impedancia eléctrica torácica: la declaración de consenso veterinario de 2022. Front Vet Sci. (2022) 9:946911. doi: 10.3389/fvets.2022.946911
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Mosing M, Moens Y. Aplicaciones veterinarias de Eit. En:Adler A, Holder D, , editores. Tomografía de Impedancia Eléctrica: Métodos, Historia y Aplicaciones, 2ª Edn. Boca Ratón: Prensa CRC (2021). págs. 290-301.
11. Woo EJ, Hua P, Webster JG, Tompkins WJ. Método de elementos finitos en tomografía de impedancia eléctrica. Med Biol Eng Comput. (1994) 32:530–6. doi: 10.1007/BF02515311
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Grychtol B, Lionheart WR, Bodenstein M, Wolf GK, Adler A. Impacto del desajuste de la forma del modelo en la calidad de la reconstrucción en la tomografía de impedancia eléctrica. IEEE Trans Med Imaging. (2012) 31:1754–60. doi: 10.1109/TMI.2012.2200904
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Ambrisko TD, Schramel JP, Adler A, Kutasi O, Makra Z, Moens YP. Evaluación de la distribución de la ventilación mediante tomografía de impedancia eléctrica en caballos de pie. Physiol Meas. (2016) 37:175–86. doi: 10.1088/0967-3334/37/2/175
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Ambrisko TD, Schramel JP, Auer U, Moens YPS. Impacto de cuatro decúbidos diferentes en la distribución de la ventilación en perros beagle conscientes o anestesiados que respiran espontáneamente: un estudio de tomografía de impedancia eléctrica. PLoS Uno. (2017) 12:e0183340. doi: 10.1371/journal.pone.0183340
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Mosing M, Marly-Voquer C, MacFarlane P, Bardell D, Böhm SH, Bettschart-Wolfensberger R, et al. Distribución regional de la ventilación en caballos en decúbito dorsal durante la ventilación espontánea y mecánica evaluada por tomografía de impedancia eléctrica: una serie de casos. Veterinario Anaesth Analg. (2017) 44:127–32. doi: 10.1111/vaa.12405
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Sacks M, Byrne DP, Herteman N, Secombe C, Adler A, Hosgood G, et al. Tomografía de impedancia eléctrica para medir la distribución de la ventilación pulmonar en caballos sanos y caballos con sobrecarga de volumen cardíaco izquierdo. J Veterinario Pasante Med. (2021). doi: 10.1111/jvim.16227
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Adler A, Amyot R, Guardo R, Bates JHT, Berthiaume Y. Monitorización de los cambios en los volúmenes de aire y líquido pulmonar con tomografía de impedancia eléctrica. J Appl Physiol. (1997) 83:1762–7. doi: 10.1152/jappl.1997.83.5.1762
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Brabant O, Crivellari B, Hosgood G, Raisis A, Waldmann AD, Auer U, et al. Efectos de la peep en la relación entre el volumen corriente y el cambio de impedancia total medido mediante tomografía de impedancia eléctrica (Eit). J Clin Monit Comput. (2021) 121–10. DOI: 10.1007/s10877-021-00651-x
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Crivellari B, Raisis A, Hosgood G, Waldmann AD, Murphy D, Mosing M. Uso de la tomografía de impedancia eléctrica (Eit) para estimar el volumen corriente en caballos anestesiados sometidos a cirugía electiva. Animales. (2021) 11:350. doi: 10.3390/ani11051350
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Mosing M, Waldmann AD, Raisis A, Böhm SH, Drynan E, Wilson K. Monitorización de la ventilación de marea mediante tomografía de impedancia eléctrica en caballos anestesiados. Veterinario Equino J. (2019) 51:222–6. doi: 10.1111/evj.12998
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Shono A, Kotani T. Implicaciones clínicas de la monitorización de la ventilación regional mediante tomografía de impedancia eléctrica. J Cuidados Intensivos. (2019) 7:4. doi: 10.1186/s40560-019-0358-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Scheid P, Piiper J. Mecánica respiratoria y flujo de aire en aves. En:King AS, McLelland J, , editores. Forma y función en las aves. Londres: Academic Press (1989). págs. 369-91.
23. McNab BK. ¿Qué determina la tasa basal del metabolismo? J Exp Biol. (2019) 222:591. doi: 10.1242/jeb.205591
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Jetz W, Freckleton RP, McKechnie AE. Ambiente, tendencia migratoria, filogenia y tasa metabólica basal en aves. PLoS UNO. (2008) 3:E3261. doi: 10.1371/journal.pone.0003261
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Nopp P, Harris ND, Zhao TX, Brown BH. Modelo de las propiedades dieléctricas del tejido pulmonar humano frente a la frecuencia y el contenido de aire. Med Biol Eng Comput. (1997) 35:695–702. doi: 10.1007/BF02510980
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Nopp P, Rapp E, Pfützner H, Nakesch H, Ruhsam C. Propiedades dieléctricas del tejido pulmonar en función del contenido de aire. Phys Med Biol. (1993) 38:699–716. doi: 10.1088/0031-9155/38/6/005
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. McLelland J. Anatomía de los pulmones y los sacos de aire. En:King AS, McLelland J, , editores. Forma y función en las aves. Londres: Academic Press (1989). págs. 221-79.
28. Yushkevich PA, Piven J, Hazlett HC, Smith RG, Ho S, Gee JC, et al. Segmentación activa de contornos 3D guiada por el usuario de estructuras anatómicas: eficiencia y fiabilidad significativamente mejoradas. Neuroimagen. (2006) 31:1116–28. doi: 10.1016/j.neuroimage.2006.01.015
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Waldmann AD, Meira C, Bohm SH, Dennler M, Mosing M. Construcción de un modelo robusto de Beagle para aplicaciones de EIT. En:Ollmar S, Abtahi F, Erlandsson B-E, Janerot-Sjöberg B, Lindecrantz K, Mridha M, et al., , editores. 17ª Conferencia Internacional de Tomografía de Impedancia Eléctrica (EIT). Estocolmo: Swisstom (2016). Pág. 158.
30. Waldmann AD, Meira C, Auer U, Bohme S, Braun C, Bohm SH, et al. Contribución del modelo de elementos finitos de animales a la base de datos. En:Ollmar S, Abtahi F, Erlandsson B-E, Janerot-Sjöberg B, Lindecrantz K, Mridha M, et al., , editores. 17ª Conferencia Internacional de Tomografía por Impedancia Eléctrica. Estocolmo. Estocolmo: Swisstom (2016). Pág. 161.
31. McCall KE, Waldmann AD, Bohm SH, Rajapaksa A, Tan A, Perkins EJ, et al., editores. Uso de EIT para determinar el papel de la edad gestacional en la respuesta del volumen pulmonar durante la aireación al nacer: un estudio de viabilidad. 16ª Conferencia Internacional sobre Aplicaciones Biomédicas de la Tomografía por Impedancia Eléctrica. Neuchâtel: CSEM SA (2015).
32. Casteleyn C, Cornillie P, Van Cruchten S, Van den Broeck W, Van Ginneken C, Simoens P. Anatomía del tracto respiratorio inferior en aves domésticas, con énfasis en la respiración. Anat Histol Embrionario. (2018) 47:89–99. doi: 10.1111/ahe.12332
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Ambrosio AM, Carvalho-Kamakura TPA Ida KK, Varela B, Andrade F, Facó LL, et al. Se evaluó la distribución de la ventilación mediante tomografía de impedancia eléctrica y la influencia del volumen corriente, el reclutamiento y la presión positiva al final de la espiración en perros anestesiados con isoflurano. Veterinario Anaesth Analg. (2017) 44:254–63. doi: 10.1016/j.vaa.2016.06.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Chatziioannidis I, Samaras T, Nikolaidis N. Tomografía de impedancia eléctrica: ¿un nuevo método de estudio para el síndrome de dificultad respiratoria neonatal? Hipocracia. (2011) 15:211–5.
35. Sophocleous L, Frerichs I, Miedema M, Kallio M, Papadouri T, Karaoli C, et al. Rendimiento clínico de una nueva interfaz textil para tomografía de impedancia eléctrica de tórax neonatal. Physiol Meas. (2018) 39:044004. doi: 10.1088/1361-6579/aab513
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Brabant O, Loroesch S, Adler A, Waldmann AD, Raisis A, Mosing M. Evaluación del rendimiento del diseño y el material del electrodo para una correa de tomografía de impedancia eléctrica de animales grandes. Registro Veterinario. (2022) 191:E2184. DOI: 10.1002/VTR.2184
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Roth CJ, Ehrl A, Becher T, Frerichs I, Schittny JC, Weiler N, et al. Correlación entre la ventilación alveolar y las propiedades eléctricas del parénquima pulmonar. Physiol Meas. (2015) 36:1211–26. doi: 10.1088/0967-3334/36/6/1211
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Brackenbury JH. Determinantes físicos del patrón de flujo de aire dentro del pulmón aviar. Respir Physiol. (1972) 15:384–97. doi: 10.1016/0034-5687(72)90078-3
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Jones JH, Effmann EL, Schmidt-Nielsen K. Cambios en el volumen pulmonar durante la respiración en patos. Respir Physiol. (1985) 59:15–25. doi: 10.1016/0034-5687(85)90014-3
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Mosing M, Waldmann AD, Sacks M, Buss P, Boesch JM, Zeiler GE, et al. ¿Qué dificulta el intercambio gaseoso pulmonar y cambia la distribución de la ventilación en rinocerontes blancos inmovilizados (ceratotherium simum) en decúbito lateral? J Appl Physiol. (2020) 129:1140–9. doi: 10.1152/japplphysiol.00359.2020
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. West JB, Luks A. Mecánica de la respiración. En:West JB, Luks A, , editores. West’s Respiratory Physiology: The Essentials, 10ª ed. Filadelfia, Pensilvania: Lippincott Williams y Wilkins (2016). págs. 108-41.
42. Rey AS, Payne DC. La respiración normal y los efectos de la postura en Gallus domesticus. J Physiol. (1964) 174:340–7. doi: 10.1113/jphysiol.1964.sp007491
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Malka S, Hawkins MG, Jones JH, Pascoe PJ, Kass PH, Wisner ER. Efecto de la posición del cuerpo en los volúmenes del sistema respiratorio en halcones de cola roja anestesiados (buteo jamaicensis) medidos mediante tomografía computarizada. Am J Vet Res. (2009) 70:1155–60. doi: 10.2460/ajvr.70.9.1155
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Hawkins MG, Malka S, Pascoe PJ, Solano AM, Kass PH, Ohmura H, et al. Evaluación de los efectos de la decúbito dorsal versus lateral sobre el sistema cardiopulmonar durante la anestesia con isoflurano en halcones de cola roja (buteo jamaicensis). Am J Vet Res. (2013) 74:136–43. doi: 10.2460/ajvr.74.1.136
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Nevitt BN, Langan JN, Adkesson MJ, Mitchell MA, Henzler M, Drees R. Comparación del volumen de los sacos aéreos, el volumen pulmonar y las densidades pulmonares determinadas mediante el uso de tomografía computarizada en pingüinos de Humboldt (spheniscus humboldti) conscientes y anestesiados colocados en decúbito ventral, dorsal y lateral derecho. Am J Vet Res. (2014) 75:739–45. doi: 10.2460/ajvr.75.8.739
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Scheid P, Slama H, Willmer H. Volumen y ventilación de los sacos de aire en patos estudiados por lavado con gas inerte. Respir Physiol. (1974) 21:19–36. doi: 10.1016/0034-5687(74)90004-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Moreno-Martínez F, Byrne D, Raisis A, Waldmann AD, Hosgood G, Mosing M. Comparación de los efectos de un tubo endotraqueal o una máscara facial sobre el patrón de respiración y la distribución de la ventilación en caballos anestesiados. Front Vet Sci. (2022) 9:895268. doi: 10.3389/fvets.2022.895268
Resumen de PubMed | Texto completo de Crossref | Google Académico
48. Mosing M, Waldmann AD, MacFarlane P, Iff S, Auer U, Bohm SH, et al. Los caballos reclutan automáticamente sus pulmones mediante la retención de la respiración inspiratoria después de la recuperación de la anestesia general. PloS UNO. (2016) 11:E0158080-E. doi: 10.1371/journal.pone.0158080
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Brackenbury JH. Dinámica del flujo de aire en el pulmón aviar determinada por métodos directos e indirectos. Respir Physiol. (1971) 13:319–29. doi: 10.1016/0034-5687(71)90036-3
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Gillespie JR, Gendner JP, Sagot JC, Bouverot P. Impedancia del sistema respiratorio inferior en patos medida por oscilaciones forzadas durante la respiración normal. Respir Physiol. (1982) 47:51–68. doi: 10.1016/0034-5687(82)90092-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Urushikubo A, Nakamura M, Hirahara H. Efectos de la distensibilidad de los sacos de aire en el flujo en los parabronquios: dinámica de fluidos computacional utilizando un modelo anatómicamente simplificado de un sistema respiratorio aviar. J Biomed Ing. (2013) 06:483–92. doi: 10.4236/jbise.2013.64061
52. Butler JP, Banzett RB, Fredberg JJ. Válvulas inspiratorias en bronquios aviares: consideraciones aerodinámicas. Respir Physiol. (1988) 72:241–55. doi: 10.1016/0034-5687(88)90010-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
53. Grychtol B, Schramel JP, Braun F, Riedel T, Auer U, Mosing M, et al. Thoracic Eit in 3d: experiences and recommendations. Physiol Meas. (2019) 40:074006. DOI: 10.1088/1361-6579/AB291D
Resumen de PubMed | Texto completo de Crossref | Google Académico
54. Gravenstein N, Lampotang S, Beneken JEW. Factores que influyen en la capnografía en el circuito de baño. J Clin Monit. (1985) 1:6–10. doi: 10.1007/BF02832683
Resumen de PubMed | Texto completo de Crossref | Google Académico
55. Rich GF, Sullivan MP, Adams JM. ¿Es necesario el muestreo distal de Co2 al final de la espiración en sujetos pequeños? Anestesiología. (1990) 73:265–8. doi: 10.1097/00000542-199008000-00013
Resumen de PubMed | Texto completo de Crossref | Google Académico
56. Raisis AL, Mosing M, Hosgood GL, Secombe CJ, Adler A, Waldmann AD. Uso de la tomografía de impedancia eléctrica (Eit) para evaluar la frecuencia del pulso en caballos anestesiados. Veterinario J. (2021) 273:105694. doi: 10.1016/j.tvjl.2021.105694
Resumen de PubMed | Texto completo de Crossref | Google Académico
57. Trepte CJ, Phillips C, Solà J, Adler A, Saugel B, Haas S, et al. Tomografía de impedancia eléctrica para la evaluación no invasiva de la variación del volumen sistólico en la salud y la lesión pulmonar experimental. Hno. J Anaesth. (2017) 118:68–76. doi: 10.1093/bja/aew341
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: sacos aéreos, aves, aves, patrón respiratorio, distribución de la ventilación, decúbito, ventilación
Cita: Wong AM, Lum HY, Musk GC, Hyndman TH, Waldmann AD, Monks DJ, Bowden RS y Mosing M (2024) Tomografía de impedancia eléctrica en pollos anestesiados (Gallus domesticus). Frente. Vet. Sci. 11:1202931. doi: 10.3389/fvets.2024.1202931
Recibido: 09 de abril de 2023; Aceptado: 22 de enero de 2024;
Publicado: 13 marzo 2024.
Editado por:
Mojtaba Hoseini-Ghahfarokhi, Centro Hospitalario de la Universidad de Montreal (CRCHUM), Canadá
Revisado por:
Simone Ringer, Universidad de Zúrich, Suiza
Sandra Wenger, Kleintierpraxis Laupeneck, Suiza
Meng Dai, Cuarta Universidad Médica Militar, China
Derechos de autor © 2024 Wong, Lum, Musk, Hyndman, Waldmann, Monks, Bowden y Mosing. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Martina Mosing, m.mosing@vetmeduni.ac.at
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía