Transmisión transplacentaria del virus de la diarrea epidémica porcina
Transmisión transplacentaria del virus de la diarrea epidémica porcina
 Jihoon Ryu1†
Jihoon Ryu1†  Gi-Jong Kang2†
Gi-Jong Kang2†  Onnuri Kim2
Onnuri Kim2  Parque Jae-Yeon2
Parque Jae-Yeon2  Hyun-Jin Shin1,2*
Hyun-Jin Shin1,2*- 1Instituto de Investigación de Medicina Veterinaria, Daejeon, Corea del Sur
- 2Laboratorio de Enfermedades Infecciosas, Facultad de Medicina Veterinaria, Universidad Nacional de Chungnam, Daejeon, Corea del Sur
Debido a que el virus de la diarrea epidémica porcina (PEDV) es un patógeno crítico que resulta en una rápida propagación y altas tasas de mortalidad en lechones, se requiere comprender la ruta de transmisión del PEDV para su control. Hasta ahora, es bien sabido que las vías de transmisión del PEDV son diversas, como la vía fecal-oral, los piensos contaminados, los trabajadores agrícolas y los vehículos de transporte. Sin embargo, a diferencia de varios virus infectados por cerdos, no hubo informes de transmisión vertical con PEDV. En nuestro estudio, confirmamos la posible transmisión vertical del PEDV. Confirmamos la presencia de PEDV en testículos de lechones y cordones umbilicales de cerdas PEDV positivas. Estos hallazgos son evidencia directa de que la PEDV se transmite verticalmente a través de la placenta. Este es el primer informe sobre la transmisión transplacentaria del PEDV y será información muy importante para el control del PED.
Introducción
El virus de la diarrea epidémica porcina (PEDV) es el agente etiológico de la diarrea epidémica porcina (PED), que causa deshidratación, vómitos y diarrea acuosa aguda. Debido a que tiene una alta tasa de mortalidad en lechones recién nacidos, el PEDV es uno de los patógenos críticos que afectan a la industria porcina (1). El PEDV es un virus de ARN monocatenario, de sentido positivo y con envoltura que pertenece al género Alphacoronavirus, familia Coronaviridae, orden Nidovirales. Debido a que el PEDV se descubrió por primera vez en la década de 1970, el virus se ha propagado ampliamente en muchos países (2). La vía fecal-oral directa de los cerdos que ingieren heces o vómitos de cerdos infectados se considera generalmente la principal vía de transmisión del PEDV. Además, también se ha informado que la transmisión mecánica, como la de los vehículos de transporte, las personas que entran y trabajan en la granja y los piensos contaminados, son las principales vías de transmisión del PEDV (1, 3, 4). Alonso et al. (5) informaron que el PEDV también podría mostrar transmisión aérea bajo ciertas condiciones, y Sun et al. (3) y Li et al. (6) sugirieron que el PEDV puede diseminarse por transmisión en la leche a lechones lactantes como otra forma de transmisión oral. Identificamos muchos casos de lechones PED positivos y, curiosamente, algunos de ellos estaban relacionados con lechones de 1 día de edad. Con esta observación, asumimos una posible transmisión vertical del PEDV por vía transplacentaria. Sin embargo, la infección a través de la transmisión horizontal, como la cama, la ubre, la cerca y otros factores mecánicos, también puede tener una alta probabilidad. Sobre la base de nuestros resultados, no hubo pruebas convincentes de cómo se infectan los lechones de 1 día de edad, aparte de una posible transmisión vertical; Por lo tanto, nos interesó investigarlo. En este estudio, investigamos la posibilidad de transmisión del PEDV a través de una vía transplacentaria, que nunca se ha estudiado en el PEDV.
Materiales y métodos
Muestreo
Las cerdas se seleccionaron a ciegas durante el período de seguimiento en las granjas, que se habían notificado previamente como casos positivos de PED. Durante el período de exploración, no hubo síntomas clínicos asociados a PED ni en cerdas ni en lechones. Además, mantuvimos las condiciones asépticas para excluir la contaminación cruzada durante el muestreo el día del parto. A modo de ejemplo, se recogieron cordones umbilicales y testículos de cada lechón utilizando tijeras y fórceps esterilizados en autoclave. Además, se utilizaron un conjunto separado de instrumentos, tubos y bolsas para aislar la muestra individual. Para minimizar la contaminación del medio ambiente, como la ubre y la cama, limpiamos tanto como fue posible y recolectamos muestras con mucho cuidado. Para este estudio se recogieron un total de 50 testículos (un testículo por lechón) y 13 cordones umbilicales. Los testículos y los cordones umbilicales se lavaron cinco veces en solución salina tamponada con fosfato (PBS) y se congelaron a -80 °C hasta su uso en experimentos.
Reacción en cadena de la polimerasa con transcripción inversa
Se llevó a cabo una RT-PCR para la membrana (M) de PEDV altamente conservada entre diferentes cepas de PEDV. Los testículos congelados se transfirieron en nitrógeno líquido y se trituraron hasta convertirlos en polvo en un mortero, y el ARN total se extrajo utilizando AllspinTM (GeneAll, Corea). La transcripción inversa a ADNc se realizó utilizando el kit de síntesis de ADNc SuperiorScript III (Enzynomics, Corea) con 1 μg de ARN total. Las secuencias de cebadores del dominio N-terminal (NTD) de PEDV M y S1 utilizadas fueron las siguientes: adelante: 5′- ATGTCTAACGGTTCTATTCCCG-3′ y reversa: 5′-GACTAAATGAAGCACTTTCTCAC-3′ para PEDV M; y hacia adelante: 5′-ATGAAGTCTTTAACCTACTT-3′ y hacia atrás: 5′-AACATATTGCATAGCACAACC-3′ para PEDV S1 NTD. La amplificación por PCR se realizó utilizando 2X TOPsimples DyeMIX-tenuto (Enzinomía) y las siguientes condiciones de ciclo: Desnaturalización durante 10 min a 95 °C, 30 ciclos de 30 s a 95 °C, 30 s a 58 °C y 45 s a 72 °C; y una extensión final de 7 minutos a 72 °C. Los productos de PCR se separaron en electroforesis en gel de agarosa al 0,8% y se visualizaron utilizando Lumino Graph II (ATTO, Japón).
Inmunohistoquímica
La IHQ se realizó utilizando testículos que muestran resultados positivos o negativos en la RT-PCR. Los tejidos testiculares se fijaron en formol, se incluyeron en parafina y se cortaron en secciones de 3 μm. Para detectar el PEDV, los portaobjetos se desparafinaron en xileno y se rehidrataron mediante etanol graduado. La actividad de la peroxidasa endógena en el tejido se bloqueó con peróxido de hidrógeno al 3%. Después de bloquear con suero de cabra normal al 5%, los portaobjetos se incubaron con anticuerpo monoclonal anti-PEDV casero como dilución 1:100 en 0,1 ml de diluyente de anticuerpos SignalStain® (Cell Signaling Technology, Beverly, MA). A continuación, se aplicó Alexa Fluor Plus 488 Alexa Fluor Plus 1 (ThermoFisher Scientific, Waltham, MA) como anticuerpo secundario a una concentración de 2 μg/ml durante 33 h a temperatura ambiente. Se utilizó un colorante Hoechest 342.2000 para teñir los núcleos, y los portaobjetos se montaron en un medio de montaje de fluorescencia antidecoloración (Abcam, Cambridge, MA) y luego se lavaron. Los tejidos teñidos se examinaron bajo microscopio de fluorescencia (Optinity KI-3F; Korea Lab Tech, Corea), y las imágenes se analizaron utilizando el software Optinity OpticView v7.<> (Korea Lab Tech).
Aislamiento de virus
Para el aislamiento del virus, las células Vero se sembraron en placas de cultivo celular de 12 pocillos (1,5 × 105 celdas por pocillo). Los cordones umbilicales congelados se homogeneizaron con 10 volúmenes de medios esenciales mínimos (MEM) preenfriados y libres de suero que contenían antibióticos y luego se centrifugaron a 3.000 rpm durante 15 min. Los sobrenadantes se filtraron a través de 0,45 μm y las células Vero se infectaron con 100 μl de homogeneizados tisulares. Después de la incubación inicial durante 2 h, las células se lavaron con PBS tres veces y se reemplazaron con un MEM fresco que contenía 5 μg/ml de tripsina (BioShop, Canadá) y un 2% de antibiótico-antimicótico (Gibco, Reino Unido). Los pasajes ciegos continuaron hasta que se observaron efectos citopáticos (CPE).
Resultados
Identificación del PEDV en los testículos de los lechones
Para probar la posibilidad de que el PEDV pueda transmitirse por vía transplacentaria, se recolectaron un total de 50 testículos de lechones y 13 cordones umbilicales el día del nacimiento, y las muestras individuales se colocaron en bolsas resellables para evitar la contaminación cruzada. Los testículos y los cordones umbilicales se lavaron cinco veces en PBS y se congelaron a -80 °C hasta su uso en los experimentos. Para confirmar el PEDV en lechones nacidos de cerdas PEDV positivas, se realizó una RT-PCR, dirigida a un gen PEDV M altamente conservado. Los testículos congelados se transfirieron a nitrógeno líquido y se trituraron hasta convertirlos en polvo en un mortero, y se realizó la extracción de ARN total, la transcripción inversa a ADNc y la PCR como se describió anteriormente (7). Se encontró que 16 de las 50 muestras de testículos analizadas fueron positivas para PEDV (Figura 1A). Como se recogieron inmediatamente después del nacimiento y no tenían otras posibles fuentes de infección, estos resultados positivos para la PCR confirmaron claramente la infección antes de que nacieran.
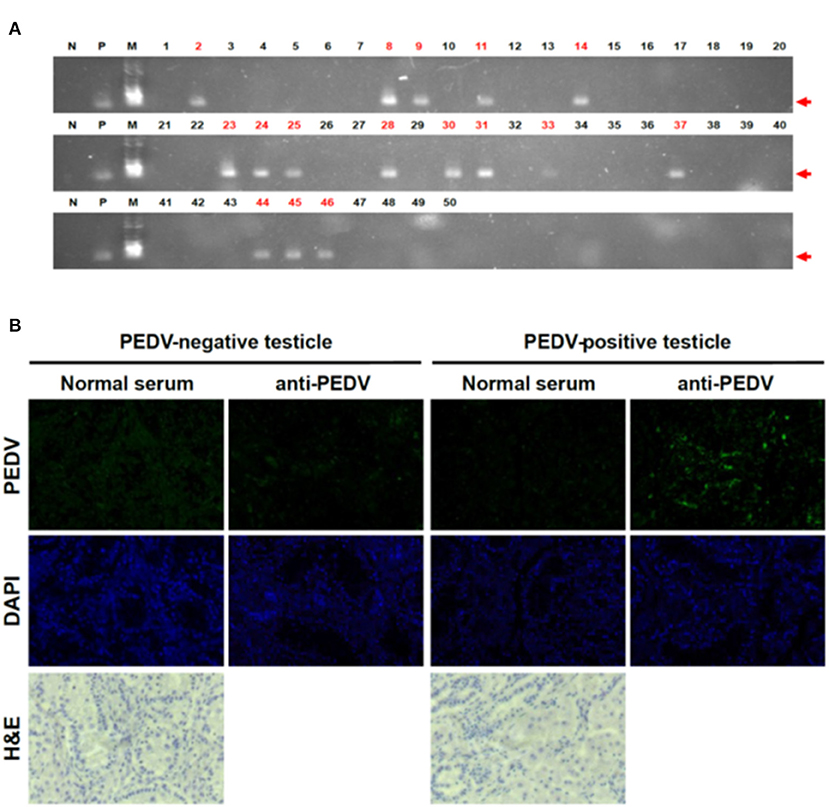 FIGURA 1. Detección de PEDV en tejidos de testículos de lechones. A) Resultados de la RT-PCR en testículos de lechones. Se realizó una RT-PCR dirigida al gen PEDV M (N, control negativo; P: control positivo; M, marcador). Los números rojos indican muestras positivas. (B) IHQ en muestras de testículos confirmó claramente PEDV positivo. Utilizamos sueros positivos para PEDV como anticuerpo primario y utilizamos IgG anti-ratón conjugada con Alexa 488 como segundo anticuerpo.
FIGURA 1. Detección de PEDV en tejidos de testículos de lechones. A) Resultados de la RT-PCR en testículos de lechones. Se realizó una RT-PCR dirigida al gen PEDV M (N, control negativo; P: control positivo; M, marcador). Los números rojos indican muestras positivas. (B) IHQ en muestras de testículos confirmó claramente PEDV positivo. Utilizamos sueros positivos para PEDV como anticuerpo primario y utilizamos IgG anti-ratón conjugada con Alexa 488 como segundo anticuerpo.
Para excluir errores técnicos por RT-PCR, se reconfirmaron los resultados por IHQ con testículos que mostraron resultados positivos o negativos de RT-PCR. De acuerdo con los resultados de la RT-PCR, se observaron señales muy fuertes en los tejidos (Figura 1B). Los resultados de la IHQ confirmaron claramente que no solo el genoma del PEDV, sino también las proteínas del PEDV estaban presentes en las muestras de testículos de lechones recién nacidos. Estos resultados respaldan fuertemente nuestro hallazgo de que los lechones estaban infectados por PEDV antes de nacer, lo que confirma la infección a través de la placenta.
Identificación del PEDV en el cordón umbilical
Entre las enfermedades virales porcinas, el virus del síndrome respiratorio y reproductivo porcino (PRRSV), el virus de la peste porcina clásica (PPC) y el circovirus porcino (PCV) son virus representativos que muestran transmisión transplacentaria, durante la cual los virus generalmente se encuentran en el cordón umbilical, la sangre del cordón umbilical o la placenta (8-10). Sin embargo, no ha habido informes sobre la transmisión vertical de PEDV. Sun et al. informaron que la transmisión a través de la leche es una de las posibles vías de propagación del PEDV de las cerdas a los lechones lactantes. Sin embargo, sus resultados solo confirmaron la posible transmisión por leche de cerda, y no se comprobó transmisión vertical (3, 6). Sin embargo, para confirmar la transmisión vertical, es necesario demostrar que el virus se transmite a través de la placenta antes del parto, lo que significa que los lechones ya tienen PEDV en el momento del nacimiento.
En nuestro estudio, dado que se encontró PEDV en testículos de lechones neonatos, especulamos que PEDV podría transmitirse a través de la placenta de la cerda a los lechones en el útero. Para verificar nuestra hipótesis, se realizó una RT-PCR para detectar el PEDV en los tejidos del cordón umbilical. Encontramos que dos de las 13 muestras de cordón umbilical fueron positivas (Figura 2A). Debido a que el gen de la espícula (S) es crucial para la caracterización y diferenciación de los PEDV, se realizó una RT-PCR dirigida a la región parcial del PEDV S1 [621 pares de bases (pb)] que es la más variable. Las secuencias se analizaron utilizando BLAST del Centro Nacional de Información Biotecnológica y se compararon con varias secuencias de referencia del gen PEDV S en GenBank. El análisis filogenético sobre la base de PEDV S1 parcial se realizó utilizando el software MEGA-X por el método de unión de vecinos con 1.000 réplicas de bootstrap. Los resultados de la homología de secuencia indicaron que PEDV S1 de cordones umbilicales mostró identidades nucleotídicas del 94-95% con la cepa DR1 del grupo G13a (Figura 2B). Los resultados del árbol filogenético confirmaron fuertemente que estos PEDV encontrados en cordones umbilicales mostraron una alta homología con las cepas de PEDV G1a (Figura 2C).
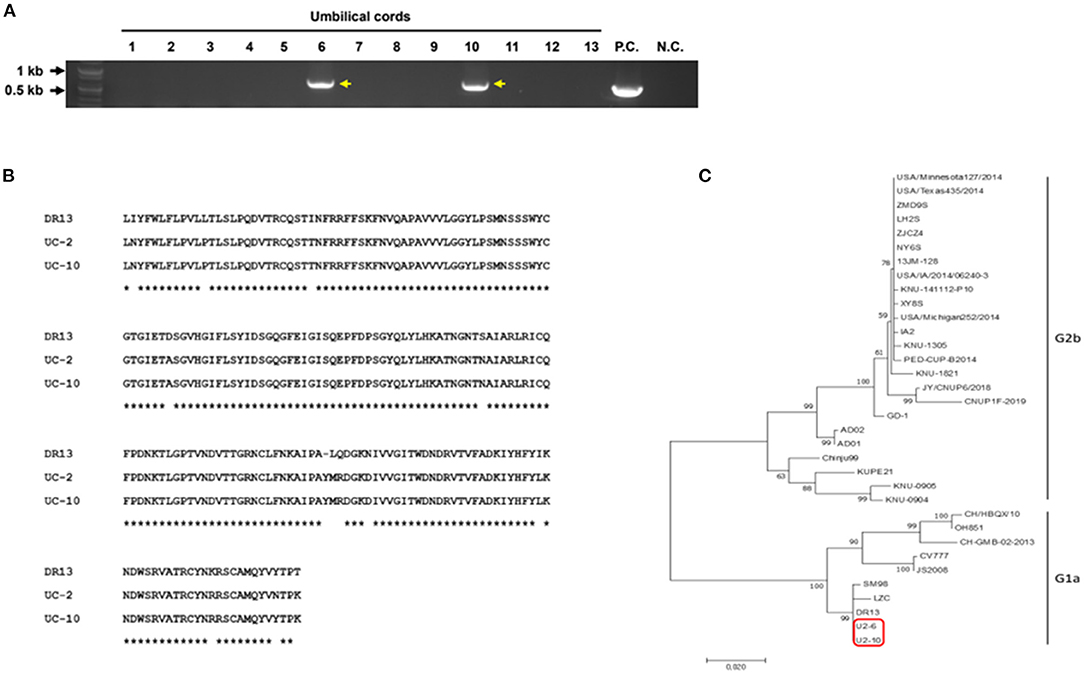 FIGURA 2. Detección y caracterización del PEDV a partir de tejidos de cordón umbilical. (A) resultados de RT-PCR en 13 cordones umbilicales dirigidos al gen PEDV M (P.C., control positivo; N.C., control negativo). (B) Alineación de aminoácidos de la proteína de pico parcial de PEDV. Se secuenció el pico parcial del PEDV. * indica secuencias idénticas. (C) Árbol filogenético de genes parciales de la espícula del PEDV de cepas de PEDV publicadas de GenBank y PEDV de cordones umbilicales (recuadro rojo).
FIGURA 2. Detección y caracterización del PEDV a partir de tejidos de cordón umbilical. (A) resultados de RT-PCR en 13 cordones umbilicales dirigidos al gen PEDV M (P.C., control positivo; N.C., control negativo). (B) Alineación de aminoácidos de la proteína de pico parcial de PEDV. Se secuenció el pico parcial del PEDV. * indica secuencias idénticas. (C) Árbol filogenético de genes parciales de la espícula del PEDV de cepas de PEDV publicadas de GenBank y PEDV de cordones umbilicales (recuadro rojo).
Aislamiento del PEDV de los cordones umbilicales
Se procedió a la toma de muestras positivas para RT-PCR para el aislamiento del virus. Además, encontramos una clara formación de CPE por PEDV aislado (Figura 3C), pero no en las células Vero no infectadas (Figura 3A). El aislado produjo un CPE típico y claro, similar con otros PEDV en células Vero en el laboratorio. El aislamiento se realizó mediante ensayo inmunofluorescente (IFA) utilizando anticuerpos anti-PEDV (Figuras 3B, D). Los anticuerpos contra el PEDV se detectaron en el mismo lugar donde se formó el CPE (Figura 3D).
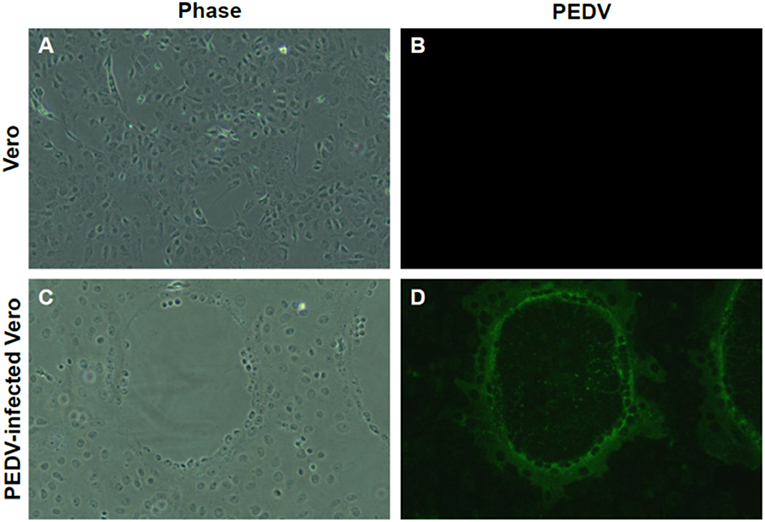 FIGURA 3. Aislamiento del PEDV del cordón umbilical. (A,B) Células Vero no infectadas. (C) EFECTO citopático (CPE) formación de PEDV recién aislado del cordón umbilical. Se encontró una clara formación de CPE, como la aglomeración y fusión celular, en las células Vero infectadas con células recién aisladas. (D) Confirmación de infección por PEDV por IFA. Confirmación de PEDV y su replicación por IFA utilizando sueros positivos para PEDV. Aumento, ×400.
FIGURA 3. Aislamiento del PEDV del cordón umbilical. (A,B) Células Vero no infectadas. (C) EFECTO citopático (CPE) formación de PEDV recién aislado del cordón umbilical. Se encontró una clara formación de CPE, como la aglomeración y fusión celular, en las células Vero infectadas con células recién aisladas. (D) Confirmación de infección por PEDV por IFA. Confirmación de PEDV y su replicación por IFA utilizando sueros positivos para PEDV. Aumento, ×400.
Discusión
Aunque los programas de vacunación continua están en curso en todo el mundo, al menos en Corea, y todos los cerdos son vacunados cada año, hay muchos problemas de PEDV que siguen sin estar claros. En los estudios epidemiológicos de PED, son muy comunes los brotes repetidos en las mismas granjas que habían experimentado previamente brotes de PED. Se han descrito varios métodos de transmisión del PEDV y, entre ellos, el contacto directo con heces infectadas podría ser la principal fuente de transmisión. Hasta la fecha, no ha habido informes sobre la transmisión vertical del PEDV a través de la vía transplacentaria.
En este estudio, reportamos evidencia directa de transmisión transplacentaria de PEDV mediante la detección del virus en cordones umbilicales y testículos de lechones de un día. Planteamos la hipótesis de que las cerdas portadoras asintomáticas son la principal fuente de infección por PEDV porque encontramos muchas muestras positivas de PEDV entre los lechones recién nacidos. Nuestros hallazgos en este estudio apoyan claramente nuestra hipótesis. Aunque se ha informado previamente que la infección por PEDV podría ocurrir a través del calostro o la leche, nuestros resultados confirman claramente que la infección por PEDV ocurrió mucho antes, antes del nacimiento. Los lechones se infectaron en el útero o a través de la placenta, y los lechones nacieron con la infección. Esta es la única manera de explicar cómo los lechones de 1 día de edad se infectaron con PEDV.
En los estudios de referencia, se ha confirmado la transmisión vertical de varias enfermedades virales en cerdos, como el virus de la peste porcina, el parvovirus porcino, el PCV y el PRRSV. Debido a que estos virus causan principalmente trastornos reproductivos como el aborto y la muerte fetal, la transmisión vertical se considera una ruta de propagación crítica y un impacto financiero significativo en la industria porcina (9, 11, 12). Las posibles vías de transmisión vertical son a través de la placenta, la infección durante o después del nacimiento, o a través del calostro. También se ha estudiado que, entre estas vías de transmisión vertical, la transmisión transplacentaria está estrechamente relacionada con una infección persistente en la que los virus se perpetúan en las piaras de cerdos (13-16). Debido a esta importante razón, un PEDV circulante en la granja porcina y un brote no regulado podrían explicarse por nuestro hallazgo.
Sin embargo, se necesitan estudios adicionales. Nuestra pregunta principal ahora es cómo las cerdas adquirieron el PEDV. Este podría ser un hallazgo muy importante con implicaciones para el control de los brotes de PEDV. Aquí, informamos, por primera vez, la detección de transmisión vertical de PEDV. Nuestros datos proporcionan información novedosa y muy importante sobre la vía de transmisión del PEDV y serán útiles para establecer una estrategia de vacunación para el PEDV.
Conclusiones
El objetivo de nuestro estudio es encontrar evidencia sobre la transmisión vertical del PEDV. Hasta donde llega nuestro conocimiento actual, este es el primer informe que proporciona resultados científicos para la transmisión vertical del PEDV a través de la placenta. Encontramos PEDV en los tejidos testiculares de lechones y en los cordones umbilicales de cerdas PEDV positivas mediante análisis molecular e inmunológico. Además, el PEDV se aisló con éxito de los cordones umbilicales. Estos resultados apoyan fuertemente que el PEDV se transmite verticalmente de la cerda a los lechones. A pesar de la necesidad de más estudios para complementar nuestros resultados, al menos encontramos que la propagación del PEDV está ocurriendo a través de rutas más diversas de lo que pensamos. Además, nuestros hallazgos serán útiles para diseñar un programa de vacunación para prevenir la propagación del PEDV.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres de los repositorios y los números de acceso se pueden encontrar en el artículo/Material complementario.
Declaración de Ética
No se requirió revisión y aprobación ética para el estudio con animales porque se trata de estudios en la granja y en el estudio de campo.
Contribuciones de los autores
H-JS y JR redactaron el manuscrito y todos los autores contribuyeron a la interpretación general de los datos y a la redacción. Además, H-JS supervisó la RT-PCR, la inmunohistoquímica y el análisis de secuenciación. G-JK y JR recolectaron testículos y cordones umbilicales en la granja porcina y realizaron inmunohistoquímica y RT-PCR. OK y J-YP realizaron inmunohistoquímica y análisis de secuenciación. Todos los autores leyeron y aprobaron el manuscrito final.
Financiación
Esta investigación contó con el apoyo de una subvención del Programa de Desarrollo Tecnológico para la Agricultura y la Silvicultura del Ministerio de Alimentación, Agricultura, Silvicultura y Pesca de la República de Corea.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2021.802816/full#supplementary-material
Referencias
1. Lee C. Virus de la diarrea epidémica porcina: un virus porcino epizoótico emergente y reemergente. Virol J. (2015) 12:193. doi: 10.1186/s12985-015-0421-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Jung K, Saif LJ, Wang Q. Virus de la diarrea epidémica porcina (PEDV): una actualización sobre etiología, transmisión, patogénesis y prevención y control. Virus Res. (2020) 286:198045. doi: 10.1016/j.virusres.2020.198045
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Sun R-Q, Cai R-J, Chen Y-Q, Liang P-S, Chen D-K, Song C-X. Brote de diarrea epidémica porcina en lechones lactantes, China. Infect Dis. (2012) 18:161–3. doi: 10.3201/eid1801.111259
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Jung K, Saif LJ. Infección por el virus de la diarrea epidémica porcina: etiología, epidemiología, patogenia e inmunoprofilaxis. Veterinario J. (2015) 204:134–43. doi: 10.1016/j.tvjl.2015.02.017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Alonso C, Goede DP, Morrison RB, Davies PR, Rovira A, Marthaler DG, et al. Evidencia de infectividad del virus de la diarrea epidémica porcina transmitido por el aire y detección de ARN viral en el aire a largas distancias de los rebaños infectados. Res. Veterinaria. (2014) 45:73. DOI: 10.1186/s13567-014-0073-z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Li R, Tian X, Qiao S, Guo J, Xie W, Zhang G. Secuencia completa del genoma de la variante del virus de la diarrea epidémica porcina CH/HNYF/2014. Anuncio del genoma. (2015) 3:E01486–01415. doi: 10.1128/genomea.01486-15
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Park J-Y, Ryu J, Shin H-J. Aislamiento del nuevo virus de la diarrea epidémica porcina (PEDV), cepa CNUP6-2018 en Corea del Sur y sus características genéticas. J Prev Medicina Veterinaria. (2019) 43:234–8. doi: 10.13041/jpvm.2019.43.4.234
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Canó JP, Dee SA, Murtaugh MP, Rovira A, Morrison RB. Dinámica de la infección y manifestaciones clínicas tras la inoculación experimental de primerizas a los 90 días de gestación con una dosis baja del virus del síndrome respiratorio y reproductivo porcino. Can J Vet Res. (2009) 73:303–7.
9. Rose N, Opriessnig T, Grasland B, Jestin A. Epidemiología y transmisión del circovirus porcino tipo 2 (PCV2). Virus Res. (2012) 164:78–89. doi: 10.1016/j.virusres.2011.12.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Zhao Y, Wang T, Yao L, Liu B, Teng C, Ouyang H. El virus de la peste porcina clásica se replicó pobremente en células de cerdos transgénicos MxA. BMC Vet Res. (2016) 12:169. doi: 10.1186/s12917-016-0794-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Mims CA. Transmisión vertical de virus. Microbiol Rev. (1981) 45:267-86. DOI: 10.1128/mr.45.2.267-286.1981
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Martín-Valls GE, Hidalgo M, Cano E, Mateu E. Las pruebas de cordones umbilicales mediante PCR en tiempo real son adecuadas para evaluar la transmisión vertical del virus del síndrome respiratorio y reproductivo porcino en condiciones de campo. Veterinario J. (2018) 234:27–9. doi: 10.1016/j.tvjl.2018.01.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Park Y, Oh Y, Wang M, Ganges L, Bohórquez JA, Park S, et al. Una nueva vacuna de marcadores de subunidades de glicoproteína E2 producida en plantas es capaz de prevenir la transmisión vertical del virus de la peste porcina clásica después de la doble vacunación. Vacunas. (2021) 9:418. doi: 10.3390/vaccines9050418
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Van Oirschot JT. Producción experimental de infecciones congénitas persistentes de peste porcina: I. observaciones clínicas, patológicas y virológicas. Microbiol veterinario. (1979) 4:117–32. doi: 10.1016/0378-1135(79)90048-8
15. Bohórquez JA, Wang M, Pérez-Simó M, Vidal E, Rosell R, Ganges L. Baja relación CD4/CD8 en la infección persistente posnatal de la peste porcina clásica generada a las 3 semanas del nacimiento. Transbound Emerg Dis. (2019) 66:752–62. doi: 10.1111/tbed.13080
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Henke J, Carlson J, Zani L, Leidenberger S, Schwaiger T, Schlottau K, et al. Protección contra la transmisión transplacentaria del virus de la peste porcina clásica moderadamente virulenta mediante la vacuna de marcadores vivos «CP7_E2alf». Vacuna. (2018) 36:4181–7. doi: 10.1016/j.vaccine.2018.06.014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: virus de la diarrea epidémica porcina (PEDV), transmisión vertical, transmisión transplacentaria, testículos de lechón, cordones umbilicales
Cita: Ryu J, Kang G-J, Kim O, Park J-Y y Shin H-J (2022) Transmisión transplacentaria del virus de la diarrea epidémica porcina. Frente. Vet. Sci. 8:802816. doi: 10.3389/fvets.2021.802816
Recibido: 27 de octubre de 2021; Aceptado: 31 de diciembre de 2021;
Publicado: 15 marzo 2022.
Editado por:
Shao-Lun Zhai, Academia de Ciencias Agrícolas de Guangdong, China
Revisado por:
Enric M. Mateu, Universitat Autònoma de Barcelona, España
Dongbo Sun, Universidad Agrícola de Heilongjiang Bayi, China
Derechos de autor © 2022 Ryu, Kang, Kim, Park y Shin. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Hyun-Jin Shin, shin0089@cnu.ac.kr
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía


