Tratamiento adyuvante con toceranib para un carcinoma de células renales
Caso clínico: Tratamiento adyuvante con toceranib para un carcinoma de células renales resecado de forma incompleta con sospecha de metástasis pulmonar en un perro
 Da-Eun Lee1
Da-Eun Lee1  Chang-Hoon Nam2
Chang-Hoon Nam2  Hun-Young Yoon2
Hun-Young Yoon2  Kieun Bae3
Kieun Bae3  Kyoung-Ah Yoon3
Kyoung-Ah Yoon3  Jung-Hyun Kim1*
Jung-Hyun Kim1*- 1Departamento de Medicina Interna Veterinaria, Facultad de Medicina Veterinaria, Universidad de Konkuk, Seúl (República de Corea)
- 2Departamento de Cirugía Veterinaria, Facultad de Medicina Veterinaria, Universidad de Konkuk, Seúl (República de Corea)
- 3Departamento de Bioquímica, Facultad de Medicina Veterinaria, Universidad de Konkuk, Seúl (República de Corea)
La neoplasia renal primaria es rara en humanos y perros, siendo el carcinoma de células renales (CCR) la forma más común de este cáncer. Dado que el CCR a menudo se diagnostica en una etapa avanzada, con frecuencia se observan metástasis pulmonares. Los inhibidores de la tirosina cinasa (ITC) son los tratamientos adyuvantes estándar para el CCR metastásico en humanos. De manera similar, en medicina veterinaria, los ensayos recientes han empleado ITC para pacientes con CCR en estadio temprano que se sometieron a resección quirúrgica completa y no mostraron metástasis a distancia. Sin embargo, el uso de ITC aún no se ha reportado comúnmente en casos de CCR avanzado con metástasis. Este estudio de caso presenta los primeros resultados clínicos de la terapia con ITC en un perro con CCR y metástasis resecados de forma incompleta. Una hembra chihuahua esterilizada de 5 años de edad fue remitida a nuestro hospital con una masa renal derecha y múltiples nódulos pulmonares sospechosos de metástasis. Se extirpó quirúrgicamente una parte de la masa renal y el examen histopatológico reveló CCR con un índice mitótico elevado. Se administró quimioterapia adyuvante, debido a la resección incompleta con sospecha de metástasis pulmonar. Se realizó una prueba de predicción de la respuesta a medicamentos contra el cáncer utilizando tejidos de pacientes. Dado que toceranib mostró la respuesta más favorable, se seleccionó como agente terapéutico. Toceranib se administró por vía oral a una dosis de 2,27 mg/kg cada 48 h. Se obtuvieron registros médicos regulares para detectar posibles efectos adversos, incluida la presión arterial sistémica, el hemograma completo, el examen bioquímico del suero y el análisis de orina. Después de 2 semanas de tratamiento con toceranib, la remisión parcial de los nódulos pulmonares continuó durante 2 meses. El paciente no experimentó ningún efecto adverso del medicamento contra el cáncer durante el período de seguimiento de 4 meses. Sin embargo, el paciente falleció por una causa no identificada 6 meses después de la detección inicial de la masa renal. Este informe describe el uso de toceranib en perros con CCR. En el presente caso, el paciente mostró una respuesta inicial a la quimioterapia y, a pesar de la presencia de varios factores de mal pronóstico, el perro sobrevivió más allá de los 3 meses de vida esperados a los 6 meses. Cabe destacar que no se observaron eventos adversos durante el tratamiento.
1. Introducción
La neoplasia renal primaria no se encuentra con frecuencia en perros, con una prevalencia del 0,3-1,5% entre todas las neoplasias primarias caninas (1). El carcinoma de células renales (CCR) constituye aproximadamente el 49-65% de todas las neoplasias renales primarias (2). Los signos comúnmente reportados de neoplasia renal en perros incluyen pérdida de peso, letargo, hematuria, polidipsia, poliuria y hematuria (3). El CCR a menudo se identifica en una etapa avanzada de la enfermedad, con un 18-48% de los casos que muestran hallazgos radiográficos sugestivos de metástasis pulmonar en las imágenes torácicas (1). La nefrectomía se considera la principal opción de tratamiento para el CCR en perros y se ha informado que da lugar a períodos de supervivencia más largos en comparación con los casos en los que solo se administra terapia médica (3).
Los inhibidores de la tirosina quinasa (TKI) son pequeñas moléculas que se unen a los receptores tirosina quinasas (RTK) e inhiben la fosforilación de las proteínas diana posteriores (4). En medicina veterinaria, los ITC se han desarrollado como opciones terapéuticas para los tumores de mastocitos que no se pueden extirpar quirúrgicamente en perros (4). El fosfato de toceranib, un ITC, se emplea ampliamente en oncología veterinaria y ha sido aprobado como agente terapéutico dirigido por la Administración de Alimentos y Medicamentos (5). En comparación con la cirugía sola, se ha demostrado que el uso de fosfato de toceranib como quimioterapia adyuvante para el adenocarcinoma, incluido el CCR, en perros aumenta la mediana del tiempo hasta la progresión en comparación con la cirugía sola (6). En medicina humana, los ITC son el tratamiento estándar para el CCR metastásico (CCRm) y se ha demostrado su eficacia (7-9). El tratamiento para el CCRm consiste en dirigirse al factor de crecimiento endotelial vascular y a la diana de las vías de la rapamicina en los mamíferos (10). En el presente caso, un perro con un CCR resecado de forma incompleta y sospecha de metástasis pulmonar fue sometido a nefrectomía seguida de quimioterapia adyuvante con toceranib. En este informe se analizan la presentación clínica, el proceso diagnóstico, el enfoque terapéutico y las aplicaciones de toceranib en el tratamiento del CCR en un canino.
2. Descripción del caso
Una hembra de Chihuahua esterilizada de 5 años de edad, con un peso de 2.2 kg, fue remitida a nuestra institución para la evaluación de una masa renal derecha y múltiples nódulos pulmonares detectados durante un chequeo médico por anorexia en un hospital de animales local. El propietario informó que el paciente mostró una disminución repentina del apetito y el nivel de energía. El paciente también mostró ocasionalmente respiración con la boca abierta y aumento de la frecuencia respiratoria. El examen físico reveló signos vitales normales, incluyendo temperatura corporal, frecuencia del pulso, frecuencia respiratoria y presión arterial.
El hemograma completo (CSC) no mostró hallazgos notables. El perfil bioquímico sérico mostró hiperglobulinemia (4,6 g/dL; rango de referencia, 2,5-4,5 g/dL), elevación de la aspartato aminotransferasa (99 U/L; rango de referencia, 0-50 U/L) y gamma-glutamil transferasa (37 U/L; rango de referencia, 0-7 U/L), así como hiperlactatemia (6,23 mmol/L; rango de referencia, 0,5-2,5 mmol/L) y elevación de la proteína C reactiva (7,9 mg/dL; rango de referencia, 0,1–1 mg/dL).
Las imágenes de la radiografía torácica mostraron múltiples nódulos pulmonares de diferentes tamaños que oscilaban entre 5 y 11 mm, con un tamaño máximo de 11,4 × 8,8 mm (Figuras 1A, 2A). La radiografía abdominal reveló una opacidad de tejidos blandos entre la 13ª vértebra torácica (T13) y la tercera vértebra lumbar (L3) en la vista lateral (Figura 1B). Además, la ecografía abdominal reveló una masa heterogénea, de 53,8 × 37,9 mm de tamaño, que surge del polo craneal del riñón derecho con una respuesta vigorosa del flujo sanguíneo en el flujo E (Figura 1C). Una parte de la cara caudal del riñón derecho conservó su estructura normal, mientras que el resto sufrió una transformación tumoral. Los otros órganos y los ganglios linfáticos adyacentes no presentaban nada especial.
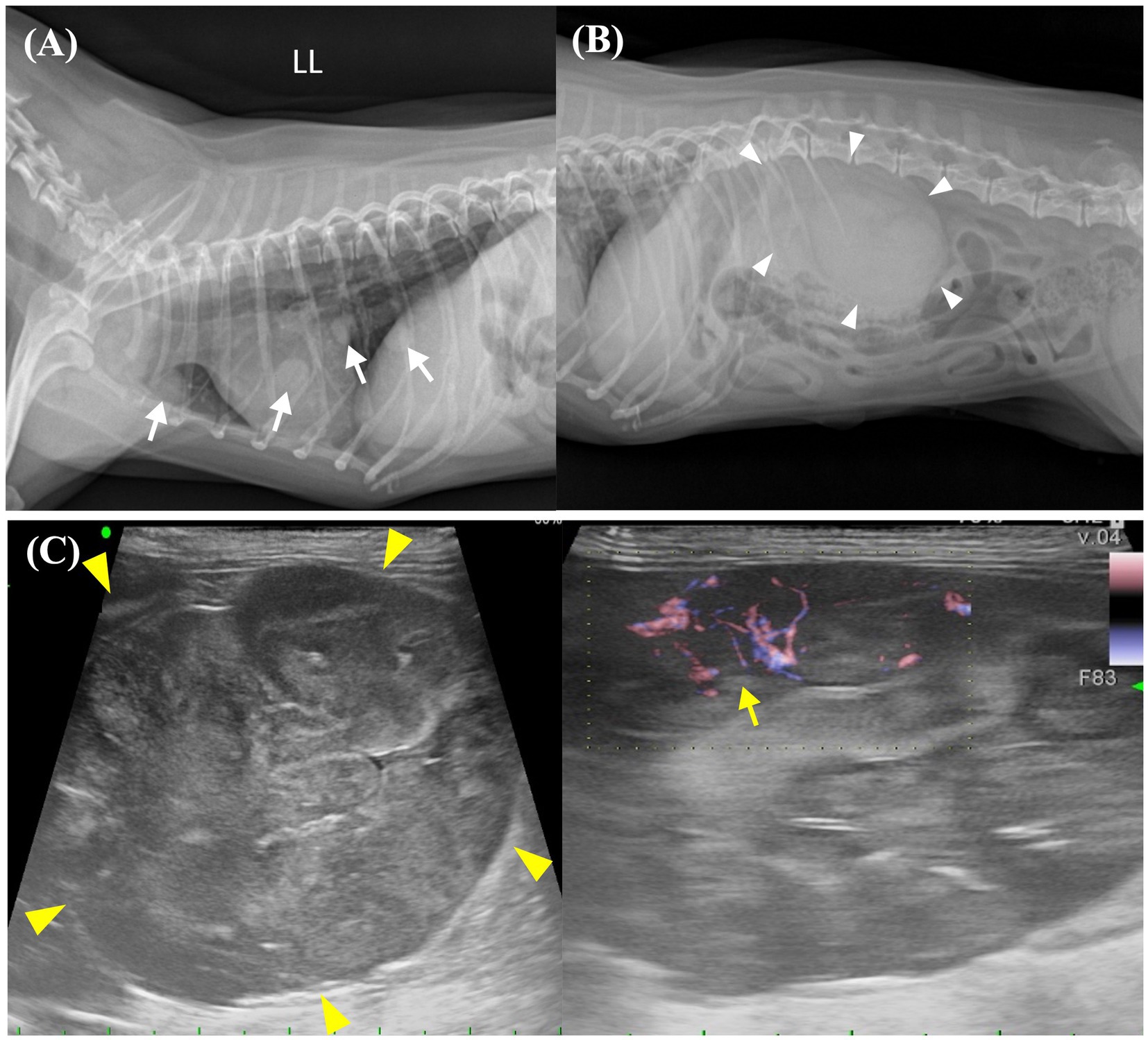 Figura 1. Imágenes preoperatorias de los nódulos pulmonares y la masa abdominal. (A) La imagen radiográfica torácica muestra la presencia de numerosos nódulos pulmonares con diámetros que oscilan entre 5 y 11 mm, que se distribuyen ampliamente por todo el campo pulmonar. Los nódulos pulmonares identificables se indican con flechas blancas. (B) La imagen radiográfica abdominal muestra una opacidad de tejidos blandos en la región del riñón derecho (puntas de flecha blancas). (C) La ecografía abdominal muestra una masa grande (53,8 × 37,0 mm), heterogénea (puntas de flecha amarillas) que surge del polo craneal del riñón derecho. El riñón derecho se acompaña de una respuesta vascular activa en el flujo E (flecha amarilla). LL: vista lateral izquierda.
Figura 1. Imágenes preoperatorias de los nódulos pulmonares y la masa abdominal. (A) La imagen radiográfica torácica muestra la presencia de numerosos nódulos pulmonares con diámetros que oscilan entre 5 y 11 mm, que se distribuyen ampliamente por todo el campo pulmonar. Los nódulos pulmonares identificables se indican con flechas blancas. (B) La imagen radiográfica abdominal muestra una opacidad de tejidos blandos en la región del riñón derecho (puntas de flecha blancas). (C) La ecografía abdominal muestra una masa grande (53,8 × 37,0 mm), heterogénea (puntas de flecha amarillas) que surge del polo craneal del riñón derecho. El riñón derecho se acompaña de una respuesta vascular activa en el flujo E (flecha amarilla). LL: vista lateral izquierda.
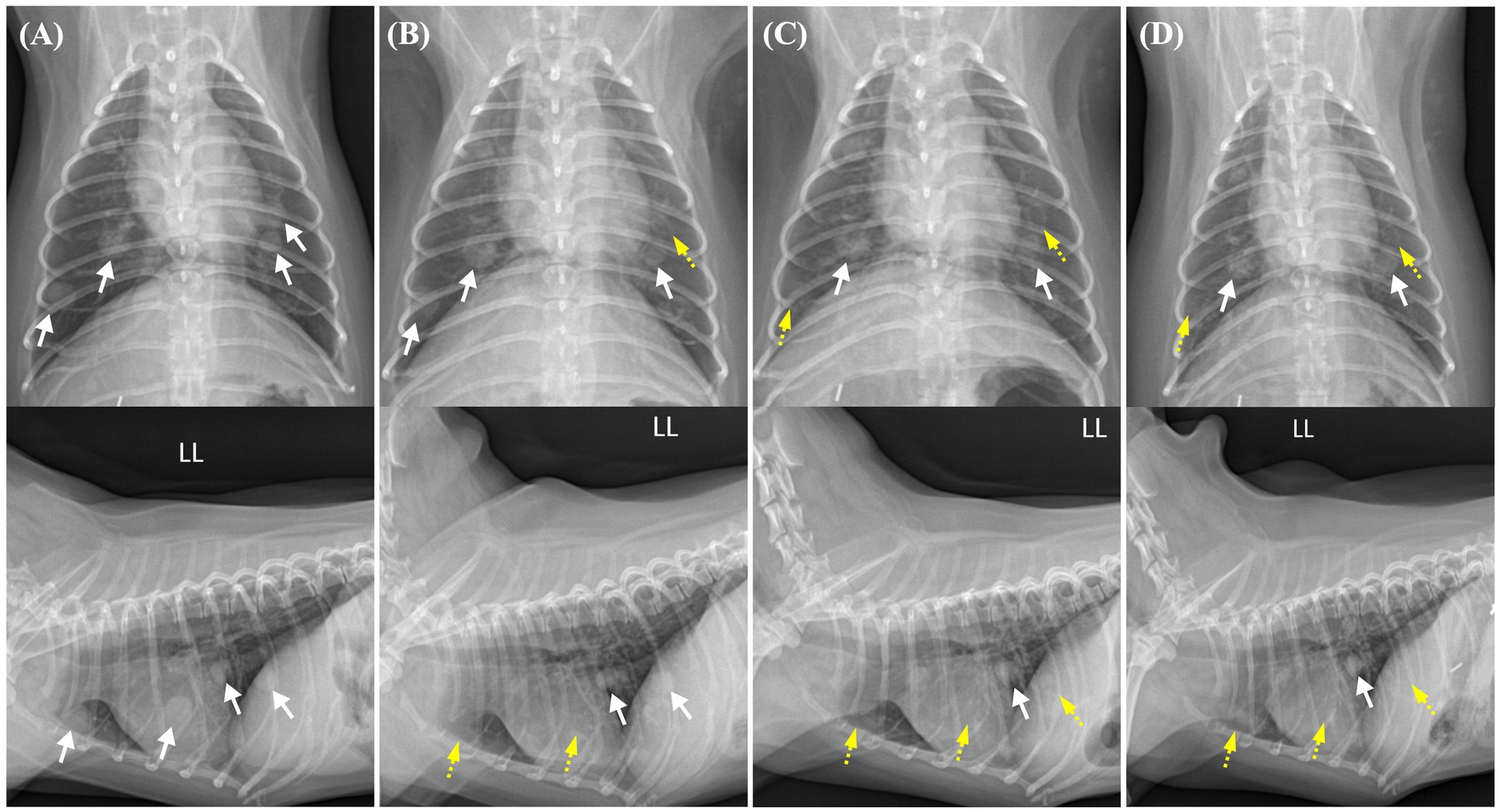 Figura 2. Cambios en los nódulos pulmonares en las radiografías torácicas desde antes de la administración de toceranib hasta 2 semanas, 2 meses y 4 meses después del inicio del tratamiento. Los nódulos pulmonares con bordes bien definidos se indican con flechas blancas, mientras que los nódulos con regresión se indican con flechas discontinuas amarillas. (A) Antes de la administración de toceranib, se observan múltiples nódulos pulmonares con opacidad de tejidos blandos en todo el campo pulmonar generalizado. El nódulo pulmonar con el tamaño más grande mide 11,4 × 8,8 mm. (B) En una radiografía torácica obtenida 2 semanas después de la administración de toceranib, el nódulo pulmonar previamente identificado con el tamaño más grande ya no es visible en la vista lateral. El diámetro medible más grande del nódulo restante es de aproximadamente 9 mm. (C) En una radiografía torácica obtenida 2 meses después de la administración de toceranib, ya no se detecta otro nódulo pulmonar de 8,4 × 7,7 mm de tamaño inicial. La mayoría de los nódulos pulmonares presentan una remisión parcial y una disminución de su tamaño. (D) En una radiografía torácica obtenida 4 meses después de la administración de toceranib, no se observa más remisión en los nódulos pulmonares existentes. Tampoco se encuentran indicios de nódulos recién detectados o de recurrencia de nódulos pulmonares previamente disminuidos.
Figura 2. Cambios en los nódulos pulmonares en las radiografías torácicas desde antes de la administración de toceranib hasta 2 semanas, 2 meses y 4 meses después del inicio del tratamiento. Los nódulos pulmonares con bordes bien definidos se indican con flechas blancas, mientras que los nódulos con regresión se indican con flechas discontinuas amarillas. (A) Antes de la administración de toceranib, se observan múltiples nódulos pulmonares con opacidad de tejidos blandos en todo el campo pulmonar generalizado. El nódulo pulmonar con el tamaño más grande mide 11,4 × 8,8 mm. (B) En una radiografía torácica obtenida 2 semanas después de la administración de toceranib, el nódulo pulmonar previamente identificado con el tamaño más grande ya no es visible en la vista lateral. El diámetro medible más grande del nódulo restante es de aproximadamente 9 mm. (C) En una radiografía torácica obtenida 2 meses después de la administración de toceranib, ya no se detecta otro nódulo pulmonar de 8,4 × 7,7 mm de tamaño inicial. La mayoría de los nódulos pulmonares presentan una remisión parcial y una disminución de su tamaño. (D) En una radiografía torácica obtenida 4 meses después de la administración de toceranib, no se observa más remisión en los nódulos pulmonares existentes. Tampoco se encuentran indicios de nódulos recién detectados o de recurrencia de nódulos pulmonares previamente disminuidos.
El paciente fue considerado no apto para un examen de tomografía computarizada debido a su condición y al riesgo que representaba la anestesia. Por lo tanto, se procedió a realizar la nefrectomía derecha. En el intraoperatorio, se observó que la masa renal se había adherido ampliamente a la vena cava caudal, lo que indica una afectación significativa del tumor en el vaso. Debido a esta extensa adherencia, se realizó una resección incompleta sin incluir el tumor dentro de la vena cava caudal. La invasión tumoral en la glándula suprarrenal ipsilateral se identificó macroscópicamente durante la operación; por lo tanto, se resecó la glándula suprarrenal. Además, se identificaron vasos sanguíneos que conectan el tumor con el hígado y se sospechó que funcionaban como vasos de alimentación (Figura 3A). Las muestras de tejido extirpadas se sometieron a una evaluación histopatológica (Figura 3B), que confirmó que la masa renal representaba CCR papilar con márgenes de escisión incompletos (Figura 4A). Teniendo en cuenta que no se ha establecido un sistema de estadificación de tumores, ganglios linfáticos y metástasis (TNM) para el CCR en perros, se determinó que el estadio TNM del paciente era T4N0M1 utilizando el sistema de estadificación TNM humano (11). El examen histopatológico reveló una alta malignidad con cromatina densa, nucléolos prominentes y numerosas figuras mitóticas (66 en 10 campos de alta potencia; Figura 4B). Aproximadamente el 45-55% de la masa estaba constituida por necrosis tumoral multifocal que invadía el parénquima circundante, caracterizada por células picnóticas y desvanecimiento nuclear. El parénquima renal circundante exhibió compresión con espaciamiento libre intersticial moderado, dilatación tubular leve y agregación linfocitaria multifocal.
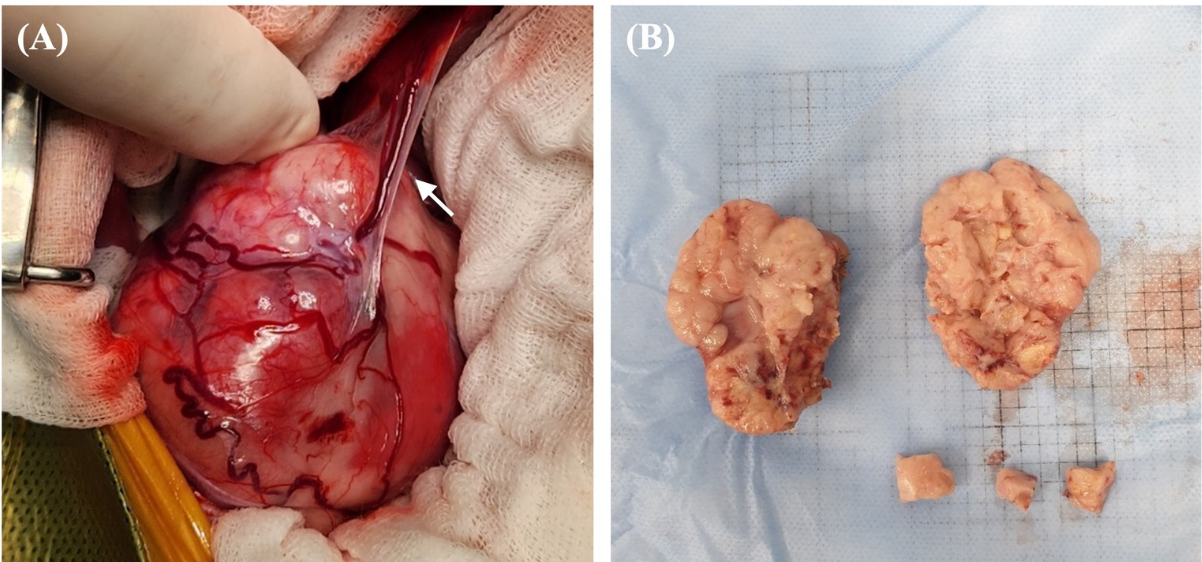
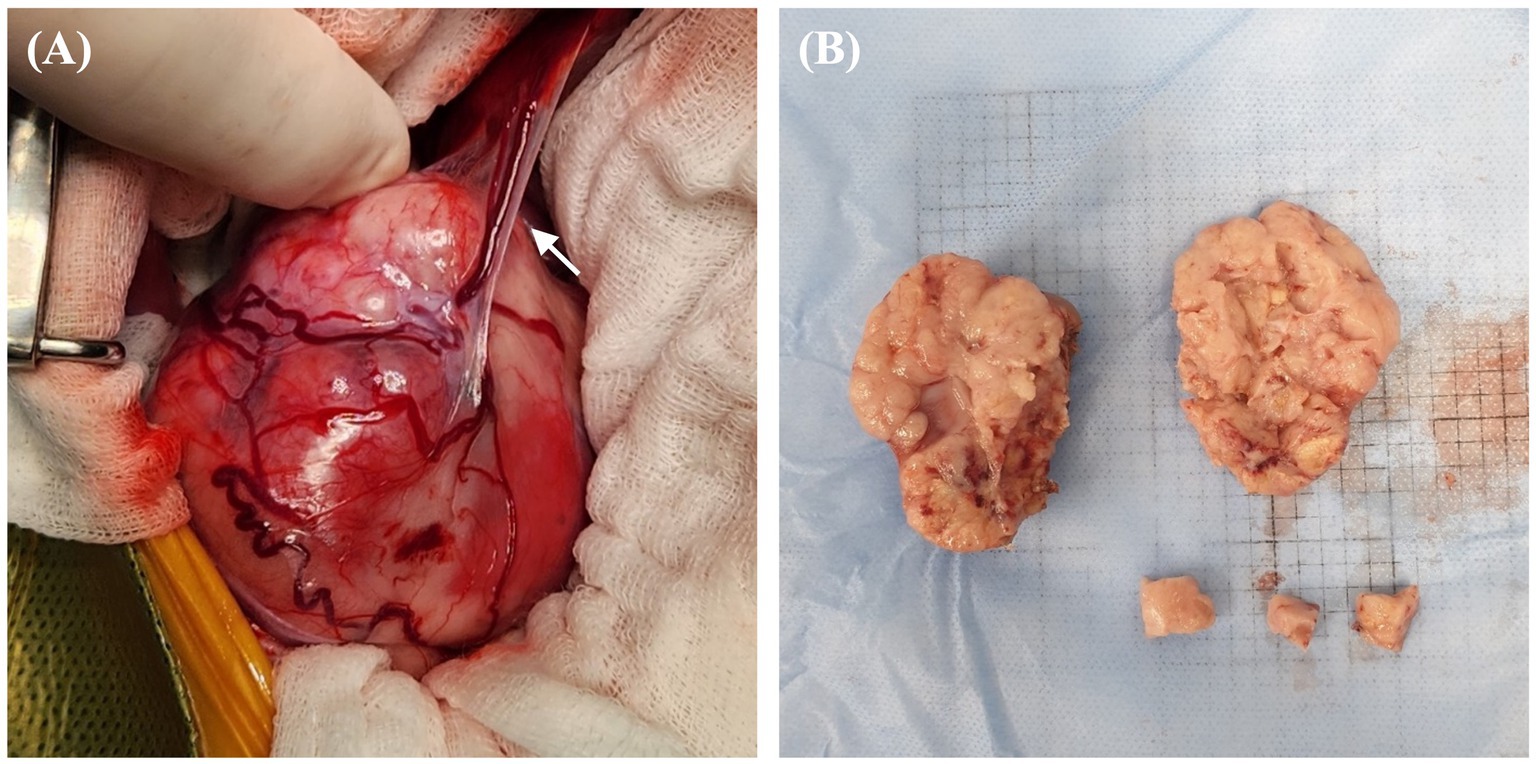 Figura 3. Características morfológicas macroscópicas de la masa renal derecha en un perro con CCR. (A) Hallazgo intraoperatorio de una masa renal altamente vascularizada con vasos sanguíneos que se conectan al hígado y potencialmente funcionan como vasos de alimentación (flecha). Se han encontrado numerosas vasijas tortuosas que rodearon la cápsula de la masa. (B) Masa extirpada quirúrgicamente de tamaño 50 × 65 mm, con un parénquima abultado y abultado, una unión corticomedular indistinta y un margen irregular; Los hallazgos sugieren una transformación tumoral completa con pérdida total de la estructura normal. CCR: carcinoma de células renales.
Figura 3. Características morfológicas macroscópicas de la masa renal derecha en un perro con CCR. (A) Hallazgo intraoperatorio de una masa renal altamente vascularizada con vasos sanguíneos que se conectan al hígado y potencialmente funcionan como vasos de alimentación (flecha). Se han encontrado numerosas vasijas tortuosas que rodearon la cápsula de la masa. (B) Masa extirpada quirúrgicamente de tamaño 50 × 65 mm, con un parénquima abultado y abultado, una unión corticomedular indistinta y un margen irregular; Los hallazgos sugieren una transformación tumoral completa con pérdida total de la estructura normal. CCR: carcinoma de células renales.
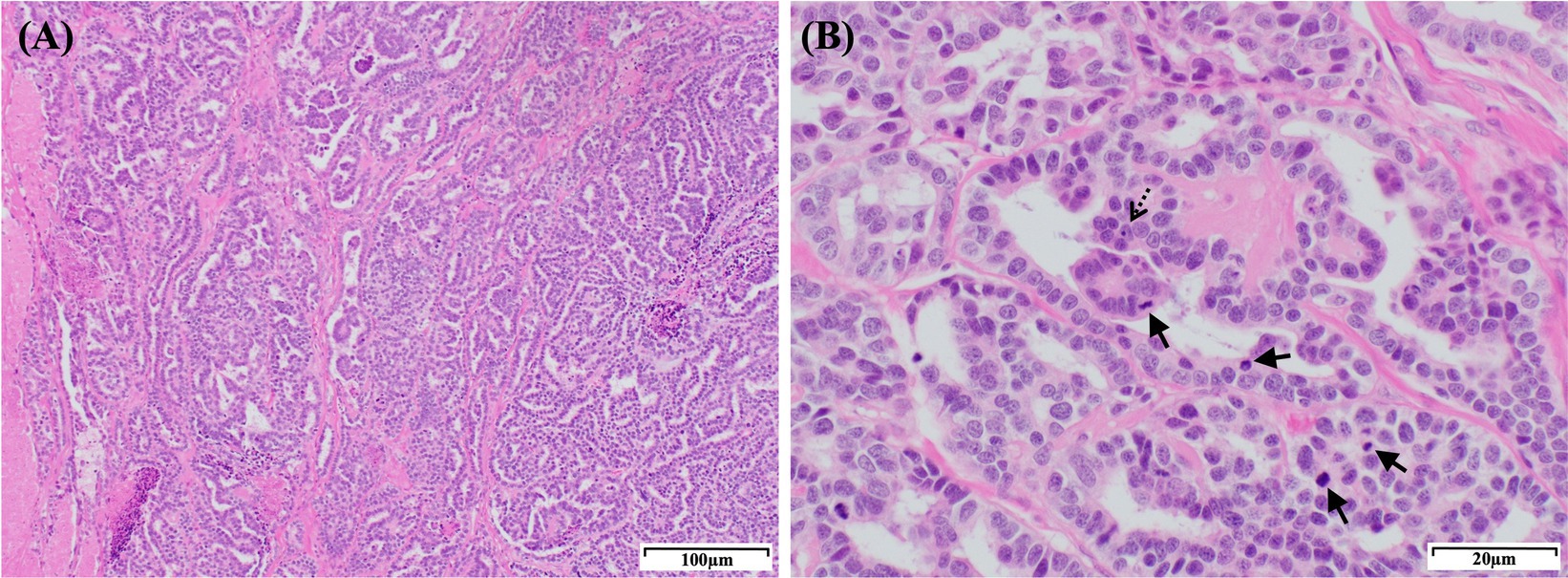 Figura 4. Características histopatológicas de la masa renal derecha en un perro con CCR papilar. (A) Sección histológica que muestra un CCR papilar. El tumor consiste en células poligonales neoplásicas densamente empaquetadas, bien definidas y no encapsuladas, dispuestas en un patrón de empalizada. Las células neoplásicas forman conductos, proyecciones papilares y lobulillos en un estroma fibrovascular fino. Tinción H&E: aumento, 100×; barra de escala, 100 μm. (B) Las células tumorales exhiben cromatina densa y 1–4 nucléolos prominentes (flecha discontinua) con bordes celulares variablemente distintos, citoplasma eosinofílico de moderado a escaso y vacuolización regional. Se observan anisocitosis y anisobariosis moderadas con un elevado número de figuras mitóticas (flechas; 66 en 10 campos de alta potencia). Tinción H&E: aumento, 400×; barra de escala, 20 μm. CCR: carcinoma de células renales; H&E, hematoxilina y eosina.
Figura 4. Características histopatológicas de la masa renal derecha en un perro con CCR papilar. (A) Sección histológica que muestra un CCR papilar. El tumor consiste en células poligonales neoplásicas densamente empaquetadas, bien definidas y no encapsuladas, dispuestas en un patrón de empalizada. Las células neoplásicas forman conductos, proyecciones papilares y lobulillos en un estroma fibrovascular fino. Tinción H&E: aumento, 100×; barra de escala, 100 μm. (B) Las células tumorales exhiben cromatina densa y 1–4 nucléolos prominentes (flecha discontinua) con bordes celulares variablemente distintos, citoplasma eosinofílico de moderado a escaso y vacuolización regional. Se observan anisocitosis y anisobariosis moderadas con un elevado número de figuras mitóticas (flechas; 66 en 10 campos de alta potencia). Tinción H&E: aumento, 400×; barra de escala, 20 μm. CCR: carcinoma de células renales; H&E, hematoxilina y eosina.
Para determinar el fármaco anticancerígeno más eficaz para este paciente, realizamos una prueba de predicción de la respuesta a fármacos anticancerígenos basada en ATP in vitro mediante un ensayo de viabilidad celular. Después de la cirugía, la muestra tumoral del paciente se recolectó y lisó utilizando colagenasa II (Life Technologies, Carlsbad, CA, Estados Unidos), hialuronidasa y Ly27632 (Sigma-Aldrich, St. Louis, MO, Estados Unidos) a 37 °C. Después de la filtración a través de un filtro celular de 70 μm (BD Biosciences, San Diego, CA, Estados Unidos), la muestra tumoral se disoció en células individuales. Estas células se cultivaron en el medio Eagle’s/F12 modificado de Advanced Dulbecco suplementado con suero bovino fetal al 10%, ácido N-10-hidroxietilpiperazina-N′-2-etanosulfónico de 2 mM, junto con GlutaMAX™ (Thermo Fisher Scientific, Waltham, MA, Estados Unidos) y Zellshield (Minerva Biolabs, Berlín, Alemania). Posteriormente, las células (1 × 10®4) se sembraron en placas de 96 pocillos y se incubaron durante la noche a 37°C en un CO al 5%2 atmósfera humidificada. El medio se reemplazó con un gradiente de concentraciones de fármacos quimioterápicos. Después de 24 h, la viabilidad celular se evaluó mediante el ensayo de viabilidad celular luminiscente CellTiter-Glo (Promega, Madison, WI, Estados Unidos), siguiendo las instrucciones del fabricante. Los resultados demostraron que entre sorafenib, imatinib, doxorrubicina, carboplatino y toceranib (Palladia, Zoetis, Florham Park, NJ, Estados Unidos), toceranib mostró el efecto citotóxico más potente (Figura suplementaria S1). A diferencia del carboplatino, que no indujo la muerte celular incluso a una concentración alta de 100 μM, el toceranib mostró una mayor eficacia antitumoral, incluso a la concentración más baja de 6 μM, en comparación con otros agentes quimioterapéuticos.®®
Así, 1 mes después de la cirugía, se inició la administración de toceranib a dosis de 2,27 mg/kg por vía oral cada 48 h, de acuerdo con la dosis mínima recomendada en la ficha. La dosis se ajustó teniendo en cuenta los posibles efectos adversos y el posible aumento futuro de la dosis. Los intervalos de revisión médica para los eventos adversos a los medicamentos, la recurrencia tumoral y la metástasis fueron una vez por semana durante las primeras 2 semanas, seguidos de cada 2 semanas durante 4 semanas y mensualmente a partir de entonces. En el examen de seguimiento de 2 semanas, no se observaron efectos adversos después de las evaluaciones de la medición sistémica de la presión arterial, el hemograma, el perfil químico sérico, el perfil de coagulación y el análisis de orina, según los criterios de terminología común del grupo de oncología cooperativa veterinaria para eventos adversos (VCOG-CTCAE) (12). En la Figura 2 se muestran los cambios seriados en los nódulos pulmonares tras la administración de toceranib. Los nódulos pulmonares, sospechosos de metástasis de carcinoma de células renales, mostraron una disminución del tamaño y la opacidad en la radiografía torácica, acompañada de difuminación de sus bordes (Figura 2B). El dueño informó que el perro estaba activo y mostraba una alimentación, bebida, micción y respiración estable normales.
En el chequeo a los 2 meses, se observó que el paciente había mantenido un buen estado de forma constante. El propietario informó que el paciente parecía estar libre de dolor, mostrando altos niveles de energía y un fuerte apetito. No se observaron hallazgos notables en relación con los tumores o los efectos adversos del toceranib. En la radiografía torácica, la mayoría de los nódulos pulmonares presentaban remisión parcial y habían disminuido de tamaño (Figura 2C). La ecografía abdominal no reveló hallazgos adicionales sugestivos de metástasis del CCR.
En la revisión a los 4 meses, en comparación con la radiografía torácica de hace 2 meses, no se observó mayor regresión en los nódulos pulmonares existentes; Parecían similares. Sin embargo, no se observaron signos de recidiva en aquellos que habían mostrado remisión previamente, y no se detectaron nódulos adicionales (Figura 2D). Del mismo modo, no se observaron efectos adversos relacionados con la quimioterapia según los criterios VCOG-CTCAE (12). Sin embargo, 1 semana antes de la revisión programada de 5 meses, el paciente experimentó fatiga severa, vómitos y diarrea y falleció en casa sin una causa definitiva. Esto ocurrió 6 meses después de la detección inicial de la masa renal y posterior cirugía y 5 meses después de la administración de toceranib. No se realizó la necropsia debido a la negativa del propietario.
3. Discusión
El CCR presenta una baja respuesta a la quimioterapia y la nefrectomía es reconocida como la opción de tratamiento más eficaz para los perros (3). La cirugía contribuye a prolongar el tiempo de supervivencia en perros con CCR. Sin embargo, el papel de la quimioterapia adyuvante en la prolongación del tiempo de supervivencia no se ha establecido completamente (3). Aunque se ha informado de quimioterapia adyuvante, incluida la administración de quimioterapéuticos convencionales, ITC y quimioterapia metronómica, después de la cirugía, no ha habido una extensión significativa de la mediana de supervivencia en comparación con los casos en los que no se ha administrado quimioterapia adyuvante (2). Solo un estudio ha informado de una mediana de supervivencia prolongada en perros con CCR que recibieron toceranib como quimioterapia adyuvante después de la cirugía en comparación con los que se sometieron a cirugía sola (6).
El índice mitótico (IM) es un indicador pronóstico importante para perros con varios tipos de cáncer, incluidos los tumores de mastocitos, los melanomas, los carcinomas mamarios y los sarcomas de tejidos blandos (2). Además, el IM está fuertemente asociado con el grado tumoral de ciertos tumores de mastocitos caninos (13). También se ha identificado como un factor pronóstico fiable en perros con CCR, con una supervivencia de 40 meses en los casos con infarto de miocardio < 10, y de 15 meses en los casos con infarto de miocardio que oscila entre 10 y 30 (1). Se ha informado que la mediana de supervivencia es de 4 a 6 meses con infarto de miocardio >30 (1, 2). En el presente caso, el examen histopatológico reveló un IM de 66, lo que indica un grado significativo de malignidad.
Carvalho et al. observaron una mediana de supervivencia significativamente más corta en los perros con CCRm que en los que no tenían metástasis en el momento del diagnóstico (2). Además, se ha informado que los perros con CCR completamente resecado sin metástasis tienen un período de supervivencia de 3 a 4 meses sin quimioterapia adyuvante (14, 15). Sin embargo, no se dispone de datos sobre el período de supervivencia de los perros con CCRm que se han sometido a una resección incompleta de la masa renal. Por lo tanto, anticipamos que el pronóstico de nuestro paciente no sería favorable, incluso con quimioterapia, y estimamos el tiempo de supervivencia en menos de 3 meses después de considerar la resección incompleta realizada, la presencia de sospecha de metástasis pulmonar y el alto IM. Sin embargo, el paciente sobrevivió hasta 6 meses desde el momento de la detección inicial de la masa renal.
Para la prueba de predicción de la respuesta a medicamentos contra el cáncer, elegimos sorafenib, imatinib, doxorrubicina, carboplatino y toceranib en función de su historial de aplicación previa en humanos y perros. Entre estos cinco agentes quimioterapéuticos convencionales y dirigidos, toceranib exhibió los efectos citotóxicos más potentes, por lo tanto, la decisión de administrar toceranib se basó en su eficacia óptima. Se vigiló de cerca la respuesta del paciente al toceranib y los posibles efectos secundarios. Sin embargo, no se observaron efectos secundarios asociados con toceranib, como anorexia, vómitos, diarrea, hemorragia gastrointestinal, hipertensión, proteinuria o el síndrome nefrótico recientemente reportado (5, 16, 17). El propietario informó que el paciente permanecía en buenas condiciones y no presentaba ninguna respuesta al dolor.
La sospecha de lesiones metastásicas pulmonares en nuestro caso no se confirmó a través de un examen histopatológico debido a las preocupaciones financieras del propietario. Por lo tanto, no pudimos determinar definitivamente si los nódulos pulmonares eran tumores pulmonares primarios o producto de la metástasis del CCR a los pulmones. Sin embargo, la metástasis pulmonar del CCR se consideró el escenario más probable, considerando la alta probabilidad de que estos carcinomas hicieran metástasis a los pulmones. Además, la regresión de los nódulos múltiples fue evidente en la radiografía torácica regular. Además, después de la administración de toceranib, el propietario observó una mejora significativa en el apetito y la vitalidad del paciente. Durante el seguimiento regular, el número y el tamaño de los nódulos múltiples sospechosos de metástasis pulmonares en la radiografía torácica se redujeron, lo que sugiere una respuesta positiva del CCR al toceranib. Además, la monitorización continua de metástasis hepáticas mediante ecografía abdominal no reveló metástasis en otros órganos de la cavidad abdominal, a pesar de la presencia de vasos sanguíneos que conectan la masa renal con el hígado. Además, no se observó recidiva a pesar de los antecedentes de resección incompleta de la masa renal del paciente.
El toceranib es un ITC multidiana con actividad inhibidora contra varios receptores, como el receptor del factor de crecimiento endotelial vascular, el receptor del factor de crecimiento derivado de plaquetas y el receptor Kit (18). Por lo tanto, el fármaco puede exhibir un potencial antiangiogénico y antitumoral (18). En nuestro paciente, los efectos antiangiogénicos de toceranib podrían haber contribuido a la ausencia de metástasis adicionales dentro de la cavidad abdominal a pesar de la resección incompleta del CCR. Además, la reducción del tamaño de los nódulos pulmonares sospechosos de metástasis podría atribuirse a estas propiedades antiangiogénicas. Aunque los ITC se han utilizado ampliamente para el tratamiento del CCR en humanos, su aplicación en perros con CCR es menos común (19). Para el tratamiento del CCRm en humanos, se han aprobado varios ITC que se dirigen específicamente a la vía de señalización del factor de crecimiento endotelial vascular como tratamientos de primera y segunda línea, incluidos sorafenib y sunitinib (20). El uso de ITC como terapias dirigidas ha mejorado notablemente las tasas de supervivencia en pacientes humanos con CCR (21). Sin embargo, lograr una respuesta completa a la terapia médica en humanos con mRCC es un desafío. Tres patrones clínicos reconocidos se asocian con el desarrollo de resistencia en el CCRm (22). Un pequeño porcentaje de pacientes muestra resistencia al tratamiento desde el principio, mientras que otros experimentan una regresión tumoral inicial, seguida de una progresión de la enfermedad después de un corto período. Sin embargo, algunos pacientes muestran una respuesta positiva temprana al tratamiento y mantienen la enfermedad estable durante un período prolongado (23).
Se especuló que el trastorno gastrointestinal agudo y la resistencia a los medicamentos eran las causas principales de la muerte súbita de nuestro paciente. Teniendo en cuenta los casos notificados de muerte por ulceración o perforación gastrointestinal asociada a ITC (24-26), no se puede descartar la posibilidad de que estas complicaciones sean las causas agudas de muerte, aunque el paciente no mostró efectos adversos gastrointestinales compatibles con la toxicidad de toceranib durante el control regular. La muerte también podría haber ocurrido debido a la reducción de la respuesta a los medicamentos causada por la resistencia a los medicamentos, un fenómeno comúnmente observado en los casos de CCRm humanos. A pesar de la remisión parcial inicial de los nódulos pulmonares sospechosos de metástasis durante los primeros 2 meses de tratamiento, no se observó una mejoría adicional en la capacidad de respuesta.
En medicina veterinaria, las opciones de tratamiento para el CCRm altamente maligno son difíciles de determinar debido a la rareza de estos tumores y al número limitado de estudios previos. En consecuencia, los médicos encuentran dificultades a la hora de seleccionar la quimioterapia óptima para el CCRm debido a la falta de pruebas suficientes. Algunos casos de carcinoma notificados respaldan la eficacia terapéutica de toceranib como quimioterapia adyuvante con efectos secundarios mínimos (6, 27–29). En cuanto al CCRm, solo un caso reciente ha descrito el uso de toceranib tras la nefrectomía con el objetivo de frenar la progresión de las lesiones metastásicas (30). Este tratamiento condujo a una notable reducción del tamaño de las masas pulmonares, sospechadas como lesiones metastásicas en la tomografía computarizada, y prolongó el tiempo de supervivencia del paciente (30). El toceranib provocó una respuesta favorable de las presuntas lesiones pulmonares metastásicas tanto en el caso referenciado como en el nuestro. Además, en nuestro caso, teniendo en cuenta la resección incompleta del tumor primario, se evitó eficazmente cualquier recidiva adicional. Sobre la base de su alto efecto antitumoral, indicado tanto por nuestra prueba de respuesta a medicamentos contra el cáncer como por informes de casos anteriores, toceranib podría considerarse una opción de tratamiento para el CCRm con una respuesta favorable.
Hasta donde sabemos, este es el primer caso veterinario reportado de tratamiento con toceranib en un canino con CCR resecado de forma incompleta y sospecha de metástasis pulmonar. Inicialmente, el paciente tuvo un resultado clínico positivo sin efectos adversos significativos. Este informe de caso proporciona información valiosa sobre los resultados clínicos del tratamiento con toceranib y el pronóstico del CCR resecado de forma incompleta, una presentación poco frecuente en medicina veterinaria. Se justifica una mayor investigación veterinaria sobre las estrategias médicas estándar y la resistencia a los ITC en el CCR canino.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
El Centro de Ética de la Investigación de la Universidad de Konkuk eximió del requisito de aprobación ética para los estudios con animales porque este estudio es un informe de caso y solo se utilizó información retrospectiva sobre el paciente. A los efectos de este informe, no se llevaron a cabo experimentos ni muestreos por separado. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio. Se obtuvo el consentimiento informado por escrito del participante/paciente para la publicación de este informe de caso.
Contribuciones de los autores
D-EL: Escritura – borrador original. C-HN: Redacción – revisión y edición. H-YY: Escritura – revisión y edición. KB: Escritura – revisión y edición. K-AY: Análisis formal, Redacción – revisión y edición. J-HK: Escritura – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este trabajo fue apoyado por la subvención de la Fundación Nacional de Investigación de Corea financiada por el Gobierno de Corea (MSIT) (NRF-2021R1A2C2008112).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1287185/full#supplementary-material
Abreviaturas
CCR: carcinoma de células renales; mRCC: carcinoma metastásico de células renales; ITC: inhibidor de la tirosina quinasa; IM: índice mitótico; VCOG-CTCAE, grupo de oncología cooperativa veterinaria: criterios terminológicos comunes para eventos adversos.
Referencias
1. Edmondson, EF, Hess, AM, y Powers, BE. Importancia pronóstica de las características histológicas en los carcinomas caninos de células renales: 70 nefrectomías. Veterinario Pathol. (2015) 52:260–8. doi: 10.1177/0300985814533803
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Carvalho, S, Stoll, AL, Priestnall, SL, Suarez-Bonnet, A, Rassnick, K, Lynch, S, et al. Evaluación retrospectiva de la expresión de COX-2, factores histológicos y clínicos como indicadores pronósticos en perros con carcinomas de células renales sometidos a nefrectomía. Veterinario Comp Oncol. (2017) 15:1280–94. doi: 10.1111/vco.12264
3. Bryan, JN, Henry, CJ, Turnquist, SE, Tyler, JW, Liptak, JM, Rizzo, SA, et al. Neoplasia renal primaria de perros. J Veterinario Pasante Med. (2006) 20:1155–60. doi: 10.1111/j.1939-1676.2006.tb00715.x
4. Frezoulis, P, y Harper, A. El papel del fosfato de toceranib en perros con neoplasia de mastocitos: una revisión sistemática. Veterinario Comp Oncol. (2022) 20:362–71. doi: 10.1111/vco.12799
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Bavcar, S, y Argyle, DJ. Inhibidores del receptor tirosina quinasa: fármacos dirigidos molecularmente para la terapia veterinaria contra el cáncer. Veterinario Comp Oncol. (2012) 10:163–73. doi: 10.1111/j.1476-5829.2012.00342.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Yamazaki, H, Tanaka, T, Mie, K, Nishida, H, Miura, N y Akiyoshi, H. Evaluación del tratamiento adyuvante postoperatorio con fosfato de toceranib contra el adenocarcinoma en perros. J Veterinario Pasante Med. (2020) 34:1272–81. doi: 10.1111/jvim.15768
7. Escudier, B, Eisen, T, Stadler, WM, Szczylik, C, Oudard, S, Siebels, M, et al. Sorafenib en el carcinoma de células renales de células claras avanzado. N Engl J Med. (2007) 356:125–34. doi: 10.1056/NEJMoa060655
8. Motzer, RJ, Hutson, TE, Tomczak, P, Michaelson, MD, Bukowski, RM, Rixe, O, et al. Sunitinib versus interferón alfa en el carcinoma metastásico de células renales. N Engl J Med. (2007) 356:115–24. doi: 10.1056/NEJMoa065044
9. Motzer, RJ, Michaelson, MD, Rosenberg, J, Bukowski, RM, Curti, BD, George, DJ, et al. Eficacia de sunitinib contra el carcinoma de células renales avanzado. J Urol. (2007) 178:1883–7. doi: 10.1016/j.juro.2007.07.030
10. Ljungberg, B, Albiges, L, Abu-Ghanem, Y, Bedke, J, Capitanio, U, Dabestani, S, et al. Directrices de la Asociación Europea de Urología sobre el carcinoma de células renales: la actualización de 2022. Eur Urol. (2022) 82:399–410. doi: 10.1016/j.eururo.2022.03.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Egner, JR. Manual de estadificación del cáncer del AJCC. JAMA. (2010) 304:1726. doi: 10.1001/jama.2010.1525
12. LeBlanc, AK, Atherton, M, Bentley, RT, Boudreau, CE, Burton, JH, Curran, KM, et al. Grupo de oncología cooperativa veterinaria: criterios de terminología común para eventos adversos (VCOG-CTCAE v2) después de la terapia en investigación en perros y gatos. Veterinario Comp Oncol. (2021) 19:311–52. doi: 10.1111/vco.12677
13. Romansik, EM, Reilly, CM, Kass, PH, Moore, PF y London, CA. El índice mitótico es predictivo de la supervivencia de los tumores cutáneos de mastocitos caninos. Veterinario Pathol. (2007) 44:335–41. doi: 10.1354/vp.44-3-335
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Kobayashi, N, Suzuki, K, Murakami, H, Kagawa, E, Aoki, I, y Nagashima, Y. Carcinoma cromófobo de células renales con transformación sarcomatoide en un perro. J Vet Diagn Investig. (2010) 22:983–7. doi: 10.1177/104063871002200624
15. Petterino, C, Luzio, E, Baracchini, L, Ferrari, A, y Ratto, A. Leucocitosis paraneoplásica en un perro con carcinoma renal. Veterinario Clin Pathol. (2011) 40:89–94. doi: 10.1111/j.1939-165X.2011.00296.x
16. Tjostheim, SS, Stepien, RL, Markovic, LE, y Stein, TJ. Efectos del fosfato de toceranib sobre la presión arterial sistólica y la proteinuria en perros. J Veterinario Pasante Med. (2016) 30:951–7. doi: 10.1111/jvim.13951
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Remerowski, SM, Herrera, CL y Donnelly, LL. Síndrome nefrótico asociado a fosfato de toceranib en un perro: informe de un caso. BMC Vet Res. (2021) 17:146. doi: 10.1186/s12917-021-02850-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Londres, CA. Inhibidores de la tirosina quinasa en medicina veterinaria. El mejor compañero Anim Med. (2009) 24:106–12. doi: 10.1053/j.tcam.2009.02.002
19. Kane, RC, Farrell, AT, Saber, H, Tang, S, Williams, G, Jee, JM, et al. Sorafenib para el tratamiento del carcinoma de células renales avanzado. Clin Cáncer Res. (2006) 12:7271–8. doi: 10.1158/1078-0432.CCR-06-1249
20. Hsieh, JJ, Purdue, MP, Signoretti, S, Swanton, C, Albiges, L, Schmidinger, M, et al. Carcinoma de células renales. Nat Rev Dis Primers. (2017) 3:17009. doi: 10.1038/nrdp.2017.9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Motzer, RJ, Hutson, TE, Tomczak, P, Michaelson, MD, Bukowski, RM, Oudard, S, et al. Supervivencia global y resultados actualizados de sunitinib en comparación con interferón alfa en pacientes con carcinoma de células renales metastásico. J Clin Oncol. (2009) 27:3584–90. doi: 10.1200/JCO.2008.20.1293
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Fisher, R, Gore, M y Larkin, J. Tratamientos sistémicos actuales y futuros para el carcinoma de células renales. Semin Cancer Biol. (2013) 23:38–45. doi: 10.1016/j.semcancer.2012.06.004
23. Rini, BI y Flaherty, K. Efecto clínico y consideraciones futuras para la terapia dirigida molecularmente en el carcinoma de células renales. Urol Oncol. (2008) 26:543–9. doi: 10.1016/j.urolonc.2008.03.012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Sheppard-Olivares, S, Bello, NM, Johannes, CM, Hocker, SE, Biller, B, Husbands, B, et al. Fosfato de toceranib en el tratamiento del insulinoma canino: un estudio multicéntrico retrospectivo de 30 casos (2009-2019). Vet Rec Abierto. (2022) 9:E27. DOI: 10.1002/VRO2.27
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Prebble, AR, Weishaar, KM, Thamm, DH, Leary, D, LaRue, SM, Martin, T, et al. Aumento de la incidencia de toxicidad gastrointestinal en pacientes con cáncer canino tratados con radioterapia abdominal simultánea y fosfato de toceranib. Veterinario Comp Oncol. (2022) 20:142–53. doi: 10.1111/vco.12756
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Inoue, T, Kinoshita, H, Komai, Y, Kawabata, T, Kawa, G, Uemura, Y, et al. Dos casos de perforación gastrointestinal después de radioterapia en pacientes tratados con inhibidor de la tirosina quinasa para carcinoma de células renales avanzado. Mundo J Surg Oncol. (2012) 10:167. doi: 10.1186/1477-7819-10-167
27. Heaton, CM, Fernandes, AFA, Jark, PC y Pan, X. Evaluación de toceranib para el tratamiento del adenocarcinoma del saco anal de la glándula apocrina en perros. J Veterinario Pasante Med. (2020) 34:873–81. doi: 10.1111/jvim.15706
28. Kim, SW, Choi, JW, Kim, JM, Yoon, HY, Bae, K, Yoon, KA, et al. Caso clínico: toceranib como quimioterapia adyuvante en un perro con colangiocarcinoma combinado hepatocelular resecado de forma incompleta. Front Vet Sci. (2023) 9:963390. doi: 10.3389/fvets.2022.963390
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Choi, L, Choi, JY, Yoon, HY, Bae, K, Yoon, KA y Kim, JH. Terapia adyuvante con toceranib para el carcinoma hepatocelular y el colangiocarcinoma en un Pomerania. Veterinario Med. (2023) 68:83–9. doi: 10.17221/49/2022-VETMED
Palabras clave: quimioterapia adyuvante, carcinoma canino de células renales, metástasis pulmonar, inhibidor de la tirosina quinasa, fosfato de toceranib
Cita: Lee D-E, Nam C-H, Yoon H-Y, Bae K, Yoon K-A y Kim J-H (2023) Caso clínico: Terapia adyuvante con toceranib para un carcinoma de células renales resecado de forma incompleta con sospecha de metástasis pulmonar en un perro. Frente. Vet. Sci. 10:1287185. doi: 10.3389/fvets.2023.1287185
Recibido: 01 de septiembre de 2023; Aceptado: 27 de octubre de 2023;
Publicado: 13 noviembre 2023.
Editado por:
Remo Lobetti, Especialistas Veterinarios Irlanda, Irlanda
Revisado por:
Chad Mitchell Johannes, Universidad Estatal de Colorado, Estados
Unidos Chul Park, Universidad Nacional de Chonbuk, República de Corea Byeongteck Kang, Universidad Nacional de Chungbuk, República de Corea
Derechos de autor © 2023 Lee, Nam, Yoon, Bae, Yoon y Kim. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Jung-Hyun Kim, junghyun@konkuk.ac.kr
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía