Tratamiento de la epicarditis constrictiva mediante el procedimiento de gofre en un perro
Caso clínico: Tratamiento de la epicarditis constrictiva mediante el procedimiento de gofre en un perro que había sido sometido previamente a una pericardiectomía subtotal
 Rebecca Saundes*
Rebecca Saundes*  Steven Garnett
Steven Garnett  Brittany Lucchetti
Brittany Lucchetti  Sophy Jesty
Sophy Jesty- Centro de Referencia Veterinaria de Charleston, Charleston, Carolina del Sur, Estados Unidos
Una hembra de 10 años de edad, esterilizada de Braco Alemán de Pelo Corto, que pesaba 26,8 kg (59 libras), presentó una historia de 2 semanas de ascitis recurrente. El perro tenía una historia de 4 años de derrame pericárdico idiopático que causaba episodios esporádicos de taponamiento cardíaco y ascitis secundaria. Se realizó una pericardiectomía subtotal 3 meses antes de la presentación. El paciente había evolucionado bien durante 2 meses después de este procedimiento, momento en el que la ascitis transudada modificada de gran volumen recurrió, lo que requirió abdominocentesis cada 10 días. La tomografía computarizada (TC) torácica y abdominal no reveló causa abdominal o vascular de ascitis. La ecocardiografía transtorácica realizada bajo anestesia general mostró epicarditis constrictiva (pericarditis visceral) que resultó en disfunción diastólica e insuficiencia cardíaca congestiva del lado derecho. Se realizó una esternotomía para un procedimiento pericárdico en forma de gofre o pericardiotomía cruzada, es decir, una incisión en el epicardio engrosado. Los hallazgos ecocardiográficos postoperatorios fueron compatibles con la resolución de la epicarditis constrictiva. A los 8 meses del postoperatorio, el perro era clínicamente normal y solo había requerido una abdominocentesis un mes después del procedimiento de gofre. Este caso clínico describe el tratamiento exitoso de un perro con epicarditis constrictiva mediante una técnica quirúrgica novedosa (procedimiento de gofre) que aún no ha sido descrita en medicina veterinaria.
Introducción
En los perros, las enfermedades pericárdicas que causan derrame pericárdico dan lugar a signos de insuficiencia cardíaca derecha o taponamiento cardíaco como resultado de la compresión ventricular y la restricción del volumen ventricular diastólico (1). La pericarditis constrictiva (PC) es un trastorno pericárdico poco frecuente, a menudo de etiología desconocida, que es difícil de diagnosticar tanto en pacientes humanos como veterinarios sin un cateterismo cardíaco invasivo y costoso (2). En el ecocardiograma, la PC puede caracterizarse por un pericardio engrosado (no siempre presente), derrame pericárdico de pequeño volumen y anomalías hemodinámicas intracardíacas secundarias a la pérdida de la distensibilidad pericárdica (3, 4).
El tratamiento de elección para la pericarditis constrictiva tanto en personas como en animales es la pericardiectomía parietal (5). En casos raros de constricción pericárdica en humanos, el epicardio (es decir, el pericardio visceral) también está engrosado y calcificado de tal manera que una pericardiectomía convencional no alivia la fisiología constrictiva y, por lo tanto, persisten los signos clínicos. En estos casos, se realiza un procedimiento de waffle para aliviar la cicatrización epicárdica mediante la creación de incisiones cruzadas en toda la superficie de ambos ventrículos, aliviando así la constricción y permitiendo un llenado ventricular adecuado (5, 6).
Este caso clínico es el primero en medicina veterinaria en detallar el diagnóstico de epicarditis constrictiva en un perro que previamente había sido sometido a una pericardiectomía subtotal (extirpación del pericardio parietal), así como un tratamiento exitoso con una técnica quirúrgica nunca antes reportada en el perro.
Información para el paciente
Se obtuvo el consentimiento informado del titular para la publicación de este informe de caso. Una hembra de 10 años de edad, esterilizada y de 26,8 kg de peso fue presentada al Centro de Referencia Veterinaria de Charleston por ascitis recurrente. El perro tenía una historia de 4 años de derrame pericárdico idiopático que resultó en 4 episodios de taponamiento cardíaco con ascitis que ocurrieron entre 6 y 18 meses de diferencia. Tres meses antes de la presentación, el paciente se sometió a pericardiectomía subtotal y se recuperó bien. La histopatología del pericardio extraído reveló pericarditis fibrosante crónica difusa severa sin agentes infecciosos ni células neoplásicas identificadas.
Hallazgos clínicos
En el examen físico en el momento de la presentación, el perro tenía signos vitales normales (frecuencia cardíaca de 100 latidos/min; temperatura de 101.0 F; frecuencia respiratoria de 24 respiraciones/min), ruidos cardíacos normales, pulsos sincrónicos y distensión abdominal severa con una onda de líquido y pulsos yugulares. Los análisis de sangre no mostraron hallazgos anormales. La TC torácica y abdominal confirmó la presencia de derrame peritoneal de etiología desconocida, estructuras cardiovasculares normales y sin evidencia de enfermedad metastásica pulmonar ni trombos intravasculares. La ascitis se caracterizó como un trasudado modificado en la citología.
Evaluación diagnóstica
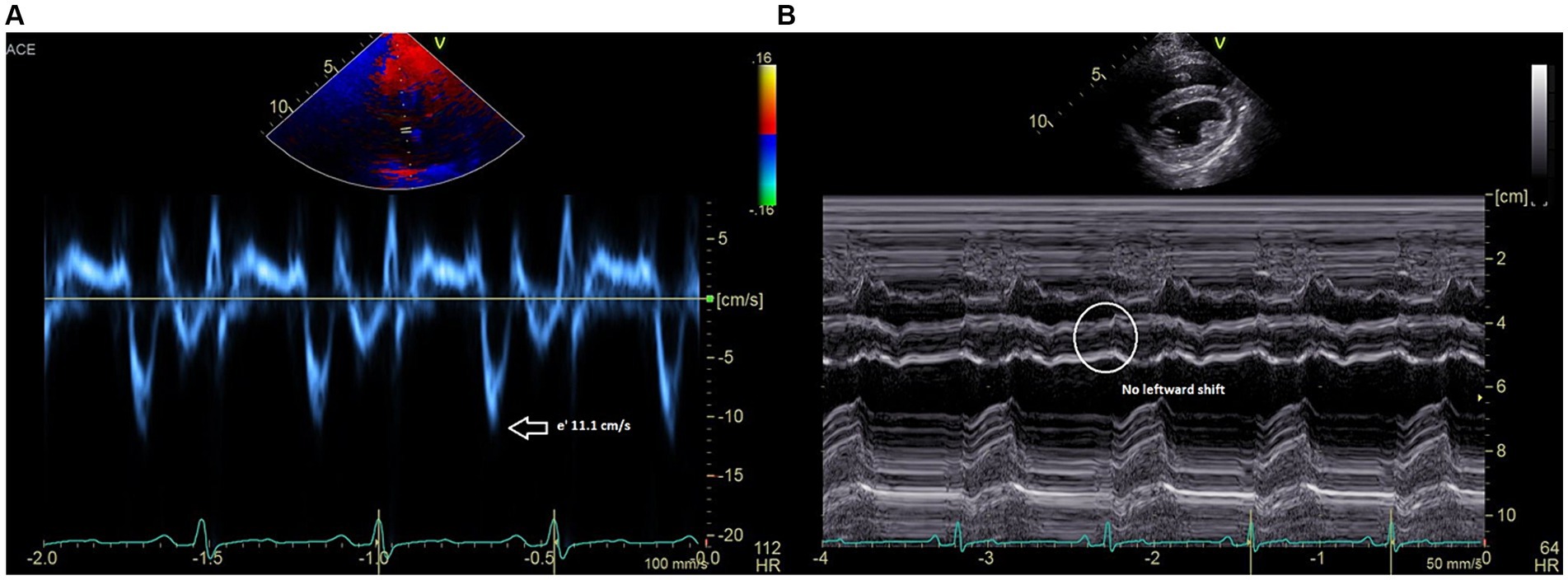
Todas las imágenes ecocardiográficas bidimensionales se obtuvieron utilizando un transductor phased array de 5 MHz (GE Vivid E90). En la ecocardiografía, la epicarditis constrictiva se confirmó en base a los siguientes hallazgos clave: variación respiratoria del >25% en la velocidad de la onda E mitral durante la respiración (Figura 1A); variación respiratoria significativa en los flujos diastólicos tricuspídeos; una velocidad e’ del anillo mitral septal de ≥15 cm/s (Figura 1B); reversión diastólica moderada del flujo venoso hepático con espiración; y desplazamiento septal ventricular hacia la izquierda con inspiración en la imagen en modo M del tabique ventricular (Figura 1C) (5, 7). Con base en este diagnóstico, se recomendó que cualquier tejido pericárdico parietal restante se extirpara quirúrgicamente y, lo que es más importante, que se realizara simultáneamente la escisión epicárdica para aliviar la constricción epicárdica y restaurar la función diastólica. Debido a los prometedores resultados publicados del procedimiento de gofre en medicina humana y a la escasez de estudios veterinarios que citaran la forma de realizar la escisión epicárdica en perros, se optó por realizar un procedimiento de gofre en este paciente.
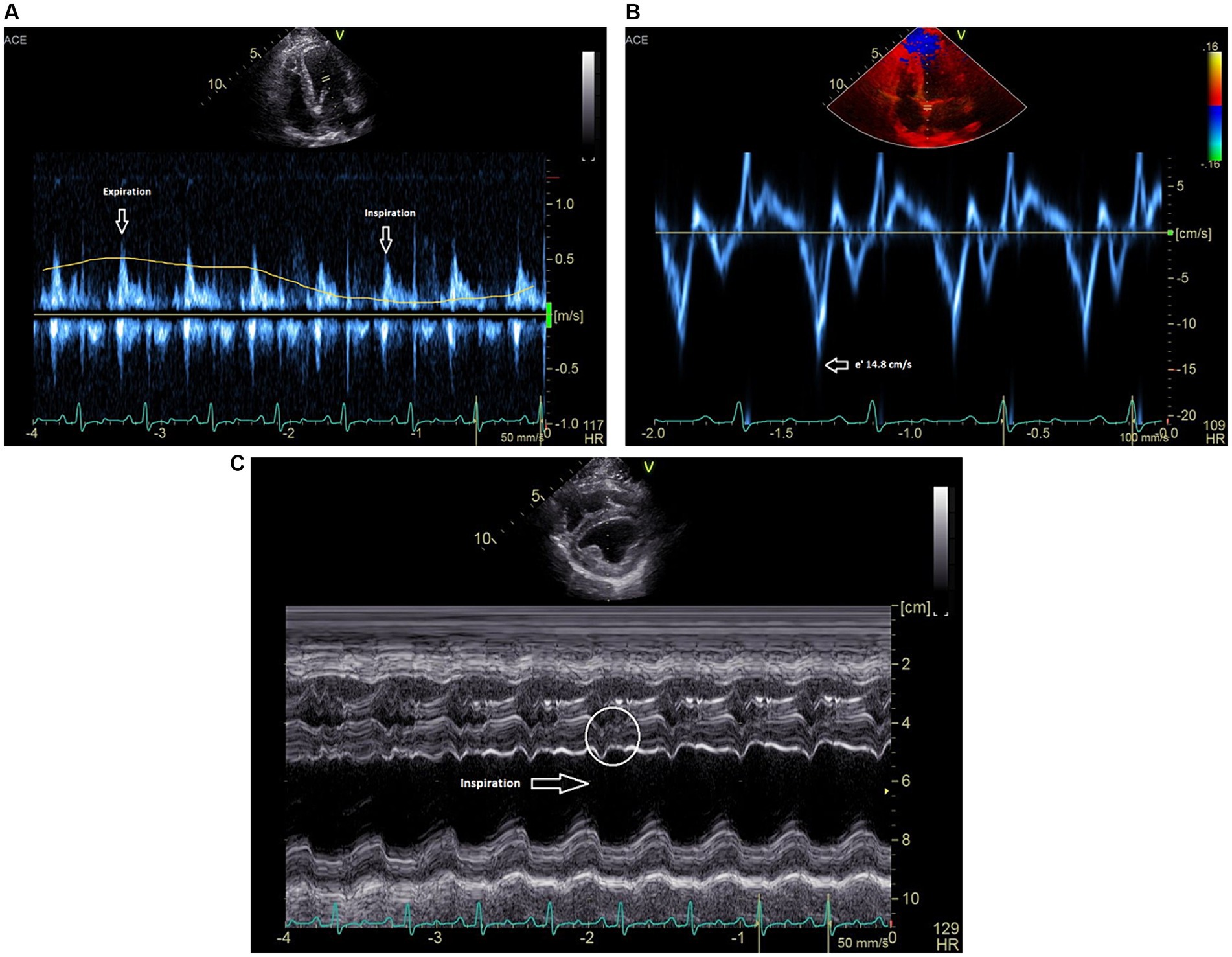 Figura 1. (A) El espectro Doppler de onda pulsada de las velocidades de entrada mitral demuestra una marcada variación respiratoria de las velocidades máximas de la onda E. (B) Anillo mitral medial, diastólica precoz (e’), velocidades Doppler tisulares cercanas a 15 cm/s. (C) Registro en modo M (eje corto) que muestra un cambio del tabique ventricular hacia la izquierda en la inspiración. También se observa un temblor diastólico septal latido a latido.
Figura 1. (A) El espectro Doppler de onda pulsada de las velocidades de entrada mitral demuestra una marcada variación respiratoria de las velocidades máximas de la onda E. (B) Anillo mitral medial, diastólica precoz (e’), velocidades Doppler tisulares cercanas a 15 cm/s. (C) Registro en modo M (eje corto) que muestra un cambio del tabique ventricular hacia la izquierda en la inspiración. También se observa un temblor diastólico septal latido a latido.
Intervención terapéutica
El paciente fue sedado con trazodona oral (3,5 mg/kg cada 8 h) en los 2 días anteriores y la mañana de la anestesia y premedicado con hidromorfona intravenosa (0,1 mg/kg) y midazolam (2 mg/kg). La anestesia fue inducida con propofol (12 mL administrados) y mantenida con isoflurano vaporizado que no superó el 1,5% durante el procedimiento, una infusión continua de lidocaína (50 mcg/kg/min) para mitigar las arritmias ventriculares que pueden ocurrir con la manipulación cardíaca, y una infusión continua de ketamina (0,5 mg/kg/h) y fentanilo (10 mcg/kg/h). Se administraron líquidos intravenosos a razón de 5 mL/kg/h. El paciente fue colocado en decúbito dorsal seguido de preparación aséptica del tórax ventral y abdomen. Se inició ventilación mecánica antes de la incisión de la pared torácica. Se realizó una incisión torácica en la línea media ventral seguida de esternotomía con una sierra sagital accionada por gas. La exploración torácica reveló adherencia del pericardio parietal remanente a las caras dorsal y craneal del corazón y un epicardio firme y fibroso. El pericardio parietal restante se diseccionó lejos del corazón utilizando Blunt y Ligasure™ disección y extirpación a nivel de los nervios frénicos. Durante esta fase del procedimiento, el paciente se vio comprometido hemodinámicamente, experimentando hipotensión (monitorización directa de la presión arterial de 60/30 mmHg) y bradicardia sinusal profunda y bloqueo AV de 2º grado (frecuencia cardíaca de 30-40 lpm). Al paciente se le retiró la anestesia gaseosa y se le mantuvo con anestesia intravenosa total, mediante el aumento de dosis de ketamina (1 mg/kg/h) y fentanilo (20 mcg/kg/h). Se añadió una infusión de norepinefrina de velocidad constante a través de un nuevo catéter intravenoso periférico y se mantuvo a una velocidad de 0,2-0,6 mcg/kg/min. También se administraron dos dosis de atropina intravenosa (0,02 mg/kg). Esto resultó en una ligera mejoría de los parámetros hemodinámicos del paciente, caracterizados por una presión arterial invasiva de 70/30 mmHg y una frecuencia cardíaca de 60 lpm. El catéter arterial experimentó un artefacto de sobreamortiguación significativo que se alivió intermitentemente con el enjuague durante todo el procedimiento.
A continuación, utilizando un bisturí #10 y unas tijeras de iris curvas, se realizaron incisiones de grosor parcial en un patrón en forma de cuadrícula a través de la pared del ventrículo izquierdo seguida de la pared del ventrículo derecho. Primero se realizaron las incisiones longitudinales, seguidas del sombreado cruzado (Figura 2). Las incisiones estaban separadas aproximadamente 1 cm y tenían una profundidad de 5 mm. Se continuó con la disección profunda hasta que se alivió la tensión en el epicardio y se separaron los lados de los rayos. Tan pronto como se realizaron dos incisiones longitudinales en el epicardio, la presión arterial del paciente se normalizó a 90/50 mmHg y la frecuencia cardíaca mejoró a 110 lpm, lo que indica una mejora hemodinámica. La hemorragia leve se controló con cauterización bipolar. Subjetivamente, el ventrículo izquierdo tuvo más expansión y mejoró la contracción después de la formación del waffle. Se colocó un tubo torácico MILA de 12 Fr 30 cm del lado izquierdo y se aseguró con nylon. La cavidad torácica se lavó rutinariamente con solución salina. La incisión de esternotomía se realizó con 1 PDS en patrón cruzado. Los músculos intratorácicos se apusieron mediante 0 PDS en un patrón continuo simple. Nocita (5,3 mg/kg) se inyectó por vía intramuscular y bilateral a lo largo de la incisión. El espacio subcutáneo se cerró con 3-0 Monocryl en un patrón continuo simple, seguido de un cierre intradérmico con Monocryl 3-0 en un patrón continuo simple. A continuación, se aplicaron grapas cutáneas. Utilizando el tubo torácico, se evacuó el tórax de cualquier resto de aire y líquido. El tiempo anestésico total fue de 3 h y 10 min con un tiempo quirúrgico de 2 h y 15 min.®
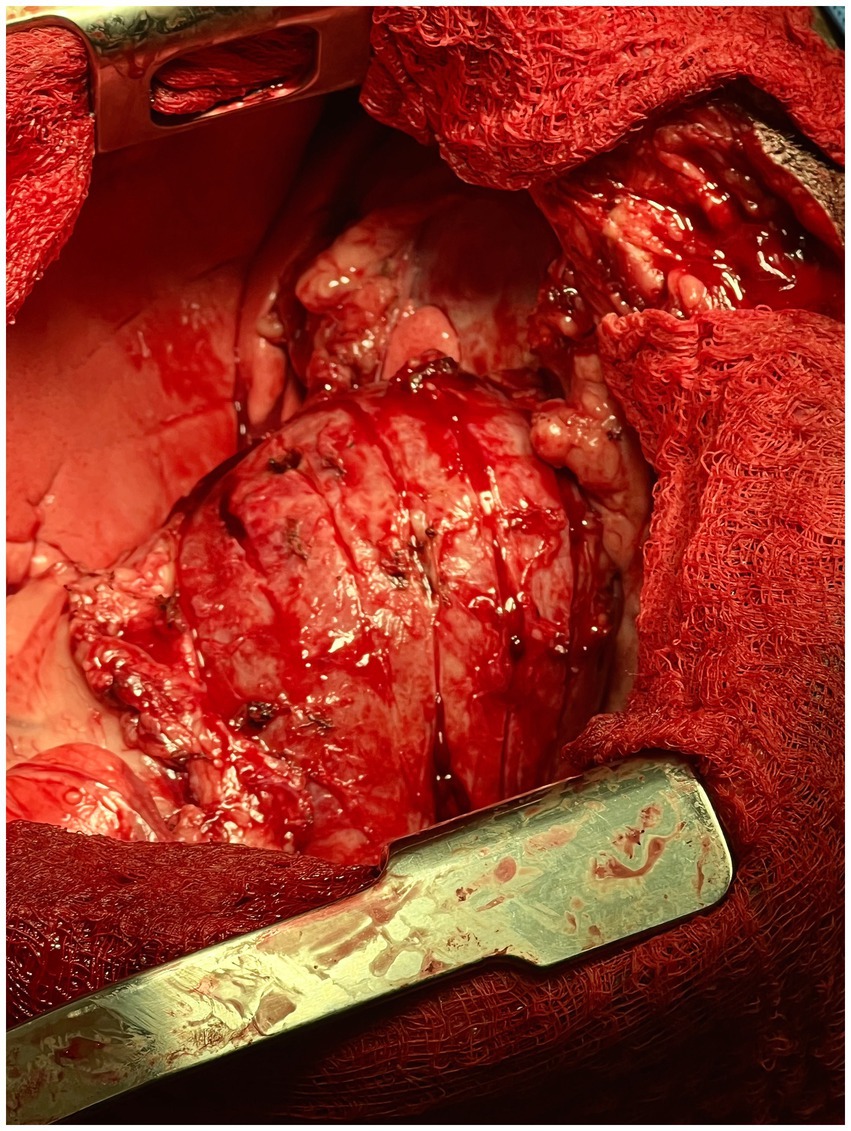 Figura 2. Fotografía intraoperatoria de las incisiones epicárdicas longitudinales realizadas en la pared ventricular izquierda del corazón en el paciente canino descrito en este informe.
Figura 2. Fotografía intraoperatoria de las incisiones epicárdicas longitudinales realizadas en la pared ventricular izquierda del corazón en el paciente canino descrito en este informe.
La ecocardiografía postoperatoria realizada bajo el mismo evento anestésico reveló un patrón normalizado de entrada mitral y tricúspide con respiración, reducción de la velocidad e’ del anillo mitral septal de ~11,1 cm/s (Figura 3A) y sin inversión del flujo venoso hepático durante la espiración. También mejoraron las dimensiones diastólicas internas del ventrículo izquierdo y las estimaciones de la función sistólica (LVIDd 33,7 en comparación con el pre-waffle que midió 29,0; FS 40% en comparación con el pre-waffle que midió 25%) y no se observó desplazamiento septal hacia la izquierda en la inspiración (Figura 3B). El paciente se recuperó sin complicaciones de la anestesia. Las arritmias ventriculares leves se apreciaron por telemetría a las pocas horas del postoperatorio y se resolvieron con un único bolo intravenoso de cloruro de magnesio (3 mEq/kg) diluido 1:3 con NaCl al 0,9% y administrado durante 15 min.
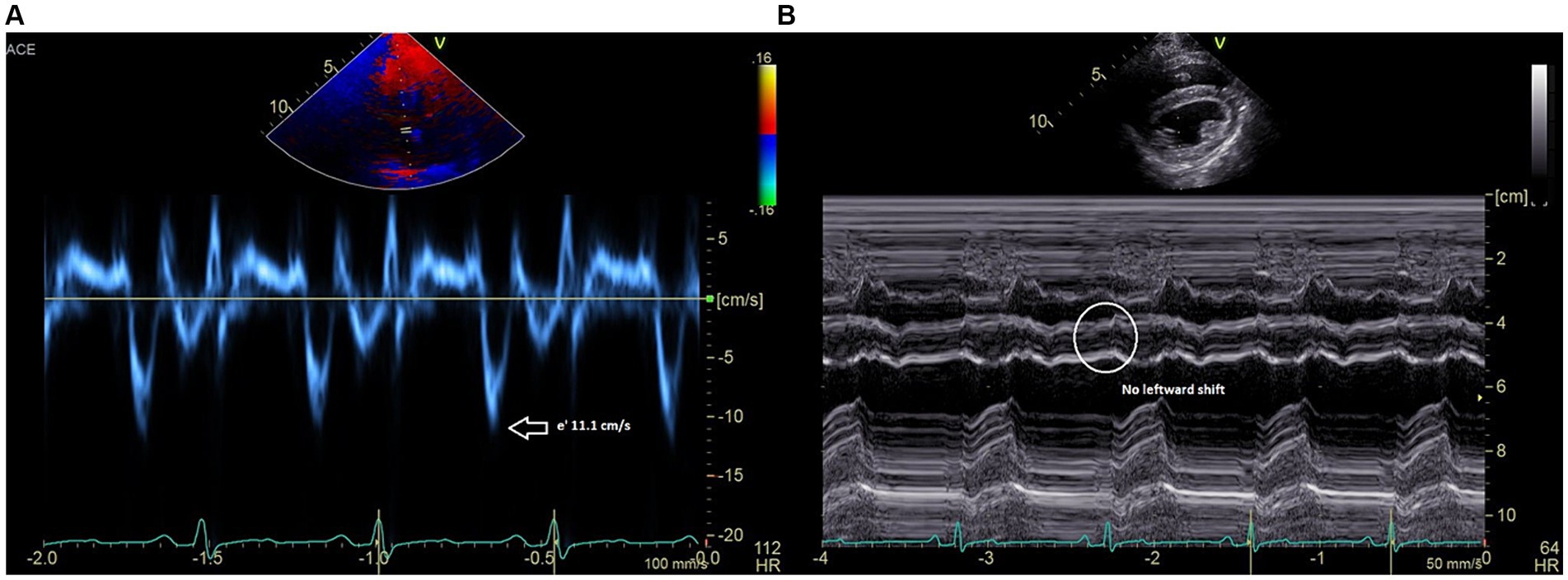 Figura 3. (A) Las velocidades Doppler tisular diastólica precoz (e’) del anillo mitral medial se reducen a 11 cm/s. (B) Registro en modo M (eje corto) que muestra un desplazamiento del tabique ventricular hacia la izquierda resuelto y un temblor diastólico septal latido a latido resuelto.
Figura 3. (A) Las velocidades Doppler tisular diastólica precoz (e’) del anillo mitral medial se reducen a 11 cm/s. (B) Registro en modo M (eje corto) que muestra un desplazamiento del tabique ventricular hacia la izquierda resuelto y un temblor diastólico septal latido a latido resuelto.
Evolución del paciente
La histopatología realizada en el tejido epicárdico extraído mostró una marcada fibrosis con necrosis multifocal y endocarditis linfocítica, histiocítica y neutrofílica. No hubo evidencia de enfermedad infecciosa o neoplasia.
El perro fue dado de alta 4 días después de la operación con gabapentina oral (10 mg/kg) cada 8-12 h sin complicaciones aparentes y sin ascitis recurrente. Una vez obtenidos los resultados de la biopsia, se inició el tratamiento con espironolactona (2 mg/kg dos veces al día) por los beneficios antifibróticos. Se requirió una sola abdominocentesis a las 4 semanas del postoperatorio. Desde que se realizó esa abdominocentesis han transcurrido 7 meses y no se ha producido ningún acúmulo significativo de ascitis.
Discusión
La parálisis cerebral es rara tanto en humanos como en especies veterinarias. Hay informes de casos limitados en gatos, vacas y caballos (8-11). En 1984 se publicó una pequeña serie de casos en los que se describió la hemodinámica de cateterismo cardíaco de la pericarditis constrictiva en perros (1), así como algunos informes y una serie de 17 casos de pericarditis efusiva-constrictiva inducida por coccidioidomicosis en caninos publicados en 2005 (4, 12, 13). La causa de la parálisis cerebral es a menudo desconocida, pero cuando se identifica en animales, puede ser causada por cuerpos extraños metálicos, agentes infecciosos como actinomicosis y coccidioidomicosis, afecciones crónicas como quilotórax o derrame pericárdico idiopático y neoplasias como linfoma, mesotelioma o carcinomatosis del pericardio (2, 8, 14). En humanos, las causas más comunes son idiopáticas (61%) y después de una cirugía cardíaca (37%) (15).
Diagnóstico
La principal consecuencia hemodinámica de la parálisis cerebral es una marcada reducción del llenado ventricular y, por lo tanto, del volumen ventricular con una mayor dependencia interventricular como resultado del encajonamiento del corazón dentro de una membrana fibrótica distensible. Aunque la constricción afecta a ambos ventrículos por igual, el síndrome clínico se caracteriza por signos de insuficiencia cardíaca derecha debido a la elevación de la presión venosa central (1, 8).
La medición invasiva de la presión hemodinámica mediante cateterismo cardíaco es el estándar de oro para el diagnóstico de la parálisis cerebral en humanos. Los hallazgos distintivos incluyen la elevación e igualación de las presiones diastólicas finales en ambos ventrículos (interdependencia ventricular) y una «raíz cuadrada» o caída diastólica temprana y signo de meseta diastólica media en los trazados ventriculares con descensos x e y prominentes en los trazados auriculares (1). Debido al costo y la naturaleza invasiva de esta prueba diagnóstica, el cateterismo cardíaco a menudo no se realiza en pacientes veterinarios.
En este caso, los hallazgos ecocardiográficos se utilizaron para apoyar fuertemente el diagnóstico de epicarditis visceral constrictiva. En el corazón con un pericardio normal, los ventrículos izquierdo y derecho pueden llenarse de forma relativamente independiente, de modo que durante la inspiración, cuando la presión intratorácica negativa aumenta el retorno venoso al corazón derecho, la pared libre del ventrículo derecho puede moverse excéntricamente para permitir un mayor llenado (8, 16). Sin embargo, con la parálisis cerebral, el aumento del llenado del ventrículo derecho con la inspiración se produce con compromiso del ventrículo izquierdo debido al aumento de la interdependencia ventricular. El tabique ventricular es forzado hacia la izquierda, lo que se puede observar en el modo M en este paciente (Figura 1C). Debido al compromiso del llenado del lado izquierdo durante la inspiración, la variación respiratoria del >25% en la velocidad de la onda E mitral se considera un signo específico de pericarditis constrictiva en pacientes humanos (7, 16) y se documentó en este caso (Figura 1A). Por último, una relación de reversión diastólica espiratoria de la vena hepática >/= 0,79 tiene una sensibilidad del 87% y una especificidad del 91% para el diagnóstico de pericarditis constrictiva en humanos, y también se observó en ella (16). Todas las características ecocardiográficas de la pericarditis constrictiva se resolvieron en este caso después del procedimiento de waffle.
Tratamiento quirúrgico
Tanto en pacientes veterinarios como humanos, la pericardiectomía es el procedimiento estándar que se realiza para aliviar la disfunción diastólica causada por la pericarditis constrictiva. Se asocia con una tasa de mortalidad del 6 al 19% en estudios en humanos (17). En un pequeño subconjunto de pacientes humanos con pericarditis constrictiva, el epicardio también está engrosado, lo que da lugar a una epicarditis constrictiva. Estos pacientes afectados no mejoran en el postoperatorio, por lo que requieren una cirugía repetida llamada procedimiento de gofre (5, 15).
El procedimiento de gofre fue descrito por primera vez en medicina humana en 1983 por Heimbecker como una alternativa menos traumática y eficaz a la resección epicárdica en pacientes con epicarditis constrictiva. Tras la extirpación del pericardio parietal, la técnica se describió como una serie de incisiones epicárdicas realizadas con disección eléctrica y/o aguda tanto en dirección longitudinal como transversal (en forma de rejilla). A continuación, se introdujo un director ranurado debajo del epicardio engrosado para despegar el tejido constrictor de la forma más atraumática posible (18). Toda la superficie de ambos ventrículos se hizo una incisión de manera similar hasta que el epicardio se convirtió en un patrón similar a un gofre de 1 cm2 islas de tejido cicatricial (Figura 4). Cabe destacar que es imperativo comenzar el procedimiento sobre el ventrículo izquierdo para evitar la insuficiencia cardíaca izquierda aguda. Si primero se realiza una incisión en forma de gofre sobre el ventrículo derecho, el ventrículo izquierdo sufriría inmediatamente una precarga masiva sin el «estallido» de la disfunción diastólica, lo que daría lugar a un edema pulmonar fulminante agudo (19). Una vez que se completa el gofre, a menudo se observa una expansión ventricular inmediata y un aumento de la contractilidad.
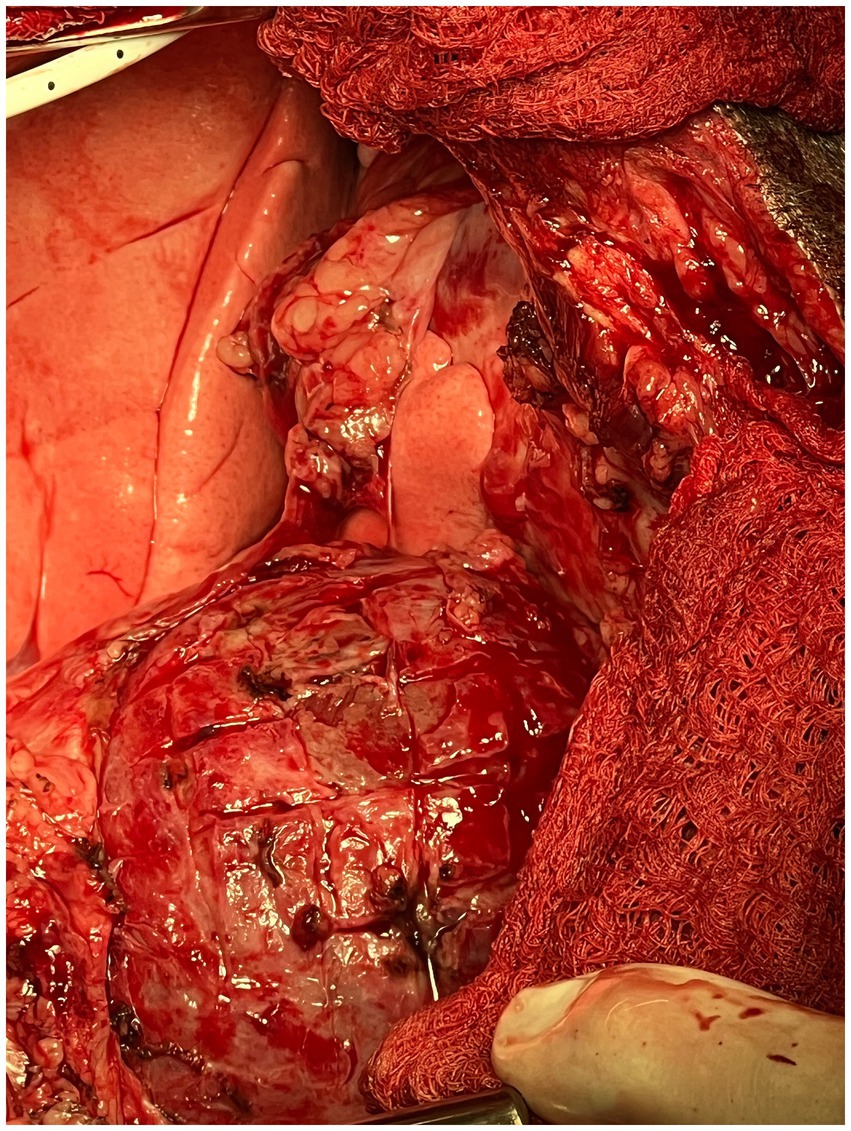 Figura 4. Fotografía intraoperatoria del gofre epicárdico completo en el paciente canino descrito en este informe.
Figura 4. Fotografía intraoperatoria del gofre epicárdico completo en el paciente canino descrito en este informe.
Desde que esta técnica se describió originalmente en 1983, ha habido otros 10 artículos que hacen referencia al procedimiento de gofres en medicina humana con resultados exitosos a corto plazo (20). A pesar de que existe un reporte de escisión epicárdica o stripping en perros (13), hasta donde sabe el autor, este reporte es la primera descripción del procedimiento de gofre en medicina veterinaria. Y lo que es aún más singular, se realizó en un paciente que se había sometido previamente a una pericardiectomía subtotal y que tenía signos recurrentes de insuficiencia cardíaca congestiva del lado derecho meses después.
Resultado
Los estudios en humanos han demostrado que el procedimiento de waffle, realizado junto con una pericardiectomía total para la pericarditis constrictiva con engrosamiento epicárdico, resultó en una función diastólica postoperatoria superior en comparación con la pericardiectomía total sola (6, 20). Además, la adición del procedimiento de gofre a la pericardiectomía total no aumentó significativamente el tiempo operatorio, la pérdida de sangre, la transfusión de sangre perioperatoria o la estancia postoperatoria en estos pacientes (6). No hay informes en la literatura humana sobre la supervivencia a largo plazo de los pacientes que se someten al procedimiento de gofre en comparación con los que se someten a pericardiectomía sola. Un estudio retrospectivo realizado por Gatti et al. incluyó a 81 pacientes humanos que se sometieron a pericardiectomía por pericarditis constrictiva, incluido el procedimiento de gofre en varios de estos pacientes. Mostró una supervivencia a 10 años libre de muerte por todas las causas del 76,9% con la eliminación completa de la constricción cardíaca a través de la escisión epicárdica, lo que podría mejorar los resultados a largo plazo (21). La serie de casos veterinarios de Heinritz et al., que detalla los resultados de 17 perros con pericarditis efusivo-constrictiva inducida por coccidioidomicosis, tratados con pericardiectomía subtotal y escisión epicárdica, mostró una tasa de mortalidad perioperatoria del 23,5% y una tasa de supervivencia a los 2 años después del alta del 82% (13).
En conclusión, este caso clínico describe el diagnóstico ecocardiográfico de epicarditis constrictiva y el tratamiento quirúrgico exitoso con un procedimiento de gofre en un paciente previamente sometido a pericardiectomía subtotal. En el momento de escribir este artículo, 8 meses después del waffle, el paciente permanece asintomático. Se requieren casos adicionales para validar la seguridad y eficacia del procedimiento de gofres para esta afección poco común en pacientes veterinarios, pero este informe muestra resultados alentadores.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Contribuciones de los autores
RS: Redacción – revisión y edición, Redacción – borrador original. SG: Escritura, revisión y edición. BL: Escritura – revisión y edición. SJ: Escritura, revisión y edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Thomas, WP, Reed, JR, Bauer, TG y Breznock, EM. Enfermedad pericárdica constrictiva en el perro. J Am Vet Med Assoc. (1984) 184:546–53.
2. De Madron, E. Enfermedades pericárdicas. E MadronDe, (Ed.). Ecocardiografía clínica del perro y del gato. St. Louis, MO: Elsevier (2005) 268–269
3. Minagawa, T, Ohara, T, Kasegawa, K, Takeda, M, Hiranuma, W, Matsuoka, T, et al. Persistencia del patrón constrictivo a pesar de la mejoría de los síntomas después del procedimiento de gofre: informe de un caso de pericarditis constrictiva. Estuches para tarjetas J. (2020) 22:85–9. doi: 10.1016/j.jccase.2020.04.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Rivera, PA, y Borgarelli, M. Imágenes cardiovasculares: pericarditis constrictiva y derrame tricavitario en un perro con mesotelioma pericárdico. Tarjeta J Vet. (2020) 32:55–9. doi: 10.1016/j.jvc.2020.09.005
5. Kiamanesh, O, Luk, A, Nesbitt, GC, Badiwala, M y Mak, S. Gofre pericárdico para la pericarditis efusiva-constrictiva. Falla cardíaca ESC. (2020) 7:3213–4. doi: 10.1002/ehf2.12926
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Shiraishi, M, Yamaguchi, A, Muramatsu, K, Kimura, N, Yuri, K, Matsumoto, H, et al. Validación del procedimiento de gofre para pericarditis constrictiva con engrosamiento epicárdico. Cirugía Cardiovasca de Tórax Gen (2014) 63:30–7. doi: 10.1007/s11748-014-0434-6
7. Hatle, LK, Appleton, CP y Popp, RL. Diferenciación de la pericarditis constrictiva y la miocardiopatía restrictiva mediante ecocardiografía Doppler. Circ. (1989) 79:357-70. doi: 10.1161/01.CIR.79.2.357
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Thomason, JD, Radlinsky, MG, Rapoport, G, Howerth, EW, Acevedo, KF, Fallaw, TL, et al. Diagnóstico ecocardiográfico Doppler y tratamiento quirúrgico de la pericarditis constrictiva en un gato. J Feline Med Surg. (2012) 14:276–9. doi: 10.1177/1098612X11435041
9. Nigam, JM y Manohar, M. Pericardectomía como tratamiento para la pericarditis constrictiva en una vaca. Rec. Veterinario (1973) 92:202–3. doi: 10.1136/vr.92.8.202
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Elhanafy, MM, y French, DD. Presentación atípica de pericarditis constrictiva en una vaquilla Holstein. Representante de Caso Vet Med. (2012) 2012:1–5. doi: 10.1155/2012/604098
11. Hardy, J, Robertson, JT y Reed, SM. Pericarditis constrictiva en una yegua: intento de tratamiento mediante pericardiectomía parcial. Eq Vet J. (1992) 24:151–4. doi: 10.1111/j.2042-3306.1992.tb02802.x
12. Campbell, SL, Forrester, SD, Johnston, SA, Jacobson, JD y Moon, ML. Quilotórax asociado con pericarditis constrictiva en un perro. J Am Vet Med Assoc. (1995) 206:1561–4. doi: 10.2460/javma.1995.206.10.1561
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Heinritz, CK, Gilson, SD, Soderstrom, MJ, Robertson, TA, Gorman, SC, y Boston, RC. Pericardectomía subtotal y escisión epicárdica para el tratamiento de la pericarditis efusiva-constrictiva inducida por coccidioidomicosis en perros: 17 casos (1999-2003). J Am Vet Med Assoc. (2005) 227:435–9. doi: 10.2460/javma.2005.227.435
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Berg, R, y Wingield, W. Derrame pericárdico en el perro: una revisión de 42 casos. J Am Anim Hosp Assoc. (1984) 20:721–30.
15. Espejo-Paeres, C, Marcos-Alberca, P, Nicolás-Pérez, C, y Macaya, C. El procedimiento de waffle como tratamiento de un primer episodio de insuficiencia cardíaca derecha: reporte de un caso. Eur Corazón J. (2018) 2:1–5. doi: 10.1093/ehjcr/yty148
16. Welch, TD, Ling, LH, Espinosa, RE, Anavekar, NS, Wiste, HJ, Lahr, BD, et al. Diagnóstico ecocardiográfico de pericarditis constrictiva. Imágenes de Circ Cardiovasc. (2014) 7:526–34. doi: 10.1161/CIRCIMAGING.113.001613
17. Hoit, BD. Manejo de la cardiopatía pericárdica efusiva y constrictiva. Circ. (2001) 105:2939–42. doi: 10.1161/01.CIR.0000019421.07529.C5
18. Heimbecker, RO, Smith, D, Shimizu, S, y Kestle, J. Técnica quirúrgica para el tratamiento de la epicarditis constrictiva que complica la pericarditis constrictiva (el procedimiento de waffle). Ann Thorac Surg. (1983) 36:605–6. doi: 10.1016/S0003-4975(10)60693-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Matsuura, K, Mogi, K y Takahara, Y. Procedimiento de gofre sin bomba con bisturí ultrasónico para la pericarditis constrictiva. Eur J Cirugía cardiotorácica. (2015) 47:e220-2. doi: 10.1093/ejcts/ezu554
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Muraoka, A, Aizawa, K, y Misawa, Y. Procedimiento de gofre para pacientes seleccionados con pericarditis constrictiva. Ann Clin Representante de Casos (2017) 2:1–2.
21. Gatti, G, Fiore, A, Ternacle, J, Porcari, A, Fiorica, I, Poletti, A, et al. Pericardiectomía para pericarditis constrictiva: análisis de factores de riesgo para fracaso precoz y tardío. Vaso cardíaco. (2020) 35:92–103. doi: 10.1007/s00380-019-01464-4
Palabras clave: pericardiectomía, gofre, epicarditis, constrictiva, derrame pericárdico
Cita: Saunders R, Garnett S, Lucchetti B y Jesty S (2024) Caso clínico: Tratamiento de la epicarditis constrictiva mediante el procedimiento de gofre en un perro que se había sometido previamente a una pericardiectomía subtotal. Frente. Vet. Sci. 11:1335433. doi: 10.3389/fvets.2024.1335433
Recibido: 08 de noviembre de 2023; Aceptado: 04 de abril de 2024;
Publicado: 12 Abril 2024.
Editado por:
Michael Jaffe, Universidad Estatal de Mississippi, Estados Unidos
Revisado por:
Philipp Mayhew, Universidad de California, Davis, Estados
Unidos Bruno Alberigi, Universidad Federal Rural de Río de Janeiro, Brasil
Derechos de autor © 2024 Saunders, Garnett, Lucchetti y Jesty. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Rebecca Saunders, rebecca.saunders@nva.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía