Una dosis viva atenuada de la vacuna contra Salmonella Typhimurium
Una dosis viva atenuada de la vacuna contra Salmonella Typhimurium y un diluyente tienen efectos mínimos sobre la microbiota cecal de los pollos ponedoras
 Samiullah Khan1
Samiullah Khan1  Andrea R. McWhorter1
Andrea R. McWhorter1  Daniel M. Andrews2
Daniel M. Andrews2  Gregory J. Underwood2
Gregory J. Underwood2  Robert J. Moore3
Robert J. Moore3  Thi Thu Hao Van3
Thi Thu Hao Van3  Richard K. Gast4
Richard K. Gast4  Kapil K. Chousalkar1*
Kapil K. Chousalkar1*- 1Facultad de Ciencias Animales y Veterinarias, Universidad de Adelaida, Roseworthy, SA, Australia
- 2Bioproperties Pty Ltd, Ringwood, VIC, Australia
- 3Facultad de Ciencias, Universidad RMIT, Bundoora, VIC, Australia
- 4Centro Nacional de Investigación Avícola de EE. UU., Servicio de Investigación Agrícola del USDA, Athens, GA, Estados Unidos
Entre las estrategias de reducción de Salmonella en la producción avícola, una opción es utilizar una vacuna contra Salmonella. El objetivo de vacunar a las parvadas de ponedoras es reducir la excreción de Salmonella de tipo silvestre en el entorno avícola, reduciendo así la contaminación de los productos avícolas (huevos y carne). El diluyente nutritivo y una dosis más alta de la vacuna pueden mejorar su potencial de colonización en el intestino de los pollos. En este estudio, se reconstituyó una vacuna viva atenuada disponible comercialmente (Vaxsafe ST) en diferentes medios y se administró por vía oral a pollitos de un día de edad en tres dosis diferentes (10®7, 108y 109 UFC/pollito). Se evaluó la colonización intestinal de la cepa vacunal y los efectos de la vacunación sobre la microbiota intestinal en pollos ponedoras comerciales. El diluyente y la dosis de la vacuna afectaron mínimamente a la diversidad alfa de la microbiota. La diversidad beta de la microbiota fue significativamente diferente (P < 0,05) en función del diluyente y la dosis de la vacuna, lo que indicó que los pollos vacunados y no vacunados tenían diferentes comunidades microbianas intestinales. Se observaron diferencias en la abundancia de varios géneros, incluyendo Blautia, Colidextribacter, Dickeya, Enterococcus, Lactobacillus, Pediococcus y Sellimonas. La abundancia de Colidextribacter fue significativamente menor en los pollos que recibieron la vacuna reconstituida en diluyentes de Marek y agua, mientras que la abundancia de Lactobacillus fue significativamente menor en el grupo de agua. La dosis más alta de la vacuna (109 UFC/pollito) no alteraron significativamente (P > 0.05) la abundancia de géneros microbianos. La edad de los pollos afectó a la composición de la microbiota de forma más significativa que la dosis y el diluyente de la vacuna. La abundancia de Lactobacillus, Blautia, Caproiciproducens, Pediococcus y Colidextribacter fue significativamente mayor en el día 14 en comparación con el día 7 después de la vacunación. La carga vacunal de Salmonella Typhimurium en el ciego no se vio afectada significativamente por el diluyente y la dosis de la vacuna; sin embargo, fue significativamente menor (P < 0,0001) en el día 14 en comparación con el día 7 después de la vacunación. En general, el S. La vacuna contra el typhimurium afectó mínimamente a la estructura de la microbiota intestinal de los pollitos ponedores, mientras que los cambios en la microbiota fueron más significativos con la edad de los pollos.
Introducción
Los serotipos patógenos de Salmonella asociados con animales destinados a la producción de alimentos causan salmonelosis en humanos si se consumen productos contaminados. Según la Organización Mundial de la Salud (OMS), la salmonela es una de las cuatro causas clave de enfermedades diarreicas a nivel mundial. En los países miembros de la Unión Europea, en 2021 se notificaron un total de 50.817 casos de salmonelosis humana (1). En Australia, en 2021, el Sistema Nacional de Vigilancia de Enfermedades de Notificación Obligatoria documentó un total de 10.828 casos notificados de salmonelosis humana. La carne y los huevos de pollo son una fuente importante de salmonelosis humana (2). Por lo tanto, las estrategias para reducir la contaminación por Salmonella a nivel de granja son una forma de reducir la salmonelosis humana.
Entre las estrategias de reducción de Salmonella a nivel de granja, la vacunación de las parvadas desempeña un papel fundamental. Las parvadas vacunadas eliminan niveles más bajos de Salmonella, y esto resulta en una menor contaminación de los huevos y la carne durante la clasificación de los huevos o el procesamiento de la carne (3). En Australia, muchas reproductoras de ponedoras comerciales, reproductoras de pollos de engorde y ponedoras comerciales están vacunadas con una vacuna viva atenuada contra Salmonella Typhimurium, Vaxsafe ST (Bioproperties Pty Ltd). Vaxsafe ST es una vacuna liofilizada con mutación aroA que normalmente se reconstituye en agua estéril para su administración oral y en aerosol. La mutación aroA interrumpe la vía bioquímica del shikimato, interrumpiendo así la producción de aminoácidos aromáticos esenciales, lo que impide el crecimiento en el huésped, ya que estos compuestos no están disponibles libremente. Estudios previos de Vaxsafe ST en pollos mostraron que era parcialmente eficaz para proteger a los pollos de la infección por Salmonella de tipo salvaje (4, 5). Las otras formas de vacunas contra la Salmonella, autógenas o muertas, no se utilizan comúnmente en la industria avícola australiana. Un estudio en el que se compararon los efectos de las vacunas vivas atenuadas frente a las vacunas muertas de forma múltiple mostró que la vacuna muerta proporcionaba una protección a corto plazo, mientras que la vacuna viva atenuada inyectada producía una protección más duradera (4). La limitación de las vacunas autógenas es que deben administrarse varias veces para el cebado y la generación de respuestas inmunitarias a largo plazo. Las múltiples administraciones de una vacuna inyectada la hacen poco práctica, sobre todo teniendo en cuenta el tamaño de la parvada de pollos y el coste laboral asociado. La vacuna viva atenuada registrada en Australia, Vaxsafe ST, se administra el día 1 mediante pulverización gruesa, en las semanas 2 a 4 a través del agua potable y en la semana 12 de la edad de los pollos mediante inyección intramuscular, un protocolo de vacunación que es económicamente viable y ampliamente adoptado. Para la administración intramuscular a las 12 semanas de edad de los pollos, esta vacuna se reconstituye en agua o en el diluyente de Marek.®
En los últimos años, se han llevado a cabo muchos estudios para comprender y definir el papel beneficioso de la microbiota intestinal en la exclusión competitiva de patógenos y cómo influyen en ello las variaciones en la composición, el entorno del huésped y los tratamientos. En los pollos, las diferencias en la microbiota intestinal de los pollos de engorde y las ponedoras (6) indican el papel del genotipo y la dieta. En las gallinas ponedoras, la microbiota intestinal varía con la edad y el segmento intestinal, donde hay más microbiota compleja taxonómica presente en el ciego en comparación con el íleon (7). Los días 1 a 3 de la edad de los pollos son críticos para el desarrollo de la microbiota, mientras que alrededor del día 7, la mayoría de los taxones que se encuentran en las aves maduras ya están presentes; sin embargo, las fluctuaciones en la abundancia de miembros de la comunidad microbiana continúan durante varias semanas (8).
La microbiota intestinal puede verse influenciada positiva o negativamente, dependiendo del factor desencadenante y su nivel asociado. En los pollos, entre los diferentes segmentos del intestino, los ciegos contienen la mayor diversidad y las poblaciones más densas de microbiota (9). En general, las condiciones de estrés, los agentes infecciosos y el uso de antibióticos pueden alterar la microbiota intestinal. Por ejemplo, el uso de antibióticos dietéticos redujo la diversidad alfa (riqueza), la diversidad beta y la abundancia de la microbiota cecal en pollos de engorde (10). En las gallinas ponedoras, se ha demostrado que el estrés térmico reduce los Firmicutes y aumenta los Bacteroidetes en las heces, lo que provoca la perturbación de la microbiota intestinal y sus funciones (11). Los agentes infecciosos pueden tener profundos efectos negativos en la microbiota intestinal de los pollos, como se observa en la enfermedad de Marek (12), la bronquitis infecciosa (13), la campilobacteriosis (14), la salmonelosis (15), la enteritis necrótica (16) y la gripe aviar (17).
A diferencia de los patógenos infecciosos, las vacunas utilizadas para proteger contra ellos no han sido ampliamente probadas en cuanto a las interacciones de la microbiota en muchas vacunas avícolas. Un estudio en pollos de engorde sugirió que la vacunación contra la coccidiosis influyó positivamente en la población de Lactobacillaceae, Enterobacteriaceae, Clostridiaceae y Streptococcaceae en ciegos a los 21 días de edad (18). La administración oral de un S. recombinante. La vacuna contra el Typhimurium en pollos Leghorn Blanco de 4 días de edad alteró significativamente la diversidad alfa (riqueza) y la diversidad beta de la microbiota cecal analizada en la semana 5 de la edad de los pollos (19).
Dado que Vaxsafe ST se prepara mediante la disrupción parcial del gen aroA, la vacuna no puede sintetizar algunos compuestos aromáticos. Las bacterias cultivadas en caldo nutritivo pueden aumentar la expresión de genes de la patogenicidad de Salmonella isla-1 que facilitan la adhesión e invasión a las células epiteliales intestinales. Múltiples serovares de Salmonella cultivados estáticamente en agar y suspendidos en solución salina exhiben capacidades de invasión marcadamente más bajas que las mismas cepas cultivadas en caldo rico en nutrientes (20, 21). Por lo tanto, planteamos la hipótesis de que la reconstitución de Vaxsafe ST en diluyente nutritivo mejoraría su capacidad de colonización en el intestino de los pollos. Se seleccionó el diluyente de Marek porque se utiliza en la industria avícola para la reconstitución de Vaxsafe ST para inyección intramuscular en la semana 12 y también se utiliza para reconstituir la vacuna contra la enfermedad de Marek. También se utilizó diluyente de agua de peptona tamponada (BPW), ya que su composición es muy similar a la del diluyente de Marek. Para comparar los diluyentes nutritivos, se utilizó agua estéril como control. Además, se utilizaron múltiples dosis de Vaxsafe ST para evaluar si una dosis más alta conduciría a un aumento significativo en la colonización de la vacuna en el intestino. Los principales objetivos del presente estudio fueron comprender los efectos del diluyente de la vacuna y la dosis de la vacuna (Vaxsafe ST) en la colonización de la vacuna en los ciegos y la microbiota cecal del huésped en pollos ponedoras comerciales vacunados al día de edad, un momento en el que la microbiota intestinal está cambiando rápidamente.
Materiales y métodos
Declaración ética
El Comité de Ética Animal de la Universidad de Adelaida aprobó todos los trabajos (número de aprobación S-2017-080) de acuerdo con las directrices especificadas en el «Código australiano para el cuidado y uso de animales con fines científicos, 8ª edición (2013)». El estudio siguió las directrices ARRIVE requeridas para los experimentos in vivo (22).
Incubación y cría de gallinas ponedoras
Los pollos ponedoras Isa-Brown de sexo mixto nacieron y se criaron (n = 192) en la Facultad de Ciencias Animales y Veterinarias, Campus Roseworthy, Universidad de Adelaida, según los procedimientos estándar detallados en la Guía de Manejo Isa-Brown. Los diferentes grupos de tratamiento se criaron en corrales de piso (55 cm de ancho × 125 cm de largo) en salas separadas en un centro de investigación con animales pequeños. Las aves se dividieron en 12 grupos de tratamiento, y en cada punto de tiempo de muestreo, un mínimo de 6 pollos fueron sacrificados humanamente por dislocación cervical. La malla de cada corral se cubrió con papel de pollita (205 GSM). El estado libre de salmonela de los pollos eclosionados se confirmó mediante el cultivo de muestras de meconio (n = 4) de la incubadora (Maru 190 Deluxe Cabinet), como se describió anteriormente (15). Los detalles de los grupos de tratamiento se proporcionan en la Tabla 1.
Reconstitución de vacunas y vacunación de pollos
Los viales de Vaxsafe ST (Bioproperties) se reconstituyeron en 1 ml de diluyente de Marek, agua de peptona tamponada o agua. Para el diluyente de Marek, el vial de la vacuna reconstituida (que contiene 1010 UFC/ml) se diluyó en serie 10 veces en el mismo diluyente para lograr 109 y 108 UFC por ml. El proceso se repitió para preparar diluciones de vacunas en BPW y diluyentes de agua. La dosis recomendada por el fabricante de la vacuna es de 107 UFC por pollo. Las dosis más altas de la vacuna (109 y 108 UFC/pollito) se incluyeron en el estudio para comprender si mejoraban la capacidad de colonización de la vacuna en el intestino. El día 1 después de la eclosión, los pollos individuales de los respectivos grupos de tratamiento recibieron dosis de 100 μl de la vacuna reconstituida respectiva por vía oral. Cada ave fue vacunada por vía oral para garantizar una administración uniforme de la vacuna. Los pollos no vacunados recibieron 100 μl de los diluyentes estériles. Los pollos fueron sacrificados los días 7 y 14 para el análisis de la microbiota cecal y la cuantificación de la carga vacunal en el contenido cecal. El contenido cecal se recolectó y congeló a -80 °C hasta que se utilizó para la extracción de ADN.
Extracción total de ADN del contenido cecal
El ADN total se extrajo de 192 muestras de contenido cecal luminal utilizando un protocolo modificado para el QIAamp FAST DNA Stool Mini Kit (Qiagen). El contenido cecal se recolectó de las aves en cada punto de muestreo. Brevemente, se pesaron aproximadamente 200 mg de contenido cecal por muestra en un tubo de cierre seguro de 1,5 ml y en cada muestra se añadieron 700 μl de tampón InhibitEx. Para una lisis máxima de las células microbianas, una mezcla de perlas de vidrio (lavadas con ácido ≤ 106 μm y 425-600 μm; Sigma Aldrich) se añadió a las muestras y se homogeneizó en un mezclador de balas (Next Advances) durante 5 min a velocidad 10. Las muestras fueron procesadas para la extracción de ADN como se describió anteriormente (23). Se analizó la cantidad (promedio de 88 ng/μl) y la pureza (valor promedio de 260/280 de 1,90 y valor de 260/230 de 1,70) de cada muestra de ADN para garantizar que fueran adecuadas para la secuenciación y la qPCR.
Secuenciación del metagenoma del ARNr 16s y análisis de datos
Todas las muestras fueron amplificadas por PCR para el análisis del gen 16S rRNA. Las regiones V3-V4 se amplificaron con polimerasa de alta fidelidad Q5 (New England Biolabs) utilizando los pares de cebadores 338F (5′-ACTCCTACGGGAGGCAGCAGCAG-3′) y 806R (5′-GGACTACHVGGGTWTCTAAT-3′) como se describió anteriormente (24) y se secuenciaron en un instrumento Illumina MiSeq utilizando un kit de extremos emparejados de 2 × 300 pb. Los datos de la secuencia se demultiplexaron con el software Illumina integrado, y el análisis se realizó en Quantitative Insights into Microbial Ecology 2 (QIIME2) (25). El filtrado de calidad, la eliminación de ruido y la eliminación de quimeras se realizaron utilizando Dada2 (26) como complemento QIIME2 con todos los parámetros recomendados, y las secuencias se agruparon en variantes de secuencia de amplicones (ASV). La taxonomía se asignó utilizando la base de datos SILVA v138.1 (27). La tabla de frecuencias de ASV se cargó en el sistema de análisis en línea MicrobiomeAnalyst para la normalización de los datos utilizando la opción de escala de suma acumulativa (CSS), y los datos se analizaron utilizando la diversidad alfa, la diversidad beta, el tamaño del efecto del análisis discriminante lineal (LEfSe) y las pruebas no paramétricas, según las recomendaciones del software en línea (28).
Determinación de la carga vacunal en el contenido cecal
Salmonella qPCR específica de la vacuna contra el tifimurio
La qPCR específica para el ST de Vaxsafe se optimizó con el par de cebadores (F: 5-GGTGTAATTGATCCCCAACG-3 y R: 5-GGTGTAATTGATCCCCAACG-3) diseñados por la empresa fabricante de vacunas (Bioproperties, Pty Ltd, Ringwood, Victoria, Australia) que se dirigía al gen aroA y producía un producto de 204 pb. Se probó la especificidad y la eficacia de la amplificación de la PCR utilizando ADN Vaxsafe ST diluido en serie 10 veces. El par de cebadores también se probó contra el tipo salvaje S. ADN de Typhimurium PT9 y Escherichia coli (aislado de pollo) para probar aún más su especificidad. La qPCR se realizó utilizando el kit SensiFAST SYBR Hi-ROX (Bioline) en un volumen de reacción final de 20 μl. El volumen de reacción contenía 10 μl de tampón SensiFAST, 1 μl de cada uno de los cebadores directo e inverso (10 μM), 2 μl de plantilla de ADN y 6 μl de agua. Las condiciones de ciclo en un instrumento QuantStudio 6 fueron desnaturalización inicial a 95 °C durante 3 min; 40 ciclos de recocido a 60 °C durante 30 s; extensión a 72 °C durante 30 s; una etapa de retención a 72 °C durante 5 min; y fusión de 60 °C a 95 °C. La especificidad del par de cebadores se confirmó mediante la presencia de un solo pico en el análisis de la curva de fusión y el análisis electroforético en un gel de agarosa al 2%. La eficiencia de amplificación (%) se calculó utilizando E = -1+10(−1/pendiente).
Clonación de fragmentos de ADN Vaxsafe ST y generación de una curva estándar
Un producto de qPCR recién generado (longitud de amplicón de 204 pb) del ADN de Vaxsafe ST se clonó en un plásmido (pCR4-TOPO) que se insertó en DH5α-T1R células de E. coli químicamente competentes según el protocolo del fabricante para la transformación química de un disparo, kit de clonación TOPO TA para secuenciación (Invitrogen). El plásmido recombinante se extrajo utilizando un kit de minipreparación de plásmidos rápidos PureLink según el protocolo del fabricante (Invitrogen). La inserción del fragmento Vaxsafe ST en el plásmido se confirmó mediante qPCR, análisis de curva de fusión y ejecución del amplicón en un gel de agarosa al 2%. Se utilizó el ADN Vaxsafe ST como control positivo. El plásmido recombinante se diluyó en serie para construir una curva estándar para la cuantificación de la carga vacunal a partir del contenido cecal. El número de copias de ADN para el plásmido recombinante se calculó a partir de la concentración de ADN del plásmido y el peso molecular del plásmido con un inserto de fragmento Vaxsafe ST.
Carga Vaxsafe ST en ciego
Para cuantificar la carga vacunal a partir del contenido cecal, se realizó qPCR, por duplicado, sobre el ADN del contenido cecal de todas las muestras (n = 192). La qPCR optimizada fue altamente sensible para la cuantificación de Vaxsafe ST a partir de tripa de pollo. Se utilizó una serie de dilución de 10 veces del plásmido para construir una curva estándar. Se incluyó el ADN Vaxsafe ST como control positivo, y también se utilizaron controles sin plantilla. Las muestras que caían fuera del rango de la curva estándar (Cq > 35) se excluyeron de la determinación del número de copias de Vaxsafe ST.
Análisis estadístico
El S. Carga vacunal contra el typhimurium (logaritmo10 Los datos de contenido cecal se analizaron en GraphPad Prism mediante análisis no paramétrico (Mann-Whitney). El nivel de significancia fue determinado por PLSD a P < 0,05.
Resultados
Carga vacunal en los ciegos de pollos
La carga vacunal del contenido cecal se cuantificó mediante qPCR. La qPCR optimizada fue altamente específica para el objetivo, con una eficiencia de amplificación del cebador del 97%. Todos los grupos no vacunados dieron negativo para la cepa vacunal. Dentro de cada grupo de tratamiento con diluyente, no hubo un efecto significativo de la dosis de la vacuna sobre la carga de la vacuna en el contenido cecal (Figura 1A). La carga vacunal media en el contenido cecal en el día 7 después de la vacunación fue logarítmica10 8.94, mientras que el día 14, fue Log10 8.37 (Figura 1B).
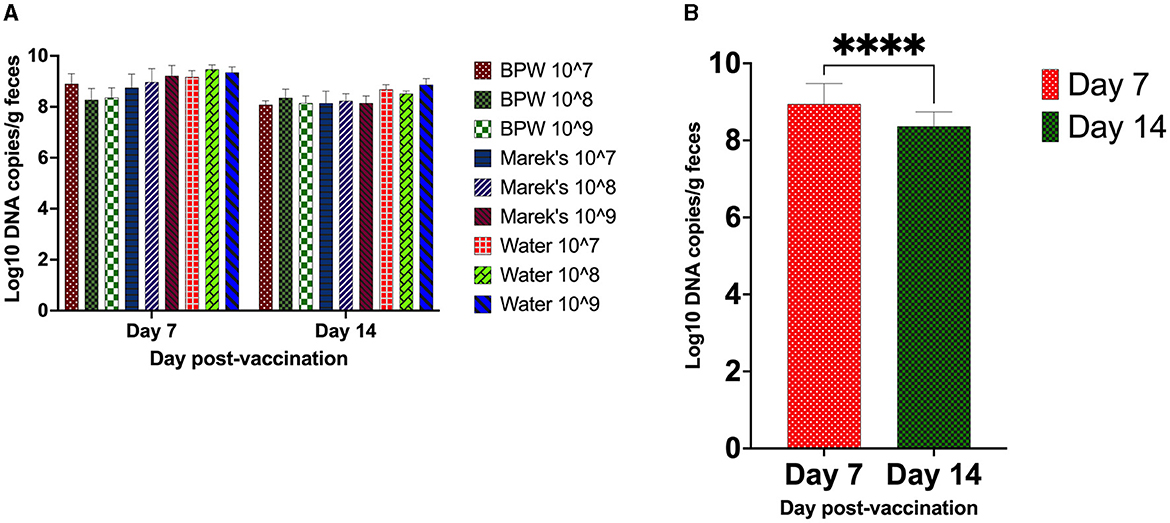 Figura 1. Carga de la vacuna S. Typhimurium (Vaxsafe ST) en el contenido cecal de pollos vacunados. Los pollos ponedoras Isa-Brown de un día de edad fueron vacunados reconstituyendo la vacuna en BPW, diluyente de Marek o agua y administrados a las 107, 108, o 109 UFC/pollo. La carga vacunal a través de qPCR se determinó en los días 7 y 14 post-vacunación. (A) La carga de la vacuna se ve afectada por la dosis y el diluyente. (B) Carga vacunal comparada en el día 7 y el día 14 después de la vacunación (P < 0,0001). El ADN extraído del contenido cecal de los grupos no vacunados no arrojó ningún producto de PCR; por lo tanto, fueron excluidos del análisis estadístico de los datos. Los datos del número de copias de ADN son de registro10 Expresado. En (B), todos los grupos de tratamiento se combinaron para comprender el efecto de la edad del pollo en la carga de vacunas. Seis pollos de cada grupo de tratamiento se procesaron el día 7, mientras que el día 14 se procesaron hasta 11 pollos para la recolección de muestras. Los asteriscos () en (B) muestran una P < 0,0001.****
Figura 1. Carga de la vacuna S. Typhimurium (Vaxsafe ST) en el contenido cecal de pollos vacunados. Los pollos ponedoras Isa-Brown de un día de edad fueron vacunados reconstituyendo la vacuna en BPW, diluyente de Marek o agua y administrados a las 107, 108, o 109 UFC/pollo. La carga vacunal a través de qPCR se determinó en los días 7 y 14 post-vacunación. (A) La carga de la vacuna se ve afectada por la dosis y el diluyente. (B) Carga vacunal comparada en el día 7 y el día 14 después de la vacunación (P < 0,0001). El ADN extraído del contenido cecal de los grupos no vacunados no arrojó ningún producto de PCR; por lo tanto, fueron excluidos del análisis estadístico de los datos. Los datos del número de copias de ADN son de registro10 Expresado. En (B), todos los grupos de tratamiento se combinaron para comprender el efecto de la edad del pollo en la carga de vacunas. Seis pollos de cada grupo de tratamiento se procesaron el día 7, mientras que el día 14 se procesaron hasta 11 pollos para la recolección de muestras. Los asteriscos () en (B) muestran una P < 0,0001.****
Los efectos de la dosis y el diluyente de la vacuna sobre las diversidades alfa y beta de la microbiota cecal
La secuenciación del amplicón del gen 16S rRNA produjo 3.646.251 secuencias después del recorte de calidad y la eliminación de quimeras, con un promedio de 23.224 lecturas por muestra de 157 muestras. La diversidad alfa mide la estructura de la comunidad de muestras individuales en términos de cuántos taxones están presentes (riqueza) y la distribución de la abundancia de taxones dentro de una muestra (uniformidad). Antes de la administración en tres dosis diferentes, Vaxsafe ST se reconstituyó en agua tamponada con peptona (BPW), diluyente de Marek y agua para saber si el diluyente y la dosis tenían algún efecto sobre la microbiota intestinal (figuras 2A-D). No se observaron diferencias significativas en la diversidad alfa de la microbiota cecal de pollos ponedoras de 14 días vacunados con diferentes diluyentes (Figura 2A). Sin embargo, los pollos vacunados con 108 y 109 Las UFC/pollo mostraron una diversidad alfa significativamente mayor en comparación con los grupos de control no vacunados (Figura 2B), y un análisis más detallado reveló que esto se debió completamente a la diversidad alfa inusualmente baja del grupo de control de agua (Figura 2D). En comparación con sus respectivos controles, las tres dosis diferentes de la vacuna (107, 108y 109 UFC/pollo) preparado en BPW y agua afectó significativamente (P < 0,05) la diversidad alfa de la microbiota cecal (Figuras suplementarias 1A, B). Sin embargo, para el diluyente de Marek, las dosis de la vacuna no afectaron significativamente la diversidad alfa (Figura suplementaria 1C). Independientemente de los tres diluyentes, la diversidad alfa fue significativamente mayor en el día 14 en comparación con el día 7 después de la vacunación (Figura 2C). El efecto significativo general de la dosis y el diluyente de la vacuna sobre la diversidad alfa cuando se analizaron los datos en función del diluyente y la dosis de la vacuna se debió principalmente a la menor diversidad en el grupo de control del agua (Figura 2D).
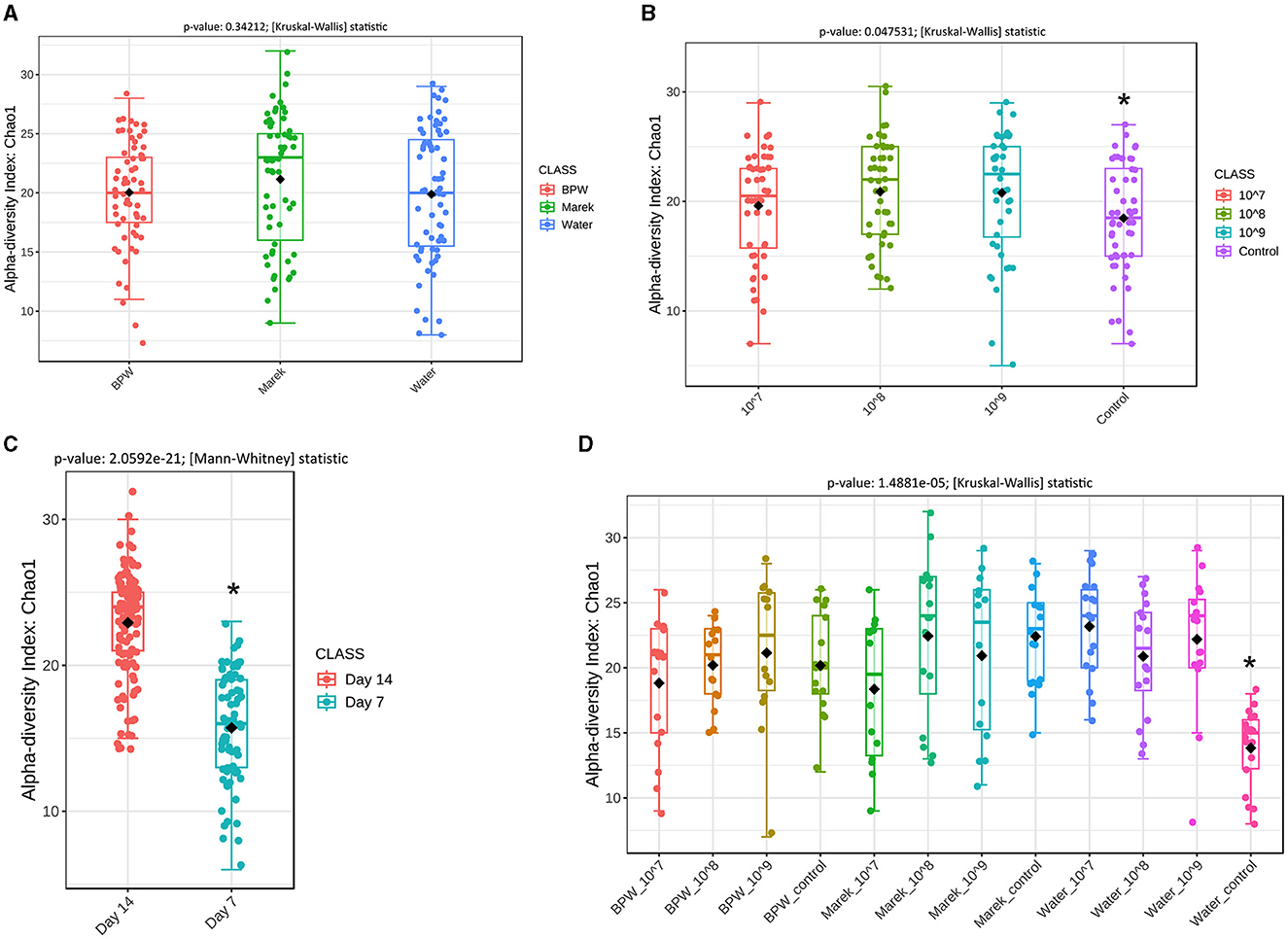 Figura 2. Diversidad alfa global de la microbiota cecal de pollitos ponedoras afectados por dosis de diluyente y vacuna contra Salmonella Typhimurium. (A) La diversidad alfa se ve afectada por el diluyente de la vacuna (P = 0,34212). (B) La diversidad alfa se ve afectada por la dosis de la vacuna (P = 0,047531). Los datos se presentan agrupando los grupos de tratamiento de dosis relevantes, y el grupo de control representa los controles de BPW, Marek y diluyentes de agua. (C) La diversidad alfa se ve afectada por la edad (P = 2.0592e-21). Todos los grupos de tratamiento se agruparon en función de la edad. (D) La diversidad alfa se ve afectada por la dosis de la vacuna y el diluyente en grupos de tratamiento individuales (P = 1,4881e-05). La diversidad alfa se midió mediante Chao1 mediante la prueba de Mann-Whitney, mientras que la diversidad beta se midió mediante el método de distancia, el índice de Bray-Curtis y el método estadístico ANOSIM. La diversidad se midió a nivel de género. Chao1 es un método no paramétrico que mide la riqueza de especies, que se refiere al número total de especies en una muestra. Dentro de cada gráfico de panel, un asterisco (*) muestra una diferencia significativa. Cada grupo de tratamiento tuvo un mínimo de seis pollos en cada punto de tiempo de muestreo.
Figura 2. Diversidad alfa global de la microbiota cecal de pollitos ponedoras afectados por dosis de diluyente y vacuna contra Salmonella Typhimurium. (A) La diversidad alfa se ve afectada por el diluyente de la vacuna (P = 0,34212). (B) La diversidad alfa se ve afectada por la dosis de la vacuna (P = 0,047531). Los datos se presentan agrupando los grupos de tratamiento de dosis relevantes, y el grupo de control representa los controles de BPW, Marek y diluyentes de agua. (C) La diversidad alfa se ve afectada por la edad (P = 2.0592e-21). Todos los grupos de tratamiento se agruparon en función de la edad. (D) La diversidad alfa se ve afectada por la dosis de la vacuna y el diluyente en grupos de tratamiento individuales (P = 1,4881e-05). La diversidad alfa se midió mediante Chao1 mediante la prueba de Mann-Whitney, mientras que la diversidad beta se midió mediante el método de distancia, el índice de Bray-Curtis y el método estadístico ANOSIM. La diversidad se midió a nivel de género. Chao1 es un método no paramétrico que mide la riqueza de especies, que se refiere al número total de especies en una muestra. Dentro de cada gráfico de panel, un asterisco (*) muestra una diferencia significativa. Cada grupo de tratamiento tuvo un mínimo de seis pollos en cada punto de tiempo de muestreo.
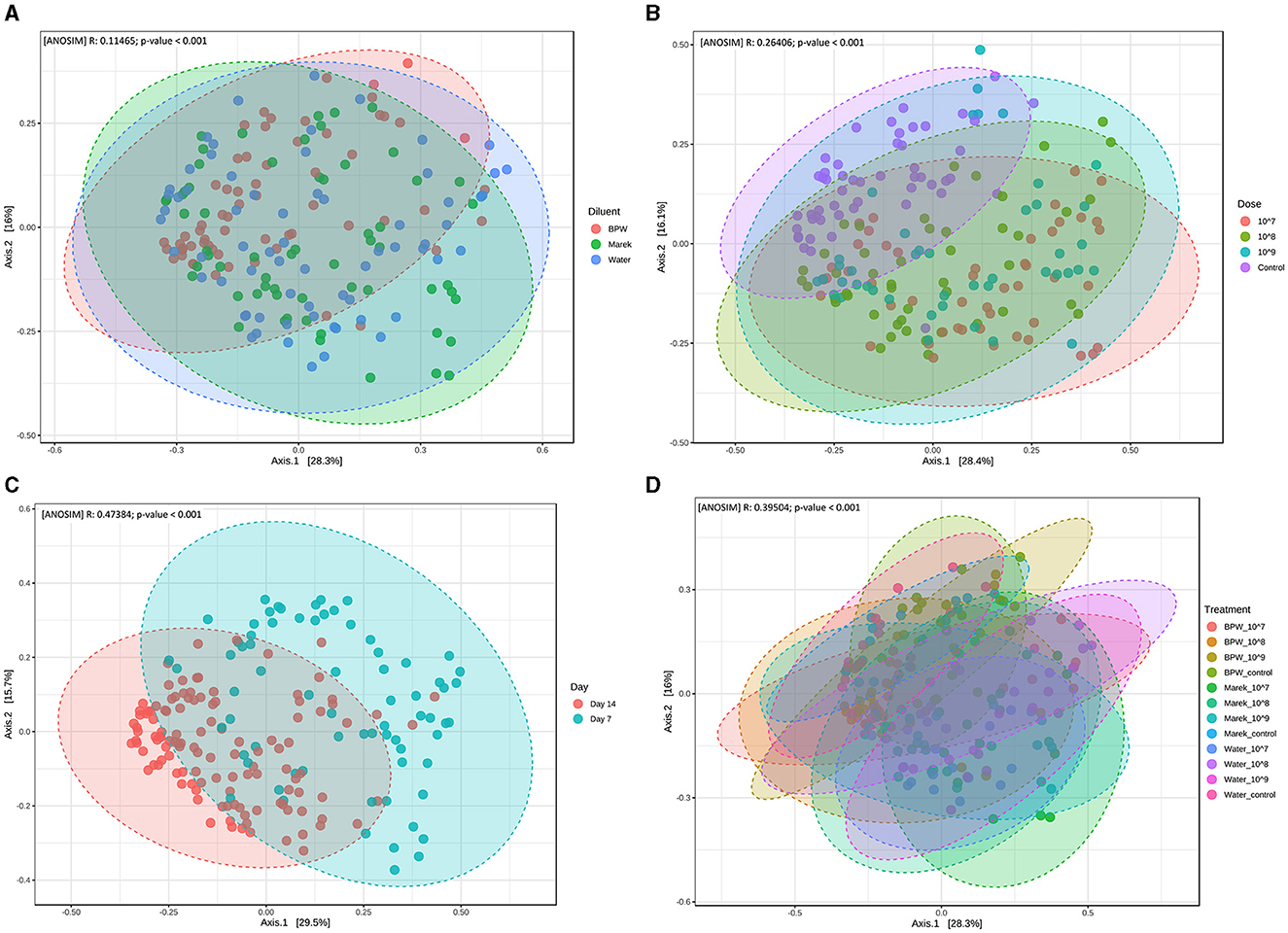
La diversidad beta mide la distancia o disimilitud de la estructura de la comunidad entre las muestras. En la evaluación del efecto de los diluyentes individuales y de las dosis de la vacuna, a pesar de las diferencias significativas entre los grupos de tratamiento, la diversidad beta de los diferentes grupos de tratamiento se superpuso entre sí (Figuras 3A-D). También se evaluó la diversidad beta de la microbiota cecal en relación con tres dosis diferentes de vacunas preparadas en tres diluyentes, a saber, BPW, Marek y agua. La diversidad beta del grupo control (no vacunados) se agrupó por separado (P < 0,001), aunque se superpuso, en comparación con los grupos que recibieron 107, 108y 109 UFC/pollito de la vacuna (Figura 3B). La diversidad beta se vio afectada significativamente por la edad de los pollos. En general, la diversidad beta en el día 7 después de la vacunación fue significativamente diferente de la de los pollos muestreados en el día 14 (Figura 3C). Dentro de los diluyentes individuales (BPW, Marek y agua), la diversidad beta fue significativamente diferente (P < 0.001), aunque muy superpuesta (Figura 3D). A diferencia de la diversidad alfa significativamente más baja en el grupo de control del agua, la diversidad beta del grupo de control del agua no fue significativamente diferente de los grupos vacunados con agua.
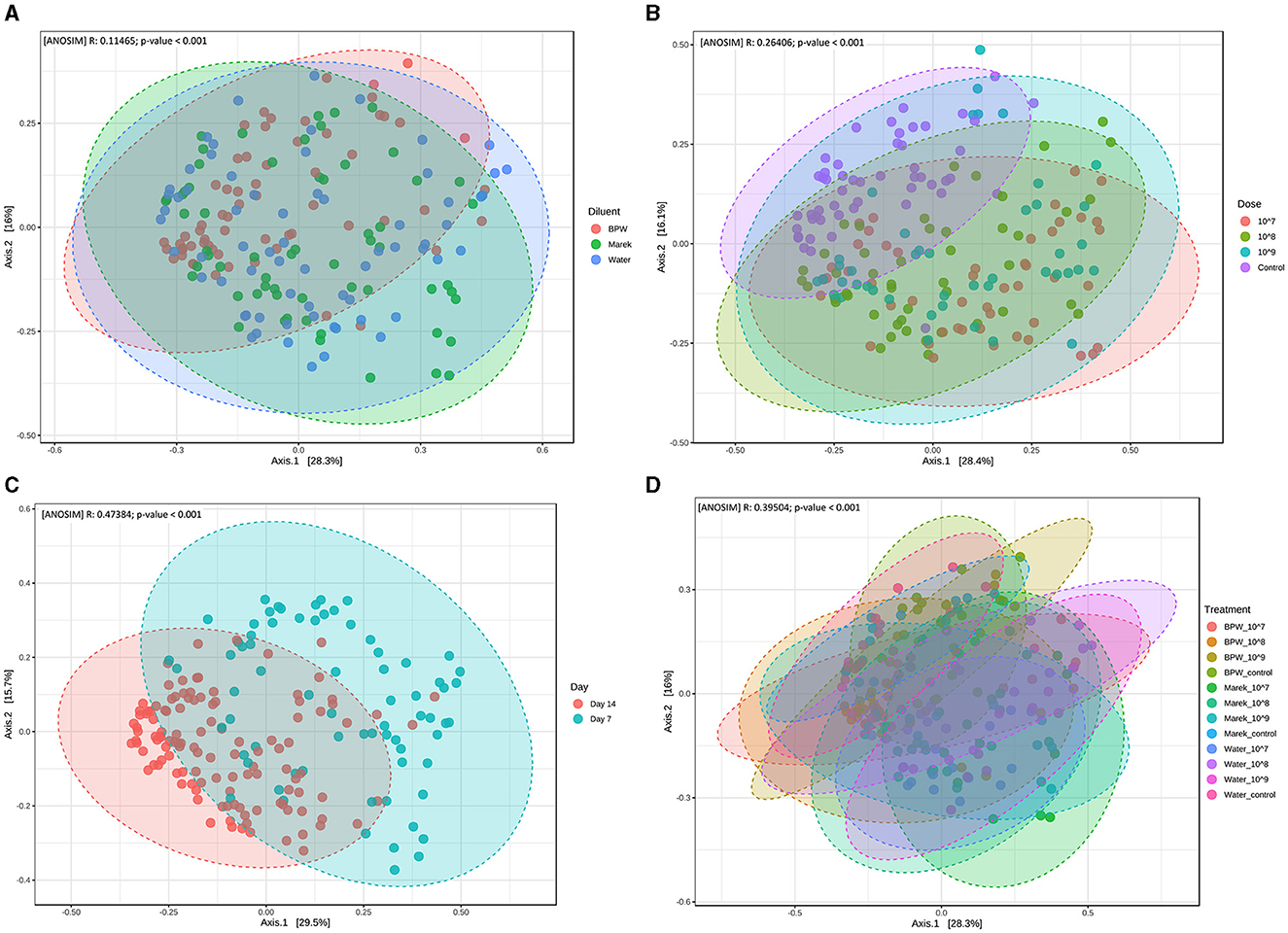 Figura 3. Diversidad beta de la microbiota cecal de gallinas ponedoras influenciada por la vacunación. (A) La diversidad beta se ve afectada por el diluyente de la vacuna (P < 0,001). (B) La diversidad beta se ve afectada por la dosis de la vacuna (P < 0,001). Los datos se presentan agrupando los grupos de tratamiento de dosis relevantes, y el grupo de control representa los controles de BPW, Marek y diluyentes de agua. (C) La diversidad beta se ve afectada por la edad (P < 0,001). Todos los grupos de tratamiento se agruparon en función de la edad. (D) La diversidad beta se ve afectada por la dosis de la vacuna y el diluyente en grupos de tratamiento individuales (P < 0,001). La diversidad beta se midió por el método de distancia con el índice de Bray-Curtis y el método estadístico ANOSIM a nivel de género. La abscisa (Eje 1) representa el primer componente principal, y el porcentaje representa la contribución del primer componente principal a la diferencia muestral; la ordenada (Eje 2) representa el segundo componente principal, y el porcentaje representa la contribución del segundo componente principal a la diferencia muestral. Cada punto de la gráfica de análisis de coordenadas principales (PCoA) representa una muestra, y la distancia entre los puntos representa la disimilitud de la microbiota cecal. Cada grupo de tratamiento tuvo un mínimo de seis pollos en cada punto de tiempo de muestreo.
Figura 3. Diversidad beta de la microbiota cecal de gallinas ponedoras influenciada por la vacunación. (A) La diversidad beta se ve afectada por el diluyente de la vacuna (P < 0,001). (B) La diversidad beta se ve afectada por la dosis de la vacuna (P < 0,001). Los datos se presentan agrupando los grupos de tratamiento de dosis relevantes, y el grupo de control representa los controles de BPW, Marek y diluyentes de agua. (C) La diversidad beta se ve afectada por la edad (P < 0,001). Todos los grupos de tratamiento se agruparon en función de la edad. (D) La diversidad beta se ve afectada por la dosis de la vacuna y el diluyente en grupos de tratamiento individuales (P < 0,001). La diversidad beta se midió por el método de distancia con el índice de Bray-Curtis y el método estadístico ANOSIM a nivel de género. La abscisa (Eje 1) representa el primer componente principal, y el porcentaje representa la contribución del primer componente principal a la diferencia muestral; la ordenada (Eje 2) representa el segundo componente principal, y el porcentaje representa la contribución del segundo componente principal a la diferencia muestral. Cada punto de la gráfica de análisis de coordenadas principales (PCoA) representa una muestra, y la distancia entre los puntos representa la disimilitud de la microbiota cecal. Cada grupo de tratamiento tuvo un mínimo de seis pollos en cada punto de tiempo de muestreo.
La dosis y el diluyente de la vacuna tuvieron efectos mínimos y consistentes sobre la microbiota cecal
Los datos de secuenciación del ARNr 16S mostraron que Anaerostignum, Blautia, Caproiciproducens, Dickeya, Erysipelatoclostridium, Lactobacillus, Pediucoccus y Sellimonas fueron significativamente diferentes en abundancia en algunas dosis de vacunas y diluyentes (Figuras 4A-H). Los pollos inoculados con la vacuna reconstituida en el diluyente de Marek no mostraron alteraciones significativas en la abundancia de los géneros más comunes. Solo cuatro géneros de baja abundancia, incluidos Incertae_Sedis, Flavonifractor, Christensenellaceae_R_7_group y Dickeya, fueron significativamente más altos (FDR < 0.05) en abundancia en el control de diluyente de Marek en comparación con los grupos vacunados con diluyente de Marek. Curiosamente, el nivel de abundancia de Blautia no fue consistente con los tratamientos, pero fue significativamente menor en los grupos de tratamiento de agua (Figura 4B).
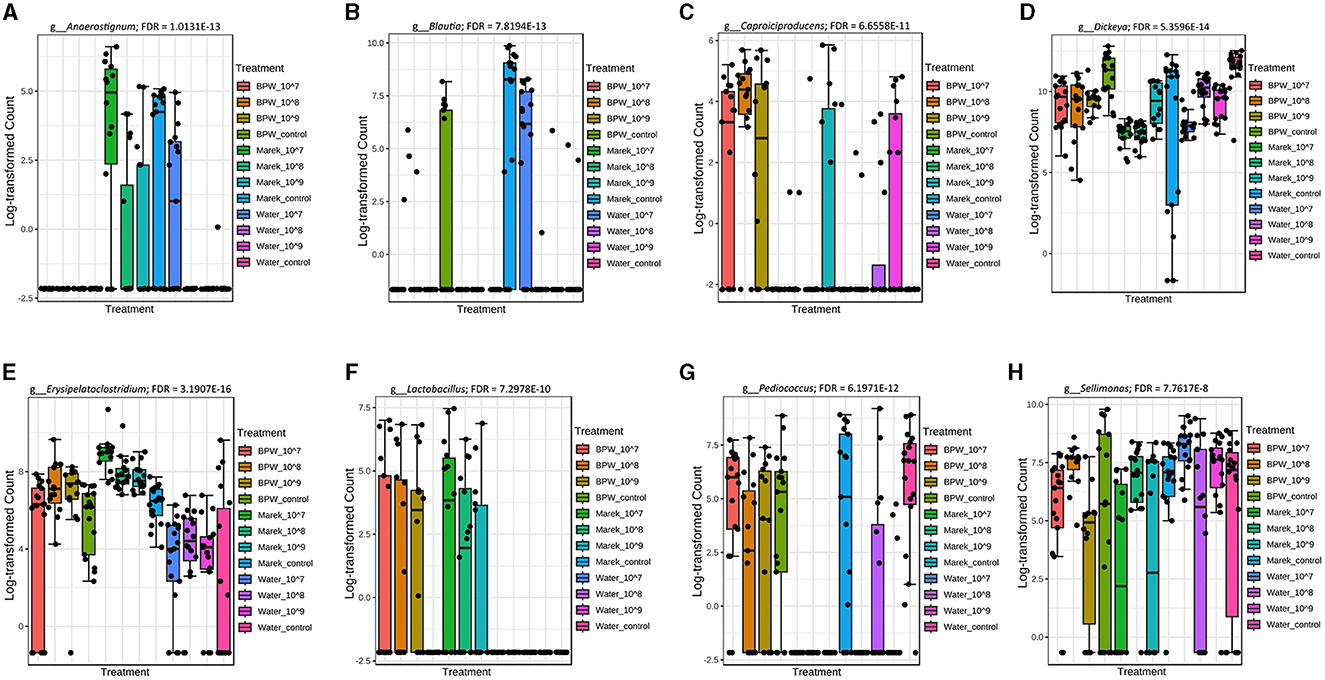 Figura 4. Géneros que fueron significativamente diferentes en abundancia en los diversos grupos de dosis y diluyentes de vacunas. Niveles de abundancia de los géneros (A) Anaerostignum (FDR = 1.0131E-13); (B) Blautia (FDR = 7.8194E-13); (C) Capriociproducens (FDR = 6.6558E-11); (D) Dickeya (FDR = 5.3596E-14); (E) Erysipelatoclostridium (FDR = 3.1907E-16); (F) Lactobacillus (FDR = 7.2978E-10); (G) Pediococo (FDR = 6.1971E-12); y (H) Sellimonas (FDR = 7.7617E-8). Los niveles de abundancia se compararon mediante una prueba no paramétrica en MicrobiomeAnalyst. Cada grupo de tratamiento tuvo un mínimo de seis pollos en cada punto de tiempo de muestreo.
Figura 4. Géneros que fueron significativamente diferentes en abundancia en los diversos grupos de dosis y diluyentes de vacunas. Niveles de abundancia de los géneros (A) Anaerostignum (FDR = 1.0131E-13); (B) Blautia (FDR = 7.8194E-13); (C) Capriociproducens (FDR = 6.6558E-11); (D) Dickeya (FDR = 5.3596E-14); (E) Erysipelatoclostridium (FDR = 3.1907E-16); (F) Lactobacillus (FDR = 7.2978E-10); (G) Pediococo (FDR = 6.1971E-12); y (H) Sellimonas (FDR = 7.7617E-8). Los niveles de abundancia se compararon mediante una prueba no paramétrica en MicrobiomeAnalyst. Cada grupo de tratamiento tuvo un mínimo de seis pollos en cada punto de tiempo de muestreo.
La edad de los pollos tuvo efectos más profundos sobre la abundancia de taxones en los ciegos que el diluyente o la dosis de la vacuna
En general, hubo 22 géneros significativamente diferentes (FDR < 0.05) en abundancia en el día 7 en comparación con el día 14 de la edad de los pollos. Entre los 22 géneros, los niveles de abundancia de Anaerostignum, Blautia, Caproiciproducens, Sellimonas, Dickeya, Colidextribacter, Flavonifractor, Incertae_sedis, Lactobacillus y Pediococcus fueron significativamente más altos en el día 14 (Figuras 5A-J), mientras que Enterococcus y Paenibacillus fueron significativamente más altos en el día 7 después de la vacunación (Figuras 5K, L).
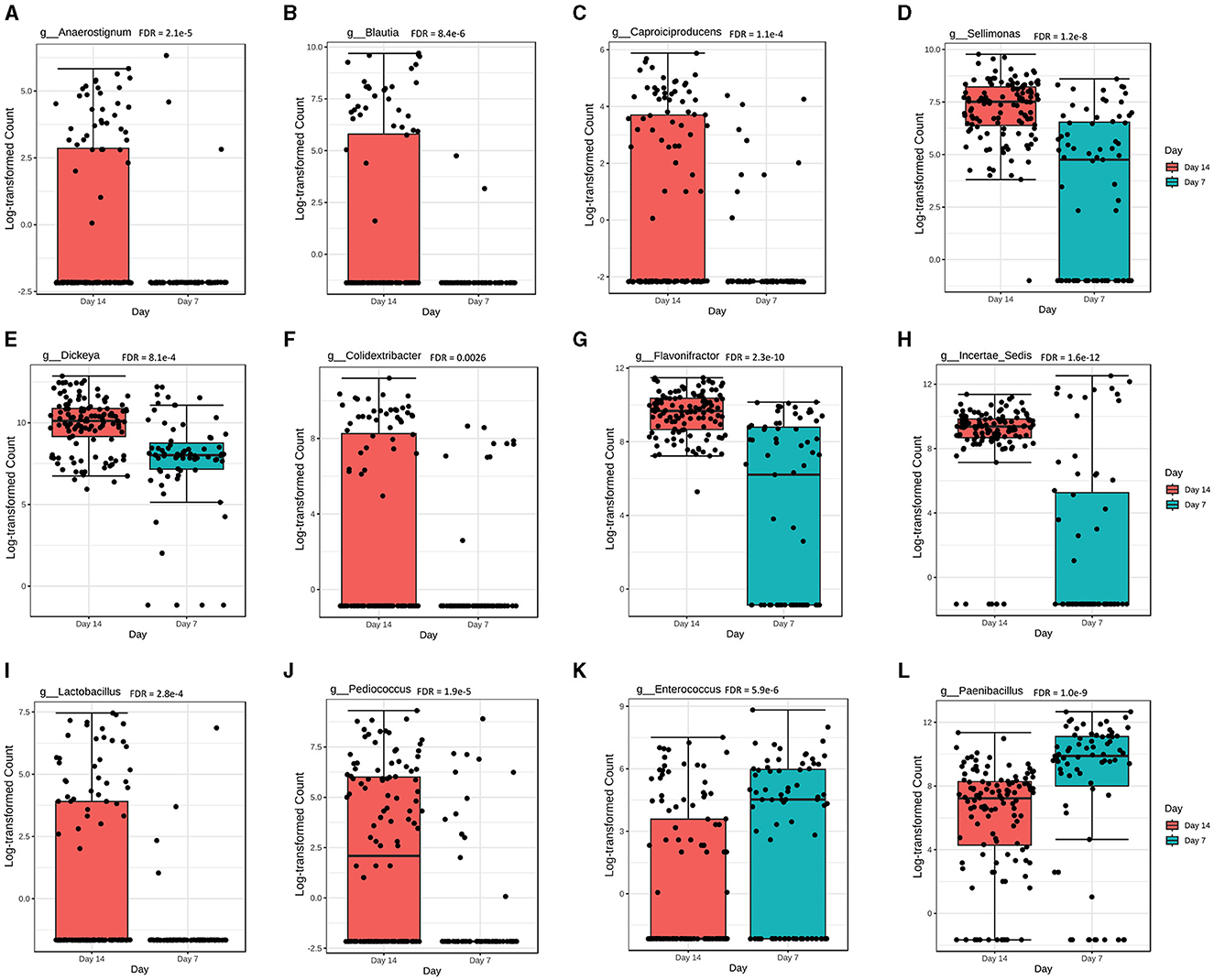 Figura 5. La abundancia general de comunidades microbianas cecales se ve afectada significativamente por la edad de los pollos. Niveles de abundancia para los géneros (A) Anaerostignum (FDR = 2.1e-5); (B) Blautia (FDR = 8.4e-6); (C) Caproiciproducens (FDR = 1.1e-4); d) Sellimonas (FDR = 1,2e-8); (E) Dickeya (FDR = 8.1e-4); f) Colidextribacter (FDR = 0,0026); (G) Flavonifractor (FDR = 2.3e-10); h) Incertae_sedis (FDR = 1,6e-12); (I) Lactobacillus (FDR = 2.8e-4); (J) Pediococo (FDR = 1.9e-5); (K) Enterococos (FDR = 5.9e-6); y (L) Paenibacillus (FDR = 1.0e-9). Las diferencias en los niveles de abundancia se evaluaron mediante una prueba no paramétrica en MicrobiomeAnalyst. Cada grupo de tratamiento tuvo un mínimo de seis pollos en cada punto de tiempo de muestreo.
Figura 5. La abundancia general de comunidades microbianas cecales se ve afectada significativamente por la edad de los pollos. Niveles de abundancia para los géneros (A) Anaerostignum (FDR = 2.1e-5); (B) Blautia (FDR = 8.4e-6); (C) Caproiciproducens (FDR = 1.1e-4); d) Sellimonas (FDR = 1,2e-8); (E) Dickeya (FDR = 8.1e-4); f) Colidextribacter (FDR = 0,0026); (G) Flavonifractor (FDR = 2.3e-10); h) Incertae_sedis (FDR = 1,6e-12); (I) Lactobacillus (FDR = 2.8e-4); (J) Pediococo (FDR = 1.9e-5); (K) Enterococos (FDR = 5.9e-6); y (L) Paenibacillus (FDR = 1.0e-9). Las diferencias en los niveles de abundancia se evaluaron mediante una prueba no paramétrica en MicrobiomeAnalyst. Cada grupo de tratamiento tuvo un mínimo de seis pollos en cada punto de tiempo de muestreo.
Para comprender mejor los efectos de la dosis y el diluyente de la vacuna, se realizó un análisis de tamaño del efecto (LEfSe) de análisis discriminante lineal (LDA) sobre los datos de abundancia de ASV para la visualización de los 10 géneros más abundantes dentro de la microbiota cecal. Se utilizó el análisis LEfSe para predecir biomarcadores asociados a los grupos de tratamiento. Erysipelatoclostridium fue el único género asociado con el diluyente de Marek, mientras que Dickeya, Flavonifractor, Colidextribacter y Clostridium_sensu_stricto_1 se asociaron con BPW. Sellimonas, Ruminococcus_torques_group, Propionispora y Christensenellaceae_R_7_group se asociaron con el grupo de tratamiento de agua (Figura suplementaria 2A). El flavonifractor y el UCG_005 se asociaron con los grupos de tratamiento (todos los diluyentes combinados) que recibieron 109 UFC/pollito, mientras que Eubacterium_hallii_group se asoció con 108 Vacuna de UFC/pollito (Figura suplementaria 2B). Como era de esperar, la edad de los pollos tuvo efectos más profundos, con seis géneros microbianos asociados con el día 14 y cuatro géneros asociados con el día 7. Los géneros asociados con las muestras del día 14 incluyeron Dickeya, Flavonifractor, Christensenellaceae_R_7_group, Incertae_Sedis, Selimones y Colidextribacter (Figura suplementaria 2C). No hubo muchos géneros microbianos asociados con dosis individuales de vacunas preparadas en grupos específicos de tratamiento con diluyentes (Figura complementaria 2D).
Discusión
En este estudio, el S. Se estudió la vacuna contra el typhimurium (Vaxsafe ST) para determinar si tenía algún efecto sobre la composición de la microbiota cecal. La dosis mínima de Vaxsafe ST recomendada por el fabricante es de 107 UFC/pollo. Tres dosis diferentes (107, 108y 109 UFC/pollo) para determinar si una dosis más alta afectaría la colonización de la vacuna en el ciego. El S. La cepa de Typhimurium en Vaxsafe ST se atenúa por la disrupción del gen aroA, cuya expresión en una célula normal de Salmonella es necesaria en la vía del shikimato para la biosíntesis de aminoácidos aromáticos. Como auxótrofo, Vaxsafe ST tiene una competitividad reducida en comparación con el ST de tipo salvaje.
La carga media de la vacuna en el contenido cecal cuantificado mediante qPCR mostró que la vacuna estuvo presente hasta el día 14 después de la vacunación. Esto demuestra la exitosa capacidad de colonización de Vaxsafe ST para la estimulación del sistema inmunitario intestinal en pollos ponedoras. Los datos de qPCR también mostraron que la carga de la vacuna disminuyó significativamente el día 14 en comparación con el día 7 después de la vacunación. Una diferencia no significativa en la carga vacunal entre los grupos de tratamiento que recibieron las tres dosis diferentes de vacuna preparadas en tres diluyentes diferentes muestra que 107 La UFC/pollito de la dosis de vacuna fue suficiente para colonizar el ciego de pollo. Los datos de carga de la vacuna también mostraron que una vacuna reconstituida en agua es tan eficiente como una vacuna reconstituida en diluyentes nutritivos (por ejemplo, BPW, Marek) en la colonización intestinal. Un estudio reciente que involucró la vacuna AviPro Salmonella DUO (una vacuna viva atenuada que consiste en S. Cepas de Typhimurium y Enteritidis) en pollos de un día de edad de ponedoras comerciales mostraron que la vacuna no se detectó en hisopos cloacales recolectados el día 2 después de la vacunación (29). Sin embargo, en un estudio separado, las cepas de la vacuna de AviPro Salmonella VacE y AviPro Salmonella Duo se detectaron mediante cultivo de hisopos cloacales recolectados 2 días después de la vacunación de pollitos ponedoras de un día de edad (30). Vaxsafe ST se pudo cuantificar a partir de los ciegos de los pollitos ponedoras en el día 7 después de la vacunación y se pudo detectar en el bazo, el hígado y el yeyuno siguiendo un método de cultivo (31). Quizás las diferencias en la detección de vacunas en varias muestras podrían deberse a múltiples factores, entre ellos la sensibilidad de las pruebas aplicadas. En general, los datos de qPCR de la cuantificación de Vaxsafe ST a partir del contenido cecal muestran que la vacuna colonizó el intestino de manera efectiva y fue cuantificable durante al menos 14 días después de la vacunación, que fue el período experimental del estudio actual.®®
El objetivo de reconstituir Vaxsafe ST en diluyentes nutritivos (BPW y Marek’s) fue determinar si estos diluyentes podían mejorar la colonización de la vacuna en el ciego de pollo. Se utilizó agua como control, ya que es el diluyente utilizado para administrar Vaxsafe ST a los pollitos mediante un aerosol grueso. Además, su objetivo era establecer si la dosis y el diluyente podían provocar un cambio significativo en la estructura de la microbiota cecal de los pollitos ponedoras. La dosis de la vacuna (107, 108y 109 UFC/pollito) no modificaron significativamente la composición de la microbiota intestinal. Se encontraron diferencias estadísticamente significativas en la diversidad beta de la microbiota cecal entre los pollos vacunados y los no vacunados, pero los cambios que impulsaron esa diferencia se produjeron principalmente entre taxones de baja abundancia y no se compartieron entre los diferentes grupos de diluyentes. La dosis y el diluyente no cambiaron significativamente la colonización de la vacuna en el intestino, lo que sugiere que los 107 La dosis de UFC/pollitos durante la vacunación es adecuada. Sin embargo, por el contrario, un estudio reciente que utiliza una dosis de 109 UFC/pollo de una vacuna atenuada recombinante diferente contra Salmonella (S. Typhimurium cepa UK-1) ha mostrado un cambio importante en la diversidad de la microbiota cecal de los pollos vacunados (19). Un estudio publicado anteriormente ha demostrado que el AviPro Salmonella Duo (que contiene S. enteritidis y S. Typhimurium serovars) en pollos ponedoras libres de patógenos específicos (< 16 días de edad) no afectó significativamente a la diversidad alfa de la microbiota cecal (32).
El análisis mostró que, en general, la vacuna reconstituida en tres diluyentes diferentes no cambiaba la diversidad alfa de la microbiota cecal. El diluyente de la vacuna de Marek contiene peptona y sacarosa como ingredientes principales, además de sales. En general, una mayor diversidad alfa en el día 14 en comparación con el día 7 de la edad del pollo mostró que la población de comunidades microbianas cecales en pollos individuales se volvió más diversa a medida que los pollos envejecían. Previamente se ha descrito una mayor diversidad alfa de la microbiota cecal en el día 12 en comparación con los días 5, 3 y 0 de la edad de las gallinas ponedoras (9, 33). En general, los datos mostraron que la administración de Vaxsafe ST afectó mínimamente a la diversidad alfa de la microbiota cecal de los pollitos ponedoras.
En el estudio actual, una diversidad beta significativamente diferente en el día 14 en comparación con el día 7 después de la vacunación mostró que la microbiota cecal cambiaba con la edad de los pollos. Anteriormente se ha descrito un cambio en la diversidad beta de la microbiota intestinal con la edad de los pollos (7). En el presente estudio, una superposición en la diversidad beta de los diferentes grupos de tratamiento mostró que la vacunación contra la Salmonella solo cambió mínimamente la estructura comunitaria de la microbiota cecal. Un estudio anterior en gallinas ponedoras de 5 semanas de edad mostró que una vacuna diferente contra la Salmonella sí cambiaba la composición de la microbiota intestinal en términos de diversidad beta (19).
Es importante evaluar el impacto de Vaxsafe ST en la composición de la microbiota intestinal y comprender que es muy diferente del efecto de la infección por Salmonella de tipo salvaje en la microbiota intestinal de los pollos. Los estudios han demostrado que las infecciones por Salmonella de tipo salvaje afectan negativamente a las diversidades alfa y beta de la microbiota intestinal, lo que provoca un aumento de la población de enterobacterias. Por ejemplo, S. La infección por Typhimurium en pollos ponedoras de 1 semana de edad modificó significativamente las diversidades alfa y beta de la microbiota cecal; disminuyó la abundancia de Coprococcus, Ruminococcus, Lactococcus y Lactobacillus; y aumento de Enterobacteriaceae no clasificadas (34). La infección por Salmonella enteritidis en una ponedora de pollos de una semana de edad redujo significativamente la diversidad general al aumentar el nivel de abundancia de Enterobacteriaceae (35). Una mayor abundancia de Lactobacillus en el BPW y en los diluyentes de Marek administrados a los grupos de vacunas muestra la utilidad de los diluyentes ricos en nutrientes utilizados para la reconstitución de vacunas. El efecto de la edad de los pollos fue obvio en la abundancia de varias comunidades microbianas. En general, Anaerostignum, Blautia, Caproiciproducens, Dickeya, Lactobacillus, Pediococcus, Sellemonas y Colidextribacter aumentaron significativamente en abundancia el día 14 en comparación con el día 7 de la edad de los pollos. Entre estas comunidades, se ha demostrado, en un estudio previo, que Lactobacillus es bajo en el día 1 en comparación con los días 7, 21 y 35 de la edad de los pollos de engorde (36). La blautia interviene en la producción de ácidos grasos de cadena corta, principalmente acetato (37), y desempeña un papel positivo en la modulación de las funciones intestinales (38). Lactobacillus ha sido ampliamente implicado en la salud intestinal de los pollos (39, 40). En el futuro, los fabricantes de vacunas podrían utilizar probióticos durante la vacunación para mejorar aún más el entorno microbiano intestinal como parte de su estrategia de salud intestinal. Los estudios en pollos ponedoras han demostrado que tanto la vacuna contra la Salmonella como los probióticos son útiles para mejorar la salud intestinal (19, 41).
Los datos obtenidos en este estudio demuestran que Vaxsafe ST muestra buenos niveles de colonización cecal con una dosis de 107 UFC/pollito sin alteración de la microbiota cecal. La vacuna se puede usar con confianza, sabiendo que hay menos riesgo de que pueda causar disbiosis.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están a disposición del público. Estos datos se pueden encontrar aquí: https://www.ncbi.nlm.nih.gov/bioproject/; PRJNA1003953.
Declaración ética
El estudio en animales fue aprobado por el Comité de Ética Animal de la Universidad de Adelaida. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
SK: Curación de datos, Análisis formal, Investigación, Metodología, Validación, Visualización, Redacción – borrador original. AM: Conceptualización, Investigación, Metodología, Administración de Proyectos, Recursos, Redacción – revisión y edición. DA: Conceptualización, Obtención de Fondos, Administración de Proyectos, Redacción – Revisión y Edición. GU: Conceptualización, Obtención de Fondos, Administración de Proyectos, Supervisión, Redacción, Revisión y Edición. RM: Investigación, Administración de proyectos, Recursos, Supervisión, Redacción, revisión y edición. TV: Investigación, Metodología, Recursos, Redacción – revisión y edición. RG: Investigación, Administración de Proyectos, Supervisión, Visualización, Redacción – Revisión y Edición. KC: Conceptualización, Obtención de Financiamiento, Investigación, Metodología, Administración de Proyectos, Recursos, Supervisión, Redacción, Revisión y Edición.
Financiación
El/los autor/es declaran/n que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio contó con el apoyo financiero de ARC-Linkage (subvención número LP190100864), un proyecto cofinanciado por el Consejo Australiano de Investigación y Bioproperties Pty Ltd, Australia. El Consejo Australiano de Investigación (ARC, por sus siglas en inglés) no tuvo ningún papel en el diseño del estudio, la recopilación y el análisis de datos, la decisión de publicar o la preparación del manuscrito.
Reconocimientos
Se agradece enormemente el apoyo recibido de la Dra. Nicky-Lee Willson, el Sr. Siyuan Jia y el Dr. Nitish Joat en la recolección de muestras.
Conflicto de intereses
Los autores declaran que este estudio recibió financiación de Bioproperties Pty Ltd. Bioproperties Pty Ltd. participó en el diseño del estudio, la interpretación de los datos y la revisión de este artículo, y suministró la vacuna y el diluyente de Marek utilizados en este proyecto de investigación. GU y DA son empleados de Bioproperties Pty Ltd, una empresa comercial de vacunas veterinarias que fabrica y vende la vacuna Vaxsafe ST.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
El/los autor/es declararon, en el momento de la presentación, ser miembro del consejo editorial de Frontiers. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1364731/full#supplementary-material
Referencias
1. Autoridad Europea de Seguridad Alimentaria y Centro Europeo para la Prevención y el Control de las Enfermedades. El informe de zoonosis One Health 2021 de la Unión Europea. EFSA J. (2022) 20:e07666. doi: 10.2903/j.efsa.2022.7666
2. Ford L, Moffatt CR, Fearnley E, Miller M, Gregory J, Sloan-Gardner TS, et al. Epidemiología de los brotes de Salmonella enterica en Australia, 2001-2016. Sistema de Alimentos Front Sosten. (2018) 2:86. doi: 10.3389/fsufs.2018.00086
3. Crouch CF, Nell T, Reijnders M, Donkers T, Pugh C, Patel A, et al. Seguridad y eficacia de una nueva vacuna trivalente inactivada contra Salmonella enterica en pollos. Vacuna. (2020) 38:6741–50. doi: 10.1016/j.vaccine.2020.08.033
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Groves PJ, Sharpe SM, Muir WI, Pavic A, Cox JM. Regímenes vacunales vivos e inactivados contra la colonización por Salmonella Typhimurium en gallinas ponedoras. Aust Vet J. (2016) 94:387–93. doi: 10.1111/avj.12490
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Mcwhorter AR, Chousalkar KK. Un ensayo de eficacia a largo plazo de una vacuna viva atenuada contra Salmonella Typhimurium en gallinas ponedoras. Microbiol frontal. (2018) 9:1380. doi: 10.3389/fmicb.2018.01380
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Ocejo M, Oporto B, Hurtado A. Caracterización de la secuenciación del amplicón del ARNr 16S de la composición del microbioma cecal de pollos de engorde y pollos de crecimiento lento criados al aire libre a lo largo de su vida productiva. Sci Rep. (2019) 9:2506. doi: 10.1038/s41598-019-39323-x
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Ngunjiri JM, Taylor KJ, Abundo MC, Jang H, Elaish M, Kc M, et al. La etapa de la granja, la edad de las aves y el sitio del cuerpo afectan de manera dominante la cantidad, la composición taxonómica y la dinámica de la microbiota respiratoria e intestinal de los pollos ponedoras comerciales. Appl Environ Microbiol. (2019) 85:e03137–e03118. doi: 10.1128/AEM.03137-18
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Ballou AL, Ali RA, Mendoza MA, Ellis JC, Hassan HM, Croom WJ, et al. Desarrollo del microbioma del pollito: cómo la exposición temprana influye en la diversidad microbiana futura. Front Vet Sci. (2016) 3:2. doi: 10.3389/fvets.2016.00002
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Xiao SS, Mi JD, Mei L, Liang J, Feng KX, Wu YB, et al. Diversidad microbiana y variación de la comunidad en los intestinos de gallinas ponedoras. Animales. (2021) 11:840. doi: 10.3390/ani11030840
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Kairmi SH, Taha-Abdelaziz K, Yitbarek A, Sargolzaei M, Spahany H, Astill J, et al. Efectos de los niveles terapéuticos de antibióticos dietéticos sobre la composición del microbioma cecal de pollos de engorde. Poult Sci. (2022) 101:101864. doi: 10.1016/j.psj.2022.101864
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Zhu L, Liao R, Wu N, Zhu G, Yang C. El estrés por calor media los cambios en el microbioma fecal y las vías funcionales de las gallinas ponedoras. Aplicación Microbiol Biotechnol. (2019) 103:461–72. doi: 10.1007/s00253-018-9465-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Bavananthasivam J, Astill J, Matsuyama-Kato A, Taha-Abdelaziz K, Shojadoost B, Sharif S. La microbiota intestinal se asocia con la protección contra la infección por el virus de la enfermedad de Marek en pollos. Virología. (2021) 553:122–30. doi: 10.1016/j.virol.2020.10.011
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Xu P, Shi Y, Liu P, Yang Y, Zhou C, Li G, et al. La secuenciación del gen 16S rRNA revela una composición alterada de la microbiota intestinal en pollos infectados con un virus de bronquitis infecciosa nefropatógeno. Sci Rep. (2020) 10:1–12. doi: 10.1038/s41598-020-60564-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Hankel J, Jung K, Kuder H, Keller B, Keller C, Gálvez E, et al. Microbiota cecal de pollos infectados experimentalmente con Campylobacter jejuni a diferentes edades. Microbiol frontal. (2019) 10:2303. doi: 10.3389/fmicb.2019.02303
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Khan S, Chousalkar KK. Salmonella La infección por Typhimurium interrumpe, pero la alimentación continua con probióticos a base de Bacillus restaura la microbiota intestinal de las gallinas infectadas. J Anim Sci Biotechnol. (2020) 11:1–16. doi: 10.1186/s40104-020-0433-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Lacey JA, Stanley D, Keyburn AL, Ford M, Chen H, Johanesen P, et al. La enteritis necrótica mediada por Clostridium perfringens no está influenciada por la microbiota preexistente, sino que se ve favorecida por grandes cambios en la microbiota posterior al desafío. Microbiol veterinario. (2018) 227:119–26. doi: 10.1016/j.vetmic.2018.10.022
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Chrzastek K, Leng J, Zakaria MK, Bialy D, La Ragione R, Shelton H. La infección por el virus de la influenza aviar de baja patogenicidad retrasa la diversificación de la microbiota del colon en dos líneas de pollos diferentes. Microbioma animal. (2021) 3:1–15. doi: 10.1186/s42523-021-00128-x
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Das Q, Shay J, Gauthier M, Yin X, Hasted T-L, Ross K, et al. Efectos de la vacunación contra la coccidiosis sobre la microbiota intestinal y la inmunidad en pollos de engorde alimentados con bacitracina y orujo de bayas. Frente Immunol. (2021) 12:1874. doi: 10.3389/fimmu.2021.621803
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Redweik GJ, Daniels K, Severin AJ, Lyte M, Mellata M. Los tratamientos orales con probióticos y vacunas vivas contra la salmonela inducen cambios únicos en los neuroquímicos intestinales y el microbioma de los pollos. Microbiol frontal. (2020) 10:3064. doi: 10.3389/fmicb.2019.03064
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Mcwhorter A, Chousalkar K. Virulencia fenotípica y genotípica comparativa de cepas de Salmonella aisladas de granjas de ponedoras australianas. Microbiol frontal. (2015) 6:12. doi: 10.3389/fmicb.2015.00012
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Mcwhorter AR, Davos D, Chousalkar K. Patogenicidad de cepas de Salmonella aisladas de cáscaras de huevo y el entorno de la granja de ponedoras en Australia. Appl Environ Microbiol. (2015) 81:405–14. doi: 10.1128/AEM.02931-14
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Percie Du Sert N, Hurst V, Ahluwalia A, Alam S, Avey MT, Baker M, et al. Las directrices ARRIVE 2.0: Directrices actualizadas para la presentación de informes sobre la investigación con animales. J Metabolismo del flujo sanguíneo de Cereb. (2020) 40:1769–77. doi: 10.1177/0271678X20943823
23. Khan S, Chousalkar KK. Enriquecimiento funcional del microbioma intestinal mediante la suplementación temprana de probióticos a base de Bacillus en gallinas libres de jaulas: un estudio de campo. Microbioma animal. (2021) 3:1–18. doi: 10.1186/s42523-021-00112-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Joat N, Van TTH, Stanley D, Moore RJ, Chousalkar K. Dinámica temporal de la microbiota intestinal en gallinas ponedoras enjauladas: una observación de campo desde la eclosión hasta el final de la puesta. Aplicación Microbiol Biotechnol. (2021) 105:4719–30. doi: 10.1007/s00253-021-11333-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Bolyen E, Rideout JR, Dillon MR, Bokulich NA, Abnet CC, Al-Ghalith GA, et al. Ciencia de datos del microbioma reproducible, interactiva, escalable y extensible utilizando QIIME 2. Nat Biotechnol. (2019) 37:852–7. doi: 10.1038/s41587-019-0209-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Callahan BJ, Mcmurdie PJ, Rosen MJ, Han AW, Johnson AJA, Holmes SP. DADA2: Inferencia de muestras de alta resolución a partir de datos de amplicones de Illumina. Métodos Nat. (2016) 13:581–3. doi: 10.1038/nmeth.3869
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Quast C, Pruesse E, Yilmaz P, Gerken J, Schweer T, Yarza P, et al. El proyecto de base de datos de genes de ARN ribosómico SILVA: mejora del procesamiento de datos y herramientas basadas en la web. Ácidos nucleicos Res. (2012) 41:D590-6. doi: 10.1093/nar/gks1219
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Chong J, Liu P, Zhou G, Xia J. Uso de MicrobiomeAnalyst para un análisis estadístico, funcional y metaanalítico integral de datos del microbioma. Nat Protoc. (2020) 15:799–821. doi: 10.1038/s41596-019-0264-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Lin C-S, Lu T-L, Chen Y-A, Yu H-Y, Wu C-Y, Yang W-Y. Seguridad de la vacuna bivalente viva atenuada contra Salmonella y su protección contra la diseminación bacteriana y la invasión de tejidos en ponedoras desafiadas con Salmonella. Poult Sci. (2022) 101:101943. doi: 10.1016/j.psj.2022.101943
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Eeckhaut V, Haesebrouck F, Ducatelle R, Van Immerseel F. La vacunación oral con una vacuna viva bivalente contra Salmonella Enteritidis/Typhimurium en ponedoras induce una protección cruzada contra la colonización cecal y de órganos internos por una cepa de Salmonella Infantis. Microbiol veterinario. (2018) 218:7–12. doi: 10.1016/j.vetmic.2018.03.022
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Jia S, Mcwhorter AR, Khan S, Andrews DM, Underwood GJ, Chousalkar KK. Investigación de un método de administración basado en gel para la administración de una vacuna viva atenuada contra Salmonella Typhimurium. Microbiol veterinario. (2023) 280:109721. doi: 10.1016/j.vetmic.2023.109721
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Jan T-R, Lin C-S, Wang S-Y, Yang W-Y. Citoquinas y modulaciones del microbioma cecal conferidas por una vacuna dual en ponedoras infectadas por Salmonella. Poult Sci. (2023) 102:102373. doi: 10.1016/j.psj.2022.102373
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Cui Y, Wang Q, Liu S, Sun R, Zhou Y, Li Y. Variaciones relacionadas con la edad en la microflora intestinal de gallinas criadas en libertad y enjauladas. Microbiol frontal. (2017) 8:1310. doi: 10.3389/fmicb.2017.01310
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Khan S, Chousalkar KK. La alimentación a corto plazo con probióticos y simbióticos modula la microbiota cecal durante la infección por Salmonella Typhimurium, pero no reduce la excreción y la invasión en los pollos. Aplicación Microbiol Biotechnol. (2020) 104:319–34. doi: 10.1007/s00253-019-10220-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Mon KK, Saelao P, Halstead MM, Chanthavixay G, Chang H-C, Garas L, et al. La infección por Salmonella enterica serovars Enteritidis altera la diversidad de la microbiota autóctona en pollitos jóvenes ponedoras. Front Vet Sci. (2015) 2:61. doi: 10.3389/fvets.2015.00061
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Zhou Q, Lan F, Li X, Yan W, Sun C, Li J, et al. Caracterización espacial y temporal de la microbiota intestinal en pollos de engorde. Front Vet Sci. (2021) 8:712226. doi: 10.3389/fvets.2021.712226
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Rey FE, Faith JJ, Bain J, Muehlbauer MJ, Stevens RD, Newgard CB, et al. Disección del potencial metabólico in vivo de dos acetógenos intestinales humanos. J Biol Chem. (2010) 285:22082–90. doi: 10.1074/jbc. M110.117713
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Liu X, Guo W, Cui S, Tang X, Zhao J, Zhang H, et al. Una evaluación exhaustiva de la seguridad de Blautia producta DSM 2950. Microorganismos. (2021) 9:908. doi: 10.3390/microorganismos9050908
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Meimandipour A, Shuhaimi M, Soleimani A, Azhar K, Hair-Bejo M, Kabeir B, et al. Grupos microbianos seleccionados y perfil de ácidos grasos de cadena corta en un ciego de pollo simulado suplementado con dos cepas de Lactobacillus. Poult Sci. (2010) 89:470–6. doi: 10.3382/ps.2009-00495
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Forte C, Manuali E, Abbate Y, Papa P, Vieceli L, Tentellini M, et al. La dieta de Lactobacillus acidophilus influye positivamente en el rendimiento del crecimiento, la morfología intestinal y la microbiología intestinal en pollos criados en zonas rurales. Poult Sci. (2018) 97:930–6. doi: 10.3382/ps/pex396
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Groves PJ, Williamson SL, Ahaduzzaman M, Diamond M, Ngo M, Han A, et al. ¿Puede una combinación de vacunación, probióticos y tratamiento con ácidos orgánicos en gallinas ponedoras proteger contra la exposición temprana a Salmonella Typhimurium y el desafío en la madurez sexual? Vacuna. (2021) 39:815–24. doi: 10.1016/j.vaccine.2020.12.044
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: Vacuna contra Salmonella Typhimurium, pollitos ponedoras, producción avícola, salmonelosis, microbiota intestinal
Cita: Khan S, McWhorter AR, Andrews DM, Underwood GJ, Moore RJ, Van TTH, Gast RK y Chousalkar KK (2024) Una dosis y un diluyente vivos atenuados de la vacuna contra Salmonella Typhimurium tienen efectos mínimos en la microbiota cecal de pollos ponedoras. Frente. Vet. Sci. 11:1364731. doi: 10.3389/fvets.2024.1364731
Recibido: 03 de enero de 2024; Aceptado: 06 de marzo de 2024;
Publicado: 15 de abril de 2024.
Editado por:
Wageha Awad, Universidad de Medicina Veterinaria de Viena, Austria
Revisado por:
Daniel Hernández-Patlán, Universidad Nacional Autónoma de México, México
Danielle Mahaffey Graham, Universidad de Arkansas, Estados Unidos
Derechos de autor © 2024 Khan, McWhorter, Andrews, Underwood, Moore, Van, Gast y Chousalkar. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Kapil K. Chousalkar, kapil.chousalkar@adelaide.edu.au
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía