Un aislado de bacteriófago lítico redujo las lesiones inducidas por Clostridium perfringens en pollos
Un aislado de bacteriófago lítico redujo las lesiones inducidas por Clostridium perfringens en pollos de engorde desafiados con enteritis necrótica
 Chake Keerqin1
Chake Keerqin1  Katherine McGlashan2
Katherine McGlashan2  Thi Thu Hao Van3
Thi Thu Hao Van3  Helene N. Chinivasagam2
Helene N. Chinivasagam2  Robert J. Moore3
Robert J. Moore3  Mingan Choct1
Mingan Choct1  Shu-Biao Wu1*
Shu-Biao Wu1*- 1Facultad de Ciencias Ambientales y Rurales, Universidad de Nueva Inglaterra, Armidale, Nueva Gales del Sur, Australia
- 2Recinto de Ecociencias, Departamento de Agricultura y Pesca, Dutton Park, QLD, Australia
- 3Facultad de Ciencias, Universidad RMIT, Bundoora, VIC, Australia
Fondo: Los bacteriófagos son depredadores virales de bacterias y son comunes en la naturaleza. Sus infecciones específicas del huésped contra bacterias específicas los convierten en un agente natural atractivo para controlar patógenos bacterianos. Ha aumentado el interés por el potencial de los bacteriófagos como agentes antibacterianos en las industrias de animales de producción.
Métodos: Se aislaron un total de 18 bacteriófagos de entornos avícolas comerciales australianos, de los cuales se eligieron tres fagos altamente activos para su enriquecimiento. Las bibliotecas de secuenciación se prepararon utilizando un kit Nextera XT (Illumina) y se secuenciaron en un instrumento Illumina MiSeq utilizando una química de extremos emparejados de 2 × 300 pb. A continuación, se ensamblaron los datos de la secuencia y se alinearon con el bacteriófago a2 como referencia. Se realizó un ensayo en animales mediante la nasograma oral de Clostridium perfringens netB que contenía la cepa EHE-NE18 a los pollos de engorde Ross 308 antes de la inoculación con especies de Eimeria. Los pollos se criaron siguiendo la guía de manejo para Ross 308 de d 0 a d 21 y se alimentaron con dietas de inicio y crecimiento que cumplieron con los requisitos nutricionales específicos de la raza. Se midió la ganancia de peso corporal y el consumo de alimento en los días 9 y 21 y se calculó la FCR ajustada con la mortalidad.
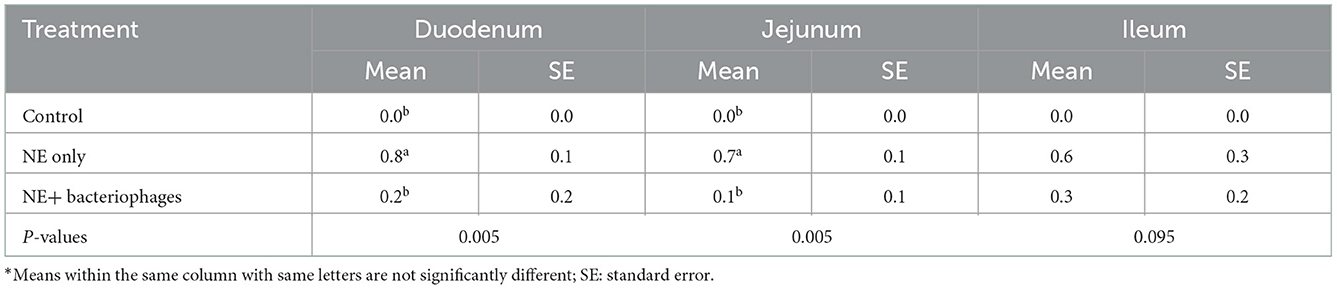
Resultados: Los bacteriófagos aislados solo tenían un 96,7% de similitud con el bacteriófago Clostridium más estrechamente relacionado, previamente caracterizado, lo que indicaba que podrían representar una nueva cepa de bacteriófago. Un «cóctel» que contenía los tres bacteriófagos fue capaz de lisar in vitro cuatro cepas conocidas de C. perfringens inductoras de enfermedades. La administración oral del cóctel de bacteriófagos a pollos de engorde desafiados con enteritis necrótica alivió notablemente las lesiones necróticas intestinales en el duodeno y el yeyuno el día 16 después de la eclosión. El tratamiento con fagos redujo significativamente las puntuaciones de las lesiones de las aves desafiadas con NE (P < 0,01), y las puntuaciones de las lesiones entre las aves tratadas con los bacteriófagos y las aves no desafiadas no fueron estadísticamente diferentes (P > 0,05). Sin embargo, no se observó ningún efecto sobre el rendimiento del crecimiento durante el período registrado de los días 9 a 21.
Conclusión: Estos hallazgos sugieren que el tratamiento con bacteriófagos es un enfoque prometedor para proteger la salud intestinal de la enteritis necrótica inducida por C. perfringens. Se requerirá más investigación sobre la dosis, la vía de administración y estudios de validación a gran escala para avanzar aún más en este enfoque para el control de patógenos.
Introducción
La enteritis necrótica (EN) es una enfermedad entérica bacteriana en las aves de corral que representa más de 6 mil millones de dólares anuales de pérdida de ganancias para la industria en todo el mundo en tratamientos y medidas de contención (1). La etiología de la NE ha sido bien caracterizada y se debe principalmente a la rápida proliferación de cepas de C. perfringens Tipo G (2) que expresan la toxina NetB (3), aunque también se ha informado que cepas NetB negativas causan NE (4). Los brotes de NE también dependen de una serie de factores predisponentes que dan lugar a la degradación de la salud intestinal y al compromiso del estado inmunitario del huésped (3, 5, 6). Se ha informado que el cambio de alimentación, el uso de diferentes bases de cereales en la formulación de la dieta, es decir, granos no viscosos a granos viscosos, la inclusión de fuentes de proteínas de baja digestibilidad, la infección por Eimeria y el compromiso del estado inmunológico del huésped, exacerban las posibilidades de brotes de NE (7). Las parvadas afectadas por EN aguda presentan síntomas clínicos junto con un rápido aumento de la mortalidad y el sufrimiento de las parvadas en las poblaciones de aves afectadas, pero la enfermedad subclínica (leve) es más frecuente, con una tasa de mortalidad escasa o nula, y un rendimiento de crecimiento subóptimo. La forma subclínica de la enteritis necrótica conduce a consecuencias económicas más significativas con un deterioro prolongado del rendimiento del crecimiento como resultado de la pérdida de eficiencia alimenticia a lo largo del tiempo (8).
Durante décadas, las aves de corral y otros sistemas de producción animal de todo el mundo han dependido de los antibióticos en los piensos para mantener el rendimiento del crecimiento y controlar los patógenos entéricos, ya que pueden mantener eficazmente la uniformidad de la microbiota intestinal y suprimir las infecciones bacterianas (9). Sin embargo, la aparición de bacterias resistentes a los antibióticos y la posibilidad de transferencia horizontal de genes de resistencia a los antibióticos a patógenos humanos dio lugar a la prohibición de los antibióticos en los piensos y ha dado paso a prácticas libres de antibióticos que requieren alternativas a los antibióticos convencionales en los piensos para mantener el rendimiento y la salud de las parvadas. La supresión de poblaciones bacterianas intestinales específicas es esencial para controlar los patógenos oportunistas y evitar que alcancen un umbral causante de enfermedades (10). Tras la prohibición legislativa de la UE de 2006 sobre el uso de antibióticos en la alimentación animal, numerosos países de todo el mundo han seguido su ejemplo y se enfrentan a los retos de la gestión de sistemas de producción libres de antibióticos. Los primeros esfuerzos para superar estos desafíos se centraron en la adopción de medidas libres de antibióticos que proporcionaran cierta protección contra los patógenos (11), pero los resultados finales han sido inconsistentes.
La falta de consistencia en la eficacia de las alternativas actuales para mantener el rendimiento significa que se siguen explorando soluciones novedosas. El interés en los bacteriófagos se debe al hecho de que se dirigen naturalmente a bacterias específicas y tienen rangos de huéspedes estrechos. Al exponerse a bacteriófagos específicos, una bacteria huésped se somete a lisis, lo que provoca la muerte de la bacteria y la liberación de bacteriófagos que pueden seguir infectando a otras bacterias huésped; Este proceso autorreplicante es un proceso muy diferente en comparación con otras alternativas a los antibióticos. Por lo tanto, los bacteriófagos son una opción atractiva y factible para el control de patógenos. El uso de la terapia con fagos no es nuevo. De hecho, la aplicación clínica de los bacteriófagos se implementó por primera vez a principios de la década de 1920, con una amplia aplicación terapéutica en la medicina humana en los países de Europa del Este, y ha continuado hasta la actualidad (12). Muchos atributos conocidos de los bacteriófagos se ajustan a los criterios de una alternativa antibacteriana eficaz, incluida la capacidad de dosificación automática a través de la propagación lítica de la progenie de bacteriófagos, la toxicidad inherente mínima, la baja alteración de la microbiota comensal, la eliminación de la biopelícula y las vías de administración variables (13). La absorción de bacteriófagos en la superficie de las bacterias susceptibles está mediada por receptores específicos en la pared celular de las bacterias (14). Los diferentes tipos de bacteriófagos que infectan a cualquier especie de bacteria pueden reconocer diferentes receptores. Por lo tanto, la combinación de varios bacteriófagos en forma de cóctel puede mejorar su eficacia contra una bacteria objetivo. De hecho, se informó que el uso de cócteles de bacteriófagos multivalentes tuvo éxito en la reducción de la mortalidad y la mejora del rendimiento en pollos infectados con C. perfringens, lo que resultó en NE clínica (15).
Sin embargo, solo se han reportado investigaciones limitadas sobre el tratamiento profiláctico con fagos contra la enteritis necrótica subclínica inducida por C. perfringens en pollos. Este estudio se llevó a cabo para aislar y purificar bacteriófagos de entornos de producción avícola que podrían infectar y lisar a C. perfringens, determinar su perfil lítico frente a una variedad de cepas virulentas conocidas de C. perfringens capaces de inducir NE, y luego se evaluaron las propiedades profilácticas del bacteriófago aislado in vivo utilizando un modelo de desafío de enteritis necrótica.
Materiales y métodos
Recolección de muestras, hospederos bacterianos y preparación de bacteriófagos
Se recolectaron muestras de diversas fuentes dentro de entornos avícolas para el aislamiento de bacteriófagos, que incluyeron muestras de suelo de galpones y corrales de pollos de traspatio ubicados en Armidale y Tamworth, Nueva Gales del Sur, Australia, lavado de aguas residuales y despojos de siete granjas de pollos individuales, y contenido intestinal de pollos de experimentos realizados en UNE (Armidale, Nueva Gales del Sur, Australia).
Todas las muestras recolectadas se mantuvieron en hielo hasta que se procesaron. C. perfringens se aisló mediante la siembra de diluciones seriadas en peptona al 0,1% sobre la base de agar Perfringens (Oxoid, Hampshire, Reino Unido) suplementada con cicloserina de sulfito de triptosa (TSC) (Oxoid, Hampshire, Reino Unido), seguida de la incubación en condiciones anaeróbicas utilizando un sobre anaeróbico (Oxoid Australia) a los 39 añosoC durante 48 h. Las colonias putativas de C. perfringens se volvieron a rayar dos veces (para asegurar la pureza) en agar sangre de caballo fresco (HBA) (Oxoid, Hampshire, Reino Unido) y se incubaron a los 39 años.oC durante 18 h. Los aislados de bacterias se recogieron y suspendieron en el caldo Brain Heart Infusion (BHI, Oxoid, Hampshire, Reino Unido) con adición de glicerol estéril al 40% (v/v) y se almacenaron a -20oC hasta que se use.
Las muestras para el aislamiento de bacteriófagos se prepararon agitando suavemente 1 g de muestras sólidas (es decir, suelo, contenido intestinal o hojarasca) o 1 ml de muestra líquida (efluente) en 9 ml de tampón SM (0,1 M de NaCl, 1 mM de MgSO4, 0,2 M Tris-HCl, pH 7,5) durante 12 h. A continuación, el sobrenadante se centrifugó a 11.000 × g a 4oC durante 5 minutos. A continuación, el sobrenadante se filtró a través de filtros Millipore de 0,22 μm de tamaño de poro (MF-Millipore™, MERCK, Australia). Los bacteriófagos se aislaron según los métodos de Smith (16) utilizando las cepas aisladas del huésped C. perfringens. En resumen, el crecimiento nocturno de C. perfringens a partir de agar HBA se mezcló inicialmente en 3 ml de caldo de infusión cerebro-corazón (BHI), y luego se agregó más BHI para ajustar la turbidez a 220 ± 15 Unidad de Turbidez Nefelométrica (NTU). Se prepararon diluciones seriadas de filtrados de bacteriófagos en tampón SM y se mezclaron 100 μl de cada dilución de bacteriófagos con 200 μl de C. perfringens y se incubaron a 37oC durante 30 min. Cada conjunto de la mezcla de bacteriófagos y huésped se mezcló en 7 ml de agar blando BHI al 0,5% (suplementado con 1 mM de MgCl2 y 1 mM de Ca Cl2) y se recubre con agar base BHI al 1%. Las placas se incubaron anaeróbicamente a los 39oC durante 48 h. Las placas bien separadas se recogieron y se resuspendieron en 1 ml de tampón SM, luego se almacenaron a 4 °C durante la noche. Se realizaron diluciones seriadas de las placas homogeneizadas y se cultivaron con el huésped susceptible en tres ciclos de purificación de placas (16, 17).
Las cepas de fagos se prepararon de tres a cinco placas con placas confluentes de la tercera ronda de purificación de fagos. Se añadió tampón SM (5 ml) a las placas confluentes y se agitó lentamente a 10 rpm durante 12 h para resuspender el bacteriófago. A continuación, los sobrenadantes se filtraron a través de filtros Millipore de 0,22 μm de tamaño de poro (MF-Millipore™, MERCK, Australia). Los filtrados resultantes se centrifugaron a 40.000 × g a 4°C durante 2 h. Los gránulos de bacteriófagos resultantes se resuspendieron en tampón SM para formar 1 × 109 pfu/ml de caldo bacteriófago y almacenado en la oscuridad a 4 °C.
Perfil lítico del bacteriófago
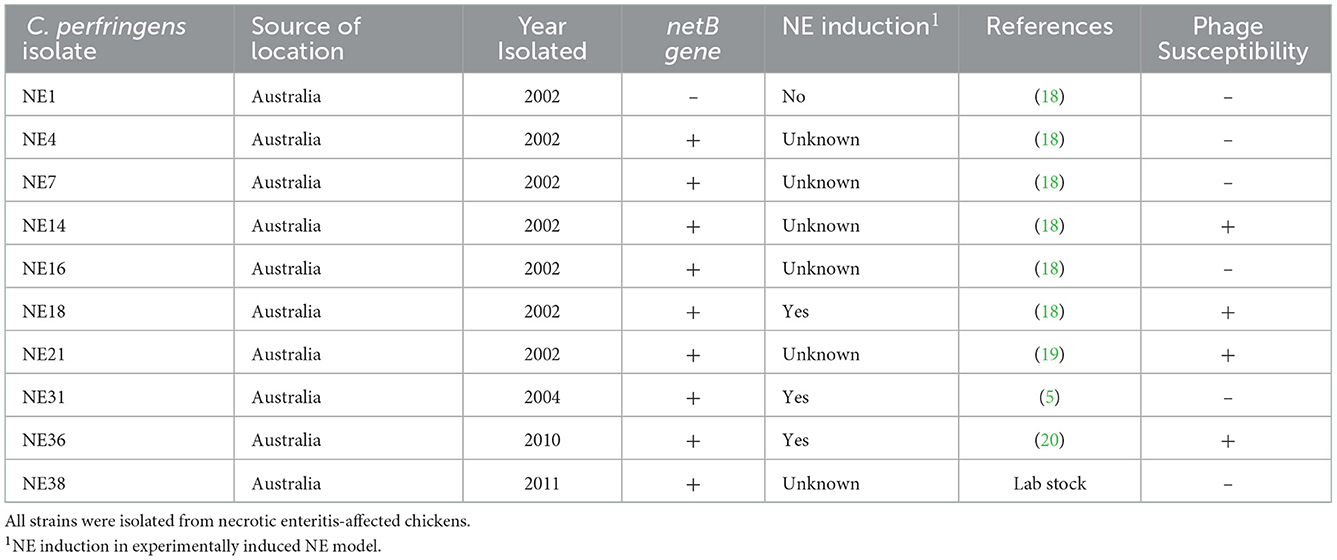
Se probó la capacidad lítica de los bacteriófagos contra cuatro cepas patógenas de C. perfringens (NE14, NE18, NE21 y NE36) para investigar la virulencia del bacteriófago contra huéspedes diana in vitro. Las características de las cepas de C. perfringens ensayadas se detallan en la Tabla 1. Los céspedes bacterianos se prepararon utilizando cepas de C. perfringens ajustadas a la turbidez (220 ± 15 NTU) mezcladas con 7 ml de agar blando BHI al 0,5% (suplementado con 5 mM de MgSO4 y 10 mM de CaCl2) y se coloca en el agar base BHI al 1% preparado. Los lisados de bacteriófagos se titularon y todos estaban dentro del rango de 1-7 × 109UFP/ml. Un volumen de 20 μl de cada preparado de bacteriófagos se colocó asépticamente por duplicado en las posiciones marcadas de los céspedes bacterianos y se puso a secar con una perturbación mínima para retener las gotas de bacteriófagos en las posiciones designadas. Las placas se incubaron anaeróbicamente a 39 °C hasta 48 h y se inspeccionaron para detectar la formación de placa. Todas las pruebas positivas se replicaron tres veces con el huésped C. perfringens correspondiente.
Secuenciación del ADN del bacteriófago
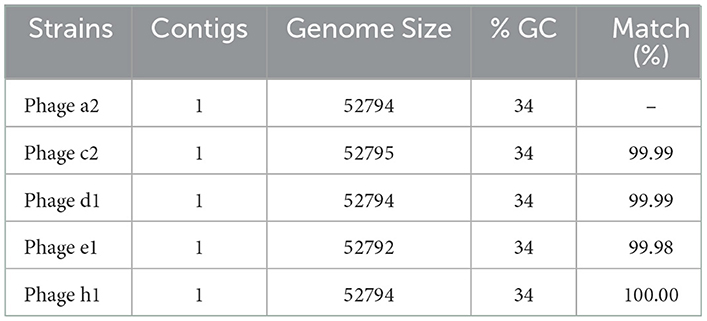
Las reservas de bacteriófagos se concentraron por precipitación con polietilenglicol y el ADN se aisló mediante un método de extracción de fenol/cloroformo. Se prepararon bibliotecas de secuenciación de 5 bacteriófagos de diferentes fuentes (A2, C2, D1, E1 y H1) utilizando un kit Nextera XT (Illumina). Las bibliotecas se secuenciaron en un instrumento Illumina MiSeq utilizando una química de extremos emparejados de 2 × 300 pb. Los datos de secuencia generados a partir del MiSeq se ensamblaron utilizando la tubería de ensamblaje A5-miseq (21). Las secuencias de ADN de bacteriófagos se alinearon utilizando Clone Manager Suite V8 (Scientific and Educational Software, NC) con el bacteriófago a2 como referencia. El análisis de homología de la secuencia del bacteriófago a2 se realizó contra la base de datos del NCBI utilizando el programa BLASTn. La predicción génica se realizó enviando la secuencia de ADN del bacteriófago a2 al servidor RAST (https://rast.nmpdr.org/) para las anotaciones RAST. Los datos de la secuencia completa del genoma se han depositado en la base de datos del NCBI con los números de acceso OP753449-OP753453.
Inoculantes de fagos y estudio in vivo
Dieciocho aislados de bacteriófagos que presentaron actividad lítica contra la cepa EHE-NE18 de C. perfringens fueron enriquecidos para la preparación de un inoculado de bacteriófagos. Se prepararon tres bacteriófagos seleccionados en grandes volúmenes utilizando el procedimiento adoptado para la purificación descrito anteriormente. Los bacteriófagos peletizados se resuspendieron en tampón SM a una concentración final de 1 × 106 UFP/ml para el experimento in vivo.
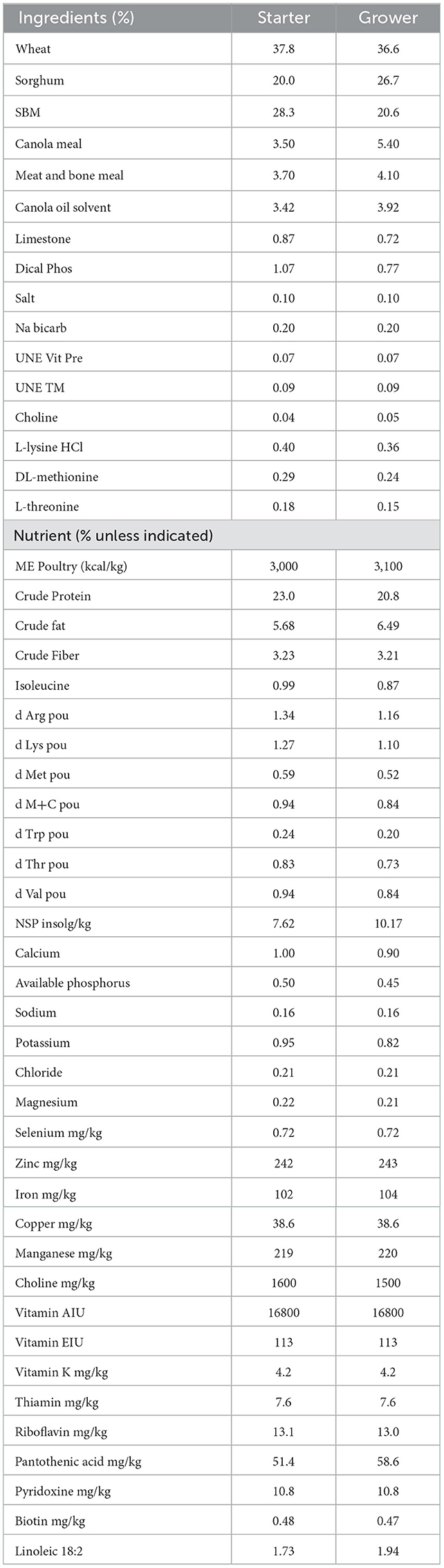
Las aves de un día (pollos de engorde Ross 308) se obtuvieron de un criadero comercial (Baiada Hatchery, Tamworth, NSW, Australia). Las aves se alojaron en 18 corrales, cada uno con 11 aves. Los corrales (0,9 × 0,95 m) se equiparon con comederos y bebederos y se utilizaron virutas de madera dura como materiales de cama. La temperatura y la iluminación se controlaron de acuerdo con la guía de pollos de engorde Ross 308. Se administró a todas las aves una dieta estándar de inicio de trigo y soja formulada para cumplir con las especificaciones de nutrientes Ross 2014 de 308 (Tabla 0). Se administró una dieta de engorde que consistía en la formulación a base de trigo desde el día 10 hasta el final del ensayo el día 2 (Tabla 10). El alimento y el agua estaban disponibles ad libitum. El peso de los corrales y el consumo de alimento se midieron en los días 21 y 2, y el índice de conversión alimenticia (FCR) se calculó dividiendo el consumo de alimento de los corrales por la ganancia de peso de las aves de corral y ajustado con la mortalidad durante el período de cría de d 9 a d 21.
El experimento consistió en un grupo de control no tratado y no desafiado, y grupos de desafío con enteritis necrótica con o sin tratamiento con bacteriófagos. En el día 9, los grupos de desafío de NE recibieron 1 ml de una mezcla de cepas de campo de especies de Eimeria que contenían 5.000 ooquistes de E. acervulina y E. maxima, y 2.500 ooquistes de E. brunetti (Eimeria Pty Ltd, Werribee, VIC, Australia) por sonda nasogástrica oral, y las aves de control no desafiadas fueron sometidas por vía oral con solución salina tamponada con fosfato 1 ml como tratamiento simulado. En los días 14 y 15, las aves de los grupos desafiados fueron inoculadas por sonda oral con 1 × 108 UFC de la cepa EHE-NE18 de C. perfringens descrita por Wu et al. (22). Las aves de tratamiento bacteriófago fueron gavadas por vía oral con 1 × 106 Las unidades del bacteriófago específico de C. perfringens inoculan aproximadamente 1 h después de la sonda nasogástrica de C. perfringens. El día 16, dos aves por corral de todos los grupos fueron seleccionadas al azar, pesadas y sacrificadas por luxación cervical para realizar análisis post-mortem y puntuación de lesiones intestinales en una escala de 0-6 según Keyburn et al. (19). El día 21, se completó el experimento y las aves fueron sacrificadas y eliminadas de acuerdo con el protocolo ético aprobado.
Análisis estadístico
Los datos se analizaron mediante ANOVA de una vía con el bolígrafo como unidad experimental. Las comparaciones pareadas de medias se realizaron mediante la prueba de Tukey cuando se detectaron diferencias entre los tratamientos mediante ANOVA. Se declaró significancia a P < 0,05 para la comparación pareada.
Resultados y discusión
Propiedades líticas de bacteriófagos específicos de C. perfringens y caracterización genómica
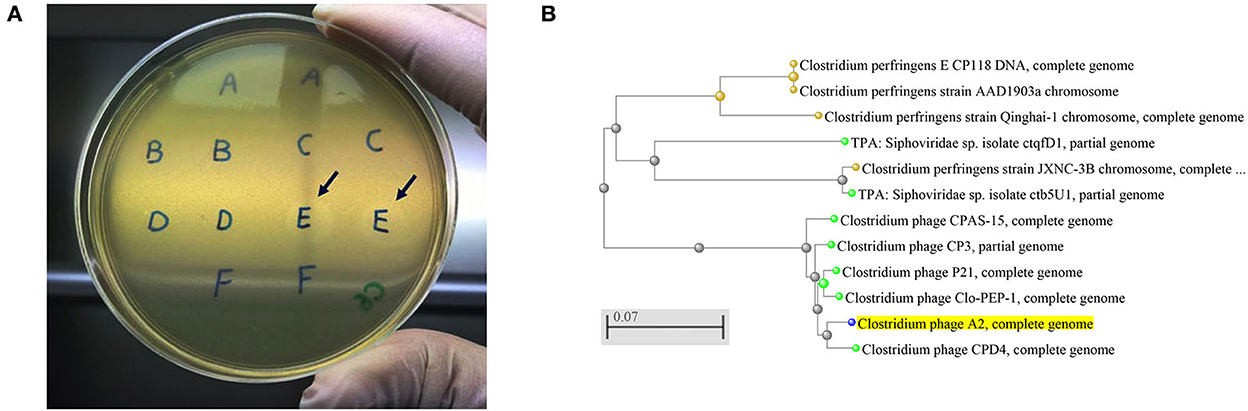
El presente estudio aisló y purificó dieciocho aislados de bacteriófagos de C. perfringens. Cada aislado de bacteriófago fue capaz de producir placas (Figura 1A) en cada uno de los hospederos de C. perfringens obtenidos de los mismos ambientes avícolas (suelo, aguas residuales, lavado de despojos o contenido intestinal) y ubicaciones geográficas correspondientes. Entre los 46 aislados de C. perfringens aislados del medio ambiente, solo tres aislados de C. perfringens fueron susceptibles a todos los aislados de bacteriófagos y, por lo tanto, se utilizaron como huéspedes para los bacteriófagos. Por lo tanto, los 18 bacteriófagos se enriquecieron posteriormente con estos tres huéspedes comunes para la purificación de bacteriófagos, y las preparaciones de bacteriófagos resultantes se utilizaron para realizar pruebas líticas individualmente contra cepas patógenas de C. perfringens derivadas de pollos con enteritis necrótica. Se observaron actividades líticas positivas para todas estas cepas de bacteriófagos frente a cuatro cepas virulentas de C. perfringens previamente descritas (NE14, NE18, NE21 y NE36) en nuestro ensayo de prueba puntual. Sin embargo, otras cepas de C. perfringens (NE1, NE4, NE7, NE16, NE31 y NE38) no fueron susceptibles a estos bacteriófagos (Tabla 1). Dado que la preparación de bacteriófagos era lítica contra la cepa NE18, que se ha informado que produce toxina NetB (3) y se ha utilizado en modelos experimentales de inducción de enfermedades NE (23), esta preparación se utilizó como inoculado en el posterior experimento in vivo con EHE-NE18 como cepa de desafío.
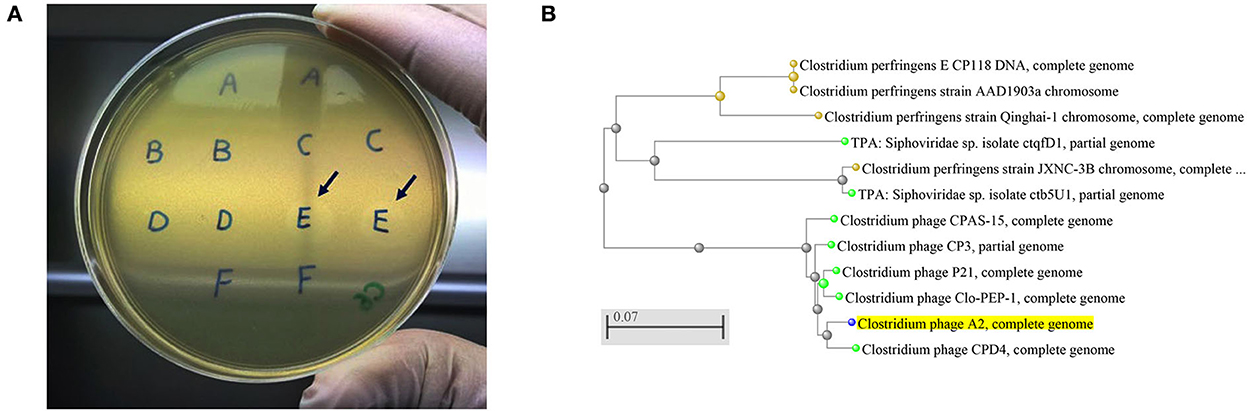 Figura 1. (A) Placas de bacteriófagos de Clostridium perfringens. Flechas que muestran las placas producidas por las cepas de la muestra E que se recolectó del contenido de cecas de pollo, (B) Un árbol evolutivo de cepas de bacteriófagos Clostridium producidas por herramientas de voladura en línea del NCBI con el método de árbol de evolución mínima rápida. El fago A2 de Clostridium aislado en el presente estudio está resaltado en amarillo, mostrando su estrecha relación con el fago CPD4 de Clostridium. La barra de escala corresponde a 0,07 sustituciones por posición de nucleótido.
Figura 1. (A) Placas de bacteriófagos de Clostridium perfringens. Flechas que muestran las placas producidas por las cepas de la muestra E que se recolectó del contenido de cecas de pollo, (B) Un árbol evolutivo de cepas de bacteriófagos Clostridium producidas por herramientas de voladura en línea del NCBI con el método de árbol de evolución mínima rápida. El fago A2 de Clostridium aislado en el presente estudio está resaltado en amarillo, mostrando su estrecha relación con el fago CPD4 de Clostridium. La barra de escala corresponde a 0,07 sustituciones por posición de nucleótido.
Un espectro estrecho de infecciosidad contra las cepas de C. perfringens también presenta la posibilidad de una eliminación controlada de las cepas patógenas de C. perfringens, pero un daño mínimo a las cepas comensales de C. perfringens. Se ha demostrado que C. perfringens existe como comensales intestinales normales con baja abundancia en el tracto intestinal de pollos sanos (6).
Se eligieron aleatoriamente cinco genomas de bacteriófagos para la secuenciación, y el análisis BLAST contra la base de datos del NCBI indicó que los bacteriófagos aislados se alinearon con los bacteriófagos CPD4 de Clostridium con una homología del 97,7% que se agruparon estrechamente como se muestra en la Figura 1B y se predijeron 77 genes, de los cuales 19 tenían funciones bacteriófagos específicas. El grado de homología con bacteriófagos previamente caracterizados indica que los bacteriófagos aislados en este estudio podrían representar una nueva cepa de bacteriófago. Se ha reportado que los aislados de bacteriófagos específicos de C. perfringens pertenecen a la familia Siphoviridae o Podviridare, y se ha demostrado que los bacteriófagos endolisina son responsables de la actividad lítica (17, 24). Las secuencias de los aislados de bacteriófagos producidos en el presente estudio generaron un único contig con el mismo contenido de GC (34%) y mostraron un tamaño de genoma similar con un 99,98-100,00% de identidades (Tabla 3). Los genomas de varios bacteriófagos específicos de C. perfringens han sido caracterizados como se informó anteriormente, proporcionando información esencial para comprender la virulencia de los fagos a sus huéspedes y para aplicaciones posteriores (17, 25).
El tratamiento con bacteriófagos redujo las lesiones inducidas por NE
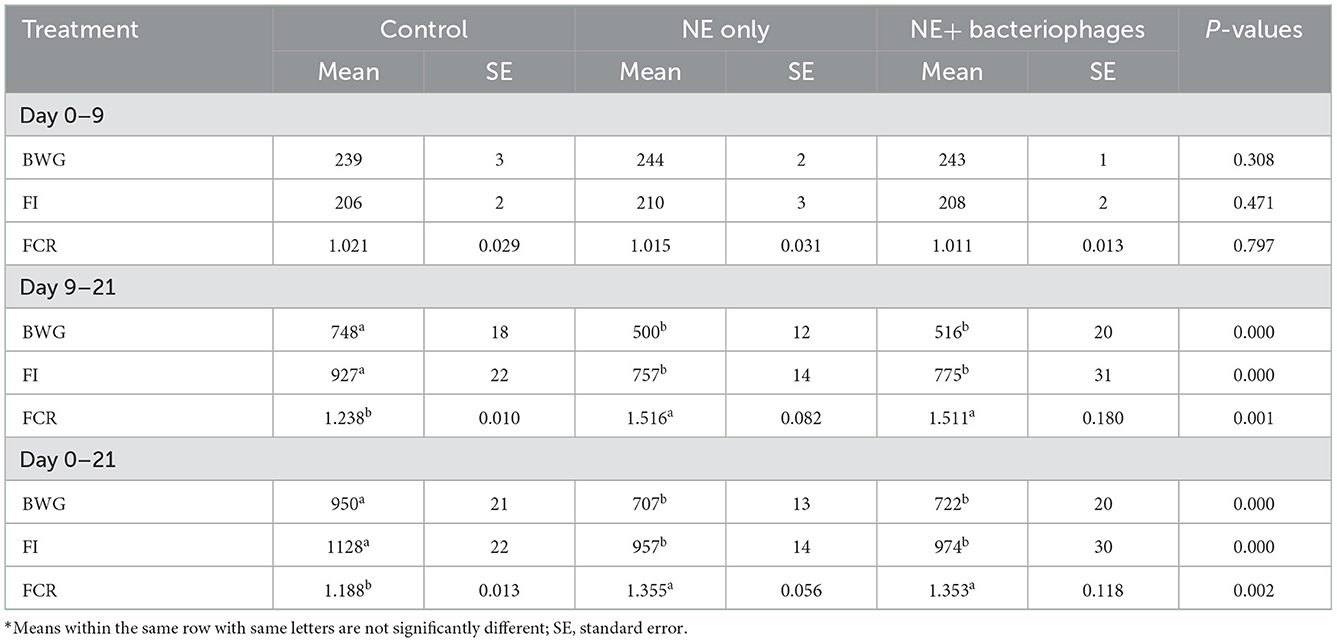
No se observó mortalidad de las aves debido a la EN y las bajas puntuaciones de las lesiones (0,8 de un máximo de 6) en el experimento de provocación in vivo, lo que indica que se había inducido una EN subclínica. Los resultados de la puntuación de la lesión se muestran en la Tabla 4. Se registraron puntuaciones de lesión más altas tanto en el duodeno (P < 0,01) como en el yeyuno (P < 0,01) de las aves desafiadas que en las no desafiadas. El tratamiento con fagos redujo significativamente las puntuaciones de las lesiones de las aves desafiadas con NE (P < 0,01), de modo que las puntuaciones de las lesiones entre las aves tratadas con los bacteriófagos y las aves control no desafiadas no fueron estadísticamente diferentes (P > 0,05). Sin embargo, este efecto significativo de los bacteriófagos en las puntuaciones de las lesiones no se manifestó completamente en las medidas de rendimiento de las aves. En el presente estudio, las aves sometidas a desafío NE se vieron significativamente afectadas, mostrando una reducción de BWG, FI y un aumento de FCR en los tratamientos desafiados en comparación con el control (Tabla 5). Las aves desafiadas con NE con o sin tratamiento con bacteriófagos redujeron el BWG y el FI y aumentaron el FCR durante los días 9 a 21 o de 0 a 21 (P < 0,001 para todos, excepto el FCR durante d 0-21, siendo P = 0,002). El modelo de desafío utilizado en el presente estudio reprodujo experimentalmente las condiciones de posibles brotes de EN en el campo, de los cuales la coccidiosis sirve como factor predisponente para dañar el epitelio intestinal antes de la infección por C. perfringens (7, 22). El presente estudio no se propuso prorratear el impacto de la Eimeria per se y, por lo tanto, es difícil determinar con certeza hasta qué punto la falta de mejora del rendimiento mediante la terapia con bacteriófagos podría deberse a su incapacidad para contrarrestar cualquier daño resultante de la coccidiosis. Eimeria afecta negativamente la utilización de nutrientes al interferir con la integridad de las células del epitelio, lo que lleva a comprometer el crecimiento de los animales (6, 26).
Aunque el tratamiento con bacteriófagos no se tradujo en una mejora del rendimiento de las aves, la menor gravedad de las lesiones intestinales en las aves tratadas sugiere que los bacteriófagos seleccionados adecuadamente contra la cepa productora de NetB de C. perfringens pueden ser dignos de una mayor exploración.
El presente estudio se centró en el rendimiento de las aves durante los días 9 a 21, cuando se aplicó el desafío NE, y se esperaba el efecto NE. Sin embargo, un período de cría prolongado podría ser útil para observar el efecto del tratamiento con bacteriófagos en el rendimiento de etapas posteriores a través de la mejora de la salud intestinal. Además, la dosis y la vía de administración de bacteriófagos también pueden ser factores importantes para la eficacia del tratamiento con bacteriófagos para proteger a las aves de la infección por NE. Estos deberán abordarse en estudios futuros para maximizar el efecto protector de los bacteriófagos, como la entrega de agua y alimento y dosis más altas. Además, es posible que se necesiten más cepas de bacteriófagos para controlar las cepas de C. perfringens en pollos mediante la administración de un cóctel de espectro más amplio.
En conclusión, se aislaron 18 cepas aisladas de bacteriófagos específicos de C. perfringens. El hallazgo de que tenían un 96,7% de similitud con el bacteriófago Clostridium más estrechamente relacionado, previamente caracterizado, indicó que representan un grupo similar de bacteriófagos Clostridium. El resultado mostró un efecto protector alentador de la aplicación de bacteriófagos con lesiones aliviadas en el intestino de las aves desafiadas por NE, a pesar de que no se observó ninguna mejora en el rendimiento. Todavía no se ha asegurado si el bacteriófago puede utilizarse en la producción avícola para combatir la NE. Se justifican más investigaciones para optimizar la dosis y el protocolo de administración y para aislar más cepas de bacteriófagos NetB positivas e incluso negativas para un control de espectro más amplio de diferentes patógenos de C. perfringens.
Declaración de disponibilidad de datos
Los datos presentados en el estudio están depositados en el repositorio GenBank del NCBI, con los números de acceso OP753449 – OP753453.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité de Ética Animal de la Universidad de Nueva Inglaterra (UNE), Armidale, Australia.
Contribuciones de los autores
CK realizó la recolección y el análisis de datos, interpretó los resultados y escribió el manuscrito. KM realizó el aislamiento de los bacteriófagos y su análisis. TV secuenció el genoma del bacteriófago, analizó los datos y leyó el manuscrito críticamente. HC participó en el diseño del proyecto, aisló bacteriófagos y revisó críticamente el manuscrito. RM participó en el diseño del proyecto, el análisis de datos y la revisión crítica del manuscrito. MC participó en la conceptualización del proyecto y revisó críticamente el manuscrito. S-BW conceptualizó, diseñó el proyecto, realizó el experimento con animales, analizó los datos y revisó críticamente el manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión enviada.
Financiación
Este estudio fue apoyado por el CRC Avícola (#1-3-4).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Wade B, Keyburn, A. El verdadero costo de la enteritis necrótica. Mundo Avícola. (2015) 31:16–17.
2. Rood, JI, Adams V, Lacey J, Lyras D, McClane BA, et al. Ampliación del esquema de tipificación basado en la toxina de Clostridium perfringens. Anaerobio. (2018) 53:5–10. doi: 10.1016/j.anaerobe.2018.04.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Keyburn AL, Boyce JD, Vaz P, Bannam TL, Ford ME, Parker D, et al. NetB, una nueva toxina que se asocia con la enteritis necrótica aviar causada por Clostridium perfringens. Patógenos PLoS. (2008) 4:e26. doi: 10.1371/journal.ppat.0040026
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Cooper KK, Songer JG. Virulencia de Clostridium perfringens en un modelo experimental de enteritis necrótica aviar. Microbiol veterinario. (2010) 142:323–8. doi: 10.1016/j.vetmic.2009.09.065
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Keyburn AL, Bannam TL, Moore RJ, Rood JI. NetB, una toxina formadora de poros de cepas de enteritis necrótica de Clostridium perfringens. Toxinas. (2010) 2:1913–27. doi: 10.3390/toxinas2071913
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Van Immerseel F, Rood JI, Moore RJ, Titball RW. Repensar nuestra comprensión de la patogénesis de la enteritis necrótica en pollos. Tendencias Microbiol. (2009) 17:32–6. doi: 10.1016/j.tim.2008.09.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Moore, RJ. Enteritis necrótica que predispone a los pollos de engorde. Pathol aviar. (2016) 45:1–22. doi: 10.1080/03079457.2016.1150587
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Skinner JT, Bauer S, Young V, Pauling G, Wilson J. Un análisis económico del impacto de la enteritis necrótica subclínica (leve) en pollos de engorde. Avian Dis. (2010) 54:1237–40. doi: 10.1637/9399-052110-Reg.1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Lanckriet A, Timbermont L, De Gussem M, Marien M, Vancraeynest D, Haesebrouck F, et al. Efecto de los anticoccidiales y antibióticos de uso común en un modelo de enteritis necrótica subclínica. Pathol aviar. (2010) 39:63–8. doi: 10.1080/03079450903505771
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Eeckhaut V, Wang J, Van Parys A, Haesebrouck F, Joossens M, Falony G, et al. El probiótico Butyricicoccus pullicaecorum reduce la conversión alimenticia y protege de microorganismos intestinales potencialmente dañinos y enteritis necrótica en pollos de engorde. Microbiol frontal. (2016) 7:1416. doi: 10.3389/fmicb.2016.01416
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Cogliani C, Goossens H, Greko C. Restricción del uso de antimicrobianos en animales destinados a la producción de alimentos: lecciones de Europa. Microbio. (2011) 6:274.
12. Sulakvelidze A, Alavidze Z, Morris JG. Terapia con bacteriófagos. Agentes antimicrobianos quimiotera. (2001) 45:649–59. doi: 10.1128/AAC.45.3.649-659.2001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Karthik K, Muneeswaran NS, Manjunathachar HV, Gopi M, Elamurugan A, Kalaiyarasu S. Bacteriófagos: alternativa eficaz a los antibióticos. Adv Anim Vet Sci. (2014) 2:1–7. doi: 10.14737/journal.aavs/2014/2.3s.1.7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Pleteneva EA, Shaburova OV, Sykilinda NN, Miroshnikov KA, Krylov SV, Mesianzhinov VV, Krylov, VN. Estudio de la diversidad en un grupo de fagos de Pseudomonas aeruginosa especie PB1 (Myoviridae) y su comportamiento en mutantes bacterianos resistentes a la adsorción. Genetika. (2008) 44:185–94. doi: 10.1134/S1022795408020051
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Miller RW, Skinner J, Sulakvelidze A, Mathis GF, Hofacre, CL. Terapia con bacteriófagos para el control de la enteritis necrótica de pollos de engorde infectados experimentalmente con Clostridium perfringens. Avian Dis. (2010) 54:33–40. doi: 10.1637/8953-060509-Reg.1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Smith HW. Los bacteriófagos de Clostridium perfringens. J Gen Microbiol. (1959) 21:622–30. doi: 10.1099/00221287-21-3-622
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Seal BS, Fouts DE, Simmons M, Garrish JK, Kuntz RL, Woolsey R, et al. Clostridium perfringens bacteriófagos ΦCP39O y ΦCP26F: organización genómica y análisis proteómico de los viriones. Arch Virol. (2011) 156:25–35. DOI: 10.1007/S00705-010-0812-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Sheedy SA, Ingham AB, Rood JI, Moore RJ. Secuencias de toxina alfa altamente conservadas de aislados aviares de Clostridium perfringens. J Clin Microbiol. (2004) 42:1345–7. doi: 10.1128/JCM.42.3.1345-1347.2003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Keyburn AL, Sheedy SA, Ford ME, Williamson MM, Awad MM, Rood JI. La toxina alfa de Clostridium perfringens no es un factor de virulencia esencial en la enteritis necrótica en pollos. Inf Immun. (2006) 74:6496–500. doi: 10.1128/IAI.00806-06
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Keyburn AL, Portela RW, Sproat K, Ford ME, Bannam TL, Yan X, et al. La vacunación con toxina NetB recombinante protege parcialmente a los pollos de engorde de la enteritis necrótica. Res. Veterinaria. (2013) 44:1. doi: 10.1186/1297-9716-44-54
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Bobina D, Jospin G, Darling AE. A5-miseq: una canalización actualizada para ensamblar genomas microbianos a partir de datos de Illumina MiSeq. Bioinformática. (2015) 31:587–9. doi: 10.1093/bioinformatics/btu661
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Wu S-B, Rodgers N, Choct M. Modelo optimizado de enteritis necrótica que produce infección clínica y subclínica de Clostridium perfringens en pollos de engorde. Avian Dis. (2010) 54:1058–65. doi: 10.1637/9338-032910-Reg.1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Gharib-Naseri, K, Kheravii, S, Keerqin, C, Swick RA, Choct, M, Wu, S-B. La expresión diferencial de genes intestinales en enteritis necrótica desafió a pollos de engorde con dos cepas diferentes de Clostridium perfringens. Ciencia avícola. (2020) 100:100886. doi: 10.1016/j.psj.2020.11.063
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Ha E, Son, B, Ryu, S. Clostridium perfringens bacteriófago virulento CPS2 y su endolisina termoestable LysCPS2. Virus. (2018) 10:251. doi: 10.3390/v10050251
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Morales CA, Oakley BB, Garrish JK, Siragusa GR, Ard MB, Seal BS. Secuencia completa del genoma del bacteriófago podoviral ΦCP24R, que es virulento para Clostridium perfringens. Arch Virol. (2012) 157:769–72. doi: 10.1007/s00705-011-1218-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Collier C, Hofacre C, Payne A, Anderson D, Kaiser P, Mackie R, et al. La mucogénesis inducida por coccidios promueve la aparición de enteritis necrótica al apoyar el crecimiento de Clostridium perfringens. Veterinario Inmunol Inmunopatíaco. (2008) 122:104–15. doi: 10.1016/j.vetimm.2007.10.014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: bacteriófago, Clostridium perfringens, enteritis necrótica, lección, pollo de engorde
Cita: Keerqin C, McGlashan K, Van TTH, Chinivasagam HN, Moore RJ, Choct M y Wu S-B (2022) Un aislado de bacteriófago lítico redujo las lesiones inducidas por Clostridium perfringens en pollos de engorde desafiados por enteritis necrótica. Frente. Vet. Sci. 9:1058115. doi: 10.3389/fvets.2022.1058115
Recibido: 30 de septiembre de 2022; Aceptado: 06 de diciembre de 2022;
Publicado: 22 diciembre 2022.
Editado por:
Juan D. Latorre, Universidad de Arkansas, Estados Unidos
Revisado por:
Thainá Landim de Barros, Universidad Estatal de Ohio, Estados
Unidos Adil Sabr Al-Ogaili, Instituto Técnico Kut, Universidad Técnica Intermedia, Irak
Derechos de autor © 2022 Keerqin, McGlashan, Van, Chinivasagam, Moore, Choct y Wu. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY). S
*Correspondencia: Shu-Biao Wu,  shubiao.wu@une.edu.au
shubiao.wu@une.edu.au
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía