Uso de la secuenciación del genoma completo

Uso de la secuenciación del genoma completo para desentrañar la diversidad genética de un espotipo prevalente de Mycobacterium bovis en un escenario multihuésped en España
 Pilar Pozo1*,
Pilar Pozo1*,  Víctor Lorente-Leal1,2,
Víctor Lorente-Leal1,2,  Suelee Robbe-Austerman3,
Suelee Robbe-Austerman3,  Jessica Hicks3,
Jessica Hicks3,  Tod Stuber3,
Tod Stuber3,  Javier Bezos1,2,
Javier Bezos1,2,  Lucía de Juan1,2,
Lucía de Juan1,2,  José Luis Sáez4,
José Luis Sáez4,  Beatriz Romero1,2,
Beatriz Romero1,2,  Julio Álvarez1,2 y
Julio Álvarez1,2 y  en nombre de la Red Española de Vigilancia del Seguimiento de la Tuberculosis Animal
en nombre de la Red Española de Vigilancia del Seguimiento de la Tuberculosis Animal- 1Centro de Vigilancia Sanitaria VISAVET, Universidad Complutense de Madrid, Madrid, España
- 2Departamento de Sanidad Animal, Facultad de Veterinaria, Universidad Complutense de Madrid, Madrid, España
- 3National Veterinary Services Laboratories, Animal and Plant Health Inspection Service, Department of Agriculture, Ames, IA, Estados Unidos
- 4Subdirección General de Sanidad e Higiene Animal y Trazabilidad, Dirección General de Sanidad de la Producción Agraria, Ministerio de Agricultura, Pesca y Alimentación, Madrid, España
A pesar de los esfuerzos invertidos en la erradicación de la tuberculosis bovina en España, la prevalencia del rebaño se ha mantenido constante en el país durante los últimos 15 años (~ 1,5-1,9%) debido a una combinación de factores epidemiológicos que afectan el control de la enfermedad, incluida la transmisión entre especies. Aquí, nuestro objetivo fue investigar la diversidad molecular de aislados de Mycobacterium bovis pertenecientes al espotipo SB0339 altamente prevalente en la interfaz ganado-fauna en diferentes regiones de España utilizando secuenciación del genoma completo (WGS). Se analizaron los datos genómicos de 136 aislados de M. bovis recuperados de diferentes especies animales (bovino, jabalí, gamo y ciervo colorado) y ubicaciones entre 2005 y 2018 para investigar la transmisión entre especies y dentro de ellas, así como dentro de los rebaños. Todos los aislados secuenciados diferían en 49-88 polimorfismos de nucleótidos individuales de su ancestro común más reciente. La heterogeneidad genética fue geográfica más que específica de la especie huésped, ya que los aislados recuperados tanto del ganado como de la vida silvestre de una región determinada estaban más estrechamente relacionados en comparación con los aislados de la misma especie pero geográficamente distantes. De hecho, se encontró una fuerte asociación entre las distancias geográficas y genéticas que separan los pares de aislados de M. bovis, con un efecto significativamente más fuerte cuando se compararon los aislados de ganado con la fauna silvestre o los aislados de ganado silvestre en España. Los mismos resultados se obtuvieron en Madrid, la región con el mayor número de aislados secuenciados, pero no se observaron diferencias según el huésped. La diversidad genética dentro del rebaño fue limitada a pesar del considerable tiempo transcurrido entre los aislamientos. La detección de cepas estrechamente relacionadas en diferentes hospedadores demuestra la compleja dinámica de transmisión entre hospedadores presente en zonas endémicas de España. En conclusión, WGS resulta una valiosa herramienta para rastrear la infección por tuberculosis bovina en una alta resolución y puede contribuir a lograr su erradicación en España.
Introducción
Mycobacterium bovis, miembro del complejo Mycobacterium tuberculosis (MTBC) y principal agente causal de la tuberculosis bovina (TBB), puede infectar a una amplia gama de especies de mamíferos, incluidas especies domésticas y de vida silvestre, así como a humanos (Cousins, 2001; Aranaz y otros, 2004; Pérez-Lago et al., 2014). Si bien la enfermedad se ha erradicado con éxito en varios países utilizando estrategias de prueba y sacrificio y restricciones de movimiento (Reviriego Gordejo y Vermeersch, 2006; Comisión Técnica de Salud y Bienestar Animal (AHAW) de la EFSA, 2014; More et al., 2015), la prevalencia de la tuberculosis bovina sigue siendo relativamente alta en varias regiones del mundo (Guta et al., 2014a; Allen et al., 2018). Los esfuerzos de erradicación se han visto constantemente obstaculizados por el largo período de latencia característico de la enfermedad (Goodchild y Clifton-Hadley, 2001), las limitaciones de las pruebas diagnósticas disponibles, particularmente para la detección de etapas tempranas de infección (de la Rua-Domenech et al., 2006), y la existencia de reservorios de vida silvestre (Garnett et al., 2002; O’Brien y otros, 2006). Por esta razón, en lugares donde se sabe que los reservorios de vida silvestre son importantes en la transmisión de la tuberculosis bovina, el control de la enfermedad debe centrarse en un enfoque integrado en la interfaz ganado-vida silvestre.
En España, aunque la prevalencia del rebaño ha disminuido significativamente desde la implementación inicial de los programas nacionales de erradicación en los años 80, la erradicación completa de la enfermedad sigue siendo difícil de alcanzar (2,2% de prevalencia de rebaño en 2002 y 1,6% en 2020; Informe Final Técnico Tuberculosis Bovina Año, 2020). La tuberculosis bovina no está distribuida de manera uniforme en todo el país, ya que la prevalencia de rebaño es mayor en las regiones central y meridional (hasta 10,9 y 6,4% en Castilla-La Mancha y Andalucía, respectivamente en 2020), mientras que la enfermedad está prácticamente ausente en las partes noroccidentales de España (0% de prevalencia de rebaño en Galicia, Asturias y las Islas Canarias, entre otros; Informe Final Técnico Tuberculosis Bovina Año, 2020). En las zonas endémicas de tuberculosis bovina, la distribución geográfica de las especies de ganado y fauna silvestre que se sabe que están infectadas con M. bovis a menudo se superponen. Esto es particularmente relevante en el caso del ganado manejado extensivamente, que puede compartir pastizales y/o puntos de agua con especies silvestres, lo que conlleva un riesgo potencial de transmisión de la infección entre especies. Además, en ciertos casos, la infección residual puede persistir en el tiempo en un rebaño a pesar de la aplicación de programas de prueba y sacrificio debido a la presencia de animales infectados pero no detectados (Karolemeas et al., 2011; Guta et al., 2014b). Aunque el jabalí es el reservorio de fauna silvestre más importante de la tuberculosis bovina en el centro y sur de España, el ciervo rojo y el gamo también pueden servir como huéspedes potenciales (Gortazar et al., 2008; Naranjo et al., 2008).
La tipificación de oligonucleótidos espaciadores de repetición variable directa (spoligotipado DVR) y la tipificación de unidades repetitivas intercaladas micobacterianas – Número variable de repeticiones en tándem (MIRU-VNTR) son las técnicas más utilizadas para caracterizar los aislados de M. bovis (Kamerbeek et al., 1997). La mayoría de los spoligotipos de M. bovis en España están circunscritos a regiones específicas, mientras que una pequeña proporción de perfiles altamente prevalentes están muy extendidos en el país (es decir, SB0121, SB0134 o SB0339; Rodríguez-Campos et al., 2012). La tipificación molecular de cepas de M. bovis ha demostrado que tanto el ganado como las especies de vida silvestre comparten perfiles similares de espotipos y VNTR, con agrupamiento espacial entre huéspedes que sugiere transmisión interespecífica a escalas locales (Aranaz et al., 2004). En estas circunstancias, el control efectivo de la tuberculosis bovina solo puede lograrse si la vida silvestre también se considera en los esfuerzos de erradicación. Además, la caracterización molecular puede ayudar a determinar si los animales recién detectados en rebaños previamente infectados pueden representar una reinfección o un fracaso en la eliminación de todo el ganado infectado en las pruebas de rebaño anteriores.
A pesar del uso generalizado del spoligotipado, esta herramienta por sí sola es incapaz de reconstruir con precisión la filogenia de los aislados de M. bovis o diferenciar aislados epidemiológicamente no relacionados en ciertos entornos dada su resolución limitada y alta tasa de homoplasia (Comas et al., 2009). Los avances recientes en la secuenciación del genoma completo (WGS) permiten la realización de exámenes de detección de todo el genoma para estudiar poblaciones microbianas, aumentando el poder de los estudios de epidemiología molecular. En este sentido, el uso de genotipado basado en polimorfismos de nucleótido único (SNP) puede proporcionar información valiosa sobre la patogenicidad y evolución de las cepas de M. bovis, permitiendo la identificación de asociaciones espaciales o de huéspedes, mejorar las investigaciones de brotes y la diferenciación de cepas de M. bovis en linajes y estructuras filogenéticas relacionadas (Joshi et al., 2012; Hauer et al., 2015; Ghebremariam y otros, 2016; Trewby et al., 2016; Orloski et al., 2018; Price-Carter et al., 2018).
En el contexto de la erradicación y el control de la tuberculosis bovina, el seguimiento de la variabilidad dentro del rebaño de M. bovis es crucial, ya que puede proporcionar información sobre posibles nuevas introducciones en eventos de recurrencia del rebaño. Además, comprender los patrones de transmisión de la tuberculosis bovina dentro del ganado y entre el ganado y las especies silvestres de diferentes áreas en España es crucial para evaluar el riesgo de infección para el ganado en una interfaz de múltiples huéspedes, particularmente en áreas endémicas donde coexisten ganado y vida silvestre infectados. Hasta la fecha, no se han realizado estudios multirregionales para caracterizar la diversidad genética entre aislados de M. bovis de ganado vacuno y fauna silvestre en España utilizando WGS. Por estas razones, el objetivo de este estudio fue utilizar tecnologías WGS para evaluar el riesgo de transmisión de TBB entre ganado y fauna utilizando como ejemplo práctico uno de los espotipos más prevalentes en España, SB0339. Este espototipo está ampliamente distribuido por todo el país y está especialmente agrupado en la provincia de Madrid, con un >48% del total de aislamientos SB0339 (extraídos de mycoDB.es). Los objetivos específicos fueron (I) investigar la diversidad genómica entre los aislados de SB0339 M. bovis recuperados de ganado vacuno y fauna silvestre durante 2005-2018 de diferentes regiones de España en general, y en Madrid en particular; (II) reconstruir las relaciones filogenéticas entre los aislados; y (III) realizar un análisis comparativo de la diversidad genómica intraespecie e interespecie para comprender los procesos evolutivos subyacentes de M. bovis en la interfaz ganado-fauna en España.
Materiales y métodos
Selección de aislados y métodos de laboratorio
Como parte del programa de erradicación de la tuberculosis bovina, se recogen muestras de tejido de bovinos o fauna silvestre sospechosa de estar infectada con tuberculosis bovina debido a resultados positivos en pruebas ante mortem (bovinos) o detección de lesiones de apariencia granulomatosa en la inspección post mortem (ganado y fauna silvestre) y se envían a los laboratorios regionales de referencia para el cultivo bacteriológico. Una vez que se detecta el crecimiento bacteriano, se extrae ADN de cultivos y se confirma la presencia de miembros MTBC a través de métodos moleculares convencionales, como la PCR o el spoligotipado DVR (Cousins et al., 1991; Kamerbeek y otros, 1997). En este contexto, se consideró una selección de aislados de M. bovis recuperados de muestras de ganado y tejido silvestre infectados naturalmente utilizando procedimientos de aislamiento estándar en el Centro de Vigilancia Sanitaria VISAVET para su inclusión en los análisis realizados aquí.
El SB0339 fue seleccionado para el estudio ya que este patrón es el tercer espotipo más prevalente en España [8,1% de todos los aislados, solo precedido por SB0121 (28,2%) y SB0134 (10,7%)], y el espotipo aislado más frecuentemente en Madrid (Rodriguez-Campos et al., 2010, 2012). Además, este espototipo se detecta con frecuencia tanto en el ganado como en la fauna silvestre (es decir, ciervos rojos, gamos y jabalíes). Un total de 1.501 (44% del total de cepas SB0339 en España, mycoDB.es) SB0339 estaban disponibles para su selección en la recogida de cepas del Centro de Vigilancia Sanitaria VISAVET y se dividieron en estratos en función de la especie animal de aislamiento, ubicación (provincia) y año de aislamiento. Posteriormente, se realizó un muestreo aleatorio estratificado, de modo que solo se consideraron para la selección solo los subconjuntos de aislados SB0339 recuperados de provincias y años en los que había más de una especie huésped disponible. En consecuencia, 259 aislados del spoligotipo SB0339 recuperados de ganado vacuno y fauna silvestre entre 2005 y 2018 en 21 regiones de España fueron sometidos a recultivo bacteriológico. Además, para evaluar el grado de heterogeneidad genética entre los aislados de M. bovis en rebaños infectados con tuberculosis bovina, se seleccionaron entre 2 y 8 aislamientos de 15 rebaños. Diez de estos rebaños habían sido infectados crónicamente, definidos como rebaños con aislamientos de M. bovis en más de 1 año.
Los aislados seleccionados identificados como M. bovis se centrifugaron a 2.500 × g durante 10 min y posteriormente se lavaron dos veces con 5 ml de solución salina tamponada con fosfato (PBS, Gibco) y se centrifugaron. Se vertieron sobrenadantes y los gránulos se volvieron a suspender en 4 ml de PBS. Las muestras se inactivaron y el ADN micobacteriano se separó aún más de los otros componentes celulares utilizando un protocolo basado en la interrupción de la perla y el fenol / cloroformo / alcohol isoamílico (PCI, Sigma-Aldrich) como se describe en otra parte.1 La calidad y concentración del ADN se midió utilizando un espectrofotómetro de nanogotas y un Qubit™ fluorómetro (Invitrogen).
Secuenciación del genoma completo
El ADN micobacteriano extraído fue enviado al Laboratorio Nacional de Servicios Veterinarios (NVSL) en Ames, Iowa (Estados Unidos) para realizar WGS. Las bibliotecas se prepararon utilizando el kit de preparación Nextera XT y el ADN genómico total se secuenció en un instrumento MiSeq para producir lecturas de 2 × 250 pb (Illumina, San Diego, CA, Estados Unidos). Los archivos FASTQ generados se analizaron utilizando la canalización vSNP interna NVSL del Departamento de Agricultura de los Estados Unidos (USDA), una canalización de llamadas de variantes dependientes de referencia de alta resolución.2 Brevemente, las lecturas genómicas se mapearon contra el genoma de referencia M. bovis AF2122/97 (National Center for Biotechnology Information [NCBI] número de acceso NC_0002945) utilizando el alineador Burrows-Wheeler (BWA; Li y Durbin, 2009; Malone et al., 2017), y vSNP luego llamaron SNP en relación con la referencia. La definición de SNP se utilizó para identificar diferentes grupos de aislados dentro de la canalización de vSNP como se especifica en los archivos de dependencia de vSNP.
Los polimorfismos de nucleótido único se llamaron usando FreeBayes, un detector de variantes basado en haplotipos, generando archivos de formato de llamada variante (VCF; Garrison y Marth, 2012). Los resultados se filtraron mediante una puntuación mínima de calidad con escala Phred (QUAL) de 150 y un recuento de alelos (CA) de 2. Los aislados que contenían llamadas heterólogas/heterocigotas en una posición SNP (AC = 1 y presentes en el <90% de las lecturas) se consideraron ambiguos según lo codificado por la Unión Internacional de Química Pura y Aplicada (IUAPC) y se inspeccionaron visualmente. Aquellas posiciones de SNP que tenían una llamada variante en más del 90% de las lecturas se consideraron homocigotas, mientras que las llamadas de variante identificadas en el <90% de las lecturas de la muestra se consideraron heterocigotas y se eliminaron del análisis.
Luego se generó un resumen de métricas de calidad para evaluar el rendimiento de la ejecución de secuenciación de cada aislado. Esto incluyó la profundidad promedio de cobertura, la longitud promedio de lectura, el porcentaje del genoma de referencia cubierto por las lecturas de cada aislado, el número de contigs que no se asignan a la referencia, el número de SNP con una puntuación de calidad (QUAL) de >300 con un AC de 2 (buenos SNP) y el código octal spoligotipo. El código octal se basó en los recuentos de cada secuencia espaciadora contra los archivos FASTQ sin procesar. Las lecturas identificadas como complejo M. tuberculosis se aislaron y las lecturas limpias se ejecutaron a través de vSNP.
Las tablas de SNP y los árboles filogenéticos se crearon después de eliminar todos los SNP no informativos (es decir, homogéneos / monomórficos entre los aislados). Los SNP identificados en el ∼10% del genoma compuesto por regiones repetitivas se excluyeron utilizando archivos de enmascaramiento predeterminados en las dependencias de vSNP, ya que el mapeo en estas regiones es propenso a errores (Cole et al., 1998). Esto incluyó la familia de genes prolina-glutamato (PE)/prolina-prolina-glutamato (PPE) altamente rica en GC y polimórfica (Cole et al., 1998). Además, se omitieron los SNP presentes en áreas con una acumulación anómala de variantes (típicamente ≥2 SNP en 10 pb debido a una alineación deficiente). Después de eliminar todas las posiciones variantes no informativas y potencialmente erróneas, los SNP informativos se validaron visualizando archivos de alineación en el software Integrative Genomics Viewer (IGV) (Robinson et al., 2011).
Los árboles filogenéticos de máxima verosimilitud se construyeron con RAxML (Stamatakis, 2014) utilizando el archivo de alineación de SNP que contiene los SNP polimórficos y validados concatenados. Se asumió que un modelo CAT reversible en el tiempo general (GTR) para la tasa de sustitución de nucleótidos con una distribución Gamma tenía en cuenta la heterogeneidad entre sitios (Stamatakis, 2014). La precisión del árbol filogenético se confirmó utilizando la tabla de SNP validada manualmente, y se realizó un filtrado adicional de SNP cuestionables aislado por aislado cuando fue apropiado.
El grado de relación genética entre los genomas de M. bovis se evaluó entre especies y dentro de ellas utilizando las distancias genéticas por pares entre aislados. Los aislados se identificaron utilizando el año de aislamiento seguido del número de aislado (#), la(s) inicial(es) de la provincia de origen, la especie animal y, en su caso, el código del rebaño o de la finca de la que se recuperó la muestra.
Análisis filogenéticos entre especies y dentro de ellas
El análisis filogenético se realizó primero en el número total de aislamientos disponibles para el estudio. Las distribuciones de las distancias de SNP por pares entre y dentro de los aislados de ganado y vida silvestre se compararon utilizando la prueba de Kruskal-Wallis seguida de pruebas post-hoc con correcciones de Bonferroni para comparaciones múltiples. Se realizó un agrupamiento bayesiano jerárquico para determinar la estructura de la población utilizando BAPS (Cheng et al., 2013). Los aislados se consideraron genéticamente cercanos cuando sus secuencias estaban dentro de 0-3 SNP entre sí (Hatherell et al., 2016). La distancia geográfica en kilómetros entre pares de aislados se calculó utilizando los centroides de los municipios en los que se recuperaron los aislados, y la relación entre las distancias genéticas y geográficas se evaluó mediante la prueba de correlación rho de Spearman.
Posteriormente, y para evitar un aumento artificial de la homogeneidad del ganado dentro de la especie, solo se seleccionó aleatoriamente un aislado por rebaño. La relación entre la distancia genética entre dos aislados y la distancia entre sus orígenes geográficos (provincia, municipio y/o estado) se exploró utilizando modelos de regresión lineal que también consideraron las especies hospedadoras de origen (es decir, si el par de aislados se originó en el ganado, en la vida silvestre o en ambos). El modelo consideró los factores de riesgo seleccionados (distancia geográfica en km y especies hospedadoras) junto con la interacción entre ambos. Finalmente, el mismo análisis se realizó solo en aislados de la región de Madrid, de los cuales se disponía del mayor número de aislamientos (ver resultados). Dado que solo se seleccionó aleatoriamente un aislado por rebaño en rebaños de ganado con múltiples aislamientos, el impacto de la selección en la evaluación de la asociación entre la distancia genética y el origen geográfico y la especie huésped se evaluó mediante un análisis de sensibilidad consistente en repetir 10 veces los análisis con un aislado por rebaño de muestreo intensivo seleccionado al azar.
Análisis filogenéticos dentro y entre rebaños
Se seleccionaron aislados recuperados de diferentes rebaños bovinos para evaluar la variabilidad genética de los aislados recuperados de los mismos rebaños a lo largo del tiempo. Se recuperaron datos sobre el tiempo transcurrido entre los aislamientos y se dispuso del número de años con aislamientos para cada rebaño infectado crónicamente. Se evaluaron las distancias genéticas dentro del rebaño (es decir, entre aislados originarios de un solo rebaño) considerando todos los rebaños y solo aquellos infectados crónicamente (con aislamientos de TB bovina recuperados en más de 1 año), junto con el número de cepas estrechamente relacionadas (≤3 SNP) presentes en los rebaños durante diferentes períodos de tiempo. Se calculó la correlación entre las distancias genéticas medianas y el número de años diferentes de los que se recuperaron los aislamientos en cada rebaño.
Se realizaron múltiples comparaciones, gráficos y análisis de filogenia utilizando los paquetes ggplot2 (Wickham, 2009), dplyr (Wickham et al., 2019), simio (Paradis et al., 2004), rgdal (Bivand et al., 2013), rhierbaps (Tonkin-Hill et al., 2018) y PMCMRplus (Pohlert, 2020) para el software R (R Core Team, 2019).
Resultados
Análisis descriptivo
Se recuperaron ciento treinta y seis aislamientos de las 259 muestras SB0339 seleccionadas. De estos, el 72,8% (n = 99) se derivó de la colección de cepas VISAVET, mientras que el 27,2% restante fue proporcionado por otros Laboratorios Regionales. Estas 136 cepas se obtuvieron durante el período 2005-2018 de bovinos (72,8%, n = 99), jabalíes (14,7%, n = 20), gamos (6,6%, n = 9) y ciervos rojos (5,9%, n = 8, Tabla 1). Se disponía de una mediana de 10 muestras por año (rango 2-25), con más aislamientos incluidos después de 2009, y los años 2010 y 2017 que representan el mayor número de aislamientos (n = 17 y n = 25, respectivamente, Figura suplementaria S1). Las áreas de origen de las muestras utilizadas en el estudio incluyeron las regiones noroeste, noreste, centro, este y sur del país (Tabla 1; Figura 1). La información de aislamiento individual y los metadatos asociados se detallan en el cuadro suplementario S1. La mayor proporción (48,5%, n = 66) de aislados se derivó de animales infectados con tuberculosis bovina localizados en Madrid, seguida de Ciudad Real (6,6%, n = 9), Islas Baleares (a partir de ahora, la región de Mallorca, 5,9%, n = 8), Zaragoza (5,9%, n = 8) y Toledo (5,1%, n = 7). El resto de las provincias representaron los 38 aislamientos restantes (27,9%) (Tabla 1; Figura 1). La información sobre el municipio exacto del que se originaron los aislados estaba disponible en 121 aislados (89%).
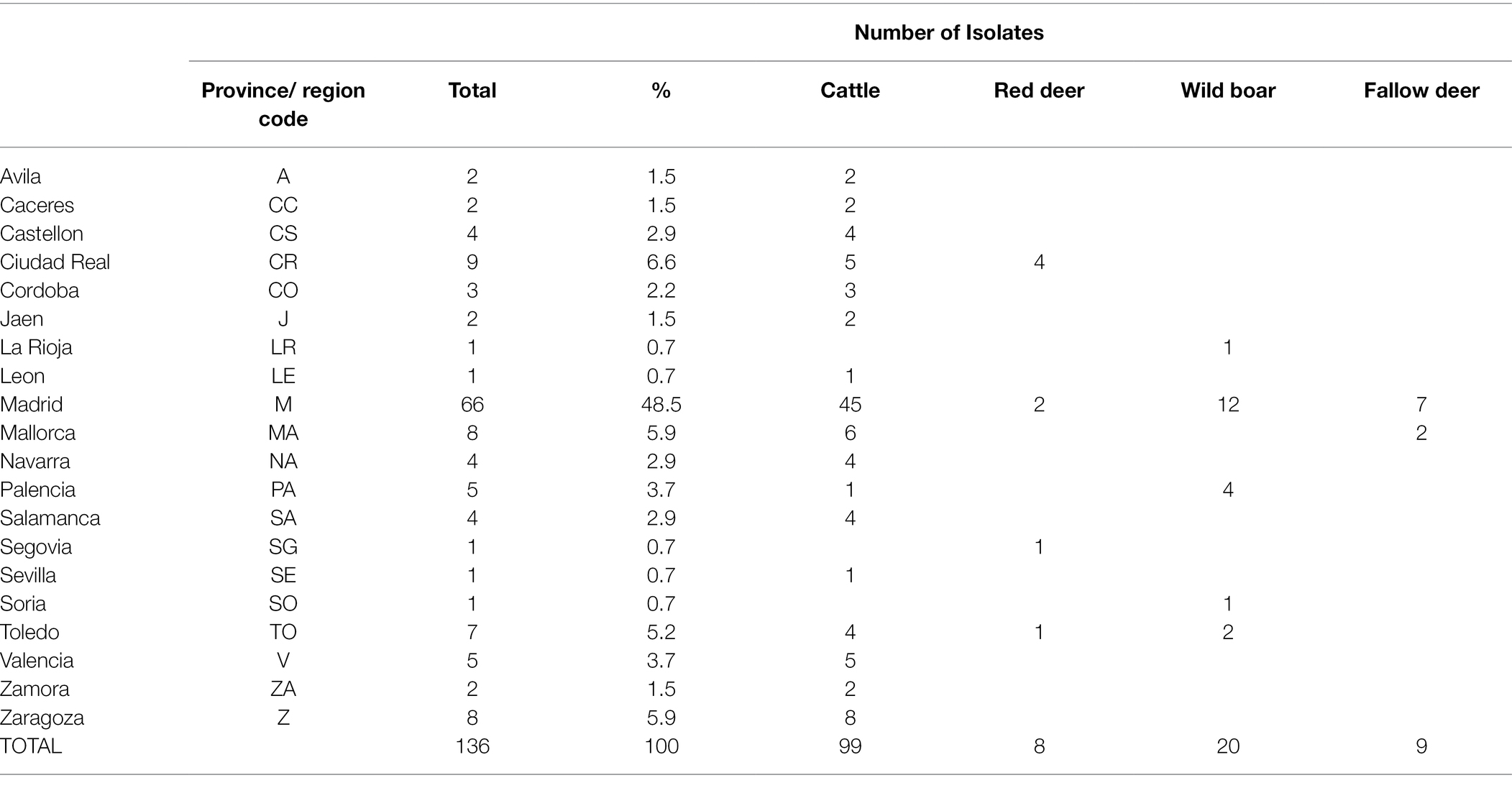 TABLA 1. Número de bovinos, ciervos rojos, jabalíes y gamos secuenciados aislados por provincia y en general incluidos en el estudio.
TABLA 1. Número de bovinos, ciervos rojos, jabalíes y gamos secuenciados aislados por provincia y en general incluidos en el estudio.
 FIGURA 1. Mapa del número de aislados de M. bovis SB0339 recuperados de ganado (A) y fauna SILVESTRE (B) por provincia incluida en el estudio.
FIGURA 1. Mapa del número de aislados de M. bovis SB0339 recuperados de ganado (A) y fauna SILVESTRE (B) por provincia incluida en el estudio.
El mayor número de cepas tanto bovinas (45,5%, n = 45/99) como de fauna silvestre (56,8%, n = 21/37) aisladas se recogieron en rebaños y fincas situadas en Madrid, donde el jabalí fue la principal especie silvestre muestreada (n = 12/21, Tabla 1; Figura 1). De los 7 municipios madrileños de los que se incluyeron aislamientos en el estudio (Colmenar Viejo, Madrid, El Boalo, Quijorna, Rascafría, San Agustín de Guadalix y San Sebastián de los Reyes), Colmenar Viejo y Madrid fueron los que registraron el mayor número de cepas (n = 26 y n = 13, respectivamente) y fauna silvestre (n = 8 en cada una) (Tabla Suplementaria S1).
Mycobacterium bovis Datos genómicos
La profundidad media de cobertura varió entre 20x y 174x excepto 7 aislados, con 85,3% (n = 116) de los aislados con valores ≥30x. La longitud media de lectura de los aislados osciló entre 186,5 y 239,4 (mediana = 229,7, IQR = 222,6–233,6). La mediana de la cobertura del genoma fue del 99,0% (IQR = 98,9–99,1). Los datos resumidos de alineación y los metadatos asociados de muestra de los 136 aislados sometidos a WGS se incluyen en la Tabla Suplementaria S1. No se detectó ninguna indicación de la presencia de aislados mixtos en la población secuenciada, ya que no se observaron muchas ocurrencias de posiciones mixtas recurrentes en todo el genoma en regiones con buenas puntuaciones de mapeo.
Análisis filogenético y estructura de agrupamiento
Se excluyeron ciento once SNP ya que se detectaron en regiones donde el mapeo era propenso a errores o estaba presente en áreas con una acumulación anómala de variantes. El análisis de los SNPs informativos mostró que entre los aislados de M. bovis españoles estudiados había un total de 1.345 SNPs, de los cuales 773 eran singletons (presentes en un solo aislado). La diversidad genética entre los aislados fue variable, con un número promedio de 62 SNP (rango = 49-88) desde que divergieron de su ancestro común más reciente (MRCA). Los aislados se subdividieron en dos grupos distantemente relacionados (A y B, Figura 2), con el más grande (A) subdividido en seis clados diferentes (A.1-A.3, A.4.1, A.4.2 y A.5) según BAPS y sobre la base de una distancia máxima dentro del clado de 57 SNP (Tabla Suplementaria S2; Figura 2; Cifras suplementarias S2, S3). Todos los aislados del grupo A se caracterizaron por la presencia de dos SNP adicionales (ausentes en el grupo B) e incluyeron el 96% (n = 95) del ganado bovino y el 97,3% (n = 36) aislados de fauna silvestre. El grupo B incluyó 5 aislados de los cuales uno fue recuperado de un jabalí y el resto de bovinos.
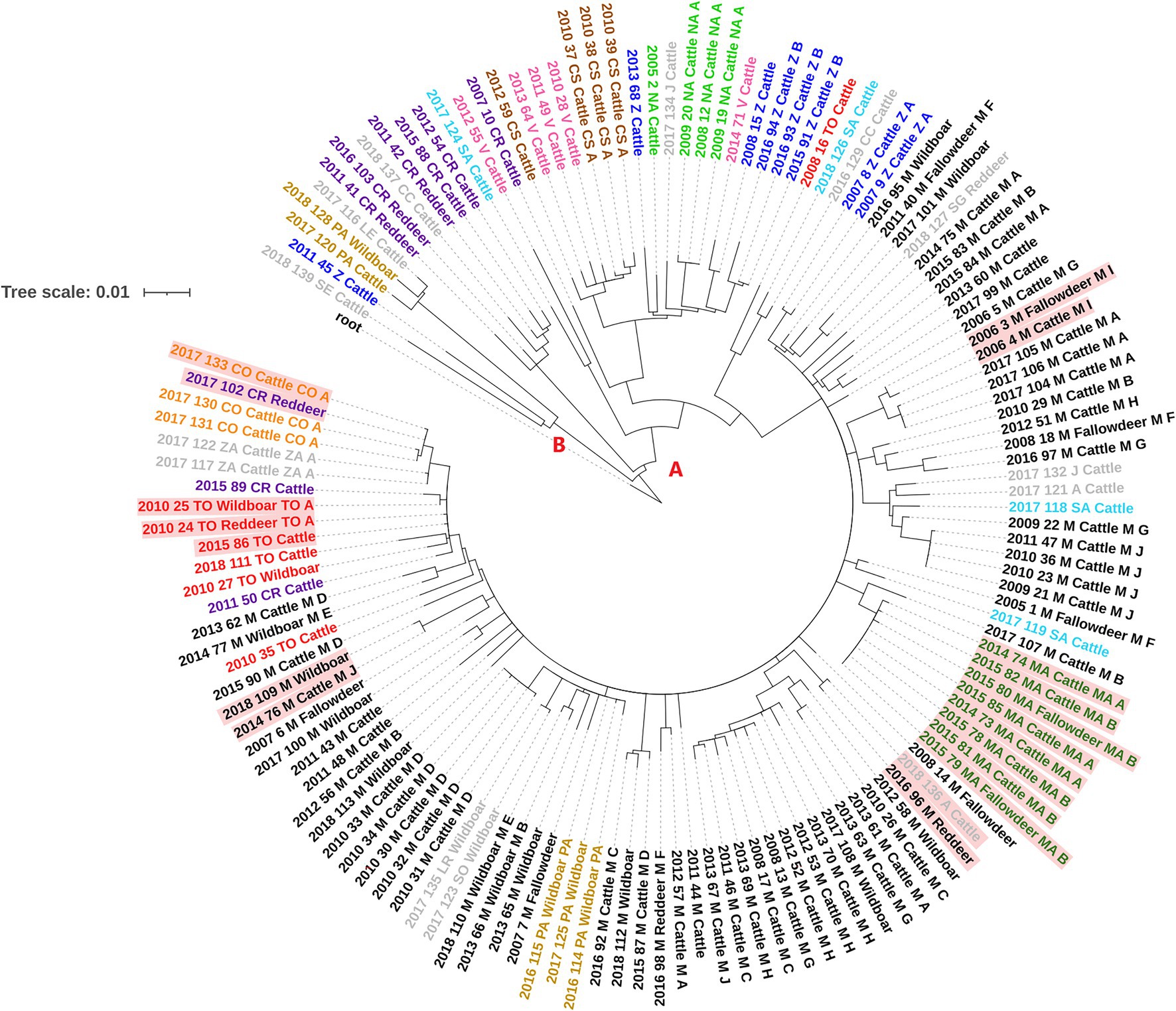 FIGURA 2. Árbol filogenético RAxML de secuencia de genoma completo construido utilizando un modelo GTR-CAT de 136 muestras españolas de M. bovis SB0339. Los dos grupos de aislados distantemente relacionados se indican con las letras A y B. Las etiquetas aisladas se colorean según la provincia de aislamiento cuyos códigos se muestran en la Tabla 1. Los aislados con distancias genéticas de ≤3 SNP entre el ganado y la vida silvestre están coloreados en fondo rojo.
FIGURA 2. Árbol filogenético RAxML de secuencia de genoma completo construido utilizando un modelo GTR-CAT de 136 muestras españolas de M. bovis SB0339. Los dos grupos de aislados distantemente relacionados se indican con las letras A y B. Las etiquetas aisladas se colorean según la provincia de aislamiento cuyos códigos se muestran en la Tabla 1. Los aislados con distancias genéticas de ≤3 SNP entre el ganado y la vida silvestre están coloreados en fondo rojo.
La distribución de clados por provincia se muestra en la figura suplementaria S4. El clado A.2 representó el mayor clado/número de aislados (74,3% del total) e incluyó todos los aislados bovinos y silvestres de Madrid (n = 66) y Mallorca (n = 8), junto con 27 aislados bovinos y de fauna silvestre de 12 provincias diferentes (Cuadro suplementario S2; Figura suplementaria S4). Los aislamientos en este clado se recuperaron durante todo el período de estudio (2005-2018) con un número medio de siete aislamientos por año (rango 1-21). El clado A.1 incluyó 3 cepos y 3 silvestres aislados recuperados entre 2011 y 2018 de provincias ubicadas en el centro y sur de España, mientras que los aislados en los clados A.3, A.4.1, A.4.2 y A.5 fueron exclusivamente de ganado vacuno y se cultivaron en 2007, 2008, 2016 y 2018 (clado A.3, n = 4), 2010-2012 (clado A.4.1, n = 7), 2005-2017 (clado A.4.2, n = 11) y 2012 y 2017 (clado A.5, n = 2). Se recuperaron aislados de los clados A.3, A.4.1 y A.4.2 de provincias que cubrían la franja central de oeste a este de España y dos regiones del norte, mientras que los dos aislados del clado A.5 procedían de provincias muy distantes (>600 km) (Figura suplementaria S4). Finalmente, los aislamientos del grupo B se recuperaron en 2011 (n = 1) y 2017-2018 (n = 4).
La distancia genética entre grupos (A versus B) osciló entre 115 y 163 SNP, mientras que las distancias genéticas dentro del grupo fueron mucho más bajas en el grupo A (mediana = 37 SNP, rango = 0-129) que en el grupo B (mediana = 96 SNP, rango = 12-108, Tabla suplementaria S2). La mediana de la distancia genética dentro del clado en el grupo A fue de 30 (rango = 21–57; Tabla suplementaria S2), mientras que la distancia genética mediana entre clados fue de 85 (rango = 35-114). Aunque los aislados en el grupo B eran genéticamente distantes (distancia media 96 SNP), dos aislados de bovinos y uno de jabalí estaban relativamente estrechamente relacionados (<16 SNP) y se recuperaron cerca en el tiempo (2017 y 2018).
Diversidad genética entre especies y dentro de ellas
La diversidad genética entre aislados de diferentes hospedadores se evaluó utilizando 90 aislados (53 de ganado vacuno -incluyendo solo uno por rebaño- y todos los aislados de vida silvestre: 20 de jabalí, 9 de gamo y 8 de ciervos rojos).
Se encontraron seis eventos de distancias genéticas cortas (≤3 SNPs) entre aislados de diferentes especies hospedadoras recuperadas cerca en el tiempo (dentro de 5 años, y dentro de <2 años en cinco de ellos) y espacio (dentro de la misma provincia o provincias vecinas). En concreto, estos eventos incluyeron: un aislamiento de ganado vacuno y un ciervo rojo recuperados en Ávila y Madrid, respectivamente, un aislado de ganado de Córdoba y una muestra de ciervo de Ciudad Real, un triplete formado por un bovino, un jabalí y un ciervo rojo M. bovis aislados de Toledo, dos muestras de M. bovis aisladas de ganado vacuno y gamo, recuperados en el mismo municipio de Madrid, un par de bovinos y jabalíes aislados recuperados de dos regiones lejanas de Madrid, y un grupo de bovinos de dos rebaños crónicamente infectados (rebaños MAA y MAB) y 2 gamos aislados recuperados en Mallorca (Figura 2).
En general, la mediana de divergencia genética dentro de los aislados de ganado en España (mediana = 80 SNP, IQR = 36-109), fue significativamente mayor (p < 0,001, Kruskal-Wallis) mayor que entre el ganado y la fauna silvestre (mediana = 66 SNP, IQR = 29-93), y dentro de los aislados de fauna silvestre (mediana = 29 SNP, IQR = 22-40). No se observaron cambios cuando se reevaluó la variabilidad del ganado dentro de la especie utilizando 10 selecciones aleatorias de aislados de los rebaños con múltiples aislamientos disponibles (cambio porcentual máximo 0.01%). Las distancias genéticas se correlacionaron de baja a moderada con las distancias geográficas (rho = 0,42, p < 0,001). Cuando se analizó la asociación entre distancias genéticas y geográficas considerando el huésped del que se originaron los aislados utilizando un modelo lineal, tanto el huésped como la interacción entre el huésped y la distancia geográfica fue significativa (Tabla Suplementaria S3): la distancia genética aumentó con el aumento de las distancias geográficas entre la ubicación de la que se originaron los dos aislados, pero este efecto fue menos pronunciado cuando se consideraron dos aislamientos de ganado en comparación con cuando dos animales silvestres Se seleccionaron aislados (y similares a cuando se consideraron parejas recuperadas tanto del ganado como de la vida silvestre; Figura 3). Se esperaba un aumento de 5 SNP en la diversidad genética dentro de los aislados de fauna silvestre por cada aumento de 100 km entre el origen de cada par de aislados, mientras que este número aumentó a 7 cuando ambos aislados se recuperaron del ganado (Tabla suplementaria S3; Figura 3). Los coeficientes y pendientes de los 10 modelos construidos sobre la base de las diferentes selecciones aleatorias de bovinos aislados de rebaños infectados crónicamente fueron similares (<10% de cambio), lo que sugiere que la selección aleatoria de aislados en rebaños de muestras intensivas no tuvo un impacto sustancial en la diversidad genética observada (Figura 3; Figura suplementaria S5; Cuadro suplementario S3).
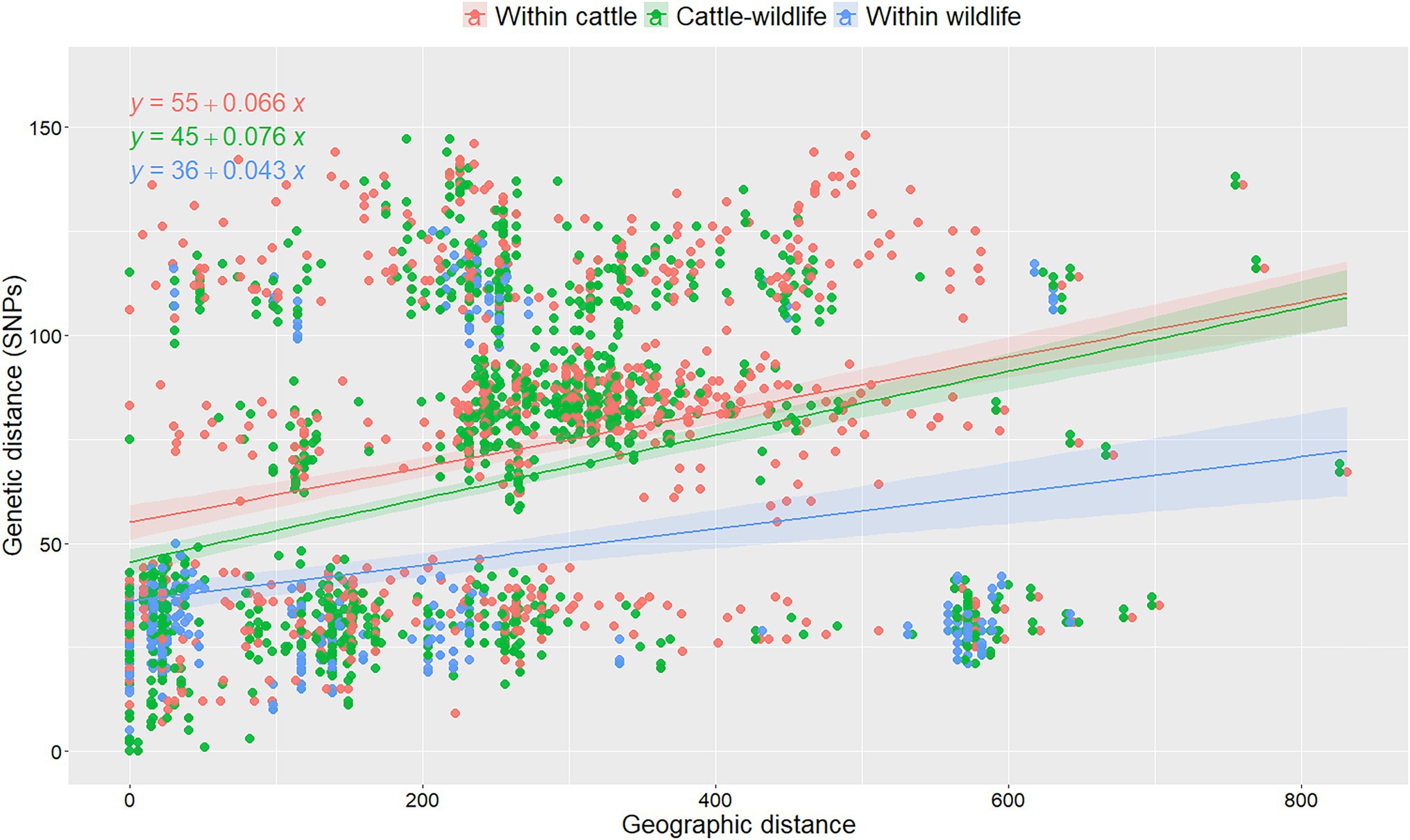 FIGURA 3. Análisis de distancias genéticas por pares entre aislados recuperados dentro y entre especies en función de sus distancias geográficas de aislamiento en una de las 10 réplicas basadas en la selección aleatoria de un aislado por rebaño infectado crónicamente. Se ajustaron líneas de regresión lineal para denotar la relación entre las distancias genéticas y geográficas por combinación de especies animales y se representaron fórmulas para cada categoría. Los colores denotan diferentes combinaciones de pares de aislados recuperados del ganado (rojo), vida silvestre (verde) y recolectados del ganado y la vida silvestre (azul). Las ecuaciones matemáticas se representaron para cada combinación de especies animales.
FIGURA 3. Análisis de distancias genéticas por pares entre aislados recuperados dentro y entre especies en función de sus distancias geográficas de aislamiento en una de las 10 réplicas basadas en la selección aleatoria de un aislado por rebaño infectado crónicamente. Se ajustaron líneas de regresión lineal para denotar la relación entre las distancias genéticas y geográficas por combinación de especies animales y se representaron fórmulas para cada categoría. Los colores denotan diferentes combinaciones de pares de aislados recuperados del ganado (rojo), vida silvestre (verde) y recolectados del ganado y la vida silvestre (azul). Las ecuaciones matemáticas se representaron para cada combinación de especies animales.
Por el contrario, cuando se realizó el mismo análisis en el subconjunto de aislados recuperados en Madrid, no se identificaron diferencias significativas (p > 0,05, prueba de Kruskal-Wallis) en las distancias encontradas entre aislados de la misma especie (mediana de distribución dentro del ganado = 30-32 SNP; mediana dentro de la fauna = 30 SNP) o diferentes especies (mediana del área de distribución ganado-fauna = 29-31 SNP). El modelo final incluyó solo la distancia geográfica entre aislados como covariable, ya que no se encontró ningún efecto significativo de la especie animal. Se observó un aumento de 13 SNPs por 100 km de distancia entre pares de aislados con base en los resultados de los 10 modelos de regresión lineal (Tabla Suplementaria S4). Los coeficientes de los modelos de regresión fueron más susceptibles a la variación en función de los aislados seleccionados aleatoriamente por rebaño (hasta un 20% de cambio, Tabla Suplementaria S4).
Diversidad genética dentro y entre rebaños
Entre las 99 secuencias de ganado, 61 se originaron en los mismos 15 rebaños y fueron seleccionadas para evaluar la diversidad dentro del rebaño (Tabla 2). La mediana del número de aislados procedentes de los 15 rebaños fue de 3 (IQR = 3–5) y se recuperaron en una mediana de 2 años diferentes (IQR = 1–4). Diez de estos rebaños se consideraron infectados crónicamente (aislados recuperados en >1 año), lo que produjo 48 aislamientos de ganado (mediana del número de aislados por rebaño infectado crónicamente = 5, rango = 3-8) recuperados a lo largo de una mediana de 4 años diferentes (IQR = 2-5). Los 5 rebaños restantes (n = 5) no infectados crónicamente representaron 2-3 muestras recuperadas en un solo año (Tabla 2).
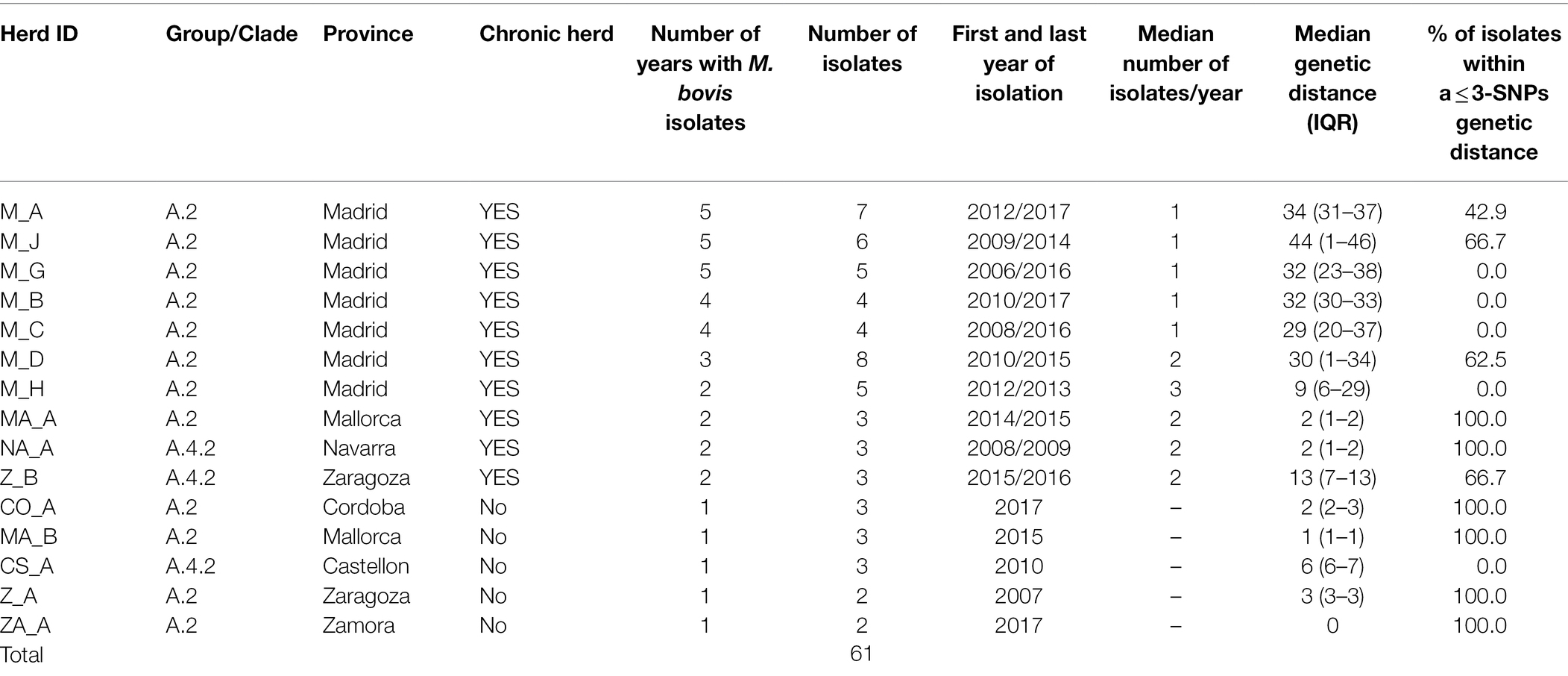 TABLA 2. Identificación del rebaño, provincia de origen, número de aislados, años entre el primer y el último aislamiento, mediana del número de aislados recuperados por año y % de aislamientos dentro de una distancia genética de ≤ 3-SNPs en rebaños incluidos en el análisis de la diversidad genética de Mycobacterium bovis dentro del rebaño.
TABLA 2. Identificación del rebaño, provincia de origen, número de aislados, años entre el primer y el último aislamiento, mediana del número de aislados recuperados por año y % de aislamientos dentro de una distancia genética de ≤ 3-SNPs en rebaños incluidos en el análisis de la diversidad genética de Mycobacterium bovis dentro del rebaño.
Los aislados de los análisis genéticos dentro del rebaño se incluyeron en tres clados del grupo A (A.2, A.4.1 y A.4.2). La mediana de las distancias genéticas dentro del rebaño entre los aislados de cada uno de los 15 rebaños osciló entre 0 y 44 SNP (mediana = 9). Se observó una mayor diversidad genética en los aislados recuperados de rebaños ubicados en Madrid (a saber, M_A-M_C, M_G y M_H), aunque los aislados de rebaños individuales tendían a agruparse (Figura suplementaria S6). Los aislados recuperados en CS_A de rebaño, recuperados dentro del mismo año, estaban en un rango de 5-7 SNP separados. La distancia genética entre los aislados recuperados de los 10 rebaños infectados crónicamente fue de 2 a 44 SNP (mediana = 30), mientras que la diversidad genética fue menor en los aislados de los 5 rebaños restantes que no estaban infectados crónicamente con tuberculosis bovina (mediana de la distancia genética dentro del rebaño = 2 SNP, rango = 0-6).
En cinco de los 10 rebaños infectados crónicamente, al menos el 60% de los aislados recuperados en un rango de 2 a 5 años diferentes estaban a una distancia de 3 SNP entre sí (Tabla 2). De hecho, hubo una alta correlación positiva entre las distancias genéticas medianas y el número de años diferentes a partir de los cuales los aislados se originaron en un rebaño (rho = 0.88, p < 0.001). Seis (M_A, M_C, M_D, M_H y M_J) de los siete rebaños con infección crónica ubicados en Madrid incluían aislados similares (es decir, ≤3 SNP), casi similares (es decir, 4 SNP para M_C y M_H) y diferentes (es decir, >20 SNP) recuperados cerca (mismo año) y distantes (hasta 10 años de diferencia) en el tiempo, respectivamente (Figura 4; Tabla 2). Sin embargo, dos de estos rebaños (M_D y M_H) produjeron aislados separados por distancias genéticas que oscilaron entre 29 y 37 SNP que se recuperaron en el mismo mes (Figura 4). Este patrón de distribución bimodal de las distancias genéticas por pares dentro del rebaño no fue evidente en el resto del rebaño crónico de Madrid y en los rebaños crónicos ubicados en otras regiones (a saber, M_B, MA_A, NA_A y Z_B, Figura 4). Además, se identificó un evento de posible persistencia o reintroducción de cepas similares en M_G de rebaño, como lo demuestran las cepas estrechamente relacionadas (6 SNP) en el rebaño encontradas con 5 años de diferencia (Figura 4).
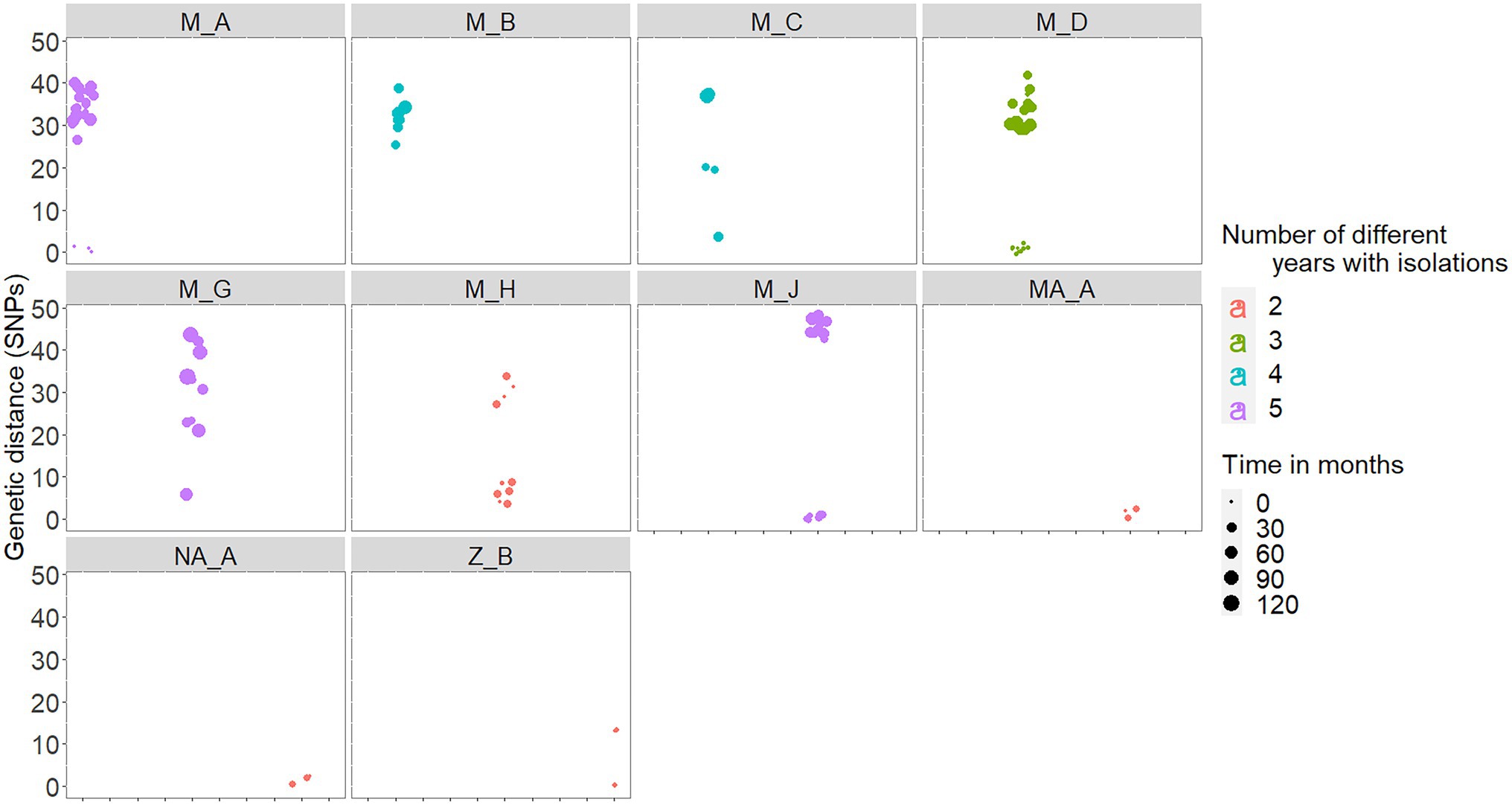 FIGURA 4. Distancias genéticas por pares dentro del rebaño entre aislados recuperados en los 10 rebaños infectados crónicamente. Las distancias genéticas se colorean en función del número de años diferentes con aislados de M. bovis (entre 2 y 5 años diferentes), y el tamaño representa el número de meses transcurridos entre cada par de aislados.
FIGURA 4. Distancias genéticas por pares dentro del rebaño entre aislados recuperados en los 10 rebaños infectados crónicamente. Las distancias genéticas se colorean en función del número de años diferentes con aislados de M. bovis (entre 2 y 5 años diferentes), y el tamaño representa el número de meses transcurridos entre cada par de aislados.
Discusión
En este estudio, la información de WGS de un gran panel de aislados de M. bovis recuperados de varias especies animales y regiones en España se utilizó para comprender el potencial de transmisión entre especies y dentro de ellas y para dilucidar el papel de la vida silvestre en la transmisión de la tuberculosis bovina. Este es el primer estudio genómico a gran escala que describe la diversidad de M. bovis en la interfaz ganadería-fauna de múltiples provincias / regiones de España y destaca el papel relevante que la genómica y los enfoques filogenéticos pueden tener para obtener conocimientos sobre la epidemiología de la tuberculosis bovina.
Se seleccionaron los aislados SB0339 porque este fue el tercer espotipo más frecuente en España, y el que se recuperó con mayor frecuencia tanto en las poblaciones de ganado como en las de fauna silvestre. Se ha aislado recurrentemente principalmente de las regiones centro-sur y norte del país, con evidencia de transmisión interespecie (García-Jiménez et al., 2013). Aunque también se han encontrado repetidamente otros esoligotipos en la interfaz ganado-fauna (por ejemplo, SB0121 y SB0134), más de un tercio de todos los aislados SB0339 proceden de jabalíes, ciervos rojos y gamos (mayor proporción de aislados de fauna silvestre para un determinado spoligotipo en España; mycoDB.es). Además, SB0339 representa el patrón molecular aislado con mayor frecuencia en Madrid, incluyendo el >50% de todas las muestras de M. bovis recuperadas en la región (mycoDB.es).
La proporción más alta (72,8%) de aislamientos incluidos en este estudio se recuperaron del ganado, mientras que 37 aislados SB0339 se recuperaron de diferentes especies de vida silvestre. Más de la mitad de ellos (n = 20) fueron recuperados de jabalíes, que se considera el principal huésped de mantenimiento en la Iberia mediterránea (Muñoz-Mendoza et al., 2013; Gortazar et al., 2015). Los aislados incluidos en el estudio se muestrearon en diferentes momentos (datos heterócronos) entre 2005 y 2018. Este amplio intervalo de tiempo se seleccionó dada la pequeña tasa de mutación de M. bovis [mediana estimada entre 0,15 y 0,5 eventos por genoma por año (Biek et al., 2012; Trewby et al., 2016; Crispell et al., 2017)], lo que hace necesario comparar aislados recuperados a lo largo de largos períodos al intentar reconstruir las relaciones filogenéticas entre ellos. Del total de muestras secuenciadas, el 84,6% (n = 115) se recuperaron después de 2009, ya que el ADN viable y de alta calidad fue difícil de recuperar de las muestras (especialmente la vida silvestre) recuperadas durante el período 2005-2009. Antes de 2005 no se disponía de aislados en el Centro VISAVET.
Los datos de todo el genoma de los 136 aislados de TBB revelaron una gran cantidad de SNP adquiridos dentro de los grupos A y B, con aislados de 47-72 y 38-61 SNP aparte de su MRCA, respectivamente (datos no mostrados). Además, se pudieron distinguir siete clados distintos entre la colección secuenciada, de los cuales tres contenían secuencias de M. bovis derivadas de la vida silvestre y del ganado. Estos resultados pueden no solo sugerir una larga historia de endemicidad, sino también que la infección por M. bovis se ha transmitido entre el ganado y las poblaciones de fauna silvestre en España durante mucho tiempo. De hecho, se esperaba un alto grado de diversidad genética en los aislados SB0339, dado que representa el 8% de todos los aislados de M. bovis tipificados en España, y ha estado circulando en varias áreas de España durante largos períodos de tiempo (Rodriguez-Campos et al., 2010; Gortazar y Boadella, 2014).
Las distancias genéticas por pares entre los aislados en el clado principal A.2 fueron las más bajas de todos los clados, a pesar de que incluyó el mayor número de secuencias (74,3% de toda la colección) e incluyó aislados de ganado y vida silvestre recuperados durante un largo período de tiempo. La similitud entre las cepas en este clado recuperadas de diferentes especies huésped sugiere eventos de transmisión recientes y / o transmisión de una fuente común (no muestreada). La evidencia de transmisión de M. bovis entre el ganado y la vida silvestre se ha reportado en numerosos estudios en todo el mundo, especialmente en áreas donde coexisten varias especies susceptibles. Un estudio que incluyó un total de 27 spoligotipos diferentes realizado en Cataluña, una región ubicada en el noreste de España, reveló la transmisión entre diferentes huéspedes (Perea et al., 2021). La investigación realizada en el Reino Unido mostró que los aislados de tejón estaban en un rango de 0 a 4 SNP aparte del aislado de ganado más cercano, y que la transmisión ocurría con mayor frecuencia de tejones a ganado que viceversa (Biek et al., 2012; Crispell et al., 2019). Utilizando un enfoque bayesiano, un estudio reciente realizado en Francia reveló una alta tasa de transmisión entre especies entre el ganado y las poblaciones de tejones (Duault et al., 2022). Además, también se sugirió una alta tasa de intercambio genético entre el ganado muestreado y las poblaciones de vida silvestre en Nueva Zelanda (Crispell et al., 2017).
En general, el tiempo y el origen geográfico de los aislados fueron buenos predictores de distancias genéticas, independientemente de la especie huésped de origen del aislado. La heterogeneidad genética fue geográfica más que específica de la especie huésped, ya que los aislados recuperados de diferentes especies animales dentro de las mismas provincias tendían a estar más estrechamente relacionados que los originarios de la misma especie y diferentes provincias. Sin embargo, a pesar del potencial de transmisión entre especies sugerido por los hallazgos de nuestro estudio, la agrupación general de aislados por especie huésped señaló que las cepas de M. bovis recuperadas de huéspedes silvestres eran menos diversas que las provenientes del ganado, y que las distancias genéticas estaban asociadas con la provincia de origen (Figura 2; Cuadro suplementario S2). Esto fue particularmente evidente en el caso de las muestras de jabalí, con aislados recuperados de la misma provincia o de provincias vecinas que estaban a pocos SNP de distancia entre sí. De hecho, estudios previos realizados en Cataluña sugirieron que la proximidad y el vecindario eran los dos factores de riesgo más importantes asociados con la heterogeneidad genética observada (Perea et al., 2021). En nuestro estudio, se observó una heterogeneidad sustancialmente mayor en las distancias genéticas por pares entre los aislamientos de ganado en España en comparación con los aislados de fauna silvestre y las parejas de ganado y fauna silvestre, lo que podría deberse a la transmisión de un mayor grupo de cepas SB0339 en el reservorio de ganado que no llegan a la fauna silvestre (Figura 3; Cuadro suplementario S3). En cambio, en el análisis de cepas de Madrid la diversidad genética de aislados recuperados de ganado vacuno y de fauna silvestre fue más similar. Aunque en un estudio previo se identificó una homogeneidad genética sustancial a nivel de spoligo-VNTR entre los bovinos aislados de Madrid (de la Cruz et al., 2014), los análisis de todo el genoma realizados aquí revelaron un alto grado general de heterogeneidad genética independientemente de la especie huésped de origen, lo que sugiere una larga historia de circulación endémica SB0339 de múltiples fuentes en Madrid (Tabla complementaria S4 ). Sin embargo, no hubo información disponible sobre los perfiles VNTR para este estudio, ya que la tipificación VNTR ya no se realiza de forma rutinaria en nuestro laboratorio. Aunque se identificó una relación significativa entre la distancia genética y geográfica de M. bovis en la región, la falta de asociación de la especie huésped con la distancia genética que separa dos aislados recuperados de Madrid también puede sugerir la evolución de cepas en huéspedes no muestreados no considerados aquí (que podrían incluir poblaciones de ganado sin vínculo de transmisión con la vida silvestre, cuadro suplementario S4; Price-Carter et al., 2018). Por el contrario, si solo se consideraran en el análisis las provincias con una gran proporción de aislamientos de ganado y fauna bovina (es decir, Madrid, Ciudad Real y Toledo), los resultados obtenidos fueron los mismos que los del análisis general de España (datos no mostrados). Este análisis confirmó que, incluso después de realizar una comparación más similar de la diversidad genética en regiones con un mayor número de aislamientos de fauna silvestre, Madrid es representativa de un escenario de transmisión SB0339 enrevesado e interespecífico. Además, la diversidad genética global de los aislados incluidos en el clado A.2 (Figuras Complementarias S2, S4) reveló resultados similares a los de Madrid, ya que no hubo diferencias significativas en las distancias se encontraron entre aislados de la misma especie (rango medio dentro del ganado = 31-32 SNP; mediana dentro de la vida silvestre = 27 SNP) o diferentes especies (rango medio ganado-vida silvestre = 28-29 SNP) (datos no mostrados). La gran heterogeneidad (rango 55-163 SNPs) identificada cuando se comparó el clado A.2 con los clados restantes identificados en regiones distintas de Madrid (Tabla Suplementaria S2) coincide con la hipótesis de larga historia de endemicidad de este espolocotipo establecida en este estudio. Sin embargo, las relaciones filogenéticas descritas en este estudio pueden ser particularmente sensibles al sesgo de selección en la población muestreada de Madrid frente a los aislados secuenciados globales recuperados en múltiples provincias de España, y las diferencias en el efecto observado explicado aquí deben interpretarse con precaución. A pesar de la asociación observada entre distancias genéticas y geográficas, en varios casos se recuperaron aislados genéticamente no relacionados (es decir, muy distintos) de lugares cercanos (y en algunos casos incluso del mismo rebaño), lo que sugiere que la infección podría haber ocurrido en un lugar diferente, particularmente en el ganado, ya que la mayoría (>81%) de los aislados de vida silvestre se recuperaron de animales en estados de caza cercados y, por lo tanto, se esperaba un movimiento limitado de animales. Desafortunadamente, los movimientos individuales de todo el ganado muestreado no estaban disponibles para este estudio y, por lo tanto, no se pudo confirmar la hipótesis de nuevas introducciones debido al movimiento de animales infectados.
Además, tres de los seis grupos de cepas muy similares (≤3 SNPs) recuperadas de ganado y fauna silvestre se encontraron en Madrid (Figura 2; Figura suplementaria S2). De hecho, el patrón SB0339 se ha encontrado recurrentemente en ciertas áreas, especialmente en el Parque Natural Monte de El Pardo ubicado en el municipio de Madrid y en Colmenar Viejo, donde factores de riesgo como rebaños manejados extensivamente y abundante presencia de reservorios de vida silvestre pueden explicar la similitud genética entre especies observada y que la prevalencia de tuberculosis bovina se ha mantenido históricamente alta tanto en el ganado como en la vida silvestre (Aranaz et al., 2004; Rodríguez-Campos et al., 2010).
Los análisis de la diversidad genética dentro del rebaño en rebaños aislados de rebaños infectados crónicamente tenían como objetivo proporcionar alguna información sobre el grado de diferencia esperado a lo largo del tiempo en un rebaño dado, lo que podría ayudar a diferenciar la fuente de un brote (es decir, recaída vs. reinfección; Hatherell et al., 2016). Aquí se utilizó un umbral de ≤ 3 SNP para definir grupos de transmisión en los que estamos seguros de que cepas similares están circulando en diferentes huéspedes. Este valor fue inferior al seleccionado en el estudio realizado en Cataluña, donde se consideró una distancia por pares de ≤12 SNPs para definir supuestos clusters de transmisión basados en los patrones de clustering observados (Perea et al., 2021). En nuestro estudio, los aislados con SNP ≤3 se consideraron estrechamente relacionados porque la mayoría de los aislados vinculados epidemiológicamente recuperados del mismo rebaño y muestreados dentro del mismo año no excedieron este nivel de divergencia. Cuando se aplicó un umbral de 10-SNPs de ≤ en nuestros análisis, 2 rebaños adicionales (a saber, CS_A y M_H) de los 15 rebaños analizados tenían >50% de las cepas muestreadas dentro de este límite circulando durante el período muestreado (Figura 4). El uso de diferentes umbrales puede afectar las inferencias sugeridas aquí (es decir, recaída vs. nuevas introducciones). Sin embargo, nuestro objetivo aquí era identificar grupos de patrones moleculares que probablemente hayan surgido de vínculos epidemiológicos en lugar de la adquisición de SNP derivados del proceso de evolución. Además, seleccionamos este punto de corte severo ya que coincidía con el derivado de la revisión extensa de la literatura del MTBC para identificar con precisión eventos de transmisión reciente, recaída y reinfecciones (Kato-Maeda et al., 2013; Roetzer et al., 2013; Lee et al., 2015). En general, identificamos una fuerte relación de tiempo y origen espacial y variabilidad genética, de modo que esos factores fueron altamente informativos para caracterizar la circulación como aislados tendentes a agruparse en un patrón dentro del rebaño. Las distancias genéticas observadas tanto entre los rebaños como dentro de ellos fueron muy heterogéneas dependiendo de la historia epidemiológica (número de años con aislamientos de tuberculosis bovina en el rebaño), ya que las distancias genéticas medianas por pares observadas en los 10 rebaños muestreados crónicamente variaron en gran medida (rango 2-44 SNP) en comparación con aquellos que no estaban infectados crónicamente con tuberculosis bovina (rango 0-6 SNP). Esto se esperaba ya que los rebaños no infectados crónicamente fueron muestreados durante un período de 1 año frente a un número medio de 3.5 años diferentes con aislamientos en rebaños infectados crónicamente. Sin embargo, en la mitad de los rebaños infectados crónicamente, la mayoría de los aislados recuperados durante varios años estaban separados por ≤ 3-SNP. La limitada diversidad genética dentro del rebaño encontrada recurrentemente en varios rebaños muestreados, en muchas ocasiones a pesar del considerable tiempo transcurrido entre sus aislamientos, sugiere que los animales infectados crónicamente en el rebaño (que se habrían pasado por alto en las pruebas de rebaño de tuberculosis bovina) pueden haber contribuido a la persistencia de la enfermedad (Guta et al., 2014a). Además, la agrupación genética de cepas procedentes de los mismos rebaños (y las mismas provincias) indicó que M. bovis circulaba continuamente en los rebaños muestreados (sin introducciones de nuevas cepas). Alternativamente, la persistencia de cepas muy similares también puede sugerir reintroducciones de otras fuentes, como rebaños vecinos, persistencia ambiental o huéspedes alternativos como se sugiere en otros lugares (Biek et al., 2012).
La diversidad genética observada en los aislados de M. bovis analizados en SB0339 no fue aparentemente causada por recientes introducciones exógenas en España. En cambio, las distancias genéticas observadas sugirieron una infección endémica automantenida dentro de diferentes especies animales en cada región, con ciertos eventos de transmisión entre especies, lo que fue particularmente evidente en el caso de Madrid. A pesar del pequeño tamaño de la muestra incluida en este estudio, este cuadro está de acuerdo con los hallazgos de estudios previos en España y en otros lugares sobre el efecto potencial de los factores de riesgo locales (es decir, proximidad espacial, manejo extensivo en rebaños de carne, contacto con otras fuentes de infección) en áreas endémicas de tuberculosis bovina (Green et al., 2008; Biek et al., 2012; Pozo et al., 2020). Además, nuestros resultados están de acuerdo con un estudio previo realizado en Portugal, donde la diversidad genética observada apoyó la circulación natural de M. bovis durante mucho tiempo con múltiples interacciones de diferentes especies huésped (Reis et al., 2021). La interacción con los reservorios de fauna silvestre se identificó como la segunda causa más importante de descomposición del rebaño en España, después de la infección residual (Guta et al., 2014a). De hecho, los aislados de M. bovis recuperados de especies silvestres en el Parque Nacional de Doñana eran, de hecho, más prevalentes en el ganado, contribuyendo así a la persistencia de la tuberculosis bovina (Romero et al., 2008). El ganado vacuno y los tejones encontrados en el norte de España en la misma área geográfica y durante el mismo período compartieron espotipos similares, lo que sugiere una dinámica común de infección (Balseiro et al., 2013). A fin de cuentas, la mayor diversidad de huéspedes identificada en la epidemiología de la tuberculosis bovina en España conduce a cadenas de transmisión mayores y más diversas (Barasona et al., 2019). También se identificaron vínculos epidemiológicos entre diferentes huéspedes que involucran a las mismas especies analizadas aquí (es decir, jabalí y ciervo colorado) en países vecinos como Portugal (Cunha et al., 2012; Reis et al., 2020) y Francia (Hauer et al., 2015; Michelet et al., 2019), aunque se identificaron diferentes patrones moleculares. Los resultados obtenidos aquí son importantes teniendo en cuenta el grado relativamente alto de persistencia que existe en varias regiones de España, como las partes central y suroeste del país.
El muestreo de diferentes especies hospedadoras realizado aquí coincidió con unidades temporales (años) y espaciales (provincia de origen) similares. Sin embargo, debido a la fuerte dependencia de la disponibilidad de aislados en la colección de cepas VISAVET y al grado moderado de éxito (~60%) en el recultivo de aislados, los sesgos incluidos en este estudio fueron inevitables.
El potencial de los análisis derivados de WGS puede verse comprometido cuando una población huésped mal muestreada contribuye a la transmisión, que en este caso podrían ser los reservorios de vida silvestre. Además, el muestreo de la población huésped a menudo se limita a las investigaciones de brotes en las que el muestreo se reduce a los rebaños afectados y la inclusión de otras fuentes, como granjas cercanas o reservorios de vida silvestre, enfrenta limitaciones financieras, éticas o logísticas. Más de la mitad de los aislados de fauna silvestre incluidos aquí (n = 20) se originaron a partir de muestras recogidas de jabalíes, principalmente de Madrid, y la mayoría (n = 15/17) de los aislados de ciervo rojo y gamo M. bovis también se muestrearon en las regiones centrales del país. En contraste, otras provincias estaban claramente subrepresentadas en nuestra colección: el centro de España fue muestreado más intensamente en comparación con las regiones del sur, donde la tuberculosis bovina es altamente prevalente tanto en el ganado como en la vida silvestre (Ministerio de Agricultura, Pesca, Alimentación y Medio Ambiente, 2020; Ministerio de Agricultura, Pesca y Alimentación, 2021). El esfuerzo de muestreo diferencial entre regiones puede haber afectado la solidez de nuestros hallazgos, particularmente con respecto a la vida silvestre, al considerar todo el país. Por lo tanto, nuestros hallazgos no deben extrapolarse a otras áreas a menos que estudios adicionales confirmen el grado de diversidad dentro y entre las especies que se encuentran aquí. Sin embargo, los aislados pertenecientes al spoligotipo SB0339 proceden mayoritariamente de Madrid, que fue la región más intensamente muestreada y en la que se logró un mejor equilibrio ganadería-fauna silvestre (49% del total de aislados, relación ganado:fauna silvestreMADRID 2:1 Vs. ganado:vida silvestreEN GENERAL 3:1). En cuanto al ganado vacuno, en todas las provincias incluidas durante el período de estudio se dispuso de estrategias similares de prueba y sacrificio basadas en pruebas anuales utilizando la prueba intradérmica única de tuberculina intradérmica y, por lo tanto, se dispuso de una representación razonable de bovinos positivos para tuberculosis bovina infectados con SB0339 que circulaban en España. Aunque el control y la vigilancia de la tuberculosis bovina en la fauna silvestre no están tan estandarizados como en el ganado y había menos aislados de fauna silvestre disponibles para el análisis, una alta fracción de los aislados de fauna silvestre se recuperaron de Madrid (con una alta prevalencia de tuberculosis bovina y densidad de vida silvestre), lo que sugiere que los resultados observados aquí pueden ser una aproximación justa del escenario real de SB0339 no solo en el ganado, pero también en fauna silvestre (Ministerio de Agricultura, Pesca, Alimentación y Medio Ambiente, 2020; Ministerio de Agricultura, Pesca y Alimentación, 2021).
Además, entre las 136 muestras, había 7 aislados con baja (<20x) profundidad de cobertura, con regiones de ADN de poca o nula cobertura que conducen a la identificación de SNP poco confiables. Asimismo, el porcentaje del genoma de referencia cubierto por estas secuencias fue inferior al 99%, lo que para organismos clonales como M. bovis, implica la necesidad de una cantidad significativa de corrección. Aunque los resultados obtenidos en estas muestras de baja cobertura deben considerarse con precaución, no se esperaba un sesgo importante debido a llamadas erróneas de SNP. Estas llamadas ambiguas ocurrieron en SNPs no informativos (SNPs compartidos por todos los aislados incluidos en el estudio que no fueron relevantes para definir el patrón de agrupamiento aquí presentado). Las llamadas erróneas se verificaron meticulosamente con IGV, y los SNP confiables se corrigieron manualmente como lo sugiere la documentación de vSNP (Orloski et al., 2018) y se realizaron en varios estudios (Orloski et al., 2018; Salvador et al., 2019; Perea y otros, 2021; Reis et al., 2021). En caso de que las llamadas erróneas cayeran en áreas con baja cobertura o problemas de mapeo, estas se filtraron manualmente.
Los métodos de genotipado de alto rendimiento como WGS han creado oportunidades sin precedentes para estudiar la red de transmisión de microorganismos como M. bovis y permiten rastrear las fuentes de infección, lo que puede complementar otras medidas incluidas en el programa de erradicación de la tuberculosis bovina en España. Dada la creciente rentabilidad de las técnicas de caracterización basadas en WGS, creemos que la tipificación basada en WGS eventualmente se convertirá en el estándar para los estudios epidemiológicos moleculares de TB bovina, como también ha sido la tendencia con otros patógenos (por ejemplo, patógenos transmitidos por los alimentos). Este estudio confirmó que M. bovis probablemente se mantiene en poblaciones de múltiples huéspedes en lugar de un solo huésped en áreas de alta pero también baja prevalencia (por ejemplo, Mallorca), y que la contribución relativa de los reservorios de vida silvestre al mantenimiento de la tuberculosis bovina en algunas regiones puede ser baja en comparación con el centro y suroeste de España. Si bien las técnicas tradicionales de tipificación han demostrado que los patrones moleculares de M. bovis se mantienen dentro de grupos espaciales bien definidos, su poder para discriminar aún más las cepas dentro de los grupos, lo que podría ayudar a explicar la persistencia y la transmisión, es limitado (Trewby et al., 2016). En este sentido, WGS resulta una herramienta valiosa para mejorar la comprensión de la epidemiología de la tuberculosis bovina, incluso para patógenos de evolución lenta y conservados genéticamente como M. bovis (Garnier et al., 2003). Aquí, WGS se utilizó para describir la heterogeneidad genética en un spoligotipo altamente predominante en un intento de evaluar el potencial de transmisión entre especies independientemente de la dirección, ya que los árboles filogenéticos presentados aquí no son equivalentes a los árboles de transmisión. La combinación de datos de secuencia de M. bovis y modelos matemáticos que consideran la estructura temporal inherente a muestras heterócronas seleccionadas puede aumentar el poder estadístico para inferir procesos evolutivos de M. bovis, como se realizó en investigaciones anteriores (Glaser et al., 2016; Crispell et al., 2017, 2019; Salvador et al., 2019). La inclusión de un reloj molecular en los análisis realizados aquí y la adición de una selección equilibrada de muestras entre el ganado y la fauna silvestre serán objeto de los siguientes análisis. En última instancia, la adición de la escala temporal en el análisis de las heterogeneidades genéticas entre aislados puede ayudar a cuantificar el papel de los reservorios de fauna y el ganado en la dinámica de la infección por M. bovis en España.
Declaración de disponibilidad de datos
Los conjuntos de datos generados y analizados para este estudio se pueden encontrar en el Archivo de Lectura de Secuencia de Información del Centro Nacional de Biotecnología (NCBI-SRA) y se puede acceder a ellos bajo el número de BioProyecto PRJNA804719.
Declaración ética
No se requirió revisión ética y aprobación para el estudio con animales porque todas las muestras se recogieron como parte de la vigilancia reglamentaria autorizada en el marco del Programa Nacional de Erradicación de la Tuberculosis Bovina de España. No se obtuvo el consentimiento informado por escrito para la participación de los propietarios porque no se requirió la aprobación de los propietarios de locales para este estudio.
Contribuciones del autor
PP y JA diseñaron el estudio, escribieron el manuscrito y recibieron comentarios sustanciales de todos los autores. PP y VL-L realizaron los cultivos bacteriológicos de muestras y extracción de ADN. PP analizó los datos con la ayuda de JA, VL-L, SR-A, JH, TS, BR, JB y LJ. JLS proporcionó asesoramiento sobre la interpretación de los datos. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Colaboradores de la Red Española de Vigilancia del Seguimiento de la Tuberculosis Animal
Los miembros de la Red Española de Vigilancia y Seguimiento de la Tuberculosis Animal que participaron en este estudio incluyen el Ministerio de Agricultura, Pesca y Alimentación junto con Laboratorios Centrales y Regionales; Laboratorio Central de Sanidad Animal de Santa Fe, Granada; Laboratorio Regional de Sanidad Animal, Junta de Castilla y León; Instituto de Biología Animal Balears; Instituto de Investigaciones en Recursos Cinegéticos (IREC), Ciudad Real; Laboratorio Regional Agroalimentario y Ambiental de Castilla-La Mancha (LARAGA); Conselleria de Agricultura, Pesca y Alimentación, Unidad de Análisis de Sanidad Animal, Generalitat Valenciana; Departamento de Agricultura, Ganadería y Alimentación, Gobierno de Navarra; y Servicio de Ganadería y Protección Animal, Subdirección General de Higiene y Seguridad Alimentaria, Comunidad de Madrid.
Financiación
Esta investigación fue una contribución al proyecto Estrategias Integradas para el Control y Erradicación de la Tuberculosis en España (ERATUB; RTI2018-096010-B-C22, Ministerio de Ciencia, Innovación y Universidades). El Ministerio de Agricultura, Pesca y Alimentación y el Área de Ganadería de la Comunidad de Madrid apoyaron esta publicación. JA recibió un contrato Ramón y Cajal del MINECO (RYC-2016-20422).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Reconocimientos
Queremos agradecer a Francisco Lozano y Alexandra Gutiérrez por su apoyo durante los análisis de laboratorio; el Ministerio de Agricultura, Pesca y Alimentación, la Comunidad de Madrid, el Laboratorio Central de Sanidad Animal (LCSA, Santa Fe-Granada); y a la Junta de Castilla y León por aportar las muestras incluidas en el estudio.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fmicb.2022.915843/full#supplementary-material
Notas
Referencias
Allen, A. R., Skuce, R. A. y Byrne, A. W. (2018). Tuberculosis bovina en Gran Bretaña e Irlanda – ¿Una tormenta perfecta? La confluencia de posibles impedimentos ecológicos y epidemiológicos para controlar una enfermedad infecciosa crónica. Frente. Vet. Sci. 5:109. doi: 10.3389/fvets.2018.00109
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Aranaz, A., De Juan, L., Montero, N., Sánchez, C., Galka, M., Delso, C., et al. (2004). Tuberculosis bovina (Mycobacterium bovis) en fauna silvestre en España. J. Clin. Microbiol. 42, 2602–2608. doi: 10.1128/JCM.42.6.2602-2608.2004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Balseiro, A., Gonzalez-Quiros, P., Rodriguez, O., Francisca Copano, M., Merediz, I., de Juan, L., et al. (2013). Relaciones espaciales entre tejones euroasiáticos (Meles meles) y ganado infectado por Mycobacterium bovis en el norte de España. Veterinario J. 197, 739–745. doi: 10.1016/j.tvjl.2013.03.017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Barasona, J. A., Gortazar, C., de la Fuente, J. y Vicente, J. (2019). La riqueza del huésped aumenta el riesgo de enfermedad tuberculosa en áreas administradas por el juego. Microorganismos 7:60182. doi: 10.3390/microorganismos7060182
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Biek, R., O’Hare, A., Wright, D., Mallon, T., McCormick, C., Orton, R. J., et al. (2012). La secuenciación del genoma completo revela patrones de transmisión local de Mycobacterium bovis en poblaciones simpátricas de ganado vacuno y tejón. PLoS Pathog. 8:E1003008. doi: 10.1371/journal.ppat.1003008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Bivand, R., Keitt, T., y Rowlingson, B.. (2013). rgdal: Bindings for the ‘Geospatial’ Data Abstraction Library. Versión del paquete de R 1.4-8.
Cheng, L., Connor, T. R., Sirén, J., Aanensen, D. M. y Corander, J. (2013). Agrupación jerárquica y espacialmente explícita de secuencias de ADN con software BAPS. Mol. Biol. Evol. 30, 1224–1228. doi: 10.1093/molbev/mst028
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cole, S. T., Brosch, R., Parkhill, J., Garnier, T., Churcher, C., Harris, D., et al. (1998). Descifrando la biología de Mycobacterium tuberculosis a partir de la secuencia completa del genoma. Nature 393, 537–544. doi: 10.1038/31159
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Comas, I., Homolka, S., Niemann, S. y Gagneux, S. (2009). Genotipado de bacterias genéticamente monomórficas: secuenciación de ADN en Mycobacterium tuberculosis destaca las limitaciones de las metodologías actuales. PLoS One 4:e7815. doi: 10.1371/journal.pone.0007815
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Primos, D. V. (2001). Infección y control por Mycobacterium bovis en ganado doméstico. Rev. Sci. Tech. 20, 71–85. doi: 10.20506/rst.20.1.1263
Cousins, D. V., Wilton, S. D., y Francis, B. R. (1991). Uso de la amplificación del ADN para la identificación rápida de Mycobacterium bovis. Veterinario Microbiol. 27, 187–195. doi: 10.1016/0378-1135(91)90010-D
Crispell, J., Benton, C. H., Balaz, D., De Maio, N., Ahkmetova, A., Allen, A., et al. (2019). Combinar genómica y epidemiología para analizar la transmisión bidireccional de Mycobacterium bovis en un sistema multihuésped. elife 8:45833. doi: 10.7554/eLife.45833
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Crispell, J., Zadoks, R. N., Harris, S. R., Paterson, B., Collins, D. M., de-Lisle, G. W., et al. (2017). Uso de la secuenciación del genoma completo para investigar la transmisión en un sistema de múltiples huéspedes: tuberculosis bovina en Nueva Zelanda. BMC Genomics 18:180. DOI: 10.1186/S12864-017-3569-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cunha, M. V., Matos, F., Canto, A., Albuquerque, T., Alberto, J. R., Aranha, J. M., et al. (2012). Implicaciones y desafíos de la tuberculosis en ungulados de fauna silvestre en Portugal: una perspectiva de epidemiología molecular. Res. Vet. 92, 225–235. doi: 10.1016/j.rvsc.2011.03.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
de la Cruz, M. L., Pérez, A., Bezos, J., Pages, E., Casal, C., Carpintero, J., et al. (2014). Dinámica espacial de la tuberculosis bovina en la Comunidad Autónoma de Madrid, España (2010-2012). PLoS One 9:e115632. doi: 10.1371/journal.pone.0115632
Resumen de PubMed | Texto completo de CrossRef | Google Académico
de la Rua-Domenech, R., Goodchild, A. T., Vordermeier, H. M., Hewinson, R. G., Christiansen, K. H. y Clifton-Hadley, R. S. (2006). Diagnóstico ante mortem de tuberculosis en bovinos: revisión de las pruebas de tuberculina, ensayo de interferón gamma y otras técnicas diagnósticas auxiliares. Res. Vet. 81, 190–210. doi: 10.1016/j.rvsc.2005.11.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Duault, H., Michelet, L., Boschiroli, M.-L., Durand, B. y Canini, L. (2022). Un modelo evolutivo bayesiano hacia la comprensión de la contribución de la vida silvestre a la transmisión de Mycobacterium bovis de la familia F4 en el suroeste de Francia. Vet. 53:28. doi: 10.1186/s13567-022-01044-x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Comisión Técnica de Salud y Bienestar Animal de la EFSA (AHAW) (2014). Declaración sobre un marco conceptual para la tuberculosis bovina. EFSA J. 12:59. doi: 10.2903/j.efsa.2014.3711
García-Jiménez, W. L., Fernández-Llario, P., Benítez-Medina, J. M., Cerrato, R., Cuesta, J., García-Sánchez, A., et al. (2013). Reducción de la densidad poblacional de jabalí euroasiático (Sus scrofa) como medida para el control de la tuberculosis bovina: efectos en jabalíes y una población simpátrica de gamo (Dama dama) en el centro de España. Prev. Vet. Med. 110, 435–446. doi: 10.1016/j.prevetmed.2013.02.017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Garnett, B. T., Delahay, R. J. y Roper, T. J. (2002). Uso de recursos ganaderos por tejones (Meles meles) y riesgo de transmisión de tuberculosis bovina (Mycobacterium bovis) al ganado. Proc. Biol. Sci. 269, 1487–1491. DOI: 10.1098/RSPB.2002.2072
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Garnier, T., Eiglmeier, K., Camus, J.-C., Medina, N., Mansoor, H., Pryor, M., et al. (2003). La secuencia completa del genoma de Mycobacterium bovis. Proc. Natl. Acad. Sci. U. S. A. 100, 7877–7882. DOI: 10.1073/PNAS.1130426100
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Garrison, E., y Marth, G.. (2012). Detección de variantes basada en haplotipos a partir de secuenciación de lectura corta. arXiv. [Epub antes de imprimir]. doi: 10.48550/arXiv.1207.3907
Ghebremariam, M. K., Rutten, V. P., Vernooij, J. C., Uqbazghi, K., Tesfaalem, T., Butsuamlak, T., et al. (2016). Prevalencia y factores de riesgo de tuberculosis bovina en ganado lechero en Eritrea. BMC Vet. 12:80. doi: 10.1186/s12917-016-0705-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Glaser, L., Carstensen, M., Shaw, S., Robbe-Austerman, S., Wunschmann, A., Grear, D., et al. (2016). Epidemiología descriptiva y análisis de secuenciación del genoma completo para un brote de tuberculosis bovina en ganado vacuno y venado de cola blanca en el noroeste de Minnesota. PLoS One 11:e0145735. doi: 10.1371/journal.pone.0145735
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Goodchild, A. V., y Clifton-Hadley, R. S. (2001). Transmisión de Mycobacterium bovis de ganado a ganado. Tuberculosis 81, 23–41. doi: 10.1054/tube.2000.0256
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Gortazar, C. y Boadella, M. (2014). «Tuberculosis animal en España», en Tuberculosis Zoonótica Mycobacterium bovis y Otras Micobacterias Patógenas. eds. C. O. Thoen, J. H. Steele y J. B. Kaneene (Estados Unidos: John Wiley & Sons).
Gortazar, C., Che Amat, A. y O’Brien, D. J. (2015). Preguntas abiertas y avances recientes en el control de una enfermedad infecciosa multihuésped: la tuberculosis animal. Mammal Rev. 45, 160–175. doi: 10.1111/mam.12042
Gortazar, C., Torres, M. J., Vicente, J., Acevedo, P., Reglero, M., de la Fuente, J., et al. (2008). Tuberculosis bovina en la reserva de la biosfera de Doñana: el papel de los ungulados silvestres como reservorios de enfermedades en los últimos reductos del lince ibérico. PLoS One 3:e2776. doi: 10.1371/journal.pone.0002776
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Green, D. M., Kiss, I. Z., Mitchell, A. P. y Kao, R. R. (2008). Estimaciones de la transmisión local y basada en el movimiento de la tuberculosis bovina en el ganado vacuno británico. Proc. Biol. Sci. 275, 1001–1005. DOI: 10.1098/RSPB.2007.1601
Guta, S., Casal, J., Garcia-Saenz, A., Saez, J. L., Pacios, A., Garcia, P., et al. (2014b). Persistencia de factores de riesgo de tuberculosis bovina en rebaños de vacuno del sur y centro de España. Prev. Vet. Med. 115, 173–180. doi: 10.1016/j.prevetmed.2014.04.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Guta, S., Casal, J., Napp, S., Saez, J. L., Garcia-Saenz, A., Perez de Val, B., et al. (2014a). Investigación epidemiológica de los desgloses de rebaños de tuberculosis bovina en España 2009/2011. PLoS One 9:e104383. doi: 10.1371/journal.pone.0104383
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Hatherell, H. A., Colijn, C., Stagg, H. R., Jackson, C., Winter, J. R. y Abubakar, I. (2016). Interpretación de la secuenciación del genoma completo para investigar la transmisión de la tuberculosis: una revisión sistemática. BMC Med. 14:21. doi: 10.1186/s12916-016-0566-x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Hauer, A., De Cruz, K., Cochard, T., Godreuil, S., Karoui, C., Henault, S., et al. (2015). Evolución genética de Mycobacterium bovis causante de tuberculosis en ganado y fauna silvestre en Francia desde 1978. PLoS One 10:e0117103. doi: 10.1371/journal.pone.0117103
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Informe Final Técnico Tuberculosis Bovina Año (2020). Ministerio de Agricultura, Pesca y Alimentación; 2021 Disponible en: https://www.mapa.gob.es/es/ganaderia/temas/sanidad-animal-higiene-ganadera/annexiiinformefinaltecnicotb2020_tcm30-564497.pdf (consultado el 12 de septiembre de 2021).
Joshi, D., Harris, N. B., Waters, R., Thacker, T., Mathema, B., Krieswirth, B., et al. (2012). Los polimorfismos de nucleótido único en el genoma de Mycobacterium bovis resuelven las relaciones filogenéticas. J. Clin. Microbiol. 50, 3853–3861. doi: 10.1128/JCM.01499-12
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Kamerbeek, J., Schouls, L., Kolk, A., van Agterveld, M., van Soolingen, D., Kuijper, S., et al. (1997). Detección simultánea y diferenciación de cepas de Mycobacterium tuberculosis para diagnóstico y epidemiología. J. Clin. Microbiol. 35, 907–914. DOI: 10.1128/JCM.35.4.907-914.1997
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Karolemeas, K., McKinley, T. J., Clifton-Hadley, R. S., Goodchild, A. V., Mitchell, A., Johnston, W. T., et al. (2011). Recurrencia de las crisis de tuberculosis bovina en Gran Bretaña: factores de riesgo y predicción. Prev. Vet. Med. 102, 22–29. doi: 10.1016/j.prevetmed.2011.06.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Kato-Maeda, M., Ho, C., Passarelli, B., Banaei, N., Grinsdale, J., Flores, L., et al. (2013). Uso de la secuenciación del genoma completo para determinar la microevolución de Mycobacterium tuberculosis durante un brote. PLoS One 8:e58235. doi: 10.1371/journal.pone.0058235
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Lee, R. S., Radomski, N., Proulx, J. F., Manry, J., McIntosh, F., Desjardins, F., et al. (2015). Reaparición y amplificación de la tuberculosis en el ártico canadiense. J. Infectar. Dis. 211, 1905–1914. doi: 10.1093/infdis/jiv011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Li, H., y Durbin, R. (2009). Alineación rápida y precisa de lectura corta con la transformada de madrigueras-Wheeler. Bioinformática 25, 1754-1760. DOI: 10.1093/bioinformatics/btp324
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Malone, K. M., Farrell, D., Stuber, T. P., Schubert, O. T., Aebersold, R., Robbe-Austerman, S., et al. (2017). Actualización de la secuencia del genoma de referencia y anotación de Mycobacterium bovis AF2122/97. Genoma Announc. 5, E00157–E00117. doi: 10.1128/genomeA.00157-17
Michelet, L., Conde, C., Branger, M., Cochard, T., Biet, F. y Boschiroli, M. L. (2019). Red de transmisión de la infección por Mycobacterium bovis transmitida por ciervos revelada por un enfoque WGS. Microorganismos 7:687. doi: 10.3390/microorganismos7120687
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ministerio de Agricultura, Pesca y Alimentación (2021). Dirección General De Sanidad de la Producción Agraria: Ministerio de Agricultura, Pesca y Alimentación. Disponible en: https://www.mapa.gob.es/es/ganaderia/temas/sanidad-animal-higiene-ganadera/programatb2021versionabril_tcm30-561045.pdf (consultado el 12 de septiembre de 2021).
Ministerio de Agricultura, Pesca, Alimentación y Medio Ambiente (2020). Plan de Actuación sobre TUBerculosis en Especies Silvestres (PATUBES). Disponible en: https://www.mapa.gob.es/es/ganaderia/temas/sanidad-animal-higiene-ganadera/patubes2017_3_tcm30-378321.pdf (consultado el 5 de agosto de 2021).
More, S. J., Radunz, B. y Glanville, R. J. (2015). Lecciones aprendidas durante la erradicación exitosa de la tuberculosis bovina de Australia. Rec. 177, 224–232. DOI: 10.1136/VR.103163
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Muñoz-Mendoza, M., Marreros, N., Boadella, M., Gortazar, C., Menéndez, S., de Juan, L., et al. (2013). Tuberculosis del jabalí en la España atlántica ibérica: una imagen diferente de los hábitats mediterráneos. BMC Vet. 9:176. doi: 10.1186/1746-6148-9-176
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Naranjo, V., Gortazar, C., Vicente, J. y de la Fuente, J. (2008). Evidencia del papel del jabalí europeo como reservorio del complejo Mycobacterium tuberculosis. Veterinario Microbiol. 127, 1–9. doi: 10.1016/j.vetmic.2007.10.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
O’Brien, D. J., Schmitt, S. M., Fitzgerald, S. D., Berry, D. E. y Hickling, G. J. (2006). Manejo del reservorio de vida silvestre de Mycobacterium bovis: La experiencia de Michigan, EE. UU. Veterinario Microbiol. 112, 313–323. doi: 10.1016/j.vetmic.2005.11.014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Orloski, K., Robbe-Austerman, S., Stuber, T., Hench, B. y Schoenbaum, M. (2018). Secuenciación del genoma completo de Mycobacterium bovis aislado de ganado en los Estados Unidos, 1989-2018. Frente. Vet. Sci. 5:253. doi: 10.3389/fvets.2018.00253
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Paradis, E., Claude, J. y Strimmer, K. (2004). APE: análisis de filogenética y evolución en lenguaje R. Bioinformática 20, 289–290. DOI: 10.1093/bioinformatics/btg412
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Perea, C., Ciaravino, G., Stuber, T., Thacker, T. C., Robbe-Austerman, S., Allepuz, A., et al. (2021). El análisis de SNP del genoma completo identifica grupos putativos de transmisión de Mycobacterium bovis en ganado y fauna silvestre en Cataluña, España. Microorganismos. 9:1629. doi: 10.3390/microorganismos9081629
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Perez-Lago, L., Navarro, Y. y Garcia-de-Viedma, D. (2014). Conocimiento actual y desafíos pendientes en zoonosis causadas por Mycobacterium bovis: una revisión. Res. Vet. 97, S94–S100. doi: 10.1016/j.rvsc.2013.11.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Pohlert, T. (2020). PMCMRplus: Calcular comparaciones múltiples por pares de sumas medias de rango. Versión del paquete R 1.4.4.
Pozo, P., Romero, B., Bezos, J., Grau, A., Nacar, J., Saez, J. L., et al. (2020). Evaluación de los factores de riesgo asociados a los rebaños con una mayor duración de las averías de tuberculosis bovina en Castilla y León, España (2010-2017). Frente. Vet. Sci. 7:545328. doi: 10.3389/fvets.2020.545328
Price-Carter, M., Brauning, R., de Lisle, G. W., Livingstone, P., Neill, M., Sinclair, J., et al. (2018). Secuenciación del genoma completo para determinar la fuente de infecciones por Mycobacterium bovis en rebaños de ganado y vida silvestre en Nueva Zelanda. Front Vet Sci. 5:272. DOI: 10.3389/FVETS.2018.00272
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Equipo central de R (2019). R: Un lenguaje y entorno para la computación estadística. Viena, Austria: R Foundation for Statistical Computing.
Reis, A. C., Salvador, L. C. M., Robbe-Austerman, S., Tenreiro, R., Botelho, A., Albuquerque, T., et al. (2021). La secuenciación del genoma completo refina el conocimiento sobre la estructura poblacional de Mycobacterium bovis a partir de un sistema de tuberculosis de múltiples huéspedes. Microorganismos. 9:1585. doi: 10.3390/microorganismos9081585
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Reis, A. C., Tenreiro, R., Albuquerque, T., Botelho, A. y Cunha, M. V. (2020). La vigilancia molecular a largo plazo proporciona pistas sobre el origen bovino de Mycobacterium bovis en Portugal. 10:20856. DOI: 10.1038/S41598-020-77713-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Reviriego Gordejo, F. J., y Vermeersch, J. P. (2006). Hacia la erradicación de la tuberculosis bovina en la Unión Europea. Veterinario Microbiol. 112, 101–109. doi: 10.1016/j.vetmic.2005.11.034
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Robinson, J. T., Thorvaldsdóttir, H., Winckler, W., Guttman, M., Lander, E. S., Getz, G., et al. (2011). Visor de genómica integrativa. Nat. Biotechnol. 29, 24–26. DOI: 10.1038/NBT.1754
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Rodriguez-Campos, S., Gonzalez, S., de Juan, L., Romero, B., Bezos, J., Casal, C., et al. (2012). Una base de datos de tuberculosis animal (mycoDB.Es) en el contexto del programa nacional español de erradicación de la tuberculosis bovina. Infecta. Jineta. Evol. 12, 877–882. doi: 10.1016/j.meegid.2011.10.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Rodriguez-Campos, S., Romero, B., Bezos, J., de Juan, L., Alvarez, J., Castellanos, E., et al. (2010). Alta diversidad de espotipos dentro de una población de Mycobacterium bovis: pistas para comprender la demografía del patógeno en Europa. Veterinario Microbiol. 141, 89–95. doi: 10.1016/j.vetmic.2009.08.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Roetzer, A., Diel, R., Kohl, T. A., Ruckert, C., Nubel, U., Blom, J., et al. (2013). Secuenciación del genoma completo versus genotipado tradicional para la investigación de un brote de Mycobacterium tuberculosis: un estudio epidemiológico molecular longitudinal. PLoS Med. 10:E1001387. doi: 10.1371/journal.pmed.1001387
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Romero, B., Aranaz, A., Sandoval, A., Alvarez, J., de Juan, L., Bezos, J., et al. (2008). Persistencia y evolución molecular de la población de Mycobacterium bovis de ganado vacuno y fauna silvestre en el Parque Nacional de Doñana revelada por variación de genotipo. Veterinario Microbiol. 132, 87–95. doi: 10.1016/j.vetmic.2008.04.032
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Salvador, L. C. M., O’Brien, D. J., Cosgrove, M. K., Stuber, T. P., Schooley, A. M., Crispell, J., et al. (2019). Manejo de enfermedades en la interfaz fauna-ganado: uso de la secuenciación del genoma completo para estudiar el papel del alce en la transmisión de Mycobacterium bovis en Michigan, EE. Mol. 28, 2192–2205. DOI: 10.1111/mec.15061
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Stamatakis, A. (2014). RAxML versión 8: una herramienta para el análisis filogenético y post-análisis de filogenias grandes. Bioinformática 30, 1312-1313. doi: 10.1093/bioinformática/btu033
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Tonkin-Hill, G., Lees, J. A., Bentley, S. D., Frost, S. D. W. y Corander, J. (2018). RhierBAPS: Una implementación de R del algoritmo de agrupación de poblaciones hierBAPS. Bienvenidos Open Res. 3:93. doi: 10.12688/wellcomeopenres.14694.1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Trewby, H., Wright, D., Breadon, E. L., Lycett, S. J., Mallon, T. R., McCormick, C., et al. (2016). Uso de la secuenciación bacteriana del genoma completo para investigar la persistencia local y la propagación en la tuberculosis bovina. Epidemias 14, 26–35. doi: 10.1016/j.epidem.2015.08.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Wickham, H. (2009). ggplot2: Gráficos elegantes para el análisis de datos. Springer-Verlag Nueva York.
Wickham, H., François, R., Henry, L. y Müller, K.. (2019). Versión del paquete R 0.4.3. R Found. Stat. Comput., Viena. Disponible en: https://CRAN.R-project.org/package=dplyr (consultado el 12 de septiembre de 2021).
Cita: Pozo P, Lorente-Leal V, Robbe-Austerman S, Hicks J, Stuber T, Bezos J, de Juan L, Saez JL, Romero B y Alvarez J (2022) Uso de la secuenciación del genoma completo para desentrañar la diversidad genética de un espotipo prevalente de Mycobacterium bovis en un escenario de múltiples huéspedes en España. Frente. Microbiol. 13:915843. doi: 10.3389/fmicb.2022.915843
Recibido: 08 Abril 2022; Aprobado: 30 de mayo de 2022;
Publicado: 11 julio 2022.
Editado por:
Caterina Guzmán-Verri, Universidad Nacional de Costa Rica, Costa Rica
Revisado por:
Lorraine Michelet, Agence Nationale de Sécurité Sanitaire de l’Alimentation, de l’Environnement et du Travail (ANSES), Francia
Maria Vitale, Instituto Zooprofiláctico Experimental de Sicilia (IZSSi), Italia
Amandine Hauer, Universidad de Gdansk, Polonia
Flabio R. Araujo, Corporación Brasileña de Investigación Agropecuaria (EMBRAPA), Brasil
Copyright © 2022 Pozo, Lorente-Leal, Robbe-Austerman, Hicks, Stuber, Bezos, de Juan, Saez, Romero y Alvarez. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Pilar Pozo, ppozo@ucm.es
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

