Uso de la videoelectroencefalografía como examen de primera línea en neurología veterinaria
Uso de la videoelectroencefalografía como examen de primera línea en neurología veterinaria: desarrollo y estandarización de la electroencefalografía en perros y gatos sin sedar
 Elsa Lyon1,2,3*
Elsa Lyon1,2,3*  Hervé Pochat3
Hervé Pochat3  Stéphane Blot4
Stéphane Blot4  Thibaut Troupel4,5
Thibaut Troupel4,5  Nicolas Van Caenegem4,6
Nicolas Van Caenegem4,6  Stéphane Besnard1†
Stéphane Besnard1†  Catherine Escriou2†
Catherine Escriou2†- 1Laboratorio Vertex, Departamento STAPS de la UFR, UniCaen, Caen, Francia
- 2Servicio de Medicina Interna de Pequeños Animales, Servicio de Neurología, VetAgro Sup, Marcy l’Etoile, Francia
- 3Amset Medical, Saint-Maur-des-Fossés, Francia
- 4U955-IMRB, INSERM, Departamento de Medicina Interna de Pequeños Animales, Servicio de Neurología, Ecole Nationale Vétérinaire d’Alfort, Maisons-Alfort, Francia
- 5Servicio de Neurología, AniCura CHV Pommery, Reims, Francia
- 6Servicio de Neurología, AniCura TRIOVet, Rennes, Francia
Objetivo: Evaluar la viabilidad y validar el uso de la videoelectroencefalografía (EEG) en perros y gatos conscientes y proponer pautas de EEG de rutina en la práctica clínica veterinaria.
Diseño: Estudio clínico prospectivo.
Datos: Se llevaron a cabo ciento cincuenta registros de EEG para validar el valor añadido clínico, la reproducibilidad y las directrices en 140 animales propios. Se realizaron 111 electroencefalogramas en perros y 49 en gatos.
Procedimientos: Se compararon los registros realizados con 8 electrodos de Ag/AgCl de perno sin alambre de EEG sostenidos por correas elásticas y 8 electrodos de Ag de copa con alambre de EEG sostenidos por un auricular fabricado a medida combinado con un dispositivo de video-EEG con cable. La colocación de los electrodos se determinó de acuerdo con los protocolos de EEG en animales publicados previamente. Se agregaron sensores fisiológicos, como electrocardiografía, electromiografía y sensores respiratorios. Se probaron protocolos de estimulación. Se evaluó la calidad y la interpretabilidad.
Resultados: Los auriculares y los procedimientos de grabación parecían adecuados para todas las formas y tamaños de cráneo. Los registros de video-EEG se realizaron con éxito sin tranquilización ni anestesia, excepto en 9 animales. La mediana del tiempo de registro del EEG fue de 40 min. La impedancia se mantuvo por debajo de 20 kΩ en el 99% de los EEG de perros y en el 98% de los EEG de gatos. Se reportó isosincronía en el 6% de los canales. El setenta y cinco por ciento de los EEG de perros y el 83% de los EEG de gatos fueron legibles durante más del 50% (al 100%) de su duración. La discriminación exitosa de los estados de vigilancia a partir del análisis del ritmo (vigilia, somnolencia y somnolencia) fue posible en el 99% de los EEG de perros y en el 91% de los EEG de gatos. Las respuestas de conducción fótica durante las estimulaciones fóticas se observaron en el 11% de los EEG de perros y en el 85% de los EEG de gatos. Los registros electroencefalográficos fueron directamente informativos en el 32% de los exámenes: en el 25% las anomalías del EEG se asociaron con signos clínicos y en el 7% se referían a anomalías del EEG sin síntomas clínicos durante el registro. El trece por ciento de los perros sometidos a estimulación fótica exhibieron anomalías epilépticas. Entre los 9 EEG con otras estimulaciones basadas en la historia, tres mostraron grafoelementos epilépticos.
Conclusiones: Hemos desarrollado un procedimiento estandarizado de video-EEG no anestesiado de fácil realización y reproducible en perros y gatos. Se evaluaron criterios técnicos y médicos cualitativos y cuantitativos que estuvieron de acuerdo con las recomendaciones del EEG humano. Además, hemos demostrado su relevancia y precisión para fines diagnósticos, proporcionando más argumentos para el uso del EEG como prueba de exploración funcional neurológica de primera línea.
1 Introducción
En medicina humana, la electroencefalografía (EEG) y el video-EEG se implementan de forma amplia y rutinaria en varios campos, como la neurología, los cuidados intensivos (para la evaluación del coma), la neuropediatría, la gerontología y la medicina de urgencias. En particular, el EEG se utiliza en epileptología, y su uso permite una clasificación más fina de las epilepsias, que va más allá de la determinación de los tipos de convulsiones y las categorías de epilepsia para incluir la caracterización electroclínica y la descripción de los síndromes epilépticos (1). Los procedimientos de registro del EEG se han estandarizado a partir de recomendaciones internacionales y nacionales, cubriendo aspectos como el número y la colocación de los electrodos, la duración del examen, los parámetros y ajustes de registro, la elección de los protocolos de estimulación y el análisis de vídeo para el diagnóstico de las convulsiones de acuerdo con el contexto médico (2-6).
En neurología veterinaria, el EEG se utiliza de forma confidencial, mientras que la epilepsia es uno de los trastornos neurológicos más comunes en perros (7, 8) con una prevalencia estimada que oscila entre el 0,6 y el 0,75% (8, 9). Sin embargo, la prevalencia de esta enfermedad es significativamente mayor en razas específicas, con prevalencias reportadas de 3.1-33% (10-16) con presentación clínica variable y gravedad de la enfermedad (10). Las convulsiones también son comunes en los gatos y pueden representar el 2% de los motivos de las visitas al veterinario (17), con convulsiones recurrentes que representan una prevalencia estimada del 0,16% (18). Sin embargo, la epilepsia felina sigue estando mal caracterizada y la epilepsia de causa desconocida se reporta en el 22% de los gatos con convulsiones (19).
Las clasificaciones actuales de las convulsiones y la epilepsia en perros y gatos solo se basan en la semiología de las convulsiones y la etiología de la epilepsia, respectivamente (20). La epilepsia incluye la epilepsia idiopática con antecedentes genéticos comprobados o sospechados o de causa desconocida y sin indicación de epilepsia estructural y epilepsia estructural, causada por una patología cerebral identificada (20). La dificultad para realizar fácilmente el EEG en la práctica veterinaria es probablemente el principal factor que subyace a la diferencia entre la clasificación de la epilepsia humana y la de los animales de compañía. El desarrollo del EEG veterinario podría mejorar significativamente el diagnóstico, la clasificación y el tratamiento de la epilepsia de los animales de compañía (21). Recientemente, ha habido un renovado interés en la medicina veterinaria, con la publicación de protocolos que proporcionan información sobre la posición de los electrodos en el cráneo (22-25), los tipos de electrodos sugeridos (23), los protocolos anestésicos (22, 26, 27), la viabilidad del registro en animales sin anestesia mediante video-EEG (24) y la interpretación (28). Una encuesta sobre las prácticas de EEG de los neurólogos veterinarios (29) revela la variabilidad en los protocolos empleados con respecto al uso de video, la duración de las grabaciones y la evaluación de la calidad de la grabación a través de mediciones de impedancia. Esta encuesta muestra específicamente una preferencia por los electrodos subcutáneos, cableados o de aguja sobre los electrodos de superficie. Los métodos de colocación pueden adherirse a los protocolos publicados (22, 24, 30, 30-34) o a los enfoques individuales que a menudo implican diferentes protocolos de sedación. Además, la encuesta destaca que los neurólogos veterinarios no utilizan el EEG de forma rutinaria, ya que algunos lo realizan menos de una vez al año. Los desafíos citados incluyen el acceso limitado a equipos de EEG y la insuficiente capacitación y experiencia en la realización e interpretación de EEG.
Nuestro objetivo fue desarrollar un método y estándares para los exámenes de EEG de rutina en medicina veterinaria similares a los utilizados en pacientes humanos en condiciones no sedadas. Esto implicó el uso de electrodos de copa o tapas de electrodos y sesiones de grabación que duraron de 20 a 30 minutos durante la visita médica, como se menciona en las recomendaciones (3-6). A partir de una cohorte de 230 perros y gatos, en diversos contextos fisiológicos y patológicos, seleccionamos y probamos electrodos y posiciones, desarrollamos y validamos un método de registro en condiciones de vigilia, sin dolor, restricción y aprendizaje, lo que condujo a recomendaciones y mejores prácticas para las investigaciones rutinarias de EEG en medicina veterinaria. En este artículo, presentamos la sección metodológica completa y su validación, incluido el procedimiento detallado, la evaluación de la calidad del registro, las discriminaciones de artefactos y las ilustraciones que muestran patrones de EEG fisiológicos y patológicos.
2 Materiales y métodos
El Comité de Ética de VetAgro Sup (Nº 18) emitió un dictamen favorable (Nº 1966) sobre el protocolo experimental el 28 de noviembre de 2019.
2.1 Procedimientos generales
Se realizaron registros electroencefalográficos en gatos y perros presentados en la unidad de neurología del campus veterinario de VetAgro Sup y École nationale vétérinaire d’Alfort (ENVA). Los animales incluidos fueron traídos por sus dueños para consultas médicas u hospitalizados por un corto período debido a trastornos cerebrales. Los animales inconscientes (es decir, animales en coma y estado epiléptico) fueron excluidos de este estudio. Se recogieron los antecedentes, los signos clínicos y los resultados de las investigaciones diagnósticas. En este estudio se evitó intencionadamente el uso de criterios restrictivos para demostrar la reproducibilidad del método para perros y gatos en diversos contextos médicos y para evitar el sesgo de selección.
Las grabaciones se realizaron después de la consulta, ya sea de inmediato o con cita previa en los días siguientes. Fueron realizados por uno de los autores (EL) en presencia de al menos el acompañante del animal (propietario o clínico), excepto en dos exámenes en los que el operador estaba solo.
Las salas de examen se personalizaron para minimizar la estimulación visual, auditiva y olfativa y para que fueran cómodas. Estaban limpios, equipados con una mesa de examen y una mesa para colocar el dispositivo de adquisición, sillas, colchonetas y golosinas para perros y gatos. Era posible crear oscuridad en la habitación para la estimulación fótica, y una luz nocturna proporcionaba suficiente luz de iluminación para la grabación.
Se aconsejó a los propietarios que alimentaran y sacaran a sus animales antes del examen. Podrían traer al compañero de dormir de su mascota y sus golosinas favoritas. Las grabaciones se realizaron en su mayoría con los perros tumbados en el suelo, con o sin colchoneta, y los gatos en su caja de transporte, a menudo con la parte superior abierta, y colocados en la mesa de examen. También se realizaron grabaciones con el animal en el regazo del dueño. En caso de calor excesivo durante el verano, se proporcionó una estera refrigerada al animal para evitar la polipnea.
2.2 Dispositivo
Los registros de EEG se realizaron utilizando un dispositivo de EEG con cable (Brainbox 1042 Braintronics BV, Fl. Países Bajos) con software de EEG (Coherence 7.1.3.2037 Natus Europe GMBH, Planegg, Alemania). Los ajustes de adquisición fueron frecuencia de muestreo por canal 256 Hz, filtro de paso alto 0,3 s, filtro de paso bajo 35 Hz, resolución 7 μV/mm, montajes longitudinales y transversales. Estos montajes fueron preferidos sobre el montaje referencial para evitar la contaminación del electrodo de referencia por artefactos, especialmente cardíacos, y para maximizar las posibilidades de observar potenciales focales pequeños (30, 31). Se utilizó un filtro de 50 Hz para evitar perturbaciones relacionadas con la corriente alterna. Estos ajustes son los recomendados en medicina humana, excepto el filtro de paso bajo, que se redujo de 70 a 35 Hz para limitar los artefactos musculares sin restringir la observación de los ritmos cerebrales (2-6). Este dispositivo permitió la grabación sincronizada de vídeo y EEG, así como la configuración y visualización de protocolos de luz.®®
2.3 Electrodos y tapón
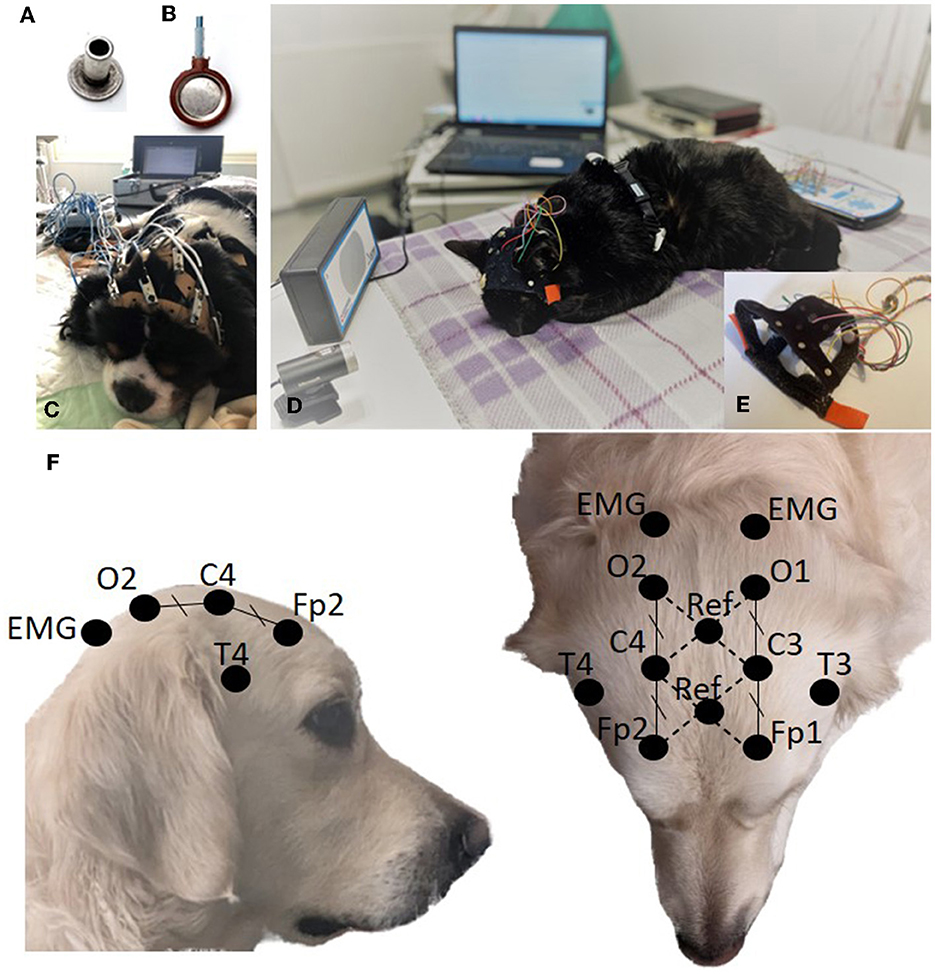
Las pautas humanas recomiendan el uso de electrodos de superficie para el EEG de rutina, ya sea electrodos de gel de copa de oro o Ag / AgCl o tapas de electrodos (5, 6). Como las tapas de los electrodos están diseñadas para uso humano, optamos por electrodos de superficie de copa o espárrago, siendo estos últimos equivalentes a los electrodos de copa no cableados. Compatible con sistemas de sujeción adaptados a la cabeza del animal. Se compararon los electrodos Ag/AgCl sin espárragos (Preborn, M.E.I, La Farlède, Francia; Figura 1A) y electrodos de Ag de copa con alambre (NE-112A, Nihon Kohden, Tokio, Japón; Figura 1B). El primero se utilizó durante un período inicial de 18 meses, asegurado a las cabezas de los animales mediante correas elásticas perforadas cada 1,5 cm, en las que se insertaron los electrodos y se mantuvieron en su lugar mediante pinzas de cocodrilo de los cables eléctricos (Figura 1C). Este último se utilizó durante una segunda fase de 14 meses, en la que se dispuso de un gorro de electrodo para EEG diseñado para perros y gatos en siete tamaños (PetCap, Elyope, Saint-Maur-des-Fossés, Francia) (32) (Figuras 1D, E).®®
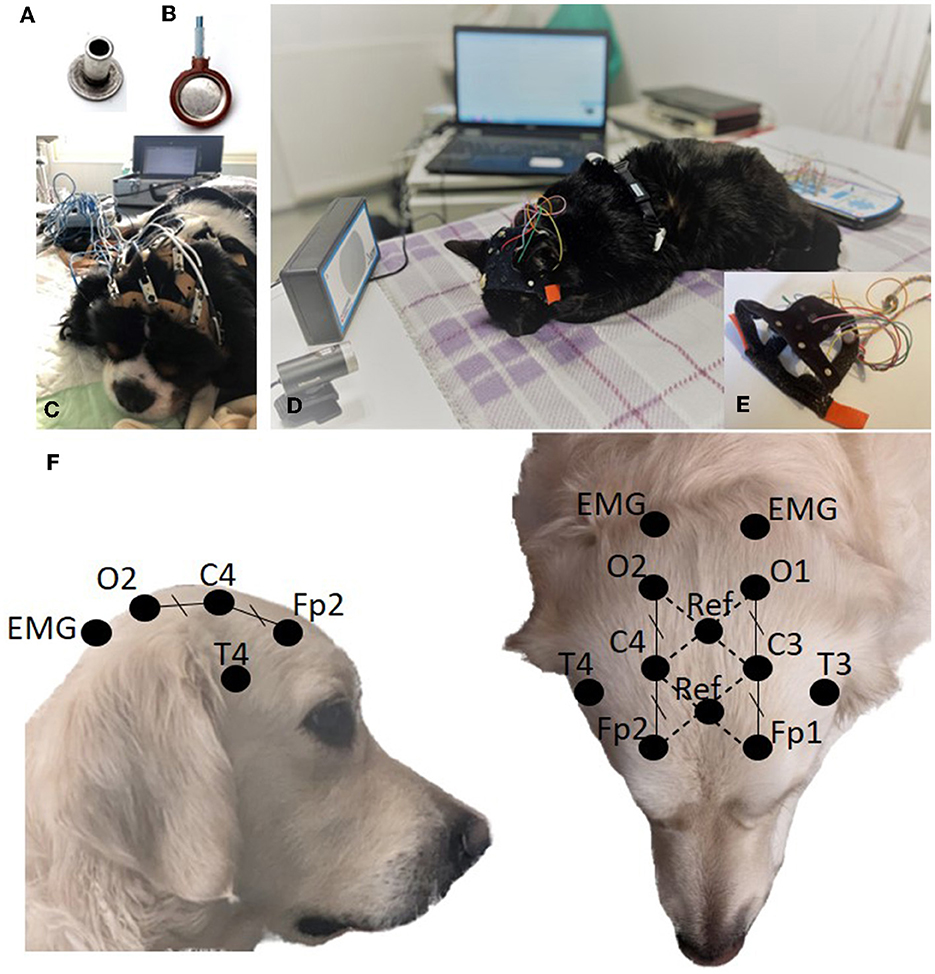 Figura 1. Electrodo de espárrago (A). Electrodo de copa (B). Configuración de adquisición de EEG mediante electrodos de pernos y correas elásticas (C). Configuración de adquisición de EEG mediante electrodos de copa y PetCap (D) con detalles de los electrodos recubiertos con pasta conductora e insertados en el sistema (E). Posicionamiento del electrodo (F).®
Figura 1. Electrodo de espárrago (A). Electrodo de copa (B). Configuración de adquisición de EEG mediante electrodos de pernos y correas elásticas (C). Configuración de adquisición de EEG mediante electrodos de copa y PetCap (D) con detalles de los electrodos recubiertos con pasta conductora e insertados en el sistema (E). Posicionamiento del electrodo (F).®
2.4 Posición del electrodo y contacto con la piel
La colocación de los ocho electrodos, tanto en las correas elásticas como en el PetCap, se basó en las propuestas de Pellegrino y Sica (22) y James et al. (24). Los electrodos frontales (Fp1/Fp2) se colocaron caudales al canto medio, en el borde externo de la línea temporal. Los electrodos occipitales (O1/O2) se colocaron en una línea transversal entre las apófisis mastoideas a una distancia igual de la línea media que los electrodos frontales. Los electrodos centrales (C3/C4) se colocaron a medio camino entre los electrodos frontal y occipital en el plano transversal y a la misma distancia de la línea media que los electrodos frontal y occipital. Los electrodos temporales (T3/T4) se colocaron en la base de la oreja, justo por encima de la cresta temporal (Figura 1F). Nuestro software de adquisición permite el uso de 2 electrodos de referencia y calcula la diferencia de potencial eléctrico entre ellos para eliminar el ruido. Estos 2 electrodos de referencia se colocaron en la línea mediana en la intersección de las diagonales Fp1-C4 y Fp2-C3 para la primera referencia y en la intersección de las diagonales C3-O1 y C4-O2 para la segunda (Figura 1F). Los electrodos se colocaron en la cabeza sin afeitar, lo más cerca posible de la piel, separando los pelos. Para los electrodos de pernos, se colocaron correas elásticas en la cabeza del animal, luego los electrodos se insertaron simétricamente en las perforaciones de las correas. A continuación, se aplicaron pasta y gel conductores (Ten20, Weaver and Company, Aurora, CO, EE.UU., y SignaGel Parker Laboratories, INC. Fairfield, NJ, EE.UU.) entre la piel y el electrodo. En el caso de los electrodos de copa, los electrodos se introdujeron previamente en el PetCap y se recubrieron con Ten20 antes de colocar el auricular en el animal y añadir el SignaGel, lo que redujo el tiempo de intervención (Figura 1E).®®®®®®
Simultáneamente, se realizó un electrocardiograma (ECG) y un registro respiratorio, con un electrodo torácico y un sensor de movimiento sostenidos por una cinta torácica colocada detrás de las patas delanteras del animal. Se colocaron dos electrodos de superficie de electromiografía (EMG) en las regiones anterior y dorsal de los músculos del cuello, posteriores a los electrodos occipitales, asegurados por el PetCap (Figuras 1E, F).®
2.5 Grabación
Los registros electroencefalográficos se iniciaron después de verificar los valores de impedancia de los electrodos y se monitorearon en tiempo real, lo que permitió ajustar los electrodos si fuera necesario.
La cámara se colocó por encima y de cara al animal y se reposicionó si el animal se movía (Figura 1D).
La estimulación fótica intermitente (IPS) se realizó al inicio del examen cuando el animal estaba acostado en estado de vigilia. La lámpara se colocó a la altura de los ojos, a 30 cm de distancia del animal y el programa siguió un programa que aumentaba la frecuencia de los destellos de luz: 3-5-7-10-13-15-17-20-25-30-35-40-45-50 Hz, con 10 s de duración y 5 s de pausa entre cambios de frecuencia (Figura 1D). Si el paciente se quedaba dormido durante la estimulación fótica, esta prueba se repetía al final del examen de EEG después de que el paciente se despertara. Otras estimulaciones, como el ruido y la comida, se llevaron a cabo en función de los posibles desencadenantes de convulsiones informados por el propietario y el médico.
Los animales no fueron estimulados para promover el descanso durante al menos 20 min. Si el paciente se quedó dormido durante la grabación, la fase de vigilia después de la siesta se registró durante un mínimo de 5 minutos.
El operador anotó el rastro registrado con la mayor cantidad de información posible sobre los eventos que pueden ocurrir durante el examen, en el entorno o específicos del paciente.
2.6 Interpretación
Todas las grabaciones fueron revisadas visualmente por tres autores: SBe, CE y EL, durante sesiones de lectura conjuntas con el fin de obtener un consenso. Los ajustes utilizados para la interpretación eran los mismos que para la adquisición, pero podían modularse para facilitar la discriminación de patrones. Se enumeraron artefactos, ritmos fisiológicos y eventos paroxísticos. La vigilia se identificó en el EEG mediante la visualización de un fondo de actividad rápida de bajo voltaje perturbado por artefactos de movimiento ocular y corporal y contracciones musculares (canales EEG y EMG). La somnolencia se identificó mediante la visualización de un fondo de actividad EEG rápida de bajo voltaje, con ritmos alfa (8-12 Hz) o ritmos theta (4-7 Hz), menos artefactos de movimiento ocular y corporal, menos tono muscular y respiración más regular (sensor de movimiento respiratorio). El sueño de movimientos oculares no rápidos (no REM) se identificó por la aparición de actividad delta de medio y alto voltaje (1-4 Hz) y/o husos del sueño (ondas con una frecuencia de 12-16 Hz) en el EEG, ausencia de artefactos de movimiento ocular y corporal, respiración regular y disminución del tono muscular. El sueño REM se identificó mediante la visualización de una actividad rápida de bajo voltaje en el EEG, EMG de amplitud débil pero alterada durante los espasmos faciales o de las piernas y las sacudidas mioclónicas, respiración irregular (cinturón respiratorio) y latidos cardíacos (ECG) (33-36). Los eventos paroxísticos observados incluyeron picos, complejo de poliespiga, complejo de picos y ondas lentas, complejo de polipicos y ondas lentas, ondas agudas, ondas trifásicas y ondas lentas (37, 38).
2.7 Estadísticas
En ausencia de distribución normal, se utilizaron pruebas no paramétricas. La estadística descriptiva se presenta como mediana [1er cuartil−3er cuartil]. Las variables cuantitativas entre los grupos se compararon mediante la prueba de Mann-Whitney-Wilcoxon (para dos grupos) o la prueba de Kruskall-Wallis y la prueba post-hoc de Dunn-Bonferroni (para más de dos grupos). Las distribuciones de múltiples grupos se compararon mediante la prueba de homogeneidad de chi-cuadrado, con algunos grupos agregados si los números eran insuficientes y con corrección de continuidad de Yates si era necesario. Los resultados se consideraron estadísticamente significativos con una P < 0,05. Todas las pruebas estadísticas se llevaron a cabo con el software R (4.2.1). Los gráficos se generaron utilizando el paquete de R ggplot 2 (39) y Microsoft Excel (Microsoft Corporation One Microsoft Way, Redmond, WA, EE. UU.). Utilizamos una proporción expresada en porcentaje, llamada «porcentaje legible», calculada con el tiempo correspondiente al número de páginas legibles de 20 segundos dividido por la duración total de la grabación en minutos. De hecho, si más de la mitad de la página de 20 segundos era ininterpretable debido a un artefacto, es decir, cuya amplitud provoca la superposición de los canales de grabación, cualquiera que sea el montaje utilizado (referencial o bipolar) en el ajuste de 7 μV/mm, o cuya frecuencia sobrecarga la visualización de los ritmos fisiológicos, la página se consideraba ilegible. Además, el registro de EEG se detuvo durante las comprobaciones de impedancia y se reinició después. Las páginas durante estas comprobaciones de impedancia también se contaban como ilegibles.®
3 Resultados
3.1 Población
Entre octubre de 2019 y julio de 2022 se investigaron doscientos treinta electroencefalograma.
Los primeros 80 registros se utilizaron para desarrollar el protocolo, específicamente para establecer el posicionamiento de las bandas elásticas para lograr una configuración simétrica durante los registros, validar las posiciones de los electrodos con PetCap, elegir los tipos de electrodos de superficie, seleccionar los geles de contacto y equipar el dispositivo de EEG con video y lámpara de estimulación fótica sincronizada.®
Las siguientes 150 grabaciones se incluyeron en el estudio con 140 animales, 101 realizadas en perros y 49 en gatos.
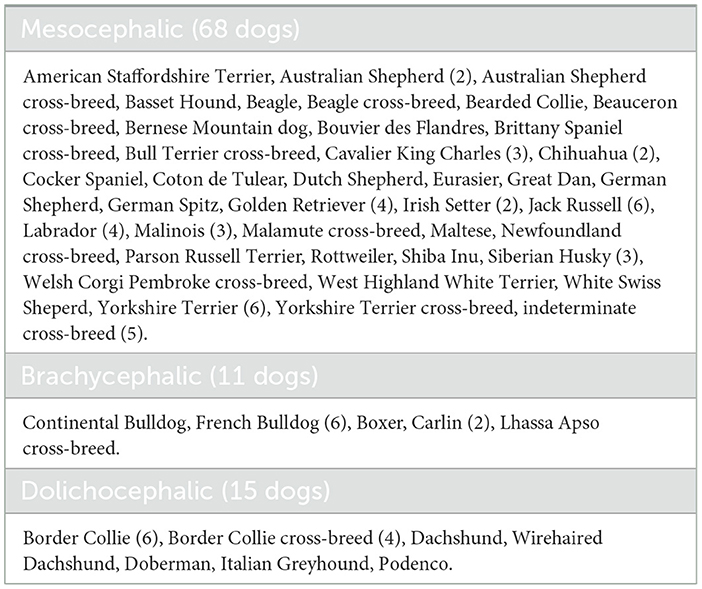
Se registraron noventa y cuatro perros, de los cuales 88 se registraron una vez, cinco perros dos veces y un perro, tres veces. Cuarenta y una razas de perros estuvieron representadas, 18 perros fueron mestizos. Las conformaciones de la cabeza de los perros se clasificaron en tres categorías: dolicocéfalos, con un cráneo muy alargado, braquicéfalos, con una cara muy plana, y mesocéfalos, cercanos al tipo primitivo (40) (Tabla 1). Eran 43 hembras y 51 machos, con edades comprendidas entre los 4 meses y los 17 años [4,3 años [1,8-7,6]], con un peso que oscilaba entre 2,6 y 64,6 kg [17,2 kg [8,9-25,45]]. Cinco perros eran perros sanos traídos por sus dueños, que eran estudiantes de veterinaria que participaron en el estudio, mientras que todos los demás perros fueron presentados por sus dueños para consultas de neurología. Ochenta perros tenían antecedentes de al menos un episodio paroxístico en los 6 meses anteriores, ya fueran ataques epilépticos típicos o episodios menos característicos como persecución de la cola, mioclonía, rigidez episódica o ataxia, lamido compulsivo, mordedura de moscas, colapsos episódicos, episodios de trance, episodios de castañeteo de la mandíbula, babeo episódico, masticación episódica, agresión episódica, polipnea episódica o trastornos episódicos del movimiento. Nueve perros presentaron un estado confusional o signos de deterioro vestibular, pero ningún evento paroxístico.
Se registraron 46 gatos, de los cuales 43 se registraron una vez y 3 dos gatos. Se registraron seis razas de gatos, 1 mestizo y gatos domésticos de pelo corto [Bengala, Birmano (2 gatos), Devon Rex, Noruego, Persa, Ragdoll (2 gatos), Mapache principal de raza mixta, Doméstico de pelo corto (37 gatos)]. Eran 23 hembras y 23 machos, con edades comprendidas entre los 7 meses y los 17 años [3,5 años [1,4-7,9]], con un peso que oscilaba entre 700 y 7,4 kg [4 kg [3,15-4,8]]. Cuarenta gatos tenían antecedentes de al menos un evento paroxístico, ya sea ataques epilépticos típicos o episodios menos característicos como piel enrollada, persecución de la cola, rascado, agresión episódica, gruñidos episódicos, vocalización episódica, lamido compulsivo, episodios de trance, rigidez o ataxia episódica, posible trastorno del sueño REM o trastornos episódicos de los movimientos. Seis gatos tenían un estado confusional o signos de deterioro vestibular, pero ningún evento paroxístico.
3.2 Validación de la viabilidad del EEG no sedado
El noventa y cuatro por ciento (141/150) de los registros de EEG se llevaron a cabo sin el uso de medicamentos sedantes. Dos perros fueron sometidos a EEG después de la Resonancia Magnética (RM) o la Respuesta Auditiva Evocada del Tronco Encefálico (BAER) y estaban bajo sedación, mientras que tres gatos y un perro recibieron premedicación preventiva debido a su agresividad (dexmedetomidina/butorfanol para un gato y gabapentina para los demás). Además, se sedó a tres perros inquietos para minimizar el movimiento y los artefactos respiratorios (dexmedetomidina). Los resultados presentados aquí se refieren al EEG sin tranquilización, es decir, 95 EEG realizados en perros y 46 EEG realizados en gatos.
Se realizaron sesenta y cinco electroencefalogramas de perros y 28 electroencefalogramas de gatos en presencia del propietario. Se utilizaron golosinas para mantener ocupados a los perros si se agitaban durante la prueba del casco. Todos los perros mantuvieron el sistema de EEG en la cabeza y un gato inicialmente retiró el sistema, que se volvió a instalar. A pesar de los movimientos suaves, acostado en varias posiciones (decúbito esteral o lateral), de pie o sacudiendo, los electrodos permanecieron unidos con buen contacto entre el electrodo y la piel e impedancias. En algunos casos, se aplicó una tira de banda elástica (Vetrap™) de forma preventiva para asegurar el sistema de montaje si el animal parecía agitado antes de la grabación. No se notificaron reacciones dermatológicas tras el uso de Ten20 y SignaGel. El gel se retiró con champú seco y, si era necesario, se complementó con champú húmedo en casa por el propietario, como en el uso humano.®®
Sesenta y cuatro electroencefalogramas de perros se realizaron con electrodos de pernos, y 31 electroencefalogramas de perros se realizaron con electrodos de copa. Veinticuatro electroencefalogramas de gato se realizaron con electrodos de perno y 22 electroencefalogramas de gato se realizaron con electrodos de copa.
Se logró la estimulación fótica en 42 EEG de perros y 27 EEG de gatos, ya que el dispositivo de registro no estaba equipado inicialmente para ello al inicio del estudio. No se realizó estimulación lumínica en los casos de estado epiléptico no convulsivo diagnosticado por EEG (4 EEG).
De acuerdo con la historia proporcionada por los propietarios, se llevaron a cabo otras estimulaciones para desencadenar convulsiones, incluida la comida (cinco perros) y los sonidos (tres perros y un gato) como aplausos, sonido de llaves, sonido de papel arrugado y sonido de botellas de plástico aplastadas.
La mediana del tiempo de registro del EEG fue de 40 min para las dos especies [Perros: 40 min [30–55]; Gatos: 40 min [27–49]] (Figura 2A). Seis pacientes tuvieron un tiempo de registro de < 20 min, 4 por limitaciones de tiempo relacionadas con el funcionamiento del servicio, 1 donde el diagnóstico se estableció inmediatamente con base en los hallazgos del EEG y 1 por agitación excesiva. Veintiséis animales tuvieron un registro que duró más de 60 minutos, 12 estaban durmiendo profundamente, nueve estaban inquietos y tuvimos que esperar a que el animal se calmara para tener un rastro de EEG legible, y otros cinco para maximizar las posibilidades de registrar las convulsiones.
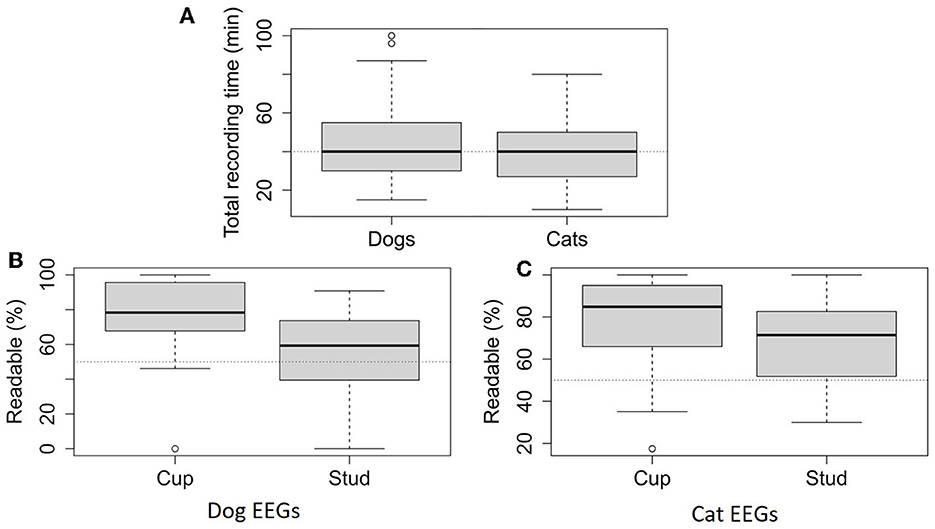 Figura 2. Tiempo total de registro de los electroencefalogramas de perros (95) y de gatos (46) (A). Porcentaje legible calculado con las páginas de 20 segundos que no se ven perturbadas por artefactos durante más de la mitad de su duración sobre el tiempo total de grabación, según el tipo de electrodo, para EEG de perro (64 EEG con electrodos de perno y 31 EEG con electrodos de copa) (B) y EEG de gato (24 EEG con electrodos de espárrago y 22 EEG con electrodos de copa) (C).
Figura 2. Tiempo total de registro de los electroencefalogramas de perros (95) y de gatos (46) (A). Porcentaje legible calculado con las páginas de 20 segundos que no se ven perturbadas por artefactos durante más de la mitad de su duración sobre el tiempo total de grabación, según el tipo de electrodo, para EEG de perro (64 EEG con electrodos de perno y 31 EEG con electrodos de copa) (B) y EEG de gato (24 EEG con electrodos de espárrago y 22 EEG con electrodos de copa) (C).
3.3 Validación de la calidad técnica de los registros de EEG
3.3.1 Impedancia
El software de electroencefalografía proporciona intervalos de valores de las mediciones de impedancia (Z) para cada electrodo: Z > 100 kΩ (escrito >100 en el software), 50 < Z ≤ 100 kΩ (escrito < 100), 20 < Z ≤ 50 kΩ (escrito < 50), 10 < Z ≤ 20 kΩ (escrito < 20), 5 < Z ≤ 10 kΩ (escrito < 10), Z ≤ 5 kΩ (escrito < 5). Todos los valores de impedancia registrados fueron ≤ 50 kΩ (indicar < 5 o < 10 o < 20 o < 50 por el software). En los EEG de perros, el 98,8% (751/760) de las impedancias fueron ≤ 20 kΩ (indicadas < 5 o < 10 o < 20 por el software) y, en los EEG de gato, el 97,6% (359/368), independientemente de los tipos de electrodo utilizados. Se observaron impedancias ≤ 10 kΩ (indicadas < 5 o < 10 por el software) en el 81 y el 85,2% de los EEG de perros y gatos, con electrodos de copa, y en el 64,5 y el 70,3% con electrodos de perno (Figura 3A). Comparando los números en los grupos de impedancia < 5 y < 10 con los de los grupos < 20 y < 50 por tipo de electrodo (espárrago o copa), concluimos que las impedancias del electrodo de copa son menores que las impedancias del electrodo de espárrago (EEG de perro: x cuadrado = 121,32, df = 1, p < 0,001; electroencefalograma de gato: x cuadrado = 10,856, df = 1, p < 0,001; Figura 3A). Las impedancias no son homogéneas, dependiendo de la posición de los electrodos en los EEG de perros y gatos (EEG de perros: x-cuadrado = 26,228, df = 14, p = 0,024; EEG de gato: x-cuadrado = 33,97, df = 14, p = 0,002; Figura 3B).
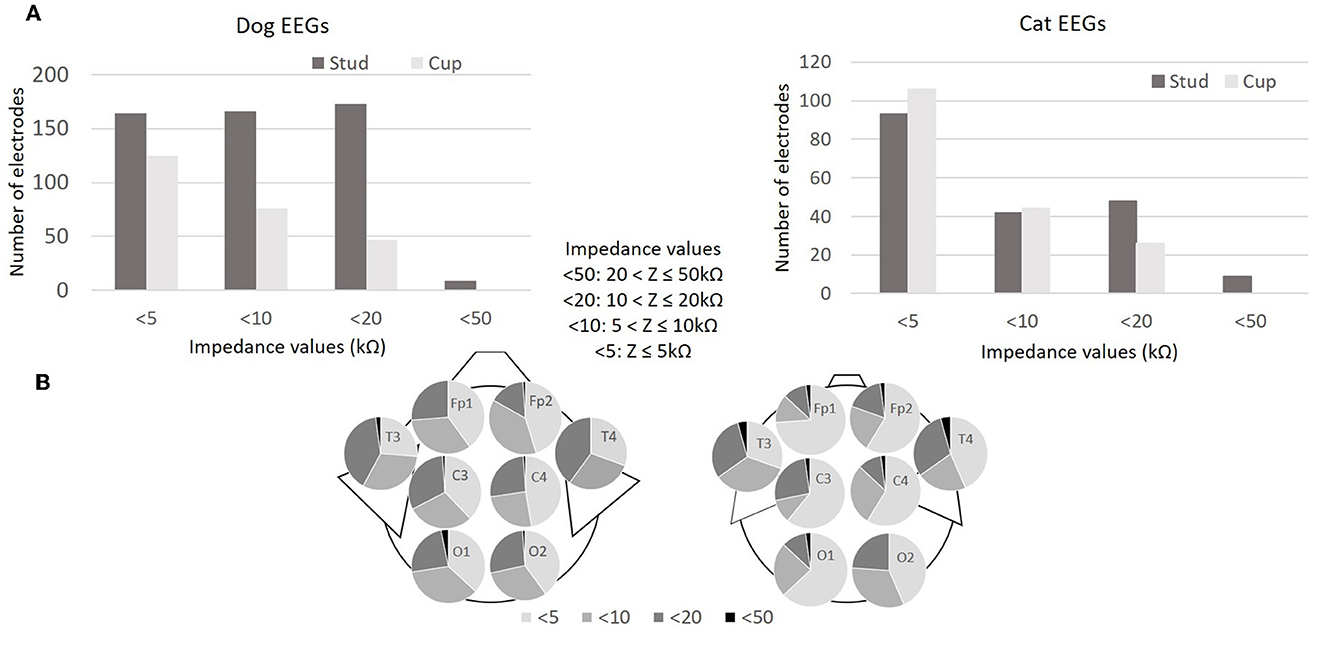 Figura 3. Valores de impedancia (kΩ) de los 760 electrodos durante los EEG de 95 perros (electrodos de 95×8) y valores de impedancia de los 368 electrodos durante los 46 electroencefalogramas de gato (electrodos de 46×8) (A). Distribución de los valores de impedancia (kΩ) según la posición del electrodo en 95 EEG de perro y 46 EEG de gato (B).
Figura 3. Valores de impedancia (kΩ) de los 760 electrodos durante los EEG de 95 perros (electrodos de 95×8) y valores de impedancia de los 368 electrodos durante los 46 electroencefalogramas de gato (electrodos de 46×8) (A). Distribución de los valores de impedancia (kΩ) según la posición del electrodo en 95 EEG de perro y 46 EEG de gato (B).
3.3.2 Montajes e isosincronía
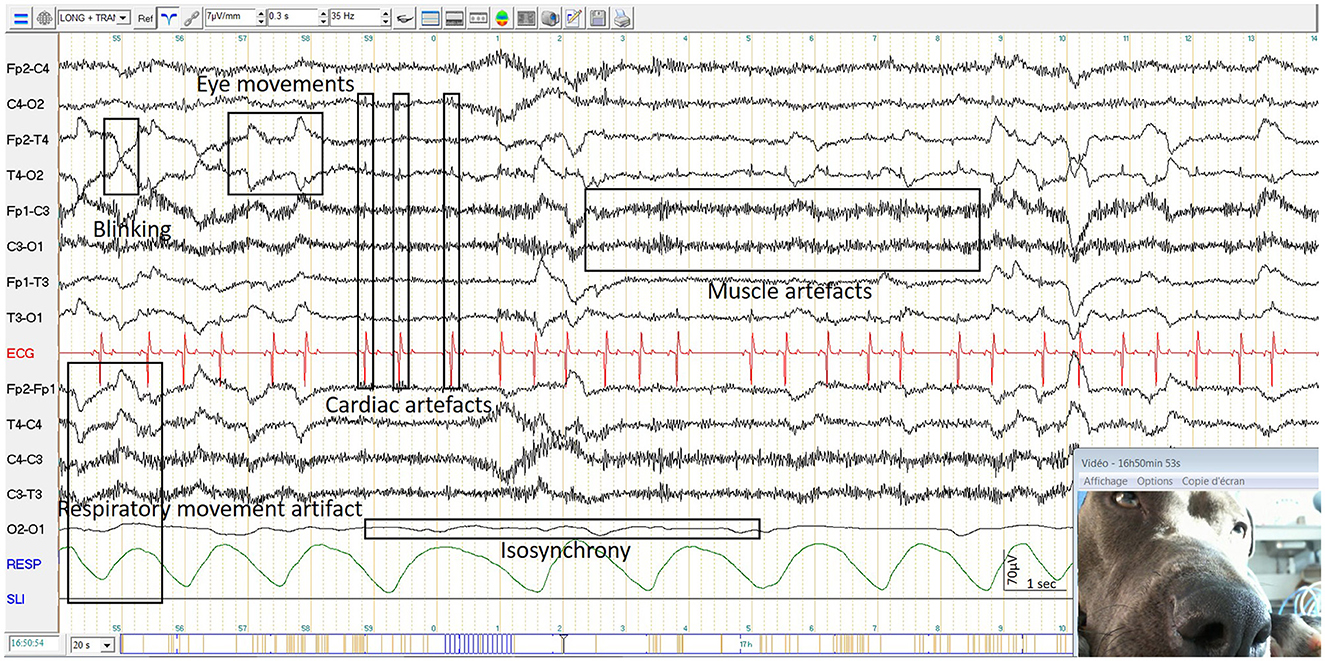
Definimos «canales utilizables» como canales sin isosincronía, que aparecen en la traza del EEG como una línea plana (Figura 4). En el caso de los electroencefalogramas caninos, en el montaje longitudinal, el 93,4% (478/512) de los canales fueron utilizables con electrodos de espárrago y el 94,7% (235/248) con electrodos de copa. En el montaje transversal, el 95,6% (306/320) de los canales fueron utilizables con electrodos de espárrago y el 94,8% (147/155) con electrodos de copa. En el caso de los electroencefalogramas por tac, en el montaje longitudinal el 83,3% (160/192) de los canales fueron utilizables con electrodos de espárrago y el 93,2% (164/176) con electrodos de copa. En el montaje transversal, el 79,2% (95/120) de los canales fueron utilizables con electrodos de espárrago, y el 97,3% (107/110) fueron utilizables con electrodos de copa. Sumando los valores de los canales utilizables de perros y gatos en montaje longitudinal con electrodos de copa (235 + 164 = 399) y dividiendo por el número total de canales de perros y gatos en montaje longitudinal con electrodos de copa (248 + 176 = 424) obtuvimos la proporción de canales utilizables que fue en porcentaje del 94,1%. Por lo tanto, el porcentaje de isosincronía en el montaje longitudinal con electrodos de copa para perro y gato combinados fue del 5,9% (100-94,1%).
El montaje longitudinal con ocho canales utilizables se configuró más fácilmente en perros más grandes en comparación con perros pequeños (Figura 5A). Esta diferencia es menos perceptible en los gatos, ya que la variación de peso y tamaño es menos significativa (Figura 5B). Los 3 EEG con solo cuatro canales longitudinales utilizables se realizaron con electrodos de perno en animales inquietos. Uno de estos EEG se repitió debido a la agitación del animal, y el número de canales fue de ocho durante la segunda grabación.
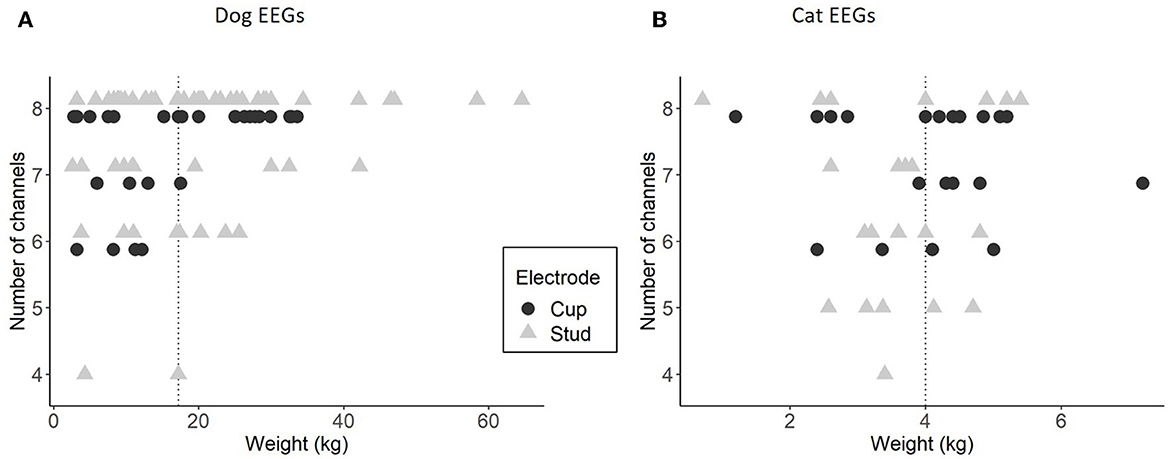 Figura 5. Relación entre el peso de los animales y el número de canales utilizables en el montaje longitudinal, para EEG de perro con semental (64 EEG) y copa (31 EEG) (A) y para EEG de gato con semental (24 EEG) y copa (22 EEG) (B). La línea punteada representa la mediana de los pesos en cada especie.
Figura 5. Relación entre el peso de los animales y el número de canales utilizables en el montaje longitudinal, para EEG de perro con semental (64 EEG) y copa (31 EEG) (A) y para EEG de gato con semental (24 EEG) y copa (22 EEG) (B). La línea punteada representa la mediana de los pesos en cada especie.
3.3.3 Artefactos
Observamos artefactos técnicos, como artefactos del entorno eléctrico, particularmente cuando la caja del amplificador se colocó sobre una superficie metálica, así como artefactos de estallido de los electrodos. Además, se observaron artefactos específicos para el uso de pinzas de cocodrilo con electrodos de perno cuando estaban en contacto entre sí. También observamos artefactos relacionados con las personas en el entorno de grabación, incluido el registro del pulso cardíaco del propietario, las caricias del animal y el contacto con los cables, y los movimientos en la habitación.
Algunos artefactos fisiológicos observados fueron similares a los descritos en los atlas de medicina humana, como los latidos del corazón, los movimientos respiratorios, las contracciones musculares y los movimientos globales (Figura 4). Sin embargo, también observamos artefactos específicos de perros y gatos, como artefactos para lamer, movimientos de orejas y movimientos de aleteo de la cola.
El setenta y cuatro punto siete por ciento (71/95) de las grabaciones de perros fueron legibles durante más del 50% de su duración hasta el 100%, el 13,7% (13/95) de las grabaciones fueron legibles durante el 25-50% de su duración y el 11,6% (11/95) de las grabaciones fueron legibles durante < 25% de su duración. En estos últimos casos, el animal tenía problemas de comportamiento, o los dueños eran intrusivos, o las técnicas de estimulación como la alimentación generaban una gran cantidad de artefactos. El «porcentaje legible» por debajo del 50% se asoció principalmente con el uso de electrodos de espárrago (20/24). En consecuencia, el «porcentaje legible» fue significativamente mayor en los registros de EEG con electrodos de copa que en los de electrodos de espárrago [electrodos de perno: 59% [40-73]; electrodos de copa: 78% [68-96]; p < 0,001; Figura 2B].
Nueve perros tuvieron 2 registros, 4 por su agitación y los demás por seguimiento médico. La mediana de los porcentajes de legibilidad de las primeras grabaciones de perros agitados fue del 16% [12-25], mientras que la de las segundas grabaciones fue del 70% [61-75], lo que sugiere el efecto beneficioso de la habituación en algunos casos específicos.
El ochenta y dos punto seis por ciento (38/46) de las grabaciones de gatos fueron legibles durante más del 50% de su duración hasta el 100%, el 15,2% (7/46) de las grabaciones fueron legibles durante el 25-50% de su duración, el 2,2% (1/46) de las grabaciones fueron legibles durante < el 25% de su duración. Las principales dificultades encontradas estuvieron relacionadas con el contacto inadecuado entre las pinzas de cocodrilo, que se acentúa por el pequeño tamaño de las cabezas de los gatos y con las intervenciones de los propietarios. En los gatos, no encontramos diferencias significativas entre el «porcentaje legible» en los registros de EEG con electrodos de espárrago y los de electrodos de copa [electrodos de perno: 71% [52-82]; electrodos de copa: 85% [68-94]; p = 0,0503; Figura 2C].
3.4 Validación de la interpretabilidad del EEG
3.4.1 Ritmos fisiológicos
Se observaron ritmos fisiológicos en el 98,9% (94/95) de los EEG de perros, incluidos los ritmos de vigilia (92/94) (Figuras 6A, B), somnolencia (72/94) (Figura 6C) y sueño (46/94) (Figura 6D). En el caso de los electroencefalogramas de gato, se observaron ritmos fisiológicos en el 91,3% (42/46), incluidos los ritmos de vigilia (41/42) (Figura 7A), somnolencia (33/42) (Figura 7B) y sueño (9/42) (Figura 7C). No se observaron ritmos fisiológicos en cinco registros, probablemente debido a la patología de cuatro animales (encefalopatía difusa para un perro y un gato, un estado epiléptico no convulsivo para dos gatos) y a la razón técnica en un gato (macho intacto con altos valores de impedancia posiblemente debido a la especificidad de la piel).
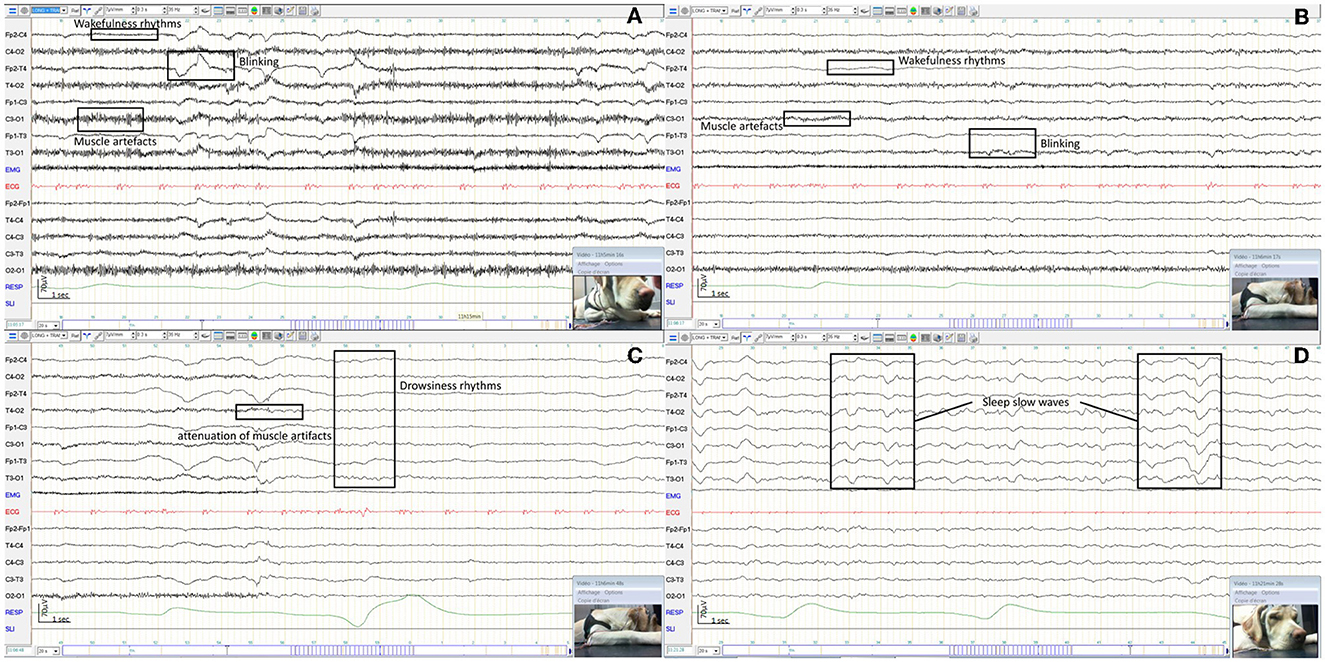 Figura 6. EEG de un perro despierto que muestra un ritmo rápido de baja amplitud y artefactos del parpadeo y la actividad muscular con ejemplos en los recuadros (A). EEG del mismo perro que antes, despierto y tranquilo, mostrando un ritmo rápido de baja amplitud con artefactos reducidos por parpadeo y actividad muscular con ejemplos en los recuadros (B). EEG del mismo perro que antes, dormido, que muestra un ritmo de amplitud media de 5 Hz (C). EEG del mismo perro que antes, somnoliento, que muestra ritmos de alta amplitud de 1−3 Hz con ejemplos en los recuadros (D).
Figura 6. EEG de un perro despierto que muestra un ritmo rápido de baja amplitud y artefactos del parpadeo y la actividad muscular con ejemplos en los recuadros (A). EEG del mismo perro que antes, despierto y tranquilo, mostrando un ritmo rápido de baja amplitud con artefactos reducidos por parpadeo y actividad muscular con ejemplos en los recuadros (B). EEG del mismo perro que antes, dormido, que muestra un ritmo de amplitud media de 5 Hz (C). EEG del mismo perro que antes, somnoliento, que muestra ritmos de alta amplitud de 1−3 Hz con ejemplos en los recuadros (D).
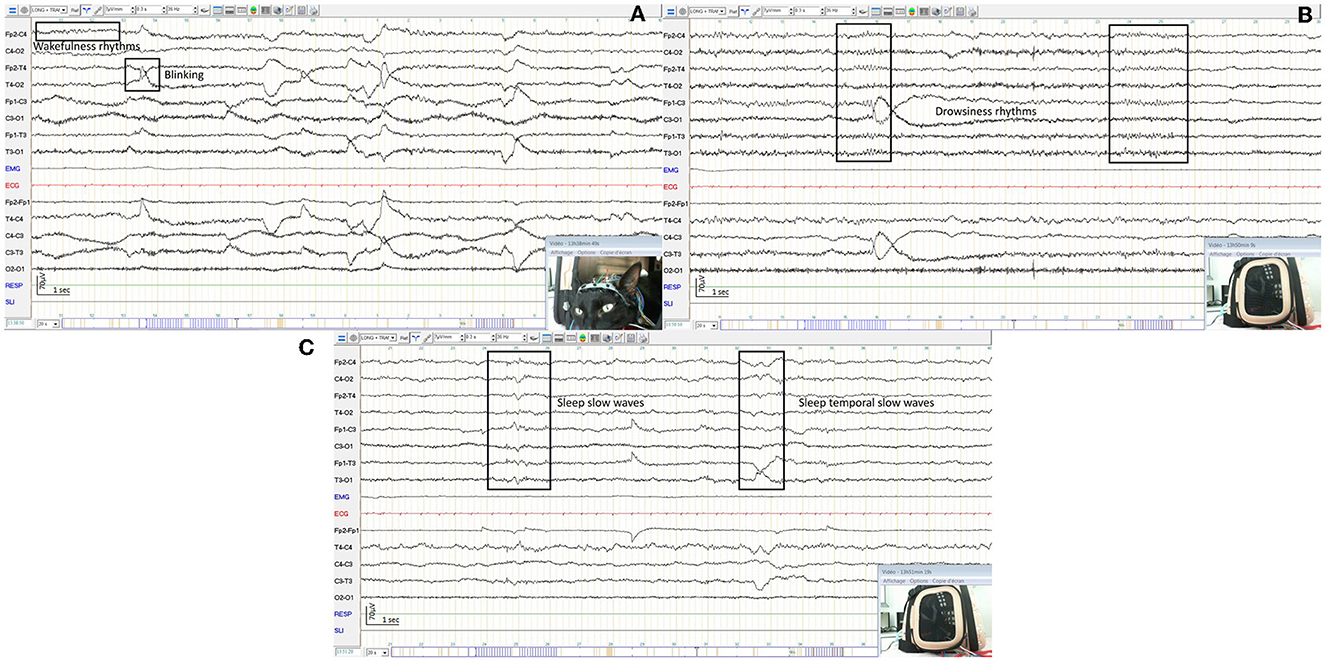 Figura 7. EEG de un gato despierto que muestra un ritmo rápido de baja amplitud y artefactos del parpadeo y la actividad muscular con ejemplos en los recuadros (A). EEG del mismo gato que el anterior, dormitado, con un ritmo de amplitud media (B) de 7 Hz. EEG del mismo gato que el anterior, somnoliento, con ritmos mixtos theta y delta con ejemplos en los recuadros (C).
Figura 7. EEG de un gato despierto que muestra un ritmo rápido de baja amplitud y artefactos del parpadeo y la actividad muscular con ejemplos en los recuadros (A). EEG del mismo gato que el anterior, dormitado, con un ritmo de amplitud media (B) de 7 Hz. EEG del mismo gato que el anterior, somnoliento, con ritmos mixtos theta y delta con ejemplos en los recuadros (C).
Se determinaron cinco grupos en función de los ritmos fisiológicos observados: EEG con ritmos de vigilia solo (W), EEG con ritmos de vigilia y somnolencia (WD), EEG con ritmos de vigilia, somnolencia y sueño (WDS), EEG con somnolencia solo (D) y otros ritmos no fisiológicos (O). El grupo W consistió en 22 EEG de perros y 9 EEG de gatos, el grupo WD tuvo 24 EEG de perros y 23 EEG de gatos, el grupo WDS tuvo 46 EEG de perros y 9 EEG de gatos, el grupo D tuvo 2 EEG de perros y 1 EEG de gato, y el grupo O tuvo 1 EEG de perro y 4 EEG de gato. Los tres grupos W, WD y WDS se observaron en ambas especies del estudio, independientemente de los dos tipos de electrodos (Figura 8A). Los perros eran más propensos a dormir y los gatos a dormitar durante las grabaciones, y esta tendencia fue más pronunciada con los electrodos de copa (Figura 8A). Los ritmos fisiológicos se observaron tanto en machos como en hembras (Figura 8B) y fueron más fáciles de observar en los animales más jóvenes en comparación con los más viejos (Figura 8C). Las edades de los perros en los tres grupos W, WD y WDS fueron significativamente diferentes (EEG de perros: Kruskall-Wallis chi-cuadrado = 8,32, df = 2, p = 0,02; EEG de gato: Kruskall-Wallis chi-cuadrado = 6,48, df = 2, p = 0,04) con animales más jóvenes en el grupo WDS que en el grupo W (p = 0,03) y en el grupo WD (p = 0,03) en EEG de perros y con animales más jóvenes en el grupo WDS que en el grupo WD ( p = 0,02) en EEG de gatos (Figura 8C). La mediana del tiempo de registro en los grupos W fue de 35,5 min [29-45] para los EEG de perros y de 32,5 min [25-44] para los EEG de gatos, en los grupos WD de 43 min [30-58] para los EEG de perros y de 40 min [30-45] para los EEG de gatos, y en los grupos de WDS fue de 41 min [33-59] para los EEG de perros y de 50 min [42-59] para los EEG de gatos (Figura 8D). Los otros dos grupos, D y O, involucraron solo a unos pocos animales y estaban relacionados con sus respectivas enfermedades.
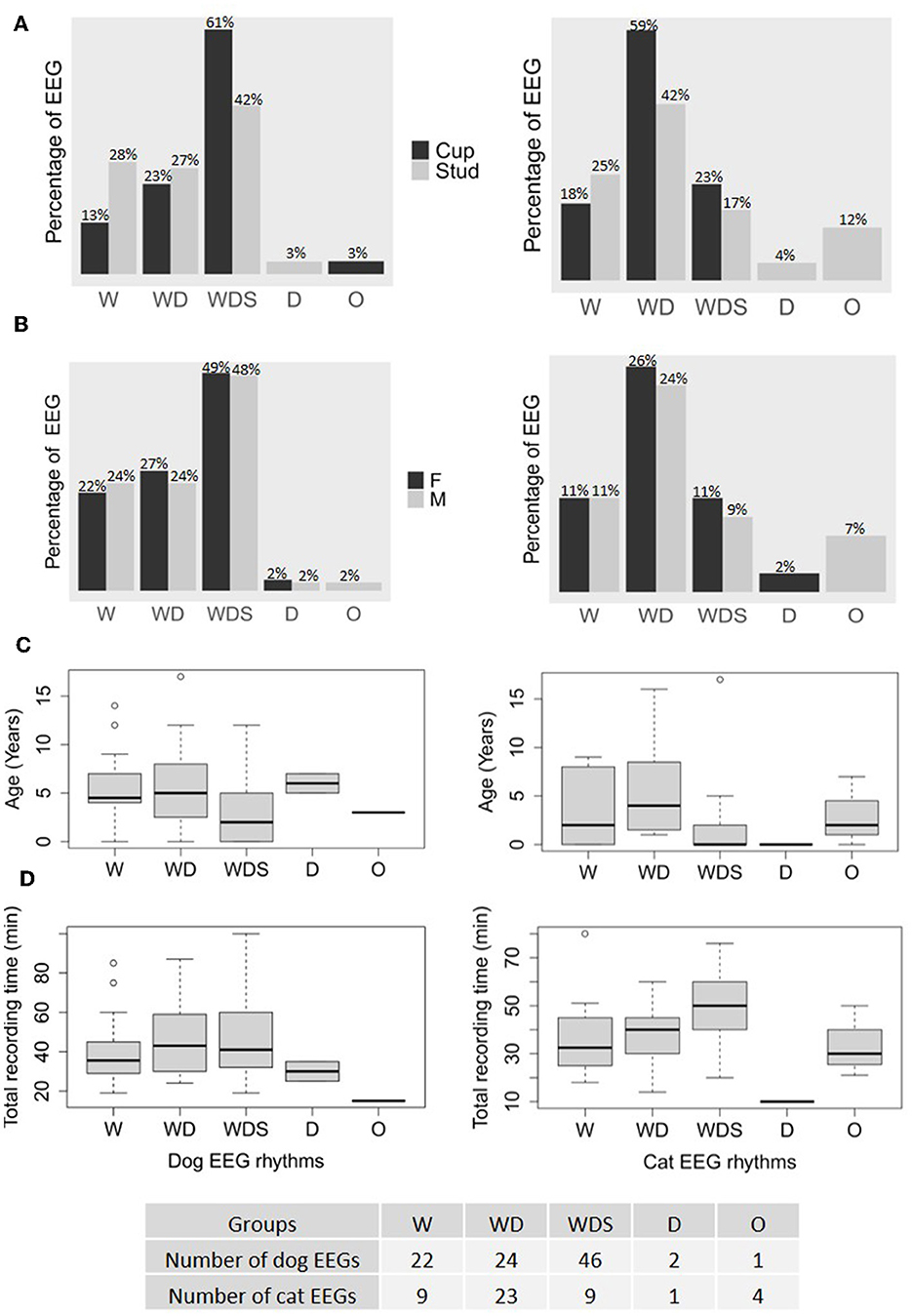 Figura 8. Las distinciones rítmicas (W, solo vigilia; WD, vigilia y somnolencia; WDS, vigilia, somnolencia y sueño; D, somnolencia solamente; O, distintos de los estados fisiológicos) en los registros de 95 perros (a la izquierda) y 46 gatos (a la derecha) detallados según el tipo de electrodos utilizados y expresados como porcentaje del número total de registros realizados para cada tipo de electrodo, copa y perno (A), su sexo (B), su edad (C) y el tiempo total de registro (D).
Figura 8. Las distinciones rítmicas (W, solo vigilia; WD, vigilia y somnolencia; WDS, vigilia, somnolencia y sueño; D, somnolencia solamente; O, distintos de los estados fisiológicos) en los registros de 95 perros (a la izquierda) y 46 gatos (a la derecha) detallados según el tipo de electrodos utilizados y expresados como porcentaje del número total de registros realizados para cada tipo de electrodo, copa y perno (A), su sexo (B), su edad (C) y el tiempo total de registro (D).
3.4.2 Tareas de estimulación
3.4.2.1 Estimulación fótica intermitente
Se observó respuesta fótica sincrónica con destellos de luz en el 11% (5/45) de los EEG de perros, con frecuencias que variaron de 3 a 10 Hz y en el 85% (23/27) de los EEG de gatos, con frecuencias que variaron de 3 a 30 Hz, sin ningún signo clínico (Figuras 9A, B). Se observaron descargas epilépticas durante la IPS en el 13% (6/45) de los EEG caninos (Figura 9C). En 5 perros se observó mioclonía clínica simultáneamente con descargas epilépticas, mientras que en el perro restante no se observó ninguna manifestación clínica. Cuatro de estos seis perros mostraron mioclonías leves durante el sueño y descargas epilépticas en el trazo del EEG.
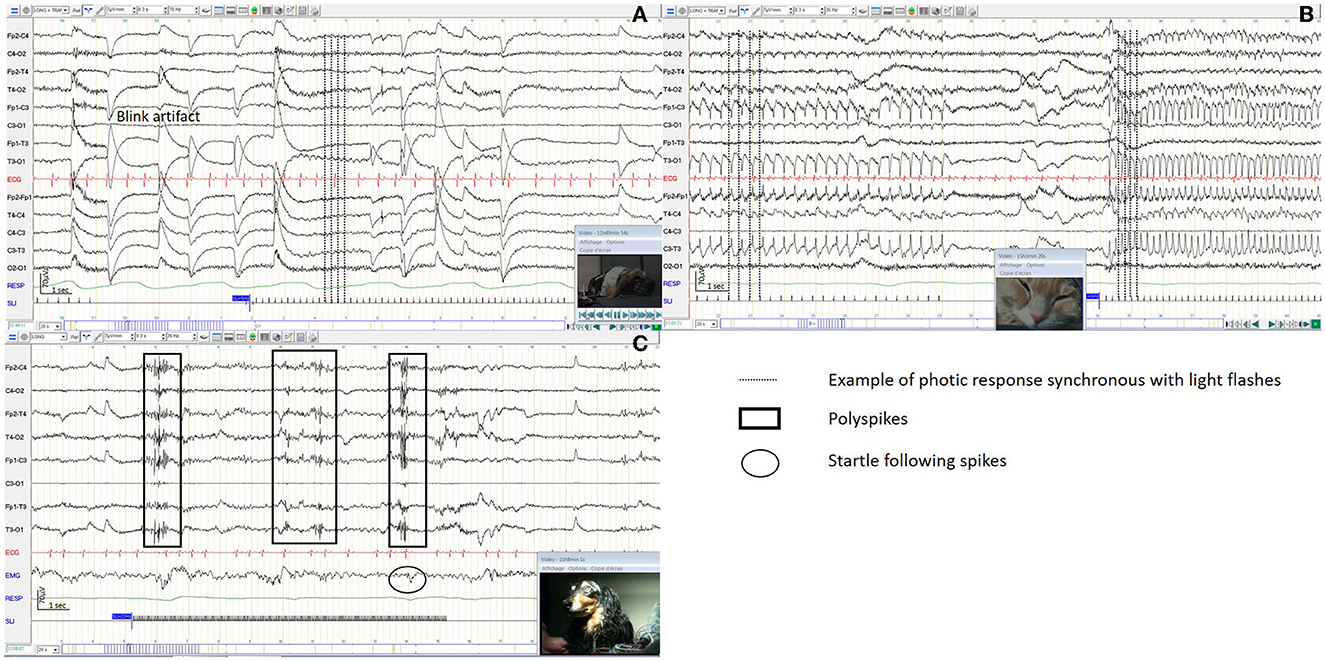 Figura 9. Reactividad a la estimulación fótica intermitente en un EEG de perro (A), en un EEG de gato (B), con complejos de polispike en un EEG de perro (C).
Figura 9. Reactividad a la estimulación fótica intermitente en un EEG de perro (A), en un EEG de gato (B), con complejos de polispike en un EEG de perro (C).
3.4.2.2 Otras tareas de estimulación
Durante la estimulación con alimentos con cinco perros, dos perros presentaron evento clínico paroxístico, incluyendo uno epiléptico y otro no epiléptico. Durante la estimulación con sonidos con tres perros y un gato, todos presentaron evento clínico paroxístico. En el EEG se observaron descargas epilépticas simultáneamente con evento clínico paroxístico en un perro y en un gato.
3.4.3 Interpretación electroclínica
Ningún animal presentó crisis epilépticas tónico-clónicas generalizadas durante los registros de EEG. Sin embargo, 37 animales mostraron síntomas sugestivos de crisis epilépticas, como mioclonías localizadas en la cara, extremidades o tronco, con un amplio rango de intensidad como temblores, movimientos bruscos o sobresaltos o alteraciones en la conciencia o signos neuroconductuales como escalofríos y polipnea (41). Entre estos animales, el 75,7% (28/37) presentó grafoelementos patológicos concomitantes, el 59,5% (22/37) presentó patrones epilépticos (37) (Figura 10) y el 16,2% (6/37) mostró otros grafoelementos patológicos, como ondas trifásicas y descargas periódicas, sugestivas de encefalopatía. Dieciséis punto dos por ciento (6/37) de los animales presentaron manifestaciones paroxísticas no seguidas de anomalías en el EEG, descartando una causa epiléptica. El 8,10 por ciento (3/37) de los animales presentaban síntomas clínicos, pero los artefactos en el trazo del EEG dificultaban la interpretación. Además, 9 EEG mostraron patrones epilépticos o convulsivos sin signos clínicos durante eventos eléctricos.
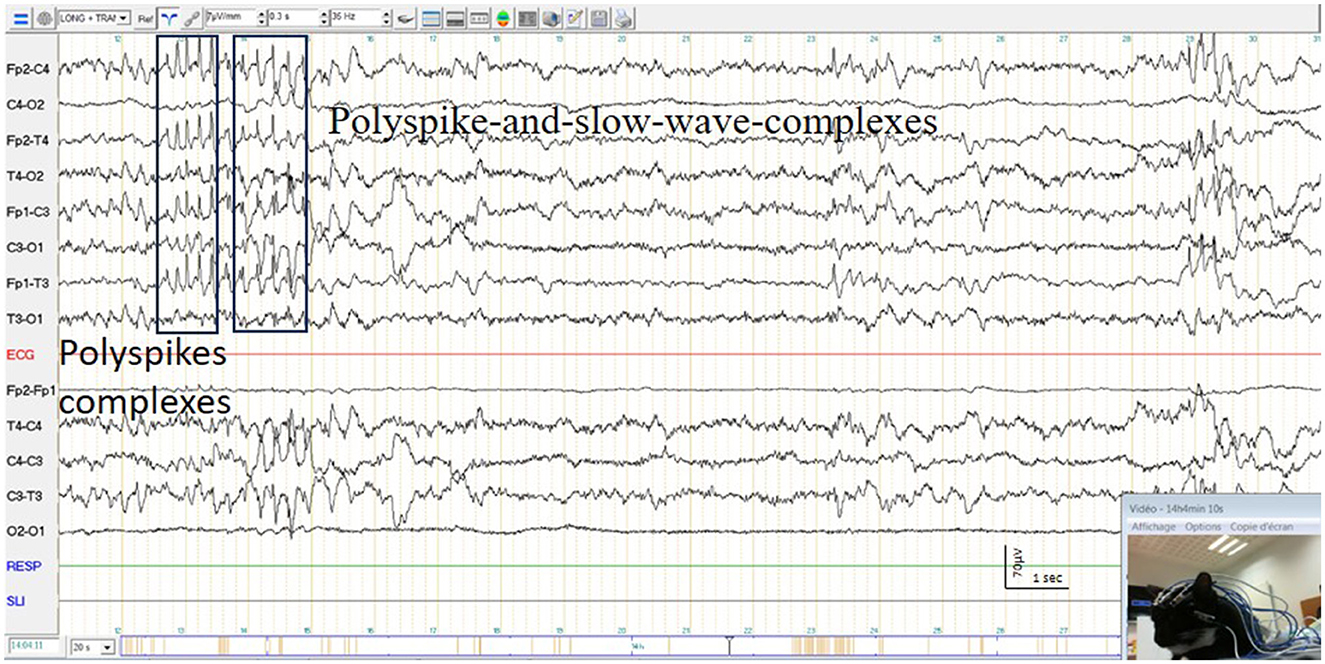 Figura 10. Complejos de Polyspike y complejos de Polyspike y de onda lenta y espasmos simultáneos de la cara de un gato.
Figura 10. Complejos de Polyspike y complejos de Polyspike y de onda lenta y espasmos simultáneos de la cara de un gato.
Entre los 136 animales no control y no tranquilizados, 27,2% (37/136) presentaron signos clínicos durante el examen y 25% (34/136) de los EEG proporcionaron información diagnóstica. Además, el 6,6% (9/136) de los EEG mostraron patrones epilépticos o convulsivos sugestivos de epilepsia sin signos clínicos (37). Así, el EEG fue informativo en el 31,6% (43/136) de los pacientes, a pesar de la inclusión de una población muy variable (Tabla 2).
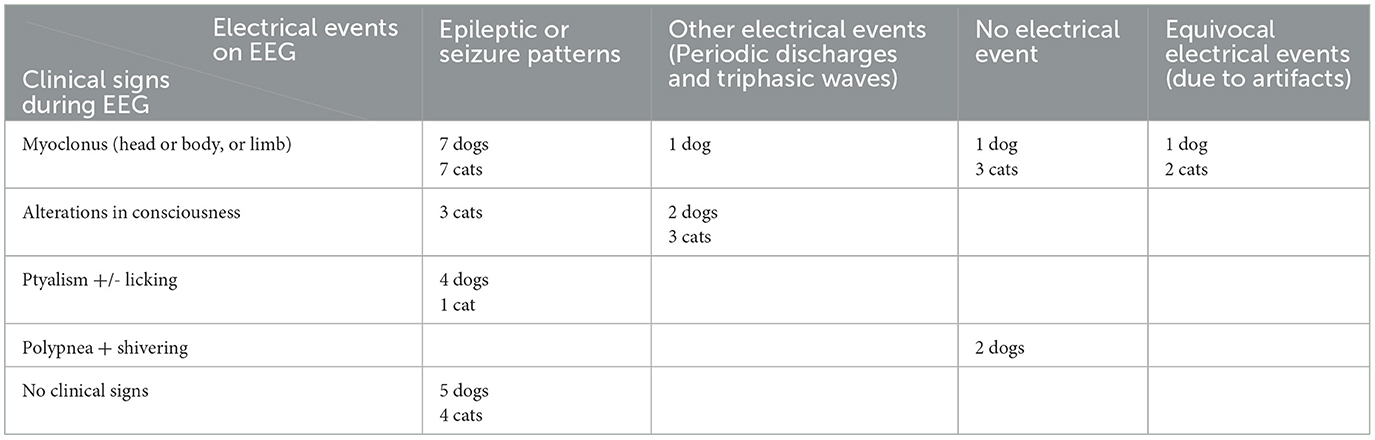 Tabla 2. Correlaciones entre los patrones clínicos y eléctricos observados durante el EEG según la literatura (37).
Tabla 2. Correlaciones entre los patrones clínicos y eléctricos observados durante el EEG según la literatura (37).
4 Discusión y conclusión
El objetivo de este trabajo fue proponer un método que facilitara el uso del EEG en la práctica veterinaria para uso rutinario, adaptado a las limitaciones específicas del animal respetando su bienestar, de modo que pudiera observar la función cerebral y los trastornos en la situación más fisiológica posible. Hemos logrado realizar exámenes EEG en 150 perros y gatos de diversos tamaños y conformaciones en un entorno clínico, sin necesidad de anestesia en el 94% de los casos. Los gatos estaban particularmente tranquilos durante el examen, y el hecho de que pudieran permanecer en su caja de transporte abierta o cubierta fue beneficioso para su relajación. La presencia del dueño y la posibilidad de tumbarse en su propia cesta ayudaba mucho a los perros a relajarse. Para los animales más agitados, el dueño a veces se acostaba junto a su animal o lo tomaba en su regazo. La gestión del ruido ambiental era particularmente importante, ya que algunos preferían el silencio y otros un ruido de fondo monótono como el de una discusión. También nos preocupamos de ser pocos en número en la sala, colocándonos lejos del animal, en una posición sentada, tranquila y apartando la mirada del animal y orientada hacia la pantalla de la cámara, siendo lo menos intervencionistas posible y pacientes.
Nuestro estudio permitió describir el desempeño del EEG sin necesidad de anestesia o sedación, entrenamiento médico o reclutamiento voluntario (24, 35, 42-44), en una amplia muestra de perros y gatos. Hasta donde sabemos, no se ha realizado ningún estudio sobre EEG sin anestesia en gatos sanos o enfermos antes de este. El uso de electrodos de superficie y la posibilidad de montarlos en un sistema de retención nos dio una ventaja real sobre el uso de agujas al poder ofrecer este examen a cualquier animal que muestre signos de disfunción encefálica, sea cual sea el temperamento del animal y con la plena confianza y aval del propietario. Este último podría incluso ayudar con el EEG, tranquilizando a su animal, ayudando con la configuración del sistema en animales que exhibieron una actitud particularmente cautelosa hacia el veterinario, proporcionando información sobre los elementos desencadenantes de las convulsiones y validando la concordancia de las convulsiones observadas durante el examen y en el hogar.
Los electrodos de superficie no son invasivos, son cómodos, proporcionan exámenes de EEG de alta calidad y se utilizan ampliamente en medicina humana. Por lo tanto, optamos por electrodos de superficie en lugar de electrodos de aguja, pero tuvimos que considerar un sistema de sujeción que permitiera colocarlos en la cabeza del animal. Este debía ser capaz de asegurar un posicionamiento simétrico y constante en relación con el relieve óseo del cráneo del animal, sea cual sea su conformación. Probamos 2 sistemas de sujeción, cada uno compatible con 1 tipo de perno o copa de electrodo de superficie. Uno consistía en correas elásticas colocadas alrededor de la cabeza del animal. Estas correas se perforaron cada 1,5 cm, lo que permitió seleccionar los orificios de inserción del electrodo del perno de acuerdo con el relieve óseo. El otro consistía en un sistema que se enhebraba a través de la cabeza del animal, y se ofrecía en 7 tamaños para adaptarse a las diferentes conformaciones de los animales. Los electrodos de copa estaban equipados con cubiertas para que pudieran engancharse a la tapa. Esto nos permitió comparar dos enfoques: el primero con un sistema que permite la colocación libre de los electrodos, pero cuya instalación es tediosa, y el segundo con un sistema más restringido, pero de rápida instalación. El segundo sistema es similar a las tapas precableadas disponibles para los humanos.
Nos preocupamos por obtener exámenes de buena calidad para poder interpretar los trazos con la mayor precisión posible. Para ello, se utilizaron criterios de evaluación y se aseguró de que la calidad de los trazados obtenidos fuera equivalente a la de otros métodos utilizados en medicina veterinaria. También comprobamos que esta calidad se ajustaba a las recomendaciones publicadas para la realización de EEG en medicina humana (2-6).
Las impedancias obtenidas fueron inferiores a 20 kΩ en el 98,8% de los EEG caninos y en el 97,6% de los electroencefalogramas de gato, con mejores resultados con electrodos de copa, que obtuvieron impedancias inferiores a 10 kΩ para más del 80% de los electrodos. Estos valores de impedancia se alinean con los reportados en la literatura, que van de 5 a 30 kΩ para electrodos de aguja en perros (22-24, 44-46) y gatos (47), y de 5 a 15 kΩ para electrodos de copa (23, 35) y con las recomendaciones de medicina humana de que los valores de impedancia para los electrodos de superficie sean inferiores a 10 kΩ (4, 6).
Las derivaciones observadas en el montaje longitudinal se determinan para cada hemisferio entre los electrodos frontal y central, central y occipital, frontal y temporal y temporal y occipital, y se denominan canales. La tasa de canales utilizables supera el 93% para ambas especies, ya que los demás canales se ven afectados por la isosincronía ligada a la proximidad de los electrodos o a la difusión en gel entre dos electrodos. Esta tasa de isosincronía del 5,9% se acerca a la tasa de isosincronía del 5,5% obtenida con electrodos de aguja en el EEG de perros, con la misma observación de que la isosincronía fue más frecuente en perros más pequeños (45). No hemos encontrado valores de incidencia de isosincronía en medicina humana, pero está bien descrita. En la investigación médica, los electrodos secos se desarrollaron para eliminar la necesidad de gel para evitar el problema de la isosincronía y ahorrar tiempo. Independientemente de las tecnologías utilizadas, las impedancias de estos electrodos secos son más altas que las de los electrodos de gel, y para algunos, especialmente los electrodos sin contacto, la señal eléctrica muy débil debe amplificarse directamente a nivel del electrodo, lo que los hace más pesados y voluminosos (48-50). En medicina humana, los electrodos de gel siguen siendo el estándar de oro (6, 50). Los electrodos secos están menos estudiados en medicina veterinaria. Se han estudiado electrodos poliméricos con un recubrimiento de plata/cloruro de plata (Ag/AgCl) y electrodos metálicos chapados en oro recubiertos con sulfonato de poliestireno (3,4-etilendioxitiofeno) (PEDOT:PSS) como sensores de ECG en perros (51, 52). En un estudio no publicado se han utilizado electrodos de EEG PressOn™ y electrodos de EEG secos accionados por resorte, pero la calidad de las señales de EEG obtenidas sigue siendo inferior a las registradas por los electrodos de aguja en el mismo estudio (53). Por lo tanto, sugerimos la utilización de electrodos de gel en medicina veterinaria mientras se monitorean de cerca los avances potenciales que la investigación y el desarrollo de electrodos secos apropiados podrían producir.
Nuestro objetivo fue evaluar el impacto de los artefactos, que son inevitablemente más prevalentes durante los registros de EEG sin anestesia. En consecuencia, se buscó identificar claramente estos artefactos, evaluar su grado de influencia en el rastro y determinar la duración del examen requerido para obtener un rastro interpretable de 20 minutos, de acuerdo con las recomendaciones para el EEG de rutina en medicina humana (6). Hemos reconocido claramente artefactos técnicos y fisiológicos similares a los descritos en medicina humana (38) y veterinaria (23, 45), además de los específicos originados en la situación de examen sin anestesia y técnicas de estimulación como la ingesta de alimentos. La descripción detallada de estos artefactos aún no se publicará en un artículo futuro. Sin embargo, a pesar de estos artefactos, el 75% de los EEG de perros y el 83% de los EEG de gatos fueron legibles durante más del 50% de su duración, con un tiempo medio de registro de 40 minutos en ambas especies. Por lo tanto, los trazados de EEG de más de 40 minutos pueden proporcionar datos suficientes para ser médicamente relevantes con un impacto mínimo de los artefactos.
El reconocimiento e identificación de los ritmos fisiológicos normales de vigilia, somnolencia y sueño es una condición necesaria imprescindible para poder leer un EEG. Nos pareció importante poder identificarlos claramente utilizando electrodos de superficie en un contexto sin anestesia. Los ritmos fisiológicos descritos en la literatura (33-36) para los electrodos de espárrago y copa se visualizaron en ambas especies, independientemente de la conformación, el sexo o la edad. La somnolencia, observada en el 84% de los EEG de perros y en el 82% de los EEG de gatos con electrodos de copa, también sirve como marcador de buena tolerancia y bienestar del animal durante el registro.
El EEG de rutina en medicina humana incluye el uso de dos métodos provocativos para la inducción de convulsiones: hiperventilación e IPS. La hiperventilación no es posible en animales, así como en niños pequeños, ya que requiere que el paciente realice voluntariamente respiraciones profundas. Por lo tanto, nos centramos en IPS con un protocolo de destellos de frecuencia de 3-5-7-10-13-15-17-20-25-30-35-40-45-50 Hz. Los protocolos IPS sugeridos en los artículos veterinarios son variables, y ningún argumento favorece a uno sobre los otros (44, 46, 47, 54, 55). Las recomendaciones recientes en medicina humana sugieren realizar destellos de frecuencia de 1-2-8-10-15-18-20-25-40-50-60 Hz (6) sin que podamos determinar si este protocolo sería el mejor para su uso en mascotas. También se indica que la IPS para humanos debe realizarse con ambos ojos cerrados y ojos abiertos. Sin embargo, es difícil solicitar esto a los animales, y cerrar manualmente los ojos puede provocar movimientos que generen artefactos. Sin embargo, hemos observado que los animales cierran y abren los ojos de forma natural durante el IPS. Por lo tanto, encontramos que la IPS era una técnica de estimulación muy bien tolerada y fácil de usar en animales despiertos.
En la gran proporción de los EEG de gato (85% de los casos), se observaron grafoelementos de alta amplitud de forma sincrónica y con la misma frecuencia que los destellos de luz, idénticos en apariencia a la conducción fótica descrita en algunos humanos. Esta particularidad en gatos ha sido descrita previamente durante exámenes bajo anestesia (47), pero se desconoce su significado, así como sus implicaciones médicas en gatos que no muestran este entrenamiento. En perros, este fenómeno se ha observado en el 11% de los casos y también ha sido descrito previamente (56).
Se observaron descargas epilépticas durante la IPS en seis perros, asociadas con respuestas mioclónicas en cinco perros. En el caso de dos perros, las anomalías solo se observaron durante el IPS, lo que justifica su uso en el EEG canino.
Tal y como se recomendó (6) y dado que los animales no estaban anestesiados, también se realizaron estimulaciones que se sabe que provocan convulsiones según lo informado por el propietario, como ruidos o estímulos alimentarios. Observamos descargas epilépticas en un EEG de perro después de una comida y en EEG de un perro y un gato después de la emisión de ruido. Nuestro método EEG sin anestesia permite confirmar las epilepsias reflejas, documentadas tanto en perros (7, 57, 58) como en gatos (59).
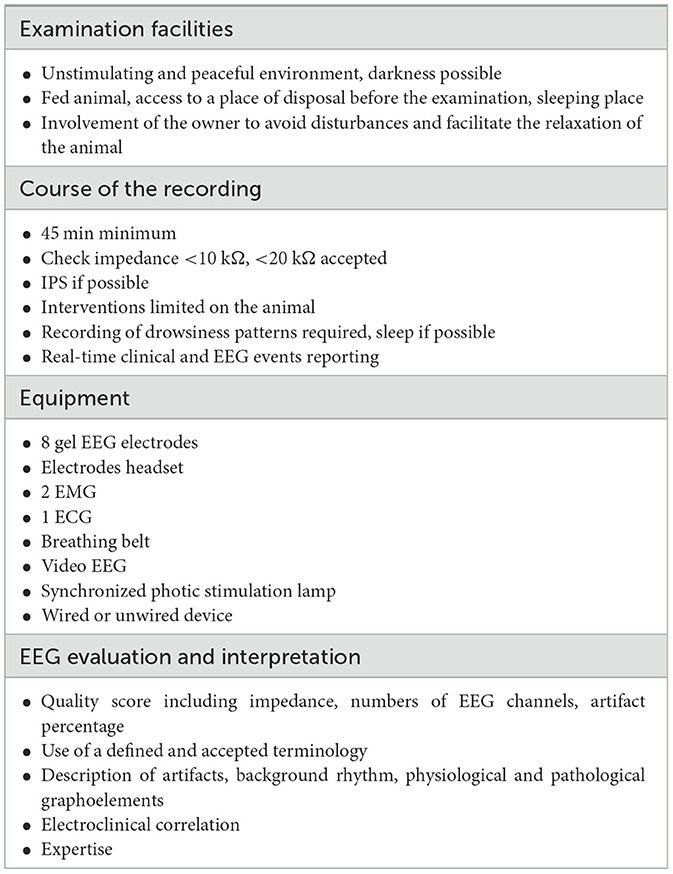
Nuestra población incluyó animales con manifestaciones paroxísticas compatibles con crisis epilépticas, episodios de discinesia o trastornos compulsivos, y otros sin manifestaciones paroxísticas pero con estados confusionales o afectación vestibular. Dentro de esta gran población, el 31,6% de los registros de EEG permitieron establecer o aclarar diagnósticos de diferentes maneras: estableciendo una correlación entre los síntomas clínicos y las anomalías eléctricas observadas en el EEG, demostrando la ausencia de anomalías eléctricas durante el evento clínico paroxístico o revelando descargas epilépticas interictales. Un estudio reporta una tasa de EEG diagnóstica en condiciones ambulatorias sin anestesia del 68% (43/63) en una población de perros con antecedentes de eventos paroxísticos (43). Sin embargo, la comparación de nuestros resultados es difícil porque incluimos animales con antecedentes de eventos paroxísticos, algunos de los cuales fueron tratados con fármacos antiepilépticos, y animales con encefalopatía o trastornos vestibulares. Algunos estudios reportan descargas epilépticas en hasta el 50% de los perros sanos bajo anestesia (27, 54). En nuestro estudio, ninguno de los cinco perros del grupo de control presentó ninguna anomalía en el EEG. Esto pone de manifiesto la necesidad de utilizar protocolos estandarizados, superando la variabilidad asociada a los protocolos anestésicos, los electrodos y los criterios de interpretación del EEG para realizar exámenes tanto en animales sanos como enfermos. Estos resultados nos han llevado a desarrollar las primeras pautas para el registro rutinario del EEG (Tabla 3) de forma fácil, rápida y reproducible. Gracias a esta metodología, el EEG de rutina, realizado de forma no invasiva y sin anestesia, pudo ofrecerse antes de la resonancia magnética y el análisis del líquido cefalorraquídeo, tal y como recomienda un informe de consenso del Grupo de Trabajo Internacional sobre Epilepsia Veterinaria (21). Puede permitir el diagnóstico, así como el manejo terapéutico adecuado de la disfunción cerebral y la estabilización de la condición del animal, lo que permite una investigación exhaustiva de cualquier causa estructural en mejores condiciones.
Nuestro estudio es un paso prometedor hacia el uso generalizado del EEG en la práctica común para el diagnóstico neurológico con un protocolo fácil y no invasivo que utiliza electrodos de superficie y sin anestesia. Este protocolo está especialmente indicado para perros y gatos, para los que el EEG en la práctica clínica no está en absoluto desarrollado y permitiría la caracterización electroclínica de las epilepsias.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
Los estudios en animales fueron aprobados por el Comité de Ética de VetAgro Sup (Nº 18). Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
EL: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Visualización, Redacción, borrador original, Redacción, revisión y edición. HP: Adquisición de fondos, administración de proyectos, recursos, supervisión, redacción, revisión y edición. SBl: Investigación, Metodología, Redacción, revisión y edición. TT: Investigación, Metodología, Redacción, Revisión y Edición. NV: Investigación, Metodología, Redacción, Revisión y Edición. SBe: Conceptualización, Análisis formal, Metodología, Supervisión, Validación, Redacción, revisión y edición. CE: Conceptualización, Análisis formal, Investigación, Metodología, Supervisión, Validación, Redacción, revisión y edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Reconocimientos
Nos gustaría agradecer a la Universidad de Caen y a VetAgro Sup por el apoyo de este trabajo y a Amset Medical por el equipo de EEG.
Conflicto de intereses
EL era empleado de AMSET MEDICAL. EL es el solicitante de la patente No. FR3101533.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Scheffer IE, Berkovic S, Capovilla G, Connolly MB, French J, Guilhoto L, et al. Clasificación ILAE de las epilepsias: documento de posición de la Comisión ILAE de Clasificación y Terminología. Epilepsia. (2017) 58:512–21. doi: 10.1111/epi.13709
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Nuwer MR, Comi G, Emerson R, Fuglsang-Frederiksen A, Guérit JM, Hinrichs H, et al. Estándares IFCN para el registro digital de EEG clínico. Electroencefalograma Clin Neurophysiol. (1998) 106:259–61. doi: 10.1016/S0013-4694(97)00106-5
3. Flink R, Pedersen B, Guekht AB, Malmgren K, Michelucci R, Neville B, et al. Pautas para el uso de la metodología EEG en el diagnóstico de la epilepsia. Acta Neurol Scand. (2002) 106:1–7. doi: 10.1034/j.1600-0404.2002.01361.x
4. Sociedad Americana de Neurofisiología Clínica. Directriz 2: Normas técnicas mínimas para la electroencefalografía pediátrica. J Clin Neurophysiol Off Publ Am Electroencephalogr Soc. (2006) 23:92–6. doi: 10.1097/00004691-200604000-00003
5. André-Obadia N, Sauleau P, Cheliout-Heraut F, Convers P, Debs R, Eisermann M, et al. Recommandations françaises sur l’électroencéphalogramme. Neurophysiol Clin Neurophysiol. (2014) 44:515–612. doi: 10.1016/j.neucli.2014.10.001
6. Peltola ME, Leitinger M, Halford JJ, Vinayan KP, Kobayashi K, Pressler RM, et al. EEG de rutina y sueño: estándares mínimos de registro de la Federación Internacional de Neurofisiología Clínica y la Liga Internacional Contra la Epilepsia. Epilepsia. (2023) 64:602–18. doi: 10.1111/epi.17448
7. Tomás WB. Epilepsia idiopática en perros. Vet Clin North Am Small Anim Pract. (2000) 30:183–206. doi: 10.1016/S0195-5616(00)50009-6
8. Heske L, Nødtvedt A, Jäderlund KH, Berendt M, Egenvall A. Estudio de cohorte de epilepsia en 665.000 perros asegurados: incidencia, mortalidad y supervivencia tras el diagnóstico. Veterinario J. (2014) 202:471–6. doi: 10.1016/j.tvjl.2014.09.023
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Kearsley-Fleet L, O’Neill DG, Volk HA, Church DB, Brodbelt DC. Prevalencia y factores de riesgo de la epilepsia canina de origen desconocido en el Reino Unido. Rec. Veterinario (2013) 172:338. doi: 10.1136/vr.101133
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Hülsmeyer VI, Fischer A, Mandigers PJJ, DeRisio L, Berendt M, Rusbridge C, et al. Comprensión actual del Grupo de Trabajo Internacional sobre Epilepsia Veterinaria de la epilepsia idiopática de origen genético o sospechado genético en perros de raza pura. BMC Vet Res. (2015) 11:175. doi: 10.1186/s12917-015-0463-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Berendt M, Gulløv CH, Christensen SLK, Gudmundsdottir H, Gredal H, Fredholm M, et al. Prevalencia y características de la epilepsia en las variantes de pastor belga Groenendael y Tervueren nacidas en Dinamarca entre 1995 y 2004. Acta Vet Scand. (2008) 50:51. doi: 10.1186/1751-0147-50-51
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Berendt M, Gulløv CH, Fredholm M. Epilepsia focal en el pastor belga: evidencia de herencia mendeliana simple. J Pequeña Anim Pract. (2009) 50:655–61. doi: 10.1111/j.1748-5827.2009.00849.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Famula TR, Oberbauer AM, Brown KN. Heredabilidad de las crisis epilépticas en el tervueren belga. J Pequeña Anim Pract. (1997) 38:349–52. doi: 10.1111/j.1748-5827.1997.tb03483.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Hülsmeyer V, Zimmermann R, Brauer C, Sauter-Louis C, Fischer A. Epilepsia en Border Collies: manifestación clínica, resultado y modo de herencia. J Veterinario Pasante Med. (2010) 24:171–8. doi: 10.1111/j.1939-1676.2009.0438.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Berendt M, Gredal H, Pedersen LG, Alban L, Alving J. Un estudio transversal de la epilepsia en Labradores Retriever daneses: prevalencia y factores de riesgo seleccionados. J Veterinario Pasante Med. (2002) 16:262–8. doi: 10.1111/j.1939-1676.2002.tb02367.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Casal ML, Munuve RM, Janis MA, Werner P, Henthorn PS. Epilepsia en perros lobo irlandeses. J Veterinario Pasante Med. (2006) 20:131–5. doi: 10.1111/j.1939-1676.2006.tb02832.x
17. Schriefl S, Steinberg TA, Matiasek K, Ossig A, Fenske N, Fischer A. Clasificación etiológica de las convulsiones, señalización, signos clínicos y resultados en gatos con trastornos convulsivos: 91 casos (2000-2004). J Am Vet Med Assoc. (2008) 233:1591–7. doi: 10.2460/javma.233.10.1591
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. O’Neill DG, Phillipps SA, Egan JR, Brodbelt D, Church DB, Volk HA. Epidemiología de los trastornos convulsivos recurrentes y la epilepsia en gatos bajo atención veterinaria primaria en el Reino Unido. J Veterinario Pasante Med. (2020) 34:2582–94. doi: 10.1111/jvim.15881
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Wahle AM, Brühschwein A, Matiasek K, Putschbach K, Wagner E, Mueller RS, et al. Caracterización clínica de la epilepsia de causa desconocida en gatos. J Veterinario Pasante Med. (2014) 28:182–8. doi: 10.1111/jvim.12250
20. Berendt M, Farquhar RG, Mandigers PJJ, Pakozdy A, Bhatti SFM, De Risio L, et al. Informe de consenso del Grupo de Trabajo Internacional sobre la Epilepsia Veterinaria sobre la definición, clasificación y terminología de la epilepsia en los animales de compañía. BMC Vet Res. (2015) 11:182. doi: 10.1186/s12917-015-0461-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. De Risio L, Bhatti S, Muñana K, Penderis J, Stein V, Tipold A, et al. Propuesta de consenso del Grupo de Trabajo Internacional sobre Epilepsia Veterinaria: Enfoque diagnóstico de la epilepsia en perros. BMC Vet Res. (2015) 11:148. doi: 10.1186/s12917-015-0462-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Pellegrino F, Sica R. Técnica de registro electroencefalográfico canino: hallazgos en perros normales y epilépticos. Clin Neurophysiol Off J Int Fed Clin Neurophysiol. (2004) 115:477–87. doi: 10.1016/S1388-2457(03)00347-X
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. James FMK, Allen DG, Bersenas AME, Grovum WL, Kerr CL, Monteith G, et al. Investigación del uso de tres electrodos electroencefalográficos para el registro electroencefalográfico a largo plazo en perros despiertos y sedados. Am J Vet Res. (2011) 72:384–90. doi: 10.2460/ajvr.72.3.384
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. James FMK, Cortez MA, Monteith G, Jokinen TS, Sanders S, Wielaender F, et al. Utilidad diagnóstica de la videoelectroencefalografía inalámbrica en perros no sedados. J Veterinario Pasante Med. (2017) 31:1469–76. doi: 10.1111/jvim.14789
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Hasegawa D. Técnicas diagnósticas para detectar la zona epileptógena: análisis fisiopatológico y prequirúrgico de la epilepsia en perros y gatos. Veterinario J. (2016) 215:64–75. doi: 10.1016/j.tvjl.2016.03.005
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Tourai K, Senba H, Sasaki N, Tokuriki M, Ohashi F, Takeuchi A, et al. EEG del desarrollo del perro beagle bajo sedación con xilacina. Nihon Juigaku Zasshi Jpn J Vet Sci. (1985) 47:459–63. doi: 10.1292/jvms1939.47.459
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Utsugi S, Saito M, Sato T, Kunimi M. Relación entre las descargas epileptiformes interictales bajo sedación con medetomidina y las convulsiones clínicas en la epilepsia idiopática canina. Rec. Veterinario (2019) 187:67. doi: 10.1136/vr.104947
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Berendt M, Høgenhaven H, Flagstad A, Dam M. Electroencefalografía en perros con epilepsia: similitudes entre los hallazgos humanos y caninos. Acta Neurol Scand. (1999) 99:276–83. doi: 10.1111/j.1600-0404.1999.tb00676.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Luca J, McCarthy S, Parmentier T, Hazenfratz M, Linden AZ, Gaitero L, et al. Estudio del uso y las técnicas de electroencefalografía para perros. Front Vet Sci. (2023) 10:1198134. doi: 10.3389/fvets.2023.1198134
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Acharya JN, Hani AJ, Thirumala PD, Tsuchida TN. Guía 3 de la Sociedad Americana de Neurofisiología Clínica: una propuesta de montajes estándar para ser utilizados en EEG clínico. J Clin Neurophysiol. (2016) 33:312. doi: 10.1097/WNP.000000000000000317
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Acharya JN, Acharya VJ. Descripción general de los montajes de EEG y principios de localización. J Clin Neurophysiol. (2019) 36:325. doi: 10.1097/WNP.0000000000000000538
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Lyon E. Dispositif de recueil des signaux électrophysiologiques pour la tête d’un animal. FR3101533 de Patentes de Francia (2021).
33. Lucas EA, Powell EW, Murphree OD. Patrones basales de sueño-vigilia en el perro de muestra. Physiol Behave. (1977) 19:285–91. doi: 10.1016/0031-9384(77)90340-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Wauquier A, Verheyen JL, Van Den Broeck WAE, Janssen PAJ. Análisis visual e informático de los patrones de sueño-vigilia de 24 h en el perro. Electroencefalograma Clin Neurophysiol. (1979) 46:33–48. doi: 10.1016/0013-4694(79)90047-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Kis A, Szakadát S, Kovács E, Gácsi M, Simor P, Gombos F, et al. Desarrollo de una técnica de polisomnografía no invasiva para perros (Canis familiaris). Physiol Behave. (2014) 130:149–56. doi: 10.1016/j.physbeh.2014.04.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Bódizs R, Kis A, Gácsi M, Topál J. El sueño en el perro: relevancia comparativa, conductual y traslacional. Curr Opin Behav Sci. (2020) 33:25–33. doi: 10.1016/j.cobeha.2019.12.006
37. Kane N, Acharya J, Beniczky S, Caboclo L, Finnigan S, Kaplan PW, et al. Un glosario revisado de los términos más utilizados por los electroencefalógrafos clínicos y una propuesta actualizada para el formato de informe de los hallazgos del EEG. Revisión 2017. Clin Neurophysiol Pract. (2017) 2:170–85. doi: 10.1016/j.cnp.2017.07.002
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Gelisse P, Crespel A. Atlas de Electroencefalografía—Volumen 1 : EEG despierto y dormido. 3ED : Procedimientos y artefactos de activación. John Libbey Eurotexto.
39. Wickham H. ggplot2: Gráficos elegantes para el análisis de datos. Nueva York, NY: Springer-Verlag (2016).
40. Ekenstedt KJ, Crosse KR, Risselada M. Braquicefalia canina: anatomía, patología, genética y bienestar. J Comp Pathol. (2020) 176:109–15. doi: 10.1016/j.jcpa.2020.02.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Packer R, Berendt M, Bhatti S, Charalambous M, Cizinauskas S, De Risio L, et al. Concordancia interobservador de la semiología de eventos paroxísticos caninos y felinos y clasificación por especialistas y no especialistas en neurología veterinaria. BMC Vet Res. (2015) 11:39. doi: 10.1186/s12917-015-0356-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Kujala MV, Törnqvist H, Somppi S, Hänninen L, Krause CM, Vainio O, et al. Reactividad de las oscilaciones cerebrales de los perros a estímulos visuales medida con electroencefalografía no invasiva. PLoS UNO. (2013) 8:e61818. doi: 10.1371/journal.pone.0061818
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Parmentier T, Monteith G, Cortez MA, Wielaender F, Fischer A, Jokinen TS, et al. Efecto de la anestesia general previa o de la sedación y de los fármacos anticonvulsivos sobre la utilidad diagnóstica de la videoelectroencefalografía inalámbrica en perros. J Veterinario Pasante Med. (2020) 34:1967–74. doi: 10.1111/jvim.15856
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Wielaender F, Sarviaho R, James F, Hytönen MK, Cortez MA, Kluger G, et al. Epilepsia mioclónica generalizada con fotosensibilidad en perros jóvenes causada por una GTPasa 1 defectuosa de la familia DIRAS. Proc Natl Acad Sci USA. (2017) 114:2669–74. doi: 10.1073/pnas.1614478114
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Cauduro A, Dondi M, Favole P, Opreni M, Simonetto LA, Lorenzo V. Artefactos durante el registro electroencefalográfico interictal a corto plazo en perros. J Am Anim Hosp Assoc. (2017) 53:80–9. doi: 10.5326/JAAHA-MS-6486
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Brauer C, Kästner SBR, Rohn K, Schenk HC, Tünsmeyer J, Tipold A. Registros electroencefalográficos en perros que sufren de epilepsia idiopática y sintomática: valor diagnóstico de los protocolos de EEG interictal de corta duración complementados por dos técnicas de activación. Veterinario J. (2012) 193:185–92. doi: 10.1016/j.tvjl.2011.10.006
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Brauer C, Kästner SBR, Kulka AM, Tipold A. Procedimientos de activación en los electroencefalogramas de gatos sanos y epilépticos bajo anestesia con propofol. Rec. Veterinario (2012) 170:360. doi: 10.1136/vr.100113
Resumen de PubMed | Texto completo de Crossref | Google Académico
48. Godin DT, Parker PA, Scott RN. Características acústicas de los electrodos de superficie de acero inoxidable. Med Biol Eng Comput. (1991) 29:585–90. doi: 10.1007/BF02446089
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Searle A, Kirkup L. Una comparación directa de electrodos de registro bioeléctricos húmedos, secos y aislantes. Physiol Meas. (2000) 21:271. doi: 10.1088/0967-3334/21/2/307
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. López-Gordo MA, Sánchez-Morillo D, Valle FP. Electrodos de EEG secos. Sensores. (2014) 14:12847–70. doi: 10.3390/s140712847
51. Virtanen J, Leivo J, Vehkaoja A, Somppi S, Tornqvist H, Fiedler P, et al. Rendimiento de los electrodos de contacto seco en ECG canino. En: ACI’18: Actas de la Quinta Conferencia Internacional sobre Interacción Animal-Ordenador. 4–6 de diciembre de 2018. Atlanta, Georgia; Nueva York, NY: ACM (2018). págs. 1-5.
52. Brugarolas R, Latif T, Dieffenderfer J, Walker K, Yuschak S, Sherman BL, et al. Sistemas de sensores de frecuencia cardíaca portátiles para el monitoreo inalámbrico de la salud canina. IEEE Sens J. (2016) 16:3454–64. doi: 10.1109/JSEN.2015.2485210
53. Hazenfratz M. Viabilidad de electrodos de superficie seca para electroencefalografía (EEG) en perros. (Tesis), Universidad de Guelph, Guelph, ON, Canadá (2021).
54. Wrzosek M, Ives JR, Karczewski M, Dziadkowiak E, Gruszka E. Relación entre las descargas epileptiformes y la actividad de fondo en el análisis visual de exámenes electroencefalográficos en perros con convulsiones de diferentes etiologías. Veterinario J Lond Engl. (2017) 222:41–51. doi: 10.1016/j.tvjl.2017.03.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
55. Holliday TA, Cunningham JG, Gutnick MJ. Estudios clínicos y electroencefalográficos comparativos de la epilepsia canina. Epilepsia. (1970) 11:281–92. doi: 10.1111/j.1528-1157.1970.tb03892.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
56. Holliday TA, Williams C. Electroencefalografía clínica en perros. Veterinario Neurol Neurosurg J. (1999) 1:1.
57. Shell L, Scariano R, Rishniw M. Características de las convulsiones específicas de estímulo en perros con epilepsia refleja: 43 casos (2000-2014). J Am Vet Med Assoc. (2017) 250:75–8. doi: 10.2460/javma.250.1.75
Resumen de PubMed | Texto completo de Crossref | Google Académico
58. Brocal J, Lowrie M, Wamsley G, Cauduro A, Mandigers P, Gutiérrez-Quintana R, et al. Ataques epilépticos provocados por comer en perros. J Veterinario Pasante Med. (2020) 34:1231–8. doi: 10.1111/jvim.15773
Palabras clave: EEG, video-EEG, electrodo de gel, canino, felino, epilepsia, encefalopatía
Cita: Lyon E, Pochat H, Blot S, Troupel T, Van Caenegem N, Besnard S y Escriou C (2024) Uso de la videoelectroencefalografía como examen de primera línea en neurología veterinaria: desarrollo y estandarización de la electroencefalografía en perros y gatos sin sedar. Frente. Vet. Sci. 11:1326165. doi: 10.3389/fvets.2024.1326165
Recibido: 22 de octubre de 2023; Aceptado: 08 de enero de 2024;
Publicado: 26 enero 2024.
Editado por:
Marcin Adam Wrzosek, Universidad de Ciencias Ambientales y de la Vida de Breslavia, Polonia
Revisado por:
Mihai Musteata, Universidad de Ciencias Agrícolas y Medicina Veterinaria Ion Ionescu de la Brad de Iaşi, Rumanía
Yoshihiko Yu, Investigador Independiente, Mitaka, Japón Miyoko Saito, Universidad de Azabu, Japón
Derechos de autor © 2024 Lyon, Pochat, Blot, Troupel, Van Caenegem, Besnard y Escriou. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Elsa Lyon, elsa.lyon@elyope.com
†Estos autores han contribuido por igual a este trabajo y comparten la autoría principal
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía