Validación clínica de inmunocomplejos circulantes para su uso como marcador diagnóstico de leishmaniosis canina
Validación clínica de inmunocomplejos circulantes para su uso como marcador diagnóstico de leishmaniosis canina
 Juliana Sarquis1
Juliana Sarquis1  Parodia de Nuria2
Parodia de Nuria2  Ana Montoya1
Ana Montoya1  Cristina Cacheiro-Llaguno2
Cristina Cacheiro-Llaguno2  Juan Pedro Barrera1
Juan Pedro Barrera1  Rocío Checa1
Rocío Checa1  María Ángeles Daza3
María Ángeles Daza3  Jerónimo Carnés2
Jerónimo Carnés2  Guadalupe Miró1*
Guadalupe Miró1*- 1Departamento de Sanidad Animal, Facultad de Veterinaria, Universidad Complutense de Madrid, Madrid, España
- 2Unidad de Investigación y Desarrollo de Alergia e Inmunología, LETI Pharma S.L.U., Madrid, España
- 3Servicio de Urgencias y UCI de Pequeños Animales, Hospital Veterinario Docente, Facultad de Veterinaria, Universidad Complutense de Madrid, Madrid, España
Introducción: La leishmaniosis canina (CanL) es una enfermedad sistémica que afecta a los perros. Cuando no se puede controlar la multiplicación del parásito, los perros muestran constantemente altos niveles de antígenos y anticuerpos IgG, lo que conduce a la formación de complejos inmunes circulantes (CIC). La intervención oportuna para reducir la carga parasitaria y los niveles de CIC es crucial para prevenir el daño irreversible a los órganos. Sin embargo, actualmente se carece de una prueba diagnóstica para cuantificar los niveles de CIC.
Métodos: En este estudio del mundo real, nuestro objetivo era examinar el rendimiento de un nuevo ELISA para medir los niveles de CIC en perros infectados naturalmente con Leishmania infantum. Treinta y cuatro perros fueron tratados de acuerdo con su condición clínica y seguidos durante 360 días. Antes (día 0) y después del tratamiento (días 30, 90, 180, 270 y 360), todos los perros se sometieron a un examen físico y se obtuvieron muestras de sangre para hemograma, perfil bioquímico, electroforesis de proteínas séricas e IFAT. La CIC sérica precipitada por PEG se determinó mediante ELISA.
Resultados: Nuestros resultados indican niveles más altos de CIC en perros en estadios avanzados de la enfermedad, mostrando títulos de anticuerpos más altos (p < 0,0001, r = 0,735), anemia (p < 0,0001), disproteinemia (p < 0,0001) y proteinuria (p = 0,004). Es importante destacar que los perros que respondieron bien al tratamiento exhibieron niveles de CIC en declive (p < 0,0001), mientras que en los que respondieron mal y en los que experimentaron recaídas, el CIC fue consistentemente elevado. El CIC emergió como un discriminador robusto de la recaída, con un área bajo la curva (AUC) de 0,808. El punto de corte óptimo para identificar con precisión la recaída fue una densidad óptica de 1,539.
Discusión: Nuestros hallazgos sugieren que se debe esperar una disminución de los niveles de CIC en perros que muestren una respuesta favorable al tratamiento. Por el contrario, en los perros que muestran una respuesta deficiente y recaídas clínicas recurrentes, los niveles de CIC serán altos, lo que enfatiza la necesidad de un seguimiento vigilante. Estos hallazgos sugieren que la CIC podría servir como un biomarcador valioso para la progresión de la enfermedad, la eficacia del tratamiento y la detección de recaídas en la LCAN. Nuestro estudio contribuye a mejorar los enfoques diagnósticos para CanL y subraya el potencial de la CIC como herramienta complementaria en la práctica veterinaria. A medida que avancemos, los estudios más amplios serán esenciales para confirmar estos hallazgos y establecer puntos de corte definitivos para la aplicación clínica.
1 Introducción
La leishmaniosis canina (CanL), una enfermedad zoonótica potencialmente mortal causada por un protozoo intracelular obligado, Leishmania infantum, se transmite a los seres humanos y a otros animales a través de flebótomos chupadores de sangre. Los perros se consideran el principal reservorio peridoméstico de infección (1, 2).
La leishmania puede infectar cualquier órgano, tejido o fluido biológico, determinando que los signos clínicos de la CanL son inespecíficos e incluyen letargo, pérdida de apetito, pérdida de peso, lesiones cutáneas, onicogriposis, linfadenomegalia generalizada, poliuria y polidipsia, lesiones oculares, epistaxis, cojera y otros signos clínicos menos frecuentes como vómitos y diarrea (3). Sin embargo, muchos perros no muestran signos clínicos aparentes o anomalías clínico-patológicas durante varios meses o años después de que se confirma la infección. Estos perros se definen como perros infectados clínicamente sanos. En cuanto a los perros enfermos, un sistema de clasificación propuesto por el grupo LeishVet ayuda a orientar a los profesionales en el manejo clínico de estos animales y ofrece información pronóstica (3). En este sistema, se describen cuatro estadios clínicos según la gravedad de la enfermedad en función del estado serológico, los signos clínicos y los hallazgos de laboratorio.
Después de la infección, los perros infectados y enfermos clínicamente sanos muestran diferentes respuestas inmunitarias al parásito. Los perros sanos montan una respuesta robusta Th1, que es crucial para detener la multiplicación del parásito y para la eliminación intracelular del parásito. Por el contrario, los perros enfermos muestran en su mayoría una respuesta Th2, lo que conduce a la inmunosupresión y la proliferación de parásitos (4, 5). En estos animales, los antígenos de Leishmania y los anticuerpos IgG inespecíficos se acumulan gradualmente en el torrente sanguíneo a medida que el parásito se multiplica, lo que lleva a la formación de complejos inmunes circulantes (CIC). Estas moléculas grandes se depositan en el endotelio de varios órganos, como la piel, los ojos, las articulaciones y los glomérulos renales, y causan daños graves en los órganos, a menudo irreversibles. Cuando esto ocurre, los perros pueden desarrollar poliartritis inmunomediada, vasculitis, úlceras indolentes y uveítis crónica, lo que puede conducir a la ceguera que requiere la enucleación de uno o ambos ojos. En los estadios III o IV de LeishVet, el depósito de CIC en los glomérulos renales puede conducir a una enfermedad renal crónica (ERC) con consecuencias potencialmente mortales (6-8).
El uso de antimoniales o miltefosina en combinación con alopurinol es el tratamiento estándar para la CanL. En algunos casos, los esteroides también son necesarios para controlar los signos clínicos mediados por el sistema inmunitario (9, 10). El tratamiento oportuno es vital para reducir la carga parasitaria y los niveles de CIC, y así mitigar el riesgo de daño irreversible a los órganos. Sin embargo, actualmente no existe una prueba diagnóstica para cuantificar los niveles de CIC antes y después del tratamiento. Parody et al. (11) desarrollaron un método para cuantificar los niveles séricos de CIC en perros con CanL que ha sido recientemente validado en laboratorio (12). En su trabajo, Parody et al. (11) confirmaron una clara asociación entre la progresión de la enfermedad y el aumento de los niveles de CIC, sugiriendo que el CIC podría servir como un biomarcador valioso para fines diagnósticos y también para rastrear la progresión de la enfermedad y evaluar la eficacia del tratamiento (13). Validar estos hallazgos en un estudio del mundo real es el primer paso para poner este método a disposición de los profesionales. El objetivo del presente estudio fue examinar el rendimiento de este nuevo biomarcador en un entorno clínico mediante la medición de los niveles de CIC en perros infectados naturalmente con L. infantum.
2 Materiales y métodos
2.1 Diseño del estudio
Este estudio de cohorte longitudinal se realizó en la Unidad de Enfermedades Infecciosas del Hospital Veterinario Docente de la Universidad Complutense de Madrid (UCM), Madrid, España. El protocolo del estudio fue aprobado por el Comité de Ética en Investigación de esta Universidad. Los participantes fueron perros traídos al hospital por sus dueños durante el período de mayo de 2021 a abril de 2022 para su evaluación después de un primer diagnóstico de CanL, o seguimiento para chequeos o debido a una recaída clínica. Los perros se consideraron elegibles si estaban infectados de forma natural con L. infantum [serología positiva para Leishmania mediante prueba de anticuerpos fluorescentes indirectos (IFAT >1:100, citología positiva y/o resultado positivo de PCR)] y su enfermedad se clasificó como LeishVet estadios I-IV. Antes de la inscripción, informamos a todos los propietarios de perros sobre el protocolo del estudio, incluida la opción de retirar a sus perros del estudio en cualquier momento, y obtuvimos su consentimiento por escrito.
2.2 Protocolo de estudio
Los perros se incluyeron en el estudio el día 0 (visita 1 inscripción antes del tratamiento) y posteriormente se les hizo un seguimiento durante 12 meses. El tratamiento adecuado se inició poco después de la inscripción. Las visitas a nuestro servicio se programaron para los días de inicio del tratamiento 30, 90, 180, 270 y 360 (Figura 1).
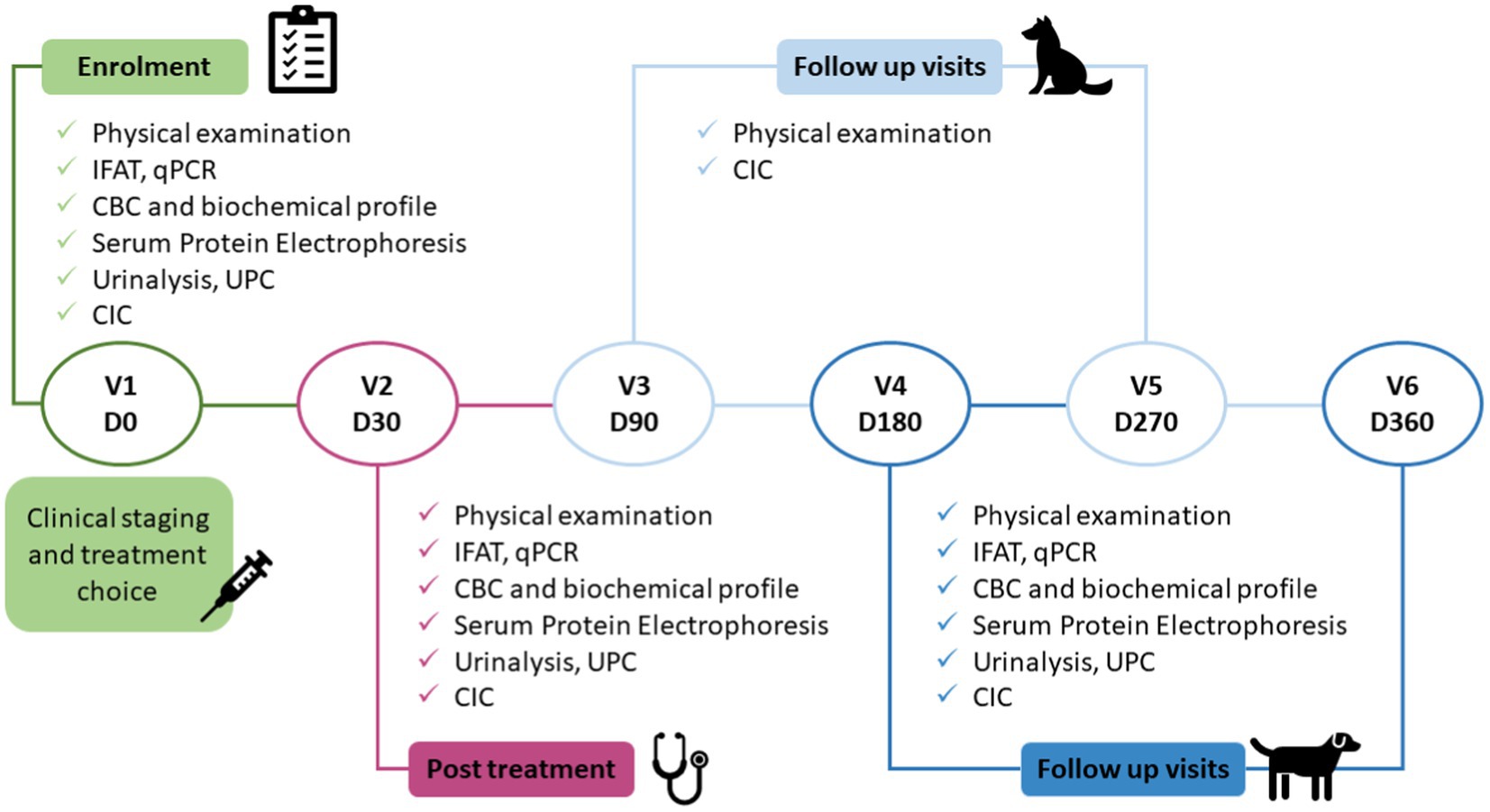 Figura 1. Protocolo del estudio. El estudio clínico consistió en seis visitas, enrolamiento (pretratamiento), después de completar 30 días de tratamiento, y cuatro visitas de seguimiento. IFAT, prueba de anticuerpos fluorescentes indirectos; Hemograma: hemograma completo; UPC: cociente proteína/creatinina urinaria; CIC: inmunocomplejos circulantes; qPCR: reacción en cadena de la polimerasa cuantitativa.
Figura 1. Protocolo del estudio. El estudio clínico consistió en seis visitas, enrolamiento (pretratamiento), después de completar 30 días de tratamiento, y cuatro visitas de seguimiento. IFAT, prueba de anticuerpos fluorescentes indirectos; Hemograma: hemograma completo; UPC: cociente proteína/creatinina urinaria; CIC: inmunocomplejos circulantes; qPCR: reacción en cadena de la polimerasa cuantitativa.
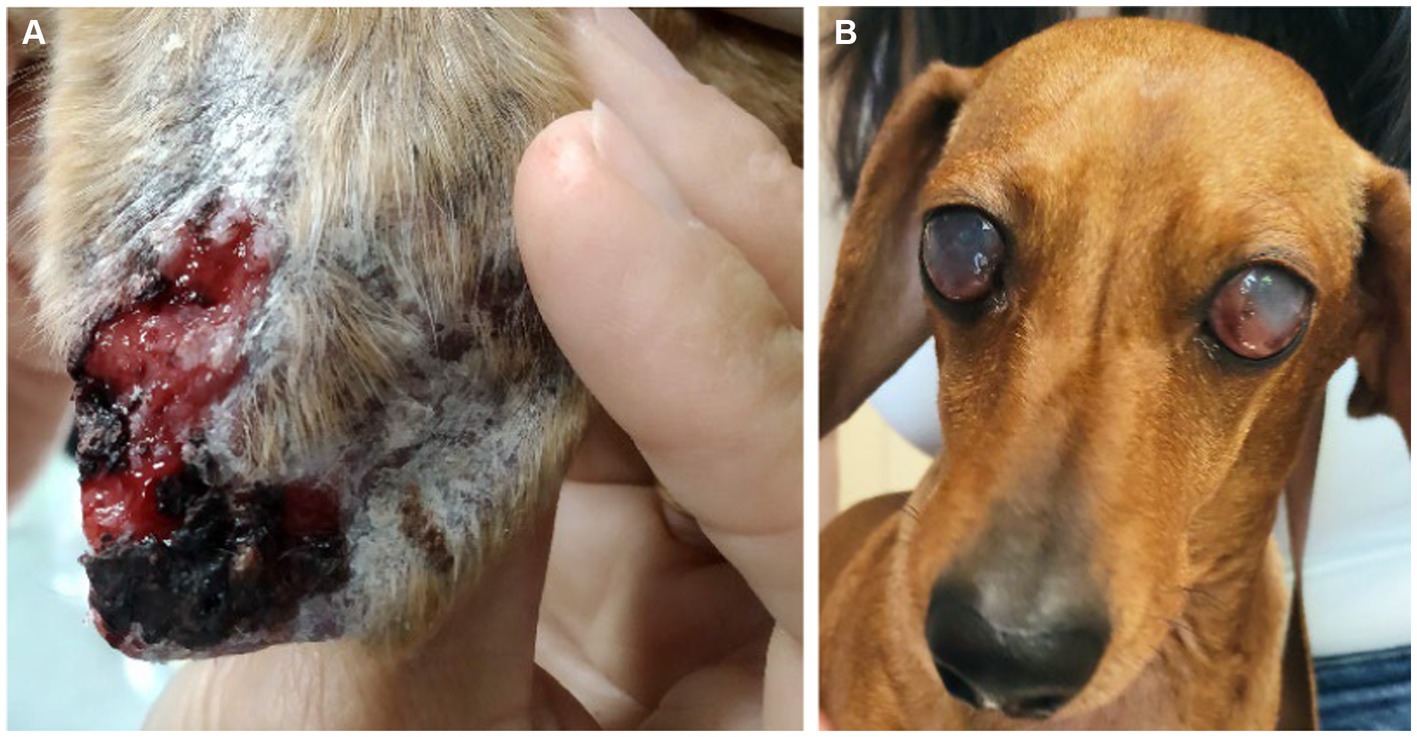
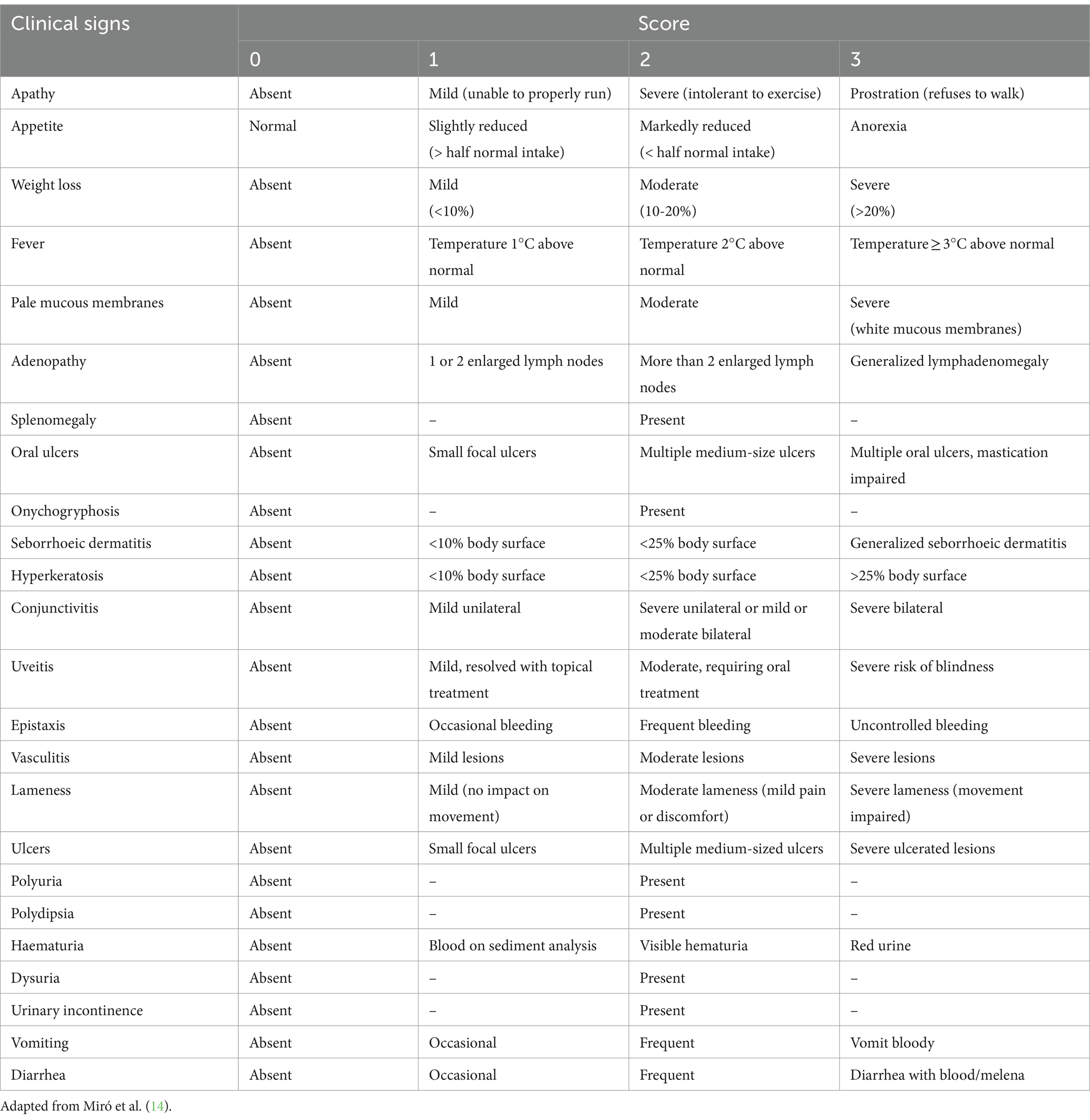
Los perros se sometieron a un examen físico exhaustivo en cada visita. Se recopilaron datos sobre signos clínicos, incluidos signos de depósito de CIC (Figura 2). Cada signo clínico se clasificó de 0 a 3 (gravedad baja a alta) para obtener una puntuación clínica global para cada animal (máximo 68) (Tabla 1).
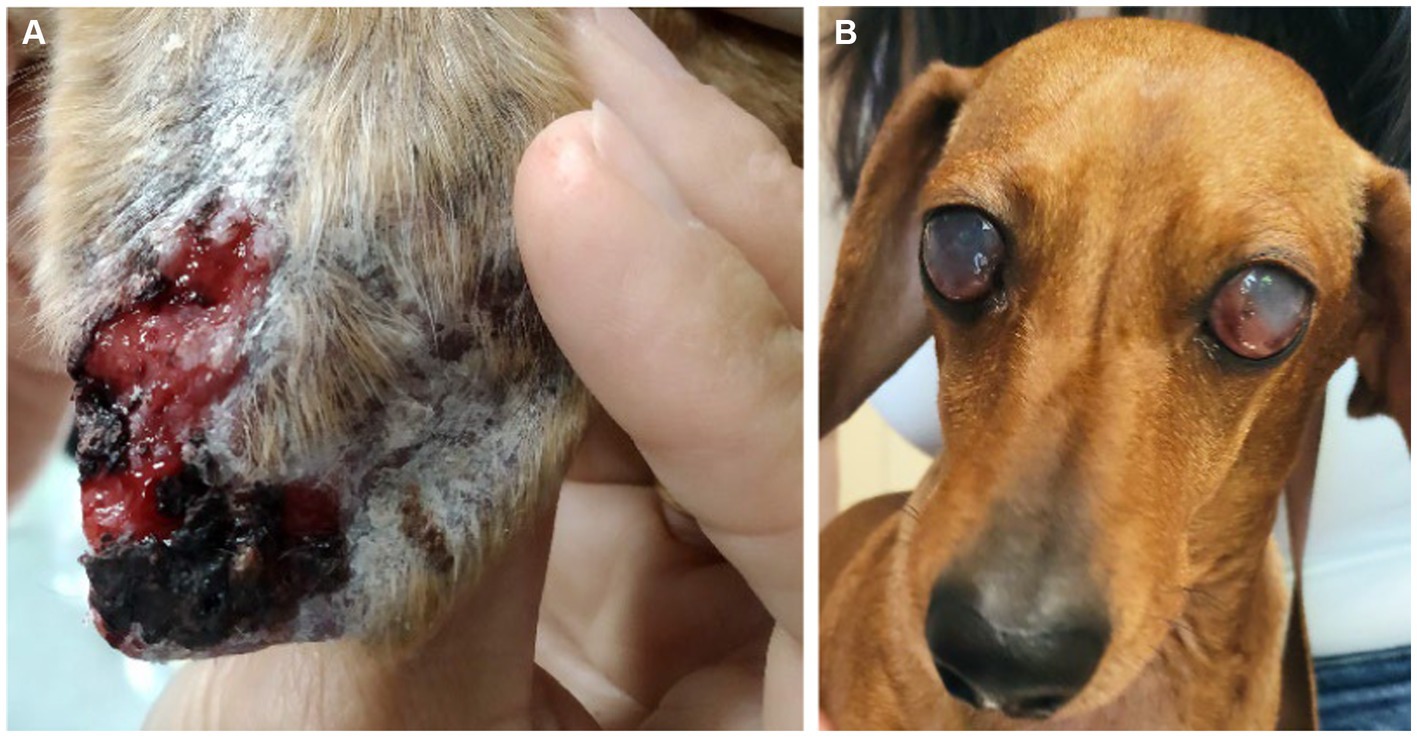 Figura 2. Signos clínicos de depósito de CIC en perros con CanL. (A) Úlcera en el pabellón auricular asociada a vasculitis. (B) Ceguera asociada a uveítis bilateral.
Figura 2. Signos clínicos de depósito de CIC en perros con CanL. (A) Úlcera en el pabellón auricular asociada a vasculitis. (B) Ceguera asociada a uveítis bilateral.
En cada visita se recogieron muestras de sangre para determinar las concentraciones séricas de CIC mediante PEG ELISA (11) (Figura 1). En los días 0, 30, 180 y 360, también se realizaron pruebas de laboratorio de rutina para determinar el estado clínico del perro, que incluyeron hemograma completo (CBC), perfil bioquímico (creatinina, urea y alanina aminotransferasa), electroforesis de proteínas séricas y prueba de anticuerpos de inmunofluorescencia anti-Leishmania (IFAT) (15). Se utilizaron diluciones seriadas de 1:50 a 1:6400 y la seropositividad se definió por un punto de corte ≥1:200. El análisis de orina, incluyendo la densidad de la orina, el análisis de sedimentos y la relación proteína/creatinina (UPC), también se realizaron en los días 0, 30, 180 y 360 en muestras de orina obtenidas preferentemente por cistocentesis, o por captura libre en un recipiente estéril. También se realizó una PCR cuantitativa para confirmar la infección en el día 0 y cuantificar la carga parasitaria a los 6 y 12 meses después de la inscripción. Sobre la base del examen físico y los hallazgos clínico-patológicos, los perros fueron asignados a los estadios I-IV de la enfermedad clínica de LeishVet (3).
2.3 Aislamiento y cuantificación de CIC
Un método de precipitación modificado con polietilenglicol (PEG; Sigma-Aldrich, St. Louis, MO, Estados Unidos) para separar antígenos libres y anticuerpos de CIC (11). Los CIC precipitados con PEG se peletizaron por centrifugación, luego se reconstituyeron en solución salina tamponada con fosfato (PBS) 0,01 M y se almacenaron a -80 °C para su uso posterior. Las CIC se cuantificaron mediante un método ELISA específico de Leishmania descrito por Parody et al. (11). Todas las muestras se analizaron por duplicado y se registró el valor medio. Se consideró como valor de corte una media de DO de 0,274 + 3 desviaciones estándar de las muestras negativas; Cualquier muestra que exhibiera absorbancia por encima del valor de corte se consideró positiva.
2.4 Tratamiento
El tratamiento de cada perro fue determinado por uno de los autores (un veterinario especialista en enfermedades infecciosas) y se basó en la historia clínica, el examen físico y los hallazgos de laboratorio. Los perros infectados clínicamente sanos o los que se encontraban en el estadio I no recibieron tratamiento o solo recibieron alopurinol durante 6 a 12 meses. Los perros en estadios II o III fueron tratados con una combinación de antimoniato de meglumina (MGA) (50 mg/kg por vía subcutánea cada 12 h durante 28 días) y alopurinol (10 mg/kg por vía oral cada 12 h durante 6-12 meses). Cuando se consideró necesario, se añadió prednisona (0,5 mg/kg por vía oral cada 12 h durante 3-4 semanas) al régimen de tratamiento en perros en estadio III para controlar los signos de depósito de CIC (10). Los perros proteinúricos fueron tratados siguiendo las directrices de la Sociedad Internacional de Interés Renal para la ERC en perros (16).
También se registraron recaídas y se administró un segundo ciclo de leishmanicida si era necesario. La recidiva de la enfermedad se definió como un empeoramiento clínico significativo y/o anomalías de laboratorio que provocaron un nuevo ciclo de tratamiento con antimoniales.
La respuesta clínica al tratamiento se evaluó mediante el examen de las historias clínicas, los cambios producidos en las puntuaciones clínicas y las variables de laboratorio a lo largo del tiempo, y el número de recaídas producidas durante el período de estudio. Los perros que respondieron bien mostraron mejoría en los signos clínicos y las anomalías de laboratorio y no tuvieron recaídas en los 12 meses posteriores al inicio del tratamiento. Se consideró que los perros respondían mal si experimentaban una o más recaídas durante el estudio o no mostraban mejoría en las variables clínico-patológicas al final del estudio.
2.5 Análisis estadístico
Todas las pruebas estadísticas se realizaron utilizando los paquetes de software SAS (SAS Institute Inc., Cary, NC, Estados Unidos) versión 9.4 y SPSS Statistics versión 28 (SPSS Inc., Chicago, IL, Estados Unidos). Los gráficos se crearon con GraphPad Prism 10. La significación se fijó en p ≤ 0,05.
Algunas variables fueron categorizadas para el análisis: edad (2-4 años: adulto joven, 5-8 años: adulto maduro, ≥9 años: adulto mayor) (17), título IFAT según valores de corte establecidos por el laboratorio (<200 negativos, 200-400 positivos bajos, 800-1.600 positivos medios, >1.600 positivos altos) (3, 15, 18, 19), y la relación albúmina/globulina (A/G) (>0,8 normal, 0,7-0,8 disproteinemia leve, 0,5-0,69 disproteinemia moderada, <0,5 disproteinemia grave) (19-21).
Como los valores de CIC dentro de los grupos no se distribuyeron normalmente (prueba de Kolmogorov-Smirnov, p < 0,001), se utilizaron pruebas no paramétricas. Se utilizó la prueba de Wilcoxon para comparar variables categóricas entre dos grupos establecidos y la prueba de Kruskal-Wallis con corrección de Bonferroni cuando había más de dos grupos. La asociación entre los niveles de CIC y los signos clínicos del sistema de puntuación utilizado en este estudio se evaluó mediante la prueba de Chi-cuadrado, analizando específicamente la tabla de contingencia 2 × 2 formada por las variables. A partir de este análisis, se calcularon los riesgos relativos (RR) para cada signo clínico, acompañados de sus respectivos intervalos de confianza (IC) del 95%. Estas medidas sirven para cuantificar la fuerza y la dirección de la asociación entre la CIC y los signos clínicos, proporcionando información valiosa sobre su relación.
Para evaluar los cambios en los niveles de CIC a lo largo del tiempo, se utilizó la prueba de Friedman para medidas repetidas también con corrección de Bonferroni. Se utilizó la prueba de correlación de Spearman para examinar las posibles correlaciones entre los niveles de CIC y las variables continuas. También evaluamos la capacidad del nivel de CIC para identificar con precisión la recaída mediante el cálculo del área bajo la curva de características operativas del receptor (ROC) (AUC).
3 Resultados
3.1 Población de estudio
De los 44 perros inscritos, 23 eran machos y 21 hembras. Catorce perros fueron clasificados como adultos jóvenes (2-4 años), 18 como adultos maduros (5-8 años) y 11 como mayores (edad media 6,6 años; IC 95%: 1,6-14,64). Durante el estudio, tres perros murieron de una comorbilidad (2 linfoma, 1 carcinoma), y siete se perdieron durante el seguimiento, ya que los dueños no regresaron para las nuevas visitas. A pesar de que solo 34 perros completaron los 12 meses del estudio, los datos de los 44 perros inscritos se incluyeron en el análisis hasta la pérdida del seguimiento.
Los niveles de CIC fueron significativamente más altos en perros adultos jóvenes en comparación con los mayores (p < 0,001), y se encontró una baja correlación negativa entre el nivel de CIC y la edad (r = −0,273). No se detectaron diferencias en los niveles de CIC entre mestizos y razas puras (p = 0,107) ni entre perros machos y hembras (p = 0,416).
3.2 Puntuaciones clínicas y de CIC, y estadios de LeishVet
La puntuación clínica media otorgada a los 34 perros que completaron los 12 meses de seguimiento disminuyó gradualmente a lo largo del estudio (Figura 3), y las puntuaciones clínicas y los niveles de CIC mostraron una correlación positiva (Figura 3) (r = 0,5135, p < 0,0001). También se encontró que los perros que mostraban signos clínicos tenían un mayor riesgo de tener niveles elevados de CIC. En la Tabla 2 se muestran los riesgos relativos (RR) para diversos signos clínicos evaluados en asociación con la presencia de CIC en perros. Curiosamente, 10/44 perros (22,72%) tenían una puntuación clínica de cinco o menos, pero niveles altos de CIC (≥2 OD).
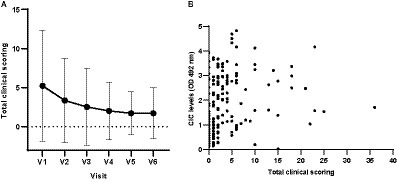 Figura 3. (A) Medias y DE de las puntuaciones clínicas totales registradas en cada visita. (B) Correlación entre las puntuaciones clínicas totales y los niveles de CIC (correlación de Spearman, r = 0,5135). V1 (Día 0), V2 (Día 30), V3 (Día 90), V4 (Día 180), V5 (Día 270) y V6 (Día 360).
Figura 3. (A) Medias y DE de las puntuaciones clínicas totales registradas en cada visita. (B) Correlación entre las puntuaciones clínicas totales y los niveles de CIC (correlación de Spearman, r = 0,5135). V1 (Día 0), V2 (Día 30), V3 (Día 90), V4 (Día 180), V5 (Día 270) y V6 (Día 360).
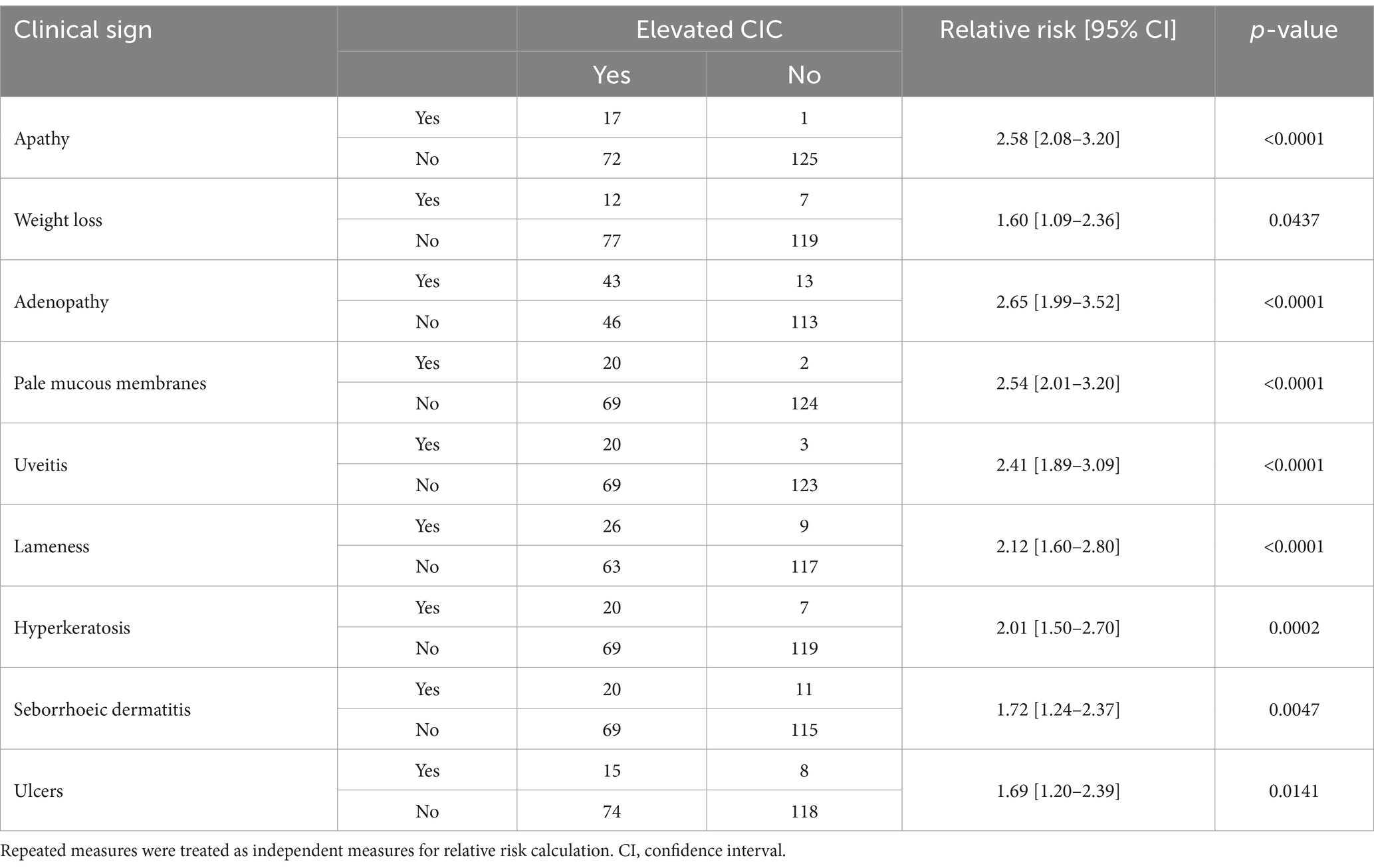 Tabla 2. Riesgo relativo de signos clínicos asociados con un riesgo significativo de inmunocomplejos circulantes (CIC) elevados.
Tabla 2. Riesgo relativo de signos clínicos asociados con un riesgo significativo de inmunocomplejos circulantes (CIC) elevados.
En el momento de la inscripción, 15 perros fueron clasificados como LeishVet estadio I, 20 como estadio II, 7 como estadio III y 2 como estadio IV. Debido al pequeño número de animales en el estadio IV, los datos de los estadios III y IV se combinaron para su análisis. Los perros en estadio I mostraron niveles de CIC significativamente más bajos que los clasificados con CanL estadios II y III (p < 0,0001) (Figura 4). No se encontraron diferencias entre los perros clasificados como II o III (p = 0,485). Además, los perros en estadio I mantuvieron consistentemente bajos niveles de CIC durante todo el estudio (Figura 4). En los pacientes en estadio II, los niveles de CIC disminuyeron después del tratamiento y se mantuvieron estables, mientras que en los pacientes en estadio III aumentaron después de 90 y 360 días de tratamiento (Figura 4).
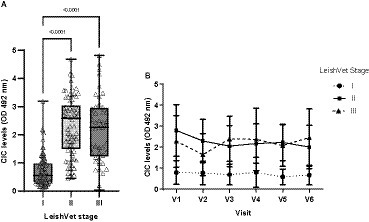 Figura 4. (A) Niveles de CIC registrados en los perros asignados a diferentes estadios de LeishVet (test no paramétrico de Kruskal-Wallis). (B) Cambios en los niveles medios de CIC registrados durante el período de estudio de 12 meses en perros en diferentes etapas de LeishVet. V1 (Día 0), V2 (Día 30), V3 (Día 90), V4 (Día 180), V5 (Día 270) y V6 (Día 360).
Figura 4. (A) Niveles de CIC registrados en los perros asignados a diferentes estadios de LeishVet (test no paramétrico de Kruskal-Wallis). (B) Cambios en los niveles medios de CIC registrados durante el período de estudio de 12 meses en perros en diferentes etapas de LeishVet. V1 (Día 0), V2 (Día 30), V3 (Día 90), V4 (Día 180), V5 (Día 270) y V6 (Día 360).
3.3 CIC y hallazgos de laboratorio
La leucopenia fue la anomalía más frecuente detectada en el hemograma, ocurriendo en el 27,78% de los perros, seguida de la trombocitopenia (22,62%) y la anemia no regenerativa (18,23%). Sin embargo, solo se encontraron diferencias significativas en los niveles de CIC para los perros anémicos (p < 0,0001) (Figura 5), que no solo tenían niveles más altos de CIC, sino que también experimentaron un aumento gradual de estos niveles a partir de los 6 meses posteriores al cese del tratamiento (Figura 5). Finalmente, se observó una correlación negativa moderada entre el hematocrito y el nivel de CIC (r = −0,547).
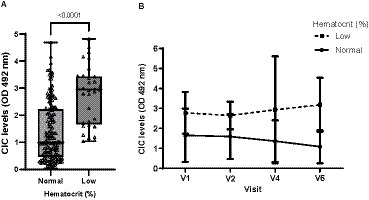 Figura 5. (A) Niveles de CIC registrados en perros con o sin anemia (prueba de Wilcoxon no paramétrica). (B) Cambios en las medias de CIC producidos durante el estudio en perros con o sin anemia. Valor de referencia hematocrito: 37-55%. V1 (Día 0), V2 (Día 30), V3 (Día 90), V4 (Día 180), V5 (Día 270) y V6 (Día 360).
Figura 5. (A) Niveles de CIC registrados en perros con o sin anemia (prueba de Wilcoxon no paramétrica). (B) Cambios en las medias de CIC producidos durante el estudio en perros con o sin anemia. Valor de referencia hematocrito: 37-55%. V1 (Día 0), V2 (Día 30), V3 (Día 90), V4 (Día 180), V5 (Día 270) y V6 (Día 360).
Entre las variables bioquímicas medidas, la creatinina se encontró elevada en solo el 8,57% de los perros, mientras que la alanina aminotransferasa (ALT) se incrementó en el 11,49%. No se encontraron diferencias significativas en los niveles de CIC entre los perros con niveles normales o elevados de creatinina (p = 0,789, r = −0,327) o ALT (p = 0,434, r = −0,216).
Se detectó hiperproteinemia en el 37,22% de las consultas. Los perros que mostraron hiperproteinemia presentaron niveles significativamente más altos de CIC (p < 0,0001) (Figura 6). En la visita 3, que fue la primera visita de seguimiento después del final del tratamiento, ambos grupos mostraron niveles reducidos de CIC. Sin embargo, en los perros con disproteinemia, estos niveles aumentaron posteriormente, mientras que los perros sin disproteinemia mantuvieron consistentemente niveles más bajos de CIC (Figura 6). Además, se encontró una correlación positiva moderada entre el CIC y los niveles de proteína total (r = 0,533, p < 0,0001).
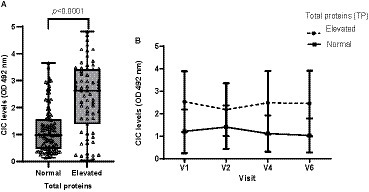 Figura 6. (A) Niveles de CIC registrados en perros con o sin hiperproteinemia (prueba de Wilcoxon no paramétrica). (B) Cambios en los niveles medios de CIC producidos durante el estudio en perros con o sin hiperproteinemia. Valor normal de referencia proteínas totales: 5,8-7,5 g/dL. Frecuencias: Normal: 57,78%; Hiperproteinemia: 37,22%. V1 (Día 0), V2 (Día 30), V4 (Día 180) y V6 (Día 360).
Figura 6. (A) Niveles de CIC registrados en perros con o sin hiperproteinemia (prueba de Wilcoxon no paramétrica). (B) Cambios en los niveles medios de CIC producidos durante el estudio en perros con o sin hiperproteinemia. Valor normal de referencia proteínas totales: 5,8-7,5 g/dL. Frecuencias: Normal: 57,78%; Hiperproteinemia: 37,22%. V1 (Día 0), V2 (Día 30), V4 (Día 180) y V6 (Día 360).
La hipoalbuminemia estuvo presente en el 22,02% de los pacientes. Los perros con hipoalbuminemia mostraron niveles de CIC significativamente más elevados (p = 0,02) (Figura 7), y se encontró una baja correlación negativa entre los niveles de CIC y albúmina (r = −0,306).
 Figura 7. Niveles de CIC registrados en perros según el nivel de albúmina (prueba no paramétrica de Wilcoxon). Albúmina de valor de referencia normal: 2,4-3,9 g/dL.
Figura 7. Niveles de CIC registrados en perros según el nivel de albúmina (prueba no paramétrica de Wilcoxon). Albúmina de valor de referencia normal: 2,4-3,9 g/dL.
Entre las globulinas, la gammaglobulina fue la más afectada, con hipergammaglobulinemia presente en el 31,1% de los animales, seguida de la hiperbetaglobulinemia (9,82%). Los perros con estas anomalías mostraron niveles significativamente más altos de CIC (p < 0,0001) (Figura 8), y encontramos una correlación positiva entre el CIC y los niveles de globulina beta (r = 0,444) y gamma (r = 0,720). Se observaron niveles elevados de globulinas alfa-1 y alfa-2 en el 2,48 y el 8,18% de los perros, respectivamente, pero no se detectaron diferencias en los niveles de CIC entre los perros con globulinas alfa-1 en sangre normales o elevadas (p = 0,960). Los perros con globulinas alfa-2 elevadas tenían niveles más altos de CIC (p = 0,022). No se encontró correlación entre los niveles de CIC y las globulinas alfa-1 y alfa-2 (r = 0,021; r = −0,022, respectivamente).
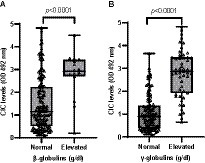 Figura 8. (A) Niveles de CIC registrados en perros según la presencia de beta-o (B) gamma-hiperglobulinemia (prueba no paramétrica de Wilcoxon). Valores normales de referencia betaglobulinas: 1,3-2,7 g/dL; gammaglobulinas: 0,5-2 g/dL.
Figura 8. (A) Niveles de CIC registrados en perros según la presencia de beta-o (B) gamma-hiperglobulinemia (prueba no paramétrica de Wilcoxon). Valores normales de referencia betaglobulinas: 1,3-2,7 g/dL; gammaglobulinas: 0,5-2 g/dL.
Entre todas las variables examinadas, la disproteinemia fue el hallazgo de laboratorio más frecuente, detectado en el 41,66% de los animales. Los perros con disproteinemia mostraron niveles significativamente más altos de CIC (p < 0,0001), y se encontró una alta correlación negativa entre el nivel de CIC y la relación A/G (r = −0,618). Cuando evaluamos el efecto del nivel de disproteinemia sobre el nivel de CIC (Figura 9), no encontramos diferencias entre los perros con disproteinemia leve (p = 1,0), moderada (p = 0,419) o severa (p = 0,121). A lo largo del estudio, los niveles de CIC se mantuvieron por debajo de 1,5 OD en perros sin disproteinemia, mientras que los niveles se mantuvieron consistentemente por encima de 2,5 OD en aquellos con disproteinemia grave (Figura 9).
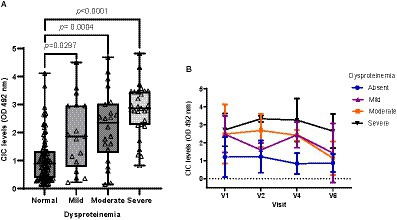 Figura 9. (A) Niveles de CIC en perros con una relación A/G normal y diferentes grados de disproteinemia (prueba no paramétrica de Kruskal-Wallis). (B) Cambios en las medias de CIC detectados en perros con una relación A/G normal y diferentes grados de disproteinemia. La relación A/G normal > 0,8; disproteinemia leve: 0,7–0,8; disproteinemia moderada: 0,6-0,5; disproteinemia grave: A/G < 0,5. V1 (Día 0), V2 (Día 30), V4 (Día 180) y V6 (Día 360).
Figura 9. (A) Niveles de CIC en perros con una relación A/G normal y diferentes grados de disproteinemia (prueba no paramétrica de Kruskal-Wallis). (B) Cambios en las medias de CIC detectados en perros con una relación A/G normal y diferentes grados de disproteinemia. La relación A/G normal > 0,8; disproteinemia leve: 0,7–0,8; disproteinemia moderada: 0,6-0,5; disproteinemia grave: A/G < 0,5. V1 (Día 0), V2 (Día 30), V4 (Día 180) y V6 (Día 360).
Una gran proporción (36,18%) de los perros mostraron un índice de UPC normal. Se registraron proteinuria limítrofe y proteinuria en el 26,32 y 36,18% de los pacientes, respectivamente. Los perros con proteinuria limítrofe (UPC = 0,2-0,5) tuvieron niveles más altos de CIC que los perros sin proteinuria (UPC > 0,5) (p = 0,035, r = 0,172). Sin embargo, no se encontraron diferencias en el CIC entre los perros con proteinuria o proteinuria limítrofe (p = 0,69).
3.4 Títulos CIC e IFAT
Los títulos de IFAT oscilaron entre negativo y 1:6400, con el punto de corte establecido en >1/100. Se observaron diferencias significativas en los niveles de CIC entre los grupos que mostraron títulos de anticuerpos negativos, bajos, medios o altos (p < 0,0001) (Figura 10), y hubo una fuerte correlación positiva entre los niveles de CIC y los títulos de IFAT (r = 0,735; p < 0,0001). Además, a lo largo del estudio, los niveles de CIC se mantuvieron consistentemente bajos en perros infectados clínicamente sanos que arrojaron resultados negativos de IFAT (Figura 10).
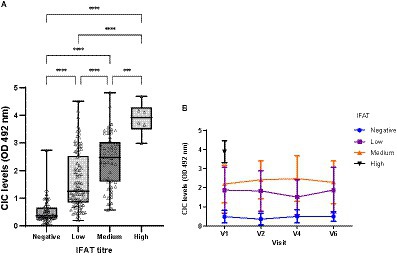 Figura 10. (A) Niveles de CIC registrados en perros que muestran diferentes títulos de anticuerpos contra L. infantum. IFAT < 200 negativo, 200-400 bajo, 800-1600 medio, >1600 alto (prueba de Kruskal-Wallis no paramétrica; p < 0,0005, p < 0,0001). (B) Cambios en las medias de CIC producidos durante el estudio en perros que muestran diferentes títulos de anticuerpos contra L. infantum. Los títulos altos no se muestran debido al bajo número detectado. V1 (Día 0), V2 (Día 30), V4 (Día 180) y V6 (Día 360).*******
Figura 10. (A) Niveles de CIC registrados en perros que muestran diferentes títulos de anticuerpos contra L. infantum. IFAT < 200 negativo, 200-400 bajo, 800-1600 medio, >1600 alto (prueba de Kruskal-Wallis no paramétrica; p < 0,0005, p < 0,0001). (B) Cambios en las medias de CIC producidos durante el estudio en perros que muestran diferentes títulos de anticuerpos contra L. infantum. Los títulos altos no se muestran debido al bajo número detectado. V1 (Día 0), V2 (Día 30), V4 (Día 180) y V6 (Día 360).*******
3.5 CIC y tratamiento
Dado que la CanL es una enfermedad crónica, en el momento de la inclusión algunos perros ya estaban recibiendo tratamiento con alopurinol (n = 15/44), domperidona (n = 1/44) (22-24), nucleótidos (n = 5/44) (25-28), prednisona (n = 1/44) o el inhibidor de la enzima convertidora de angiotensina benazepril (n = 2/44). Los regímenes de tratamiento de los perros después de la inscripción en este estudio se detallan en la Tabla 3.
Los niveles de CIC fueron significativamente mayores en los perros tratados con antimoniato de meglumina (p = 0,0036) o alopurinol (p = 0,015) y en aquellos con proteinuria tratados con benazepril (p = 0,0039). Los perros tratados con antimoniato de meglumina o alopurinol o que recibieron benazepril para controlar la proteinuria tenían casi dos veces más probabilidades de tener niveles altos de CIC (Tabla 4). Por el contrario, no se detectaron diferencias según el tratamiento con nucleótidos (p = 0,0519) o prednisona (p = 0,2312).
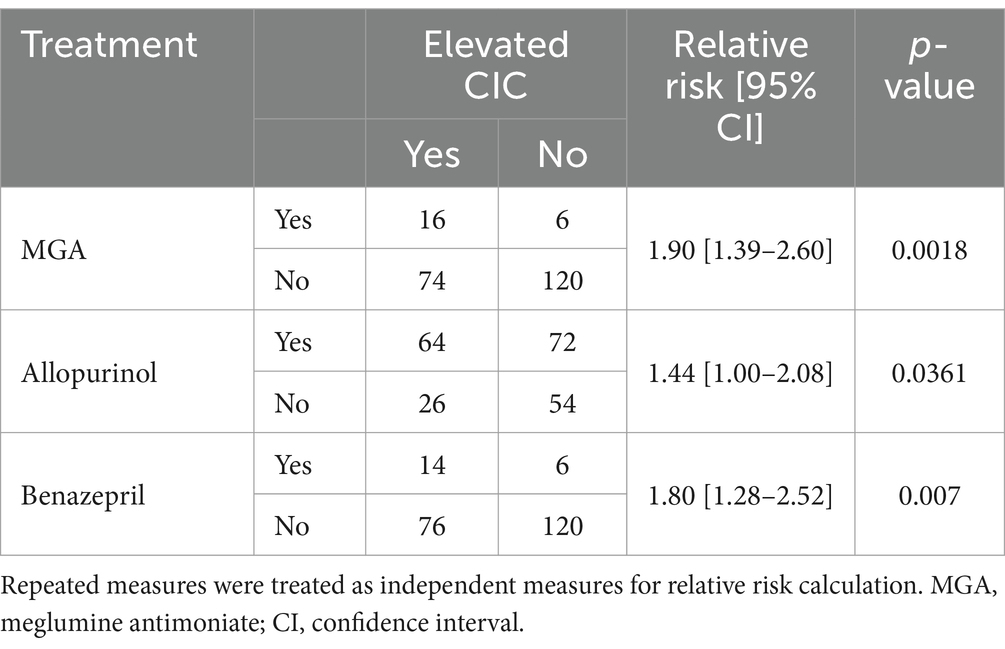 Tabla 4. Riesgo relativo de los regímenes de tratamiento asociados con un riesgo significativo de inmunocomplejos circulantes (CIC) elevados.
Tabla 4. Riesgo relativo de los regímenes de tratamiento asociados con un riesgo significativo de inmunocomplejos circulantes (CIC) elevados.
3.6 CIC y respuesta al tratamiento
Para evaluar los efectos del tratamiento en perros enfermos, también examinamos los niveles de CIC a lo largo del tiempo. Como los datos no se distribuyeron normalmente, se empleó la prueba de Friedman no paramétrica. Nueve de los 44 perros, cada uno de los cuales perdió una visita, fueron excluidos de esta parte del análisis. Nuestros resultados muestran que los niveles medios de CIC disminuyeron gradualmente después del tratamiento y se mantuvieron relativamente estables durante todo el período de estudio (Figura 11). Sin embargo, solo se detectaron diferencias significativas en los niveles de CIC entre la primera (D0) y la última (D360) (test de Friedman p = 0,022) (Figura 11).
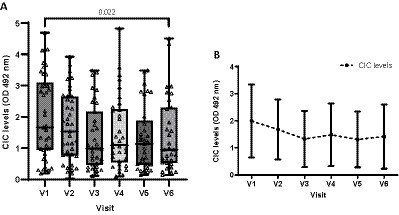 Figura 11. Gráfico de líneas de cuadro (A) y (B) que muestra los cambios en los niveles medios de CIC registrados durante el estudio. (A) Prueba de Friedman no paramétrica.
Figura 11. Gráfico de líneas de cuadro (A) y (B) que muestra los cambios en los niveles medios de CIC registrados durante el estudio. (A) Prueba de Friedman no paramétrica.
De los 44 perros incluidos inicialmente en nuestro estudio, 28 fueron clasificados como buenos respondedores, 11 como mal respondedores y 5 no pudieron ser clasificados, ya que se perdieron durante el seguimiento. Los buenos respondedores mostraron niveles significativamente más bajos de CIC que los malos respondedores (p < 0,0001) (Figura 12). Además, los buenos respondedores mostraron niveles más bajos de CIC y disminuyeron a lo largo del estudio (Figura 12). En los pacientes con mala respuesta, aunque se observó una reducción de la CIC después del tratamiento, los niveles aumentaron progresivamente a partir de los 90 días (Figura 12).
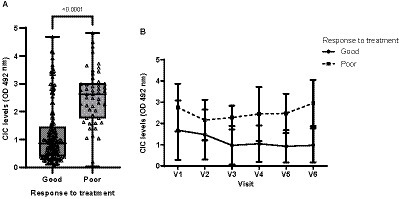 Figura 12. (A) Niveles de CIC registrados en perros que muestran una buena o mala respuesta al tratamiento (prueba de Wilcoxon no paramétrica). (B) Cambios en las medias de CIC producidos durante el estudio en perros que muestran una buena o mala respuesta al tratamiento. V1 (Día 0), V2 (Día 30), V3 (Día 90), V4 (Día 180), V5 (Día 270) y V6 (Día 360).
Figura 12. (A) Niveles de CIC registrados en perros que muestran una buena o mala respuesta al tratamiento (prueba de Wilcoxon no paramétrica). (B) Cambios en las medias de CIC producidos durante el estudio en perros que muestran una buena o mala respuesta al tratamiento. V1 (Día 0), V2 (Día 30), V3 (Día 90), V4 (Día 180), V5 (Día 270) y V6 (Día 360).
3.7 CIC y recaídas
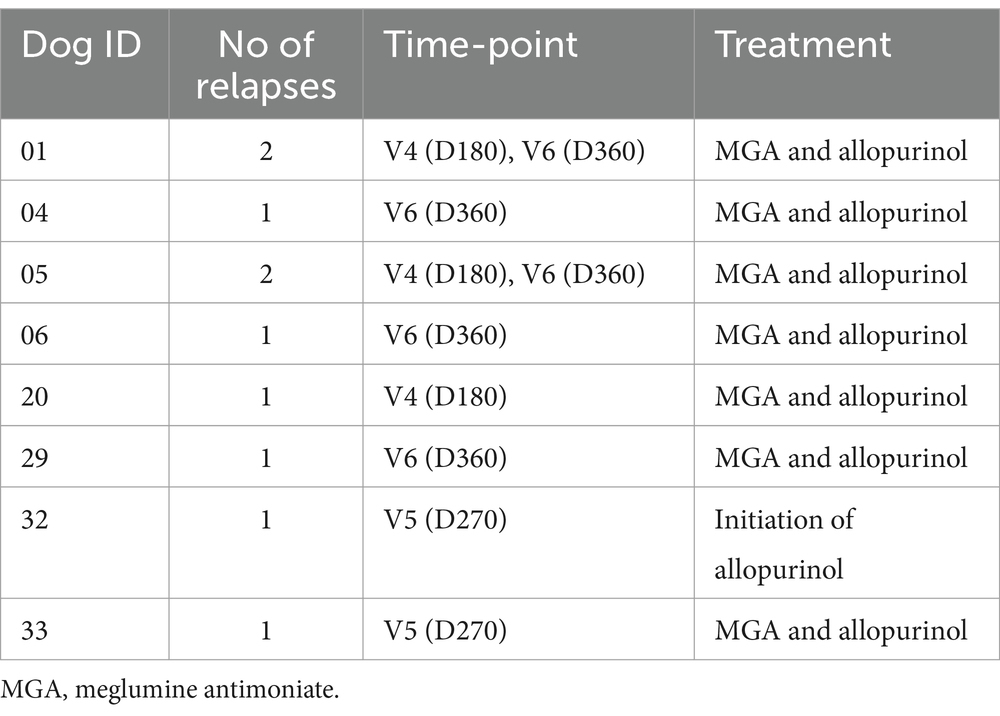
Se detectaron recaídas en el 23,18% de los animales. En el momento de la inclusión, 18 de los 44 perros habían tenido un diagnóstico previo de CanL y fueron remitidos para tratamiento debido a una recaída clínica. Durante el período de seguimiento de 12 meses, seis perros tuvieron una recaída y dos tuvieron dos recaídas (Tabla 5).
Los perros que experimentaron recaída tuvieron niveles significativamente más altos de CIC en comparación con los perros que no experimentaron recaída (p < 0,0001) (Figura 13); estos se elevaron de manera constante en todas las visitas (DO > 2) (Figura 13).
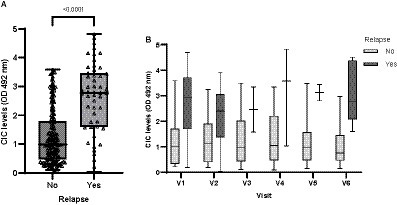 Figura 13. (A) Niveles de CIC registrados en perros que experimentan o no recaída (prueba de Wilcoxon no paramétrica). (B) Niveles de CIC registrados durante el período de estudio en perros que experimentan o no recaídas. V1 (Día 0), V2 (Día 30), V3 (Día 90), V4 (Día 180), V5 (Día 270) y V6 (Día 360).
Figura 13. (A) Niveles de CIC registrados en perros que experimentan o no recaída (prueba de Wilcoxon no paramétrica). (B) Niveles de CIC registrados durante el período de estudio en perros que experimentan o no recaídas. V1 (Día 0), V2 (Día 30), V3 (Día 90), V4 (Día 180), V5 (Día 270) y V6 (Día 360).
Curiosamente, detectamos un marcado aumento de los niveles de CIC en V4 (D180) (Figura 14), persistiendo en V5 (D270) y V6 (D360) y coincidiendo con las recaídas registradas en estos perros (Tabla 5). Por el contrario, los perros que no recayeron tuvieron niveles de CIC por debajo de 2 OD durante todo el período de estudio (Figura 14).
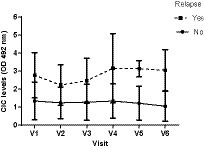 Figura 14. Cambios en las medias de CIC registradas a lo largo del estudio en perros que experimentan o no recaídas. V1 (Día 0), V2 (Día 30), V3 (Día 90), V4 (Día 180), V5 (Día 270) y V6 (Día 360).
Figura 14. Cambios en las medias de CIC registradas a lo largo del estudio en perros que experimentan o no recaídas. V1 (Día 0), V2 (Día 30), V3 (Día 90), V4 (Día 180), V5 (Día 270) y V6 (Día 360).
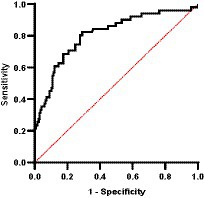
Es importante destacar que, a través del análisis de la curva ROC, pudimos determinar que el CIC era un buen discriminador de la recaída (AUC = 0,808, p < 0,0001; IC 95%: 0,736-0,881) (Figura 15). Nuestros resultados indican que el punto de corte óptimo para identificar correctamente una recidiva fue de 1,539 DO (sensibilidad 82,4%; especificidad 70,9%).
4 Discusión
Hasta donde sabemos, este es el primer estudio que valida clínicamente el uso de CICs como biomarcadores de la progresión de la leishmaniosis canina. Los perros en etapas avanzadas de esta enfermedad muestran niveles más altos de CIC (11) y un mayor riesgo de daño a múltiples órganos, lo que puede afectar significativamente la calidad de vida y reducir drásticamente la supervivencia (6-8, 29). En la actualidad, se carece de métodos diagnósticos para cuantificar el CIC. Parody et al. (11) introdujeron un método no invasivo específico para Leishmania para medir los niveles de CIC en muestras de suero de perros con leishmaniosis. Este método ha sido recientemente validado en laboratorio siguiendo las recomendaciones del grupo de Biomarcadores de los NIH (12). La especificidad y robustez del método sugieren que este nuevo biomarcador podría ser útil no solo para el diagnóstico de la LLC, sino también para el seguimiento de la progresión de la enfermedad y la posible evaluación de la eficacia del tratamiento (13). En el presente estudio en el mundo real, buscamos validar clínicamente el rendimiento de este nuevo biomarcador.
En nuestro estudio, 34 perros infectados naturalmente con L. infantum en diferentes estadios de LeishVet fueron seguidos durante 12 meses. Nuestros datos muestran que los niveles de CIC son significativamente más altos en perros adultos jóvenes que en perros senior (p < 0,001), mientras que no se detectaron diferencias según sexo o raza. La influencia del sexo, la raza y la edad en la susceptibilidad a contraer la infección ha sido explorada en numerosos estudios con resultados contrastantes (30-34). No obstante, los autores de dos estudios epidemiológicos en los que participó un gran número de perros, que tuvieron en cuenta la presencia de signos clínicos de CanL, describieron que la distribución por edades de los animales afectados era bimodal, con un primer pico correspondiente a los animales de alrededor de 3 años de edad y un segundo pico, menos evidente, que representaba a los animales de alrededor de 8 años de edad (30, 31). La edad también parece ser un factor de riesgo importante asociado con la leishmaniasis visceral (LV) en humanos según dos revisiones sistemáticas (35, 36), de modo que los niños son más susceptibles tanto a la infección como a la enfermedad. Nuestros resultados apuntan a que los perros más jóvenes controlan la enfermedad de manera menos efectiva y, por lo tanto, tienen más probabilidades de haber formado CIC.
Las puntuaciones clínicas medias disminuyeron progresivamente durante el estudio y se detectaron diferencias significativas en las puntuaciones clínicas totales entre las visitas. Además, se encontró una correlación positiva entre la puntuación clínica y los niveles de CIC (r = 0,5135, p < 0,0001). Estos resultados sugieren que una disminución en la puntuación clínica irá acompañada de una disminución en los niveles de CIC. Sin embargo, algunos perros tenían una puntuación clínica baja (≤5) a pesar de tener niveles altos de CIC (≥2 OD). Los únicos signos clínicos observados en estos perros fueron cojera, uveítis, úlceras cutáneas o poliuria/polidipsia. Por lo tanto, la medición de los niveles de CIC podría ser útil en perros que no tienen una imagen general de la CanL generalizada pero que muestran signos clínicos de depósito de complejos inmunes. Los estudios futuros arrojarán luz sobre la relación entre las puntuaciones clínicas y los niveles de CIC.
Los niveles de CIC fueron significativamente más bajos en los perros en estadio I en comparación con los estadios II y III, lo que concuerda con los hallazgos de Parody et al. (11), quienes informaron una clara asociación entre los niveles de CIC y la progresión de la enfermedad. En nuestro estudio, examinamos las tendencias en los niveles de CIC durante 12 meses en perros en diferentes etapas clínicas de CanL. Nuestros resultados indican que los perros en etapas tempranas de la enfermedad tienen niveles bajos de CIC que permanecen bajos durante largos períodos. Por el contrario, en las etapas avanzadas, los perros muestran consistentemente altos niveles de complejos inmunológicos, y se pueden observar aumentos tan pronto como 90 días después de iniciar un tratamiento específico. Estos resultados ponen de manifiesto la importancia de una monitorización estrecha y frecuente de la deposición de CIC en perros en estadios avanzados de CanL, y sugieren que este nuevo biomarcador podría utilizarse para detectar recaídas.
La anemia no regenerativa es una de las anomalías clínico-patológicas más frecuentes notificadas en perros con CanL. Algunos autores describen la correlación entre la anemia o la gravedad de los signos clínicos (21, 37, 38) y la carga parasitaria (38-40). La disproteinemia también se observa con frecuencia en perros con CanL (19-21). La electroforesis de proteínas ha demostrado ser extremadamente útil para el diagnóstico y seguimiento de la CAN y se realiza de forma rutinaria en la práctica clínica (41-44). De hecho, varios estudios han demostrado que esta técnica puede mostrar anomalías muy tempranas durante el curso de la enfermedad, incluso antes de la aparición de signos clínicos manifiestos (21, 41, 42, 45, 46). En nuestro estudio, observamos una fuerte correlación entre CIC y hematocrito (r = 0,524), proteínas totales (r = 0,507), beta- (r = 0,426) y gammaglobulinas (r = 0,673), y la relación A/G (r = −0,647). Además, nuestros resultados también muestran que los perros con anemia no regenerativa y/o disproteinemia tienen niveles significativamente más altos de CIC. Cuando examinamos la cinética de estos inmunocomplejos, observamos que los perros con anemia y/o disproteinemia mostraron niveles más altos de CIC a lo largo del estudio a pesar del tratamiento específico. En conjunto, nuestros hallazgos apuntan a la alta fiabilidad de este nuevo biomarcador, ya que se correlaciona con otras herramientas utilizadas para el diagnóstico y el manejo clínico de la LCAN. Además, confirman que los perros con anemia o disproteinemia tienen un mayor riesgo de depósito de CIC en órganos específicos.
La IFAT es una de las técnicas serológicas cuantitativas más utilizadas para la detección de anticuerpos anti-Leishmania y se considera la prueba de referencia para la infección por Leishmania. Una amplia investigación ha identificado una correlación entre los resultados de la IFAT y los signos clínicos (47-51), que se hace más evidente en las formas clínicas graves de CanL (51). En la LV humana, los anticuerpos anti-Leishmania altos también se correlacionan con la progresión de la enfermedad (4). Los estudios también han demostrado que los anticuerpos IgG no solo no protegen contra este parásito intracelular, sino que también contribuyen a la progresión de la enfermedad al revertir el perfil de citoquinas inflamatorias de las células inmunitarias e inducir la producción de altos niveles de IL-10 a través del receptor FcγRIII (4, 52). Aquí, se encontraron diferencias significativas en los niveles de CIC entre los perros que mostraron títulos de anticuerpos negativos, bajos, medios o altos, y se observó una alta correlación positiva entre los resultados de CIC e IFAT (r = 0,735). Estos hallazgos están en línea con los descritos por Parody et al. (11), quienes también observaron una alta correlación entre estas dos variables (r = 0,754). Por lo tanto, los perros con altos títulos de anticuerpos tienen niveles significativamente más altos de CIC y, por lo tanto, corren un mayor riesgo de ser depositados en los órganos diana.
Los niveles medios de CIC disminuyeron después del tratamiento y se mantuvieron por debajo de 1,5 DO durante todo el estudio, aunque solo se encontraron diferencias significativas entre la primera y la última visita. Las razones probables de esto son: (1) el pequeño número de animales incluidos en el estudio y, por lo tanto, la potencia estadística reducida cuando se utiliza la prueba de Friedman con corrección de Bonferroni; y (2) en perros que muestran una respuesta deficiente al tratamiento, los niveles de CIC pueden permanecer elevados durante varios meses. En este estudio, los perros enfermos fueron tratados con antimoniales en combinación con alopurinol, que es el tratamiento estándar para la CanL en Europa (3). Cuatro perros tratados con antimoniales y uno tratado con alopurinol también recibieron prednisona durante 1 mes para controlar los signos clínicos de depósito de CIC. Los perros tratados con antimoniales o alopurinol, o aquellos que recibieron benazepril para controlar la proteinuria, tenían niveles de CIC significativamente más altos y tenían hasta dos veces más probabilidades de tener niveles elevados de CIC en suero. Esto no es sorprendente ya que, a excepción del alopurinol, estos medicamentos se utilizan en etapas más avanzadas de la enfermedad. Debido al pequeño número de animales que recibieron tratamiento con prednisona, no se pueden sacar conclusiones sobre la cinética de los niveles de CIC en estos perros. Se necesitan más estudios para examinar el uso óptimo de este nuevo biomarcador en la adaptación y el seguimiento del uso de corticosteroides en perros que experimentan depósito de CIC.
Los buenos respondedores tuvieron niveles de CIC significativamente más bajos en comparación con los malos respondedores (p < 0,0001), que disminuyeron progresivamente a lo largo del curso del estudio. En los pacientes con mala respuesta, aunque se observó una reducción de la CIC después del tratamiento, los niveles aumentaron progresivamente hasta 90 días después del tratamiento. Estos resultados sugieren que la medición de los niveles de CIC antes y después del tratamiento podría servir para evaluar la efectividad del tratamiento.
Los perros que experimentaron recaída después del tratamiento tuvieron niveles significativamente más altos de CIC (p < 0,0001); más de 2 OD en todas las visitas. Durante el estudio, seis perros tuvieron una recaída y dos tuvieron dos recaídas. La mayoría de las recaídas ocurrieron en la visita 6, 1 año después del tratamiento. Sin embargo, tres perros tuvieron una recaída tan pronto como a los 6 meses después del tratamiento. Los estudios han demostrado que la presencia de inmunocomplejos contribuye al establecimiento de infecciones crónicas en modelos murinos y en la LV humana (4, 52). Un mecanismo clave es su capacidad para estimular a los macrófagos y otras células inmunitarias para que produzcan IL10. Esta citocina reduce la expresión de la óxido nítrico sintasa inducible (iNOS) y la producción intracelular de óxido nítrico, que son vitales para eliminar los parásitos intracelulares de Leishmania. Además, la IL-10 regula a la baja la respuesta al IFN-γ asociado a Th1, que es esencial para activar la producción de óxido nítrico dentro de las células infectadas y eliminar el parásito. En consecuencia, los perros que recayeron tenían niveles más altos de CIC, lo que puede haber sido responsable de su incapacidad para controlar la infección a pesar de recibir un tratamiento leishmanicida específico.
Es importante destacar que nuestro análisis de la curva ROC reveló que los CIC eran un buen discriminador de la recaída (AUC = 0,808) y que el punto de corte óptimo para identificar con precisión la recaída era de 1,539 OD. Esto es relevante ya que el punto de corte para la positividad adoptado en el estudio de Parody et al. (11) fue de 0,274 DO, que puede ser demasiado bajo para asociarse con enfermedad clínica. De hecho, los niveles de CIC oscilaron entre 0,8 y 1,0 OD en perros infectados clínicamente sanos, mientras que los perros enfermos tuvieron niveles entre 1,9 y 3,1 OD. Se necesitan más estudios más amplios para confirmar nuestros hallazgos y establecer puntos de corte definitivos para distinguir entre perros sanos infectados y enfermos.
Es importante mencionar que nuestro estudio no incluyó un cálculo formal del tamaño de la muestra debido a la falta de datos previos sobre los tamaños de efecto esperados para el nuevo biomarcador bajo investigación. Sin embargo, nuestro estudio arrojó resultados estadísticamente significativos, proporcionando información valiosa sobre la asociación entre los signos clínicos de CIC y los parámetros clinicopatológicos relacionados con CanL. En el futuro, los cálculos del tamaño de la muestra en estudios futuros podrían mejorar la solidez de nuestros hallazgos y contribuir a una comprensión más profunda del papel de la CIC en la progresión de la enfermedad.
5 Conclusión
Nuestros hallazgos indican concentraciones séricas elevadas de CIC tanto en perros adultos jóvenes como en aquellos en estadios avanzados de CanL con anemia y/o disproteinemia. Los perros que mostraron una respuesta favorable al tratamiento mostraron una disminución de los niveles de CIC. Por el contrario, los perros que mostraron una respuesta deficiente al tratamiento y las recaídas clínicas recurrentes exhibieron consistentemente altos niveles de CIC. En estos perros, el monitoreo vigilante es esencial para permitir un tratamiento rápido y específico y prevenir daños irreversibles en los órganos debido a la deposición de CIC.
Si bien aún se necesitan estudios en poblaciones más grandes de perros para confirmar nuestros hallazgos, el uso de CIC como biomarcador complementario para rastrear la progresión de la enfermedad en CanL es prometedor. Otros estudios que utilicen este nuevo biomarcador pueden proporcionar información sobre el tropismo de órganos específicos y los mecanismos de recaída en los pacientes que no responden. Estos estudios también mejorarán nuestra comprensión de la inmunidad celular de larga duración en perros resistentes y ayudarán en el desarrollo de vacunas contra la Leishmania.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
Los estudios en animales fueron aprobados por el Comité de Ética de la Universidad Complutense de Madrid. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
JS: Curación de datos, Análisis formal, Investigación, Metodología, Administración de proyectos, Recursos, Redacción – borrador original, Redacción – revisión y edición. NP: Investigación, Validación, Redacción – Revisión y Edición. AM: Recursos, Redacción – revisión y edición. CC-L: Investigación, Validación, Redacción – Revisión y Edición. JB: Recursos, Redacción – revisión y edición. RC: Recursos, Escritura – revisión y edición. MD: Recursos, Redacción – revisión y edición. JC: Conceptualización, Obtención de Fondos, Administración de Proyectos, Supervisión, Redacción, Revisión y Edición. GM: Conceptualización, Obtención de Financiamiento, Metodología, Administración de Proyectos, Recursos, Supervisión, Redacción, Revisión y Edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio ha sido parcialmente financiado por LETI Pharma S.L.U.
Reconocimientos
Los autores quieren agradecer a todos los perros y a sus dueños que participaron en este estudio.
Conflicto de intereses
NP, CC-L y JC fueron empleados de LETI Pharma S.L.U.
Los autores declaran que este estudio recibió financiación de LETI Pharma S.L.U. El financiador tuvo la siguiente participación en el estudio: diseño del protocolo del estudio, cuantificación de CIC y edición del manuscrito final.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Moreno, J, y Alvar, J. Leishmaniasis canina: riesgo epidemiológico y modelo experimental. Tendencias Parasitol. (2002) 18:399–405. doi: 10.1016/S1471-4922(02)02347-4
2. Miró, G, Montoya, A, Mateo, M, Alonso, A, García, S, García, A, et al. Un sistema de vigilancia de la leishmaniosis en perros callejeros de la Comunidad de Madrid: diez años de serodiagnóstico (1996-2006). Parasitol Res. (2007) 101:253–7. doi: 10.1007/s00436-007-0497-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Solano-Gallego, L, Koutinas, A, Miró, G, Cardoso, L, Pennisi, MG, Ferrer, L, et al. Instrucciones para el diagnóstico, estadificación clínica, tratamiento y prevención de la leishmaniosis canina. Parasitol veterinario. (2009) 165:1–18. doi: 10.1016/j.vetpar.2009.05.022
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Miles, SA, Conrad, SM, Alves, RG, Jeronimo, SMB, y Mosser, DM. Un papel de los complejos inmunes IgG durante la infección con el patógeno intracelular Leishmania. J Exp Med. (2005) 201:747–54. doi: 10.1084/jem.20041470
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Toepp, AJ, y Petersen, CA. El acto de equilibrio: la inmunología de la leishmaniosis. Res Vet Sci. (2020) 130:19–25. doi: 10.1016/j.rvsc.2020.02.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Geisweid, K, Mueller, R, Sauter-Louis, C y Hartmann, K. Analitos pronósticos en perros con infección por Leishmania infantum que viven en un área no endémica. Rec. Veterinario (2012) 171:399. doi: 10.1136/vr.100637
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Pereira, MA, Santos, R, Oliveira, R, Costa, L, Prata, A, Gonçalves, V, et al. Factores pronósticos y esperanza de vida en la leishmaniosis canina. Veterinaria Sci. (2020) 7:128. doi: 10.3390/vetsci7030128
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. De Jong, MK, Rappoldt, A, Broere, F, y Piek, CJ. Tiempo de supervivencia y factores pronósticos en la leishmaniosis canina en un país no endémico tratado con un protocolo de dos fases que incluye monoterapia inicial con alopurinol. Vectores parásitos. (2023) 16:163. doi: 10.1186/s13071-023-05777-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Cortese, L, Pelagalli, A, Piantedosi, D, Mastellone, V, Di Loria, A, Lombardi, P, et al. Efectos de la prednisona sobre la hemostasia en perros leishmanióticos tratados con antimoniato de meglumina y alopurinol. Veterinario J. (2008) 177:405–10. doi: 10.1016/j.tvjl.2007.05.011
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Aroch, I, Ofri, R, y Baneth, G. Epistaxis concurrente, sangrado retiniano e hipercoagulabilidad en un perro con leishmaniosis visceral. Isr J Vet Med. (2017) 72:35–48. Disponible en: http://www.ijvm.org.il/sites/default/files/aroch_1.pdf
11. Parody, N, Cacheiro-Llaguno, C, Osuna, C, Renshaw-Calderón, A, Alonso, C, y Carnés, J. Los niveles de complejos inmunes circulantes se correlacionan con la progresión de la leishmaniosis canina en perros infectados de forma natural. Parasitol veterinario. (2019) 274:108921. doi: 10.1016/j.vetpar.2019.108921
12. Osuna, C, Parody, N, Cacheiro-Llaguno, C, Renshaw-Calderón, A, y Carnés, J. Validación de laboratorio de un método ELISA para medir los niveles de inmunocomplejos circulantes en leishmaniasis visceral canina. Veterinario Inmunol Inmunopatíaco. (2022) 254:110518. doi: 10.1016/j.vetimm.2022.110518
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Cacheiro-Llaguno, C, Parody, N, Escutia, MR y Carnés, J. Papel de los complejos inmunes circulantes en la patogénesis de la Leishmaniasis canina: nuevos actores en el desarrollo de vacunas. Microorganismos. (2021) 9:712. doi: 10.3390/microorganismos9040712
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Miró, G, Oliva, G, Cruz, I, Cañavate, C, Mortarino, M, Vischer, C, et al. Estudio clínico multicéntrico y controlado para evaluar la eficacia y seguridad de la miltefosina y el alopurinol para la leishmaniosis canina. Veterinario Dermatol. (2009) 20:397–404. doi: 10.1111/j.1365-3164.2009.00824.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Mancianti, F, y Meciani, N. Serodiagnóstico específico de la leishmaniasis canina por inmunofluorescencia indirecta, hemaglutinación indirecta y contrainmunoelectroforesis. Am J Vet Res. (1988) 49:1,409–11.
16. IRIS . Sociedad Internacional de Interés Renal. Recomendaciones de tratamiento para la ERC en perros. (2023). Disponible en: http://www.iris-kidney.com/guidelines/recommendations.html (consultado el 16 de junio de 2023).
17. Creevy, KE, Grady, J, Little, SE, Moore, GE, Strickler, BG, Thompson, S, et al. Pautas de la etapa de la vida canina de la AAHA. J Am Anim Hosp Assoc. (2019) 55:267–90.
18. Solano-Gallego, L, Miró, G, Koutinas, A, Cardoso, L, Pennisi, MG, Ferrer, L, et al. Guías LeishVet para el manejo práctico de la leishmaniosis canina. Vectores parásitos. (2011) 4:86. doi: 10.1186/1756-3305-4-86
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Meléndez-Lazo, A, Ordeix, L, Planellas, M, Pastor, J, y Solano-Gallego, L. Hallazgos clinicopatológicos en perros enfermos infectados naturalmente con Leishmania infantum: comparación de cinco sistemas de clasificación clínica diferentes. Res Vet Sci. (2018) 117:18–27. doi: 10.1016/j.rvsc.2017.10.011
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Almeida, MAO, EEV, J, MLB, S-A, Alves, LC, MEA, B, y Atta, AM. Aspectos clínicos y serológicos de la leishmaniasis visceral en perros del nordeste brasileño infectados naturalmente con Leishmania chagasi. Parasitol veterinario. (2005) 127:227–32. doi: 10.1016/j.vetpar.2004.10.010
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Ribeiro, RR, da Silva, SM, de Oliveira Fulgêncio, G, Michalick, MSM, y FJG, F. Relación entre los signos clínicos y patológicos y la gravedad de la leishmaniasis canina. Rev Bras Parasitol Vet. (2013) 22:373–8. doi: 10.1590/S1984-29612013000300009
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Sabaté, D, Llinás, J, Homedes, J, Sust, M, y Ferrer, L. Un ensayo clínico aleatorizado, abierto, controlado y de un solo centro para evaluar la eficacia preventiva de un programa de tratamiento basado en domperidona contra la leishmaniasis canina clínica en un área de alta prevalencia. Prev Vet Med. (2014) 115:56–63. doi: 10.1016/j.prevetmed.2014.03.010
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Wylie, CE, Carbonell-Antoñanzas, M, Aiassa, E, Dhollander, S, Zagmutt, FJ, Brodbelt, DC, et al. Una revisión sistemática de la eficacia de las medidas de control profiláctico para la leishmaniosis canina natural, parte I: vacunas. Prev Vet Med. (2014) 117:7–18. doi: 10.1016/j.prevetmed.2014.06.015
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Fernández, M, Tabar, MD, Arcas, A, Mateu, C, Homedes, J y Roura, X. Comparación de la eficacia y seguridad de las medidas preventivas utilizadas contra la leishmaniasis canina en países del sur de Europa: estudio retrospectivo longitudinal en 1647 perros con clientes (2012-2016). Parasitol veterinario. (2018) 263:10–7. doi: 10.1016/j.vetpar.2018.09.014
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Segarra, S, Miró, G, Montoya, A, Pardo-Marín, L, Boqué, N, Ferrer, L, et al. Ensayo aleatorizado, controlado con alopurinol, de los efectos de los nucleótidos de la dieta y el compuesto activo correlacionado con la hexosa en el tratamiento de la leishmaniosis canina. Parasitol veterinario. (2017) 239:50–6. doi: 10.1016/j.vetpar.2017.04.014
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Segarra, S, Miró, G, Montoya, A, Pardo-Marín, L, Teichenné, J, Ferrer, L, et al. Prevención de la progresión de la enfermedad en perros infectados por Leishmania infantum con nucleótidos dietéticos y compuestos activos correlacionados con la hexosa. Vectores parásitos. (2018) 11:103. doi: 10.1186/s13071-018-2705-z
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Dea-Ayuela, MA, Segarra, S, Serrano, DR, y Bolás-Fernández, F. Los nucleótidos y el AHCC mejoran las respuestas de Th1 in vitro en células murinas estimuladas/infectadas por Leishmania. Moléculas. (2020) 25:3918. doi: 10.3390/moléculas25173918
28. Segarra, S . Modulación nutricional de la respuesta inmune mediada por nucleótidos en la leishmaniosis canina. Microorganismos. (2021) 9:2601. doi: 10.3390/microorganismos9122601
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Roura, X, Fondati, A, Lubas, G, Gradoni, L, Maroli, M, Oliva, G, et al. Pronóstico y seguimiento de la leishmaniasis en perros: informe de un grupo de trabajo. Veterinario J. (2013) 198:43–7. doi: 10.1016/j.tvjl.2013.04.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Miranda, S, Roura, X, Picado, A, Ferrer, L, y Ramis, A. Caracterización del sexo, la edad y la raza para una población de perros enfermos de leishmaniosis canina. Res Vet Sci. (2008) 85:35–8. doi: 10.1016/j.rvsc.2007.09.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Gálvez, R, Miró, G, Descalzo, MA, Nieto, J, Dado, D, Martín, O, et al. Tendencias emergentes en la seroprevalencia de la leishmaniasis canina en la Comunidad de Madrid. Parasitol veterinario. (2010) 169:327–34. doi: 10.1016/j.vetpar.2009.11.025
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Silva, SS, de Macedo, LO, de Oliveira, JCP, Alves, LC, de Carvalho, GA, y Ramos, RAN. Leishmaniasis visceral canina: factores de riesgo y análisis espacial en un área endémica del nordeste de Brasil. Rev Bras Parasitol Vet. (2023) 32:E003223. doi: 10.1590/S1984-29612023029
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Dos Reis, AT, do Carmo Silva, CF, Rocha, TB, DJB, C, da Costa, AP, Costa, FB, et al. Exposición e infección por Leishmania infantum en perros domésticos en un área del bioma Cerrado, Maranhão, Brasil. Informes de sementales veterinarios de parasitol reg. (2023) 39:100851. doi: 10.1016/j.vprsr.2023.100851
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Chiyo, L, Dos Santos, AG, de Souza, AB, Rivas, AV, Valle, SB, da Paixão Sevá, A, et al. Análisis transversal espacial y epidemiológico de casos de leishmaniasis visceral canina en la región de la triple frontera, Brasil, Argentina y Paraguay, entre 2015 y 2020. Acta Trop. (2023) 239:106811. doi: 10.1016/j.actatropica.2022.106811
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. da SS, CC, Barbosa, DS, Oliveira, VC, Cardoso, DT, Guimarães, NS, y Carneiro, M. Factores asociados a los casos de leishmaniasis visceral humana durante las epidemias urbanas en Brasil: una revisión sistemática. Parasitología. (2021) 148:639–47. doi: 10.1017/S0031182021000019
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Ávila, IR, de Araújo, GR, Barbosa, DS, y Bezerra, JMT. Incidencia de leishmaniasis visceral humana en la región centro-oeste de Brasil: una revisión sistemática. Acta Trop. (2023) 237:106707. doi: 10.1016/j.actatropica.2022.106707
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Amusategui, I, Sainz, A, Rodríguez, F, y Tesouro, MA. Distribución y relaciones entre parámetros clínicos y biopatológicos en la leishmaniasis canina. Eur J Epidemiol. (2003) 18:147–56. doi: 10.1023/a:1023090929302
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Reis, AB, Martins-Filho, OA, Teixeira-Carvalho, A, Carvalho, MG, Mayrink, W, França-Silva, JC, et al. La densidad de parásitos y el deterioro del estado bioquímico/hematológico se asocian con aspectos clínicos graves de la leishmaniasis visceral canina. Res Vet Sci. (2006) 81:68–75. doi: 10.1016/j.rvsc.2005.09.011
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. da Costa-Val, AP, Cavalcanti, RR, de Figueiredo, GN, Marques Michalick, MS, Alexander, B, Williams, P, et al. Leishmaniasis visceral canina: relaciones entre el estado clínico, la respuesta inmune humoral, la hematología y la infectividad por Lutzomyia (Lutzomyia) longipalpis. Veterinario J. (2007) 174:636–43. doi: 10.1016/j.tvjl.2006.11.006
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Torrecilha, RBP, Utsunomiya, YT, Bosco, AM, Almeida, BF, Pereira, PP, Narciso, LG, et al. Correlaciones entre la carga parasitaria periférica y las alteraciones clínicas y de laboratorio comunes en perros con leishmaniasis visceral. Prev Vet Med. (2016) 132:83–7. doi: 10.1016/j.prevetmed.2016.08.006
41. Riera, C, Valladares, JE, Gállego, M, Aisa, MJ, Castillejo, S, Fisa, R, et al. Seguimiento serológico y parasitológico en perros infectados experimentalmente con Leishmania infantum y tratados con antimoniato de meglumina. Parasitol veterinario. (1999) 84:33–47. doi: 10.1016/S0304-4017(99)00084-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Paradies, P, Sasanelli, M, de Caprariis, D, Testini, G, Traversa, D, Lia, RP, et al. Seguimiento clínico y de laboratorio de perros infectados de forma natural por Leishmania infantum. Veterinario J. (2010) 186:370–3. doi: 10.1016/j.tvjl.2009.09.011
43. Paltrinieri, S, Gradoni, L, Roura, X, Zatelli, A, y Zini, E. Pruebas de laboratorio para el diagnóstico y seguimiento de la leishmaniasis canina. Veterinario Clin Pathol. (2016) 45:552–78. doi: 10.1111/vcp.12413
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Villanueva-Saz, S, Ballesté, C, Casasnovas, AF, Estevez, AY, y Arribas, MTV. Bisalbuminemia en un perro con leishmaniosis tras la administración del protocolo terapéutico anti-Leishmania: una condición rara detectada en el electroforetograma. Representante de casos de Vet Rec. (2020) 8:E001290. doi: 10.1136/vetreccr-2020-001290
45. Torres, M, Bardagí, M, Roura, X, Zanna, G, Ravera, I, y Ferrer, L. Seguimiento a largo plazo de perros diagnosticados de leishmaniosis (estadio clínico II) y tratados con antimoniato de meglumina y alopurinol. Veterinario J. (2011) 188:346–51. doi: 10.1016/j.tvjl.2010.05.025
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Foglia Manzillo, V, Di Muccio, T, Cappiello, S, Scalone, A, Paparcone, R, Fiorentino, E, et al. Estudio prospectivo sobre la incidencia y progresión de los signos clínicos en perros naïve infectados de forma natural por Leishmania infantum. PLoS negl trop dis. (2013) 7:E2225. doi: 10.1371/journal.pntd.0002225
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Rodríguez, A, Solano-Gallego, L, Ojeda, A, Quintana, J, Riera, C, Gállego, M, et al. Dinámica de los isotipos de inmunoglobulinas específicas de Leishmania en perros con leishmaniasis clínica antes y después del tratamiento. J Veterinario Pasante Med. (2006) 20:495–8. doi: 10.1892/0891-6640(2006)20[495:doliii]2.0.co; 2
48. Teixeira Neto, RG, Giunchetti, RC, Carneiro, CM, de Almeida Vitor, RW, Coura-Vital, W, Quaresma, PF, et al. Relación de los niveles de IgG específicos de Leishmania y la avidez de IgG con la densidad parasitaria y los signos clínicos en la leishmaniasis canina. Parasitol veterinario. (2010) 169:248–57. doi: 10.1016/j.vetpar.2010.01.023
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. de Freitas, JCC, Lopes-Neto, BE, de Abreu, CRA, Coura-Vital, W, Braga, SL, Reis, AB, et al. Perfil de anticuerpos anti-Leishmania relacionados con el cuadro clínico en la leishmaniasis visceral canina. Res Vet Sci. (2012) 93:705–9. doi: 10.1016/j.rvsc.2011.12.009
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Koutinas, AF, y Koutinas, CK. Mecanismos patológicos subyacentes a los hallazgos clínicos en la leishmaniosis canina por Leishmania infantum/chagasi. Veterinario Pathol. (2014) 51:527–38. doi: 10.1177/0300985814521248
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Proverbio, D, Spada, E, Bagnagatti de Giorgi, G, Perego, R, y Valena, E. Relación entre el título IFAT de Leishmania y las manifestaciones clinicopatológicas (puntuación clínica) en perros. Biomed Res Int. (2014) 2014:412808. doi: 10.1155/2014/412808
Resumen de PubMed | Texto completo de Crossref | Google Académico
52. Buxbaum, LU . La infección por Leishmania mexicana induce IgG a los fosfolípidos de glicoinositol de superficie del parásito que pueden inducir IL-10 en ratones y humanos. PLoS negl trop dis. (2013) 7:E2224. doi: 10.1371/journal.pntd.0002224
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: Leishmania infantum, depósito de inmunocomplejos, leishmaniosis canina, biomarcador, PEG-ELISA
Cita: Sarquis J, Parody N, Montoya A, Cacheiro-Llaguno C, Barrera JP, Checa R, Daza MA, Carnés J y Miró G (2024) Validación clínica de inmunocomplejos circulantes para su uso como marcador diagnóstico de leishmaniosis canina. Frente. Vet. Sci. 11:1368929. doi: 10.3389/fvets.2024.1368929
Recibido: 11 de enero de 2024; Aceptado: 01 de marzo de 2024;
Publicado: 18 Marzo 2024.
Editado por:
Barbara Moroni, Instituto Zooprofiláctico Experimental para Piamonte, Liguria y Valle de Aosta (IZSPLVA), Italia
Revisado por:
Vinícius Silva Belo, Universidade Federal de São João del-Rei, Brasil
Giulia Morganti, Universidad de Perugia, Italia
Copyright © 2024 Sarquis, Parody, Montoya, Cacheiro-Llaguno, Barrera, Checa, Daza, Carnés y Miró. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Guadalupe Miró, gmiro@ucm.es
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía