Células endocrinas inmunopositivas con glucagón e insulina en conductos biliares extrahepáticos porcinos
 Células endocrinas inmunopositivas con glucagón e insulina en conductos biliares extrahepáticos porcinos y vesícula biliar
Células endocrinas inmunopositivas con glucagón e insulina en conductos biliares extrahepáticos porcinos y vesícula biliar
 Ivaylo Stefanov Stefanov1 ,2 * †
Ivaylo Stefanov Stefanov1 ,2 * †  Stefan Ivaylov Stefanov3 †
Stefan Ivaylov Stefanov3 †  Maya Vladova Gulubova2 ,4 †
Maya Vladova Gulubova2 ,4 †- 1Departamento de Anantomía, Facultad de Medicina, Universidad de Trakia, Stara Zagora, Bulgaria
- 2Departamento de Anatomía, Histología y Embriología, Patología, Universidad Prof. Dr. Asen Zlatarov, Burgas, Bulgaria
- 3Facultad de Medicina, estudiante de sexto año, Universidad de Trakia, Stara Zagora, Bulgaria
- 4Departamento de Patología General y Clínica, Facultad de Medicina, Universidad de Trakia, Stara Zagora, Bulgaria
Introducción: Se han encontrado células β y células α pancreáticas en los conductos biliares extrahepáticos murinos, pero no en la vesícula biliar. Sin embargo, no se ha reportado información en la literatura especializada sobre la presencia de células endocrinas que expresan glucagón e insulina en los conductos biliares porcinos y la vesícula biliar.
Objetivo: Nuestro objetivo fue realizar un estudio inmunohistoquímico para identificar las células positivas para glucagón e insulina y su distribución en los conductos biliares extrahepáticos porcinos y en la vesícula biliar.
Método: El método inmunohistoquímico se utilizó para detectar la presencia y distribución de células endocrinas positivas para glucagón e insulina en el conducto hepático común (ductus hepaticus communis), el conducto biliar común (ductus choledochus), el conducto cístico (ductus cysticus) y la vesícula biliar (vesica fellea) de cerdos machos. La cromogranina A se utilizó como marcador típico de las células endocrinas.
Resultados: La densidad de células positivas para cromogranina A, glucagón e insulina por campo fue mayor en el colédoco, seguido del colédoco, seguido del colédoco hepático, el conducto cístico y la vesícula biliar. Los tres tipos de células endocrinas mostraron una localización específica en las glándulas superficiales y profundas de los órganos estudiados.
Conclusión e importancia clínica: La distribución de células endocrinas inmunopositivas a glucagón e insulina en el tracto biliar extrahepático porcino se estableció por primera vez como una nueva fuente de estas hormonas. La presencia de células α y β en el epitelio de las vías biliares extrahepáticas se puede aplicar en el tratamiento de la diabetes, teniendo en cuenta la posibilidad de reprogramar el epitelio biliar a los tipos de células endocrinas pancreáticas mencionadas.
Introducción
Debido a la similitud en el peso corporal, la anatomía y la fisiología entre los cerdos y los humanos, el cerdo se ha convertido en un modelo para las investigaciones morfológicas, fisiológicas, bioquímicas y genéticas (1).
Las similitudes anatómicas y fisiológicas de órganos como el hígado, el páncreas, el riñón y el corazón también han convertido al cerdo en una especie importante de interés como donante de órganos para procedimientos de xenotrasplante (2, 3).
A pesar de las pequeñas diferencias morfológicas, los cerdos son la especie ideal para el xenotrasplante de hígado. Los avances médicos modernos han permitido el xenotrasplante de hígado de donantes de cerdos modificados genéticamente. Las nuevas técnicas médicas podrían hacer del xenotrasplante un método importante para resolver el problema de proporcionar hígados de donantes humanos (3-7).
Es bien sabido que las vías biliares extrahepáticas están representadas por el conducto hepático común (conducto hepático común, DHC), el conducto biliar común (conducto coledochus, DCH) y el conducto cístico (conducto quístico, DC). La vesícula biliar (Vesica biliaris, VB) recoge la bilis y la libera a través del conducto cístico hacia el conducto biliar común (8, 9).
Teniendo en cuenta el origen común del páncreas y la vesícula biliar junto con las vías biliares extrahepáticas (10-12), es importante saber si el tracto biliar porcino tiene células endocrinas productoras de insulina y glucagón que pueden contribuir a la fisiopatología y al tratamiento de la diabetes. Algunos autores como Dutton et al. (13) describieron una población de células endocrinas de tipo pancreático que se localizan en los conductos biliares extrahepáticos murinos. Las células insulinarias positivas se describieron como situadas entre los colangiocitos de los conductos biliares, pero no entre los colangiocitos de la vesícula biliar. Se definieron como células β productoras de insulina (14). La capacidad del colédoco para generar células pancreáticas se explica principalmente por el desarrollo embriológico común de la bilis y los conductos pancreáticos (8, 12, 14-16). Según Shiojiri (17), el conducto biliar común se desarrolló a partir del endodermo hepático caudal del intestino anterior cerca del primordio pancreático (18-20). Otros autores como Terada et al. (21), encontraron que la amilasa pancreática se expresaba tanto en hepatocitos como en colangiocitos de las vías biliares hiliares primitivas (21). Se estableció que el páncreas endocrino en la lamprea de mar surgió a través de la transdiferenciación del conducto biliar común (22, 23).
En ratones, se estableció que el origen de las células endocrinas proviene del epitelio del conducto biliar, pero no del páncreas (8, 12, 16). Se concluyó que, según su origen, las células β biliares difieren de las pancreáticas.
Se ha desarrollado un nuevo enfoque en las terapias de trasplante de islotes para la diabetes tipo 1 basado en la producción in vitro de células similares a β. Esto puede implicar el uso de células progenitoras de los islotes, células madre adultas y embrionarias, y células β maduras (24-27). Otro método consiste en producir células β a partir de células pertenecientes a tejidos de origen similar al páncreas. Varios autores han logrado convertir los hepatocitos en células similares a β (26, 28-31). Por lo tanto, las células β de DHC, DCH, DC y VB podrían usarse para el tratamiento de la diabetes, pero se deben realizar más estudios en esta dirección.
Nuestro objetivo fue describir por primera vez la localización y densidad de las células endocrinas inmunopositivas de glucagón (GluCs) e insulina (InsCs) en la pared de DHC, DCH, DC y VB porcinos para una mejor comprensión de la fisiopatología y el tratamiento de la diabetes.++
Métodos
Animales
El presente estudio utilizó seis cerdos machos clínicamente sanos de 6 meses de edad (cruce de × búlgaro Landrace) (92-100 kg) suministrados por una sola granja comercial, sometidos a una dieta estándar apropiada para la edad y sacrificados en un matadero regulado aprobado por la Agencia Búlgara de Seguridad Alimentaria, y fue financiado por el Proyecto Científico número 13/2017, Facultad de Medicina, Universidad de Trakia, Stara Zagora, Bulgaria. Se recolectaron seis hígados porcinos, junto con la vesícula biliar, el conducto cístico, el conducto hepático común, el conducto biliar común y el duodeno, de cerdos destinados al consumo de carne en el matadero. Las muestras de tejido se obtuvieron del conducto hepático común (DHC), la parte inicial del conducto cístico (DC) cerca del cuello de la vesícula biliar, la parte inicial del conducto biliar común (DCHO) cerca de la unión con el conducto cístico, la parte intramural del conducto biliar común (DCHI) y el cuello de la vesícula biliar inmediatamente después del sacrificio y se fijaron en una solución acuosa de formalina al 10%.
Se utilizaron técnicas histológicas rutinarias para procesar el material y obtener cortes seriados de parafina que se tiñeron con hematoxilina y eosina para excluir la presencia de hallazgos patológicos. Otra parte de las secciones se procesó inmunohistoquímicamente para la detección de la expresión de glucagón e insulina.
Método inmunohistoquímico para la visualización de células endocrinas positivas para glucagón e insulina en comparación con células endocrinas positivas para cromogranina A
En este trabajo se realizó la técnica ABC (complejo avidina-biotina peroxidasa). Las secciones seriadas de tejido con 5 μm de espesor se lavaron en 0,1 M de PBS y se colocaron en peróxido de hidrógeno al 1,2% en metanol durante 30 min. La recuperación del antígeno en tampón (pH 9,0) se realizó durante 20 min. Entre los pasos, las secciones se lavaron con un tampón de lavado EnVision Flex, luego se incubaron en una cámara humidificada durante la noche a 4 °C con anticuerpos primarios: anticuerpo monoclonal de ratón glucagón (dilución 1:50 en PBS, (C-11) SC-514592, Santa Cruz Biotechnology, Dallas, TX, Estados Unidos), anticuerpo monoclonal de ratón con insulina (dilución 1:50, (2D 11-45), SC-8033, Santa Cruz) y anticuerpo de conejo cromogranina A (PA 0430) (Leica Microsystems Inc.), que estaban listos para usar. La reacción inmune se visualizó con diaminobencidina. En consecuencia, se tiñeron tres secciones seriadas en un portaobjetos con anticuerpos contra el glucagón, la insulina y la cromogranina A. Se utilizaron tres portaobjetos por animal.
Se utiliza PBS en lugar de anticuerpo primario como control negativo.
Análisis estadístico
El número de células endocrinas se estimó en tres campos microscópicos X100 de tres secciones de la DHC y partes extramurales e intramurales de la DCH, la DC y el cuello de la vesícula biliar para cada anticuerpo y por cada animal. Los datos de densidad de células endocrinas (número de células endocrinas por campo y por sección transversal de una glándula) se procesaron con Graph Pad Prism 6 para Windows (Graph Pad Software, Inc., Estados Unidos) mediante ANOVA de un factor seguido de la prueba post-hoc de Tukey-Kramer. Los valores de p inferiores a 0,05 se consideraron estadísticamente significativos. Los datos se presentan como media ± DE.
Resultados
Inmunoexpresión de la cromogranina A
La inmunoexpresión de la cromogranina A (ChA) se utilizó como marcador de células endocrinas para detectar todas las células endocrinas en los órganos estudiados. De esta manera, identificamos el mayor número de células endocrinas (ChrACs) en las glándulas de la vesícula biliar y en las vías biliares extrahepáticas (Figura 1 y Tabla 1). La densidad de ChrACs por campo fue mayor en el DCHI, seguido de DCHO, DHC, DC y VB (Tabla 1).++
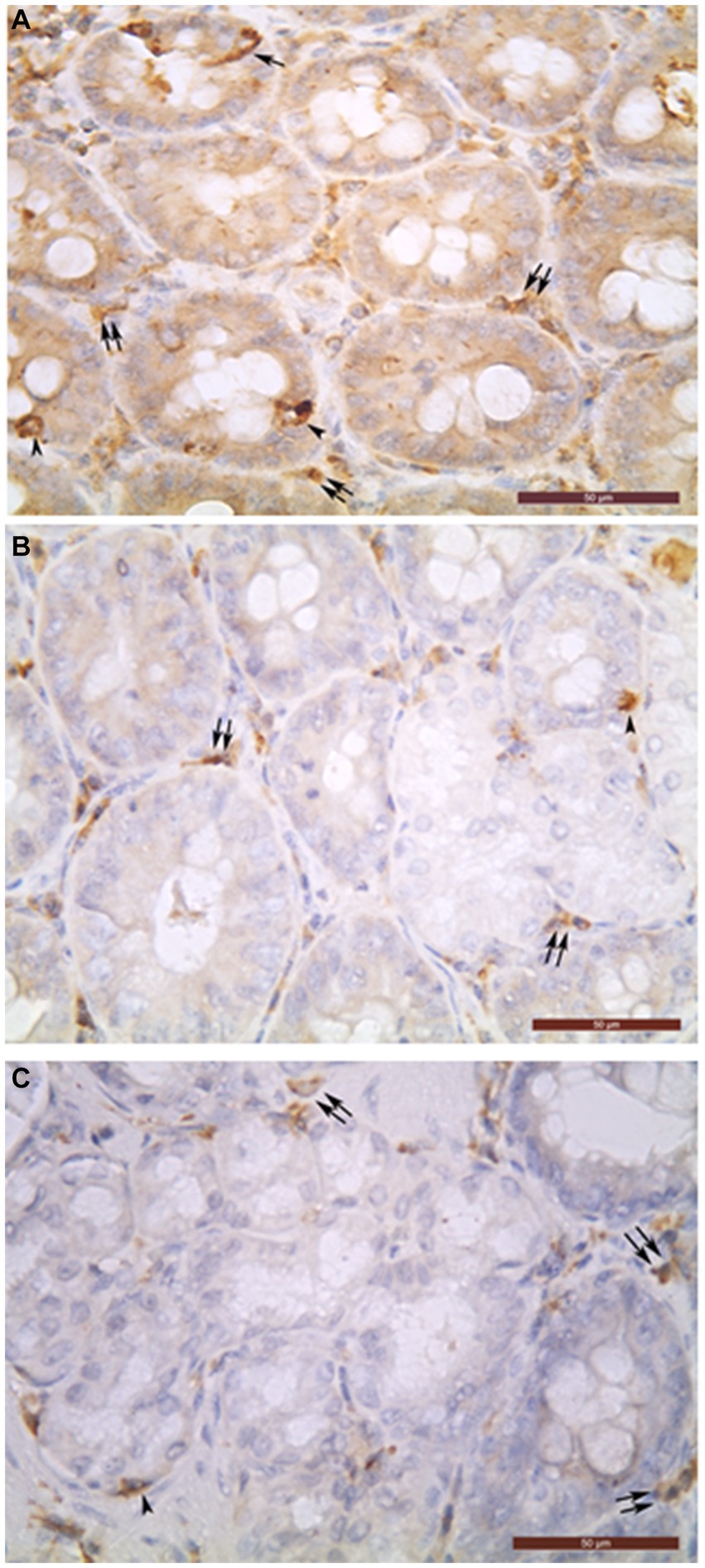 Figura 1. Células positivas para cromogranina A (A), células positivas para glucagón (B) y células glandulares positivas para insulina (C) en la parte intramural del conducto biliar común (A-C). En las glándulas biliares se pueden observar tipos de células endocrinas abiertas (puntas de flecha) y cerradas (flechas). En el tejido conectivo interglandular, también se detectaron muchas células inmunorreactivas de cromogranina A- (A), glucagón (B) e insulina (C) (flechas dobles). Barra = 50 μm.
Figura 1. Células positivas para cromogranina A (A), células positivas para glucagón (B) y células glandulares positivas para insulina (C) en la parte intramural del conducto biliar común (A-C). En las glándulas biliares se pueden observar tipos de células endocrinas abiertas (puntas de flecha) y cerradas (flechas). En el tejido conectivo interglandular, también se detectaron muchas células inmunorreactivas de cromogranina A- (A), glucagón (B) e insulina (C) (flechas dobles). Barra = 50 μm.
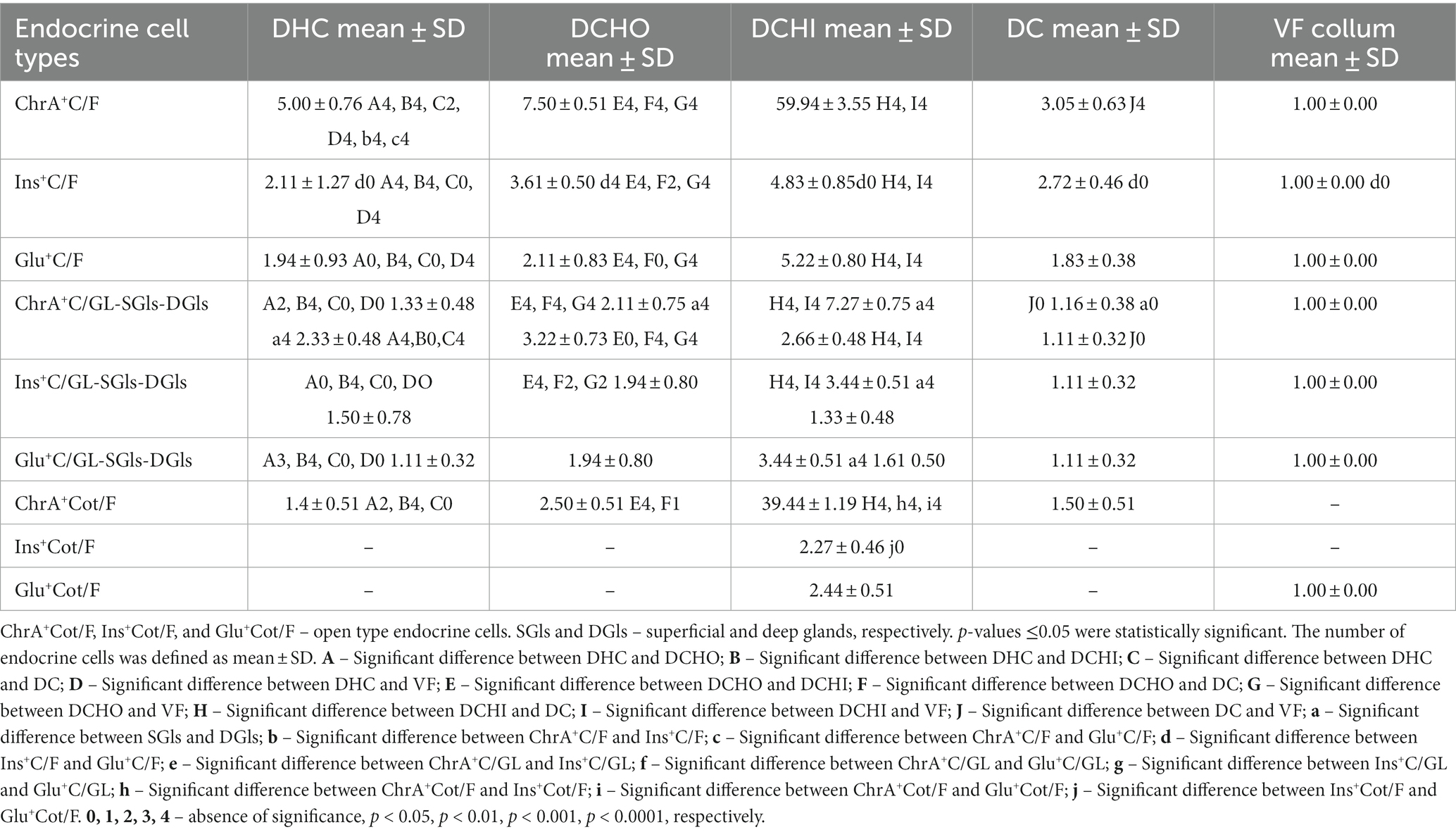 Tabla 1. Número de células positivas para cromogranina A, insulina y glucagón (ChrAC, InsC y GluC, respectivamente) por campo microscópico o por sección transversal (número promedio de secciones de todos los animales) de una glándula en la vesícula biliar (FV), el conducto cístico (DC), el conducto hepático común (DHC), el segmento inicial del conducto coledoco (DCHO) y la parte intraduodenal del conducto coledocus (DCHI) representados como media ± DE (desviación estándar). +++
Tabla 1. Número de células positivas para cromogranina A, insulina y glucagón (ChrAC, InsC y GluC, respectivamente) por campo microscópico o por sección transversal (número promedio de secciones de todos los animales) de una glándula en la vesícula biliar (FV), el conducto cístico (DC), el conducto hepático común (DHC), el segmento inicial del conducto coledoco (DCHO) y la parte intraduodenal del conducto coledocus (DCHI) representados como media ± DE (desviación estándar). +++
El epitelio biliar que recubre la capa mucosa de la vesícula biliar y los conductos extrahepáticos fue inmunonegativo. Solo las células de las glándulas intramurales de los órganos estudiados se observaron inmunopositivas (Figura 1). La densidad de ChrACs por campo fue mayor en DCHI, seguido de DCHO, DHC, DC y VB (Tabla 1).+
Inmunoexpresión de insulina y glucagón
La densidad de InsCs y GluCs se comparó con la de ChrACs para estimar el porcentaje de InsCs y GluCs. Las reacciones inmunohistoquímicas para la detección de insulina y glucagón mostraron que el número de InsCs y GluCs fue menor que el número de ChrACs (Tabla 1). En el DHC, la densidad de InsCs y GluCs fue casi igual, por ejemplo, los InsCs fueron del 42% de todos los ChrAC, pero los GluCs del 39%. En el DCHO, el número de InsC (48% de todos los ChrAC) fue significativamente mayor que el de GluCs (28% de todos los ChrAC). En el DCHI, el número de InsCs (8% de todos los ChrAC) y GluCs (9% de todos los ChrAC) fue similar. En DC, la densidad de InsCs fue del 89% de todas las ChrAC, pero de GluCs del 60%. En VB, el número de InsCs, GluCs y ChrACs fue el mismo.+++++++++++++++++++++++++++
El mayor número de InsCs y GluCs por campo se detectó en el DCHI, seguido del DCHO, DC, DHC y VB (Tabla 1).++
Se observaron más ChrACs por sección transversal de glándulas en las glándulas intramurales superficiales que en las profundas de la DCHO y la DCHI, mientras que en la DHC, estas células de las glándulas profundas fueron en mayor abundancia que en las superficiales (Tabla 1). En la DC, el número de ChrAC en las glándulas superficiales y profundas fue el mismo.++
Las InsCs y las GluCs se encontraron solo en las glándulas superficiales de la DHC, DCHO y DC.++
En el DCHI, se observaron InsCs y GluCs en las glándulas superficiales y profundas. Su número fue mayor que en otros conductos (Tabla 1).++
Células endocrinas de tipo abierto y cerrado
En el VB, los ChrACs e InsCs fueron de tipo cerrado, mientras que los GluCs fueron de tipo abierto.+++
En las vías biliares extrahepáticas se observaron tipos de ChrAC tanto abiertos como cerrados (Figura 1). En el DHC, el porcentaje de ChrAC de tipo abierto fue del 29% y el de tipo cerrado fue del 71%; en el DCHO, el 33% de los ChrAC eran de tipo abierto y el 67% de tipo cerrado; en el DCHI, el 65% eran de tipo abierto y el 35% de tipo cerrado; en el CD, el 49% fueron de tipo abierto y el 51% de tipo cerrado.+++
Los InsCs y los GluCs se representaron por tipo cerrado solo en el DHC, DCHO, DC y VB.++
En el DCHI, tanto los tipos abiertos como los cerrados estaban presentes y su número era igual. Los InsC de tipo abierto fueron el 5,7% de la cantidad total de ChrAC de tipo abierto, pero los GluC de tipo abierto fueron el 6,2% de la cantidad total de ChrAC de tipo abierto.++++
En el tejido conectivo de las capas mucosa, muscular y serosa de todos los órganos estudiados se detectaron abundantes células inmunorreactivas de cromogranina A, glucagón e insulina, pero no fueron descritas en este trabajo porque son objeto de otro estudio aún no publicado (Figura 1).
Discusión
En este estudio, las células β y α porcinas se identificaron inmunohistoquímicamente por primera vez en DHC, DCH, DC y VB porcinos. En nuestro estudio previo (27), se estableció que otras células endocrinas están presentes en la vesícula biliar porcina y en los conductos biliares extrahepáticos, como las células endocrinas positivas para grelina, somatostatina, serotonina y gastrina, pero los datos no se analizaron estadísticamente. En el presente estudio, utilizamos la detección inmunohistoquímica de la cromogranina A como un marcador bien conocido para las células endocrinas para identificar el número total de células endocrinas en el DHC, DCHO, DC y VB. Al igual que en nuestro estudio anterior (27), revelamos la localización de las ChrACs en las glándulas intramurales de los órganos estudiados, pero a diferencia de ese estudio analizamos estadísticamente la distribución de las ChrACs por las glándulas superficiales y profundas. Es bien sabido que ChrA regula los procesos secretores de forma autocrina o paracrina. Se encontró que las células ChrA positivas son células cromafines de la médula suprarrenal, los paraganglios y las células entero-cromafines y las células beta del páncreas (28). Las cromograninas, incluidas ChrA, cromogranina B y secretogranina II, son proteínas ácidas que tienen un papel importante en la formación de gránulos secretores en las células neuroendocrinas (29, 30). Dado que las cromograninas, incluida la cromogranina A, se localizan en las células neuroendocrinas (31), se han utilizado como marcadores apropiados para este tipo de células en diferentes órganos. Helmant et al. (32) encontraron que ChrA puede ser la prohormona de la pancreastatina. Descubrimos que la densidad de ChrACs por campo microscópico fue la mayor en el DCI porcino, seguido por el DCHO, DHC, DC y VB. La densidad de InsCs y GluCs por campo de visión en los mismos órganos mostró una forma similar de distribución.+++++
Nuestro hallazgo sobre la capacidad del epitelio del tracto biliar para producir glucagón e insulina extrapancreáticos puede contribuir a mejorar el tratamiento de la diabetes. Hasta la fecha, no hemos podido detectar la presencia de células secretoras de glucagón en los conductos biliares y la vesícula biliar del cerdo doméstico. El glucagón fue producido principalmente por las células α pancreáticas utilizando su precursor pro-glucagón (33, 34). No hubo información sobre las células secretoras de glucagón en los conductos biliares porcinos y la vesícula biliar.
La morfología y fisiología de las células β pancreáticas han sido bien estudiadas. Hay datos sobre la existencia de células extrapancreáticas positivas para insulina que existen como células individuales o grupos de células en y a lo largo del epitelio de los conductos biliares, pero no en el epitelio de la vesícula biliar. Se consideran verdaderas células β porque producen insulina (35). Existe evidencia de que algunas células epiteliales embrionarias extrahepáticas del conducto biliar pueden transformarse en células β que están reguladas por factores de transcripción como Pdx1 (factor de transcripción pancreático y duodenal 1 (36), HNF6 (37) y Hes1 (38)).
En cuanto a la hiperglucemia diabética tipo 1, está claro que varios factores pueden provocarla, como la pérdida de células β y el aumento postprandial de la secreción de glucagón de las células α (39). Otros autores han sugerido que la secreción inadecuada de glucagón en la diabetes tipo 1 depende de la secreción de glucagón directamente del intestino (40).
Se conocen varios mecanismos para prevenir la hipoglucemia, a saber, la reducción de la secreción de insulina de las células beta, la reducción de la absorción de glucosa en los tejidos periféricos, el aumento de la liberación de glucagón de las células α, el aumento del nivel de glucosa y la estimulación de la médula suprarrenal. Las células α defectuosas y un número reducido de células α en la diabetes tipo 1 alteran las respuestas al glucagón (39).
El estudio de Dutton et al. (13) proporcionó por primera vez datos sobre la localización de las células β fuera del páncreas en mamíferos, concretamente en ratones. Los autores encontraron células β individuales entre los colangiocitos del epitelio de la mucosa biliar, demostrando mediante la medición del ARNm de la insulina que este tipo de células endocrinas surgen precisamente del epitelio de la vía biliar ya en el día 17 embrionario y su número aumenta hasta 6 meses después del nacimiento. Dutton et al. (13) también observaron que aparecían grupos de células en la capa de tejido conectivo de los conductos biliares extrahepáticos en el hilio hepático, aumentando en número después del nacimiento hasta los 6 meses de edad. En cuanto a la presencia de células α, estos autores encontraron células individuales y un número significativamente menor que las células β. Dutton et al. (13) reportaron por primera vez β formación celular a partir de colangiocitos.
A diferencia de Dutton et al. (13), encontramos que las células α y β estaban ausentes en el epitelio mucoso de todos los conductos biliares extrahepáticos. Dichas células se observaron en las glándulas biliares ubicadas en los propios órganos mencionados, con una cantidad de células β cercana a la de células α. A diferencia de Dutton et al. (13), comparamos la cantidad de ambos tipos de células en las diferentes vías biliares extrahepáticas y como porcentaje de todas las células endocrinas positivas para cromogranina A. Por ejemplo, el mayor número de InsCs y GluCs por campo de visión se encontró en el DCHI, seguido por el DCHO, DC, DHC y VB. Los InsCs y GluCs se observaron solo en las glándulas superficiales del DHC, DCHO y DC. En el DCHI, estas células se encontraron tanto en las glándulas superficiales como en las profundas y su número fue el más alto, seguido de DCHO, DHC, DC y VB.++++
En el presente estudio, se observaron células endocrinas alargadas de tipo abierto y células endocrinas ovaladas de tipo cerrado, lo que se correlacionó con los hallazgos de varios autores sobre la forma de las células endocrinas intestinales (35-37). Se sabe que las células endocrinas intestinales de tipo abierto entran en contacto con el contenido luminal, donde reaccionan a los estímulos de sus receptores de membrana apical (33, 34), mientras que las células endocrinas de tipo cerrado no alcanzan la luz y tienen una forma de acción paracrina sobre las células diana circundantes (35). En el presente estudio, se reveló que los tres tipos de células endocrinas (ChrACs, InsCs y GluCs) en el VB eran de tipo cerrado. Sin embargo, en las vías biliares extrahepáticas se observaron tanto de tipo abierto como cerrado de ChrACs. Los InsCs y los GluCs se representaron por tipo cerrado solo en el DHC, DCHO, DC y VB. En el DCHI, los tipos InsCs y GluCs abiertos y cerrados estaban presentes y su número era igual. Por lo tanto, los productos secretores de tipo de célula abierta actuaron localmente o sobre células diana distantes a través del torrente sanguíneo. Las células de tipo cerrado se localizaron entre otras células epiteliales, lo que significa que, al igual que los tipos de células cerradas intestinales, no interactúan directamente con las sustancias luminales (35-37).++++++++
La presencia de células endocrinas positivas para glucagón e insulina en los conductos biliares y la vesícula biliar porcinos puede explicarse por estudios de otros autores (38, 39) que han revelado el papel clave del factor de transcripción Sox9, cuya activación conduce a la transición de células progenitoras pancreáticas a células endocrinas maduras. Por ejemplo, en ratones y humanos, se ha demostrado que la diferenciación de las células endocrinas está regulada principalmente por la retransmisión de Sox9 en la vía de señalización PI3K/Akt (39).
Según Banga et al. (38), las células hepáticas Sox9 están representadas por pequeños conductos biliares, progenitores similares a los hepatoblastos en el área periportal o glándulas peribiliares dentro de conductos biliares más grandes. Así, Banga et al. (38) proporcionaron evidencia de la reprogramación in vivo de las células del conducto biliar a un fenotipo similar al de las células β que puede aliviar la diabetes en individuos adultos.+
Lund et al. (40) revelaron que el glucagón extrapancreático y la hiperglucagonemia postprandial observada en pacientes pancreatectomizados totales pueden tener aplicaciones clínicas y científicas. Estos autores encontraron que el glucagón secretado por el tejido extrapancreático en humanos cambió el concepto de glucagón como una hormona específica del páncreas y, por lo tanto, abrió el camino a una nueva explicación de la hiperglucagonemia postprandial, ya que puede ser un fenómeno dependiente del intestino. Lund et al. (40) sugirieron que el glucagón derivado del intestino podría desempeñar un papel previamente desconocido en la diabetes secundaria, después de la pancreatectomía, y posiblemente, aunque especulativamente, también en la fisiopatología de otras afecciones después de la hiperglucagonemia dietética, incluida la diabetes tipo 2.
Supusimos que la presencia de células productoras de glucagón en los conductos biliares extrahepáticos porcinos y en la vesícula biliar probablemente estaba relacionada con la capacidad de esta hormona para realizar la misma función en estos órganos, como el intestino. Basándonos en los resultados de nuestra investigación, planteamos la hipótesis de que existe una conexión funcional entre los conductos biliares extrahepáticos y los islotes de Langerhans que puede definirse como un eje biliar-islote, similar a la conexión funcional entre el intestino y los islotes de Langerhans denominada por Fehmann et al. (41) el eje entero-islote. El tratamiento de la diabetes tipo 1 mediante el trasplante de islotes pancreáticos se ha investigado durante muchos años y se ha aplicado con un éxito creciente, pero el número de trasplantes fue limitado debido a la limitada oferta de donantes (19). Es por ello que se han buscado formas alternativas de sintetizar células β (20). Varios estudios han demostrado que los hepatocitos (26) y las células acinares pancreáticas (42) pueden transformarse en células β. Estos hallazgos definen a las células endocrinas biliares como un componente del sistema endocrino gastroenteropancreático y como otra fuente de glucagón e insulina, que podrían utilizarse en el desarrollo de nuevos enfoques en el tratamiento de la diabetes mellitus. Las células endocrinas en los conductos excretores pancreáticos liberan insulina, glucagón, somatostatina y polipéptido pancreático que podrían regular la función de las células acinares pancreáticas de rata (43) e influir en la producción de bilis (44). La diabetes mellitus influye en la función de las células endocrinas de los conductos y altera el metabolismo del colesterol en la dirección de la formación de cálculos en los conductos biliares y pancreáticos (45, 46). Las células positivas para glucagón en los conductos biliares intestinales y extrahepáticos participan en la conexión funcional entre estos órganos y las islas pancreáticas.
Conclusión
La distribución original de nuestro estudio fue la identificación de células β y α porcinas en los conductos biliares extrahepáticos porcinos y la vesícula biliar. El mayor número de células positivas para glucagón e insulina se detectó en la parte intramural del DCH, seguida de su parte extramural, la DC, la DHC y la VB. Estos hallazgos definieron las células endocrinas biliares como componentes del sistema endocrino gastroenteropancreático y como otra fuente de glucagón e insulina, que pueden ser utilizadas en el desarrollo de nuevos enfoques en el tratamiento de la diabetes mellitus.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue aprobado por el Comité de Ética de la Agencia Búlgara de Seguridad Alimentaria. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
IS: Conceptualización. IS, MG: Metodología. IS: Software, Análisis formal. IS: Investigación. IS: Curación de datos. IS: Escritura – preparación del borrador original. IS, SS y MG: Redacción – revisión y edición. IS y SS: Visualización. IS: Supervisión. IS: Administración de proyectos. Todos los autores han leído y están de acuerdo con la versión publicada del manuscrito.
Financiación
Este estudio fue financiado por el Ministerio de Educación y Ciencia de Bulgaria (MES) en el marco del Plan Nacional de Recuperación y Resiliencia de Bulgaria, Componente «Bulgaria Innovadora», proyecto no. BG-RRP-2.004-0006-C02 «Desarrollo de la investigación y la innovación en la Universidad de Trakia al servicio de la salud y el bienestar sostenible».
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Murtaugh, diputado , Monteiro-Rivière, NA y Panepinto, L . Razas, métodos y modelos biomédicos de investigación porcina. M. E. Tumbleson y L. B. Schook, (Eds.) Avances porcinos en la investigación biomédica, Springer Nueva York, NY (1996), p. 423-424
2. Humphray, SJ , Scott, CE , Clark, R , Marrón, B , Dobladora, C , Camm, N, et al. Un mapa integrado de alta utilidad del genoma del cerdo. Genoma Biol. (2007) 8:R139. doi: 10.1186/gb-2007-8-7-r139
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Eberhard, D , Tosh, D y Slack, JMW . Origen de las células endocrinas pancreáticas a partir del epitelio del conducto biliar. Cell Mol Life Sci. (2008) 65:3467–80. doi: 10.1007/s00018-008-8427-1
4. Nakanuma, Y , Hoso, M , Sanzen, T y Sasaki, M . Microestructura y desarrollo de las vías biliares normales y patológicas en humanos, incluido el suministro de sangre. Microsc Res Tech. (1997) 38:552–70. doi: 10.1002/(SICI)1097-0029(19970915)38:6<552::AID-JEMT2>3.0.CO; 2-H
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Edlund, HD . Biología del desarrollo del páncreas. Diabetes. (2001) 50:S5-9. doi: 10.2337/diabetes.50.2007.S5
6. Gu, G , Dubauskaite, J y Melton, DA . Evidencia directa del linaje pancreático: las células NGN3+ son progenitoras de los islotes y son distintas de las progenitoras de los conductos. Desarrollo. (2002) 129:2447–57. doi: 10.1242/dev.129.10.2447
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Mehta, S y Gittes, GK . Diferenciación pancreática. J Hepato Cirugía de Páncreas Biliar (2005) 12:208–17. doi: 10.1007/s00534-005-0981-4
8. Murtaugh, LC y Melton, DA . Genes, señales y linajes en el desarrollo del páncreas. Annu Rev Cell Dev Biol. (2003) 19:71–89. doi: 10.1146/annurev.cellbio.19.111301.144752
9. Percival, A.C. y Slack, JMW . Análisis del desarrollo pancreático mediante una etiqueta de linaje celular. Exp Cell Res. (1999) 247:123–32. doi: 10.1006/excr.1998.4322
10. Zambrowicz, BP , Imamoto, A , Disparando, S , Herzenberg, LA , Kerr, WG y Soriano, P . La interrupción de los transcritos superpuestos en la cepa trampa génica ROSA beta geo 26 conduce a una expresión generalizada de beta-galactosidasa en embriones de ratón y células hematopoyéticas. Proc Natl Acad Sci U S A. (1997) 94:3789–94. doi: 10.1073/pnas.94.8.3789
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Fukuda, A , Kawaguchi, Y , Furuyama, K , Kodama, S , Horiguchi, M , Kuhara, T, et al. La formación de páncreas ectópico en ratones knockout de Hes1 revela la plasticidad de los progenitores endodérmicos del intestino, el conducto biliar y el páncreas. J Clin Invest. (2006) 116:1484–93. doi: 10.1172/jci27704
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Clotman, F , Lannoy, VJ , Reber, M , Cereghini, S , Cassiman, D , Jacquemin, P, et al. El factor de transcripción de un corte HNF6 es necesario para el desarrollo normal de las vías biliares. Desarrollo. (2002) 129:1819–28. doi: 10.1242/dev.129.8.1819
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Dutton, JR , Chillingworth, Países Bajos , Eberhard, D , Brannon, CR , Hornsey, MA , Tosh, D, et al. Las células beta se encuentran de forma natural en los conductos biliares extrahepáticos de los ratones. J Cell Sci. (2007) 120:239–45. doi: 10.1242/jcs.03330
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Offield, MF , Jetton, TL , Labosky, PA , Rayo, M , Stein, RW , Magnuson, MA, et al. PDX-1 es necesario para el crecimiento pancreático y la diferenciación del duodeno rostral. Desarrollo. (1996) 122:983–95. doi: 10.1242/dev.122.3.983
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Elliott, WM y Youson, JH . Desarrollo del páncreas endocrino adulto durante la metamorfosis en la lamprea de mar, petromyzon marinus L. II. Microscopía electrónica e inmunocitoquímica. Anat Rec. (1993) 237:271–90. doi: 10.1002/ar.1092370214
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Holgura, JMW y Tosh, D . Transdiferenciación y metaplasia: cambio de tipos celulares. Curr Opin Genet Dev. (2001) 11:581–6. doi: 10.1016/s0959-437x(00)00236-7
17. Shiojiri, N . Desarrollo y diferenciación de los conductos biliares en el hígado de los mamíferos. Microsc Res Tech. (1997) 39:328–35. doi: 10.1002/(SICI)1097-0029(19971115)39:4<328::AID-JEMT3>3.0.CO; 2-D
18. Madsen, OD . Células madre y tratamiento de la diabetes. APMIS. (2005) 113:858–75. doi: 10.1111/j.1600-0463.2005.apm_418.x
19. Merani, S y Shapiro, AM . Estado actual del trasplante de islotes pancreáticos. Clin Sci. (2006) 110:611–25. doi: 10.1042/CS20050342
20. Sansón, S.L. y Chan, L . Terapia génica para la diabetes: reinventando el islote. Tendencias Endocrinol Metab. (2006) 17:92–100. doi: 10.1016/j.tem.2006.02.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Terada, T , Kato, M , Endo, K y Kitamura, Y . Expresión de la proteína alfa-amilasa pancreática y ARN mensajero en conductos biliares primitivos hiliares y hepatocitos durante la organogénesis hepática fetal humana: un estudio inmunohistoquímico y de hibridación in situ. Hígado. (1998) 18:313–9. doi: 10.1111/j.1600-0676.1998.tb00811.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Shapiro, AM , Lakey, JR , Ryan, EA , Korbutt, GS , Toth, E , Warnock, GL, et al. Trasplante de islotes en siete pacientes con diabetes mellitus tipo 1 con régimen inmunosupresor libre de glucocorticoides. N Engl J Med. (2000) 343:230–8. doi: 10.1056/NEJM200007273430401
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Ber, I , Shternhall, K , Perl, S , Ohanuna, Z , Goldberg, I , Barshack, I, et al. Transdiferenciación funcional, persistente y extendida del hígado al páncreas. J Biol Chem. (2003) 278:31950–7. doi: 10.1074/jbc. M303127200
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Ferber, S , Halkin, A , Cohen, H , Ber, I , Einav, Y , Goldberg, I, et al. El gen homeobox 1 pancreático y duodenal induce la expresión de genes de insulina en el hígado y mejora la hiperglucemia inducida por estreptozotocina. Nat Med. (2000) 6:568–72. doi: 10.1038/75050
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Zalzman, M , Gupta, S , Giri, RK , Berkovich, I , Sappal, BS , Karnieli, O, et al. Reversión de la hiperglucemia en ratones mediante el uso de células productoras de insulina expandibles humanas diferenciadas de las células progenitoras del hígado fetal. Proc Natl Acad Sci U S A. (2003) 100:7253–8. doi: 10.1073/pnas.1136854100
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Zalzman, M , Anker-Kitai, L y Efra, S . Diferenciación de células productoras de insulina derivadas del hígado humano hacia el fenotipo de células beta. Diabete. (2005) 54:2568–75. doi: 10.2337/diabetes.54.9.2568
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Gulubova, M , Vlaykova, I , Ivanova, K , Ganeva, I , Prangova, D , Ignatova, M, et al. Células endocrinas en vesícula biliar de cerdo, conducto quístico y conducto coledochus con especial referencia a la grelina. Bulg Chem Commun. (2017):184–90.
28. Waldum, HL y Syversen, U . La cromogranina a (CGA) y la célula similar a la enterocromafín (ECL). Adv Exp Med Biol. (2000) 482:361–7. doi: 10.1007/0-306-46837-9_29
29. Huttner, WB , Gerdes, HH y Rosa, P . La familia de las graninas (chromogranin/secretogranin). Tendencias Biochem Sci. (1991) 16:27–30. doi: 10.1016/0968-0004(91)90012-K
30. Tatemoto, K , Efendicmutt, SV , Makk, G , Feistner, GJ y Barchas, JD . Pancreastatina, un nuevo péptido pancreático que inhibe la secreción de insulina. Naturaleza. (1986) 324:476–8. doi: 10.1038/324476a0
31. Gkolfinopoulos, S , Tsapakidis, K , Papadimitriou, K , Papamichael, D y Kountourakis, P . La cromogranina a como marcador válido en oncología: ¿aplicación clínica o falsas esperanzas? Mundo J Methodol. (2017) 7:9–15. doi: 10.5662/wjm.v7.i1.9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Helmant, L , Tomás, G , Miguel, A , Levineg, A y Pamela, C . Clonación molecular y estructura primaria del ADNc de la cromogranina a humana (proteína secretora I). J Biol Chem. (1988) 263:11559–63. doi: 10.1016/S0021-9258(18)37995-X
33. Fujita, T y Kobayashi, S . Las células y hormonas del sistema endocrino GEP: los estudios actuales En: T Fujita editor. Sistema endocrino gastro-entero-pancreático: Un enfoque celular-biológico : Igaku ShoinTokyo (1974). 1–16.
34. Grube, D y Forssmann, WG . Morfología y función de las células enteroendocrinas. Horm Metab Res. (1979) 1:589–606. doi: 10.1055/s-0028-109278
35. Höfer, D , Asan, E y Dren, D . Ckhahn. Chemosens Percept Gut Physiol. (1999) 14:18–23. doi: 10.1152/physiologyonline.1999.14.1.18
36. Dockray, GJ . Detección luminal en el intestino: una visión general. J Physiol Pharmacol. (2003) 54:9–17.
37. Dockray, G . Secreciones endocrinas intestinales y su relevancia para la saciedad. Curr Opin Pharmacol. (2004) 4:557–60. doi: 10.1016/j.coph.2004.05.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Banga, AE , Akinci, L , Greder, V , Dutton, JR y Slack, JMW . Reprogramación in vivo de células Sox9+ en el hígado a conductos secretores de insulina. Proc Natl Acad Sci. (2012) 109:15336–41. doi: 10.1073/pnas.1201701109
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. McDonald, E , Li, J , Krishnamurthya, M , Becario, GF , Goodyer, CG y Wang, R . SOX9 regula la diferenciación de las células endocrinas durante el desarrollo del páncreas fetal humano. Int J Biochem Cell Biol. (2012) 44:72–83. doi: 10.1016/j.biocel.2011.09.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Lund, A , Knop, FK y Vilsboll, T . Agonistas del receptor del péptido-1 similar al glucagón para el tratamiento de la diabetes tipo 2: diferencias y similitudes. Eur J Pasante Med. (2014) 25:407–14. doi: 10.1016/j.ejim.2014.03.005
41. Fehmann, HC , Göke, R y Göke, B . Biología celular y molecular de las hormonas incretinas péptido similar al glucagón-I y polipéptido liberador de insulina dependiente de glucosa. Endocr Rev. (1995) 16:390–410. doi: 10.1210/edrv-16-3-390
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Baeyens, L , De Breuck, S , Lardon, J , Mfopou, J , Rooman, I y Bouwens, L . Generación in vitro de células beta productoras de insulina a partir de células pancreáticas exocrinas adultas. Diabetología. (2005) 48:49–57. doi: 10.1007/s00125-004-1606-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Parque, IS y Bendayan, M . Células endocrinas en el sistema pancreático y de conductos biliares de rata. Páncreas. (1994) 9:566–73. doi: 10.1097/00006676-199409000-00005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Garry, DJ , Garry, MG , Williams, J.A. , Mahoney, WC y Sorenson, RL . Efectos de las hormonas de los islotes sobre la secreción de amilasa y la localización de los sitios de unión a la somatostatina. Am J Phys. (1989) 256:G897-904. doi: 10.1152/ajpgi.1989.256.5.G897
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Marteau, P , Chrétien, Y , Calmus, Y , Parc, R y Poupon, R . Efecto farmacológico de la somatostatina sobre la secreción biliar en el hombre. (1989) 42:16–21. doi: 10.1159/000199820
46. Levy, E , Roy, CC , Lepage, G y Bendayan, M . Anomalías lipídicas en el tejido pancreático de ratas diabéticas inducidas por estreptozotocina. Lípidos. (1988) 23:771–8. doi: 10.1007/BF02536220
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: glucagón, insulina, células endocrinas, vías biliares, vesícula biliar, cerdo
Cita: Stefanov IS, Stefanov SI y Gulubova MV (2023) Células endocrinas inmunopositivas con glucagón e insulina en los conductos biliares extrahepáticos porcinos y la vesícula biliar. Frente. Vet. Sci. 10:1240143. doi: 10.3389/fvets.2023.1240143
Recibido: 14 de junio de 2023; Aceptado: 07 de septiembre de 2023;
Publicado: 29 Noviembre 2023.
Editado por:
Slavi Delchev, Universidad de Medicina de Plovdiv, Bulgaria
Revisado por:
Luis Paiva, Pontificia Universidad Católica de Chile, Chile
Lucianna Maruccio, Universidad de Nápoles Federico II, Italia
Derechos de autor © 2023 Stefanov, Stefanov y Gulubova. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Ivaylo Stefanov Stefanov, ivstefanov@abv.bg
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

