Concepto de un sistema de vigilancia activa de la fiebre Q en pequeños rumiantes

Concepto de un sistema de vigilancia activa de la fiebre Q en pequeños rumiantes alemanes: conflictos entre las mejores prácticas y la viabilidad
 Fenja InviernoAños 1*,
Fenja InviernoAños 1*,  Clara SchönebergAños 1,
Clara SchönebergAños 1,  Annika WolfAños 2,
Annika WolfAños 2,  Benjamín U. BauerAños 2,
Benjamín U. BauerAños 2,  T. Louise PrüferAños 3,
T. Louise PrüferAños 3,  Silke F. FischerAños 4,
Silke F. FischerAños 4,  Ursula GerdesAños 5,
Ursula GerdesAños 5,  Martin RungeAños 3,
Martin RungeAños 3,  Martín GanterAños 2 y
Martín GanterAños 2 y  Amely CampeAños 1
Amely CampeAños 1- Años 1Departamento de Biometría, Epidemiología y Procesamiento de la Información, Centro Colaborador de la OMS para la Investigación y Capacitación para la Salud en la Interfaz Humano-Animal-Ambiente, Universidad de Medicina Veterinaria Fundación Hannover, Hannover (Alemania)
- Años 2Clínica para Porcinos, Pequeños Rumiantes y Medicina Forense, Universidad de Medicina Veterinaria Fundación Hannover, Hannover, Alemania
- Años 3Oficina Estatal de Protección del Consumidor y Seguridad Alimentaria de Baja Sajonia – Instituto Alimentario y Veterinario Braunschweig/Hannover, Hannover, Alemania
- Años 4Laboratorio Nacional de Consultoría para Coxiella burnetii, Oficina Estatal de Salud de Baden-Württemberg, Stuttgart, Alemania
- Años 5Fondo de Enfermedades Animales de Baja Sajonia, Instituto de Derecho Público, Hannover, Alemania
La fiebre Q es una enfermedad zoonótica causada por la bacteria Coxiella burnetii. La inhalación de partículas de polvo o aerosoles contaminados procedentes de animales (especialmente pequeños rumiantes) es la principal fuente de infección humana. Por lo tanto, se conceptualizó un sistema activo de alerta temprana para la fiebre Q en el ganado alemán de pequeños rumiantes para prevenir infecciones humanas. En primer lugar, describimos la mejor práctica para establecer este sistema antes de evaluar su viabilidad, ya que la combinación de ambos evoca conflictos. Los hisopos vaginales de todos los sistemas de cría con un enfoque en las hembras reproductivas deben agruparse e investigarse mediante PCR para detectar animales que derraman C. burnetii. El muestreo multifásico basado en el riesgo se llevará a cabo a nivel de manada y dentro de la manada. A nivel de manada, se deben tomar muestras de todas las manadas que corran el riesgo de transmitir el patógeno al público. A nivel de rebaño, todas las hembras primíparas y multíparas después del parto deben someterse a pruebas para aumentar la probabilidad de identificar un rebaño positivo. El muestreo debe realizarse durante el período principal de parto y antes de la migración en zonas residenciales. Además, los animales individuales deben ser probados antes de la migración o la exposición para garantizar un estado negativo. Si una manada da positivo en al menos una muestra individual, deben aplicarse medidas preventivas específicas para la manada. Este enfoque implica enormes costes financieros (pruebas de muestras, medidas de acción/control). Por lo tanto, dar el paso para desarrollar medidas preventivas más factibles y asequibles, por ejemplo, vacunar a las pequeñas manadas de rumiantes, debería reemplazar las pruebas siempre que esté justificado.
Introducción
Agente infeccioso
Coxiella burnetii es una bacteria gramnegativa pequeña, intracelular obligatoria, pleomórfica. Debido a su alta tenacidad, C. burnetii puede ser infeccioso en la leche cruda durante 90-273 días a 4-6 ° C, así como en productos lácteos crudos como la mantequilla y el queso blando durante 42 días a 20 ° C. En el polvo y la lana, puede ser infecciosa durante 7-24 meses, dependiendo de la temperatura ambiente. C. burnetii evoca una enfermedad zoonótica y principalmente transmitida por el aire llamada fiebre Q (1, 2).
Especies afectadas
Los seres humanos se infectan por inhalación de partículas de polvo o aerosoles contaminados con sólo unos pocos organismos C. burnetii (3, 4). Las infecciones humanas a través del consumo de leche cruda o productos lácteos crudos como la mantequilla o el queso blando son posibles pero raras. No hay transmisión de hombre a hombre, excepto algunas raras excepciones, por ejemplo, por transfusión de sangre o durante el parto (5). Las infecciones por C. burnetii siguen siendo subclínicas en casi el 50% de los pacientes. Sin embargo, los síntomas inespecíficos similares a la gripe, la hepatitis o la neumonía atípica son posibles consecuencias de la fiebre Q aguda, que puede llevar a la hospitalización (6, 7). Además, aproximadamente el 20% de los pacientes están en riesgo de desarrollar fatiga crónica después de una infección (síndrome de fatiga por fiebre Q, QFS) (8). En el <1% de los pacientes infectados, la fiebre Q crónica se manifiesta en forma de endocarditis o hepatitis con una alta tasa de mortalidad. Además, la fiebre Q es un riesgo para el embarazo (6, 7).
En los animales, muchas especies como los mamíferos silvestres o domésticos y las garrapatas pueden infectarse con C. burnetii y propagar este patógeno al medio ambiente (6, 7, 9, 10). En Alemania, los rumiantes infectados (pequeños) mantenidos como ganado son la principal fuente de transmisión de patógenos a los seres humanos (1, 11, 12). Los rumiantes (pequeños) se infectan por inhalación de C. burnetii, mientras que otras vías de transmisión (por ejemplo, sexual, intrauterina, oral, infestación con garrapatas) todavía se están estudiando (7, 13-16). Por lo tanto, la transmisión de patógenos puede tener lugar a través de animales reservorios, que pueden ser parte de un rebaño o externos (por ejemplo, mamíferos salvajes, pero también perros, gatos, otras especies de rumiantes o garrapatas). Estas especies reservorios pueden tener cierta importancia en el mantenimiento de C. burnetii en el ganado, ya que los factores más importantes aquí son la contaminación del medio ambiente por sus excrementos, así como el contacto directo con el ganado en el pasto. La transmisión de patógenos de la vida silvestre a los humanos rara vez se documenta, pero es posible y debe considerarse cuando no se puede identificar la fuente de infección (6, 7, 10, 11, 15). Concentrándose en el ganado, las ovejas infectadas con C. burnetii excretan la bacteria principalmente en altas concentraciones en el líquido amniótico, la placenta y los loquios durante el parto fisiológico o el aborto. Además, la excreción en leche, heces, orina o semen es posible (1, 13, 17, 18). Las cabras y el ganado también excretan el patógeno en las concentraciones más altas en productos de nacimiento o con aborto, aunque el período de excreción es más largo en la leche (17, 19-22). La fiebre Q en ovejas es mayormente asintomática con una tasa de aborto de aproximadamente 5-20% (23). En contraste, la fiebre Q en cabras está relacionada con el aborto en la mayoría de los casos (17, 18, 22). Sin embargo, el aborto en pequeños rumiantes puede tener varias causas y no es patognomónico para una infección con C. burnetii. El impacto de C. burnetii en los trastornos reproductivos en el ganado aún está en discusión (17, 19, 20).
Patrón de aparición de la enfermedad
La fiebre Q en humanos y animales se puede encontrar en todo el mundo, excepto en Nueva Zelanda y la Antártida. En Europa, se observó una tendencia creciente entre 2012 y 2016, mientras que a partir de 2017 el número de casos confirmados de fiebre Q disminuyó nuevamente. En 2018, 29 países de la UE/EEE notificaron 794 casos confirmados de fiebre Q. Los tres países con más casos confirmados en 2018 fueron España, Francia y Alemania (24). En Alemania, los brotes de fiebre Q en la población humana ocurren regularmente, sin propagación nacional, pero a menudo en relación con pequeños rumiantes infectados. La distribución de la fiebre Q fue previamente descrita (25-27).
En resumen, el número de casos notificados de fiebre Q humana en Alemania ha aumentado a lo largo de los años y ha alcanzado su punto máximo durante los brotes desde que se reglamentaron las obligaciones de notificación en 1962 (25-27). Entre 2005 y 2018, los casos notificados oscilaron entre 416 y 93 cada año, según lo mencionado por el Instituto Robert Koch alemán (RKI), sin ninguna tendencia detectable (24, 28). Debido al concepto de vigilancia pasiva, el número de casos notificados depende de la sensibilización de los grupos de partes interesadas pertinentes y puede superar con creces las cifras medias en el caso de brotes más grandes, como los observados en 2003, 2005, 2008, 2010 o 2014, por ejemplo (11, 24, 25). En Alemania, se notifican casos esporádicos en todo el país, pero los brotes en la población humana se notifican con mayor frecuencia en los estados federales del sur y a menudo pueden estar relacionados con la fiebre Q en pequeños rumiantes (11, 25, 26).
En comparación, el número medio de casos notificados en manadas de rumiantes alemanes (pequeños) fluctuó entre 1970 y 2000 (26). Entre 2000 y 2018, se notificaron un total de 9.920 casos individuales oficiales (8.359 bovinos; 1.349 ovinos; 212 caprinos) (25). La mayoría de los animales notificados eran bovinos, lo que no solo puede explicarse por el número total de animales, sino también por los requisitos legales para el diagnóstico rutinario y la diferente progresión de la enfermedad en el ganado, lo que resulta en pruebas más frecuentes de esta especie en lugar de pequeños rumiantes (26). Una vez más, el conocimiento de la enfermedad es importante, como lo demuestra el aumento de casos notificados en bovinos, ovinos y caprinos, seguidos de brotes en la población humana en Bad Sassendorf/Soest en 2003 y en Jena en 2005 (25, 26, 29).
Como complemento de los casos notificados oficialmente, en el pasado sólo se realizaron unas pocas encuestas (25). Por ejemplo, la seroprevalencia alemana dentro del rebaño se estimó en 19,3% en bovinos, 8,7% en ovinos y 2,5% en cabras (11). Además, Wolf y sus colegas estimaron la prevalencia serológica de la manada de pequeños rumiantes en Alemania entre el 26 y el 36,6% [n = 71; 14]. En comparación, en un estudio alemán no representativo, el 7,8% del ganado vacuno (n = 21.191), el 1,3% de las ovejas (n = 1.346) y el 2,5% de las cabras (n = 278) dieron positivo para C. burnetii por PCR (30). Wolf et al. (14) detectaron que el 13,9% de los rebaños de ovinos y caprinos analizados (n = 71) fueron positivos por PCR. Otros estudios se dirigieron principalmente a la cría de ovejas dentro de los estados federales alemanes. Por lo tanto, los resultados de sus estudios varían ampliamente debido al diseño y la ubicación de su estudio (25). Sin embargo, se puede concluir que la detección de anticuerpos contra C. burnetii y el patógeno en sí difiere entre especies animales, áreas geográficas y tiempo de muestreo (25).
Potencial zoonótico
Los seres humanos tienen el mayor riesgo de inhalar C. burnetii a través del contacto distante y cercano con animales, especialmente pequeños rumiantes (1, 11, 12, 31). El contacto a distancia puede ocurrir a través de la proximidad geográfica a pequeñas manadas de rumiantes, así como por visitas a mercados de agricultores donde se exhiben pequeños rumiantes (11, 29, 31). Como la fiebre Q es una enfermedad transmitida por el aire, el patógeno puede propagarse a distancias más largas por el viento y puede representar un riesgo de infección humana (11, 31). Por lo tanto, el mayor riesgo de infección está dentro de un radio de 2 a 4 km de la fuente del patógeno. Además, en vientos huracanados, C. burnetii puede alcanzar distancias de hasta 18 km (31). La migración de pequeños rumiantes a través de zonas residenciales se identificó como un factor de riesgo potencial (32). Por lo tanto, puede ser un desafío identificar la fuente de infección en casos humanos que no tuvieron ningún contacto obvio o conocido con ovejas o cabras. Se puede observar un mayor riesgo de transmisión de pequeños rumiantes a humanos en primavera/principios de verano debido al parto fuera de temporada de algunas razas ovinas en pastos (11, 31, 33). Además, el contacto cercano con productos contaminados como el parto o la lana contaminada durante la esquila de ovejas también puede ser fuente de infecciones humanas que pueden ocurrir esporádicamente, por ejemplo, dueños de animales, sus familiares o empleados (33, 34). Además, los empleados de mataderos o laboratorios pueden infectarse en el lugar de trabajo. Las infecciones por consumo de leche cruda contaminada (productos) son posibles pero raras (5). También es posible, pero aún más rara, la infección a través de la terapia de células vivas (35).
Reglas y Regulaciones
A nivel internacional, la Organización Mundial de Sanidad Animal (OIE) incluye la fiebre Q en la categoría de enfermedades de múltiples especies (36). Además, la OIE recomienda protocolos para las pruebas de diagnóstico y la vacunación de la fiebre Q en pequeños rumiantes para prevenir infecciones humanas (5). A nivel de la Unión Europea, el muestreo de datos de zoonosis en humanos está regulado por la Decisión nº 211/98/CE y coordinado por el Centro Europeo para la Prevención y el Control de las Enfermedades (ECDC). Además, la fiebre Q está incluida en los informes resumidos comunitarios sobre zoonosis desde 2005. Para armonizar la información sobre la fiebre Q en la Unión Europea, en 2010 se desarrolló un sistema para el seguimiento y la notificación de la fiebre Q en animales en virtud de la Directiva 2003/99/CE. Este informe ha sido elaborado por la Autoridad Europea de Seguridad Alimentaria (EFSA) en colaboración con el ECDC y el Centro Colaborador de Zoonosis de la EFSA (32).
A nivel nacional, la fiebre Q en humanos es una enfermedad de declaración obligatoria con el inicio de la Ley alemana de protección contra la infección (IfSG) en 2001 (25, 37). De acuerdo con la Ley Nacional Alemana de Sanidad Animal (TierGesG) y el Reglamento alemán de enfermedades animales de declaración obligatoria (TKrMeldpflV), solo la detección directa (por cultivo o PCR) de C. burnetii en pequeños rumiantes y bovinos debe notificarse a la autoridad sanitaria veterinaria local (25, 38, 39). Todas las notificaciones son notificadas en el Sistema de notificación de enfermedades animales (TSN) por las autoridades sanitarias veterinarias locales e incluyen la fecha de detección, la especie, el rebaño y su propietario, así como el condado o ciudad de que se trate (25). Además de las reglas y regulaciones oficiales, el RKI publicó recomendaciones para la fiebre Q después de un gran brote asociado a ovejas en 2006 (9, 29). Además, una asociación de investigación interdisciplinaria en el estado federal alemán de Baden-Wuerttemberg publicó recomendaciones para el tratamiento de los casos y brotes de fiebre Q (40). Además, el Instituto Federal Alemán de Evaluación de Riesgos (BfR) recomienda la pasteurización de la leche cruda antes del consumo y el procesamiento de alimentos si se diagnostica una infección por C. burnetii en una parvada de rumiantes (2). Existe una recomendación publicada por el Ministerio de Alimentación y Agricultura de Alemania (BMEL) que incluye medidas de higiene en el caso de casos de fiebre Q en rumiantes (pequeños) (41). Sin embargo, estas recomendaciones no son obligatorias y no pueden ser impuestas por las autoridades locales de salud veterinaria. En comparación, las autoridades locales de salud pública pueden imponer medidas regulatorias para los animales basadas en el IfSG si los humanos están infectados.
Justificación para el uso de sistemas de monitoreo y vigilancia
La legislación alemana subraya la justificación del uso de un sistema de vigilancia y vigilancia (MOSS) para la fiebre Q, ya que define esta zoonosis como una enfermedad de declaración obligatoria tanto en rumiantes (pequeños) como en humanos (37-39). Por lo tanto, las dos miniventanillas de seguridad operacional que existen actualmente pueden definirse como sistemas de monitoreo pasivo, que se centran en la salud humana como la razón predominante en lugar de los efectos sobre la salud o la producción en los animales (25, 42). Sin embargo, el sistema de monitoreo pasivo de la fiebre Q en pequeños rumiantes no sirve como protección confiable para los humanos contra la infección. Esto se debe especialmente a que la infección en pequeños rumiantes puede proceder con síntomas inespecíficos o incluso asintomáticamente (17, 18). Como un sistema de notificación pasiva no detecta muy bien este tipo de enfermedades, asumimos que la aparición de fiebre Q en pequeños rumiantes está muy subestimada en Alemania (43, 44). Para prevenir nuevas infecciones en humanos, es importante recopilar información confiable sobre el estado actual de la fiebre Q de pequeñas manadas de rumiantes. Con este conocimiento, se pueden inducir medidas de acción y control específicas de la parvada, mientras que estas medidas previenen eficazmente nuevos casos en la población humana, ya que se reducirá el riesgo de transmisión (5, 38, 39). Podría discutirse que el bajo número de casos notificados en la población humana no impone directamente la necesidad de actuar. Sin embargo, se debe asumir que no se debe notificar lo suficiente de la fiebre Q en humanos, ya que los síntomas son inespecíficos y las infecciones zoonóticas no ocupan un lugar destacado en la lista de diagnósticos diferenciales (30, 45). Debido al riesgo evidente de infección humana, existe la necesidad de mejorar la monitorización pasiva en pequeños rumiantes hacia una vigilancia activa, incluidas medidas para el control de la fiebre Q (5, 42, 44). Por lo tanto, el objetivo de este trabajo fue conceptualizar dicha miniventanilla como un sistema de alerta temprana para la fiebre Q en ganado de pequeños rumiantes en Alemania y evaluar el concepto con respecto a la viabilidad.
Métodos
Para cumplir con las normas internacionales, se utilizaron y modificaron listas de verificación previamente desarrolladas para el diseño de una miniventanilla única en el sector de la sanidad animal (42, 43, 46-48). Refiriéndonos a estos estándares internacionales, resumimos las principales características y las opciones elegidas de nuestro concepto en las Tablas 1, 2. Primero, comenzamos definiendo la hipótesis y el objetivo de nuestro MOSS. Después, discutimos el tipo de sistema en detalle. Todas las demás opciones en términos de las características descritas de este concepto dependen de este objetivo con respecto a la literatura internacional sobre C. burnetii, la legislación nacional y las diferencias regionales en la cría de pequeños rumiantes. A continuación, nos centramos en las características de la población objetivo para este MOSS, que se divide en los temas especies animales, sexo y edad, región y cría. Después de esto, determinamos las variables dependientes incluyendo los temas etapa de la enfermedad, unidad de interés y diagnóstico. Luego, se discutieron las variables independientes y el factor de confusión. En el siguiente paso, nos centramos en la técnica de muestreo y el tamaño de la muestra a nivel de la parvada y dentro de la parvada, así como en el tiempo de muestreo y el sesgo. Como la fiebre Q conlleva un grave riesgo para la población humana, discutimos un plan de acción y control en caso de un estado positivo o negativo de la parvada. Como la implementación y evaluación de una MOSS son temas importantes en el momento de la planificación del concepto, discutimos la participación de las partes interesadas, así como las consideraciones económicas en el contexto de este concepto.
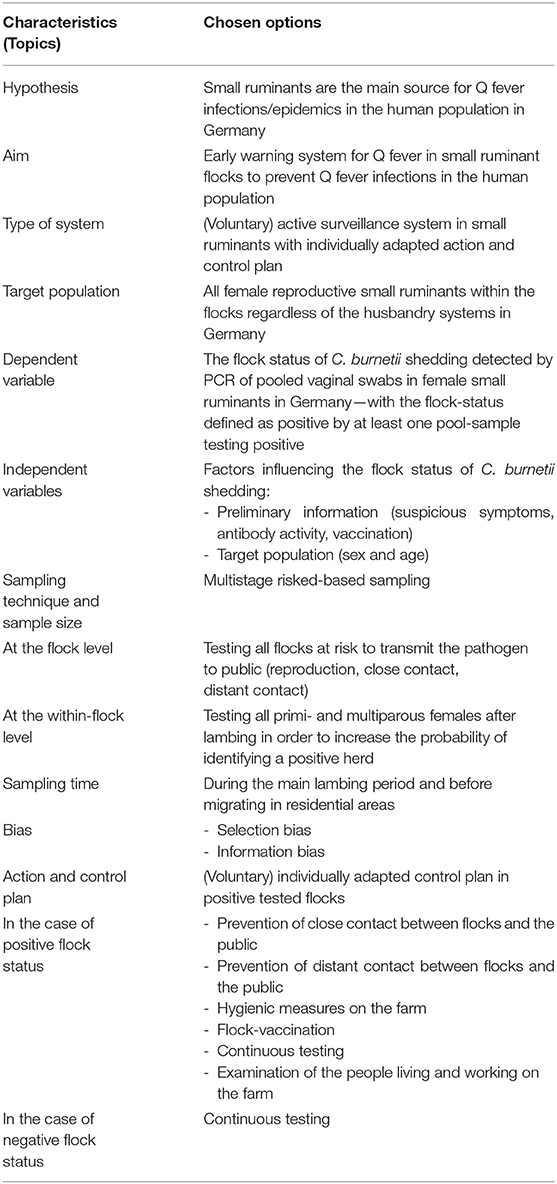 TABLA 1. Concepto de un sistema de vigilancia activa de la fiebre Q en pequeños rumiantes alemanes: conflictos entre las mejores prácticas y la viabilidad.
TABLA 1. Concepto de un sistema de vigilancia activa de la fiebre Q en pequeños rumiantes alemanes: conflictos entre las mejores prácticas y la viabilidad.
 TABLA 2. Implementación y evaluación de un sistema de vigilancia activa de la fiebre Q en pequeños rumiantes alemanes: conflictos entre las mejores prácticas y la viabilidad.
TABLA 2. Implementación y evaluación de un sistema de vigilancia activa de la fiebre Q en pequeños rumiantes alemanes: conflictos entre las mejores prácticas y la viabilidad.
La literatura referida se evaluó en una estrategia de búsqueda no sistemática utilizando la base de datos de búsqueda Web of Science (http://apps.webofknowledge.com) realizada en inglés. Los términos de búsqueda investigados se definieron y combinaron con los operadores booleanos AND y OR.
Para informar sobre nuestro concepto de un sistema de vigilancia activa de la fiebre Q en pequeños rumiantes, se utilizó la Declaración STROBE como guía (49).
Concepto del musgo
En este artículo, compilamos un concepto de un sistema de alerta temprana para la fiebre Q en pequeños rumiantes en Alemania. Primero, describimos la mejor práctica para esta miniventanilla única antes de dar el siguiente paso para abordar la viabilidad, ya que la combinación de ambos evoca conflictos. Los puntos básicos de la miniventanilla única se resumen en los cuadros 1 y 2.
Hipótesis y objetivo
Para conceptualizar una miniventanilla única, es obligatorio definir primero la hipótesis y el objetivo (42, 43). Estos generan la base para cada decisión posterior con respecto al diseño del concepto. La fiebre Q tiene una etiopatología inespecífica, así como poco efecto sobre el estado de salud de los pequeños rumiantes. Sin embargo, no existe una musa activa para la fiebre Q en pequeños rumiantes, que es obligatoria en todos los estados federales. Basándonos en estos hechos, asumimos que se desconoce el estado de salud de la mayoría de los pequeños rumiantes y, por lo tanto, las posibles fuentes de infecciones humanas por fiebre Q en Alemania. Como solo unos pocos organismos de C. burnetii pueden iniciar la infección activa en humanos (3), es imperativo detectar una posible fuente de transmisión lo antes posible. Por lo tanto, la «detección temprana en una población animal definida» es el propósito predominante de la miniventanilla de seguridad operacional presentada aquí (5, 36, 46).
Tipo de sistema
Las miniventanillas de seguridad operacional se utilizan para recopilar datos de salud de una población definida (47, 48). Sin embargo, se debe discutir si se desea una recopilación de datos «pasiva» o «activa» y si la acción debe seguir a un hallazgo positivo, es decir, «monitoreo» o «vigilancia».
En el caso de nuestra miniventanilla única, la «monitorización» daría lugar a la observación del estado de la fiebre Q en pequeños rumiantes sin ninguna actividad de control en el caso de hallazgos positivos (42, 43, 47). Sin embargo, dado que se trata de un agente zoonótico con un impacto considerable en la salud humana, las actividades de vigilancia sin control frustrarían los principios de prevención de riesgos y salud pública veterinaria. Por lo tanto, aquí se prefiere el sistema de «vigilancia». Esas actividades de control pueden ser obligatorias o voluntarias. Para la implementación obligatoria de las actividades de control, se necesitan reglas y regulaciones. En el caso de brotes humanos causados por pequeños rumiantes o bovinos, los veterinarios y las oficinas locales de salud humana tienen que colaborar estrechamente utilizando el IfSG. Sin embargo, la legislación alemana no regula las actividades de control coherentes en el caso de la fiebre Q en pequeños rumiantes sin un vínculo con los casos de fiebre Q humana (37-39). Una autoridad de salud pública competente solo puede tomar las medidas necesarias para evitar un peligro inminente si se establecen hechos que puedan conducir a la aparición de fiebre Q en humanos, o si se puede suponer que tales hechos existen (37). Por lo tanto, las regulaciones necesitan modificaciones. Mientras tanto, la vigilancia depende de la implementación voluntaria de actividades de control por parte de los propietarios de animales. Sin embargo, un sistema de vigilancia con actividades de control voluntario exige la responsabilidad de los propietarios de animales para las personas en su entorno. Para el éxito de este concepto de MOSS, otras consideraciones suponen una tasa de participación del 100%.
Además, es importante decidir si debe realizarse una recopilación de datos «pasiva» o «activa» para esta miniventanilla única (42, 43, 47). En el caso de una miniventanilla de seguridad operacional «pasiva», es necesaria una cascada de informes para recopilar datos de salud (43). Tal método «pasivo» sería una forma económica de obtener información sobre el estado de la fiebre Q de los pequeños rumiantes en Alemania, ya que las autoridades sanitarias veterinarias no necesitarían planificar la adquisición de datos, realizar pruebas de diagnóstico o financiar el trabajo de muestreo y laboratorios. Sin embargo, este sistema «pasivo» contiene muchas fuentes de error, ya que se basa en la idea de que los propietarios de animales y los veterinarios en ejercicio reconocen los signos clínicos de la fiebre Q muy fácilmente y examinan a la población de interés. Por lo tanto, la monitorización pasiva pasaría por alto a los pequeños rumiantes con un estado positivo de fiebre Q. Además, el diferente conocimiento sobre la fiebre Q y las diferentes motivaciones para informar el estado positivo de la parvada influyen negativamente en la calidad de los datos de salud (42, 43, 50). Los dueños de animales pueden estar menos motivados si desconfían del sistema, especialmente si las consecuencias después de informar un estado positivo de fiebre Q son imprevisibles [por ejemplo, estigmatzación; (43)]. Por lo tanto, la cascada de notificación no funcionaría de manera confiable para esta enfermedad. Por el contrario, una miniventanilla de seguridad operacional «activa» recopila datos de salud de manera sistemática o mediante un registro regular (42). Para el método de recolección activa, es típico definir un objetivo específico de la miniventanilla única, utilizar un proceso formal de muestreo en una población específica y un momento específico de recolección, así como pruebas estándar para detectar resultados positivos (42, 43). En general, las autoridades veterinarias locales son responsables de la coordinación de esta recogida periódica y periódica de datos sanitarios (43). Es importante invertir tanto dinero como tiempo en la adquisición de datos estructurados para obtener información válida sobre el estado de la fiebre Q en una relación costo-beneficio favorable (46-48). Por lo tanto, esto conduce a un sistema «activo» de recopilación de datos en el caso de nuestra MOSS. Una miniminisca activa no se limita a los casos clínicos con síntomas típicos, lo cual es una ventaja importante en el caso de la fiebre Q en pequeños rumiantes. Otro efecto positivo para la calidad de los datos es el control del esquema de muestreo y la recopilación de información por parte de una autoridad sanitaria veterinaria competente que garantiza la objetividad basada en estadísticas, así como el aumento de la comparabilidad de los resultados (42, 43). En conclusión, esta miniventanilla única debe aplicarse como un sistema de vigilancia activa.
Población objetivo
La población objetivo se define como la población que es el foco de un estudio (42, 51). Por ejemplo, esto puede incluir a toda la población en riesgo que es susceptible a una enfermedad específica o solo un subgrupo con cualidades especiales de esta población en riesgo (42). Si la población objetivo no está claramente definida, la interpretación individual de los resultados del estudio puede conducir a un sesgo y una percepción diferencial de los resultados (51). Para definir la población objetivo de esta minimicroa, dividimos sus características en los temas especies animales, sexo y edad, región y cría (46-48).
Especies animales
Aunque varios mamíferos domésticos y silvestres pueden ser reservorios de C. burnetii, el enfoque de este enfoque está en el ganado de pequeños rumiantes (6, 7, 9, 10). A nivel internacional, las cabras lecheras (abortando) han sido la razón de los mayores brotes de fiebre Q en humanos. Sin embargo, en Alemania, la mayoría de las epidemias a pequeña escala han sido causadas por ovejas no lecheras (25). Debido a que las ovejas y las cabras a menudo se mantienen juntas (especialmente en el sur de Alemania) y debido a que el número de cabras está aumentando en todo el país (14, 25), esta musa tiene que centrarse en ambas especies. La Oficina Federal de Estadística de Alemania informó de 19.556 granjas con 1.834.275 ovejas y 9.808 granjas con 138.810 cabras en 2016. Desafortunadamente, no hay un número oficial disponible sobre estas granjas que mantienen ovejas y cabras juntas (52, 53).
Sexo y edad
Las posibles diferencias con respecto al riesgo de transmisión a los seres humanos entre el sexo y los grupos de edad deben tenerse en cuenta al definir la población objetivo. Tanto los pequeños rumiantes hembras como los machos pueden ser infectados por C. burnetii y eliminar el patógeno a través de diferentes vías (13, 14, 18, 21, 22, 54). Sin embargo, las concentraciones más altas de patógenos se eliminan en el líquido amniótico, la placenta y los loquios durante el parto fisiológico o el aborto y en la leche de pequeños rumiantes (18, 21, 22, 54). Por lo tanto, las hembras de pequeños rumiantes después del parto son el subgrupo con mayor riesgo de que los humanos adquieran infección y, por lo tanto, se centran en esta miniventanilla única. En Alemania, aproximadamente el 64,42% (n = 1.181.560) de la población ovina y el 63,72% (n = 88.451) de la cabaña caprina son hembras reproductoras (52).
Región
Como el patrón de aparición de la enfermedad de la fiebre Q en humanos y pequeños rumiantes en Alemania se describió previamente (25-27), los casos y estudios notificados muestran que la fiebre Q es endémica en Alemania (11, 25-27). Por lo tanto, la miniventanilla única debe aplicarse en todo el país. En Alemania, las normas y reglamentos para la aplicación de una miniventanilla única se dividen en tareas nacionales, federales y de distrito. En los distritos, el nivel administrativo más bajo, las autoridades veterinarias y de salud pública son responsables de la coordinación general y la implementación de la prevención de enfermedades en animales y en humanos. Estas autoridades veterinarias y de salud pública a nivel de distrito pueden confiar en estructuras (de comunicación) entre las diferentes partes interesadas, que son necesarias para la implementación de esta MOSS (véase el capítulo «Aplicación y evaluación»). Como el viento y la distancia entre los asentamientos y los pequeños rumiantes tienen un impacto en la transmisión de la fiebre Q (11, 31), este MOSS menciona la urbanización, la densidad del ganado y las condiciones climáticas individuales en diferentes regiones de Alemania y apela a la cooperación entre los distritos vecinos en el caso de hallazgos positivos. En conclusión, esta minifinanciación de las normas comunes debe aplicarse en todo el país, siendo los distritos administrativos la estructura subregional más baja responsable de la ejecución de las actividades de acción y control.
Agricultura
La situación actual de la cría de ovinos y caprinos en Alemania fue descrita previamente por Bauer et al. (25). En resumen, la distribución de animales, granjas y razas difiere entre los estados federales alemanes (25). Además, la mayoría de las granjas alemanas de pequeños rumiantes practican una combinación de sistemas de gestión que incluyen el pastoreo cercado, la producción de leche y los rebaños pastoreados y migratorios, lo que hace que la cría sea muy poco homogénea (50). Además, la cría de pequeños rumiantes se asocia principalmente con la reproducción para la producción de corderos, así como con la conservación y protección del paisaje. Ambos están conectados con el contacto distante entre los pequeños rumiantes y el público debido al parto y el pastoreo en los pastos y la proximidad a las zonas residenciales. Las bandadas migratorias, que cambian su ubicación regularmente o incluso cruzan las fronteras de los distritos administrativos, son particularmente notables aquí. Además, el contacto cercano entre los pequeños rumiantes y el público tiene lugar en zoológicos de mascotas, vacaciones en granjas familiares y educación o terapia asistida por animales. Estos factores de riesgo para la salud pública se discutirán en la sección «Técnica de muestreo y tamaño de la muestra» de este manuscrito. Por último, esta miniventanilla única debe centrarse en toda la gama de cría de pequeños rumiantes, ya que existe un riesgo general de transmisión a los seres humanos.
Variable dependiente
Conceptualizado como un sistema de alerta temprana, la variable dependiente de esta minimicroestimulación es el estado de la fiebre Q en pequeños rumiantes.
Etapa de la enfermedad
Para describir el estado de una enfermedad en general, una minimicroestimulación puede centrarse en diferentes etapas de la enfermedad, como la infección, la aparición de síntomas, la presencia de anticuerpos o la excreción del patógeno en sí. Como tenemos que considerar el potencial zoonótico de la fiebre Q, la diseminación de patógenos por parte de pequeños rumiantes debe identificarse lo antes posible. Dado que los síntomas clínicos o la presencia de anticuerpos no pueden relacionarse con la aparición de la diseminación de patógenos (12, 18, 21, 32, 44), esta minimicroestimulación tiene que centrarse en la detección de la diseminación de patógenos en sí. Como se mencionó en el tema sexo y edad, el período perinatal es el momento de mayor riesgo de infecciones humanas (18, 21, 22), y este MOSS se centra en la detección de la diseminación de patógenos actuales temprano después del parto.
Unidad de interés
«El individuo (animal), corral, rebaño, rebaño o granja» u otra estructura definida puede elegirse como unidad de interés (42). Elegir el animal individual como la unidad de interés más pequeña es útil para detectar enfermedades esporádicas. Por lo tanto, esta estrategia es valiosa para una enfermedad que no es muy contagiosa. Sin embargo, la fiebre Q es una enfermedad contagiosa y se puede propagar fácilmente dentro de las parvadas. Esto significa que la ocurrencia de más de un individuo de C. burnetii derramando dentro de un grupo de animales es muy probable. Al elegir el estado de diseminación del patógeno a nivel de la manada, la probabilidad de un estado positivo de la manada puede cambiar con el tiempo con la composición de los individuos dentro de la manada (51). Como las granjas pueden manejar más de un rebaño, y los rebaños pueden ser alojados y manejados de manera diferente, los rebaños deben ser la unidad de interés más apropiada aquí (5, 51, 55). Debido a la alta concentración y el tiempo prolongado de excreción de C. burnetii, un solo individuo infectado por C. burnetii puede ser un riesgo suficiente de infecciones humanas (3, 29). Por lo tanto, un solo animal que dé positivo es suficiente para designar al rebaño como positivo para la excreción de C. burnetii (14, 44, 55). En conclusión, la unidad de interés es el estado de la manada de la excreción de patógenos definido por al menos una muestra individual que da positivo.
Diagnóstico
Se dispone de diferentes pruebas diagnósticas para la detección directa de C. burnetii. Solo los laboratorios especializados realizan el cultivo bacteriano. Sin embargo, la PCR es la prueba de diagnóstico más factible para esta MOSS porque las secuencias de cebadores y sondas, así como los kits listos para usar, están disponibles comercialmente, y los resultados pueden proporcionarse con alta velocidad y precisión (es decir, alta especificidad y sensibilidad) (1, 5, 25). La PCR se ha utilizado para detectar fragmentos del genoma de C. burnetii en las heces, sin embargo, se necesita más investigación para confirmar las heces como material de prueba adecuado para detectar la excreción aguda de patógenos en pequeños rumiantes (56, 57). Como prueba de diagnóstico aprobada oficialmente, la PCR puede detectar fragmentos del genoma de C. burnetii en muestras de leche, órganos de fetos, productos de nacimiento, hisopos vaginales y garrapatas (25, 58). Sin embargo, la producción de leche está presente en solo el 2,68% (n = 524) de todas las granjas ovinas y comprende solo el 0,98% (n = 17.999) de la población ovina en Alemania en 2016, lo que hace que este material de muestra no sea adecuado para esta miniventanilla única (52). Además del muestreo de fetos y productos de nacimiento, el muestreo de hisopos vaginales significa esfuerzo y costo adicionales, pero los hisopos vaginales proporcionan un material de muestreo de alta calidad (5, 25, 59). Además, se puede asignar un hisopo vaginal a un animal individual, de modo que las medidas posteriores se puedan implementar individualmente (por ejemplo, pruebas de seguimiento). Además, las muestras agrupadas de hisopos vaginales son aplicables para reducir los gastos temporales y los costes financieros (42). En conclusión, el diagnóstico debe llevarse a cabo mediante la realización de pruebas de hisopos vaginales agrupados por PCR.
Variables independientes y factores de confusión
Los factores que influyen en la probabilidad de que una parvada dé positivo para la eliminación de patógenos ya se discutieron antes y solo se enumeran aquí por razones de claridad:
• Información preliminar: Los rebaños que ya se sabe que muestran síntomas sospechosos, como el aborto a nivel de rebaño [la tasa de aborto oscila entre el 5 y el 90% de las hembras preñadas, mientras que el 5-20% es común en los rebaños de ovejas, y las altas tasas de aborto ocurren solo en algunos rebaños de cabras (23)] pueden ser un indicador de infección y derramamiento actuales y en curso. Además, los títulos de anticuerpos previamente conocidos en animales pueden ser un indicador de infección actual o en curso y de diseminación en un rebaño. Esto puede aumentar la probabilidad de que una parvada dé positivo para la pérdida de corriente, pero no hay garantía (1, 59). Aunque la vacunación previa influye en gran medida en la actividad de los anticuerpos, también reduce la cantidad de patógenos eliminados (5).
• Población objetivo: Las hembras con estado perinatal tienen más probabilidades de eliminar grandes cantidades del patógeno (ver capítulo «Sexo y edad») (18, 21).
Técnica de muestreo y tamaño de la muestra
En primer lugar, hay que decidir qué procedimiento es aplicable para el objetivo de esta miniventanilla única: un censo o una muestra. La principal desventaja de un censo es su gran costo en términos de tiempo y dinero; Por el contrario, una ventaja del muestreo es su bajo costo, al tiempo que conduce a una estimación confiable de la población objetivo si la muestra se selecciona correctamente (42, 51). Una solución es realizar una muestra basada en el riesgo. Esto permite reducir los costos y el monitoreo de las muestras más relevantes. Debido al conocido efecto agrupado de (n) animales en (m) granjas, debe considerarse el muestreo multietástico, donde primero se determina el número de rebaños y luego el número de animales por rebaño (51).
A nivel de rebaño
Por lo que respecta al muestreo basado en el riesgo, las manadas con las siguientes características deben investigarse predominantemente:
• Reproducción en general, pero especialmente cuando el parto ocurrirá en pastos: Se debe consultar información sobre el manejo del rebaño (lugar del parto, es decir, parto en establo vs. pasto), así como el momento del parto (sincronización del estro / inseminación artificial, temporada de parto) (33).
• Contacto cercano en general, pero especialmente cuando se van a exhibir pequeñas rumiantes hembras y preñadas: Información sobre exposiciones (es decir, exposiciones de conformación, vacaciones en granjas, días de puertas abiertas). Además, deben identificarse e investigarse en particular todas las hembras reproductoras de pequeños rumiantes mantenidas para parques zoológicos, la educación asistida por animales y la terapia (29).
• Contacto a distancia en general, pero especialmente cuando la migración se realiza en zonas residenciales: Se debe adquirir información sobre la migración de los rebaños y las manadas migratorias deben someterse a pruebas periódicas (31, 33).
Como se puede suponer que estas características afectan a la mayoría de las bandadas alemanas de pequeños rumiantes, este muestreo basado en el riesgo puede ser casi un censo.
A nivel de rebaño interno
En cuanto al muestreo basado en el riesgo, todas las hembras después del parto deben investigarse predominantemente. Suponiendo que el rebaño tiene un estado positivo dado que un individuo está desprendiendo C. burnetii, calculamos el tamaño de muestra requerido (n) para identificar la ausencia de enfermedad considerando el número absoluto de hembras primi-/multíparas por rebaño (N) [ver Material Suplementario; (5, 36, 51)]. Nuestro cálculo muestra que la diferencia entre censo y muestra (N-n) es mínima y, por lo tanto, este muestreo basado en el riesgo es casi un censo (ver Material Suplementario).
Tiempo de muestreo
Las pruebas de nivel de la parvada deben realizarse durante el período principal de parto y antes de migrar a áreas residenciales al menos una vez al año. Además, debe realizarse un examen ecográfico antes de exhibir, transportar/sacrificar animales individuales. Los animales en el último trimestre de la gestación no deben ser exhibidos para prevenir abortos espontáneos o nacimientos cerca de humanos y no deben ser transportados/sacrificados para prevenir la infección de comerciantes de animales y mataderos.
Predisposición
Un proceso de muestreo siempre conduce a una incertidumbre sobre la información recopilada porque una declaración concluyente en respuesta a una pregunta de investigación solo está disponible para los individuos muestreados (42). Para evaluar la calidad de esta miniventanilla única, en esta sección se analizan las posibles fuentes de sesgo.
El sesgo de selección describe la diferencia entre una estimación y la verdad (60). En el caso de esta miniventanilla única, el sesgo de selección puede originarse en la técnica de muestreo descrita anteriormente. En primer lugar, es importante mencionar que esta minifinanciación mutua depende actualmente de la participación voluntaria de los diferentes interesados. La escasa participación de estas partes interesadas podría introducir un sesgo de selección tal que solo participen los propietarios de animales interesados. Esto podría sesgar el porcentaje de parvadas que dan positivo hacia una sobreestimación, si estas personas ya saben que su parvada tiene un problema con la fiebre Q. Sin embargo, también podría sesgarse hacia una subestimación, si estas personas centran su manejo de la parvada en una estrategia de higiene perfecta y, por lo tanto, participan para prevenir nuevas infecciones por C. burnetii. Un porcentaje de sobreestimación o subestimación no impediría el objetivo de esta miniventanilla única, que es identificar tantos rebaños como sea posible en total que arrojen C. burnetii. Además, si el sistema se vuelve obligatorio, este sesgo se resolverá. A continuación, los funcionarios de sanidad veterinaria tienen que administrar el principio basado en el riesgo de la selección de manadas y de individuos dentro de las parvadas. Por ejemplo, el muestreo de pequeñas rumiantes hembras no apareadas, que no paren, o el muestreo de pequeñas rumiantes hembras apareadas durante el embarazo y tarde después del parto también pueden llevar a una subestimación. Aunque este proceso de selección puede apoyarse en el uso de un cuestionario, depende de decisiones subjetivas y puede ser una fuente de posibles sesgos. Más allá de esto, la asignación correcta de los rebaños de alto riesgo depende de que los propietarios de los animales proporcionen la información correcta.
El sesgo de información describe la diferencia entre la estimación y la verdad que se origina en la sobreestimación o subestimación de los resultados (60). En el caso de este MOSS, el mayor sesgo de información se debe a que algunos propietarios de animales no conocen el momento del parto, ya que los pequeños rumiantes machos fértiles están constantemente en el rebaño. Por lo tanto, la información sobre el momento del parto solo puede comunicarse a los funcionarios de salud veterinaria cuando ya ha tenido lugar. Por lo tanto, una muy buena comunicación entre los propietarios de animales y los veterinarios es un requisito previo para obtener muestras de manera oportuna. El sesgo de información adicional puede originarse a partir de la clasificación errónea de las piscinas, lo que resulta en una clasificación falsa del estado de la parvada. Esto depende de la sensibilidad y especificidad de la prueba diagnóstica elegida (60), que son muy altas en el caso de las pruebas de PCR (1, 5, 25). Como el desprendimiento de C. burnetii ocurre esporádicamente, los resultados de las pruebas pueden pasar por alto a un individuo positivo y, por lo tanto, el estado positivo de un rebaño. Al planificar la realización de pruebas a los rebaños por completo y durante un momento en que es más probable la identificación de animales positivos, los resultados de las pruebas falsas o negativas solo pueden modificar el estado de la enfermedad estimado a nivel de rebaño si la excreción ocurre en muy pocos animales o si el rebaño es pequeño. Por lo tanto, como la precisión de la prueba es comparativamente alta y se investigan grupos en lugar de animales individuales, el rendimiento de la prueba no tiene que considerarse como un sesgo relevante para la determinación del estado de la enfermedad.
Plan de Acción y Control
Las recomendaciones para la acción y las medidas de control con respecto a la fiebre Q en pequeños rumiantes se han publicado en otros lugares (1, 5, 12, 25, 33, 40, 41). Sin embargo, la gestión y la cría de manadas alemanas varían considerablemente entre cada sistema de producción de pequeños rumiantes, lo que da lugar a un riesgo variable de transmisión de patógenos a la población humana (5). Por lo tanto, los planes de acción y control adaptados individualmente son preferibles a las recomendaciones generales y deben desarrollarse con la cooperación de los profesionales veterinarios y de la salud humana y los propietarios de los animales.
En caso de estado positivo de la parvada (desprendimiento de patógenos en una manada)
Si se detecta la excreción de C. burnetii, deben definirse acciones inmediatas y a largo plazo en un plan de acción y control específico para el rebaño (41).
Lo más importante es que la prevención del contacto cercano entre el rebaño positivo y el público significa que las exhibiciones de animales, así como las personas no autorizadas en el rebaño (es decir, visitas a granjas, vacaciones, días de puertas abiertas) tienen que cesar hasta que se demuestre que el rebaño es negativo nuevamente. Las personas autorizadas que trabajan en el rebaño (propietarios de animales, sus empleados, comerciantes de animales, mataderos, lecherías, esquiladores de ovejas) deben protegerse con equipo de protección personal; el uso de respiradores FFP3 es lo más importante, y la ropa de trabajo protectora solo debe usarse dentro del rebaño específico (12, 33, 40, 41).
Igualmente importante es la prevención del contacto distante entre el rebaño y el público. Por lo tanto, los dueños de los animales tienen que organizar el parto dentro de un establo y almacenar materiales contagiosos como el parto o el material abortado en recipientes seguros hasta su procesamiento. Además, la limpieza y desinfección de las áreas de parto y los establos son necesarias para evitar la diseminación de patógenos. Además, el estiércol y la basura deben cubrirse durante 9 meses antes de esparcirlos en tierras de cultivo (12, 33, 40, 41). Aunque la vía de infección alimentaria es poco probable (2), la venta y el consumo de leche cruda y productos lácteos crudos deben prohibirse (12, 40, 41). Los pequeños rumiantes no deben utilizarse como fuente de terapia con células vivas (35). No se debe permitir la migración, y el rebaño debe mantenerse lo más lejos posible de la habitación humana hasta que se demuestre que el rebaño es negativo nuevamente (31). La esquila y el almacenamiento de la lana deben realizarse en una habitación cerrada mientras se usa equipo de protección personal. La lana contaminada debe destruirse en una planta de transformación (31, 33, 40, 41).
Además, una acción que concierne a los animales individuales es la vacunación. Sin embargo, se debe preferir la vacuna de fase I a la vacuna de fase II, ya que es más efectiva (61). Aunque la vacunación de fase I no puede detener la diseminación de C. burnetii, puede reducir la diseminación de patógenos (1, 17, 33, 61). El tratamiento con oxitetraciclina no se recomienda en el caso de fiebre Q en pequeños rumiantes, ya que no detiene la diseminación de patógenos (25, 61).
Como la fiebre Q ocurre esporádicamente y puede volver a aparecer después de algún tiempo, un rebaño con un estado positivo debe volver a analizarse durante al menos las próximas dos temporadas de parto (22). Para evitar una mayor propagación inadvertida del patógeno, se debe investigar la posible fuente de infección [rastreo y rastreo, la vida silvestre como reservorio de patógenos; (10, 12, 33, 34, 45, 54, 61)].
En caso de estatus negativo de rebaño
Si el estado de una parvada es negativo, la excreción de C. burnetii no se detectó mediante PCR de hisopos vaginales y actualmente es poco probable la transmisión al público. Sin embargo, como la fiebre Q ocurre esporádicamente, es necesario realizar pruebas recurrentes anualmente. En casos de mayor riesgo de transmisión al público, deben aplicarse pruebas adicionales. Además, los animales en su último trimestre de gestación no deben ser transportados, por ejemplo, para exposición o sacrificio, a fin de evitar la contaminación por patógenos por parto o sacrificio espontáneo. En consecuencia, se debe realizar un examen de ecografía para determinar el estado de embarazo de un animal individual antes del transporte.
Implementación y evaluación
Para implementar y evaluar esta miniventanilla única, es importante discutir qué partes interesadas están potencialmente afectadas y qué consideraciones económicas deben tenerse en cuenta.
Participantes
Las partes interesadas que se ven afectadas de alguna manera por esta miniventanilla única son diferentes subgrupos que trabajan en el sector de los pequeños rumiantes, así como profesionales de la salud veterinaria y humana, responsables políticos, fondos para enfermedades animales y el propio público (5, 29, 45, 55, 62-64).
El sector de los pequeños rumiantes incluye primero a los propietarios de ovejas y cabras, sus empleados y miembros de la familia. Los pequeños propietarios de rumiantes están organizados en asociaciones regionales y nacionales (de cría). Estas asociaciones representan las opiniones de sus miembros y son contrapartes importantes para ponerse en contacto con los propietarios de pequeños rumiantes y ampliar la información sobre la implementación de las MOSS. Mientras la participación sea voluntaria, los propietarios de animales tienen que aceptar activamente participar. La participación estará influenciada por la buena comunicación entre los diferentes grupos de partes interesadas y la conciencia de la importancia de esta miniventanilla única para la salud pública. Por lo tanto, discutimos la idea de vincular estrechamente el monitoreo voluntario de la fiebre Q con otro programa de monitoreo ya bien establecido (y obligatorio) para la brucelosis con un grupo de representantes de asociaciones de propietarios de pequeños rumiantes. Quedó claro que la conciencia sobre el impacto de esta enfermedad para la salud pública actualmente no es lo suficientemente alta como para desencadenar la voluntad de participar. Los representantes hicieron hincapié en que los propietarios de pequeños rumiantes ya están sobrecargados de reglamentos y documentación legal y no pueden justificar una mayor carga de trabajo y restricciones, que no son predecibles en el caso de un estado positivo de la manada. Por lo tanto, debe concluirse que antes y en paralelo con la implementación de esta miniventanilla única, se debe hacer un gran esfuerzo para crear conciencia, desmantelar las barreras y los temores y aumentar el conocimiento de la fiebre Q y exactamente cómo funcionará la miniventanilla única. Además, es necesario analizar y hacer hincapié en los posibles beneficios económicos de un resultado negativo de la prueba para crear un incentivo para la participación (véase el capítulo «Consideraciones económicas»).
Otros grupos en el sector de los pequeños rumiantes que deben tenerse en cuenta son los comerciantes de animales, los mataderos, las lecherías y los esquiladores de ovejas. Estos grupos necesitan conocer el estado de los rebaños para adaptar sus hábitos de trabajo cuando manipulan rebaños positivos con respecto al equipo de protección personal (es decir, usan máscaras respiratorias FFP-3) o cuando procesan material derivado de pequeños rumiantes [es decir, pasteurización de leche cruda, sacrificio separado, manipulación y venta de lana; (33, 40, 41)]. Algunos profesionales podrían incluso tener que posponer o cancelar su trabajo en pequeños rebaños de rumiantes que dan positivo (por ejemplo, esquiladores de ovejas) debido a la autoprotección.
Los profesionales de la salud veterinaria incluyen a los funcionarios de la autoridad de salud veterinaria que tienen que organizar pasos tales como la selección de las manadas más relevantes, así como la documentación y el análisis de los resultados de las pruebas. La elaboración de planes de acción y control específicos para la parvada es otra de sus tareas. Sin embargo, estos pasos deben llevarse a cabo en cooperación con los propietarios de los animales. En este punto, los veterinarios funcionan como un vínculo entre la autoridad de salud veterinaria y los propietarios de animales, ya que conocen a los propietarios de animales como sus clientes y, por lo tanto, pueden aconsejar qué medidas deben implementarse para el rebaño afectado. Además, los veterinarios deben realizar la toma de muestras de hisopos vaginales en nombre de la autoridad sanitaria veterinaria. Dado que existe un servicio de sanidad animal en la mayoría de los estados federales alemanes, estas tareas pueden transferirse a los veterinarios en ejercicio de esta unidad organizativa. Los laboratorios son necesarios para hacer las pruebas de diagnóstico de estos hisopos. Para implementar las medidas de seguridad necesarias en el laboratorio, las muestras deben envasarse de forma segura y acompañarse de informes preliminares significativos.
Como la fiebre Q es una zoonosis, los profesionales de la salud humana son partes interesadas adicionales en este MOSS. Por lo tanto, los funcionarios de la autoridad de salud pública y sus colegas de la autoridad de salud veterinaria deben cooperar. En el caso de un estado positivo de la manada, el intercambio de información debe tener lugar automáticamente, ya que esto proporciona una alerta temprana para llamar la atención sobre posibles casos de fiebre Q en la población humana. Por lo tanto, los funcionarios de la autoridad de salud pública deben enviar información a los médicos para crear conciencia y alerta, sin estigmatizar a los dueños de animales y sus familias. Además, los laboratorios del sector de la salud humana están involucrados si ocurren casos humanos, y deben ser informados para estar alertas sobre el potencial zoonótico también.
A continuación, los responsables de la formulación de políticas son un grupo importante de partes interesadas en esta miniventanilla única. Debido a la reciente legislación alemana, la fiebre Q solo se controla a través de una MOSS pasiva. Por lo tanto, la implementación de cualquier nuevo intento de vigilancia depende de la participación voluntaria de los propietarios de animales y los profesionales de la salud veterinaria. Por lo tanto, la legislación debe revisarse, y una miniventanilla de seguridad operacional activa debe ser obligatoria para proteger al público de manera efectiva.
Además, la revisión debe incluir subvenciones para los propietarios de animales en casos de estado positivo del rebaño. Esto lleva a los Fondos para Enfermedades Animales como nuevas partes interesadas. Estas instituciones de derecho público están reguladas en todo el país por el TierGesG, pero dentro de los estados federales el reembolso de los costos de monitoreo y lucha contra las enfermedades animales varía (38). Por lo tanto, la legislación federal es necesaria para regular el subsidio de los propietarios de animales por parte de estas instituciones en el caso de un estado positivo del rebaño.
Por último, el público debe ser mencionado como un grupo de partes interesadas. Si existe un riesgo de un brote de fiebre Q en la población, la población debe ser informada sobre los posibles factores de riesgo y el comportamiento preventivo. Por lo tanto, es importante que el departamento de relaciones públicas de cada distrito coopere con la prensa local para informar al público sin generar pánico ni estigmatizar a los pequeños propietarios de rumiantes (62, 63).
Consideraciones económicas
Las decisiones sobre este concepto están impulsadas por consideraciones económicas que afectan a todos los diferentes grupos de partes interesadas.
Los costos financieros evolucionan a partir de la coordinación de las normas mínimas de seguridad, la recolección de muestras y las pruebas, así como de las medidas de acción y control (véase el material complementario). Por lo tanto, el conflicto entre las mejores prácticas y la viabilidad es notable.
Para la coordinación de las MOSS, los costos laborales para los empleados de la autoridad de salud veterinaria deben evaluarse antes de la implementación. Aquí, el esfuerzo para recopilar información básica sobre el estado de riesgo de los rebaños dentro de cada distrito gubernamental se considera la tarea que más tiempo consume. Al calcular los costos financieros de la recolección de muestras, las pruebas de muestras y la vacunación, como medida de acción y control, consideramos la regulación alemana de tarifas veterinarias (GOT), la regulación de tarifas para la administración / protección del consumidor y la autoridad de salud veterinaria (GOVV) en Baja Sajonia y la comisión alemana permanente de vacunación para medicina veterinaria (STIKO Vet) [ver Material complementario; (65–67)]. Como la recolección de muestras debe ser realizada por veterinarios en nombre de la autoridad de salud veterinaria, se deben tener en cuenta los costos de mano de obra, los costos de conducción, los materiales (hisopos vaginales) y el envío de muestras. Además, se deben considerar los costos de las pruebas de muestras por parte de los laboratorios, por lo que la agrupación de muestras ahorra costos (ver Material suplementario). En cuanto a la acción y el control, todas las medidas aplicadas deben ser supervisadas por las autoridades veterinarias, lo que provoca costes adicionales de personal. Para la vacunación, asumimos cuatro euros por dosis de 2 ml para un pequeño rumiante (25). Además, asumimos que solo los brillos, los animales de reemplazo y las compras del rebaño (tasa de reemplazo del 20%) necesitan una inmunización inicial. Aquí, se calcularon dos dosis a intervalos de 3 semanas. Si es posible, la vacunación debe completarse 4 semanas antes del apareamiento (61), mientras que el otro 80% de la parvada recibe solo una vacuna de refuerzo por año. La recolección de muestras, las pruebas y la vacunación de todas las hembras reproductoras (n = 1.270.011) en la población alemana de pequeños rumiantes incluyen 26.090.430 euros por año en este cálculo [ver Material suplementario; (52, 53)]. Además, los propietarios de animales enfrentarían costos (adicionales) por modificar sus prácticas habituales de manejo y alojamiento de rebaños para garantizar que se evite la transmisión de patógenos. La extracción de materiales contaminados puede causar costos adicionales. Además, y lo más importante, la pérdida de ingresos para los propietarios de animales afectados también debe considerarse antes de implementar esta miniventanilla única. El daño financiero puede ser sustancial dependiendo del propósito de uso y del valor de mercado del rebaño y sus productos [es decir, prohibición del comercio con lana, leche cruda (productos) o animales vivos]. Además, también se debe considerar la pérdida de ingresos y la amenaza de empleos. Aunque la fiebre Q está incluida en la lista de la OIE, no está incluida en las «Recomendaciones aplicables a las enfermedades de la lista de la OIE y otras enfermedades de importancia para el comercio internacional» (5, 36). Dado que recomendamos detener el comercio de animales de un rebaño positivo, esto podría resultar en la pérdida de ingresos para los dueños de los animales. Este cálculo y resumen de los costos financieros muestra que no es factible aplicar este concepto de una miniventanilla única de mejores prácticas.
Finalmente, los siguientes pasos son necesarios para reducir los costos a fin de que esta miniventanilla sea factible. Las medidas preventivas deben sustituir a las pruebas siempre que esté justificado. Por lo tanto, el enfoque en la vacunación a nivel nacional sería más útil, ya que esto garantizaría una menor diseminación de patógenos por parte de pequeños rumiantes infectados. Asumiendo los costos de vacunación como se indicó anteriormente para todas las hembras reproductoras (n = 1,270,011) en la población alemana de pequeños rumiantes, una vacunación nacional de estos incluiría aproximadamente 7,722,000 euros por año. Si la recolección de muestras y las pruebas se omiten por completo, esto resultaría en una reducción de costos de 18,368,430 euros por año en comparación con el concepto de mejores prácticas [ver Material Suplementario; (52, 53)]. Además, los estudios actuales están investigando si la dosis de vacunación para ovejas puede reducirse a la mitad (1 ml por dosis) en comparación con las cabras (25). Otros estudios están analizando si la vacunación exclusiva de los brillos sería suficiente para prevenir un estado positivo de la parvada (68). Estos enfoques también reducirían aún más los costos. Desafortunadamente, no es posible evitar la recolección de muestras y las pruebas en casos de contacto cercano entre pequeños rumiantes y el público porque la vacunación no evita la eliminación completa de patógenos (5). Por otro lado, la vacunación puede reducir en gran medida el riesgo de infección por fiebre Q en la población humana. Para reducir aún más los costos, también debe considerarse que las pruebas de un número tan grande de animales significan que los costos de las pruebas de muestreo y la vacunación pueden negociarse entre la autoridad nacional de salud veterinaria y la industria, lo que resulta en costos más bajos para cada distrito, como en nuestro cálculo anterior. Además, se podrían ahorrar costos si la recolección de muestras fuera realizada por personas independientes, como empleados de la cámara responsable de agricultura o Animal Disease Founds, que tienen menores costos laborales como veterinarios. Sin embargo, se debe asegurar que los empleados tengan los conocimientos necesarios para garantizar la calidad de las muestras. Además, también podría considerarse si los propios propietarios de los animales podrían recoger las muestras. Sin embargo, esto plantea varios problemas. En primer lugar, habría que asegurarse de que todos los propietarios de animales tengan los conocimientos necesarios para llevar a cabo el muestreo correctamente. En segundo lugar, los propietarios de los animales se ven directamente afectados por los resultados de las muestras, lo que podría perjudicarlos al tomar las muestras.
Con respecto a la coordinación de las normas mínimas de seguridad, la recogida de muestras y las pruebas, así como los costos de vacunación, debe decidirse qué grupo de partes interesadas debe participar en la financiación. Los propietarios de animales podrían ser un posible grupo, ya que es su responsabilidad no comprometer la salud pública mediante la cría de animales (69). Por otro lado, no se puede esperar que los propietarios de animales asuman únicamente estos altos costos y la responsabilidad. Por lo tanto, los costos deben ser compartidos o asumidos. Si bien los propietarios de cabras pueden estar más dispuestos a aceptar costos financieros, ya que la fiebre Q conduce a pérdidas para sus animales (es decir, una mayor tasa de aborto), en contraste, los dueños de ovejas podrían estar menos dispuestos a pagar ya que la fiebre Q generalmente no muestra ningún problema de salud en las ovejas. Dados los enfoques anteriores en Alemania, lo más probable es que la cobertura financiera sea asumida por los Fondos de Enfermedades Animales. Además, las autoridades de salud pública y las autoridades de salud veterinaria deben tenerse en cuenta en lo que respecta a la gestión conjunta (de costes). Esto se debe a que las medidas solo pueden ser ordenadas por las autoridades de salud pública. Esto se basa en el IfSG. Sin embargo, también se necesita experiencia veterinaria para las medidas de control de enfermedades en pequeñas manadas de rumiantes. Por lo tanto, es deseable que un equipo interdisciplinario coordine las medidas. Además de la base jurídica del Instrumento Interinstitucional, tanto las autoridades sanitarias públicas como las veterinarias son responsables del mantenimiento de la salud pública como bien común. Aunque la infección por C. burnetii supone un mayor riesgo para la salud humana que para la sanidad animal, la financiación conjunta por parte de los propietarios de animales, Animal Disease Founds, así como las autoridades de salud pública y las autoridades de sanidad veterinaria es una conclusión lógica.
Los beneficios financieros surgen de la prevención de casos de fiebre Q humana. Por lo tanto, cada caso que puede prevenirse con este MOSS ahorra costos para médicos, laboratorios, medicamentos, hospitalización y tiempo improductivo de los humanos. «Expresada en años de vida ajustados por enfermedad (AVAD), la fiebre Q ocupó el puesto 12 de 32 enfermedades infecciosas en los Países Bajos durante el período 2007-2011, utilizando la metodología desarrollada en el marco del proyecto Burden of Communicable Diseases in Europe (BCoDE). … Los costes sanitarios asociados a la epidemia de fiebre Q en los Países Bajos se estimaron en 18,4-26,5 millones de euros y la pérdida de productividad en 1,3-10,3 millones de euros adicionales» (70). Por lo tanto, aunque no es precisamente estimable, los costos pueden ser altos y los brotes pueden afectar considerablemente al sistema de salud. Por lo tanto, cada medida preventiva es financieramente preferible a la vigilancia pasiva continua tal como está actualmente en vigor. El beneficio financiero para los pequeños propietarios de rumiantes y el incentivo asociado para participar es difícil de reconocer al comienzo de la implementación de las miniventanillas únicas. Los dueños de animales temen el daño financiero que traerá una prueba positiva. En este punto, sin embargo, es muy importante enfatizar que una minima activa también conduce a una conciencia de calidad, lo que a su vez trae beneficios financieros. Una vez que se implemente la miniventanilla única en todo el país y se disponga de conciencia de esta zoonosis entre los propietarios de pequeños rumiantes, los profesionales de la salud pública, veterinaria y humana, los propietarios de pequeños rumiantes pueden usar un estado negativo de la parvada para demostrar la calidad de sus medidas de acción contra la fiebre Q. Como beneficio financiero, los propietarios de animales de rebaños con un resultado negativo en la prueba podrían vender leche cruda (productos) a un mejor precio (por ejemplo, mediante la autocomercialización o la venta a lecherías) y escapar de las restricciones como la prohibición de migración o el sacrificio de animales. Por lo tanto, esta miniventanilla única puede ser la base para crear una marca de calidad «Q sin fiebre» para el ganado de pequeños rumiantes en el futuro. Además, esta miniminisca activa garantiza que la fiebre Q en el ganado de pequeños rumiantes se controle en todo el país y, por lo tanto, también reduce el riesgo de introducción de patógenos en parvadas libres de fiebre Q, por ejemplo, mediante compras adicionales. Por lo tanto, un beneficio financiero es que la fiebre Q en el ganado de pequeños rumiantes estará menos extendida después de la implementación de la miniventanilla única y, por lo tanto, serán necesarios menos costos para las medidas de acción en el futuro.
Los costos emocionales incluyen el estigmatismo de las personas en el sector de los pequeños rumiantes, el miedo existencial a los dueños de animales y la ansiedad del público sobre la infección. Estos costos no pueden enumerarse pecuniarios, pero deben considerarse durante el proceso de implementación y al comunicarse con las partes interesadas. Esta MOSS solo puede actuar con alta eficiencia si las emociones de los dueños de animales y del público se toman en serio y se abordan adecuadamente.
Finalmente, los beneficios emocionales evolucionan a partir de la protección del público contra la fiebre Q mientras se coopera con los dueños de animales. Conocer el estado positivo del rebaño permite a los dueños de animales tomar medidas de seguridad y, por lo tanto, demostrar su sentido de responsabilidad hacia sus semejantes. El estado negativo del rebaño puede ganar la confianza del público en los dueños de animales y conducir al fortalecimiento económico de su negocio. Los pequeños rumiantes son un componente considerable de la producción ganadera alemana, especialmente para la conservación del paisaje, y son populares en el sector privado. Esta minimusa no quiere perjudicar la cría de pequeños rumiantes en Alemania. Más bien, tiene la intención de apoyar al sector de los pequeños rumiantes con respecto a su responsabilidad en la prevención de zoonosis. Por lo tanto, un beneficio emocional es que las partes interesadas trabajarán juntas para alcanzar este objetivo en un enfoque de Una sola salud.
Conclusión
En conclusión, este concepto de vigilancia activa de la fiebre Q en ganado de pequeños rumiantes se centra en un sistema de alerta temprana para prevenir las infecciones por fiebre Q en la población humana. Teniendo en cuenta un enfoque de mejores prácticas, el objetivo es identificar las parvadas que actualmente eliminan el patógeno. Las parvadas deben considerarse positivas si al menos un grupo de hisopos vaginales es positivo por PCR. El enfoque de vigilancia culmina en medidas específicas de control y acción específica para las manadas afectadas. Si se implementara este concepto de mejores prácticas, surgiría un enorme conflicto entre los costos económicos y la viabilidad. Por lo tanto, para mantener el objetivo de esta MOSS (prevención de casos humanos mediante la detección de pequeños vertederos de rumiantes), es necesario modificar el concepto. El sistema se ha desarrollado para servir de base para la introducción de un sistema de vigilancia obligatoria a nivel nacional en el futuro. Incluso sin el contexto de la obligación posterior de participar o aplicar medidas de control, siempre es un desafío equilibrar las necesidades y la viabilidad al desarrollar una miniventanilla única.
Actualmente, la implementación exitosa de este sistema de alerta temprana depende de la participación voluntaria de los propietarios de animales. Para la aplicación nacional y obligatoria de esta MOSS, es necesaria una revisión de la legislación alemana. Solo si la ley ordena la musa activa puede prevenirse de manera segura entre el público. Mientras tanto, y después de la obligación legal, el requisito previo más importante para la prevención exitosa de la transmisión de patógenos es una estrecha cooperación entre las autoridades de salud pública y las autoridades de salud veterinaria a nivel nacional y local, así como la voluntad de conocer las posibilidades y desafíos de las otras partes. Además, una comunicación buena y de confianza con otras partes interesadas, especialmente con los dueños de los animales, es obligatoria. Después de la implementación exitosa de este concepto centrado en la fiebre Q en ganado de pequeños rumiantes, se debe considerar un sistema adicional de monitoreo y vigilancia de la fiebre Q en otros mamíferos domésticos y silvestres como grupo objetivo. Este desarrollo adicional podría proporcionar información sobre un posible reservorio de patógenos en Alemania y ampliar la protección de la salud para la población.
En conclusión, este sistema de vigilancia se construye en la interfaz de la salud pública y animal, actuando así como una herramienta de salud pública veterinaria. La responsabilidad de la medicina veterinaria y humana para la salud pública ya está bien reconocida, y el concepto One Health debería ponerse en práctica con el sistema de alerta temprana para la fiebre Q presentado aquí.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / Material complementario, las consultas adicionales pueden dirigirse al autor / s correspondiente / s.
Contribuciones del autor
Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este trabajo fue parte del Q fever—GermAn Interdisciplinary Program for reSearch y fue financiado por el Ministerio Federal de Educación e Investigación (BMBF) bajo el número de proyecto 01KI1726B como parte de la Red de Investigación sobre Enfermedades Infecciosas Zoonóticas.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2021.623786/full#supplementary-material
Referencias
1. Rodolakis A. Q fever, state of art: epidemiology, diagnosis and prophylaxis. Pequeño Rumin Res. (2006) 62:121–4. doi: 10.1016/j.smallrumres.2005.07.038
2. Bundesinstitut für Risikobewertung (BfR) Stellungnahmen 2010. Q-Fieber: Übertragung von Coxiella burnetii Durch den Verzehr von Lebensmitteln Tierischer Herkunft Unwahrscheinlich, Stellungnahme Nr. 018/2010 des BfR vom 15. Disponible en línea en: https://www.bfr.bund.de/de/bfr_stellungnahmen_2010.html (consultado el 02 de abril de 2020).
3. Jones RM, Nicas M, Hubbard AE, Reingold AL. La dosis infecciosa de Coxiella burnetii (fiebre q). Aplicación Biosaf. (2006) 11:32–41. DOI: 10.1177/153567600601100106
4. Todkill D, Fowler T, Hawker JI. Estimación del período de incubación de la fiebre q aguda, una revisión sistemática. Epidemiol Infect. (2018) 146:665–72. doi: 10.1017/S095026881700303X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Organización Mundial de Sanidad Animal (OIE). Manual de las pruebas de diagnóstico y vacunas para los animales terrestres 2019 Capítulo 3.1.16 Q Fiebre (NB: Versión adoptada en mayo de 2018) Disponible en línea en: https://www.oie.int/standard-setting/terrestrial-manual/access-online/ (consultado el 11 de marzo de 2020).
6. Tissot-Dupont H, Raoult D. Aspectos clínicos, diagnóstico y tratamiento de la fiebre Q. En: Raoult D, Parola P, editores. Enfermedades rickettsias. Boca Raton, FL: CRC Press (2007). págs. 291–9. doi: 10.3109/9781420019971.021
7. Angelakis E, Raoult D. Q fiebre. Veterinario Microbiol. (2010) 140:297–309. doi: 10.1016/j.vetmic.2009.07.016
8. Morroy G, Keijmel SP, Delsing CE, Bleijenberg G, Langendam M, Timen A, et al. Fatiga después de la fiebre q aguda: una revisión sistemática de la literatura. PLoS ONE. (2016) 11:E155884. doi: 10.1371/journal.pone.0155884
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Robert Koch-Institut (RKI). RKI-ratgeber infektionskrankheiten – merkblätter für ärzte, Q-fieber. Toro Epidemiol. (2002) 37:313–6.
10. González-Barrio D, Ruiz-Fons F. Coxiella burnetii in wild mammals: a systematic review. Transbound Emerg Dis. (2019). 66:662–71. doi: 10.1111/tbed.13085
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Georgiev M, Afonso A, Neubauer H, Needham H, Thiéry R, Rodolakis A, et al. Q fever in humans and farm animals in four European countries, 1982 to 2010. Euro Surveill. (2013) 18:13–25.
12. Plummer PJ, McClure JT, Menzies P, Morley PS, Van den Brom R, Van Metre DC. Manejo de la infección por Coxiella burnetii en poblaciones ganaderas y el riesgo zoonótico asociado: una declaración de consenso. J Vet Pasante Med. (2018) 32:1481–94. DOI: 10.1111/JVIM.15229
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Ruiz-Fons F, González-Barrio D, Aguilar-Ríos F, Soler AJ, Garde JJ, Gortázar C, et al. Patógenos infecciosos potencialmente transmitidos por el semen de la variedad negra de la raza ovina manchega: restricciones sanitarias con fines de conservación. Anim Reprod Sci. (2014) 149:152–7. doi: 10.1016/j.anireprosci.2014.07.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Wolf A, Prüfer TL, Schoneberg C, Campe A, Runge M, Ganter M, et al. Prevalencia de Coxiella burnetii en rebaños de ovejas alemanas y evaluación de un nuevo enfoque para detectar una infección a través de hisopos prepuciales a nivel de rebaño. Epidemiol Infect. (2020) 148:e88. doi: 10.1017/S0950268820000801
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Körner S, Makert GR, Mertens-Scholz K, Henning K, Pfeffer M, Starke A, et al. Captación y excreción fecal de Coxiella burnetii por garrapatas Ixodes ricinus y Dermacentor marginatus. Paras vectores. (2020) 13:1–11. DOI: 10.1186/S13071-020-3956-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Nusinovici S, Hoch T, Brahim ML, Joly A, Beaudeau F. El efecto del viento en la transmisión de Coxiella burnetii entre rebaños de ganado: un enfoque mecanicista. Transbound Emerg Dis. (2017) 64:585–92. doi: 10.1111/tbed.12423
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Rodolakis A. Fiebre Q en animales lecheros. Ann NY Acad Sci. (2009) 1166:90–3. doi: 10.1111/j.1749-6632.2009.04511.x
18. Berri M, Souriau A, Crosby M, Crochet D, Lechopier P, Rodolakis A. Relationships between the shedding of Coxiella burnetii, clinical signs and serological responses of 34 sheep. Veterinario Rec. (2001) 148:502–5. DOI: 10.1136/VR.148.16.502
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Guatteo R, Joly A, Beaudeau F. Shedding and serological patterns of dairy cows following abortions associated with Coxiella burnetii DNA detection. Veterinario Microbiol. (2012) 155:430–3. doi: 10.1016/j.vetmic.2011.09.026
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Agerholm JS. Coxiella burnetii trastornos reproductivos asociados en animales domésticos: una revisión crítica. Acta Vet Scand. (2013) 55:13. DOI: 10.1186/1751-0147-55-13
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Bouvery N, Souriau A, Lechopier P, Rodolakis A. Experimental Coxiella burnetii infection in pregnant goats: excretion routes. Vet Res BioMed Centr. (2003) 34:423–33. doi: 10.1051/vetres:2003017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Berri M, Rousset E, Champion JL, Russo P, Rodolakis A. Las cabras pueden experimentar fallas reproductivas y arrojar Coxiella burnetii en dos partos sucesivos después de una infección por fiebre Q. Res Vet Sci. (2007) 83:47–52. doi: 10.1016/j.rvsc.2006.11.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Palmer NC, Kierstead M, Key DW, Williams JC, Peaceock MG, Vellend H. Placentitis and abortion in goats and sheep in ontario by Coxiella burnetii. Can Vet J. (1983) 24:60–1.
24. Centro Europeo para la Prevención y el Control de las Enfermedades. Fiebre Q. En: ECDC. Informe Epidemiológico Anual 2018. Estocolmo: ECDC (2019).
25. Bauer BU, Runge M, Campe A, Henning K, Mertens-Scholz K, Boden K, et al. Coxiella burnetii: A Review Focusing on Infections in German Sheep and Goat Flocks. Berl münch tierärztl wochenschr 2020. Disponible en línea en: https://vetline.de/icoxiella-burnetiii-ein-uebersichtsartikel-mit-fokus-auf-das-infektionsgeschehen-in-deutschen-schaf-und-ziegenherden/150/3216/111683 (consultado el 15 de abril de 2020).
26. Hellenbrand W, Schöneberg I, Pfaff G, Kramer M, Steng G, Reintjes R, et al. La relevancia de las infecciones por Coxiella burnetii en animales para la fiebre q en humanos – medidas para la prevención y el control. Tierärztl prax. (2005) 33:5–11. DOI: 10.1055/S-0038-1624108
27. Hellenbrand W, Breuer T, Petersen L. Changing epidemiology of q fever in Germany, 1947-1999. Emerg infectar dis. (2001) 7:789–96. DOI: 10.3201/EID0705.010504
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Robert Koch-Institut (RKI). Infektions Epidemiologisches Jahrbuch Meldepflichtiger Krankheiten für Das Jahr 2018. Berlín: Robert Koch-Institut (2019).
29. Porten K, Rissland J, Tigges A, Broll S, Hopp W, Lunemann M, et al. Una oveja súper extendida infecta a cientos de personas con fiebre q en un mercado de agricultores en Alemania. BMC Infect Dis. (2006) 6:147. DOI: 10.1186/1471-2334-6-147
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Instituto Federal para la Protección de la Salud del Consumidor y Medicina Veterinaria (BgVV). Bericht über die epidemiologische Situation der Zoonosen in Deutschland für 1998, Übersicht über die Meldungen der Bundesländer. En: Hartung M, editor. BgVV-Hefte XX/1999. Berlín: Instituto Federal para la Protección de la Salud del Consumidor y Medicina Veterinaria (BgVV) (1999). pág. 172.
31. Clark NJ, Magalhaes RJS. Dispersión geográfica aérea de la fiebre q de las explotaciones ganaderas a las comunidades humanas: una revisión sistemática y una evaluación crítica de la evidencia. BMC Infect Dis. (2018) 18:218. DOI: 10.1186/S12879-018-3135-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Sidi-Boumedine K, Rousset E, Henning K, Ziller M, Niemczuck K, Roest HIJ, et al. Desarrollo de sistemas armonizados para el seguimiento y la notificación de la fiebre Q en animales en la Unión Europea. La EFSA apoya a Publ. (2010) 7:1–48. doi: 10.2903/sp.efsa.2010.EN-48
33. Ganter M. Riesgos zoonóticos de pequeños rumiantes. Veterinario Microbiol. (2015) 181:53–65. doi: 10.1016/j.vetmic.2015.07.015
34. Bond KA, Vincent G, Wilks CR, Franklin L, Sutton B, Stenos J, et al. Un enfoque de salud para controlar un brote de fiebre q en una granja de cabras australiana. Epidemiol Infect. (2016) 144:1129–41. doi: 10.1017/S0950268815002368
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. George M, Reich A, Cussler K, Jehl H, Burckhardt F. Live cell therapy as potential risk factor for q fever. Emerg infectar dis. (2017) 23:1210–2. DOI: 10.3201/EID2307.161693
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Organización Mundial de Sanidad Animal (OIE). Código Zoosanitario Terrestre. (2019). Disponible en línea en: https://www.oie.int/index.php?id=169&L=0&htmfile=sommaire.htm (consultado el 11 de marzo de 2020).
37. Infektionsschutzgesetz vom 20. Juli 2000 (BGBl. I S. 1045), Das Zuletzt Durch Artikel 3 des Gesetzes Vom 27. März 2020 (BGBl. I S. 587) Geändert worden IST. Disponible en línea en: https://www.gesetze-im-internet.de/ifsg/BJNR104510000.html (consultado el 15 de marzo de 2020).
38. Tiergesundheitsgesetz in der Fassung der Bekanntmachung vom 21. Noviembre 2018 (BGBl. I S. 1938), Das Zuletzt Durch Artikel 100 des Gesetzes vom 20. Noviembre 2019 (BGBl. I S. 1626) Geändert worden IST. Disponible en línea en: https://www.gesetze-im-internet.de/tiergesg/BJNR132400013.html (consultado el 15 de marzo de 2020).
39. Verordnung über meldepflichtige Tierkrankheiten in der Fassung der Bekanntmachung vom 11. Februar 2011 (BGBl. I S. 252), Die Zuletzt Durch Artikel 381 der Verordnung vom 31. Agosto 2015 (BGBl. I S. 1474) Geändert worden IST. Disponible en línea en: https://www.gesetze-im-internet.de/tkrmeldpflv_1983/BJNR010950983.html (consultado el 15 de marzo de 2020).
40. Chemisches und Veterinäruntersuchungsamt (CVUA) Stuttgart. Leitfaden zum Q-Fieber Baden-Württemberg: Empfehlungen zur Bekämpfung des Q-Fiebers bei kleinen Wiederkäuern in Baden-Württemberg. Stuttgart (2017).
41. Ministerio Federal de Alimentación y Agricultura (BMEL). Bekanntmachung von Empfehlungen für Hygienische Anforderungen an das Halten von Wiederkäuern vom 7 Juli 2014 (BAnz. AT 01.08.2014 BI) Geändert Durch Erste Bekanntmachung der Änderung der Bekanntmachung von Empfehlungen für Hygienische Anforderungen an das Halten von Wiederkäuern vom 19. Agosto 2014 (BAnz AT 28.08.2014 B1). Disponible en línea en: https://www.bmel.de/DE/Tier/Tiergesundheit/_texte/EmpfehlungenHygiene.html (consultado el 15 de marzo de 2020).
42. Dr. Salman. Sistemas de vigilancia y estudio de enfermedades animales: métodos y aplicaciones. Iowa, IA: Iowa State Press (2003). págs. 1–222. doi: 10.1002/9780470344866
43. Doherr MG, Audige L. Monitoring and surveillance for rare health-related events: a review from the veterinary perspective. Philos Trans R Soc Lond B. (2001) 356:1097–106. DOI: 10.1098/RSTB.2001.0898
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Hilbert A, Schmoock G, Lenzko H, Moog U, Diller R, Fröhlich A, et al. Prevalencia de Coxiella burnetii en rebaños de ovejas alemanas clínicamente sanos. BMC Res Notes. (2012) 5:152. DOI: 10.1186/1756-0500-5-152
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Roest HIJ, Tilburg JJHC, Van der Hoek W, Vellema P, Van Zijderveld FG, Klaassen CHW, et al. Artículo de revisión, la epidemia de fiebre q en los Países Bajos: historia, inicio, respuesta y reflexión. Epidemiol Infect. (2011) 139:1–12. doi: 10.1017/S0950268810002268
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Hoinville LJ. Terminología de vigilancia zoosanitaria, informe final del taller previo al ICAHS, julio de 2013 (versión 1.2). En: International Conference on Animal Health Surveillance (ICAHS). La Habana: CUB (2013).
47. Hoinville LJ, Alban L, Drewe JA, Gibbens JC, Gustafson L, Häsler B, et al. Términos y conceptos propuestos para describir y evaluar los sistemas de vigilancia zoosanitaria. Prev Vet Med. (2013) 112:1–12. doi: 10.1016/j.prevetmed.2013.06.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Comin A, Haesler B, Hoinville LJ, Peyre M, Dórea F, Schauer B, et al. RISKSUR tools: taking animal health surveillance into the future through interdisciplinary integration of scientific evidence. En: Annual Meeting of the Society for Veterinary Epidemiology and Preventive Medicine. Elsinore: DNK (2016).
49. Sargento JM, O’Connor AM. Cuestiones de la presentación de informes en estudios observacionales en medicina veterinaria. Prev Vet Med. (2014). 113:323–30. doi: 10.1016/j.prevetmed.2013.09.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Runge M, Binder A, Schotte U, Ganter M. Investigations concerning the prevalence of Coxiella burnetii and Clamydia abortus in sheep in correlation with management systems and abortion rate in Lower saxony in 2004. Berl Munch Tierarztl Wochenschr. (2012) 125:10–5. DOI: 10.2376/0005-9366-125-138
51. Dohoo IR, Martin W, Stryhn H. Investigación epidemiológica veterinaria. Charlottetown, PE: VER Inc. (2010). págs. 1–865.
52. Oficina Federal de Estadística de Alemania (Destatis). Ergebnis – 41141-0019 Landwirtschaftliche Betriebe mit Viehhaltung, Viehbestand: Bundesländer, Stichtag, Tierarten (01.03.2016). Disponible en línea en: https://www-genesis.destatis.de/genesis/online/data;sid=BD01EDE95F2DAE53798F8BBFCB748D7D.GO_2_1?operation=abruftabelleBearbeiten&levelindex=1&levelid=1568200076966&auswahloperation=abruftabelleAuspraegungAuswaehlen&auswahlverzeichnis=ordnungsstruktur&auswahlziel=werteabruf&selectionname=41141-0019&auswahltext=&werteabruf=Werteabruf (consultado el 11 de septiembre de 2019).
53. Oficina Federal de Estadística de Alemania (Destatis) Ministerio Federal de Alimentación y Agricultura (BMEL). Statistik und Berichte des BMEL, Landwirtschaft, Tierhaltung, Schafe, MBT-0117490-0000 Betriebe mit Schafhaltung nach Bestandsgrößenklassen. Disponible en línea en: https://www.bmel-statistik.de/landwirtschaft/tierhaltung/schafhaltung/ (consultado el 24 de marzo de 2020).
54. Debeljak Z, Medic S, Baralic M, Andric A, Tomic A, Vidanovic D, et al. Características clínicas, epidemiológicas y epizoóticas de un brote de fiebre Q en la región fronteriza entre Serbia y Montenegro. J infectar Dev ctries. (2018) 12:290–6. DOI: 10.3855/JID.9918
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Anderson AD, Szymanski TJ, Emery MP, Kohrs PH, Bjork AC, Marsden-Haug N, et al. Investigación epizootiológica de un brote de fiebre q e implicaciones para futuras estrategias de control. JAVMA. (2015) 247:1379–86. doi: 10.2460/javma.247.12.1379
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Bauer B, Prüfer L, Walter M, Ganter I, Frangoulidis D, Runge M, et al. Comparación de la excreción de Coxiella burnetii entre ovejas y cabras infectadas naturalmente con un genotipo asociado al ganado. Patógenos. (2020) 9:15. doi: 10.3390/pathogens9080652
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Roest HJ, van Gelderen B, Dinkla A, Frangoulidis D, van Zijderveld F, Rebel J, et al. Q Fever in pregnant goats: pathogenesis and excretion of Coxiella burnetii. PLoS ONE. (2012). 7:E48949. doi: 10.1371/journal.pone.0048949
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Friedrich-Loeffler-Institut (FLI). Amtliche Methodensammlung Q-Fieber. Greifswald-Insel Riems (2018).
59. Rousset E, Berri M, Durand B, Dufour P, Prigent M, Delcroix T, et al. Coxiella burnetii shedding routes and antibody response after outbreaks of q fever-induced abortion in dairy goat herds. Aplicación Environ Microbiol. (2009) 75:428–33. doi: 10.1128/AEM.00690-08
60. Kreienbrock L, Pigeot I, Ahrens W. Epidemiologische Methoden. Berlín; Heidelberg: Springer (2012). pág. 492. doi: 10.1007/978-3-8274-2334-4
61. Arricau-Bouvery N, Souriau A, Bodier C, Dufour P, Rousset E, Rodolakis A. Effect of vaccination with phase I and phase II Coxiella burnetii vaccines in pregnant goats. Vacuna. (2005) 23:4392–402. doi: 10.1016/j.vaccine.2005.04.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Rahaman MR, Milazzo A, Marshall H, Bi P. ¿Se utiliza un enfoque de una sola salud para el control de la fiebre Q? Una revisión exhaustiva de la literatura. Int J Medio Ambiente Salud Pública. (2019) 16:730. DOI: 10.3390/IJERPH16050730
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. de Vries DH, Kinsman J, Takacs J, Tsolova S, Ciotti M. Metodología para la evaluación de las sinergias de preparación y respuesta ante emergencias de salud pública entre las autoridades institucionales y las comunidades. BMC Health Serv Res. (2020) 20:411. DOI: 10.1186/S12913-020-05298-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Greiner M, Baumann M, Campe A, Doherr MG, Gareis M, Greif G, et al. Zur rolle der veterinärmedizin im bereich public health. Deutsch Tierärzteblatt. (2017) 65:158–61.
65. Tierärztegebührenordnung vom 28. Juli 1999 (BGBl. I S. 1691), die Zuletzt Durch Artikel 1 der Verordnung vom 10. Februar 2020 (BGBl. I S. 158) Geändert Worden IST. Disponible en línea en: https://www.gesetze-im-internet.de/got/BJNR169100999.html (consultado el 15 de marzo de 2020).
66. Gebührenordnung für die Verwaltung im Bereich des Verbraucherschutzes und des Veterinärwesens (GOVV) vom 29. Noviembre 2014, Letzte Berücksichtigte Änderung: Anlage Geändert Durch Verordnung vom 16.01.2020 (Nds. GVBl. S. 4). Disponible en línea en: http://www.nds-voris.de/jportal/portal/t/1bqx/page/bsvorisprod.psml?pid=Dokumentanzeige&showdoccase=1&js_peid=Trefferliste&documentnumber=1&numberofresults=1&fromdoctodoc=yes&doc.id=jlr-VetVwGOND2014V11Anlage&doc.part=X&doc.price=0.0#focuspoint (consultado el 15 de marzo de 2020).
67. Ständige Impfkommission Veterinärmedizin (StIKo Vet) am Friedrich-Loeffler-Institut (FLI). Leitlinie zur Impfung von Rindern und kleinen Wiederkäuern. Greifswald-Insel Riems (2018).
68. Bauer BU, Janowetz B, Turowski V, Ambros C, Alex M, Domes U, et al. Verlauf der Coxiellose in Einer Schafherde Nach Jährlicher Grundimmunisierung der Zutreter [Internet]. Tagung der DVG-Fachgruppe Krankheiten kleiner Wiederkäuer: Greifswald – Insel Riems (2019). págs. 83–5. Disponible en línea en: https://elib.tiho-hannover.de/receive/tiho_mods_00003290
Palabras clave: sistema de vigilancia, Coxiella burnetii, pequeños rumiantes, una sola salud, alerta temprana
Cita: Winter F, Schoneberg C, Wolf A, Bauer BU, Prüfer TL, Fischer SF, Gerdes U, Runge M, Ganter M y Campe A (2021) Concepto de un sistema de vigilancia activa para la fiebre Q en pequeños rumiantes alemanes: conflictos entre las mejores prácticas y la viabilidad. Frente. Vet. Sci. 8:623786. DOI: 10.3389/FVETS.2021.623786
Recibido: 30 de octubre de 2020; Aprobado: 04 Enero 2021;
Publicado: 10 febrero 2021.
Editado por:
Satoshi Sekiguchi, Universidad de Miyazaki, Japón
Revisado por:
David González-Barrio, Universidad Complutense de Madrid, España
Monika Szymańska-Czerwińska, Instituto Nacional de Investigación Veterinaria (NVRI), Polonia
Derechos de autor © 2021 Invierno, Schoneberg, Wolf, Bauer, Prüfer, Fischer, Gerdes, Runge, Ganter y Campe. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY). S
*Correspondencia: Fenja Winter, fenja.winter@tiho-hannover.de
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

