Directrices veterinarias para la electroquimioterapia de tumores superficiales
Directrices veterinarias para la electroquimioterapia de tumores superficiales
- 1VetOncologia, Buenos Aires, Argentina
- 2Université Paris-Saclay, CNRS, Gustave Roussy, Metabolic Metabolic and Systemic Aspects of Oncogenesis (METSY), Île-de-France, Francia
- 3Instituto Universitario del Hospital Italiano-CONICET, Buenos Aires, Argentina
La electroquimioterapia (ECT) consiste en la aplicación de pulsos eléctricos para aumentar la ingesta de medicamentos quimioterapéuticos (bleomicina, cisplatino o calcio) en las células tumorales. Se ha convertido en una opción de tratamiento muy valiosa en oncología veterinaria. Es una modalidad de tratamiento eficaz y segura, que no solo es beneficiosa como tratamiento paliativo, sino también para un enfoque curativo. Realizar el tratamiento adecuadamente garantizará los mejores resultados posibles, en el número mínimo de sesiones, y reducirá las complicaciones. Por lo general, solo una sesión es suficiente para lograr excelentes resultados, pero el tratamiento se puede repetir. Pueden ser necesarias varias sesiones en el caso de lesiones tratadas incompletas o muy extendidas, así como en la aparición de nuevas lesiones. La ECT es eficaz para tumores superficiales u orales de cualquier histología a los que se pueda acceder los electrodos. La bleomicina intravenosa es el medicamento preferido y la vía de administración, dejando otras formas de administración y medicamentos para casos seleccionados. Las directrices presentadas aquí están destinadas a los veterinarios que desean desarrollar su comprensión de la base de la TEC y desean realizarla de manera adecuada y efectiva. En este documento, también discutimos los problemas comunes y cómo resolverlos, e incluimos consejos prácticos para mejorar los resultados del tratamiento basados en preguntas y errores comunes de los usuarios principiantes.
Introducción
Electroquimioterapia: concepto, campo de aplicación y ventajas
La electroquimioterapia (ECT) es una modalidad de tratamiento bien establecida que se ha realizado en medicina veterinaria desde 1997 en Europa (1) y desde 2008 en América Latina. Su uso en medicina humana comenzó con un ensayo clínico publicado en 1991 (2, 3) y se convirtió en una terapia estándar en 2006 cuando se publicaron los procedimientos operativos estándar para la TEC en pacientes humanos, y se puso a disposición el equipo apropiado (4).
En medicina veterinaria, la ECT como estándar de atención ya está disponible en muchos países de todo el mundo. El uso de la TEC tuvo un fuerte crecimiento después de que se produjeran electroporadores veterinarios y se dispusiera de cursos de formación, por ejemplo, en Eslovenia, Brasil y Argentina. El impacto únicamente en América Latina se revela por el hecho de que las reuniones anuales en Brasil y Argentina reúnen a usuarios de todo el mundo para compartir sus conocimientos y experiencia. A pesar de un número relativamente bajo de publicaciones hasta ahora, más de 20 000 pacientes habían sido tratados en más de 120 centros solo en América Latina (información recopilada de la última reunión de usuarios celebrada en Brasil en 2019).
En sus inicios, la TEC se utilizó para el tratamiento paliativo de tumores cutáneos y subcutáneos de cualquier histología. Pero hoy en día, se puede usar como tratamiento de primera línea, solo o en combinación con otras terapias. Se ha utilizado para tratar tumores en diferentes regiones anatómicas, con la ayuda de los electrodos especialmente diseñados para la medicina veterinaria y humana (5-1).
ECT consiste en la permeabilización transitoria y reversible de las células a través de la aplicación de un campo eléctrico. Esto aumenta la absorción celular de ciertas moléculas, aumentando su eficacia citotóxica y anticancerígena hasta 1.000 veces (12). La bleomicina, el cisplatino o el calcio son los medicamentos que han demostrado ser eficaces, con una clara ventaja para la bleomicina entre ellos (13, 14). Las razones detrás de esta ventaja son que la bleomicina mata selectivamente las células replicantes, preservando los tejidos sanos no replicantes, induce una respuesta del sistema inmunitario y se puede administrar por vía intravenosa, proporcionando una disponibilidad de dosis adecuada en el área de tratamiento (13, 15).
Como el fármaco se introduce en la célula por un fenómeno físico, la penetración no depende del tipo celular. Los tumores de cualquier histología se pueden tratar con muy buenos resultados, con una tasa de respuesta objetiva de alrededor del 70-100%. Esta alta tasa de respuesta se puede observar en perros, gatos, caballos y, por supuesto, también en pacientes humanos (11, 16, 17). En particular, en el melanoma maligno, la tasa de respuesta objetiva en las primeras etapas es de alrededor del 90 % (9), en los carcinomas de células escamosas es de alrededor del 80 % (18), en los sóridos es de alrededor del 97 % (11) y en los tumores de mastocitos de menos de 2 cm3 es de alrededor del 100 % (19).
La aplicación de los pulsos de electroporación también induce un fenómeno de bloqueo vascular que produce la interrupción instantánea del flujo sanguíneo en el área tratada. Esto proporciona beneficios adicionales al tratamiento, es decir, atrapamiento del medicamento dentro del tumor, inanición tumoral y hemostasia inmediata en el área tratada (20, 21).
La respuesta inmunitaria juega un papel crucial en la eficacia del tratamiento, ya que se demostró en ratones inmunodeprimidos que mostraron una respuesta notablemente menor al tratamiento (13, 22,23). Además, en medicina veterinaria, el papel del sistema inmunitario es muy importante, ya que aumenta la eficacia del tratamiento, e incluso puede dar lugar a efectos abdominales en algunos casos particulares (24).
En general, se puede obtener una muy buena respuesta en una o dos sesiones para la mayoría de los casos, dependiendo del tamaño y la ubicación del tumor. También es importante recordar que la terapia se puede combinar con otras modalidades de tratamiento que aumentan su eficacia, por ejemplo, en combinación con cirugía de desenfre, quimioterapia o radioterapia (25). Finalmente, la TEC se puede aplicar cuando no hay otras opciones de tratamiento disponibles, aún con buenos resultados, lo que hace que la TEC sea una herramienta muy atractiva para el oncólogo veterinario (26).
En medicina de precisión, los tratamientos se seleccionan y personalizan con respecto a las características, la genética y los factores ambientales de los pacientes, para aumentar su eficacia y reducir los efectos secundarios (27). La medicina de precisión se basa en las particularidades biológicas y químicas del paciente y su enfermedad, por un lado, y en los efectos biológicos y químicos del tratamiento, por otro. La ECT es una contribución original a la medicina de precisión, ya que es un enfoque físico. Es importante tener en cuenta que todos los enfoques físicos clásicos hasta ahora (incluyendo radioterapia, braquiterapia, crioterapia, hipertermia, ultrasonido enfocado de alta frecuencia e incluso cirugía como enfoque ≪ mecánico ≫) son métodos ablativos, lo que significa que no discriminan selectivamente entre células cancerosas y normales. Por el contrario, el TCE no es un enfoque ablativo. Como se discutirá en las siguientes secciones, la exquisita combinación de electropermeabilización y un fármaco citotóxico no permeable como la bleomicina da como resultado una destrucción muy precisa y selectiva de las células tumorales. Por lo tanto, en la preservación de las células normales y las estructuras de los tejidos, reduciendo drásticamente los efectos secundarios de la quimioterapia clásica y de los procedimientos ablativos. Como tal, ECT es un nuevo método eficiente, fácil de aplicar y seguro para la medicina de precisión. En particular, la precisión de la ECT permite tratar de manera eficiente y segura los márgenes y el entorno de la masa tumoral porque las pocas células tumorales presentes en este volumen se eliminarán mientras que las células normales en el mismo volumen seguirán siendo viables. Esta precisión en la muerte de las células replicantes, es decir, las células tumorales, explica por qué la TEC ahorra tejidos sanos y preserva la función orgánica, que en ciertos pacientes es el aspecto más importante para elegir un tratamiento, particularmente para preservar la calidad de vida. Esta selectividad confiere al tratamiento efectos secundarios reducidos, que son leves y autolimitados, e incluso proporciona muy buenos resultados cosméticos en el tratamiento de tumores cutáneos y subcutáneos (28). También cabe destacar que, incluso en el caso de los tumores que tienen características genéticas que confieren resistencia a múltiples medicamentos, e incluso a la radioterapia, la ECT todavía juega un papel importante debido a su capacidad para superar estas barreras. La ECT obliga al medicamento a las células, logrando excelentes resultados donde otros tratamientos habían fallado. Finalmente, no solo los pulsos eléctricos per se son un adyuvante inmunológico como se demostró en (23), sino que, además, la ECT causa la muerte celular inmunogénica (29), un aspecto importante del éxito en la medicina de precisión del cáncer.
Muchas veces en el entorno veterinario, la TEC se realiza siguiendo procedimientos estándar hechos para pacientes humanos, y eso reduce su eficacia. La TEC en medicina veterinaria debe realizarse teniendo en cuenta las características únicas de los pacientes y teniendo en cuenta las diferencias entre las especies que se tratan. Para lograr su máximo potencial, es crucial planificar un tratamiento adecuado. La selección adecuada del electrodo dependerá de la anatomía del paciente, la ubicación del tumor, la profundidad de invasión y su tamaño. Además, es muy importante elegir el medicamento adecuado y la forma adecuada de administración.
En este trabajo, informamos de las Directrices veterinarias para la electroquimioterapia de tumores superficiales. Basado en datos publicados en revistas revisadas por pares y enriquecido con una cuidadosa recopilación de las preguntas de los usuarios y las dificultades comunes. Informamos de una lista de posibles desviaciones que pueden reducir la eficacia del tratamiento, y proporcionamos formas de atenuar sus consecuencias. La prevención de estas desviaciones en la práctica de la TEC es tan importante como la aplicación precisa de estas directrices.
Materiales, equipos y pacientes
Pacientes
El objetivo principal es proporcionar a los pacientes con cáncer el mejor tratamiento disponible y maximizar sus posibilidades de éxito.
En pacientes seleccionados, la TEC por sí sola puede ser una muy buena opción de tratamiento que puede proporcionar excelentes resultados. Sin embargo, en medicina veterinaria, es común recibir pacientes en etapas muy avanzadas de la enfermedad, con tumores grandes donde la ECT por sí sola puede no ser efectiva o requerirá demasiadas sesiones. En estos casos, la combinación de TEC con otras modalidades de tratamiento es muy eficaz, como se describirá más adelante. Por lo tanto, la TEC se puede usar sola o como tratamiento neoadyuvante, adyuvante o concomitante con cirugía, quimioterapia o radioterapia (25, 30). La selección adecuada del tratamiento, basada en la situación oncológica del paciente, es crucial para obtener los mejores resultados.
El propietario debe entender las expectativas del tratamiento seleccionado y las alternativas, y después de eso, firmar un consentimiento informado.
Indicaciones de ECT
1. Tumores cutáneos o subcutáneos (primarios o metastásicos) de cualquier histología, que no se pueden tratar satisfactoriamente con sus respectivos tratamientos de primera línea (26, 31).
2. Tumores primarios o metastásicos que afectan a la calidad de vida debido a sangrado, ulceración o dolor (26).
3. Tumores orales o nasales, como un solo tratamiento, o en combinación con cirugía (8, 9, 32).
4. Tumores resecados por completo (incluidas cicatrices quirúrgicas, colgajos de la piel y otras reparaciones quirúrgicas), o para extender los márgenes de seguridad durante la cirugía (33).
5. Tratamiento ECT optativo cuando otras terapias de primera línea son posibles. Se tuvo que hacer una explicación exhaustiva de otras opciones de tratamiento, y tuvieron que ser rechazadas por el propietario (31, 34).
6. Reducción de la carga de cáncer en tumores primarios o metastásicos a los que se puede acceder a los electrodos (superficial o por enfoque quirúrgico) (26, 35).
a. En pacientes bajo terapia sistémica, para el tratamiento de las lesiones que no muestran una buena respuesta.
b. En tumores grandes antes de la cirugía, para mejorar la supervivencia sin recaídas.
c. En pacientes sin opciones de tratamiento, para mejorar la calidad de vida con una intención paliativa.
Pruebas y consideraciones previas al tratamiento
Las pruebas previas al tratamiento obligatorias se enumeran a continuación.
1. Animales embarazadas o lactantes; se debe tener especial cuidado con las hembras no pagadas, ya que la bleomicina y el cisplatino pueden dañar al feto en desarrollo.
2. Los análisis de sangre para determinar la función renal y hepática deben estar dentro de los parámetros normales. Los parámetros hematológicos y de coagulación deben ser normales y comparables a los necesarios para un procedimiento quirúrgico simple.
3. Se debe evaluar el riesgo anestésico, incluido el examen cardiológico.
4. Diagnóstico histopatológico del tumor.
5. Estadificación oncológica completa que incluye radiografías de tórax de tres vistas, ecografía abdominal, tomografía computarizada o resonancia magnética si es necesario, para evaluar la presencia de metástasis u otras comorbilidades.
6. De acuerdo con cada caso específico, el manejo del dolor puede ser necesario antes de la TEC y puede ajustarse a partir de entonces.
7. Evaluar el riesgo en pacientes que recibieron previamente bleomicina; la dosis acumulada máxima para perros es de 200.000 UI/m2, mientras que para gatos aún no está establecida (36). Los pacientes que alcanzaron esta dosis deben ser tratados con cisplatino (excepto gatos) o calcio administrado intratumoralmente. Si esto no es posible, considere otra opción de tratamiento.
8. Antecedentes de alergia o hipersensibilidad a la bleomicina o al cisplatino.
En perros y gatos, se debe prestar especial atención a los siguientes casos, ya que el tratamiento puede ser difícil de realizar y se reducen las posibilidades de éxito.
1. Tumores en o cerca de la laringe. Antes de iniciar el procedimiento anestésico, asegúrese de que la lesión no impida la intubación. Considere que después del tratamiento, la lesión se hinchará y puede obstruir las vías respiratorias. Si la lesión es grande y bloquea una parte considerable de las vías respiratorias, desenreda y trate el lecho tumoral. La traqueotomía temporal o permanente puede ser una opción para reducir el riesgo de obstrucción de las vías respiratorias después del tratamiento y durante la recuperación.
2. Tumores en la lengua. La lengua tiene riego terminal, y una aplicación muy amplia de los pulsos eléctricos podría inducir necrosis de su parte rostral, debido al fenómeno del bloqueo vascular. Si el tumor se encuentra caudalmente, puede obstruir las vías respiratorias después del tratamiento. En ambos casos, considere la eliminación quirúrgica seguida de ECT en el lecho tumoral. Es posible que se necesite una sonda de alimentación en los primeros días de recuperación.
3. Tumores que comprometen la placa cribiforme, la región retroorbital, los senos paranasales u otras estructuras inalcanzables. Los tumores ubicados en la región caudal del conducto nasal pueden invadir las células etmoidales, que no se pueden tratar con éxito con electrodos estándar, ya que son muy difíciles de alcanzar. En última instancia, esto conducirá al fracaso del tratamiento. Considere otras modalidades de tratamiento como la cirugía y la radioterapia.
Consideraciones especiales para el tratamiento de caballos.
1. Deben ser tratados bajo anestesia general y deben someterse a los exámenes prequirúrgicos adecuados para el procedimiento. La vacuna contra el tétanos o el suero hiperinmune se pueden administrar a discreción del veterinario.
2. El uso de la vía IV es costoso teniendo en cuenta los altos volúmenes de drogas necesarios, y no hay suficientes estudios de seguridad en esta especie. Además, se debe evitar el uso de citostáticos intravenosos en animales que puedan estar destinados al consumo humano.
3. Las neoplasias tratadas con más frecuencia son los sarcoides, el melanoma maligno cutáneo y el carcinoma de células escamosas, todos ellos con buenos resultados (19, 37). Otras histologías se pueden tratar siempre que su enfoque sea posible utilizando los electrodos disponibles.
4. El tratamiento de las lesiones ulceradas debe adaptarse a las condiciones de vida del animal y puede requerir la administración de antibióticos y/o repelentes.
Evaluación del tamaño y el número de tumores
Para determinar la mejor estrategia de tratamiento, cuente y mida todas las lesiones. Se recomienda tomar fotos, incluida una regla, para documentar la respuesta al tratamiento. Deben tomarse con el mismo ángulo y perspectiva cada vez. Además, se pueden utilizar otros procedimientos de imagen para documentar el efecto del tratamiento.
Para calcular el volumen tumoral, utilice la siguiente fórmula, toneladaumorAl volume [cmetro3]=a ·b·c·π6
Donde a, b y c son la longitud, el ancho y el grosor del tumor, respectivamente. Para tumores delgados (o cuando no se puede medir el grosor de la lesión), reemplace la c por la b, como se puede ver en la siguiente fórmula, toneladaumorAl volume [cmetro3]=a ·barn2·π6
La carga tumoral debe ponerse en contexto al tamaño del animal tratado, sin embargo, el tamaño del tumor por sí solo tiene un impacto en el resultado del tratamiento.
En este punto, hay que determinar si el ECT se realizará como una intención paliativa o curativa, y el número de sesiones necesarias para ese fin.
ECT como intención curativa
Los tumores de hasta 3 cm3 se pueden tratar fácilmente con buenos resultados, sea cual sea su forma. Se puede utilizar como alternativa a la cirugía cuando es difícil, para evitar complicaciones postoperatorias o cuando el tumor está cerca de estructuras importantes (38-40).
En el caso de tumores superficiales extensos, de <1 cm de grosor, incluso si son mayores de 3 cm3, la TEC es una buena opción cuando las modalidades de tratamiento de primera línea han fallado o si no son factibles (38,41-43).
Se debe tener especial cuidado con el grosor del tumor, ya que la longitud de la aguja del electrodo podría limitar la posibilidad de tratar el lecho tumoral. Tenga en cuenta que solo se debe considerar la parte conductora de las agujas (algunos dispositivos usan electrodos que, a pesar de que la aguja es larga, parte de ella está aislada). El grosor del tumor debe ser menor que la longitud de la parte conductora de la aguja, que generalmente varía de 1 a 4 cm, dependiendo del fabricante. Si el tumor es más grueso que la longitud de la aguja conductora, se recomienda el desenreo seguido de la TEC del lecho tumoral y los márgenes. Si no se realiza el desenreo, se debe programar una segunda sesión de TEC para completar el tratamiento, y se debe realizar después de que se logre la respuesta a la sesión inicial. Estas rondas adicionales de ECT son parte de la planificación del tratamiento y deben establecerse durante la evaluación inicial del paciente (44). Ver Figura 1.
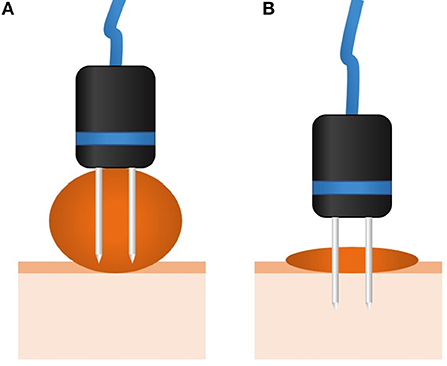 FIGURA 1. Esquema que muestra el tratamiento de un tumor más grueso que la longitud de la aguja. En (A), como se puede ver, en un tumor grueso el lecho tumoral no se trata, lo que provoca una recaída. En estos casos, se recomienda el desenreo quirúrgico para lograr la situación en (B). De lo contrario, la misma situación en (B) se puede lograr mediante múltiples sesiones de TEC, que ya deben planificarse cuando se evalúe al paciente para el tratamiento.
FIGURA 1. Esquema que muestra el tratamiento de un tumor más grueso que la longitud de la aguja. En (A), como se puede ver, en un tumor grueso el lecho tumoral no se trata, lo que provoca una recaída. En estos casos, se recomienda el desenreo quirúrgico para lograr la situación en (B). De lo contrario, la misma situación en (B) se puede lograr mediante múltiples sesiones de TEC, que ya deben planificarse cuando se evalúe al paciente para el tratamiento.
ECT como intención paliativa
La TEC es una estrategia de tratamiento muy útil, y en este contexto, se pueden tratar tumores superficialmente extensos o grandes para mejorar la calidad de vida, siempre que no haya alternativas curativas (45).
Información del propietario y consentimiento informado
Los propietarios deben ser informados sobre todas las opciones de tratamiento, los beneficios e inconvenientes de la TEC y sus posibles efectos secundarios. Los propietarios también deben ser informados sobre el resultado esperado del tratamiento. Una vez que se entiendan estos problemas, el propietario debe firmar un consentimiento informado adecuado, que debe incluir: (i) los riesgos asociados con el medicamento utilizado para el procedimiento, es decir, la fibrosis pulmonar cuando se usa bleomicina en un paciente con una dosis acumulada alta, y el riesgo de alopecia y/o cambios en la pigmentación de la piel tratada (ver Figura el tejido, que puede requerir cirugía reconstructiva, así como (iv) la posibilidad de necesitar más sesiones de tratamiento en ciertos casos.
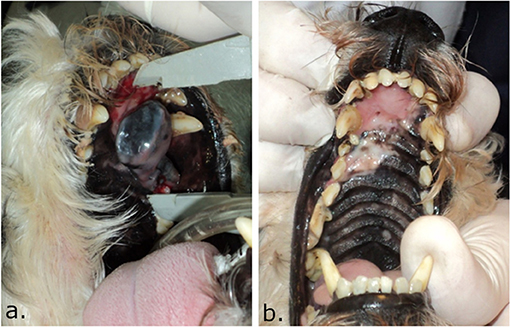 FIGURA 2. Imagen del paladar de un perro tratado con TEC con bleomicina intravenosa, donde se puede ver hipopigmentación inducida. En (A), el perro con un melanoma en el paladar antes del tratamiento. En (B), 4 meses después de la TEC, se obtuvo una respuesta completa y se ve un área hipopigmentada donde se encontraba el tumor. Tenga en cuenta que, como el hueso no se vio comprometido, se preservó la integridad del paladar. En algunos casos, la hipopigmentación puede revertir parcialmente con el tiempo.
FIGURA 2. Imagen del paladar de un perro tratado con TEC con bleomicina intravenosa, donde se puede ver hipopigmentación inducida. En (A), el perro con un melanoma en el paladar antes del tratamiento. En (B), 4 meses después de la TEC, se obtuvo una respuesta completa y se ve un área hipopigmentada donde se encontraba el tumor. Tenga en cuenta que, como el hueso no se vio comprometido, se preservó la integridad del paladar. En algunos casos, la hipopigmentación puede revertir parcialmente con el tiempo.
Electroporadores y parámetros de pulso
Los parámetros de pulso estándar aceptados para ECT son 8 pulsos monopolares de onda cuadrada de 100 μs, entregados a una frecuencia de repetición de 1 a 5.000 Hz, con una relación voltaje-distancia de 1.000 a 1300 V/cm, dependiendo de los electrodos utilizados. La frecuencia de repetición no afecta a la respuesta. Cuando se utilizan frecuencias superiores a 100 Hz, solo se ve una contracción muscular que mejora la tolerancia y la comodidad para el paciente (46, 47).
Los pulsos de onda cuadrada monopolar son el tipo de pulso preferido para ECT. Sin embargo, muchas configuraciones de pulsos bipolares también han mostrado buenos resultados (34, 48). Se necesita más investigación para determinar si hay beneficios de usar pulsos bipolares en la electrotransferencia de genes o la TEC (24,49).
Hay muchos electroporadores disponibles para realizar la TEC en medicina veterinaria. Algunos de ellos son para uso en laboratorio, y otros están diseñados específicamente para su uso en clínicas veterinarias.
Se prefieren los dispositivos automáticos, ya que se evitan errores de configuración. El electroporador debe ser capaz de mantener el voltaje (sin caídas) en cada uno de los 8 pulsos del tren. Eso es posible si el generador puede suministrar una corriente de salida máxima adecuada. Según nuestra experiencia, las salidas actuales de 35 A (durante los 100 μs de duración del pulso) son suficientes para tratar todo tipo de tumores.
Es muy importante utilizar siempre los electrodos proporcionados por el fabricante del dispositivo. La base para elegir el mejor electrodo para un paciente se analiza en la siguiente sección.
Si se utiliza un electroporador configurable, debe configurarse correctamente. Con este fin, verifique la distancia entre las agujas del electrodo que se utilizará y multiplique esta distancia en cm por 1.000 para obtener el voltaje que se utilizará. Por ejemplo, si está utilizando electrodos de aguja separados 0,4 cm entre sí, debe ajustar el voltaje de salida del dispositivo en 400 V (1.000 * 0,4 = 400). En el caso de las placas aplicadas a la piel, debe multiplicar la distancia por 1.300. Por lo tanto, en el mismo ejemplo, tienes que ajustar el voltaje de salida del dispositivo a 520 V (1,300*0.4 = 520). En el caso de las placas aplicadas directamente sobre el tumor, use 1000 V/cm, como para las agujas. A continuación, establezca la longitud del pulso en 100 μs y el intervalo de pulso entre 100 μs y 1 s (para una frecuencia de repetición entre 5.000 y 1 Hz). Configura el dispositivo para que entregue 8 pulsos (50).
Drogas utilizadas
Para realizar la ECT solo se han validado 3 medicamentos; la bleomicina administrada por vía intravenosa o intratumoral, cisplatino intratumoral o calcio intratumoral. La base de decisión para el uso de cada uno de ellos se presenta en la siguiente sección.
Métodos: Tratamiento
Anestesia
El tratamiento debe realizarse bajo anestesia general, incluso cuando se utilizan electrodos de placa. Las sensaciones y contracciones musculares inducidas por el pulso pueden ser dolorosas y estresar al paciente, provocando una agresión inducida por el dolor (51).
El procedimiento anestésico requerido para la TEC es similar al requerido por la cirugía en la misma región. Debe elegirse de acuerdo con la experiencia y la familiaridad del profesional que lo va a realizar.
Por ejemplo, para perros y gatos, un régimen típico sería el siguiente: (i) premedicación con administración intramuscular de xilazina 0,5 mg/kg y tramadol 2 mg/kg; (ii) inducción realizada con administración intravenosa de propofol 3 mg/kg; (iii) mantenimiento realizado con isoflurano inhalado 2-3 % y fentanilo intravenoso 2 Se puede añadir anestesia regional, de acuerdo con el criterio del anestesiólogo, para mejorar la comodidad de los pacientes y reducir la dosis de los anestésicos. Por ejemplo, el bloqueo del nervio infraorbitario se puede realizar al tratar la nariz. Los medicamentos antiinflamatorios se pueden usar durante o después del procedimiento y mantenerse los días siguientes, ya que se verán más tarde.
En los caballos, siempre se recomienda la anestesia general. Un régimen típico sería la anestesia regional-general combinada, para reducir la profundidad del plano anestésico requerido (52). La inducción debe llevarse a cabo en un entorno seguro y cuidadosamente elegido. El paciente debe estar bajo el plan analgésico adecuado durante todo el procedimiento.
En animales pequeños, la observación post-anestésica hasta que el paciente esté completamente despierto es muy importante, especialmente cuando se trata la nariz o la boca.
Administración de Medicamentos
Empieza pesando al paciente. Luego, mide las lesiones para calcular los volúmenes tumorales. Después de las mediciones, proceda a recortar el pelaje del área a tratar para tener una buena visualización del tumor y sus márgenes. Utilice una solución de yodo para limpiar y desinfectar toda el área a tratar (tumor y márgenes). Se recomienda encarecidamente utilizar electrodos estériles o esterilizarlos siguiendo las recomendaciones del fabricante, a pesar de que el riesgo de infección después de la TEC es muy bajo (53).
Para la dilución y administración de los medicamentos antineoplásicos, es obligatorio usar guantes y un abrigo de laboratorio, para usar protección facial y respiratoria. Si es posible, se recomienda trabajar en un gabinete de flujo de aire laminar de clase II (54).
Ruta intravenosa
Recomendamos el uso de bleomicina intravenosa para todos los casos, independientemente del tamaño de la lesión (solo se puede usar bleomicina por vía intravenosa, como se explica más adelante). Esta recomendación se basa en varias razones: (i) casi siempre se logra una adecuada distribución y concentración del fármaco en el tumor y sus márgenes cuando se respeta el momento de administración, (ii) evita dejar áreas del tumor con concentración insuficiente del fármaco debido a errores en la técnica de administración intratumoral, (iii) la administración del fármaco es más segura, ya que se evitan los derrames y fugas que se pueden producir durante la administración intratumoral, y (iv) por sí mismo es un activador del sistema inmunitario, contribuyendo a la respuesta inmunitaria local inducida por el tratamiento (23).
Tenga en cuenta que no se recomienda la administración intravenosa de bleomicina para caballos debido al enorme volumen de medicamento necesario.
La potencia de la bleomicina se mide en unidades de actividad antimicrobiana. En muchos países, la bleomicina se administra en mg o en unidades internacionales (UI), mientras que las unidades (USP) es el término utilizado en los EE. UU. La equivalencia sería 1 unidad USP = 1 mg (por potencia) = 1.000 unidades internacionales (UI) (55).
Utilice el peso del paciente para estimar el área de superficie corporal (BSA) con la siguiente fórmula.
Donde k es 0,101 para los perros y 0,1 para los gatos (56).
La técnica de administración para la vía intravenosa
El medicamento se administra a una dosis de 15.000 UI/m2 de BSA en bolo (en 30-45 s), y la dosis máxima se limita a 30.000 UI (correspondiente a 2 m2 de BSA) (50). La aplicación de los pulsos eléctricos puede comenzar de 5 a 8 minutos más tarde, después de que el medicamento se haya difundido en el tejido tumoral.
Después de la administración, aproximadamente la mitad de la dosis de Bleomicina administrada se elimina por excreción renal, por lo que se puede utilizar una dosis reducida en pacientes con disminución de la función renal (57, 58). Recuerde que la dosis acumulada máxima para los perros es de 200.000 UI/m2, mientras que para los gatos aún no está establecida (36), para evitar la fibrosis pulmonar inducida por la bleomicina, su principal efecto secundario. El fármaco se metaboliza en los tejidos por la enzima bleomicina hidrolasa, que está en muy baja concentración en la piel y los pulmones, lo que explica la sensibilidad de estos tejidos a la toxicidad de la bleomicina (58).
La gran diferencia en el tamaño y el peso corporal entre los pacientes veterinarios debe tenerse en cuenta al estimar la ventana de tratamiento. Esta vez puede verse afectada por muchos factores, entre ellos se encuentran las tasas de flujo sanguíneo tisular (59) que están influenciadas por la frecuencia cardíaca. Como se sabe, la frecuencia cardíaca está relacionada con el peso corporal (60), por lo que podemos considerar arbitrariamente una ventana de tratamiento más cercana a 5 a 25 minutos para gatos y perros pequeños, y de 8 a 40 minutos para el resto. Del mismo modo, en medicina humana, los pacientes menores de 65 años tienen una ventana de tratamiento de 5 a 15 minutos, frente a una ventana de tratamiento de 8 a 40 minutos para los pacientes mayores, esta diferencia está relacionada con la función renal (61). Se necesita un estudio adicional de la farmacocinética de la bleomicina para definir adecuadamente la ventana de tratamiento en pacientes de diferentes especies y pesos corporales.
La eficacia óptima para aplicar los pulsos se obtiene hasta 40 minutos después de la administración del medicamento. Sin embargo, este tiempo puede extenderse en pacientes mayores, así como en pacientes con insuficiencia renal. En cualquier caso, se recomienda continuar con la aplicación de pulsos eléctricos a las lesiones restantes incluso después de ese tiempo, ya que todavía hay un efecto en las lesiones. Es recomendable marcar estas lesiones, para reconocerlas durante el seguimiento (57, 62).
Ruta intratumoral
La administración intratumoral es aceptable para tumores pequeños de hasta 2 cm3 (63). En los tumores grandes, esta ruta puede ser un desafío, en particular en caballos y gatos. Por el contrario, la vía intravenosa proporcionará una distribución adecuada del medicamento en todos los casos, y por esa razón debe preferirse siempre que sea posible.
La bleomicina, el cisplatino y el calcio se pueden administrar por vía intratumoral. La entrega de los pulsos eléctricos debe comenzar inmediatamente después de su administración.
Bleomicina
La concentración recomendada de bleomicina para la administración intratumoral es de 1.000 UI/ml, y la dosis es de 250 UI/cm3 de tumor (50).
El tumor debe estar completamente infiltrado con una dosis total inferior a la que se usaría por vía intravenosa. Si esto no es posible, utilice la vía intravenosa de administración en las condiciones descritas en la sección anterior.
En especies inusuales, como tortugas, serpientes o aves, entre otras, se prefiere la ruta intratumoral debido a la falta de información sobre la dosis y los efectos de la bleomicina sistémica en estos animales.
Cisplatino
Cuando se usa cisplatino, la concentración recomendada es de 1 mg/ml, y la dosis recomendada para la inyección es llenar el volumen del tumor con el medicamento (50). En caso de que el cisplatino no esté disponible a la concentración recomendada o superior, sugerimos el uso de bleomicina. El uso de una concentración más baja es posible, pero requiere un seguimiento cercano, ya que el paciente puede necesitar un nuevo tratamiento (64).
El cisplatino es una buena opción para tratar a los caballos (11, 19). Por el contrario, este medicamento no se recomienda en gatos (65).
El carboplatino se puede usar si el cisplatino no está disponible, sin embargo, su eficacia solo se ha demostrado in vitro (66).
Calcio
Cuando se utiliza cloruro de calcio, la concentración recomendada es de 9 mg/ml. Inyecte un volumen de solución de cloruro de calcio igual a la mitad del volumen del tumor (67, 68). La electroporación con calcio puede proporcionar buenos resultados y se puede utilizar cuando no hay bleomicina o cisplatino, como tercera opción. También debe restringirse a tumores pequeños (67).
La técnica de administración para la vía intratumoral
Inserte la aguja en un solo punto en el centro del tumor y administre el medicamento de forma radial para evitar derrames. Al inyectar el medicamento, tenga cuidado de no retirar la aguja demasiado rápido para evitar derramar o filtrar el medicamento. Como solo los tumores pequeños deben tratarse con esta técnica, los márgenes de seguridad están cubiertos por la difusión del medicamento de la lesión, lo que proporciona una concentración adecuada para un tratamiento exitoso de los márgenes. El tejido sano, si se infiltra por cualquiera de los medicamentos anteriores, puede necrotizarse y, por lo tanto, se debe evitar la inyección directa del tejido sano circundante (69).
Los pulsos eléctricos deben aplicarse inmediatamente después de la administración del medicamento, ya que se lava rápidamente (50). Si hay más de una lesión que tratar, se recomienda administrar el medicamento y administrarles los pulsos, uno por uno. Es importante señalar que si el medicamento se administra a todos los tumores en primer lugar, y el pulso se realiza después de eso, los últimos que se pulsan pueden no tener una concentración adecuada del medicamento.
En caballos, donde no es posible la bleomicina intravenosa, los tumores grandes se pueden tratar de esta manera; inyectar la mitad de la lesión y pulse inmediatamente después. Luego, inyecte la otra mitad y pulse. Al hacer esto, una lesión grande puede tratarse con éxito.
Selección de electrodos
Tipos de electrodos y sus ventajas
En general, la mayoría de los dispositivos vienen con dos tipos de electrodos: el electrodo de agujas y los electrodos de placa (ver Figura 3).
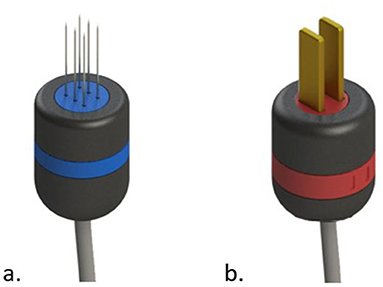 FIGURA 3. Tipos comunes de electrodos para electroporación. En (A) agujas electrodo. En (B) electrodos de placa.
FIGURA 3. Tipos comunes de electrodos para electroporación. En (A) agujas electrodo. En (B) electrodos de placa.
Utilice siempre los electrodos proporcionados por el fabricante del dispositivo y observe el número máximo de usos destinados a ellos. Exceder el número máximo de usos previstos puede reducir significativamente la eficacia del tratamiento. Si están disponibles, se recomiendan electrodos desechables.
Electrodos de agujas
Este tipo de electrodo se recomienda para el tratamiento de la gran mayoría de los tumores.
En pacientes veterinarios, la piel es más gruesa que en humanos (70), siendo una capa muy resistiva que puede interferir con la homogeneidad y la intensidad del campo eléctrico a nivel tumoral. Además, el grosor de la piel y, por lo tanto, la impedancia eléctrica de la piel son muy variables, dependiendo de muchos factores, es decir, la especie, la raza, la edad y la parte del cuerpo, entre otros. Mediante el uso de agujas, esta capa gruesa se supera y el campo eléctrico se puede aplicar con una distribución adecuada. Por lo tanto, siempre se prefieren los electrodos de aguja.
Las agujas generalmente se distribuyen en dos filas de tres o cuatro, separadas entre 0,4 y 0,5 cm entre sí. Hay otros patrones, como el hexagonal, que se comportan de la misma manera.
Toda la superficie del tumor debe estar cubierta para tratar adecuadamente el tumor. En particular, los tumores de mastocitos deben tratarse en espiral desde la periferia hasta el centro (ver Figura 4). Como el campo eléctrico cae muy rápidamente fuera de los electrodos, se necesita una superposición mínima en la aplicación para evitar dejar áreas no tratadas. Si el tumor es más grueso que la longitud de las agujas, puede ser necesario un desenreo quirúrgico. Además, se puede tratar en varias sesiones, que deben estar al menos 4 semanas de diferencia, para evitar el sobretratamiento del área, siempre que no haya crecimiento del tumor. Si se observa el crecimiento de los tejidos tumorales, se debe realizar la siguiente sesión de tratamiento lo antes posible. Un caso particular es cuando el tumor solo se trata parcialmente en la primera sesión. En este caso, los tejidos restantes no tratados se pueden tratar al día siguiente sin preocupaciones.
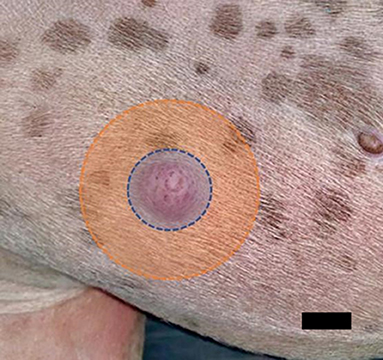 FIGURA 4. Principio de tratamiento de los tumores de mastocitos. Primero, se debe tratar la periferia (área naranja) y luego el tumor (área azul). Barra de escala de 1 cm.
FIGURA 4. Principio de tratamiento de los tumores de mastocitos. Primero, se debe tratar la periferia (área naranja) y luego el tumor (área azul). Barra de escala de 1 cm.
Para la base de decisión sobre cuándo retirar un tumor previamente tratado, consulte la sección Seguimiento y retratamiento.
Electrodos de placas paralelas
Los electrodos de placas paralelas son muy útiles para tratar lesiones superficiales con una invasión de unos pocos milímetros. La profundidad de tratamiento de este tipo de electrodos varía según la distancia entre las placas (71). Según las simulaciones presentadas en la Figura 5, en electrodos con placas separadas 4 mm entre sí, la profundidad máxima de tratamiento es de <3 milímetros. Las lesiones que invaden más profundamente que esto deben tratarse con electrodos de aguja. Es importante recordar que para el tratamiento de lesiones superficiales a través de la piel, la relación voltaje-distancia debe ser de 1.300 V/cm (72). Pero, para el tratamiento del lecho tumoral después de la cirugía de desenreda, 1000 V/cm son suficientes. A medida que se elimina la piel, el campo eléctrico puede llegar a partes más profundas de los tejidos (71).
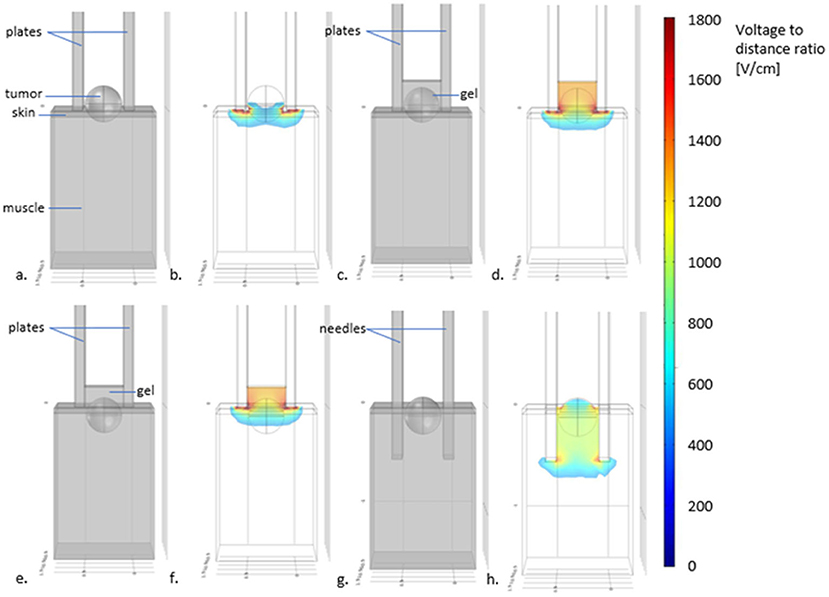 FIGURA 5. Esquema que muestra la profundidad del tratamiento con diferentes electrodos y recomendaciones visuales para el uso de electrodos de placas o agujas. En (A) placas, los electrodos se utilizan para tratar un tumor superficial, sin usar gel conductor. En (B) la simulación de la distribución del campo eléctrico (usando COMSOL Multiphysics 4.3, en color las intensidades del campo eléctrico por encima del umbral para la electroporación reversible del tejido) revela que las partes superficiales del tumor pueden no ser tratadas adecuadamente. En (C) el esquema muestra la adición de gel entre las placas. En (D), la simulación muestra que ahora, la distribución del campo eléctrico permite tratar el tumor por completo. En (E), el caso de un tumor con una profundidad de invasión >3 mm tratado con electrodos de placa no penetrantes. Como se puede ver en (F), incluso con el uso de gel, es posible que las partes más profundas del tumor no se traten adecuadamente. De hecho, la intensidad del campo cae por debajo del umbral de electroporación a una distancia menor que la separación de las placas. Para estos casos, se deben usar electrodos de aguja, como se muestra en (G) donde el mismo tumor (con una profundidad de invasión >3 mm) se trata con electrodos de aguja sin gel conductor. La simulación de campo eléctrico en (H) muestra que todo el tumor ahora está completamente tratado.
FIGURA 5. Esquema que muestra la profundidad del tratamiento con diferentes electrodos y recomendaciones visuales para el uso de electrodos de placas o agujas. En (A) placas, los electrodos se utilizan para tratar un tumor superficial, sin usar gel conductor. En (B) la simulación de la distribución del campo eléctrico (usando COMSOL Multiphysics 4.3, en color las intensidades del campo eléctrico por encima del umbral para la electroporación reversible del tejido) revela que las partes superficiales del tumor pueden no ser tratadas adecuadamente. En (C) el esquema muestra la adición de gel entre las placas. En (D), la simulación muestra que ahora, la distribución del campo eléctrico permite tratar el tumor por completo. En (E), el caso de un tumor con una profundidad de invasión >3 mm tratado con electrodos de placa no penetrantes. Como se puede ver en (F), incluso con el uso de gel, es posible que las partes más profundas del tumor no se traten adecuadamente. De hecho, la intensidad del campo cae por debajo del umbral de electroporación a una distancia menor que la separación de las placas. Para estos casos, se deben usar electrodos de aguja, como se muestra en (G) donde el mismo tumor (con una profundidad de invasión >3 mm) se trata con electrodos de aguja sin gel conductor. La simulación de campo eléctrico en (H) muestra que todo el tumor ahora está completamente tratado.
Los electrodos de placa son muy útiles para tratar los párpados y las orejas colocándolos entre las placas.
Otros diseños funcionan de manera similar a los electrodos de placa, como los electrodos de contacto y los electrodos en forma de L. Este tipo de electrodos se utilizan solo para el tratamiento de tumores superficiales, y los tejidos no se pueden tratar colocándolos entre las partes conductoras, como es posible con los electrodos de placa. Particularmente en algunos dispositivos, un electrodo en forma de L está configurado para entregar 4 pulsos, y por esa razón, se requiere una rotación ortogonal entre dos trenes de pulsos.
Controla siempre el contacto entre el tejido y los electrodos (73). Si no es adecuado, se debe utilizar gel conductor para mejorar la distribución del campo eléctrico y, por lo tanto, el resultado del tratamiento. El gel debe tener una conductividad similar a la del tejido tratado. Para fines generales, el gel de ecografía es adecuado. Recuerde que una cantidad excesiva de gel es mejor que una insuficiente para mejorar el contacto entre el tumor y el electrodo (74). Evite el uso de vaselina, ya que puede impedir el flujo de la corriente eléctrica, reduciendo la eficacia del tratamiento. Además, evite la superposición excesiva de dos aplicaciones adyacentes, particularmente en tejido sano, ya que puede provocar daño tisular no deseado o necrosis excesiva (ver también la sección Recomendaciones accionables).
Recomendaciones de seguridad
El electroporador utilizado debe cumplir con las normas básicas de seguridad, incluida la detección de arco, la detección de cortocircuitos y la alarma de caída de voltaje para garantizar una entrega de pulso adecuada.
Los artefactos en los monitores ECG se pueden ver durante el pulso, debido a la interferencia eléctrica entre los dispositivos, y no deben confundirse con arritmias o cualquier otra alteración cardíaca (ver Figura 6).
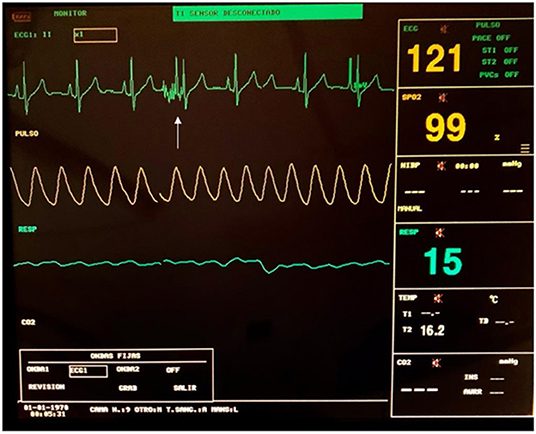 FIGURA 6. Monitorización del ECG durante un procedimiento de TEC. Se puede ver un artefacto durante la entrega de los pulsos (flecha blanca).
FIGURA 6. Monitorización del ECG durante un procedimiento de TEC. Se puede ver un artefacto durante la entrega de los pulsos (flecha blanca).
Los instrumentos quirúrgicos metálicos deben mantenerse alejados de los electrodos y del área de tratamiento, evitando su contacto durante la administración del pulso. Este punto se abordará en la sección Recomendaciones accionables.
Antibióticos y analgesia después del tratamiento
Los antibióticos profilácticos se pueden administrar por vía oral o intramuscular, antes o después del procedimiento.
El uso de medicamentos antiinflamatorios no esteroideos (AINE) es la opción recomendada para el control del dolor, porque, después del tratamiento, el dolor puede ser provocado por la inflamación del tejido tratado. En lesiones grandes, la asociación de los AINE con los opioides puede ser útil. Si el tratamiento se realiza en la nariz, la lengua, los párpados o cerca de la laringe, se prefiere el uso de corticosteroides a los AINE durante las primeras 48 horas, debido a su mayor efecto antiinflamatorio. Los AINE se pueden usar después de la suspensión de los corticosteroides. Sin embargo, el uso simultáneo de ambos, que es común en la medicina humana, está contraindicado en perros y gatos, ya que aumenta los efectos secundarios (75).
Cuidado de heridas
No se necesita apósito para la herida después del tratamiento. En los días siguientes después del tratamiento, el área tratada puede presentar un supurador que puede ser limpiado por el propietario. Los collares isabelinos se pueden usar en gatos y perros para evitar que el animal lame el área tratada.
Evaluación de los resultados
Seguimiento y retratamiento
El seguimiento se planifica individualmente en función de las necesidades de los pacientes y se recomienda a los 15 días y a los 1, 2, 4 y 6 meses después del tratamiento. En cada seguimiento, la lesión debe medirse y fotografiarse para documentar la respuesta al tratamiento.
Una vez que se trata el tumor, se reduce lentamente de tamaño con poca o ninguna necrosis. El mecanismo de acción de la bleomicina consiste en cortar las hebras de ADN, y las células mueren al intentar dividirse. Por esta razón, las células tumorales están «marcadas» para morir, pero solo mueren después de tratar de dividirse (58, 62). Mientras la lesión siga encogiéndose, no se necesitan más sesiones de tratamiento, porque no hay ningún beneficio en el tratamiento de las células ya tratadas. Por el contrario, puede inducir necrosis del tejido. El efecto terapéutico máximo se observa después de 6-8 semanas, pero puede tardar más. A veces, el tumor entra en un estado de reposo y, después de 2 o 3 meses, comienza a encogerse de nuevo.
Antes de programar una nueva sesión de tratamiento, se debe esperar la respuesta completa, en lugar de realizar la siguiente sesión en un tiempo fijo. Esto también se aplica al retratamiento de una lesión tratada previamente. Tenga en cuenta que en el caso de tejidos no tratados previamente o partes del tumor que quedaron sin tratar (en el caso de lesiones muy grandes, por ejemplo, en caballos) no es necesario retrasar una nueva sesión para tratar estos tejidos no tratados. En el caso de que las lesiones tratadas vuelvan a crecer, la nueva sesión de tratamiento no debe retrasarse.
Aunque el síndrome de lisis tumoral es muy poco común, al tratar tumores grandes se deben tomar medidas especiales para prevenirlo, en cualquier caso, es esencial un diagnóstico rápido y un tratamiento rápido.
En el seguimiento de un tumor tratado con TEC, se pueden ver cuatro tipos de evoluciones. La evolución común es lo que sucede en la mayoría de los casos. El tumor se encoge después de una hinchazón inicial y sigue encogiéndose hasta que se logra la respuesta final (Figura 7a). A veces, al principio, la lesión se comporta como la anterior, pero poco después, deja de encogerse. Permanece del mismo tamaño durante un tiempo variable, luego vuelve a encogerse. Llamamos a esto una evolución de dos veces (Figura 7b). Esto podría atribuirse a las células tumorales que no se dividen, que entran en el ciclo de división celular y mueren solo en ese momento, ya que tienen sus hebras de ADN cortadas por bleomicina sin matarlas inmediatamente. Otro tipo de evolución se caracteriza por lesiones que después del tratamiento no muestran una contracción evidente, debido a su alta población de células quiescentes (ver Figura 7c). Llamamos a esto evolución sin cambios. La evolución del escape tumoral se ve cuando, después de la reducción inicial, el tumor comienza a crecer de nuevo (ver Figura 7d). En este caso, se debe programar una nueva sesión de tratamiento sin demora, ya que el tumor no se ha tratado lo suficiente (ver Figura 8). Es importante tener en cuenta que la evolución del tumor es diferente de la respuesta, ya que la respuesta puede ser la misma en los cuatro casos. Comprender los tipos de evolución es esencial para determinar si repetir o no una sesión de tratamiento. En los tres primeros tipos de evolución, se recomienda esperar y hacer un seguimiento cercano de la lesión. Especialmente en la evolución de dos veces, o en la evolución sin cambios, ya que pueden terminar en la evolución del escape tumoral. Esto es particularmente importante, ya que el tratamiento de las lesiones que están evolucionando después de uno de los tres primeros tipos de evolución, puede ser innecesario e incluso puede conducir a la necrosis tisular, debido al sobretratamiento. Si hay dudas sobre una lesión constante, se recomienda realizar una biopsia para evitar confundir el resto del tumor con el tejido cicatricial residual.
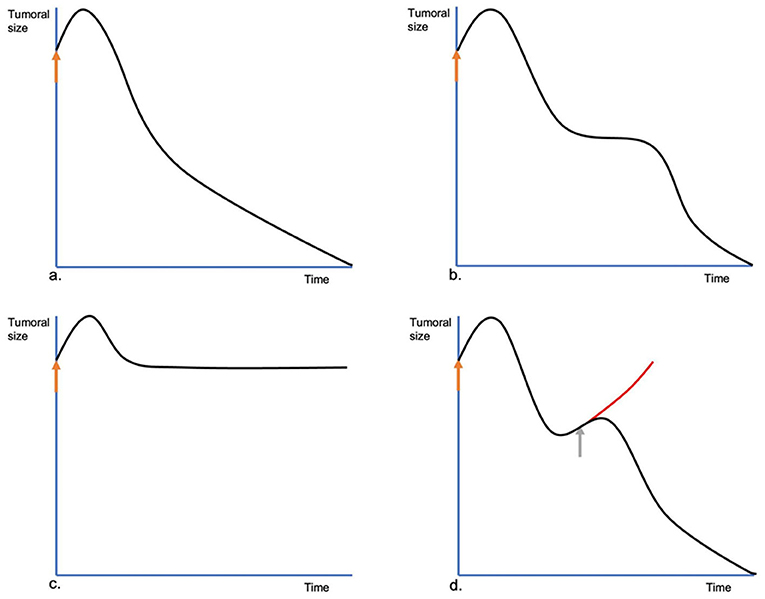 FIGURA 7. Diferentes evoluciones de los tumores tratados por la TEC. En (A), la evolución común. Al principio, inmediatamente después de la sesión de TEC (flecha naranja), la lesión tratada se hincha, aumentando su tamaño, pero al día siguiente, comienza a reducirse constantemente hasta su remisión completa. En (B), la doble evolución. La lesión, después de la hinchazón inicial, comienza a reducirse, pero se detiene. La lesión se mantiene estable durante algún tiempo y luego vuelve a encogerse hasta su respuesta final. En (C), la evolución sin cambios. Después de la hinchazón inicial, el tumor se encoge a su tamaño previo al tratamiento, sin encogerse más, ni encogiéndose muy lentamente. En (D), la evolución del escape tumoral. Después de la respuesta inicial, el tumor comienza a crecer de nuevo. Se debe realizar una nueva sesión de ECT lo antes posible (flecha gris) para evitar una recaída.
FIGURA 7. Diferentes evoluciones de los tumores tratados por la TEC. En (A), la evolución común. Al principio, inmediatamente después de la sesión de TEC (flecha naranja), la lesión tratada se hincha, aumentando su tamaño, pero al día siguiente, comienza a reducirse constantemente hasta su remisión completa. En (B), la doble evolución. La lesión, después de la hinchazón inicial, comienza a reducirse, pero se detiene. La lesión se mantiene estable durante algún tiempo y luego vuelve a encogerse hasta su respuesta final. En (C), la evolución sin cambios. Después de la hinchazón inicial, el tumor se encoge a su tamaño previo al tratamiento, sin encogerse más, ni encogiéndose muy lentamente. En (D), la evolución del escape tumoral. Después de la respuesta inicial, el tumor comienza a crecer de nuevo. Se debe realizar una nueva sesión de ECT lo antes posible (flecha gris) para evitar una recaída.
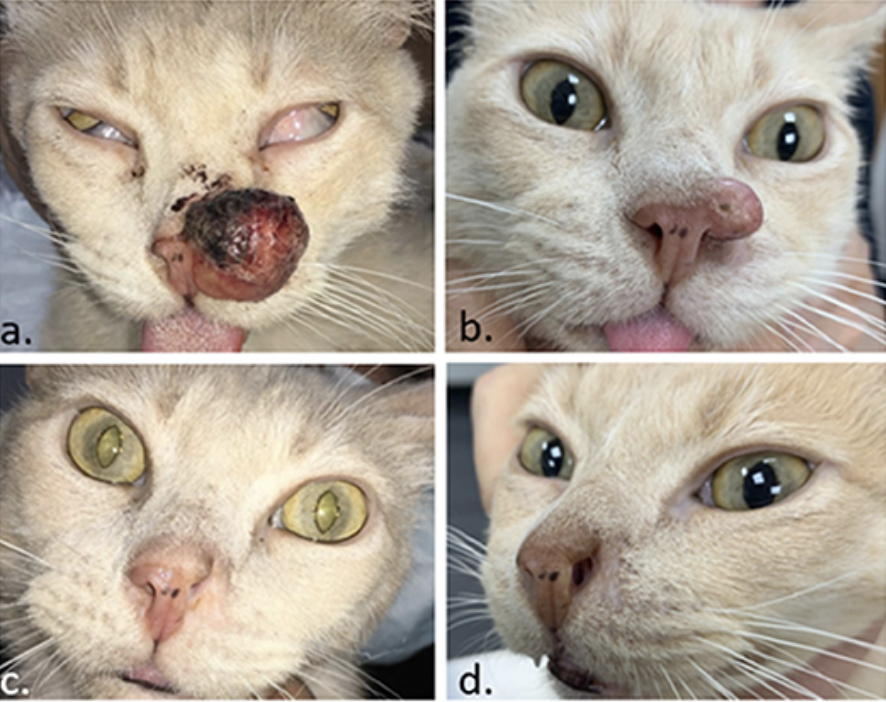
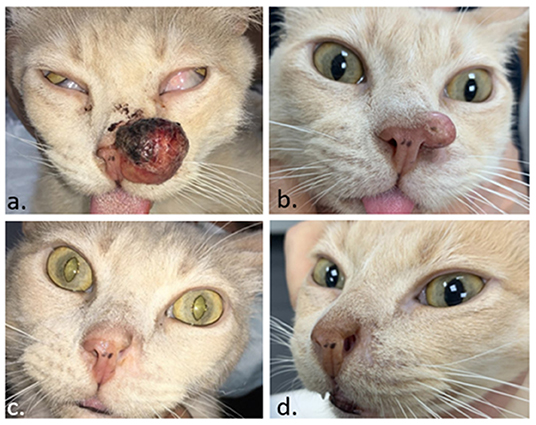 FIGURA 8. Paciente felino con un carcinoma de células escamosas en la nariz. En (A) el día de la TCE. En (B) 1 mes después, se recuperó el tumor y se realizó una segunda sesión de ECT. En (C), se obtuvo una respuesta completa 1 mes después del segundo ECT. En (D), el paciente permanece libre de enfermedad 4 meses después.
FIGURA 8. Paciente felino con un carcinoma de células escamosas en la nariz. En (A) el día de la TCE. En (B) 1 mes después, se recuperó el tumor y se realizó una segunda sesión de ECT. En (C), se obtuvo una respuesta completa 1 mes después del segundo ECT. En (D), el paciente permanece libre de enfermedad 4 meses después.
No hay datos sobre los intervalos mínimos entre los retiros, pero al menos 4 semanas es un período recomendado cuando se usa bleomicina intravenosa.
Considere el retratamiento si:
• La lesión no se trató lo suficiente en la primera sesión.
• La lesión comienza a crecer
• Se desarrollan nuevas lesiones.
Combinación Con Otras Terapias
La TEC no excluye otros tratamientos, por el contrario, puede aumentar su eficacia. Por esa razón, muchos tratamientos estándar como la cirugía (10, 44, 51), la quimioterapia (30), la inmunoterapia (24, 76) y la radioterapia (77) pueden ser más efectivos en combinación con la TEC (25).
Para tumores de más de 3-4 cm3, la TEC se puede combinar con la cirugía como una herramienta citorreductora neoadyuvante para realizar una cirugía menos extensa, lo que permite la función o la preservación de órganos. La ECT también se puede utilizar como terapia adyuvante para limpiar los márgenes insuficientemente resecados. Y finalmente, se puede usar intraoperatoriamente, para limpiar el lecho tumoral de la resección (10, 25, 44, 51).
La quimioterapia o la quimioterapia metronómica se pueden utilizar como adyuvantes de la TEC. Sin embargo, teniendo en cuenta el papel beneficioso de la TEC como activador del sistema inmunitario, la respuesta puede verse afectada por el efecto inmunosupresor de la quimioterapia sistémica (29). Se debe evaluar cuidadosamente si los riesgos superan los beneficios de esta combinación de quimioterapia neoadyuvante, concomitante o adyuvante con TEC (25).
La radioterapia se puede utilizar en combinación con la TEC, particularmente para tumores que invaden un área fuera del alcance de los electrodos. Al revés también es posible, la ECT se puede utilizar después de la radioterapia para tratar las recaídas radiorresistentes (77, 78).
Finalmente, en la Figura 9 se presenta un procedimiento paso a paso sobre cómo realizar el tratamiento.
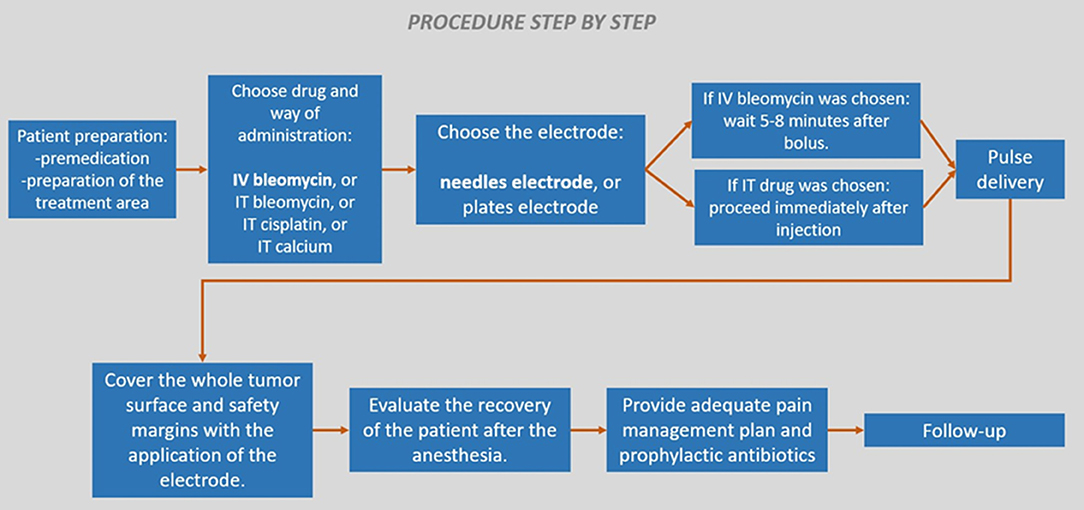 FIGURA 9. Procedimiento de electroquimioterapia paso a paso. En negrita, las opciones preferidas cuando sea posible.
FIGURA 9. Procedimiento de electroquimioterapia paso a paso. En negrita, las opciones preferidas cuando sea posible.
Recomendaciones procesables: Problemas que a menudo se observaron en el procedimiento que deben evitarse para mejorar los resultados
Relacionado con el paciente
Asunto
A veces, pasa demasiado tiempo entre la primera consulta y el procedimiento de la TEC. En los tumores muy activos, esto puede cambiar completamente el estado del paciente, y puede ser necesario un nuevo ensentamiento para confirmar que la TEC sigue siendo la mejor opción de tratamiento.
Recomendación
Las evaluaciones previas a la ECT deben realizarse un máximo de 4 días antes del tratamiento. Si es necesario, solicite nuevos procedimientos de imagen.
Asunto
Al igual que la anterior, si pasa mucho tiempo entre la primera consulta y la TEC, incluso si el tumor no creció mucho, el paciente puede deteriorarse gravemente. Esto es famoso por los tumores que impiden una alimentación adecuada. Esta situación puede aumentar el riesgo de anestésico y el procedimiento puede volverse imposible.
Recomendación
Asegúrese de proporcionar el apoyo clínico adecuado (hidratación suficiente, apoyo en la alimentación y analgesia adecuada) con el objetivo de que el tratamiento ECT se realice en las mejores condiciones.
En pacientes gravemente deteriorados, es posible tratar solo la mitad de la lesión. Si su evolución es positiva en unos días, trate la segunda mitad de la lesión lo antes posible.
Relacionado con la técnica
Asunto
El tiempo de tratamiento óptimo ha pasado y queda tejido por tratar.
Recomendación
Continúe tratando todos los tejidos restantes que deben tratarse, independientemente del tiempo transcurrido. Todas las lesiones tratadas fuera de la ventana de tratamiento óptima deben marcarse y seguirse cuidadosamente para un pronto nuevo tratamiento en caso de rebrote o ausencia de respuesta. Es recomendable planificar el momento de la administración de bleomicina, especialmente en pacientes con lesiones muy extensas, o cuando el procedimiento se realiza de forma intraoperatoria.
Cuando se utiliza la administración intratumoral del medicamento, el volumen tumoral inyectado debe tratarse lo más rápido posible. Si el tumor es grande y la inyección dura más de 2 minutos (19), entregue los pulsos en la parte inyectada y, después de eso, proceda a inyectar y pulse las otras partes.
Para obtener más detalles, consulte la sección Administración de Medicamentos.
Asunto
El tumor es grueso y no se puede garantizar el tratamiento de las partes más profundas.
Recomendación
El campo eléctrico cae muy rápidamente fuera de la región entre las agujas o placas de los electrodos. Por esa razón, se deben hacer consideraciones especiales al tratar todo el volumen del tumor, incluidas sus partes más profundas. Es muy importante cubrir todo el tumor, especialmente su lecho, para reducir el riesgo de recaída. Cuando se utilizan electrodos de superficie, la profundidad de tratamiento es de alrededor de 3 mm como máximo. Para los tumores que invaden a mayor profundidad, los electrodos de aguja siempre deben usarse para garantizar el alcance adecuado del campo eléctrico a los tejidos más profundos (79). Si el grosor del tumor es mayor que la longitud de las agujas, proceda con el desenreo antes de la TEC, como se explicó anteriormente.
Asunto
Uso inadecuado de los electrodos de la aguja en lesiones redondeadas o pedunculadas.
Procedimiento de mitigación
Es muy importante garantizar el tratamiento de todo el tumor, evitando cuidadosamente el sobretratamiento. Es de suma importancia cubrir la base de la lesión con el campo eléctrico. En lesiones redondeadas o pedunculadas, un error común es insertar el electrodo de las agujas perpendicularmente a la superficie del tumor. Este enfoque sobretrata el centro del tumor produciendo electroporación irreversible y no cubre el lecho tumoral. El enfoque correcto es insertar el electrodo de las agujas perpendicularmente a la superficie donde se encuentra el tumor. Se recomienda una ligera superposición de la aplicación del electrodo, y se debe evitar una gran separación o demasiadas superposiciones de la aplicación del electrodo (ver Figura 10).
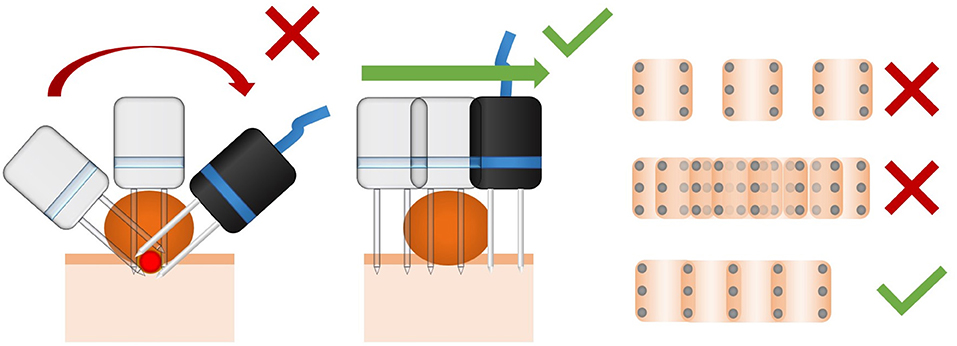 FIGURA 10. Qué hacer y qué no hacer sobre la técnica de entrega de campo eléctrico usando electrodos de aguja. A la izquierda, un error común durante el tratamiento de las lesiones redondeadas es la aplicación perpendicularmente a la superficie. De esta manera, el lecho tumoral puede no ser tratado correctamente, y el centro de la masa puede ser sobretratado. En el medio, el suministro de los pulsos se perpendicularmente a la superficie donde se encuentra el tumor. Esto proporciona un tratamiento adecuado del lecho de la lesión. A la derecha, es un esquema de la distancia entre las aplicaciones de un electrodo de 6 agujas. Como se puede ver, si están demasiado separadas (arriba), las áreas no tratadas pueden provocar una recaída. Si están demasiado superpuestos (medio), el sobretratamiento puede producir necrosis y daño tisular no deseado. La distancia correcta es una ligera superposición de las aplicaciones (abajo).
FIGURA 10. Qué hacer y qué no hacer sobre la técnica de entrega de campo eléctrico usando electrodos de aguja. A la izquierda, un error común durante el tratamiento de las lesiones redondeadas es la aplicación perpendicularmente a la superficie. De esta manera, el lecho tumoral puede no ser tratado correctamente, y el centro de la masa puede ser sobretratado. En el medio, el suministro de los pulsos se perpendicularmente a la superficie donde se encuentra el tumor. Esto proporciona un tratamiento adecuado del lecho de la lesión. A la derecha, es un esquema de la distancia entre las aplicaciones de un electrodo de 6 agujas. Como se puede ver, si están demasiado separadas (arriba), las áreas no tratadas pueden provocar una recaída. Si están demasiado superpuestos (medio), el sobretratamiento puede producir necrosis y daño tisular no deseado. La distancia correcta es una ligera superposición de las aplicaciones (abajo).
Asunto
El tumor rodea un diente.
recomendación
La presencia del diente entre las agujas puede afectar gravemente la distribución del campo eléctrico. El tumor puede ser tratado si encaja entre las agujas sin aumentar su separación. Pero, debido a que la progresión de la enfermedad probablemente llevaría a un aflojamiento del diente (que tendrá que eliminarse más tarde de todos modos), se recomienda extraer el diente y tratar el área correctamente.
Asunto
Los implantes metálicos o los instrumentos quirúrgicos cercanos a los electrodos pueden conducir la electricidad a través de ellos y provocar un cortocircuito y dañar el dispositivo.
Procedimiento de mitigación
Se debe prestar especial atención para evitar la inserción de una aguja en contacto o muy cerca de cualquier implante metálico o instrumento quirúrgico.
Asunto
La presencia de sangre en el área de tratamiento puede aumentar la conductividad e inducir un arco o desviar el campo eléctrico, lo que provoca un tratamiento incompleto/inexacto del tumor.
Recomendación
La hemostasia adecuada es esencial durante el procedimiento.
Asunto
ECT que utiliza medicamentos que no son bleomicina, cisplatino o calcio.
Recomendación
Use solo los medicamentos quimioterapéuticos probados para la TEC que son: bleomicina, cisplatino y calcio, de acuerdo con las prescripciones recomendadas en la sección Administración de medicamentos. Hay medicamentos que, en la quimioterapia clásica, son eficaces para cánceres específicos, pero la elección del medicamento adecuado para la TEC no depende del tipo histológico. La mayoría de los medicamentos de quimioterapia de uso común se han probado con poco o ningún beneficio al agregar los pulsos eléctricos (80) porque estos medicamentos ya penetran en las células sin restricciones, incluso en ausencia de cualquier tipo de permeabilización celular.
Relacionado con el dispositivo
Asunto
El electroporador no funciona correctamente.
recomendación
Siempre transmita un pulso al aire antes de anestesiar al paciente para garantizar el correcto funcionamiento de los dispositivos. Si el problema persiste, intente apagarlo y volver a encenderlo, comprobando la conexión correcta del electrodo y el pedal al dispositivo y luego repita la prueba. Si el problema persiste, póngase en contacto con el fabricante.
Asunto
Una avería de la fuente de alimentación eléctrica es un evento imprevisto que puede ocurrir en casi cualquier entorno. La mayoría de los dispositivos de grado médico vienen con una batería interna que les permite seguir funcionando. Los dispositivos de electroporación a menudo no tienen baterías y, por esa razón, no pueden seguir funcionando durante una avería de la fuente de alimentación eléctrica.
recomendación
Una fuente de alimentación ininterrumpida regular (UPS) de 750 W puede proporcionar suficiente energía para completar 4 o 5 sesiones de tratamiento dependiendo del consumo eléctrico de sus dispositivos.
Asunto
Se requieren muchas sesiones de tratamiento para lograr una respuesta y/o el tratamiento es difícil debido a la pérdida de nitidez de las agujas.
recomendación
En medicina humana, los electrodos desechables son la única opción para el tratamiento, pero en medicina veterinaria, todavía es posible usar electrodos no desechables. Los electrodos de la aguja pueden verse gravemente afectados incluso después de una sola sesión de ECT. La oxidación de la superficie de las agujas puede aislar partes de ellas, lo que puede afectar en gran medida la distribución de los campos eléctricos y, por lo tanto, reducir la eficacia del tratamiento. Esta oxidación puede no verse a simple vista. Use electrodos desechables si es posible (consulte la Figura 11). Si no están disponibles en su configuración, el mantenimiento de los electrodos debe hacerse lijando las agujas antes del tratamiento. Esto eliminará la oxidación y mejorará la conducción eléctrica.
 FIGURA 11. Ejemplos de asas con agujas desechables. En (A) el mango del desechable que se muestra en (C).En (B) el mango para el desechable que se muestra en (D).
FIGURA 11. Ejemplos de asas con agujas desechables. En (A) el mango del desechable que se muestra en (C).En (B) el mango para el desechable que se muestra en (D).
Mantenga sus electrodos en buenas condiciones, haga evaluaciones periódicas y considere adquirir otros nuevos si muestran signos de desgaste.
La nitidez de las agujas también puede verse afectada, y el uso posterior de estas agujas puede producir un trauma no deseado en el tejido. Las agujas ya usadas también pueden tender a excursión dentro del tejido, alejándose unas de otras (lo que puede producir un campo eléctrico insuficiente) o hacia la otra (lo que puede producir un arco o un cortocircuito). Si las agujas están dobladas, corrija la flexión antes de insertarlas en el tejido.
Asunto
El electroporador muestra una advertencia al intentar emitir los pulsos.
recomendación
Algunos tumores muestran una conductividad eléctrica muy alta, lo que significa que se necesitan corrientes eléctricas muy altas para mantener un campo eléctrico adecuado. Los electroporadores pueden no ser capaces de suministrar corrientes tan altas. Si el dispositivo que está utilizando está advirtiendo que el campo eléctrico no se logró correctamente, retire las agujas a la mitad de la salida y entregue los pulsos. Tenga en cuenta que la parte más profunda de la lesión no será tratada, y se debe programar una nueva sesión tan pronto como la parte superficial (el volumen tratado) responda. Abstenerse de modificar los parámetros del tratamiento, ya que pueden inducir necrosis y/o disminuir seriamente la eficiencia del tratamiento.
Discusión: El uso de la TEC en la práctica veterinaria
La TEC es una práctica bien establecida en medicina veterinaria. Ganó el estatus bastante rápidamente debido a su alta eficiencia y efectos secundarios insignificantes, y porque proporciona un tratamiento adecuado cuando otras modalidades de tratamiento han fracasado o son engorrosas.
Si bien la TEC se usa regularmente en gatos, perros y equinos, los pacientes de un espectro variado de otras especies también han sido tratados con éxito, entre ellos: hurones (81), elefantes, peces, tortugas (82, 83), erizos (84), serpientes (85), aves (86, 87), cerdos (88), entre otros.
En medicina humana, la TEC es una herramienta muy valiosa. Comenzó como un tratamiento paliativo, y comenzó su uso rutinario en 2006, después del estudio ESOPE (5) y la aprobación del electroporador de grado médico, el Cliniporator (Igea, Carpi, Italia). Sus principales indicaciones son los tumores cutáneos y subcutáneos de cualquier histología que no son candidatos para otras modalidades de tratamiento. Recientemente, se puede realizar como el primer enfoque a petición del paciente, o para el tratamiento de tumores internos y profundos (50). Los Estados Unidos y el resto del mundo siguieron con el desarrollo de otros generadores. En América Latina, su uso comenzó en Argentina en 2020 después de la aprobación de otro electroporador de grado médico, el OncoPore (BIOTEX SRL, Buenos Aires, Argentina). Además de las indicaciones establecidas en los Procedimientos Operativos Estándar Actualizados para la TEC publicada por Gehl et al., se está llevando a cabo una intensa investigación para extender las aplicaciones de la TEC a otros órganos, como el hígado (12), el cerebro (89), el páncreas (12) y los huesos (12). Se desarrolló un electrodo endoscópico, el EndoVe, para el tratamiento del cáncer colorrectal (90) y el esófago (91). La ECT es hoy en día un activo valioso para el oncólogo. Se puede usar solo o en combinación con otras terapias, y proporciona una nueva opción de tratamiento cuando otras han fallado o no son factibles (30).
La experiencia personal de los autores comprende más de 4.000 casos, tratados en varias especies animales, en más de 10 años de práctica. Esa experiencia también incluye el tratamiento de pacientes humanos en el entorno clínico, lo que nos permite ser conscientes de las diferencias relevantes que tienen los tratamientos. También se basa en la organización de los talleres latinoamericanos sobre ECT, la impartición de 9 cursos a más de 150 veterinarios de América Latina y España, así como en el servicio a muchos usuarios a través de diferentes plataformas en línea para responder a sus preguntas (https://vetoncologia.com/ect).
Esta guía proporciona información práctica y útil actualizada a los veterinarios. Aquí trajimos información detallada sobre aspectos importantes que deben tenerse en cuenta para tratar el amplio espectro de pacientes que abarcan la medicina veterinaria.
Declaración de disponibilidad de datos
Los autores pondrán a disposición los datos sin procesar que respaldan las conclusiones de este artículo, sin reservas indebidas.
Declaración ética
Se siguieron todas las regulaciones del Consejo Profesional de Médicos Veterinarios (Argentina). Este trabajo fue aprobado por la IACUC de la Facultad de Ciencias Veterinarias de la Universidad de Buenos Aires, Argentina. Número de protocolo: 2018/31. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones del autor
Todos los autores contribuyeron igualmente al diseño, la redacción y la corrección del manuscrito y aprobaron la versión presentada.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Agradecimientos
Los autores quieren reconocer a todas las personas involucradas en la investigación, difusión y enseñanza de ECT para animales de compañía. Es imposible hacer una lista completa que incluya a todas las personas relevantes involucradas. Por último, nos gustaría dar las gracias al Prof. doctor Guillermo Marshall, por sus esfuerzos sostenidos para introducir la TEC en medicina humana y veterinaria en Argentina.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2022.868989/full#supplementary-material
Referencias
1. Mir LM, Devauchelle P, Quintin-Colonna F, Delisle F, Doliger S, Fradelizi D, et al. Primer ensayo clínico de tratamiento de sarcomas de tejidos blandos de gatos mediante electroquimioterapia. Br J Cáncer. (1997) 76:1617-22. doi: 10.1038/bjc.1997.606
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
2. Belehradek M, Domenge C, Luboinski B, Orlowski S, Belehradek J, Mir LM. Electroquimioterapia, un nuevo tratamiento antitumoral. Primer ensayo clínico de fase I-II. Cáncer. (1993) 72:3694–700. doi: 10.1002/1097-0142(19931215)72:12<3694::aid-cncr2820721222>3.0.co;2-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
3. Mir LM, Belehradek M, Domenge C, Orlowski S, Poddevin B, Belehradek J Jr, et al. [Electrochemoterapia, un nuevo tratamiento antitumoral: primer ensayo clínico]. C R Acad Sci III. (1991) 313:613-8.
4. Mir LM, Gehl J, Sersa G, Collins CG, Garbay J-R, Billard V, et al. Procedimientos operativos estándar de la electroquimioterapia: instrucciones para el uso de bleomicina o cisplatino administrados de forma sistémica o local y pulsos eléctricos administrados por el CliniporatorTM por medio de electrodos invasivos o no invasivos. Eur J Cancer Suppl. (2006) 4:14-25. doi: 10.1016/j.ejcsup.2006.08.003
5. Marty M, Sersa G, Garbay JR, Gehl J, Collins CG, Snoj M, et al. Electroquimioterapia: un tratamiento fácil, altamente efectivo y seguro de las metástasis cutáneas y subcutáneas: resultados del estudio ESOPE (European Standard Operating Procedures of Electrochemotherapy). Eur J Cancer Suppl. (2006) 4:3–13. doi: 10.1016/j.ejcsup.2006.08.002
6. Benazzo M, Bertino G, Groselj A. Electroquimioterapia para el cáncer de cabeza y cuello. Manual de Electroporación. (2017) 1903-15. doi: 10.1007/978-3-319-32886-7_102
7. Gargiulo M, Serra Mestre JM, Cortese A, Murphy DC, Parascandolo S, Razzano S. Eficacia a largo plazo de la electroquimioterapia para el tratamiento del carcinoma de células escamosas del labio inferior. J Craniomaxillofac Surg. (2018) 46:1968–74. doi: 10.1016/j.jcms.2018.08.013
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
8. Maglietti F, Tellado M, Olaiz N, Michinski S, Marshall G. Procedimiento de electroquimioterapia mínimamente invasivo para tratar tumores del conducto nasal en perros utilizando un electrodo de una sola aguja. Radiol Oncol. (2017) 51:422-30. doi: 10.1515/raon-2017-0043
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
9. Tellado MN, Maglietti FH, Michinski SD, Marshall GR, Signori E. Electroquimioterapia en el tratamiento del melanoma maligno oral canino y los factores que influyen en el resultado del tratamiento. Radiol Oncol.(2020) 54:68-78. doi: 10.2478/raon-2020-0014
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
10. Cemazar M, Tamzali Y, Sersa G, Tozon N, Mir LM, Miklavcic D, et al. Electroquimioterapia en oncología veterinaria. J Pasante Veterinario Médico. (2008) 22:826-31. doi: 10.1111/j.1939-1676.2008.0117.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
11. Tamzali Y, Borde L, Rols MP, Golzio M, Lyazrhi F, Teissie J. Tratamiento exitoso de los sarcoides equinos con electroquimioterapia con cisplatino: un estudio retrospectivo de 48 casos. Veterinario Equino J. (2012) 44:214–20. doi: 10.1111/j.2042-3306.2011.00425.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
12. Probst U, Fuhrmann I, Beyer L, Wiggermann P. La electroquimioterapia como una nueva modalidad en oncología intervencionista: una revisión. Tratamiento de la Res del Cáncer Tecnológico. (2018) 17:1533033818785329. doi: 10.1177/1533033818785329
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
13. Mir LM. Bases y justificación de la electroquimioterapia. En: 11a Conferencia Mediterránea sobre Ingeniería Médica y Biomédica e Informática. Liubliana (2007). p. 622.
14. Sersa G, Miklavcic D. Electroquimioterapia de tumores. J Vis Exp. (2008) 22:1038. doi: 10.3791/1038
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
15. Mir LM, Orlowski S. La base de la electroquimioterapia. Electroquimioterapia Electrogeneterapia Medicamento Transdérmico Deliv. (2000) 37:99-117. doi: 10.1385/1-59259-080-2:99
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
16. Spugnini EP, Baldi A. Electroquimioterapia en oncología veterinaria: desde el rescate hasta la terapia de primera línea. Métodos Mol Biol. (2014) 1121:247-56. doi: 10.1007/978-1-4614-9632-8_22
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
17. Gehl J, Serša G. Electroquimioterapia y sus aplicaciones clínicas. Manual de Electroporación. (2017) 1771–86. doi: 10.1007/978-3-319-32886-7_91
18. Tozon N, Pavlin D, Sersa G, Dolinsek T, Cemazar M. Electroquimioterapia con inyección intravenosa de bleomicina: un estudio observacional en carcinoma de células escamosas superficiales en gatos. J Feline Med Surg. (2014) 16:291–9. doi: 10.1177/1098612X13507071
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
19. Tozon N, Kramaric P, Kos Kadunc V, Sersa G, Cemazar M. Electroquimioterapia como tratamiento único o adyuvante para la cirugía de tumores sarcoides cutáneos en caballos: un estudio retrospectivo de 31 casos.Veterinario Rec. (2016) 179:627. doi: 10.1136/vr.103867
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
20. Gehl J, Geertsen PF. Paliación de hemorragias y tumores cutáneos ulcerados mediante electroquimioterapia. Eur J Cancer Suppl. (2006) 4:35–7. doi: 10.1016/j.ejcsup.2006.07.007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
21. Gehl J, Skovsgaard T, Mir LM. Reacciones vasculares a la electroporación in vivo: caracterización y consecuencias para la administración de fármacos y genes. Biochim Biophys Acta. (2002) 1569:51–8. doi: 10.1016/S0304-4165(01)00233-1
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
22. Calvet CY, Mir LM. La prometedora alianza de la electroquimioterapia contra el cáncer con la inmunoterapia. Metástasis del cáncer Rev. (2016) 35:165-77. doi: 10.1007/s10555-016-9615-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
23. Calvet CY, Famin D, André FM, Mir LM. La electroquimioterapia con bleomicina induce características de la muerte celular inmunogénica en las células de cáncer de colon murino. Oncoinmunología. (2014) 3:e28131. doi: 10.4161/onci.28131
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
24. Maglietti F, Tellado M, De Robertis M, Michinski S, Fernández J, Signori E, et al. La electroporación como estrategia de inmunoterapia para el cáncer en medicina veterinaria: estado del arte en América Latina.Vacunas. (2020) 8:537. doi: 10.3390/vacunas8030537
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
25. Tellado M, Maglietti F, Impellizeri J. La electroquimioterapia como componente multimodal del tratamiento del cáncer: combinaciones con cirugía, criocirugía, radioterapia y quimioterapia. En: Impellizeri JA, editor.Electroporación en la práctica de oncología veterinaria. Cham: Springer (2021). p. 205-16.
26. Tozon N, Milevoj N, Impellizeri J. Electroquimioterapia en oncología veterinaria. En: Impellizeri JA, editor. Electroporación en la práctica de oncología veterinaria. Cham: Springer (2021). p. 63-12.
27. Hodson R. Medicina de precisión. Naturaleza. (2016) 537:S49. doi: 10.1038/537S49a
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
28. Bonadies A, Bertozzi E, Cristiani R, Govoni FA, Migliano E. Electroquimioterapia en neoplasias cutáneas de pacientes con cáncer de cabeza y cuello: eficacia clínica y beneficios estéticos. Acta Derm Venereol. (2019) 99:1246–52. doi: 10.2340/00015555-3341
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
29. Sersa G, Teissie J, Cemazar M, Signori E, Kamensek U, Marshall G, et al. Electroquimioterapia de tumores como vacunación in situ impulsada por la electrotransferencia de inmunogénica. Inmune de cáncer inmunitario. (2015) 64:1315-27. doi: 10.1007/s00262-015-1724-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
30. Campana LG, Edhemovic I, Soden D, Perrone AM, Scarpa M, Campanacci L, et al. Electroquimioterapia – Avances técnicos en aplicaciones emergentes, nuevas indicaciones, enfoques combinados y colaboración multiinstitucional. Eur J Surg Oncol. (2019) 45:92–102. doi: 10.1016/j.ejso.2018.11.023
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
31. Lowe RJ. Beneficios y efectos secundarios de la electroquimioterapia en pacientes veterinarios. 1er Congreso Mundial sobre Electroporación y Campos Eléctricos Pulsados en Biología, Medicina y Tecnologías Alimentarias y Ambientales. Singapur: Springer (2016). p. 437-40.
32. Simčič P, Lowe R, Granziera V, Pierini A, Torrigiani F, Lubas G. Electroquimioterapia en el tratamiento del carcinoma de células escamosas no silares oral canino. Un informe de una serie de casos. Comp Comp Oncol. (2020) 18:428-32. doi: 10.1111/vco.12530
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
33. Spugnini EP, Renaud SM, Buglioni S, Carocci F, Dragonetti E, Murace R, et al. La electroquimioterapia con cisplatino mejora el control local después de la ablación quirúrgica del fibrosarcoma en gatos: un enfoque para mejorar el índice terapéutico de los medicamentos de quimioterapia altamente tóxicos. J Transl Med.(2011) 9:152. doi: 10.1186/1479-5876-9-152
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
34. Spugnini EP, Azzarito T, Fais S, Fanciulli M, Baldi A. Electroquimioterapia como tratamiento de primera línea del cáncer: experiencias de la medicina veterinaria en el desarrollo de nuevos protocolos. Objetivos de medicamentos contra el cáncer de Curr. (2015) 16:43-52. doi: 10.2174/156800961601151218155340
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
35. Cutrera J, King G, Jones P, Kicenuik K, Gumpel E, Xia X, et al. Tratamiento seguro y eficaz de neoplasias espontáneas con terapia de electro-químico-geno de interleucina 12. J Cell Mol Med. (2015) 19:664–75. doi: 10.1111/jcmm.12382
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
36. Papich MG. Manual de Medicamentos Veterinarios Papich – Libro electrónico. Ámsterdam: Elsevier Health Sciences (2020). p. 1056.
37. Rols MP, Tamzali Y, Teissié J. Electroquimioterapia de caballos. Un informe clínico preliminar. Bioelectroquímica. (2002) 55:101-5. doi: 10.1016/S1567-5394(01)00156-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
38. Milevoj N, Tozon N, Licen S, Lampreht Tratar U, Sersa G, Cemazar M. Calidad de vida relacionada con la salud en perros tratados con electroquimioterapia y/o electrotransferencia de genes de interleucina-12. Vet Med Sci. (2020) 6:290–8. doi: 10.1002/vms3.232
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
39. Edhemovic I, Brecelj E, Gasljevic G, Marolt Music M, Gorjup V, Mali B, et al. Electroquimioterapia intraoperatoria de metástasis hepáticas colorrectal. J Surg Oncol. (2014) 110:320–7. doi: 10.1002/jso.23625
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
40. Mali B, Miklavcic D, Campana LG, Cemazar M, Sersa G, Snoj M, et al. Tamaño del tumor y eficacia de la electroquimioterapia. Radiol Oncol. (2013) 47:32-41. doi: 10.2478/raon-2013-0002
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
41. Whelan MC, Larkin JO, Collins CG, Cashman J, Breathnach O, Soden DM, et al. Tratamiento eficaz de un extenso cáncer de mama recurrente que era refractario a la terapia multimodal mediante múltiples aplicaciones de electroquimioterapia. Eur J Cancer Suppl. (2006) 4:32–4. doi: 10.1016/j.ejcsup.2006.07.006
42. Campana LG, Testori A, Mozzillo N, Rossi CR. Tratamiento del melanoma metastásico con electroquimioterapia. J Surg Oncol. (2014) 109:301–7. doi: 10.1002/jso.23512
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
43. Campana LG, Valpione S, Mocellin S, Sundararajan R, Granziera E, Sartore L, et al. Electroquimioterapia para metástasis superficiales diseminadas por melanoma maligno. Br J Surg. (2012) 99:821-30. doi: 10.1002/bjs.8749
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
44. Lowe R, Gavazza A, Impellizeri JA, Soden DM, Lubas G. El tratamiento de tumores de mastocitos caninos con electroquimioterapia con o sin escisión quirúrgica. Comp Comp Oncol. (2017) 15:775-84. doi: 10.1111/vco.12217
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
45. Cemazar M, Sersa G. Avances recientes en electroquimioterapia. Bioelectricidad. (2019) 1:204-13. doi: 10.1089/bioe.2019.0028
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
46. Miklavcic D, Pucihar G, Pavlovec M, Ribaric S, Mali M, Macek-Lebar A, et al. El efecto de los pulsos eléctricos de alta frecuencia en las contracciones musculares y la eficiencia antitumoral in vivo para un uso potencial en electroquimioterapia clínica. Bioelectroquímica. (2005) 65:121–8. doi: 10.1016/j.bioelechem.2004.07.004
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
47. Pucihar G, Mir LM, Miklavcic D. El efecto de la frecuencia de repetición de pulsos en la absorción en células electropermeabilizadas in vitro con posibles aplicaciones en electroquimioterapia. Bioelectroquímica.(2002) 57:167-72. doi: 10.1016/S1567-5394(02)00116-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
48. Spugnini EP, Baldi A. Electroquimioterapia en oncología veterinaria: estado de la técnica y perspectivas.Veterinario Clin North Am Pequeño Anim Pract. (2019) 49:967-79. doi: 10.1016/j.cvsm.2019.04.006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
49. Potočnik T, Miklavčič D, Maček Lebar A. Transferencia de genes por electroporación con pulsos bipolares de alta frecuencia en vitro. Bioelectroquímica. (2021) 140:107803. doi: 10.1016/j.bioelechem.2021.107803
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
50. Gehl J, Sersa G, Matthiessen LW, Muir T, Soden D, Occhini A, et al. Procedimientos operativos estándar actualizados para la electroquimioterapia de tumores cutáneos y metástasis cutáneas. Acta Oncol. (2018) 57:874–82. doi: 10.1080/0284186X.2018.1454602
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
51. Tozon N, Lampreht Tratar U, Znidar K, Sersa G, Teissie J, Cemazar M. Procedimientos operativos de la electroquimioterapia para el tratamiento del tumor en perros y gatos. J Vis Exp. (2016). doi: 10.3791/54760
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
52. Gozalo-Marcilla M, Ringer SK. Recuperación después de la anestesia general en caballos adultos: un resumen estructurado de la literatura. Animales. (2021) 11:1777. doi: 10.3390/ani11061777
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
53. Tozon N, Kodre V, Sersa G, Cemazar M. Tratamiento eficaz de los tumores perianales en perros con electroquimioterapia. Res. de lucha contra el cáncer (2005) 25:839-45.
54. Martin S, Larson E. Prácticas de gestión de quimioterapia de enfermeras de oncología ambulatorias y de consultorio. Oncol Nurs Forum. (2003) 30:575–81. doi: 10.1188/03. ONF.575-581
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
55. Stefanou A, Siderov J. Comité de Práctica Especializada en Oncología de la Sociedad de Farmacéuticos Hospitalarios de Australia. La nomenclatura de la dosis de errores médicos de la bleomicina debe estandarizarse para evitar errores.BMJ. (2001) 322:1423–4.
56. Vail DM, Thamm DH, Liptak J. Oncología clínica de animales pequeños de Withrow y MacEwen – Libro electrónico. Ámsterdam: Elsevier Health Sciences (2019). p. 864.
57. Groselj A, Krzan M, Kosjek T, Bosnjak M, Sersa G, Cemazar M. La farmacocinética de la bleomicina del bolo de la dosis de bleomicina en pacientes de edad avanzada tratados con electroquimioterapia. Cáncer Quimio Pharmacol. (2016) 77:939-47. doi: 10.1007/s00280-016-3004-z
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
58. Dorr RT. Farmacología de la bleomicina: mecanismo de acción y resistencia, y farmacocinética clínica. Semin Oncol. (1992) 19:3–8.
59. Jerzsele A. Farmacocinética veterinaria comparativa. Lecturas en Farmacocinética Avanzada – Teoría, Métodos y Aplicaciones. Viena: InTech (2012).
60. Hezzell MJ, Dennis SG, Humm K, Agee L, Boswood A. Relaciones entre la frecuencia cardíaca y la edad, el peso corporal y la raza en 10 849 perros. J Pequeña Práctica De Anim. (2013) 54:318-24. doi: 10.1111/jsap.12079
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
61. Groselj A, Bosnjak M, Krzan M, Kosjek T, Bottyán K, Plesnik H, et al. Concentración de bleomicina en el plasma y los tumores de los pacientes después de la electroquimioterapia. Un estudio del Grupo InspECT.Farmacología. (2021) 13:1324. doi: 10.3390/pharmaceutics13091324
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
62. Mir LM, Tounekti O, Orlowski S. Bleomicina: Renacimiento de un medicamento antiguo. Gen Pharmacol.(1996) 27:745–8. doi: 10.1016/0306-3623(95)02101-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
63. Campana LG, Testori A, Curatolo P, Quaglino P, Mocellin S, Framarini M, et al. Eficacia del tratamiento con electroquimioterapia: un estudio observacional prospectivo multiinstitucional en 376 pacientes con tumores superficiales. Eur J Surg Oncol. (2016) 42:1914-23. doi: 10.1016/j.ejso.2016.06.399
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
64. Spugnini EP, Vincenzi B, Citro G, Dotsinsky I, Mudrov T, Baldi A. Evaluación del cisplatino como agente de electroquimioterapia para el tratamiento de tumores de mastocitos desextirpados de forma incompleta en perros. J Pasante Veterinario Médico. (2011) 25:407-11. doi: 10.1111/j.1939-1676.2011.0678.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
65. Knapp DW, Richardson RC, DeNicola DB, Long GG, Blevins WE. Toxicidad del cisplatino en gatos. J Pasante Veterinario Médico. (1987) 1:29-35. doi: 10.1111/j.1939-1676.1987.tb01983.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
66. Sersa G, Miklavcic D, Cemazar M, Rudolf Z, Pucihar G, Snoj M. Electroquimioterapia en el tratamiento de tumores. Eur J Surg Oncol. (2008) 34:232-40. doi: 10.1016/j.ejso.2007.05.016
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
67. Frandsen SK, Vissing M, Gehl J. Una revisión exhaustiva de la electroporación del calcio, una nueva modalidad de tratamiento del cáncer. Cánceres. (2020) 12:290. doi: 10.3390/cancers12020290
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
68. Frandsen SK, Gehl J, Tramm T, Thoefner MS. Electroporación de calcio de sarcoides equinos. Animales.(2020) 10:517. doi: 10.3390/ani10030517
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
69. Bik L, Sangers T, Greveling K, Prens E, Haedersdal M, van Doorn M. Eficacia y tolerabilidad de la bleomicina intralesional en dermatología: una revisión sistemática. J Am Acad Dermatol. (2020) 83:888–903. doi: 10.1016/j.jaad.2020.02.018
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
70. Bronaugh RL, Stewart RF, Congdon ER. Métodos para estudios de absorción percutánea in vitro. II Modelos de animales para piel humana. Toxicol Appl Pharmacol. (1982) 62:481–8. doi: 10.1016/0041-008X(82)90149-1
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
71. Cindrič H, Kos B, Miklavčič D. Electrodos y distribución de campo eléctrico en la práctica clínica. En: Impellizeri JA, editor. Electroporación en la práctica de oncología veterinaria. Cham: Springer (2021). p. 21-59.
72. Bertino G, Sersa G, De Terlizzi F, Occhini A, Plaschke CC, Groselj A, et al. Proyecto de investigación europea sobre electroquimioterapia en cáncer de cabeza y cuello (EURECA): resultados del tratamiento del cáncer de piel. Eur J Cancer. (2016) 63:41–52. doi: 10.1016/j.ejca.2016.05.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
73. Corovic S, Al Sakere B, Haddad V, Miklavcic D, Mir LM. Importancia de la superficie de contacto entre los electrodos y el tejido tratado en la electroquimioterapia. Tratamiento de la Res del Cáncer Tecnológico.(2008) 7:393-400. doi: 10.1177/153303460800700507
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
74. Ivorra A, Al-Sakere B, Rubinsky B, Mir LM. El uso de geles conductores para la homogeneización del campo eléctrico aumenta la eficacia antitumoral de las terapias de electroporación. Phys Med Biol. (2008) 53:6605–18. doi: 10.1088/0031-9155/53/22/020
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
75. Narita T, Sato R, Motoishi K, Tani K, Naito Y, Hara S. La interacción entre los medicamentos antiinflamatorios no esteroideos administrados por vía oral y la prednisolona en perros sanos. J Vet Med Sci. (2007) 69:353–63. doi: 10.1292/jvms.69.353
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
76. Milevoj N, Tratar UL, Nemec A, Brožič A, Žnidar K, Serša G, et al. combinación de electroquimioterapia, electrotransferencia genética de plásmido que codifica la IL-12 canina y cirugía citorreductora en el tratamiento del melanoma maligno oral canino. Res Vet Sci. (2019) 122:40–9. doi: 10.1016/j.rvsc.2018.11.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
77. Campana LG, Valpione S, Falci C, Mocellin S, Basso M, Corti L, et al. La actividad y seguridad de la electroquimioterapia en la recurrencia persistente de la pared torácica por cáncer de mama después de la mastectomía: un estudio de fase II. Tratamiento de la respuesta del cáncer de mama. (2012) 134:1169–78. doi: 10.1007/s10549-012-2095-4
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
78. Sersa G, Cufer T, Paulin SM, Cemazar M, Snoj M. Electroquimioterapia de la recurrencia del cáncer de mama de la pared torácica. Tratamiento contra el cáncer Rev. (2012) 38:379–86. doi: 10.1016/j.ctrv.2011.07.006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
79. Miklavcic D, Corovic S, Pucihar G, Pavselj N. Importancia de la cobertura tumoral por un campo eléctrico local suficientemente alto para una electroquimioterapia eficaz. Eur J Cancer Suppl. (2006) 4:45–51. doi: 10.1016/j.ejcsup.2006.08.006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
80. Jaroszeski MJ, Dang V, Pottinger C, Hickey J, Gilbert R, Heller R. Toxicidad de los agentes anticancerígenos mediadas por electroporación in vitro. Medicamentos contra el cáncer. (2000) 11:201–8. doi: 10.1097/00001813-200003000-00008
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
81. Racnik J, Svara T, Zadravec M, Gombac M, Cemazar M, Sersa G, et al. Electroquimioterapia con bleomicina de diferentes tipos de tumores cutáneos en un hurón (Mustela putorius furo). Radiol Oncol. (2017) 52:98-104. doi: 10.1515/raon-2017-0057
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
82. Donnelly KA, Papich MG, Zirkelbach B, Norton T, Szivek A, Burkhalter B, et al. Concentraciones plasmáticas de bleomicina durante el tratamiento electroquimoterapéutico de los fibropapillomas en turtleschelonia mydas verdes. J Aquat Anim Health. (2019) 31:186–92. doi: 10.1002/aah.10067
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
83. Brunner CHM, Dutra G, Silva CB, Silveira LMG, de Fátima Monteiro Martins M, Electroquimioterapia para el tratamiento de fibropapilomas en Chelonia mydas. J Zoo Wildl Med. (2014) 45:213–8. doi: 10.1638/2010-0125.1
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
84. Spugnini EP, Lanza A, Sebasti S, Baldi A. Paliación de electroquimioterapia de un carcinoma de células escamosas oral en un erizo africano (Atelerix albiventris). Foro de Res Veterinario. (2018) 9:379–81. doi: 10.30466/vrf.2018.33109
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
85. Lanza A, Baldi A, Spugnini EP. Cirugía y electroquimioterapia para el tratamiento del carcinoma cutáneo de células escamosas en un deslizador de vientre amarillo (Trachemys scripta scripta). J Am Vet Med Assoc.(2015) 246:455–7. doi: 10.2460/javma.246.4.455
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
86. Lanza A, Baldi A, Rossi G, Spugnini EP. Electroquimioterapia para el tratamiento de un hemangioendotelioma subcutáneo de bajo grado extirpado de baja extirpado en un periquito (Melopsittacus undulatus). Veterinario abierto J. (2019) 9:269. doi: 10.4314/ovj.v9i3.13
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
87. Racnik J, Svara T, Zadravec M, Gombac M, Cemazar M, Sersa G, et al. Electroquimioterapia con cisplatino para el tratamiento de un fibroma cutáneo no operativo en una cacatúa (Nymphicus hollandicus). N Z Vet J.(2019) 67:155–8. doi: 10.1080/00480169.2018.1564393
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
88. Weissman M, Donnelly LL, Branson K, Glahn A, Nagy D, Havis B, et al. Electroquimioterapia para un carcinoma cutáneo de células escamosas en un cerdo vietnamita con barriga (Susscrofa). J Exotic Pet Med.(2020) 34:37–43. doi: 10.1053/j.jepm.2020.03.013
89. Linnert M, Agerholm-Larsen B, Mahmood F, Iversen HK, Gehl J. Tratamiento de tumores cerebrales: electroquimioterapia. En: Hayat MA, editor. Tumores del sistema nervioso central, Volumen 12: Mecanismos moleculares, cáncer infantil, tratamientos y radiocirugía. Dordrecht: Springer Países Bajos (2014). p. 247-259.
90. Hansen HF, Bourke M, Stigaard T, Clover J, Buckley M, O’Riordain M, et al. Electroquimioterapia para el cáncer colorrectal mediante electroporación endoscópica: un estudio clínico de fase 1. Endosc Int Abierto.(2020) 08:E124-32. doi: 10.1055/a-1027-6735
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
91. Egeland C, Baeksgaard L, Johannesen HH, Löfgren J, Plaschke CC, Svendsen LB, et al. Electroquimioterapia endoscóscópica para el cáncer de esófago: un estudio clínico de fase I. Endosc Int Abierto. (2018) 6:E727-34. doi: 10.1055/a-0590-4053
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Palabras clave: electroporación, cáncer, oncología, mascotas, perros, gatos, caballos, procedimientos
Cita: Tellado M, Mir LM y Maglietti F (2022) Directrices veterinarias para la electroquimioterapia de tumores superficiales. Frente. Veterinario. Sci. 9:868989. doi: 10.3389/fvets.2022.868989
Editado por: Carlos Eduardo Fonseca-Alves, Universidad Paulista, Brasil
Revisado por:
Elisabetta Razzuoli, Instituto Zooprofiláctico Experimental para Piamonte, Liguria y Valle de Aosta (IZSTO), Italia
Zeinab Shankayi, Universidad Tarbiat Modares, Irán
Copyright © 2022 Tellado, Mir y Maglietti.
*Correspondencia: Felipe Maglietti, felipemaglietti@gmail.com
Descargo de responsabilidad: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamación que pueda ser fabricado por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía