Efectos del heno de Leymus chinensis y el heno de alfalfa sobre el rendimiento del crecimiento y la microbiota ruminal
 Efectos del heno de Leymus chinensis y el heno de alfalfa sobre el rendimiento del crecimiento, la microbiota ruminal y la metabolómica no dirigida de la carne en corderos
Efectos del heno de Leymus chinensis y el heno de alfalfa sobre el rendimiento del crecimiento, la microbiota ruminal y la metabolómica no dirigida de la carne en corderos
 Hanning Wang†
Hanning Wang†  Lingbo Meng†
Lingbo Meng†  Lan Mi*
Lan Mi*- Laboratorio Estatal Clave de Regulación Reproductiva y Cría de Ganado de Pastizales, Laboratorio Clave de Biotecnología de Forrajes y Cultivos Endémicos, Ministerio de Educación, Facultad de Ciencias de la Vida, Universidad de Mongolia Interior, Hohhot, China
Objetivo: El objetivo de este estudio fue comparar los efectos del heno de Leymus chinensis y el heno de alfalfa como forraje sobre la bacteria ruminal y la metabolómica de la carne en corderos.
Métodos: Catorce corderos machos fueron asignados aleatoriamente a dos tratamientos dietéticos (un grupo fue alimentado con concentrado y heno de Leymus chinensis; otro fue alimentado con concentrado y heno de alfalfa) con siete repeticiones por tratamiento. El experimento de alimentación duró 60 días. Los corderos fueron sacrificados al final del experimento de alimentación. Se determinó el comportamiento de crecimiento, el rendimiento de la canal y el peso de varias vísceras. Los contenidos de longissimus dorsi y rumen se recolectaron para metabolómica no dirigida y análisis de secuenciación de amplicones de ADNr 16S, respectivamente.
Resultados: Los corderos alimentados con heno de alfalfa mostraron un aumento significativo en la ganancia media diaria, el peso de la canal, el porcentaje de aderezo, el área del ojo de lomo y el peso del riñón. La alimentación con heno de Leymus chinensis y heno de alfalfa dio como resultado diferentes deposiciones de metabolitos de la carne y comunidades bacterianas del rumen en los corderos. La abundancia relativa de los filos Fibrobacteres, Bacteroidetes y Spirochaetes fue mayor en el grupo de heno de Leymus Chinensis, mientras que la abundancia relativa de Firmicutes, Proteobacteria, Fusobacteria y Verrucomicrobia fue mayor en el grupo de heno de alfalfa. Sobre la base de la metabolómica no dirigida, las principales vías metabólicas alteradas incluyeron el metabolismo de la alanina, el aspartato y el glutamato, el metabolismo de la D-glutamina y el D-glutamato, el metabolismo de la fenilalanina, el metabolismo del nitrógeno y el metabolismo de la tirosina. Varios géneros de bacterias, incluidos BF31, Alistipes, Faecalibacterium, Eggerthella y Anaeroplasma, se correlacionaron significativamente con el rendimiento del crecimiento y los metabolitos de la carne.
Conclusión: El heno de alfalfa mejoró el rendimiento del crecimiento y las características de la canal en los corderos. El heno de Leymus chinensis y el heno de alfalfa causaron diferentes deposiciones de metabolitos de la carne al modificar la comunidad bacteriana del rumen. Estos hallazgos serán beneficiosos para la futura utilización del forraje para el crecimiento de las ovejas, el rendimiento de la canal y la mejora de la calidad de la carne.
1. Introducción
El cordero es una de las carnes más consumidas en todo el mundo debido a su alto contenido en proteínas y bajo contenido de colesterol (1). Con la creciente demanda de carne de alta calidad, la calidad de la carne ha inducido cada vez más atención. Mejorar las dietas de los animales es una de las formas más efectivas de mejorar el rendimiento del crecimiento animal, las características de la canal y la calidad de la carne (2, 3). El forraje es una fuente de nutrientes necesaria para los rumiantes. En particular, los tipos y la calidad del forraje son factores clave que afectan a la productividad de los rumiantes, la composición de la canal, la microbiota ruminal y la calidad de la nutrición de la carne, como los aminoácidos, los ácidos grasos y los elementos minerales (4, 5).
Leymus chinensis, una especie perenne de gramíneas, está ampliamente distribuida en la estepa euroasiática, incluida la meseta oriental de Mongolia Interior y la llanura de Songnen en China (6). Leymus chinensis ha sido uno de los principales forrajes debido a su alto rendimiento, valores nutricionales apropiados y palatabilidad (7). Se ha reportado que la adición de heno de Leymus chinensis en la dieta para reemplazar parte del ensilado de maíz y el heno de alfalfa facilitó la mejora de la producción de leche, la producción de grasa y proteína láctea, y la concentración de grasa láctea (8). La mejora de la proporción de ensilado de Leymus chinensis disminuyó la degradabilidad de la materia seca y la fibra detergente neutra, pero promovió la degradabilidad de la proteína cruda en las combinaciones de ensilado de Leymus chinensis y ensilado de maíz en ganado vacuno (7). Además, la dieta de heno de Leymus chinensis aumentó el contenido de ácidos grasos C15:0 en la carne de cordero en comparación con la dieta de forraje mixto (5). Como la ganancia media diaria (GMD) de las ovejas fue mayor en el grupo de tratamiento con heno de Leymus chinensis, el heno de Leymus chinensis fue de mejor calidad para las ovejas que el tallo de Vigna radiata (9).
El heno de alfalfa es famoso por su alta calidad y se utiliza ampliamente como un importante forraje dietético para los rumiantes. La alimentación con heno de alfalfa aumentó el rendimiento del crecimiento en corderos, como el GMD, en comparación con las dietas de paja de trigo (10). La alimentación de las ovejas lactantes con heno de alfalfa promovió la producción de leche en comparación con las dietas de paja de trigo (10). Una mezcla de heno de alfalfa y rastrojo de maíz en una proporción de 60:40 optimizó el crecimiento y las características de la canal de los corderos (11). Además, el heno de alfalfa como ingrediente para complementar la dieta baja en energía aumentó los ácidos grasos omega-3 y redujo la proporción omega-6: omega-3 en la carne de cordero (12), lo que indica que la alfalfa afecta los metabolitos de la carne y la calidad nutricional.
El rumen es un ecosistema complejo que contiene una microbiota funcional responsable de la fermentación ruminal y un papel importante en la producción de sustancias nutritivas y calorías en los rumiantes (13, 14). La comunidad de bacterias ruminales está estrechamente correlacionada con las dietas (15). Curiosamente, la modificación de la dieta tiene un efecto en cascada sobre la microbiota ruminal, lo que afecta al rendimiento del crecimiento animal y a la calidad de la carne (15). Informes anteriores han revelado que varios forrajes tienen un gran efecto en la composición de la microbiota ruminal y fecal (16-18). Por ejemplo, los corderos alimentados con alfalfa tuvieron una mayor abundancia relativa de Akkermansia y Asteroleplasma que el grupo de tratamiento de mezcla de trébol púrpura de la pradera y alfalfa (18). La dieta de heno de alfalfa elevó la proporción de Prevotella y Selenomonas en comparación con la dieta de tallo de maíz, mientras que la alimentación con tallo de maíz aumentó la proporción de Thermoactimoyces, Bacillus, Papillibacter, Anaerotruncus y Streptomyces en comparación con el heno de Leymus chinensis o heno de alfalfa alimentado en vacas lecheras (19). También se han revelado asociaciones entre la comunidad bacteriana del rumen con la deposición de metabolitos. Por ejemplo, el Bacteroidales_UCG-001_norank se relacionó negativamente con los ácidos grasos, incluidos C18:2 y C20:4 en el longissimus dorsi (LD) de ovejas (20). Los aminoácidos, incluyendo isoleucina y glicina, se correlacionaron positivamente con Anaeroplasma y negativamente con Parabacteroides y Alloprevotella (21). Moryella se asoció positivamente con ácidos grasos como C16:0 y C18:1n9c, y negativamente con C20:4 n6, C20:3 n6 y C20:5 en el músculo lumbar de cordero (22). Moryella también mostró una relación positiva con los metabolitos de la carne, incluyendo L-carnosina, N-acetil-L-histidina, y negativamente relacionada con N-acetilaspartylglutamato, L-carnitina, L-citrulina y Pro-Glu (22). Por lo tanto, es importante caracterizar la relación entre las bacterias del rumen y los metabolitos de la carne.
Hasta donde sabemos, la comparación del rendimiento de crecimiento, las características de la canal y los metabolitos de la carne de ovejas alimentadas con heno de Leymus chinensis y heno de alfalfa sigue estando poco definida. Las alteraciones en la comunidad bacteriana del rumen y las interacciones entre bacterias y metabolitos también son escasas. La falta de una evaluación en profundidad puede afectar la aplicación de forrajes en la cría de rumiantes. Por lo tanto, este estudio se centró en investigar los efectos del heno de Leymus chinensis y el heno de alfalfa sobre el crecimiento y las características de la canal, la deposición de metabolitos de la carne y la comunidad bacteriana del rumen en corderos. Este estudio facilitará la evaluación del crecimiento y el rendimiento de la canal, así como de la calidad de la carne de las ovejas alimentadas con forrajes de diferentes tipos de forraje, y proporcionará una referencia importante para mejorar el crecimiento de los rumiantes y el rendimiento de la canal mediante la manipulación de dietas en el futuro.
2. Materiales y métodos
2.1. Animales y diseño experimental
El protocolo con animales de este estudio fue aprobado por el Comité de Cuidado y Uso de Animales de la Universidad de Mongolia Interior (Aprobación No. IMU-ovejas-2020-041).
Se compraron corderos machos sanos de Frisona Oriental × Han de cola pequeña de Inner Mongolia Lark Biotechnology Co., Ltd. Se seleccionaron catorce corderos con una edad media de 60 días y un peso corporal de unos 22,03 ± 1,08 kg. Los ensayos de alimentación se llevaron a cabo en la Base Nutricional de Ovejas de Carne de la Universidad de Mongolia Interior, donde cada cordero se alojó individualmente en los mismos corrales. Catorce corderos fueron asignados aleatoriamente a dos grupos de tratamiento dietético: un grupo fue alimentado con concentrado y heno de Leymus chinensis (grupo Lc); otro fue alimentado con concentrado y heno de alfalfa (Medicago sativa) (grupo Ms) con libre acceso al agua. El grupo Lc consumió alrededor de 325 g de concentrado y 803 g de heno de Leymus chinensis por oveja por día, mientras que el grupo Ms consumió alrededor de 325 g de concentrado y 925 g de heno de alfalfa por oveja por día. Los ingredientes y las composiciones químicas de las dietas se muestran en la Tabla Suplementaria S1. Antes del experimento, los corderos se aclimataron al medio ambiente durante aproximadamente 1 semana. El experimento duró 60 días. Al final del experimento, se seleccionaron los corderos para el sacrificio después de ayunar durante aproximadamente 12 h, y se recolectaron las muestras de LD y contenido ruminal. Las muestras musculares se recogieron con un bisturí desechable en el mismo lugar de la LD de cada cordero en tubos centrífugos libres de ARNasa de 50 ml y se almacenaron a -80 °C para el análisis de metabolitos. Después de abrir el rumen, el contenido del rumen se filtró utilizando 4 capas de gasa estéril, y el contenido del rumen se recolectó en un tubo de centrífuga libre de ARNasa de 50 ml y se almacenó a -80 °C para el análisis del amplicón de ADNr 16S.
2.2. Análisis químico del forraje (heno de Leymus chinensis y heno de alfalfa)
Se determinó la materia seca y las cenizas trituradas de las muestras de heno de Leymus chinensis y heno de alfalfa de acuerdo con Ran et al. (23). La proteína bruta, la fibra detergente ácida, la fibra detergente neutra y la grasa bruta en las muestras de heno de Leymus chinensis y heno de alfalfa se determinaron utilizando un analizador automático de proteína/nitrógeno Kjeldahl (K1160, Hanon Advanced Technology Group, China), un analizador automático de fibras (F2000, Hanon Advanced Technology Group, China) y un extractor automático Soxhlet (SOX606, Hanon Advanced Technology Group, China) respectivamente con referencia a Shi et al. (24). El contenido de elementos minerales se determinó utilizando microondas (REVO, LabTech, China) y un espectrómetro de emisión óptica de plasma acoplado inductivamente (PQ 9000, analytikjena, alemán) (25).
2.3. Determinación del crecimiento y del rendimiento de la canal y del índice de órganos
El peso corporal y el peso de la canal se midieron después del ayuno nocturno y la evisceración, respectivamente. El área del ojo de lomo entre las costillas 12 y 13 se trazó en papel de sulfato y se calculó (26). Porcentaje de aderezo = peso de la canal/peso corporal. Índice de órganos = peso de órganos/peso corporal (27). Peso total = peso corporal final (FBW) − peso corporal inicial (IBW). Ganancia media diaria (GMD) = ganancia total de peso/total de días. Relación alimento/ganancia (F/G) = ingesta media diaria de alimento (ADFI)/ADG.
2.4. Secuenciación del amplicón del ADNr 16S y análisis bioinformático
El contenido ruminal se recolectó y almacenó a -80 °C. El ADN microbiano se extrajo utilizando un kit TIANGEN. La región V3-V4 del gen bacteriano ADNr 16S se amplificó mediante PCR (95 °C durante 3 min, seguido de 30 ciclos a 95 °C durante 30 s, 50 °C durante 30 s, 72 °C durante 45 s y una extensión a 72 °C durante 10 min) utilizando el par de cebadores F3 (ACTCCTACGGGAGGCAGCAG) y R4 (GGACTACHVGGGTWTCTAAT) (28). Se agregó el kit de preparación de la biblioteca de ADN para Illumina siguiendo las recomendaciones del fabricante y se agregaron códigos de índice. La secuenciación de alto rendimiento se realizó utilizando la plataforma Illumina MiSeq PE300 para detectar los amplicones de ADNr 16S de acuerdo con los protocolos estándar.
Después de la secuenciación, las lecturas de extremos emparejados de la secuenciación se fusionaron mediante FLASH y las lecturas de baja calidad se filtraron mediante Trimmomatic. Se utilizó UPARSE para alinear las unidades taxonómicas operativas (OTU) con un 97% de identidad. La taxonomía se asignó a las OTU mediante la búsqueda en la versión 13.8 de la base de datos Greengenes. Las diversidades α y β se calcularon mediante QIIME2. Los biomarcadores con diferencias estadísticas se examinaron mediante el análisis de tamaño del efecto discriminante lineal (LEfSe), y los criterios de cribado fueron el umbral de LDA ≥4,0 y el valor de p <0,05. El análisis de redundancia (RDA) y el análisis de correlación de rangos de Spearman se realizaron utilizando los paquetes R: vegan y pheatmap, respectivamente.
2.5. Análisis metabolómico y bioinformático no dirigido
El análisis metabolómico no dirigido se hizo referencia al método anterior (29, 30). Brevemente, se mezclaron muestras de 200 mg de LD con metanol de 2-clorofenilalanina (4 ppm) (−20 °C) y se molieron con una trituradora de tejidos de alto rendimiento durante 90 s a 60 Hz. Las muestras se centrifugaron a 4°C durante 10 min a 12.000 rpm, y el sobrenadante se filtró a través de una membrana de 0,22 μm para obtener las muestras preparadas para LC-MS. Veinte microlitros de cada muestra se llevaron a las muestras de control de calidad, y el resto de las muestras se utilizaron para la detección de LC-MS.
La detección de LC-MS se comparó con el método anterior (31). La separación cromatográfica se llevó a cabo en un sistema Thermo Ultimate 3000 equipado con una columna ACQUITY UPLC HSS T3 mantenida a 40 °C. La temperatura del muestreador automático era de 8 °C. La elución en gradiente de analitos se realizó con ácido fórmico al 0,1% en agua (C) y ácido fórmico al 0,1% en acetonitrilo (D) o formiato de amonio 5 mM en agua (A) y acetonitrilo (B) a un caudal de 0,25 mL/min. La inyección de 2 μL de cada muestra se realizó después del equilibrio. Se utilizó un gradiente lineal creciente del disolvente B (v/v) de la siguiente manera: 0–1 min, 2% B/D; 1–9 min, 2%–50% B/D; 9–12 min, 50–98% B/D; 12-13,5 min, 98 % B/D; 13,5–14 min, 98 % B/D; 14-20 min, modelo D-positivo al 2% (modelo B negativo al 2-17 min, 14-17 min) (31).®
Los experimentos ESI-MSn se ejecutaron en el espectrómetro de masas Thermo Q Exactive Focus con una tensión de pulverización de 3,8 kV y −2,5 kV en modo positivo y negativo, respectivamente. El gas de vaina y el gas auxiliar se fijaron en 30 y 10 unidades arbitrarias, respectivamente. La temperatura de la columna capilar fue de 325°C. El analizador escaneó en un rango de masas de m/z 81–1.000 para un escaneo completo con una resolución de masas de 70.000. Los experimentos de MS/MS de adquisición dependiente de datos (ADD) se realizaron con un escaneo HCD. La energía de colisión normalizada fue de 30 eV. Los datos en bruto fueron convertidos al formato mzXML por Proteowizard (v3.0.8789), y luego procesados por el paquete MetaboAnalystR (32).
2.6. Análisis estadísticos
Para el análisis estadístico se utilizó GraphPad Prism. Los resultados del comportamiento del crecimiento, el comportamiento de la canal y el índice de órganos se presentan como medias ± error estándar (EE). Todos los datos se consideraron estadísticamente significativos con p < 0,05. La significación estadística del índice de órganos, el crecimiento y el rendimiento de la canal y los metabolitos se determinaron mediante la prueba t. La significación estadística de la diversidad de α se realizó con pruebas de Wilcoxon.
3. Resultados
3.1. Mejora de las características de crecimiento y canal en corderos alimentados con heno de alfalfa
Para investigar los efectos del heno de Leymus chinensis y el heno de alfalfa sobre el crecimiento y el rendimiento de la canal, primero comparamos el peso de la canal y el área del ojo de lomo entre los dos grupos. El IBW no fue significativamente distinto, mientras que el aumento de peso total, el FBW y el ADG fueron significativamente mayores en el grupo de Ms. El peso de la canal, el porcentaje de aderezo y el área del ojo de lomo también aumentaron obviamente en el grupo de Ms. Sin embargo, los corderos del grupo Ms. tuvieron un ADFI más alto. La F/G fue similar entre los dos grupos (Tabla 1). Además, se analizó el índice de órganos en corderos. El índice renal aumentó en el grupo de EM, mientras que otros como el bazo, el pulmón, el hígado y el índice cardíaco no se vieron afectados significativamente (Tabla 2). Estos datos indicaron que, en comparación con el heno de Leymus chinensis, el heno de alfalfa mejoró el crecimiento y las características de la canal en los corderos.
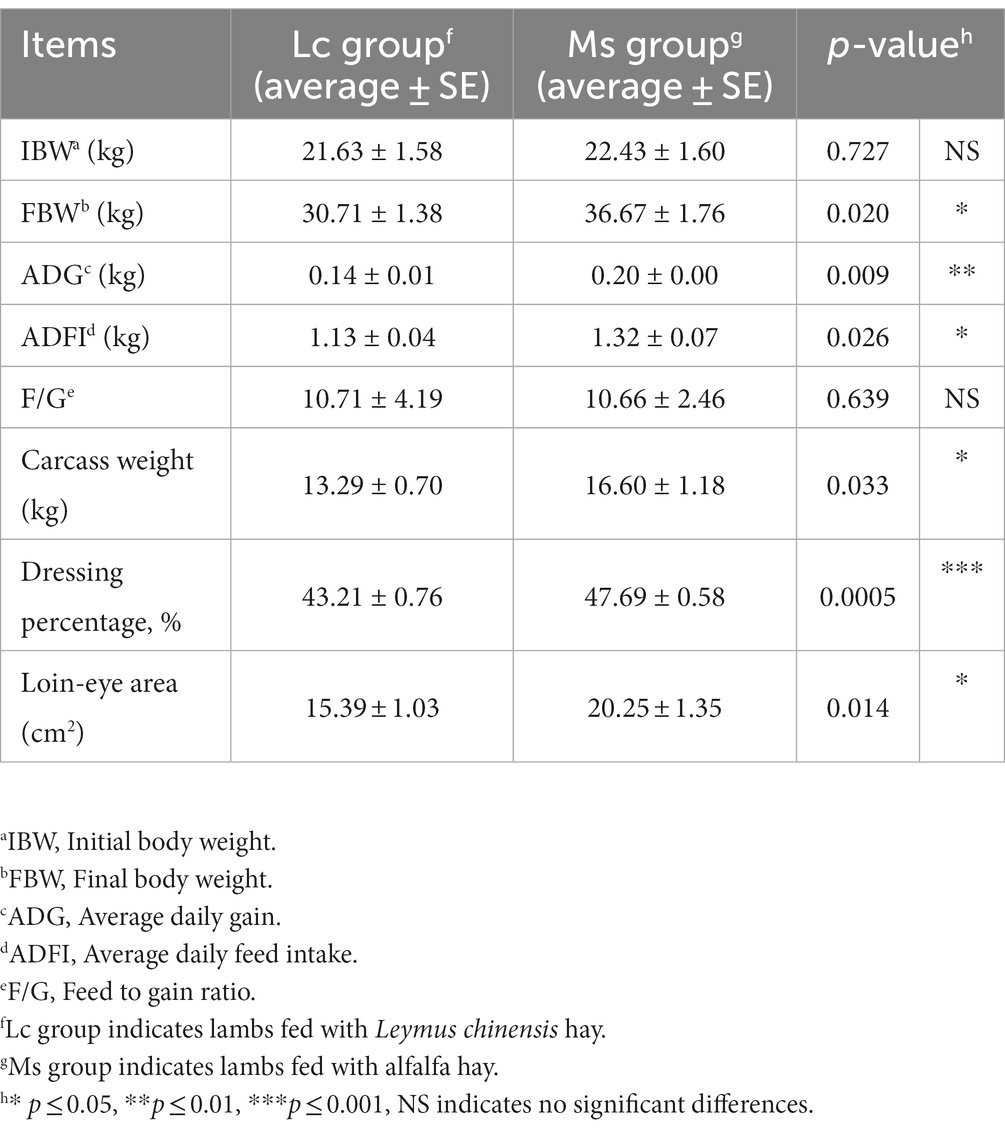 Tabla 1. Efectos del heno de Leymus chinensis y heno de alfalfa sobre el crecimiento y el rendimiento de la canal de las ovejas (n = 7).
Tabla 1. Efectos del heno de Leymus chinensis y heno de alfalfa sobre el crecimiento y el rendimiento de la canal de las ovejas (n = 7).
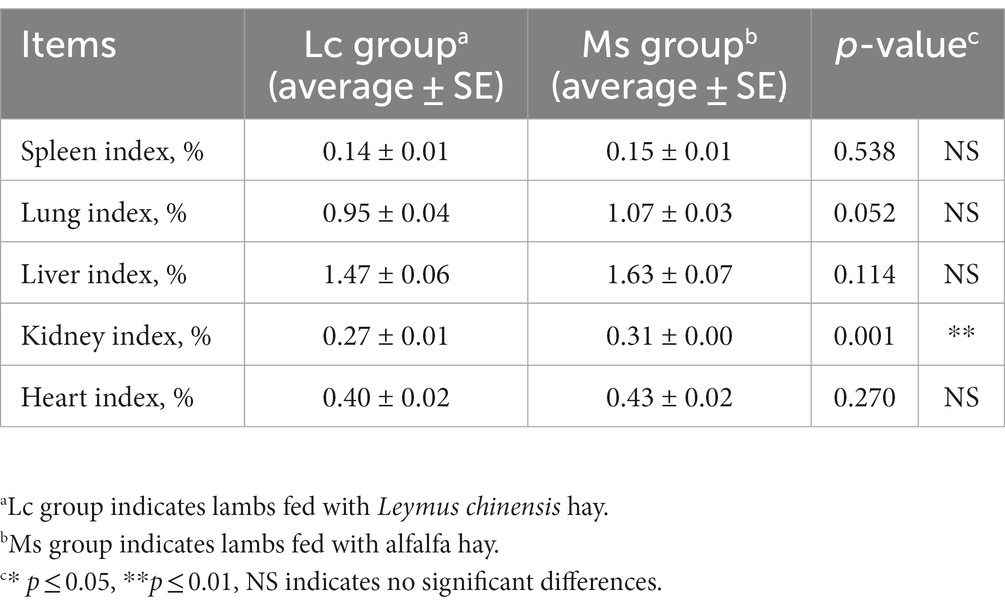 Tabla 2. Efectos del heno de Leymus chinensis y el heno de alfalfa sobre el índice de órganos (n = 7).
Tabla 2. Efectos del heno de Leymus chinensis y el heno de alfalfa sobre el índice de órganos (n = 7).
3.2. Alteraciones de la diversidad y composición bacteriana del rumen entre dos grupos
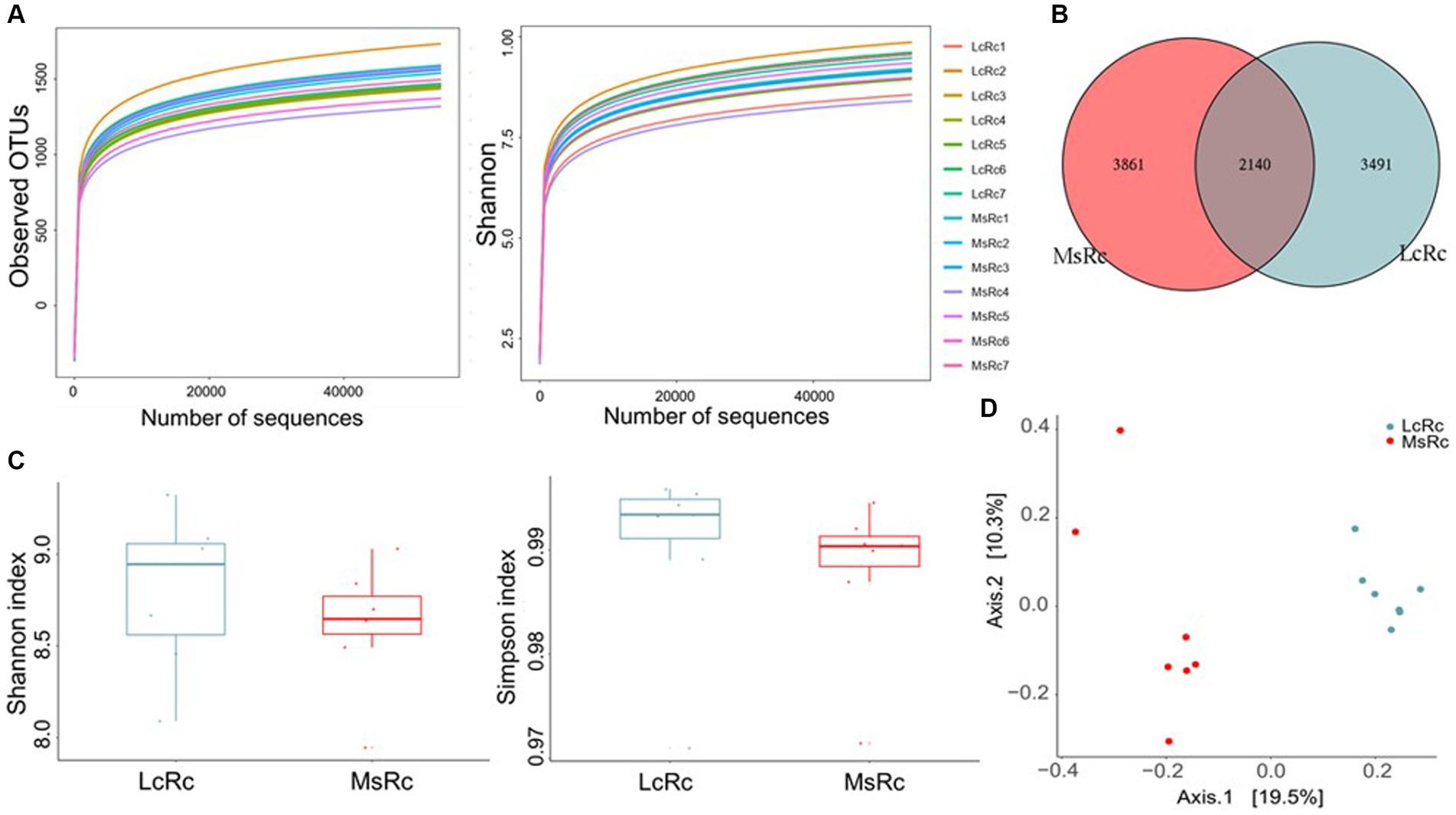
Para investigar los efectos del heno de Lemus chinensis y el heno de alfalfa sobre la microbiota ruminal, realizamos y analizamos la secuenciación bacteriana del ADNr 16S del contenido ruminal entre dos grupos. Las curvas de OTU y Shannon observadas alcanzaron la fase de saturación, lo que sugiere la profundidad de secuencia suficiente y confiable capturada en este estudio (Figura 1A). Se identificaron un total de 2.140 OTU en ambos grupos, entre las cuales se observaron 3.491 y 3.861 OTU específicas en los grupos Lc y Ms., respectivamente (Figura 1B). Los índices de Shannon y Simpson reflejaron la riqueza y diversidad de la comunidad bacteriana. No se observaron diferencias significativas en el índice de Shannon y Simpson entre los dos grupos (Figura 1C). La β-diversidad que se presenta como Análisis de Coordenadas Principales (PCoA), Escalamiento multidimensional no métrico (NMDS), Análisis de Componentes Principales (PCA) y Análisis de Discriminación de Mínimos Cuadrados Parciales (PLS-DA) se aplicó además para analizar la variación de la estructura bacteriana. El NMDS, el PCA y el PLS-DA se encuentran en la Figura Suplementaria S3. El contenido ruminal del grupo Lc (LcRc) formó una comunidad bacteriana ruminal diferente agrupada separadamente del contenido ruminal del grupo Ms (MsRc) (Figura 1D).
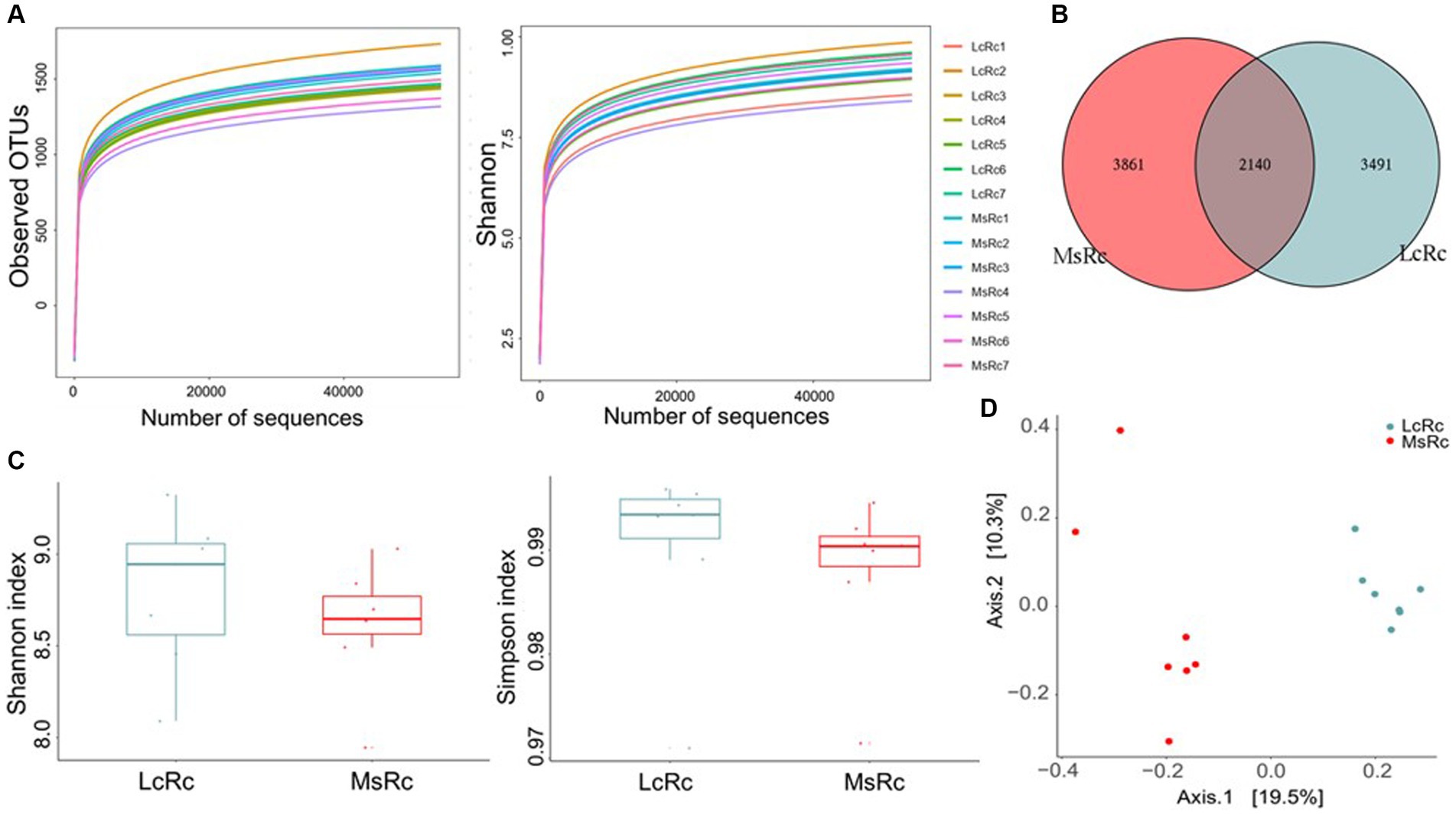 Figura 1. La diversidad de la microbiota ruminal de los corderos alimentados con heno de Lemus chinensis y heno de alfalfa. (A) OTUs observadas y curvas de Shannon de la microbiota ruminal. (B) El diagrama de Venn ilustra la superposición de OTU microbianas entre los dos grupos. (C) La α-diversidad incluye el índice de Shannon y Simpson. (D) La β-diversidad se presenta como PCoA. n = 7 en cada grupo. LcRc y MsRc indican el contenido ruminal de corderos alimentados con heno de Leymus chinensis y heno de alfalfa, respectivamente.
Figura 1. La diversidad de la microbiota ruminal de los corderos alimentados con heno de Lemus chinensis y heno de alfalfa. (A) OTUs observadas y curvas de Shannon de la microbiota ruminal. (B) El diagrama de Venn ilustra la superposición de OTU microbianas entre los dos grupos. (C) La α-diversidad incluye el índice de Shannon y Simpson. (D) La β-diversidad se presenta como PCoA. n = 7 en cada grupo. LcRc y MsRc indican el contenido ruminal de corderos alimentados con heno de Leymus chinensis y heno de alfalfa, respectivamente.
Para definir mejor la composición de la microbiota ruminal en el LcRc y el MsRc, se analizaron los porcentajes de abundancia de la comunidad bacteriana a nivel de filo y género. A nivel de filo, Bacteroidetes, Firmicutes, Spirochaetes y Fibrobacteres fueron los filos dominantes (Figura 2A). La abundancia relativa de Fibrobacteres, Bacteroidetes y Spirochaetes fue obviamente mayor en el grupo Lc (Tabla Suplementaria S2); la abundancia relativa de Firmicutes, Actinobacteria, Fusobacteria, Verrucomicrobia y Proteobacteria fue obviamente mayor en el MsRc (Tabla Suplementaria S2). A nivel de género, los 20 géneros principales estuvieron presentes con una abundancia relativamente alta (Figura 2B). Los 17 géneros se alteraron significativamente entre dos grupos, entre los cuales solo 5 géneros, es decir, Clostridiu, Fibrobacter, Selenomonas, BF311 y Treponema, fueron mayores en el LcRc. La mayoría de las bacterias alteradas en el MsRc, incluyendo Moryella, Blautia, p_75_a5, Faecalibacterium, Mogibacteriaceae, Anaerostipes, Bifidobacterium, Eggerthella y Collinsella pertenecen a Firmicutes y Actinobacteria (Tabla Suplementaria S3).
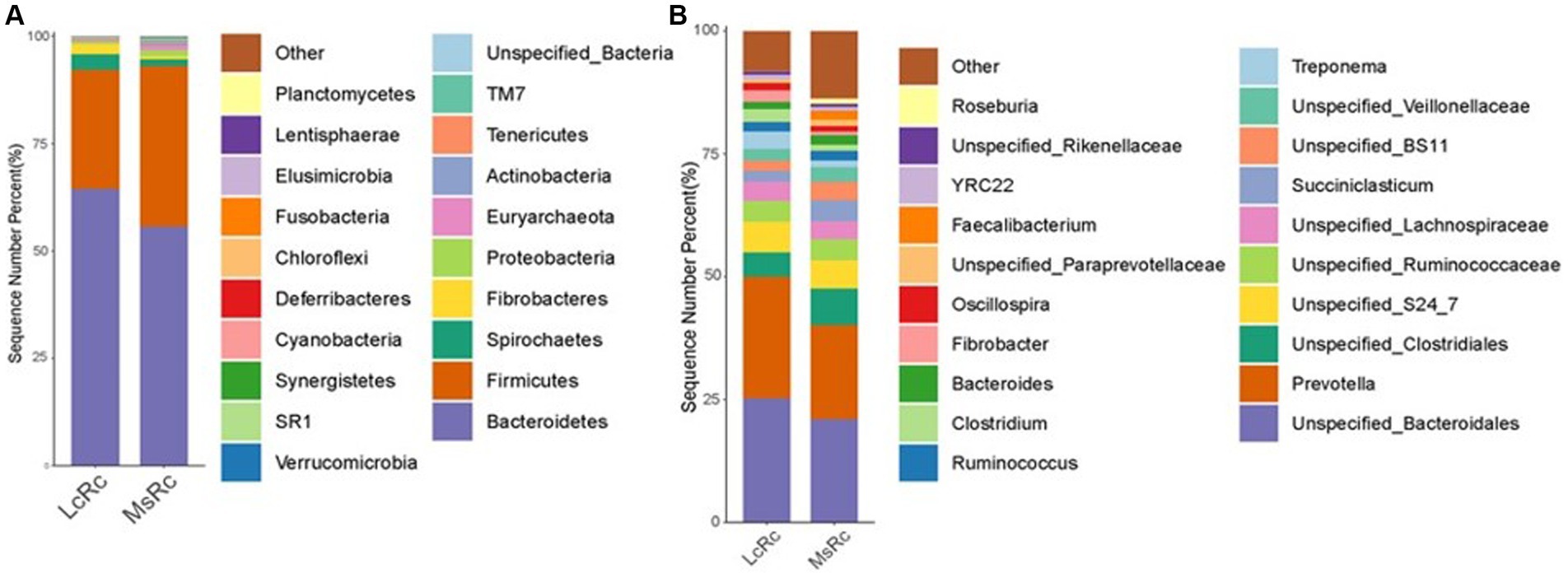 Figura 2. Composición de la microbiota ruminal de corderos alimentados con heno de Lemus chinensis y heno de alfalfa. Distribución taxonómica de las comunidades bacterianas ruminales de diferentes grupos a nivel de filo (A) y de género (B). LcRc y MsRc indican el contenido ruminal de corderos alimentados con heno de Leymus chinensis y heno de alfalfa, respectivamente. «p_» denota la clasificación a nivel de filo, «f_» denota la clasificación a nivel de filo y «g_» denota la clasificación a nivel de género.
Figura 2. Composición de la microbiota ruminal de corderos alimentados con heno de Lemus chinensis y heno de alfalfa. Distribución taxonómica de las comunidades bacterianas ruminales de diferentes grupos a nivel de filo (A) y de género (B). LcRc y MsRc indican el contenido ruminal de corderos alimentados con heno de Leymus chinensis y heno de alfalfa, respectivamente. «p_» denota la clasificación a nivel de filo, «f_» denota la clasificación a nivel de filo y «g_» denota la clasificación a nivel de género.
La composición bacteriana del rumen se comparó a través del análisis LEfSe con 4,0 como umbral en la puntuación LDA para identificar especies específicas en cada grupo. La constitución de las bacterias del rumen cambió entre LcRc y MsRc. Un total de 17 secuencias de taxones se enriquecieron en el LcRc y pertenecían principalmente a Fibrobacteres, Bacteroidetes y Spirochaetes (Figura 3). Un total de 7 bacterias ruminales pertenecientes principalmente a Firmicute fueron determinadas como enriquecidas en el MsRc (Figura 3). En conjunto, los corderos de los grupos Lc y Ms. tenían composiciones distintas de la comunidad bacteriana del rumen, lo que puede conducir a diferentes rendimientos de crecimiento, rendimiento de la canal y perfiles metabólicos.
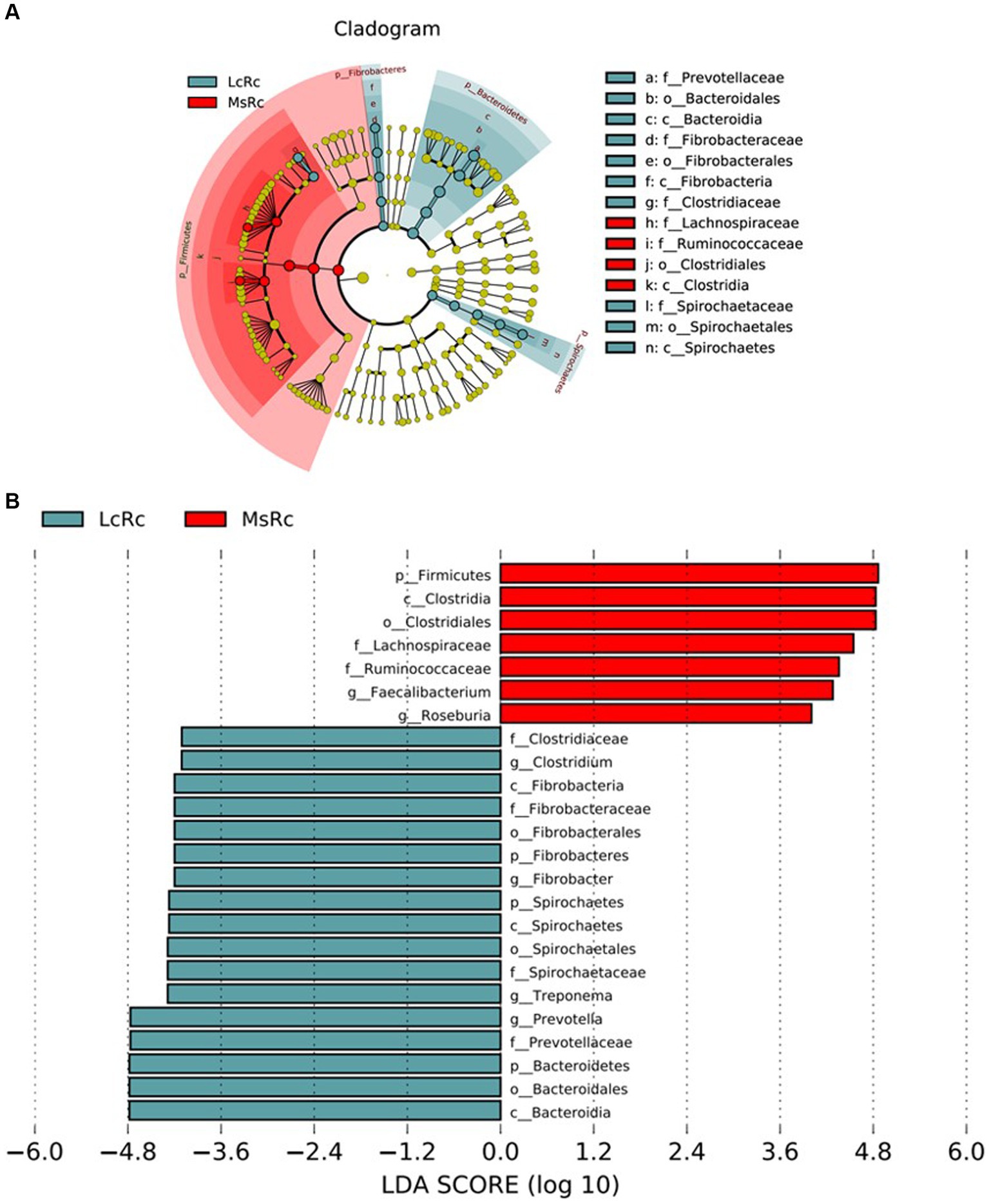 Figura 3. Efecto del heno de Lemus chinensis y el heno de alfalfa sobre la diversidad taxonómica de las bacterias del rumen. El cladograma (A) y el histograma (B) muestran taxones bacterianos ruminales con una puntuación de análisis discriminante lineal (LDA) >4.0 mediante análisis LEfSe. LcRc y MsRc indican el contenido ruminal de corderos alimentados con heno de Leymus chinensis y heno de alfalfa, respectivamente.
Figura 3. Efecto del heno de Lemus chinensis y el heno de alfalfa sobre la diversidad taxonómica de las bacterias del rumen. El cladograma (A) y el histograma (B) muestran taxones bacterianos ruminales con una puntuación de análisis discriminante lineal (LDA) >4.0 mediante análisis LEfSe. LcRc y MsRc indican el contenido ruminal de corderos alimentados con heno de Leymus chinensis y heno de alfalfa, respectivamente.
3.3. Microbiota ruminal clave asociada a la GMD, el peso de la canal y el peso corporal
Para investigar más a fondo la posible relación entre la variación de la microbiota ruminal y la GMD, el peso de la canal y el peso corporal, realizamos la RDA y la correlación de Spearman entre las bacterias ruminales diferenciales y los parámetros del huésped. De acuerdo con RDA, los tratamientos de heno de Lemus chinensis y heno de alfalfa fueron distintos y se observaron dos grupos diferentes. La GMD, el peso de la canal y el peso corporal mostraron una correlación significativa con la comunidad bacteriana (Figuras 4A, B). Los datos de correlación de Spearman mostraron que la abundancia relativa de BF311 y Pseudobutyrivibrio se relacionó negativamente con la GMD, el peso de la canal y el peso corporal (Figura 4C). Además, la mayoría de las bacterias a nivel de género, como Enterococcus, Lactobacillus, Acidaminococcus y Moryella pertenecientes a Firmicutes, mostraron una correlación fuertemente positiva con la GMD, el peso de la canal y el peso corporal (Figuras 4C). Alistipes pertenecientes a Bacteroidetes, Eggerthella y Bifidobacterium pertenecientes a Bacteroidetes, y Anaeroplasma pertenecientes a Tenericutes, también se asociaron positivamente con ADG, peso en canal y peso corporal (Figura 4C).
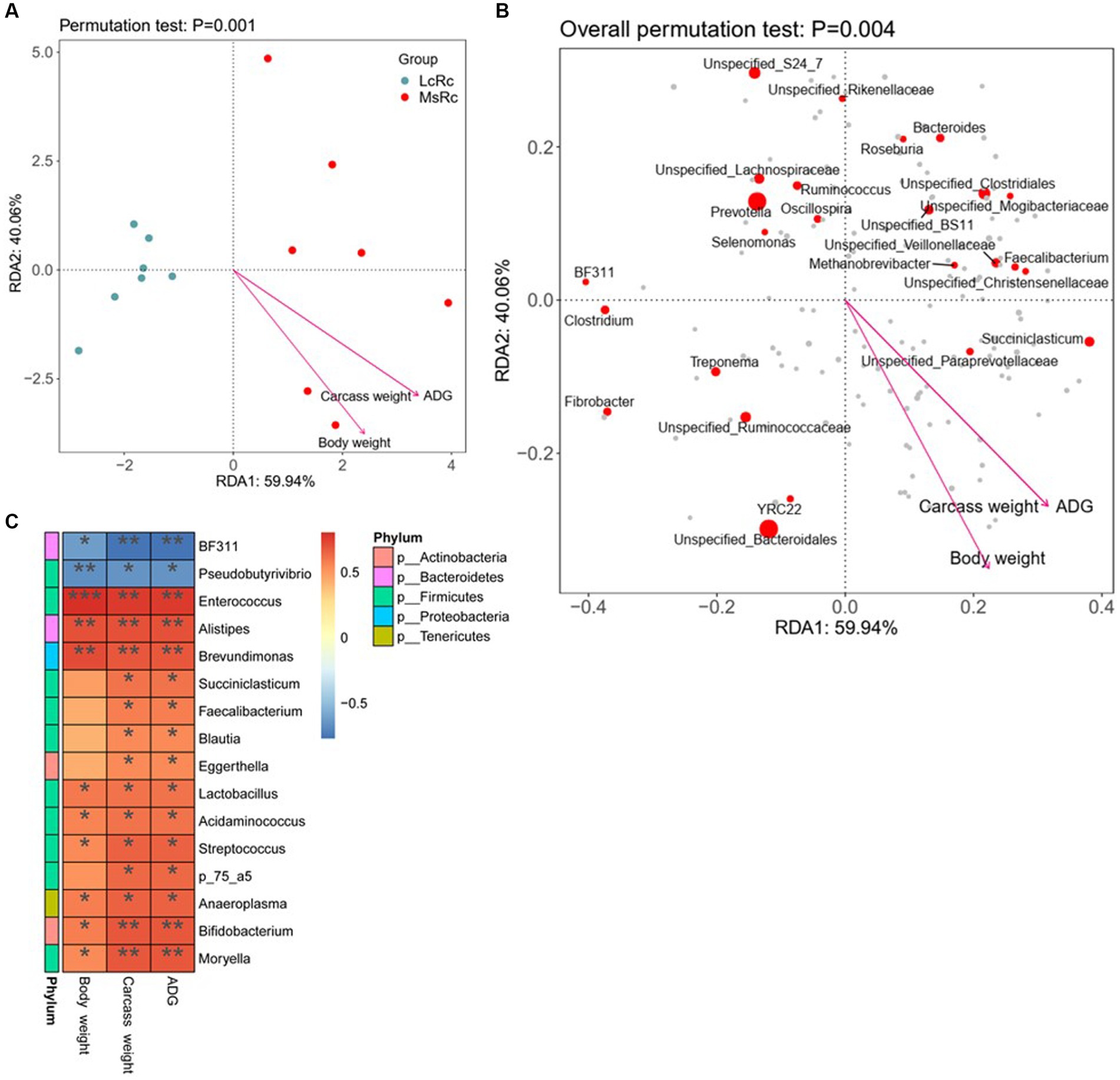 Figura 4. Relación entre las bacterias clave del rumen con la GMD, el peso de la canal y el peso corporal. (A,B) La RDA se realizó en el perfil taxonómico a nivel de género y en los parámetros del hospedador, incluyendo ADG, peso de la canal y peso corporal. Las flechas indican la correlación entre la estructura de la comunidad y los parámetros del anfitrión. (C) Análisis de correlación de la microbiota ruminal clave con la GMD, el peso de la canal y el peso corporal. La significación estadística se calculó mediante el análisis de correlación de Spearman. p ≤ 0,05, p ≤ 0,01, p ≤ 0,001.******
Figura 4. Relación entre las bacterias clave del rumen con la GMD, el peso de la canal y el peso corporal. (A,B) La RDA se realizó en el perfil taxonómico a nivel de género y en los parámetros del hospedador, incluyendo ADG, peso de la canal y peso corporal. Las flechas indican la correlación entre la estructura de la comunidad y los parámetros del anfitrión. (C) Análisis de correlación de la microbiota ruminal clave con la GMD, el peso de la canal y el peso corporal. La significación estadística se calculó mediante el análisis de correlación de Spearman. p ≤ 0,05, p ≤ 0,01, p ≤ 0,001.******
3.4. Perfiles metabolómicos de longissimus dorsi
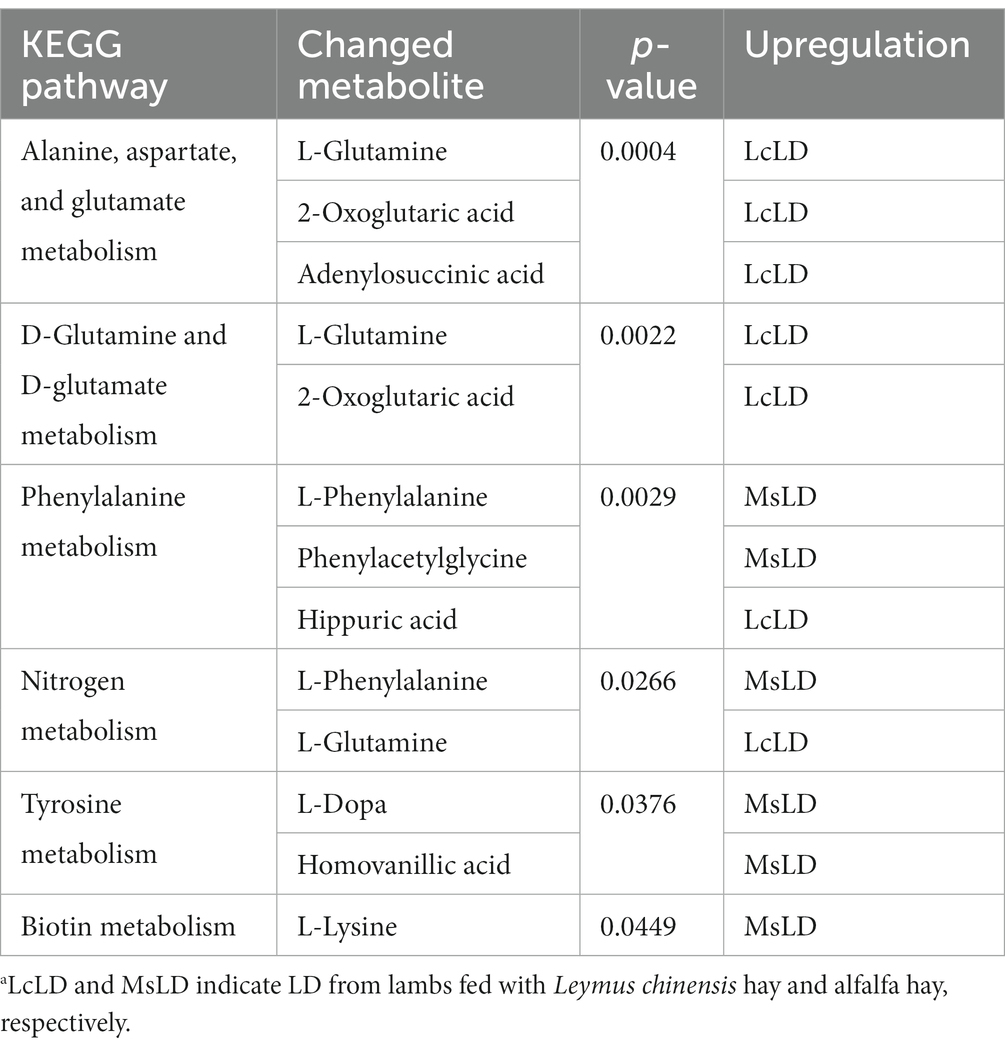
Para definir similitudes y diferencias entre la carne de cordero alimentada con heno de Leymus chinensis y heno de alfalfa, realizamos y analizamos los perfiles de metabolomas no dirigidos de las muestras de LD. Los gráficos de puntuación de PCA con modos de ionización positiva y negativa no revelaron una agrupación significativa de los dos grupos de tratamiento (Figura 5A), pero un análisis posterior reveló diferencias significativas en la composición de metabolitos. Estos metabolitos consistieron principalmente en péptidos, lípidos, ácidos orgánicos, esteroides, carbohidratos, ácidos nucleicos, vitaminas y cofactores, hormonas y transmisores (Figura 5B). Estas dos comparaciones identificaron 96 metabolitos diferenciales significativos (67 en el modo positivo y 29 en el modo negativo), entre los cuales 52 y 44 metabolitos diferenciales estaban elevados en los grupos Lc y Ms., respectivamente. En detalle, los ácidos orgánicos y sus derivados, como la N-acetil-L-leucina, la panteteína, la cisteínil glicina, la alanil tirosina y la Ala-Ile, fueron mayores en el grupo Ms longissimus dorsi (MsLD), mientras que la cinamoil glicina, el L-arginosuccinato y el Glu-Thr fueron mayores en el grupo Lc longissimus dorsi (LcLD). Los lípidos y las moléculas similares a los lípidos como la 2-metilbutiroilcarnitina, el ácido glicourodesoxicólico y el ácido 2-hidroximirístico fueron más altos en el LcLD, mientras que el ácido hexadecanediouc, la prostaglandina F2alfa y el ácido tetradecanodioico fueron más altos en el MsLD. Curiosamente, el LcLD contenía compuestos organoheterocíclicos más altos, como la momocrocolina, el ácido (+)-alfa-lipoico, el metil indol-3-acetato, los bencenoides, (es decir, el ácido hipúrico), los fenilpropanoides y los policétidos (es decir, el ácido 2-fenilpropiónico). La MsLD tenía una mayor abundancia relativa de alcaloides y derivados, incluido el éster metílico de ecgonina (Figuras 5C, D). Entre el heno de Leymus chinensis y el heno de alfalfa, los péptidos como Ala-Ile, Glu-Thr, N-acetil-Asp-Glu, gamma-glutamil-cisteína y gamma-glutamil-L-leucina, cambiaron significativamente (Figuras 5C, D). Además, basándonos en el análisis de la vía, encontramos que estos metabolitos diferenciales estaban enriquecidos principalmente en el metabolismo de la alanina, el aspartato y el glutamato, el metabolismo de la D-glutamina y el D-glutamato, el metabolismo de la fenilalanina, el metabolismo del nitrógeno y el metabolismo de la tirosina (Figuras 6A, B). Los metabolitos modificados en estas vías se mostraron en la Tabla 3, lo que indica que los diferentes forrajes afectaron la composición y el contenido de aminoácidos, y su metabolismo, lo que condujo a diversas cualidades nutricionales de la carne.
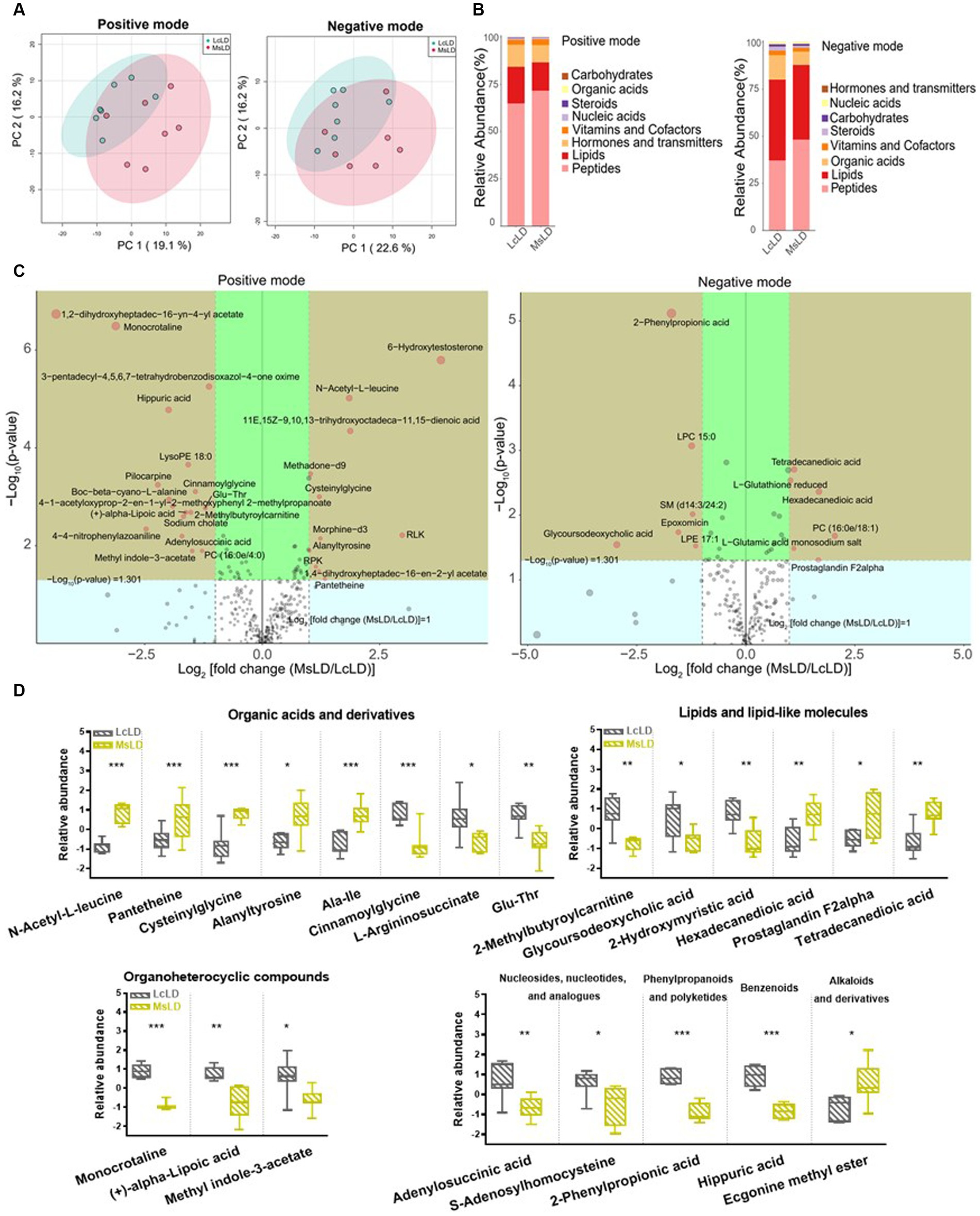 Figura 5. Efectos del heno de Lemus chinensis y el heno de alfalfa sobre los metabolitos de LD en corderos. (A) Diagramas de dispersión del modelo PCA basados en las características de los metabolitos identificados. (B) Composición de metabolitos en LcLD y MsLD. (C) Diagrama volcánico de metabolitos diferenciales entre LcLD y MsLD. (D) Diagrama de caja de metabolitos diferenciales seleccionados. n = 7 en cada grupo. p ≤ 0,05, p ≤ 0,01, p ≤ 0,001. LcLD y MsLD indican LD de corderos alimentados con heno de Leymus chinensis y heno de alfalfa, respectivamente.******
Figura 5. Efectos del heno de Lemus chinensis y el heno de alfalfa sobre los metabolitos de LD en corderos. (A) Diagramas de dispersión del modelo PCA basados en las características de los metabolitos identificados. (B) Composición de metabolitos en LcLD y MsLD. (C) Diagrama volcánico de metabolitos diferenciales entre LcLD y MsLD. (D) Diagrama de caja de metabolitos diferenciales seleccionados. n = 7 en cada grupo. p ≤ 0,05, p ≤ 0,01, p ≤ 0,001. LcLD y MsLD indican LD de corderos alimentados con heno de Leymus chinensis y heno de alfalfa, respectivamente.******
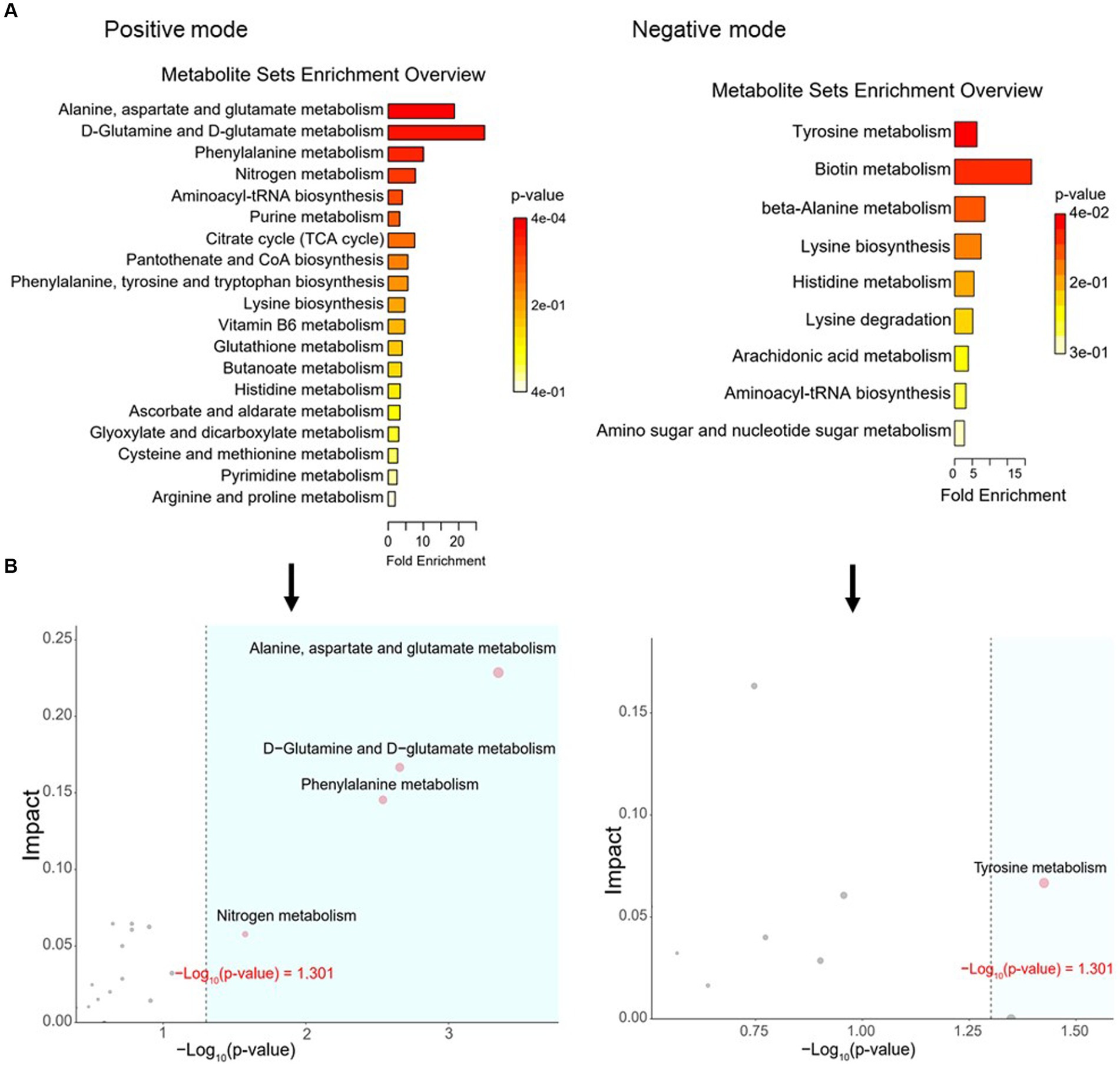 Figura 6. Análisis de vías de metabolitos diferenciales. (A) Vías KEGG enriquecidas de la comparación entre LcLD y MsLD. (B) Enriquecimiento de vías y análisis de topología.
Figura 6. Análisis de vías de metabolitos diferenciales. (A) Vías KEGG enriquecidas de la comparación entre LcLD y MsLD. (B) Enriquecimiento de vías y análisis de topología.
Para facilitar la identificación de posibles biomarcadores entre los dos grupos, se aplicaron PLS-DA y OPLS-DA para identificar las principales diferencias en los metabolitos. Los gráficos de puntuación PLS-DA mostraron la mejor separación de las muestras de LcLD y MsLD (Figura suplementaria S2A). Varios biomarcadores potenciales con VIP >2, como la monocrocolina, el ácido hipúrico, la 6-hidroxitestosterona, la N-acetil-L-leucina, LysoPE 18:0, Ala-Ile, la metadona-d9, la cisteinilglicina, la cinamoilglicina, la pilocarpina y el ácido 2-fenilpropiónico, se destacaron en los gráficos del volcán (Figura suplementaria S2B). Para minimizar el sobreajuste en el modelo PLS-DA, exploramos más a fondo los posibles marcadores utilizando OPLS-DA entre grupos. El análisis presentó un gráfico de puntuación con validación cruzada (R2X = 0,311, R2Y = 0,993, Q2 = 0,737, p-valor = 0,01) del modelo discriminante entre LcLD y MsLD en modo de ionización positiva. El gráfico de puntuación con validación cruzada (R2X = 0,454, R2Y = 0,995, Q2 = 0,526, valor p = 0,05) se mostró en modo de ionización negativa. Los biomarcadores identificados fueron los mismos que los identificados por PLS-DA con una tendencia a ser distintos entre los dos grupos (Figura suplementaria S3). Además, el bosque aleatorio mostró los principales metabolitos diferenciales, incluyendo N-acetil-L-leucina, ácido hipúrico, ácido (+)-alfa-lipoico y ácido 2-fenilpropiónico (Figura suplementaria S4).
Como se ha mencionado, se han aclarado los metabolitos diferenciales y los posibles biomarcadores. Se analizó más a fondo la correlación de los biomarcadores potenciales con el rendimiento del crecimiento. Un total de 30 metabolitos diferenciales se asociaron significativamente con la GMD, el peso de la canal y el peso corporal. Entre ellos, 14 metabolitos que incluyen N-acetil-L-leucina, metadona-d9, ácido hexadecanedioico y alaniltirosina se relacionaron positivamente con la GMD, el peso de la canal y el peso corporal. Dieciséis metabolitos como LysoPE 18:0, cinnamoilglicina y 2-metilbutiroilcarnitina mostraron una relación negativa con el rendimiento del crecimiento (Figura 7).
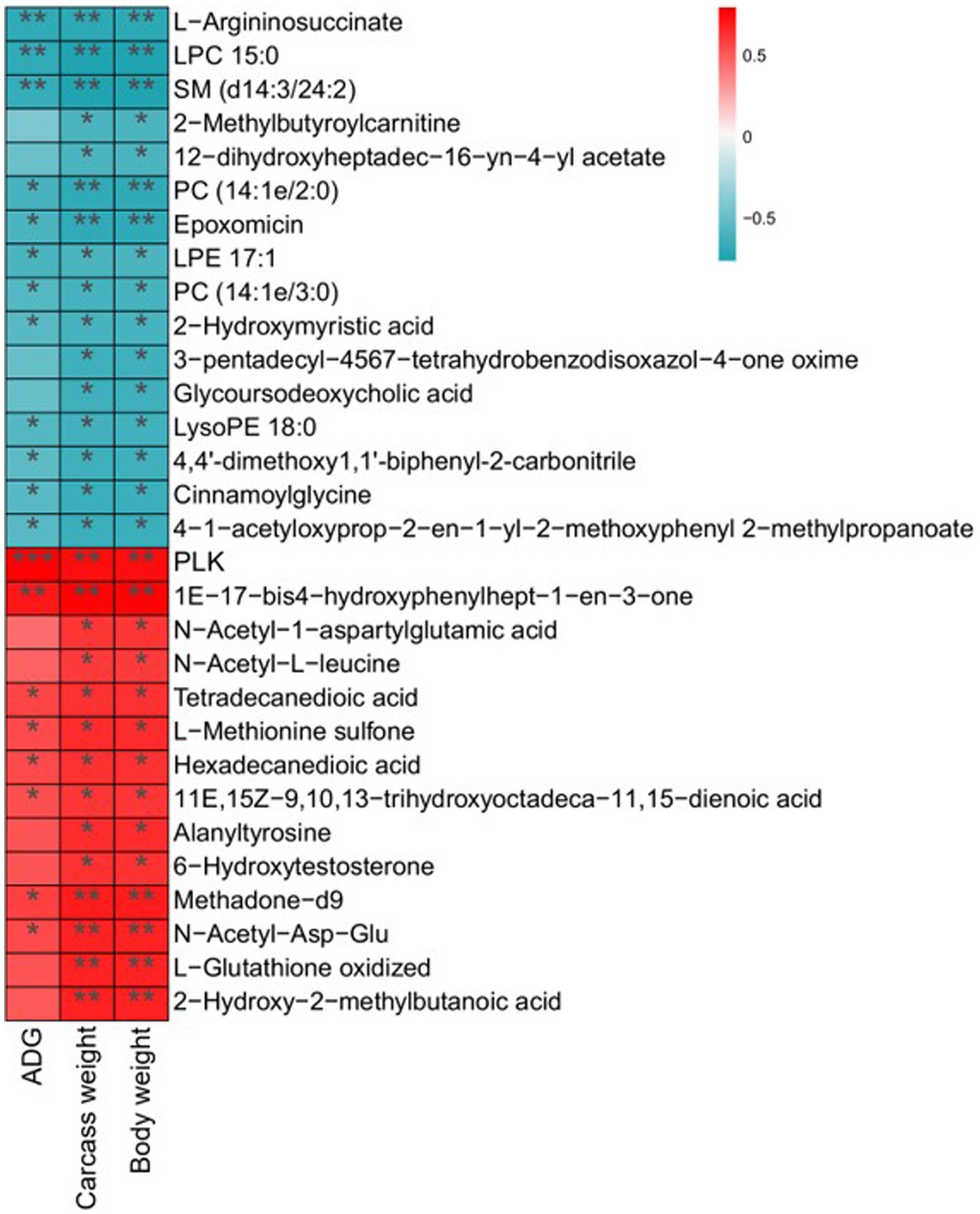 Figura 7. Análisis de correlación de metabolitos diferenciales con GMD, peso en canal y peso corporal. La significación estadística se calculó mediante el análisis de correlación de Spearman. p ≤ 0,05, p ≤ 0,01, p ≤ 0,001.******
Figura 7. Análisis de correlación de metabolitos diferenciales con GMD, peso en canal y peso corporal. La significación estadística se calculó mediante el análisis de correlación de Spearman. p ≤ 0,05, p ≤ 0,01, p ≤ 0,001.******
3.5. Correlación de la microbiota ruminal clave con metabolitos diferenciales
La secuenciación del ADNr 16S reveló que los corderos con el consumo de heno dietético de Leymus chinensis y heno de alfalfa presentaban comunidades de microbiota ruminal distintas. El análisis metabolómico indicó que la exposición al heno de Leymus chinensis y al heno de alfalfa dio lugar a diferentes perfiles metabólicos de LD. Por lo tanto, exploramos las correlaciones entre la microbiota ruminal y los metabolitos alterados de LD a través del análisis de correlación de Spearman, revelando altas correlaciones entre la microbiota ruminal clave con los metabolitos diferenciales (Figura 8). En detalle, Fibrobacter, Selenomonas, BF311, Treponema y Clostridium exhibieron una fuerte relación positiva con ácidos orgánicos y derivados como Glu-Thr, benzenoides como el ácido hipúrico, fenilpropanoides y policétidos como el ácido 2-fenilpropiónico, y compuestos organoheterocíclicos como el metil indol-3-acetato, la momocrotalina y el ácido (+)-alfa-lipoico. Y se asociaron negativamente con otros metabolitos diferenciales como Ala-Ile, N-acetil-L-leucina, ácido tetradecanedioico y metadona-d9. Otros géneros, como Bifidobacterium, Faecalibacterium, Blautia, Roseburia, Moryella, Streptococcus, [Ruminococcus] y Odoribacter, mostraron una tendencia de correlación obviamente opuesta con los cinco géneros mencionados anteriormente (Figura 8). Estos resultados indicaron que las composiciones bacterianas del rumen afectaron de manera obvia y específica a los metabolitos de LD del huésped.
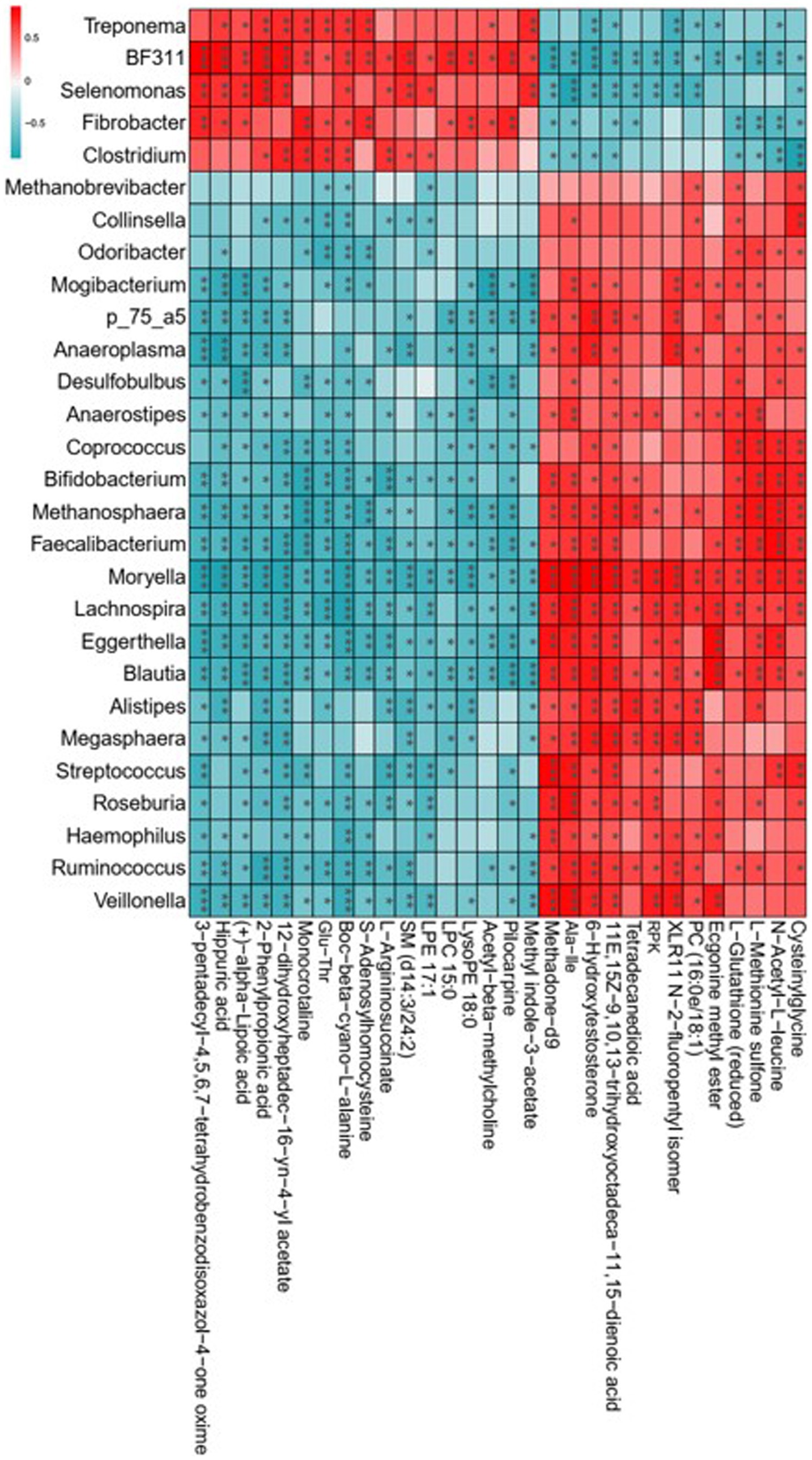 Figura 8. Análisis de correlación de la microbiota ruminal clave con metabolitos diferenciales. La significación estadística se calculó mediante el análisis de correlación de Spearman. p ≤ 0,05, p ≤ 0,01, p ≤ 0,001.******
Figura 8. Análisis de correlación de la microbiota ruminal clave con metabolitos diferenciales. La significación estadística se calculó mediante el análisis de correlación de Spearman. p ≤ 0,05, p ≤ 0,01, p ≤ 0,001.******
4. Discusión
El forraje es uno de los principales factores que afectan a la producción de rumiantes, la comunidad de microbiota ruminal y la calidad de la carne. Estudios previos exploraron las proporciones de varios forrajes como el heno de alfalfa, el heno de Leymus chinensis, el tallo de Vigna radiata y el tallo de maíz, que tuvieron un mayor efecto en los rumiantes (5, 9, 12). Hasta donde sabemos, pocos estudios han comparado sistemáticamente las características de crecimiento y canal de corderos alimentados con heno de Leymus chinensis y heno de alfalfa. En este estudio, encontramos que la alimentación con heno de alfalfa aumentó el peso de la canal de cordero, FBW, ADG, área de ojo de lomo y porcentaje de aderezo en comparación con los del grupo Lc, lo que respalda que aquellos corderos alimentados con heno de alfalfa exhibieron mejores características de canal y rendimiento de crecimiento.
La composición y diversidad de las bacterias del rumen exhiben una estrecha relación con el huésped. La dieta es uno de los factores clave que desencadena cambios en las comunidades microbianas del rumen, junto con diferentes factores ambientales (33). Para investigar los impactos del heno de Leymus chinensis y el heno de alfalfa en la comunidad bacteriana del rumen huésped, se realizó y analizó la secuenciación del amplicón del ADNr 16S. Obviamente, no hubo diferencias significativas en los índices de Shannon y Simpson en el LcRc y el MsRc. Esto indica que no hay alteraciones significativas en la diversidad de las bacterias del rumen.
Explorar los cambios en la microbiota ruminal, que están estrechamente relacionados con los metabolitos musculares, puede ayudar a investigar los mecanismos para mejorar la calidad de la carne de cordero en diferentes condiciones de forraje. A nivel de filo, Firmicutes y Bacteroidetes fueron los principales filos bacterianos en el rumen como se informó (20, 22), cuyas abundancias relativas fueron significativamente distintas en LcRc y MsRc. Los firmicutes son dominantes en todas las comunidades bacterianas del rumen y consisten en varios géneros bacterianos fibrolíticos y celulolíticos (34). Los bacteroidetes son beneficiosos para digerir los carbohidratos (35). A continuación, analizamos las diferencias en las bacterias clave del rumen a nivel de género entre los dos grupos y su correlación con la deposición de metabolitos en la LD. Los bacteroides no especificados y Prevotella fueron los géneros bacterianos dominantes en ambos grupos. Con base en el análisis LEfSe, los corderos del grupo Lc tienen una mayor abundancia relativa de Prevotella, que desempeña un papel importante en el metabolismo de polisacáridos y proteínas, y en la utilización de hemicelulosas (20). Fibrobacter también fue mayor en la LcRc, que es una bacteria celulolítica en el rumen de los rumiantes (36). Esto puede estar relacionado con la mayor ingesta de fibra de los corderos en el grupo Lc, mientras que encontramos que regulan positivamente los niveles de Glu-Thr en la LD. Los dipéptidos son importantes precursores del sabor en la carne de cordero (37), lo que sugiere que los microorganismos del rumen pueden influir en la calidad de la carne de cordero al regular las sustancias de sabor en el músculo después de alimentar con heno de Leymus chinensis. Se ha reportado que Fibrobacter fue capaz de sintetizar oligosacáridos y contribuyó a adaptarse rápidamente a cambios ambientales repentinos (33). Además, tres géneros pertenecientes principalmente a las bacterias fibrolíticas, como Selenomonas, BF311 y Treponema, estaban obviamente elevados en el LcRc. Treponema está estrechamente relacionado con los tratamientos con pectina debido a su capacidad para degradar la pectina, que comparte interacción mutua con Fibrobacter (33, 38). Las selenomonas pueden oxidar el lactato y producir ácido propiónico como principal producto de fermentación (39). Y la correlación entre estas tres bacterias fibrolíticas y los niveles de metabolitos de la LD tuvo la misma tendencia que Fibrobacter, lo que sugiere que pueden tener el mismo mecanismo de acción. La mayoría de las bacterias diferenciales significativas, como Bifidobacterium, Faecalibacterium, Mogibacterium, Anaerostipes, Alistipes y Blautia, estaban elevadas en el MsRc. Un estudio previo ha demostrado que Bifidobacterium es una bacteria sacarolítica que puede generar acetato y lactato (10). Faecalibacterium es una de las bacterias productoras de butirato relacionadas con un mayor aumento de peso y muestra acción antiinflamatoria (40). Anaerostipes también es una bacteria productora de butirato (41). En el presente estudio también se encontró que la abundancia relativa de Faecalibacterium se correlacionó positivamente con el peso corporal y el peso de la canal. Los cambios en Mogibacterium se asocian con la eficiencia alimenticia en rumiantes (42). Además, se ha demostrado que Blautia mejora los efectos antiinflamatorios beneficiosos de los huéspedes (43). Estos resultados sugirieron que el heno de alfalfa puede haber alterado la eficiencia alimenticia, influido en la producción de ácidos grasos volátiles y también facilitado la resistencia ruminal a la inflamación. En conjunto, los tipos de forraje, es decir, heno de Leymus chinensis y heno de alfalfa, dieron lugar a diferentes composiciones bacterianas ruminales de corderos.
La composición de los metabolitos de los nutrientes tiene un impacto directo en la calidad de la carne (44). Por lo tanto, los perfiles metabólicos de la carne despertaron una gran preocupación pública. Los aminoácidos son ingredientes importantes para el valor nutricional del cordero (45). De acuerdo con el análisis de la metabolómica no dirigida, encontramos diferencias significativas en los metabolitos relacionados con los aminoácidos en la carne entre los grupos Lc y Ms. Algunos metabolismos de aminoácidos, incluyendo el metabolismo de la alanina, el aspartato y el glutamato, el metabolismo de la fenilalanina, el metabolismo de la D-glutamina y el D-glutamato, y el metabolismo de la tirosina fueron cambiados, lo que sugiere que los forrajes regulaban el contenido de aminoácidos y el metabolismo, y por lo tanto afectaban la calidad nutricional de la carne. Los aminoácidos libres y los dipéptidos son importantes precursores del sabor en la carne (37). Es importante destacar que algunos péptidos tienen propiedades bioactivas (37). La cisteinilglicina perteneciente al dipéptido es un componente estructural del glutatión (46), que fue mayor en el MsLD. Entre el tratamiento con heno de Leymus chinensis y heno de alfalfa, los péptidos como Ala-Ile, Glu-Thr, N-acetil-Asp-Glu, gamma-glutamil-cisteína y gamma-glutamil-L-leucina cambiaron significativamente. El péptido gamma-glutamil, gamma-glutamil-L-leucina, ha sido reconocido como una molécula que imparte kokumi (47). Otro péptido gamma-glutamil, la gamma-glutamil-cisteína, puede activar el receptor sensible al calcio y luego impartir las respuestas inducidas por el péptido kokumi (48).
Los microorganismos del rumen proporcionan energía para el metabolismo muscular al huésped principalmente en forma de ácidos grasos volátiles (49). La alimentación con heno de Leymus chinensis y heno de alfalfa no solo alteró los sustratos disponibles para la fermentación ruminal, sino que también puede haber alterado la distribución de varios ácidos grasos en el rumen, afectando así a la composición de la microbiota ruminal y a los niveles de metabolitos musculares LD (50). Por ejemplo, Du et al. (51) encontraron que Ruminiclostridium_6 y U29-B03 podrían estar participando en el metabolismo de los carbohidratos para producir ácidos grasos volátiles, que promueven la deposición de IMF afectando la sensibilidad en los músculos. Los cambios significativos en la abundancia relativa de las bacterias asociadas en los grupos Lc y Ms. en el presente estudio pueden causar alteraciones en los niveles de metabolitos en el músculo a través de la vía de los ácidos grasos volátiles. Sin embargo, se necesitaría más investigación para revelar la conexión entre diferentes forrajes y cambios en la microbiota ruminal y los metabolitos musculares.
5. Conclusión
En comparación con los corderos con la dieta de heno de Leymus chinensis, los corderos alimentados con heno de alfalfa mostraron un mejor rendimiento de crecimiento y rendimiento de la canal. El heno de Leymus chinensis condujo al enriquecimiento de los géneros Fibrobacter, Treponema, Selenomonas y BF311. El heno de alfalfa condujo al enriquecimiento de Blautia, Anaerostipes, Faecelibacterium, Alistipes, Bifidobacterium y otros géneros. Las bacterias ruminales después de la alimentación con diferentes forrajes afectan la calidad de la carne de cordero al influir en el metabolismo de varios aminoácidos y polipéptidos en la carne de cordero. También se demostró que el metabolismo de la alanina, el aspartato y el glutamato, el metabolismo de la D-glutamina y el D-glutamato, el metabolismo de la fenilalanina, el metabolismo del nitrógeno y el metabolismo de la tirosina fueron las vías metabólicas clave involucradas después de alimentar con heno de Leymus chinensis y heno de alfalfa. Además, el análisis conjunto de los microbios del rumen y la metabolómica indicaron una estrecha relación entre la composición microbiana del rumen y los metabolitos musculares. Estos resultados tienen una importancia importante para la futura utilización adecuada y racional de los pastos para mejorar la calidad de la carne de cordero.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres de los repositorios y los números de acceso se pueden encontrar en: https://www.ncbi.nlm.nih.gov/bioproject; PRJNA995904.
Declaración ética
El estudio en animales fue aprobado por el Comité de Cuidado y Uso de Animales de la Universidad de Mongolia Interior (Aprobación No. IMU-ovejas-2020-041). El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
HW: Escritura – borrador original. LiM: Curación de datos, redacción, revisión y edición. LaM: Redacción – revisión y edición, curación de datos.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este trabajo contó con el apoyo del Departamento de Ciencia y Tecnología de la Región Autónoma de Mongolia Interior (zdzx2018016 y zdzx2018065) y el equipo innovador de talentos de Grassland de la Región Autónoma de Mongolia Interior de China (12000-12102621).
Reconocimientos
Expresamos nuestra gratitud a los investigadores diligentes y comprometidos de nuestros laboratorios por su inquebrantable dedicación y arduo trabajo. Además, extendemos nuestro sincero agradecimiento a todas las personas que han contribuido a la realización de esta tesis.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1256903/full#supplementary-material
Abreviaturas
Lc, Leymus chinensis; Ms, Medicago sativa; LD, Longissimus dorsi; OTUs, Unidades taxonómicas operativas; ADG, Ganancia media diaria; FBW: Peso corporal final; IBW: Peso corporal inicial; F/G, relación entre el avance y la ganancia; ADFI, Ingesta media diaria de alimento.
Referencias
1. Wang, B, Ma, T, Deng, KD, Jiang, CG y Diao, QY. Efecto de la suplementación con urea sobre el rendimiento y la seguridad en dietas de ovejas cruzadas Dorper. J Anim Physiol Anim Nutr. (2016) 100:902–10. doi: 10.1111/jpn.12417
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Qin, X, Zhang, T, Cao, Y, Deng, B, Zhang, J y Zhao, J. Efectos de la suplementación con orujo de espino amarillo en la dieta sobre la masa muscular esquelética y la calidad de la carne en corderos. Ciencia de la carne. (2020) 166:108141. doi: 10.1016/j.meatsci.2020.108141
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Knight, MI, Butler, KL, Linden, NP, Burnett, VF, Ball, AJ, McDonagh, MB, et al. Comprender el impacto del valor genético del rendimiento de la carne magra de los toros en la composición de la canal, la calidad de la carne, el contenido de nutrientes y minerales del cordero australiano. Ciencia de la carne. (2020) 170:108236. doi: 10.1016/j.meatsci.2020.108236
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Sun, HX, Zhong, RZ, Liu, HW, Wang, ML, Sun, JY y Zhou, DW. Calidad de la carne, composición de ácidos grasos de los tejidos y contenido gastrointestinal, y estado antioxidante de la semilla de cordero alimentado con una halófita (Suaeda glauca). Ciencia de la carne. (2015) 100:10–6. doi: 10.1016/j.meatsci.2014.09.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Zhang, XQ, Jiang, C, Jin, YM, Li, P y Zhong, JF. El efecto de la sustitución de heno de hierba mixta con heno de Urtica cannabina y/o heno de Leymus chinensis sobre el perfil bioquímico de la sangre, las características de la canal y la composición de ácidos grasos intramusculares en corderos de engorde. Anim Feed Sci Technol. (2021) 272:114780. doi: 10.1016/j.anifeedsci.2020.114780
6. Chen, S, Huang, X, Yan, X, Liang, Y, Wang, Y, Li, X, et al. Análisis del transcriptoma en pasto oveja (Leymus chinensis): gramínea perenne dominante de la estepa euroasiática. PLoS Uno. (2013) 8:E67974. doi: 10.1371/journal.pone.0067974
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Zhang, X, Wang, H, You, W, Zhao, H, Wei, C, Jin, Q, et al. Degradabilidad in vitro del ensilado de maíz y el ensilado de Leymus chinensis y evaluación de sus proporciones mixtas en el rendimiento, la digestión y los parámetros séricos en el ganado vacuno. J Anim Physiol Anim Nutr. (2020) 104:1628–36. doi: 10.1111/jpn.13392
8. Yan, R, Chen, S, Zhang, X, Han, J, Zhang, Y y Undersander, D. Comunicación breve: efectos de la sustitución de parte del ensilado de maíz y heno de alfalfa por heno de Leymus chinensis en la producción y composición de la leche. J Lácteos Sci. (2011) 94:3605–8. doi: 10.3168/jds.2010-3536
9. Yang, Z, Wang, Y, Yuan, X, Wang, L y Wang, D. La ingesta de forraje y el aumento de peso de las ovejas se ven afectados por las mezclas de forraje durante el invierno en el noreste de China. Anim Sci J. (2017) 88:1058–65. doi: 10.1111/asj.12747
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Obeidat, BS, Subih, HS, Taylor, JB y Obeidat, MD. El heno de alfalfa mejora el rendimiento de lactancia de las ovejas Awassi y el rendimiento de los corderos en crecimiento cuando se utiliza como fuente de forraje en comparación con la paja de trigo. Trop Anim Salud Prod. (2019) 51:581–8. DOI: 10.1007/S11250-018-1735-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Sun, L, Yin, Q, Gentu, G, Xue, YL, Hou, ML, Liu, LY, et al. La alimentación con mezclas forrajeras de heno de alfalfa y rastrojo de maíz optimiza el rendimiento del crecimiento y las características de la canal de los corderos. Anim Sci J. (2018) 89:359–66. doi: 10.1111/asj.12928
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Ponnampalam, EN, Dunshea, FR, y Warner, RD. Uso de heno de alfalfa en alimentos para rumiantes para mejorar la productividad animal, el valor nutricional de la carne y la conservación de la carne en un clima más variable. Ciencia de la carne. (2020) 170:108235. doi: 10.1016/j.meatsci.2020.108235
13. Morgavi, DP, Rathahao-Paris, E, Popova, M, Boccard, J, Nielsen, KF y Boudra, H. Las comunidades microbianas del rumen influyen en los fenotipos metabólicos de los corderos. Microbiol frontal. (2015) 6:1060. doi: 10.3389/fmicb.2015.01060
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Vasta, V, Yáñez-Ruiz, DR, Mele, M, Serra, A, Luciano, G, Lanza, M, et al. Comunidades bacterianas y protozoarias y perfil de ácidos grasos en el rumen de ovejas alimentadas con una dieta que contenía taninos añadidos. Appl Environ Microbiol. (2010) 76:2549–55. doi: 10.1128/AEM.02583-09
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Zened, A, Combes, S, Cauquil, L, Mariette, J, Klopp, C, Bouchez, O, et al. La ecología microbiana del rumen evaluada por 454 Gs Flx La pirosecuenciación se ve afectada por la suplementación con almidón y aceite de las dietas. FEMS Microbiol Ecol. (2013) 83:504–14. doi: 10.1111/1574-6941.12011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Petri, RM, Forster, RJ, Yang, W, McKinnon, JJ y McAllister, TA. Caracterización de la diversidad bacteriana ruminal y parámetros de fermentación en bovinos alimentados con concentrado con y sin forraje. J Appl Microbiol. (2012) 112:1152–62. doi: 10.1111/j.1365-2672.2012.05295.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Huws, SA, Lee, MRF, Muetzel, SM, Scott, MB, Wallace, RJ y Scollan, ND. El tipo de forraje y el aceite de pescado causan cambios en la diversidad bacteriana del rumen. FEMS Microbiol Ecol. (2010) 73:396–407. doi: 10.1111/j.1574-6941.2010.00892.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Huang, QQ, Holman, DB, Alexander, T, Hu, TM, Jin, L, Xu, ZJ, et al. Microbiota fecal de corderos alimentados con trébol morado de la pradera (Dalea purpurea vent.) y alfalfa (Medicago sativa). Arch Microbiol. (2018) 200:137–45. doi: 10.1007/s00203-017-1427-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Zhang, RY, Zhu, WY, Zhu, W, Liu, JX y Mao, SY. Efecto de las fuentes de forraje de la dieta sobre la microbiota ruminal, la fermentación ruminal y las aminas biógenas en vacas lecheras. J Sci Food Agr. (2014) 94:1886–95. doi: 10.1002/jsfa.6508
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Wang, B, Luo, Y, Wang, Y, Wang, D, Hou, Y, Yao, D, et al. Composición de bacterias ruminales y ácidos grasos de la carne de ovejas Sunit criadas bajo diferentes regímenes de alimentación en China. J Sci Food Agric. (2021) 101:1100–10. doi: 10.1002/jsfa.10720
21. Qu, W, Nie, C, Zhao, J, Ou, X, Zhang, Y, Yang, S, et al. Análisis de la metabolómica del microbioma de los efectos del consumo a largo plazo de productos finales de glicación avanzada en la dieta sobre la microbiota fecal y los metabolitos de ratón C57bl/6. J Agric Food Chem. (2018) 66:8864–75. doi: 10.1021/acs.jafc.8b01466
22. Wang, B, Wang, Y, Zuo, S, Peng, S, Wang, Z, Zhang, Y, et al. El perfil metabolómico no dirigido y dirigido del músculo revela una mejor calidad de la carne en corderos bronceados de pastoreo artificial a través de la reprogramación de la comunidad bacteriana del rumen. J Agric Food Chem. (2021) 69:846–58. doi: 10.1021/acs.jafc.0c06427
23. Ran, T, Saleem, AM, Beauchemin, KA, Penner, GB y Yang, W. Índice de procesamiento del grano de cebada y detergente neutro no digerido en la dieta La concentración de fibra afectó el comportamiento de masticación, el pH ruminal y la digestibilidad total de los nutrientes del tracto de las novillas alimentadas con una dieta alta en granos. J Anim Sci. (2021) 99:skab011. doi: 10.1093/jas/skab011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Shi, B, He, W, Su, G, Xu, X y Shan, A. El efecto de aumentar el nivel de fibra del detergente neutro a través de diferentes ingredientes de fibra a lo largo de la gestación de las cerdas. Animales. (2021) 11:415. doi: 10.3390/ani11020415
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Rubio-Armendáriz, C, Gutiérrez, ÁJ, Gomes-Furtado, V, González-Weller, D, Revert, C, Hardisson, A, et al. Metales esenciales y oligoelementos de los cereales y sus derivados comercializados y consumidos en Cabo Verde. Biol Trace Elem Res. (2023) 201:444–54. doi: 10.1007/s12011-022-03158-x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Xiang, J, Zhong, L, Luo, H, Meng, L, Dong, Y, Qi, Z, et al. Un análisis comparativo de las características de la canal y la carne, y las bacterias del rumen entre las ovejas mongolas chinas y las ovejas mestizas de Dorper × mongolas chinas. Animal. (2022) 16:100503. doi: 10.1016/j.animal.2022.100503
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Fan, L, He, ZZ, Ao, X, Sun, WL, Xiao, X, Zeng, FK, et al. Efectos de las sobredosis residuales de fitasa sobre el rendimiento del crecimiento, la mineralización de la tibia y el peso relativo de los órganos en patos alimentados con dietas deficientes en fósforo. Poult Sci. (2019) 98:3926–36. doi: 10.3382/ps/pez114
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Takahashi, S, Tomita, J, Nishioka, K, Hisada, T y Nishijima, M. Desarrollo de un cebador universal procariota para el análisis simultáneo de bacterias y arqueas mediante secuenciación de nueva generación. PLoS Uno. (2014) 9:e105592. doi: 10.1371/journal.pone.0105592
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Ponnusamy, K, Choi, JN, Kim, J, Lee, SY y Lee, CH. Comunidad microbiana y comparación metabolómica de las heces del síndrome del intestino irritable. J Med Microbiol. (2011) 60:817–27. doi: 10.1099/jmm.0.028126-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Sangster, T, Major, H, Plumb, R, Wilson, AJ y Wilson, ID. Una estrategia de control de calidad pragmática y de fácil implementación para el análisis metabonómico basado en Hplc-Ms y Gc-Ms. Analista. (2006) 131:1075–8. DOI: 10.1039/B604498K
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Want, EJ, Wilson, ID, Gika, H, Theodoridis, G, Plumb, RS, Shockcor, J, et al. Procedimientos de perfil metabólico global para orina utilizando Uplc-Ms. Nat Protoc. (2010) 5:1005–18. doi: 10.1038/nprot.2010.50
32. Chong, J y Xia, J. Metaboanalystr: un paquete de R para el análisis flexible y reproducible de datos metabolómicos. Bioinformática. (2018) 34:4313–4. doi: 10.1093/bioinformatics/bty528
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Xie, X, Yang, C, Guan, LL, Wang, J, Xue, M y Liu, JX. La persistencia de las bacterias celulolíticas Fibrobacter y Treponema después de una intervención dietética a corto plazo basada en rastrojo de maíz revela el potencial para mejorar la función fibrolítica del rumen. Microbiol frontal. (2018) 9:1363. doi: 10.3389/fmicb.2018.01363
34. Evans, NJ, Brown, JM, Murray, RD, Getty, B, Birtles, RJ, Hart, CA, et al. Caracterización de nuevos aislados de Treponema del tracto gastrointestinal bovino y comparación con Treponemas de dermatitis digital bovina. Appl Environ Microbiol. (2011) 77:138–47. doi: 10.1128/AEM.00993-10
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Spence, C, Wells, WG, y Smith, CJ. Caracterización del operón de utilización primaria de almidón en el anaerobio obligado Bacteroides fragilis: regulación por fuente de carbono y oxígeno. J Bacteriol. (2006) 188:4663–72. doi: 10.1128/JB.00125-06
36. Qi, M, Nelson, KE, Daugherty, SC, Nelson, WC, Hance, IR, Morrison, M, et al. Diferencias genómicas entre Fibrobacter succinogenes S85 y Fibrobacter intestinalis Dr7, identificadas por hibridación sustractiva de supresión. Appl Environ Microbiol. (2008) 74:987–93. doi: 10.1128/aem.02514-07
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Kaczmarska, K, Taylor, M, Piyasiri, U y Frank, D. Perfiles de sabor y metabolitos de la carne, sustitutos de la carne y productos alimenticios tradicionales ricos en proteínas de origen vegetal disponibles en Australia. Alimentos. (2021) 10:801. doi: 10.3390/foods10040801
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Liu, J, Pu, YY, Xie, Q, Wang, JK y Liu, JX. La pectina induce un cambio in vitro en la población microbiana del rumen atribuido al grupo pectinolítico Treponema. Curr Microbiol. (2015) 70:67–74. doi: 10.1007/s00284-014-0672-y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Vidra, A, y Nemeth, A. Ácido propiónico bioproducido: una revisión. Período Polytech Chem Ing. (2018) 62:57–67. doi: 10.3311/PPch.10805
40. Oikonomou, G, Teixeira, AG, Foditsch, C, Bicalho, ML, Machado, VS, y Bicalho, RC. Diversidad microbiana fecal en terneros lecheros predestetados descrita por pirosecuenciación del ADNr metagenómico 16s. Asociaciones de especies de Faecalibacterium con salud y crecimiento. PLoS Uno. (2013) 8:E63157. doi: 10.1371/journal.pone.0063157
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Xie, F, Xu, L, Wang, Y y Mao, S. La secuenciación metagenómica revela que la alimentación con alto contenido de granos altera la composición y el metabolismo de la microbiota cecal e induce lesiones de la mucosa cecal en ovejas. mSystems. (2021) 6:E0091521. doi: 10.1128/mSystems.00915-21
42. McLoughlin, S, Spillane, C, Claffey, N, Smith, PE, O’Rourke, T, Diskin, MG, et al. La composición del microbioma ruminal está alterada en las ovejas con divergencia en la eficiencia alimenticia. Microbiol frontal. (2020) 11:1981. doi: 10.3389/fmicb.2020.01981
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Jenq, RR, Taur, Y, Devlin, SM, Ponce, DM, Goldberg, JD, Ahr, KF, et al. La blautia intestinal se asocia con una reducción de la muerte por enfermedad de injerto contra huésped. Trasplante de médula ósea Biol. (2015) 21:1373–83. doi: 10.1016/j.bbmt.2015.04.016
44. Huang, Y, Zhou, L, Zhang, J, Liu, X, Zhang, Y, Cai, L, et al. Una comparación a gran escala de la calidad de la carne y la composición de ácidos grasos intramusculares entre tres razas porcinas autóctonas chinas. Ciencia de la carne. (2020) 168:108182. doi: 10.1016/j.meatsci.2020.108182
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Cai, Z-W, Zhao, X-F, Jiang, X-L, Yao, Y-C, Zhao, C-J, Xu, N-Y, et al. Comparación de la composición de aminoácidos musculares y ácidos grasos de cerdos machos castrados y no castrados en diferentes edades de sacrificio (2010) Ital J Anim Sci. 9, E33. doi: 10.4081/ijas.2010.e33
46. Oestreicher, J y Morgan, B. Glutatión: distribución subcelular y transporte de membrana1. Biochem Cell Biol. (2019) 97:270–89. doi: 10.1139/bcb-2018-0189
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Lee, YC, Chi, MC, Lin, MG, Chen, YY, Lin, LL y Wang, TF. Síntesis biocatalítica de γ-glutamil-L-leucina, un dipéptido que imparte Kokumi, por Bacillus licheniformis γ-glutamiltranspeptidasa. Biotecnología alimentaria. (2018) 32:130–47. doi: 10.1080/08905436.2018.1444636
48. Ohsu, T, Amino, Y, Nagasaki, H, Yamanaka, T, Takeshita, S, Hatanaka, T, et al. Implicación del receptor sensible al calcio en la percepción del gusto humano. J Biol Chem. (2010) 285:1016–22. doi: 10.1074/jbc. M109.029165
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Nathani, NM, Patel, AK, Mootapally, CS, Reddy, B, Shah, SV, Lunagaria, PM, et al. Efecto del forraje sobre la composición de la microbiota ruminal en el eficiente convertidor de piensos y el robusto búfalo indio Jaffrabadi (Bubalus bubalis). BMC Genómica. (2015) 16:1116. doi: 10.1186/s12864-015-2340-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Ghimire, S, Kohn, RA, Gregorini, P, White, RR, y Hanigan, MD. Representación de las interconversiones entre ácidos grasos volátiles en el modelo de vaca Molly. J Lácteos Sci. (2017) 100:3658–71. doi: 10.3168/jds.2016-11858
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Du, M, Yang, C, Liang, Z, Zhang, J, Yang, Y, Ahmad, AA, et al. Los niveles de energía de la dieta afectan a las bacterias relacionadas con el metabolismo de los carbohidratos y mejoran la calidad de la carne en el músculo longissimus Thoracis del yak (Bos grunniens). Front Vet Sci. (2021) 8:718036. doi: 10.3389/fvets.2021.718036
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: heno de alfalfa, rendimiento de crecimiento, cordero, heno de Leymus chinensis, metabolómica, bacterias ruminales
Cita: Wang H, Meng L y Mi L (2023) Efectos del heno de Leymus chinensis y el heno de alfalfa en el rendimiento del crecimiento, la microbiota ruminal y la metabolómica no dirigida de la carne en corderos. Frente. Vet. Sci. 10:1256903. doi: 10.3389/fvets.2023.1256903
Recibido: 11 de julio de 2023; Aceptado: 24 de octubre de 2023;
Publicado: 16 noviembre 2023.
Editado por:
Wen-Chao Liu, Universidad Oceánica de Guangdong, China
Revisado por:
Maghsoud Besharati, Universidad de Tabriz, Irán
Yushan Jia, Universidad Agrícola de Mongolia Interior, China
Derechos de autor © 2023 Wang, Meng y Mi. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Lan Mi, lanmi_90@126.com
†Estos autores han contribuido igualmente a este trabajo y comparten la primera autoría
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía