Evaluación de la actividad inmunomoduladora de cepas probióticas de calostro y leche canina
Aislamiento, caracterización y evaluación de la actividad inmunomoduladora de cepas probióticas de calostro y leche canina
 Sandra Rayén Quilodrán-Vega1*
Sandra Rayén Quilodrán-Vega1*  Carolina Muñoz-Flores1,2
Carolina Muñoz-Flores1,2  Ana Pino1
Ana Pino1  Paula Buldres2
Paula Buldres2  Felipe Sandoval2
Felipe Sandoval2  Alex Aguirre1
Alex Aguirre1  Brígida Portillo1
Brígida Portillo1  Natalie Parra2
Natalie Parra2  Claudia Altamirano3
Claudia Altamirano3  Leonardo Albarracín4
Leonardo Albarracín4  Julio Villena4
Julio Villena4  Jorge R. Toledo2*
Jorge R. Toledo2*- 1Laboratorio de Microbiología de Alimentos, Facultad de Ciencias Veterinarias, Universidad de Concepción, Chillán, Chile
- 2Laboratorio de Biotecnología y Biofármacos, Departamento de Fisiopatología, Facultad de Ciencias Biológicas, Universidad de Concepción, Concepción, Chile
- 3Laboratorio de Cultivos Celulares, Escuela de Ingeniería Bioquímica, Pontificia Universidad Católica de Valparaíso, Valparaíso, Chile
- 4Laboratorio de Inmunobiotecnología, Centro de Referencia de Lactobacilos (CERELA-CONICET), San Miguel de Tucumán, Argentina
Fondo: Este estudio tuvo como objetivo caracterizar las posibles cepas probióticas para su uso en perros para prevenir enteropatías infecciosas. Las bacterias lácticas (BAL) aisladas de leche canina y calostro se caracterizaron de acuerdo con sus propiedades funcionales, incluyendo su resistencia a afecciones gastrointestinales, efecto inhibidor contra patógenos y adhesión intestinal.
Métodos: Los efectos inmunomoduladores de las cepas también se analizaron en estudios in vitro e in vivo. Entre las cepas evaluadas, dos cepas de BAL (TUCO-16 y TUCO-17) mostraron notable resistencia al pH 3.0, sales biliares y pancreatina, así como efectos inhibidores contra Escherichia coli, Salmonella sp. y Clostridium perfringens patógenos.
Resultados: Las cepas TUCO-16 y TUCO-17 indujeron un aumento significativo en la expresión de TNF-α, IL-8 y TLR2 en macrófagos caninos. La administración oral de las cepas TUCO-16 y TUCO-17 a ratones aumentó significativamente su resistencia a las infecciones intestinales patógenas por E. coli o Salmonella. Ambas cepas caninas redujeron el daño intestinal y los recuentos de patógenos en el hígado y el bazo y evitaron su diseminación al torrente sanguíneo. Estos efectos protectores se relacionaron con la capacidad de las cepas TUCO-16 y TUCO-17 para modular diferencialmente la producción de IFN-γ, IFN-β, TNF-α, IL-6, KC, MCP-1 e IL-10 en la mucosa intestinal.
Conclusión: Ambas cepas, TUCO-16 y TUCO-17, son candidatas potenciales a probióticos para mejorar la salud intestinal de los perros, en particular por su capacidad para inhibir el crecimiento de patógenos gramnegativos comunes en las infecciones gastrointestinales y modular la respuesta inmunitaria del animal. Se requieren más estudios para demostrar de manera efectiva los efectos beneficiosos de las cepas TUCO-16 y TUCO-17 en perros.
1 Introducción
En la última década se han producido grandes avances en el conocimiento de la composición de la microbiota intestinal de animales como los perros. La mayoría de los microorganismos detectados en el tracto gastrointestinal canino pertenecen a los filos Bacillota (Firmicutes), Fusobacteriota (Fusobacteria), Bacteroidota (Bacteroidetes), Pseudomonadota (Proteobacteria) y Actinomycetota (Actinobacteria) (1). El microbioma de un perro sano es estable; sin embargo, su salud puede desestabilizarse debido a la edad, la dieta y otros factores ambientales, lo que lleva a la disbiosis; Por ejemplo, la inflamación intestinal aguda y crónica, en la que las alteraciones intestinales provocan cambios funcionales en el transcriptoma, el proteoma o el metaboloma microbiano (2, 3). Los microbiomas de perros y humanos son estructural y funcionalmente similares, lo que implica que los estudios en humanos son predictivos en perros y viceversa, obteniendo un doble beneficio en la investigación (4).
Los perros, al igual que los humanos, pueden desarrollar enteropatías infecciosas, caracterizadas por una duración de hasta 3 semanas con síntomas como diarrea, vómitos, náuseas, dolor abdominal y pérdida de peso, entre otros. Las enteropatías se pueden revertir en perros con un cambio en la dieta, la administración de antibióticos o inmunosupresores (5). Entre los antibióticos más utilizados en los perros para tratar las enteropatías se encuentran el metronidazol, la amoxicilina, la tilosina y la lincomicina (6-8). El uso de antibióticos puede mejorar los síntomas clínicos de los pacientes con infecciones gastrointestinales; Sin embargo, provocan alteraciones negativas en la microbiota intestinal, y también existe preocupación por la selección de bacterias resistentes a los antibióticos (9). Los estudios han demostrado que el número de aislados multirresistentes está aumentando y pueden transmitirse entre las bacterias animales y la microbiota humana, lo que supone un gran problema para la salud pública (10-12). Además, los signos gastrointestinales asociados a los antibióticos, como hiporexia marcada, vómitos y diarrea, pueden conducir a la interrupción prematura del tratamiento con antibióticos (13). Por lo tanto, se necesitan urgentemente alternativas preventivas y terapéuticas alternativas para reducir significativamente estos trastornos en los perros.
Los microorganismos probióticos se han propuesto como alternativas a los antibióticos para mejorar la protección de la mucosa intestinal (14, 15). Los probióticos humanos son una terapia alternativa para el mantenimiento de la salud en las mascotas; Sin embargo, la fuente más apropiada de probióticos debe derivarse de la propia mascota (16). El control de patógenos intestinales en mascotas es una preocupación creciente y es deseable seleccionar cepas probióticas nativas que exhiban especificidad de huésped para hacer frente a las condiciones intestinales asociadas con la domesticación y las bacterias patógenas multirresistentes (17-19). El aislamiento del huésped ha sido una fuente valiosa para identificar cepas con características probióticas beneficiosas para la salud intestinal de las mascotas, evitando el uso de probióticos de origen humano (20, 21). En estos estudios, se identificaron cepas que mejoran los parámetros fecales en perros con diarrea, su estado nutricional, una disminución en los recuentos de coliformes, un aumento de bacterias lácticas (BAL) y un aumento de hemoglobina y magnesio sérico. Además, la administración de estas cepas probióticas mejora la ingesta de alimentos, el peso de los animales y su inmunidad y modula la microbiota intestinal en perros de diferentes edades (22). A pesar de los prometedores resultados obtenidos con cepas de BAL aisladas de perros, no existen estudios que demuestren su eficacia para modular beneficiosamente la inmunidad frente a patógenos.
En el presente trabajo, analizamos las propiedades de un banco de cepas aisladas de leche canina y calostro en cuanto a su resistencia a afecciones gastrointestinales, efecto inhibidor sobre patógenos, adhesión intestinal y efectos inmunomoduladores en estudios in vitro e in vivo, con el objetivo de seleccionar cepas que pudieran ser utilizadas para diseñar una nueva formulación probiótica canina para prevenir trastornos gastrointestinales en perros.
2 Materiales y métodos
2.1 Recogida de muestras
La leche canina y el calostro fueron extraídos asépticamente de perras por un profesional veterinario. Las muestras de leche materna y calostro se recogieron asépticamente lavando la zona del pezón con una solución de agua y jabón para evitar la contaminación con otros microorganismos de la piel. El veterinario debe usar guantes esterilizados apropiados durante los procedimientos. Luego de la colecta, las muestras fueron trasladadas al laboratorio de Microbiología de Alimentos, de la Facultad de Ciencias Veterinarias de la Universidad de Concepción (ciudad de Chillán, Chile). Las muestras se inocularon en caldo Man Rogosa y Sharpe (MRS) y se incubaron en microaerofilia, a 37°C, durante 48 h. A continuación, las bacterias se rayaron en agar MRS y las placas se incubaron en las condiciones mencionadas. Como cepas testigo se utilizaron el probiótico Lacticaseibacillus casei Shirota y la cepa Lactobacillus acidophilus del probiótico comercial BIOPOWER (CPB). Además, también se utilizó una cepa inmunomoduladora de leche materna de cerdo (TUCO-4) perteneciente al grupo de los lactobacilos (23).
2.2 Caracterización de cepas
Las cepas caninas de BAL se estudiaron en función de sus características macroscópicas y microscópicas según la tinción de Gram, la morfología de la colonia y la prueba de catalasa. También se determinaron sus características funcionales en función de su resistencia a las sales biliares (Oxgall 0,5 y 5,0% p/v), NaCl (2,0, 6,0 y 9,0% p/v), pancreatina (0,5, 1,0 y 2,0% p/v) y al ácido (pH 3), como se ha descrito anteriormente (23, 24). Brevemente, las cepas se cultivaron en caldo MRS con sales biliares, NaCl, pancreatina y a pH 3 (ajustado con HCl 1M) y se incubaron en microaerofilia, a 37°C durante 24 h. La viabilidad se probó en agar MRS y se incubó en las mismas condiciones mencionadas.
2.3 Actividad antimicrobiana
Se analizó el efecto de las cepas caninas de BAL contra patógenos en agar blando o agar semisólido (24). Los patógenos bacterianos utilizados en estos experimentos fueron E. coli ATCC 25922, una cepa enterotoxigénica de E. coli (ETEC), Salmonella enterica ATCC 13076, un aislado clínico de Salmonella sp., y Clostridium perfringens NCTC 13170. Las cepas de BAL se lavaron dos veces con Butterfield’s Buffer (5.000 rpm durante 5 min) y se ajustaron a 0,5 McFarland. Se detectaron gotas en la superficie del agar MRS y se dejaron secar durante 45 min. Las placas se incubaron en microaerofilia, a 37°C durante 48 h. Cada cepa patógena se ajustó a 0,5 McFarland y se añadió 1 mL a 9 mL de agar blando (75%) o medio tioglicolato (para C. perfringens). Las placas se incubaron aeróbicamente a 37°C durante 24 h y anaeróbicamente para cultivos de C. perfringens. Se midieron los diámetros de las zonas de inhibición.
2.4 Perfil de seguridad presunta
Las cepas caninas de BAL se probaron de acuerdo con la seguridad presunta, en agar sangre de oveja y en medio de gelatina (23). Las cepas se rayaron en agar sangre de oveja y se incubaron a 37°C durante 48 h en condiciones microaerofílicas. Para la detección de gelatinasa, las cepas se sometieron a una profunda mezcla de gelatina y se incubaron en las mismas condiciones mencionadas anteriormente. Después de este período, los tubos con los cultivos en medio de gelatina se colocaron a 4°C durante 2 h para verificar la acción de licuefacción. Además, se analizó el perfil de resistencia antibiótica de las cepas caninas de BAL frente a los discos antibióticos (amikacina 30 μg, eritromicina 15 μg, vancomicina 30 μg, ciprofloxacina 5 μg, gentamicina 20 μg, amoxicilina 25 μg, tetraciclina 30 μg y ampicilina 10 μg) que se colocaron en la superficie del agar MRS con la cepa BAL-prueba ajustada a una concentración de McFarland de 0,5. Las placas se incubaron a 37°C durante 48 h en microaerofilia. Se midieron los diámetros de las zonas de inhibición.
2.5 Clasificación de las cepas
Las cepas caninas seleccionadas (TUCO-16 y TUCO-17) se clasificaron mediante PCR convencional para determinar su pertenencia al grupo de lactobacilos reales utilizando los cebadores LbG (5′AGAAGAGGACAGTGGAAC delantero y 5′TTACAAACTCTCATGGTGTGTG inverso). El ADN se extrajo de acuerdo con las instrucciones del proveedor del kit comercial Mo bio (Carlsbad, CA, EE. UU.). L. casei Se utilizó Shirota como control positivo y la cepa Staphylococcus aureus ATCC 29213 como control negativo (25).
2.6 Actividad inmunomoduladora in vitro
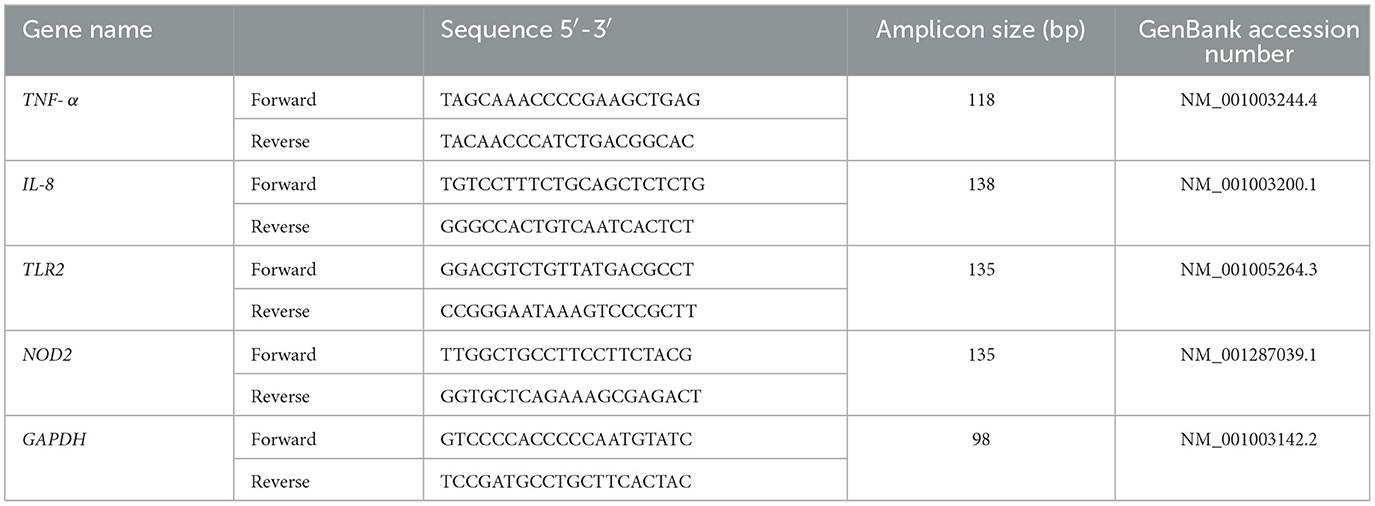
Se evaluó la actividad inmunomoduladora de las cepas caninas de BAL en la línea celular de macrófagos caninos DH82. Para la comparación se utilizó la cepa porcina TUCO-4 y el probiótico CPB. Las células DH82 se sembraron en placas de 24 pocillos hasta una confluencia del 80%. Los macrófagos caninos fueron estimulados durante 12 h con las diferentes suspensiones bacterianas (106, 107, 108 o 109 UFC/mL) de las cepas TUCO-16, TUCO-17, TUCO-4 o CPB. Se incluyeron controles negativos sin tratamiento durante 12 y 24 h. Todas las condiciones se realizaron por triplicado. Las resuspensiones bacterianas se prepararon con medio de cultivo DMEM suplementado con suero fetal bovino (FBS) al 10 %, 2 mM de L-glutamina y solución de aminoácidos no esenciales (NEAA). Las células se cultivaron a 37 °C con 5% de CO2. Después de las estimulaciones, la extracción de ARN se realizó utilizando el reactivo Trizol (Invitrogen, Thermo Fisher Scientific, Waltham, MA, USA), de acuerdo con las instrucciones del fabricante. Las muestras de ARN se cuantificaron con el lector de microplacas Synergy HTX (BioTek Instruments, EE. UU.), la integridad se verificó mediante electroforesis en gel de agarosa y las muestras se almacenaron a -80 °C. Se realizaron ensayos de PCR en tiempo real (RT-PCR) para evaluar la expresión relativa de las citocinas proinflamatorias TNF-α e IL-8, y los receptores de reconocimiento de patrones (PRR) TLR2 y NOD2. Se utilizó la expresión de GAPDH como gen normalizador (Tabla 1). Para la síntesis de ADN complementario y PCR en tiempo real, se utilizó el kit comercial Brilliant II SYBR Green QRT-PCR Master Mix, 1-Step (Agilent, EE. UU.) en el sistema de PCR en tiempo real AriaMx (Agilent, EE. UU.). Los resultados se analizaron mediante el método comparativo de Ct (2®−ΔΔCt).
2.7 Actividad inmunomoduladora in vivo
Se obtuvieron ratones hembra BALB/c de 5 semanas de edad de la colonia cerrada mantenida en CERELA-CONICET (Tucumán, Argentina). Los animales fueron alojados en jaulas de plástico en una sala controlada (22 ± 2°C de temperatura, 55 ± 2% de humedad) con un ciclo de luz/oscuridad de 12 h. Los ratones se alojaron en jaulas de plástico y las condiciones ambientales se mantuvieron constantes, de acuerdo con las normas para el alojamiento de animales. El bienestar animal estuvo a cargo de investigadores y personal especial capacitado en el cuidado y manejo de animales en CERELA. Se calculó el número mínimo de ratones requeridos para un análisis estadístico adecuado con la ayuda del Laboratorio de Bioestadística del CERELA. La salud y el comportamiento de los ratones se monitorearon dos veces al día. Los animales fueron sacrificados inmediatamente después de que se alcanzara el punto de tiempo mediante el uso de xilacina y ketamina. No se observaron signos de malestar o dolor antes de que los ratones alcanzaran los puntos finales. No se observaron muertes antes de que los ratones alcanzaran los puntos finales.
Todos los experimentos se realizaron de acuerdo con la Guía para el Cuidado y Uso de Animales de Laboratorio y aprobados por el Comité Ético de Cuidado Animal de CERELA, Argentina (números de protocolo BIOT-CRL/14 y BIOT-CRL/11).
Las cepas TUCO-16 y TUCO-17 se administraron por vía oral a diferentes grupos de ratones durante cinco días consecutivos a una dosis de 108 células/ratón/día (Figura suplementaria 1). Los grupos tratados con BAL y los ratones de control no tratados fueron alimentados con una dieta convencional equilibrada ad libitum. Un día después de la última administración de BAL (día 6), los animales fueron desafiados con E. coli patógena o Salmonella.
En la primera serie de experimentos, los animales se infectaron por vía oral con una cepa K88 de E. coli enterotoxigénica adaptada a ratones (ETEC) (1 × 109 diluidos con tampón de carbonato 0,1 M (pH 9,0) (26). Dos días después de la infección, los ratones fueron sacrificados para recolectar las muestras de yeyuno, íleon, bazo e hígado. Los tejidos colectados se pesaron y homogeneizaron en caldo BHI. Los homogeneizados se sembraron en el medio de agar MAC resistente a la kanamicina para los recuentos de ETEC. Los resultados se expresaron como logaritmo de unidades formadoras de colonias (UFC) por gramo de órgano. También se evaluaron los marcadores bioquímicos séricos de lesión, así como las concentraciones de citoquinas intestinales 2 días después de la provocación con ETEC, como se describe a continuación.
En el segundo conjunto de experimentos, los ratones tratados y de control fueron desafiados con 50 μl de 107 células/ratón de Salmonella typhimurium (20DL50) por vía oral (27). Una alícuota (200 μL) del patógeno intestinal procedente de un cultivo nocturno se colocó en 5 mL de caldo BHI estéril y se incubó durante 4 horas más (37 °C, aerobiosis). La concentración de Salmonella se ajustó a 1 × 107 UFC en PBS. Dos días después de la infección, los ratones fueron sacrificados para recolectar las muestras de yeyuno, íleon, bazo e hígado. Los tejidos colectados se pesaron y homogeneizaron en caldo BHI. También se evaluaron los marcadores bioquímicos séricos de lesión, así como las concentraciones de citocinas intestinales 2 días después de la exposición a Salmonella, como se describe a continuación.
Se determinaron las actividades de la lactato deshidrogenasa (LDH) y la aspartato aminotransferasa (AST) en el suero para evaluar indirectamente la lesión gastrointestinal. Las muestras de sangre se obtuvieron mediante punción cardíaca bajo anestesia. Las actividades de LDH y AST, expresadas en unidades por litro de suero, se determinaron midiendo la formación de la forma reducida de nicotinamida adenina dinucleótido (NAD) utilizando los reactivos y procedimientos de Wiener (Wiener Lab, Buenos Aires, Argentina) (26).
Las muestras de líquido intestinal se obtuvieron como se ha descrito anteriormente (26). Brevemente, el intestino delgado se lavó con 5 mL de PBS y el líquido se centrifugó (10.000 g, 4 °C 10 min) para separar el material particulado. Las muestras de sobrenadante intestinal se mantuvieron congeladas a -80 °C hasta su uso. Las concentraciones de factor de necrosis tumoral (TNF)-α, IL-6, IL-10, IL-15, interferón (IFN)-β e IFN-γ, quimiocina KC (o CXCL1) y MCP-1 en el fluido intestinal a se midieron con kits de técnicas de ensayo de inmunoabsorción enzimática (ELISA) disponibles comercialmente siguiendo las recomendaciones del fabricante (R&D Systems, MN, EE. UU.).
2.8 Análisis estadístico
Se combinaron y utilizaron los siguientes programas para el análisis estadístico de datos: software GraphPad Prism 8 (GraphPad Software Inc., San Diego, CA, USA) y Excel (Microsoft 365). La significación estadística de los resultados se evaluó mediante ANOVA de una vía y la prueba de comparación múltiple de Dunnett. El nivel de significación estadística se definió como p < 0,05.
3 Resultados
3.1 Selección de posibles cepas probióticas caninas de BAL
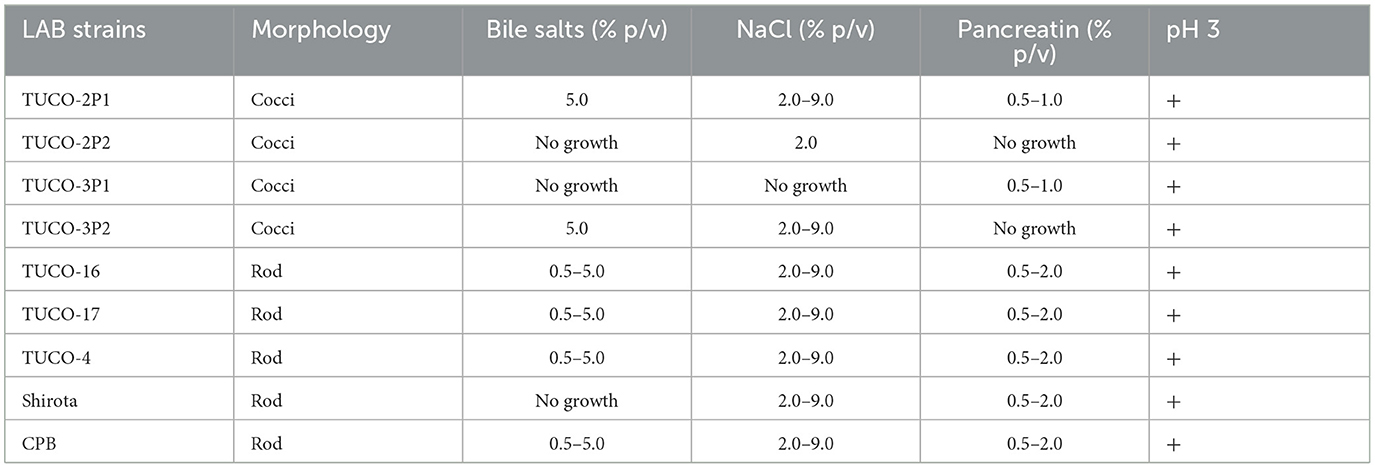
Se aislaron cinco cepas de leche materna canina (TUCO-17, TUCO-2P1, TUCO-2P2, TUCO-3P1 y TUCO-3P2) y una cepa de calostro canino (TUCO-16) y se caracterizaron por sus propiedades funcionales (Tabla 2). Para las comparaciones se utilizaron las cepas probióticas TUCO-4, Shirota y CPB. Todas las cepas aisladas fueron Gram positivas, de las cuales solo dos cepas presentaron morfología bacilar: TUCO-16 y TUCO-17. Las características funcionales de las cepas mostraron que todas ellas fueron resistentes al pH 3 a las 24 h (Tabla 2). Se destacan las cepas TUCO-16 y TUCO-17, que presentaron resistencia entre 0,5 y 5,0% p/v de sales biliares, resistencia en el rango de 2,0 a 9,0% p/v de NaCl, y fueron resistentes a todas las concentraciones de pancreatina utilizadas en este estudio, similares a las cepas control (Tabla 2). Así, los resultados mostraron que estas dos cepas caninas podían resistir condiciones gástricas. Las cepas TUCO-2P1 y TUCO-3P2 fueron resistentes al 5% p/v de sales biliares y al 2,0-9,0% p/v de NaCl, mientras que la cepa TUCO-2P2 no creció en presencia de sales biliares ni concentraciones de pancreatina, pero sí al 2% p/v de NaCl. Las cepas TUCO-2P1 y TUCO-3P1 fueron resistentes a la pancreatina en una proporción de 0,5-1,0% p/v y la cepa TUCO-3P2 no resistió las concentraciones de pancreatina (Tabla 2).
Se analizó la capacidad de las BAL caninas para inhibir el crecimiento de patógenos intestinales (Tabla 3). Todas las cepas estudiadas, incluyendo TUCO-16 y TUCO-17, mostraron efecto inhibidor contra C. perfringens, con halos de inhibición > 30 mm de diámetro. Las cepas TUCO-16 y TUCO-17 mostraron también efecto inhibidor contra las cepas patógenas de E. coli y Salmonella (Tabla 3), y fueron tan efectivas como las cepas Shirota y CBP. Sin embargo, las cepas caninas fueron menos eficientes que la cepa porcina TUCO-4 para limitar el crecimiento de E. coli patógena y Salmonella (Tabla 3). Las cepas TUCO-2P1, TUCO-2P2, TUCO-3P1 y TUCO-3P2 también se evaluaron en su capacidad para inhibir patógenos intestinales, pero no se encontraron zonas de inhibición (datos no mostrados). Teniendo en cuenta estos resultados, se seleccionaron las cepas TUCO-16 y TUCO-17 para realizar experimentos adicionales. Las cepas TUCO-16 y TUCO-17 se identificaron como pertenecientes al grupo de los lactobacilos reales mediante PCR convencional.
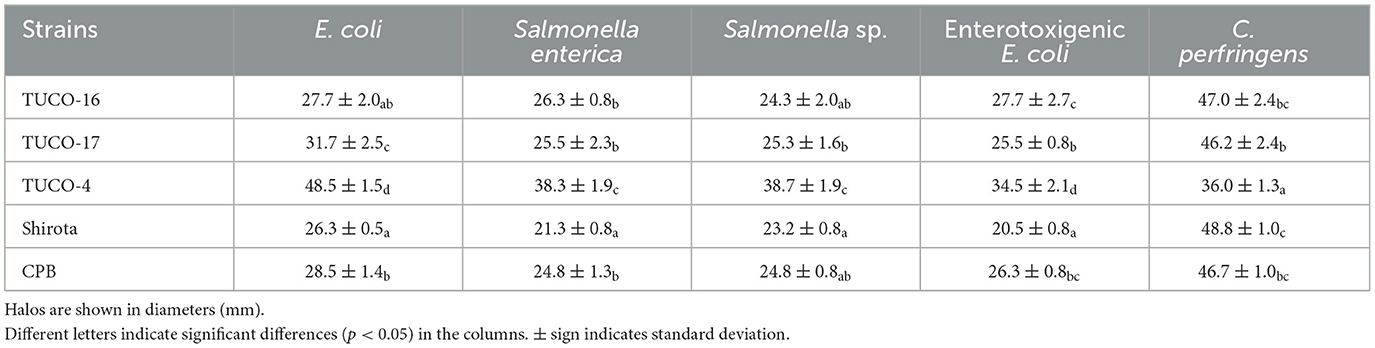 Tabla 3. Inhibición de patógenos intestinales por cepas aisladas de leche materna canina y calostro.
Tabla 3. Inhibición de patógenos intestinales por cepas aisladas de leche materna canina y calostro.
3.2 Perfil de seguridad presunta
Las presuntas características de seguridad de las cepas seleccionadas se resumen en la Tabla 4. Las cepas TUCO-16 y TUCO-17 no mostraron actividad hemolítica ni gelatinasa. Las cepas caninas presentaron perfiles de resistencia a antibióticos similares a los observados para los controles Shirota y CPB. Las cepas TUCO-16 y TUCO-17 fueron sensibles a amoxicilina, eritromicina, ampicilina y tetraciclina.
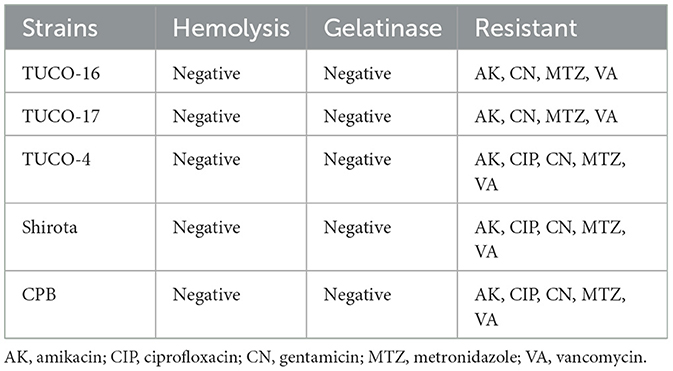 Tabla 4. Características presuntivas de seguridad de las cepas seleccionadas aisladas de leche canina y sus cepas control.
Tabla 4. Características presuntivas de seguridad de las cepas seleccionadas aisladas de leche canina y sus cepas control.
3.3 Expresión de factores de inmunomodulación de cepas caninas de BAL en macrófagos
Para la evaluación del potencial inmunomodulador de las cepas TUCO-16 y TUCO-17 se utilizaron macrófagos caninos DH82. Se observó un aumento significativo en la expresión de TNF-α para los tratamientos con TUCO-16 y TUCO-17 a las 12 h post-estimulación con la dosis más alta (Figura 1). Del mismo modo, las dosis más altas de CPB aumentaron la expresión de TNF-α. Cabe destacar que las dos dosis más bajas de TUCO-4 aumentaron la expresión de esta citoquina inflamatoria, mientras que no se observó ningún efecto con las dos dosis más altas. Se observó un efecto dosis-dependiente más claro cuando se analizó la expresión de IL-8 en macrófagos caninos después de la estimulación con cepas TUCO-16 y TUCO-17 (Figura 1). Las cepas TUCO-16 y TUCO-17 fueron tan efectivas como el control probiótico TUCO-4 para aumentar la IL-8. Sin embargo, las cepas caninas de BAL fueron menos eficientes que la CEC para mejorar la quimiocina inflamatoria.
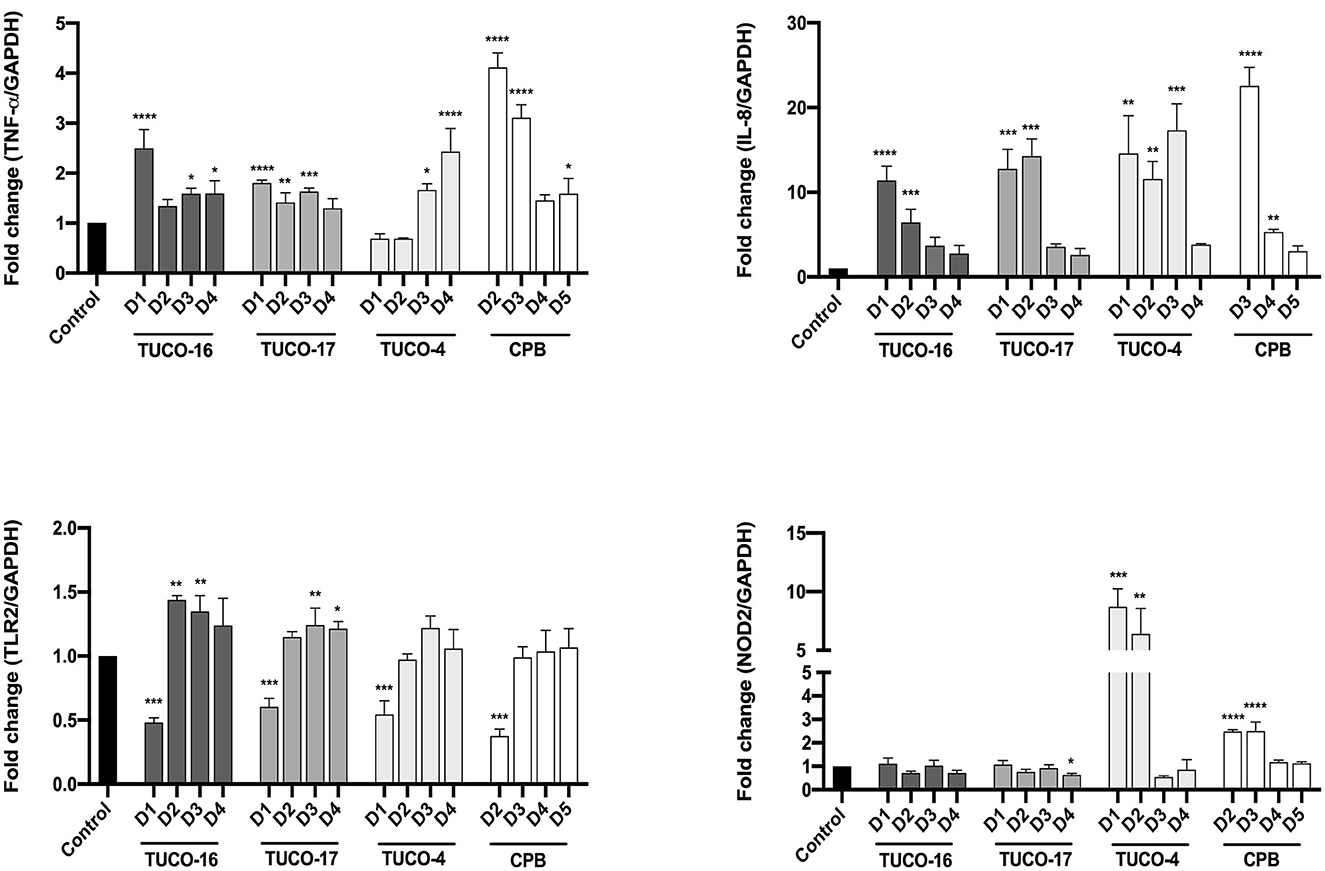 Figura 1. Expresión relativa de citoquinas proinflamatorias en células DH82 estimuladas con bacterias lácticas caninas. La expresión relativa de TNF-α, IL-8, TLR2 y NOD2 se determinó después de 12 h de estimulación. D1: 1 × 109 UFC/ml, D2: 1 × 108 UFC/ml, D3: 1 × 107 UFC/ml, D4: 1 × 106 UFC/ml, D5: 1 × 105 UFC/mL. Para las comparaciones se utilizó la cepa probiótica TUCO-4 y el probiótico comercial BIOPOWER (CPB) (*p < 0,05; **p < 0,01; ***p < 0,001; ****p < 0,0001).
Figura 1. Expresión relativa de citoquinas proinflamatorias en células DH82 estimuladas con bacterias lácticas caninas. La expresión relativa de TNF-α, IL-8, TLR2 y NOD2 se determinó después de 12 h de estimulación. D1: 1 × 109 UFC/ml, D2: 1 × 108 UFC/ml, D3: 1 × 107 UFC/ml, D4: 1 × 106 UFC/ml, D5: 1 × 105 UFC/mL. Para las comparaciones se utilizó la cepa probiótica TUCO-4 y el probiótico comercial BIOPOWER (CPB) (*p < 0,05; **p < 0,01; ***p < 0,001; ****p < 0,0001).
También se evaluó la expresión de los receptores de reconocimiento de patrones TLR2 y NOD2 en macrófagos caninos después de la estimulación con las cepas TUCO-16 y TUCO-17 (Figura 1). La dosis más alta (1 × 109 UFC/mL) de las cepas caninas redujeron significativamente la expresión de TLR2. El mismo efecto se observó para los controles probióticos TUCO-4 y CPB. Por el contrario, las dosis de BAL caninas inferiores a 1 × 109 Las UFC/ml aumentaron la expresión de TLR2. No se observaron diferencias significativas en la expresión de NOD2 cuando se compararon los niveles basales con los de macrófagos estimulados con cepas TUCO-16 y TUCO-17 (Figura 1). Por el contrario, NOD2 aumentó significativamente en las células tratadas con los controles probióticos TUCO-4 y CPB.
3.4 Las cepas caninas de BAL mejoran la resistencia a la infección por ETEC en ratones
Se evaluó la capacidad de las cepas caninas TUCO-16 y TUCO-17 para mejorar la resistencia frente a la infección por ETEC. Para ello se utilizó un modelo de infección por ETEC en ratones (26). El desafío de ratones permitió la colonización de ETEC en yeyuno, íleon, hígado y bazo, como lo muestran los recuentos de células bacterianas en estos tejidos (Figura 2). El patógeno intestinal no se detectó en muestras de sangre en este momento posterior a la infección. Los ratones tratados preventivamente con cepas TUCO-16 o TUCO-17 tenían recuentos de ETEC significativamente más bajos en yeyuno e íleon. Además, los animales que recibieron la cepa canina de BAL tenían niveles indetectables del patógeno en el hígado y el bazo (Figura 2). En línea con la mejora de la resistencia frente al desafío ETEC, los ratones tratados con cepas TUCO-16 o TUCO-17 mostraron una pérdida de peso corporal significativamente menor y niveles reducidos de los marcadores bioquímicos de lesión LDH y AST en comparación con los controles (Figura 3). Como se informó anteriormente (26), la infección por ETEC en ratones indujo un aumento en los niveles de citoquinas proinflamatorias IFN-β, IFN-γ, IL-6 y TNF-α (Figura 4) y quimiocinas KC, MCP-1 e IL-15 (Figura 5) en el intestino. Además, se observó un aumento de la citoquina reguladora IL-10 en el fluido intestinal de los animales desafiados con ETEC. Cabe destacar que los ratones tratados preventivamente con cepas de TUCO-16 o TUCO-17 tenían niveles significativamente más altos de IFN-β, IFN-γ e IL-10 intestinales que los controles. Los animales caninos tratados con BAL también tenían niveles más bajos de IL-6, TNF-α intestinal (Figura 4), KC, MCP-1 e IL-15 (Figura 5) que los controles.
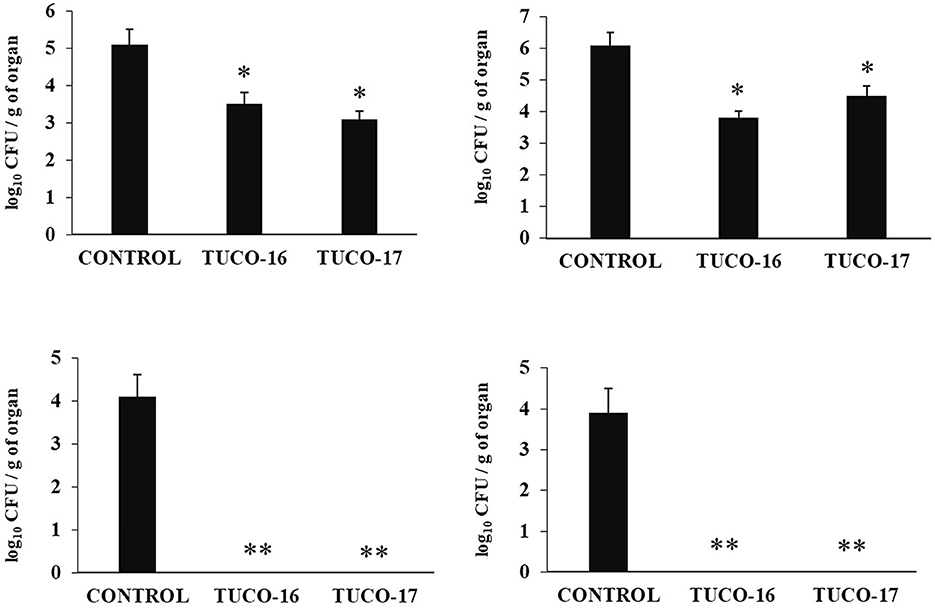 Figura 2. Efecto de las cepas caninas TUCO-16 y TUCO-17 sobre la infección por ETEC en ratones. Los ratones fueron tratados oralmente con cepas TUCO-16 o TUCO-17 durante cinco días consecutivos y luego desafiados por vía oral con ETEC. Se utilizaron como controles ratones sin tratamiento y desafiados con ETEC. Los recuentos de ETEC en yeyuno, íleon, bazo e hígado se determinaron 2 días después de la provocación con ETEC. Los resultados representan datos de tres experimentos independientes. Los valores son medias ± DE. Los asteriscos indican diferencias significativas en comparación con el grupo control ETEC (*p < 0,05, **p < 0,01).
Figura 2. Efecto de las cepas caninas TUCO-16 y TUCO-17 sobre la infección por ETEC en ratones. Los ratones fueron tratados oralmente con cepas TUCO-16 o TUCO-17 durante cinco días consecutivos y luego desafiados por vía oral con ETEC. Se utilizaron como controles ratones sin tratamiento y desafiados con ETEC. Los recuentos de ETEC en yeyuno, íleon, bazo e hígado se determinaron 2 días después de la provocación con ETEC. Los resultados representan datos de tres experimentos independientes. Los valores son medias ± DE. Los asteriscos indican diferencias significativas en comparación con el grupo control ETEC (*p < 0,05, **p < 0,01).
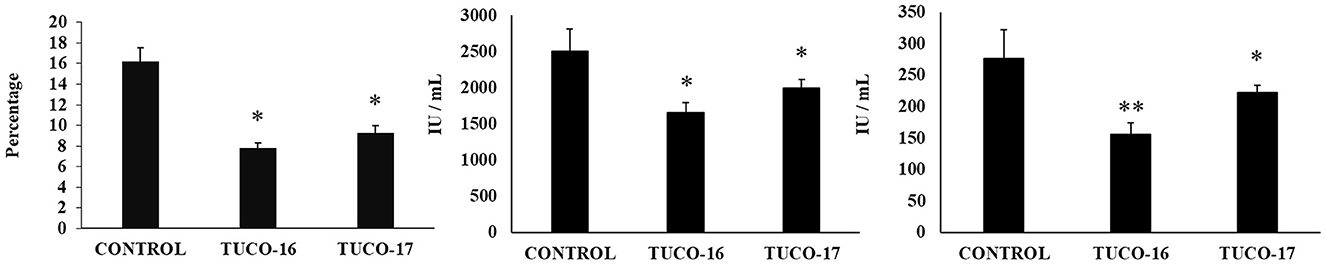 Figura 3. Efecto de las cepas caninas TUCO-16 y TUCO-17 sobre la infección por ETEC en ratones. Los ratones fueron tratados oralmente con cepas TUCO-16 o TUCO-17 durante cinco días consecutivos y luego desafiados por vía oral con ETEC. Se utilizaron como controles ratones sin tratamiento y desafiados con ETEC. Se determinó la pérdida de peso corporal, la lactato deshidrogenasa sérica (LDH) y la aspartato aminotransferasa sérica (AST) 2 días después de la provocación con ETEC. Los resultados representan datos de tres experimentos independientes. Los valores son medias ± DE. Los asteriscos indican diferencias significativas en comparación con el grupo control ETEC (*p < 0,05, **p < 0,01).
Figura 3. Efecto de las cepas caninas TUCO-16 y TUCO-17 sobre la infección por ETEC en ratones. Los ratones fueron tratados oralmente con cepas TUCO-16 o TUCO-17 durante cinco días consecutivos y luego desafiados por vía oral con ETEC. Se utilizaron como controles ratones sin tratamiento y desafiados con ETEC. Se determinó la pérdida de peso corporal, la lactato deshidrogenasa sérica (LDH) y la aspartato aminotransferasa sérica (AST) 2 días después de la provocación con ETEC. Los resultados representan datos de tres experimentos independientes. Los valores son medias ± DE. Los asteriscos indican diferencias significativas en comparación con el grupo control ETEC (*p < 0,05, **p < 0,01).
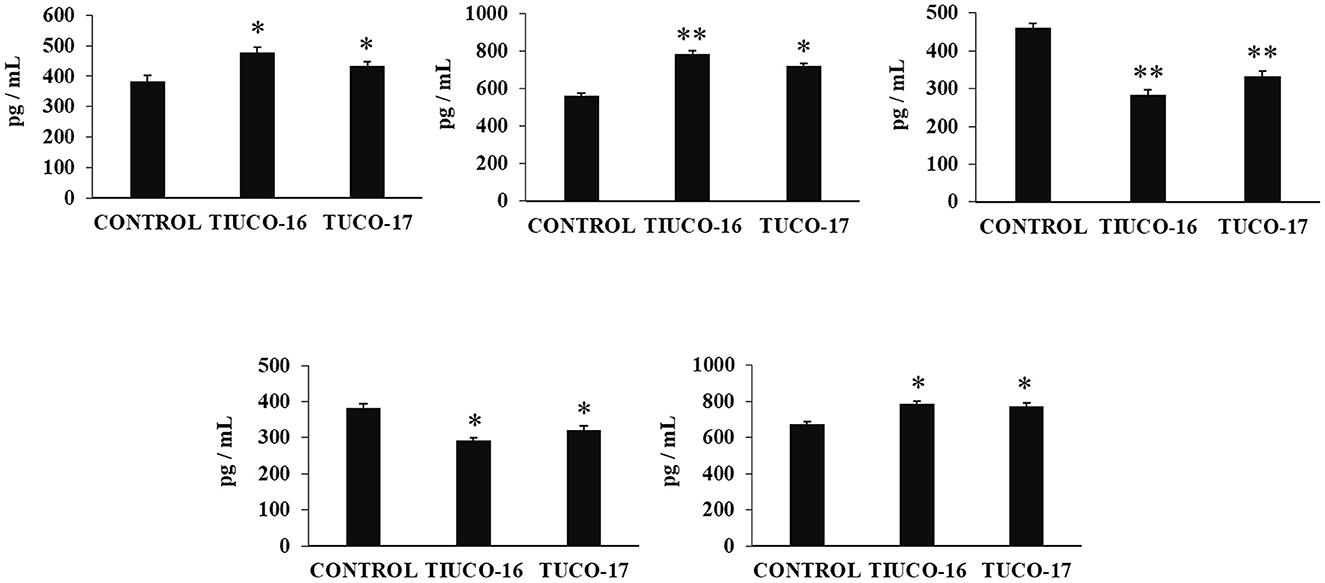 Figura 4. Efecto de las cepas caninas TUCO-16 y TUCO-17 sobre la infección por ETEC en ratones. Los ratones fueron tratados oralmente con cepas TUCO-16 o TUCO-17 durante cinco días consecutivos y luego desafiados por vía oral con ETEC. Se utilizaron como controles ratones sin tratamiento y desafiados con ETEC. Los niveles intestinales de interferón (IFN)-β, IFN-γ, interleucina (IL)-6, IL-10 y factor de necrosis tumoral (TNF)-α, se determinaron 2 días después de la provocación con ETEC. Los resultados representan datos de tres experimentos independientes. Los valores son medias ± DE. Los asteriscos indican diferencias significativas en comparación con el grupo control ETEC (*p < 0,05, **p < 0,01).
Figura 4. Efecto de las cepas caninas TUCO-16 y TUCO-17 sobre la infección por ETEC en ratones. Los ratones fueron tratados oralmente con cepas TUCO-16 o TUCO-17 durante cinco días consecutivos y luego desafiados por vía oral con ETEC. Se utilizaron como controles ratones sin tratamiento y desafiados con ETEC. Los niveles intestinales de interferón (IFN)-β, IFN-γ, interleucina (IL)-6, IL-10 y factor de necrosis tumoral (TNF)-α, se determinaron 2 días después de la provocación con ETEC. Los resultados representan datos de tres experimentos independientes. Los valores son medias ± DE. Los asteriscos indican diferencias significativas en comparación con el grupo control ETEC (*p < 0,05, **p < 0,01).
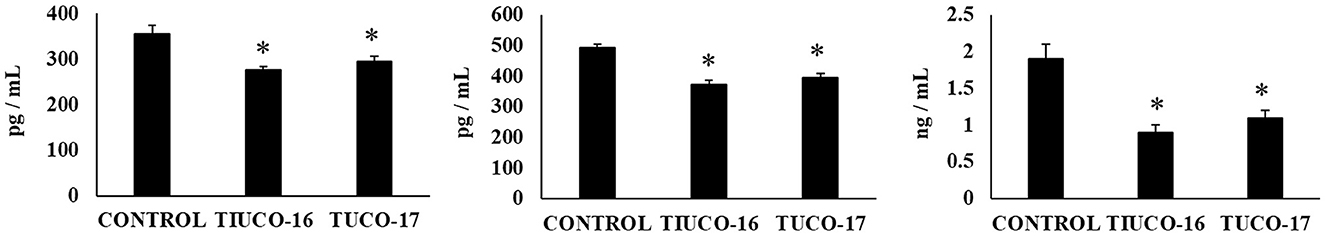 Figura 5. Efecto de las cepas caninas TUCO-16 y TUCO-17 sobre la infección por ETEC en ratones. Los ratones fueron tratados oralmente con cepas TUCO-16 o TUCO-17 durante cinco días consecutivos y luego desafiados por vía oral con ETEC. Se utilizaron como controles ratones sin tratamiento y desafiados con ETEC. Los niveles intestinales de interleucina (IL)-15, quimiocina KC (o CXCL1) y proteína quimioatrayente de monocitos 1 (MCP-1) se determinaron 2 días después de la provocación con ETEC. Los resultados representan datos de tres experimentos independientes. Los valores son medias ± DE. Los asteriscos indican diferencias significativas en comparación con el grupo control ETEC (*p < 0,05).
Figura 5. Efecto de las cepas caninas TUCO-16 y TUCO-17 sobre la infección por ETEC en ratones. Los ratones fueron tratados oralmente con cepas TUCO-16 o TUCO-17 durante cinco días consecutivos y luego desafiados por vía oral con ETEC. Se utilizaron como controles ratones sin tratamiento y desafiados con ETEC. Los niveles intestinales de interleucina (IL)-15, quimiocina KC (o CXCL1) y proteína quimioatrayente de monocitos 1 (MCP-1) se determinaron 2 días después de la provocación con ETEC. Los resultados representan datos de tres experimentos independientes. Los valores son medias ± DE. Los asteriscos indican diferencias significativas en comparación con el grupo control ETEC (*p < 0,05).
3.5 Las cepas caninas de BAL mejoran la resistencia a la infección por Salmonella en ratones
Finalmente, se evaluó la capacidad de las cepas caninas TUCO-16 y TUCO-17 para mejorar la resistencia frente a la infección por Salmonella en un modelo de ratón (27). El patógeno se detectó en muestras de sangre, hígado y bazo en ratones control (Figura 6). Los ratones tratados preventivamente con cepas TUCO-16 o TUCO-17 tenían recuentos significativamente más bajos de Salmonella en el hígado y el bazo. Además, los animales que recibieron la cepa canina de BAL tenían niveles indetectables del patógeno en muestras de sangre. El desafío con el patógeno aumentó los niveles de citocinas TNF-α, IL-1β, IL-6, IFN-γ (Figura 7) y las quimiocinas KC, MCP-1 e IL-15 (Figura 8) en el intestino. Se encontraron niveles significativamente más bajos de los factores proinflamatorios TNF-α, KC y MCP-1 en ratones tratados preventivamente con las cepas caninas TUCO-16 o TUCO-17. Además, las BAL caninas estimularon una mayor producción de IL-1β, IL-6, IFN-γ e IL-10 en el intestino de animales desafiados por Salmonella. Cabe destacar que no se encontraron diferencias en los niveles de IL-15 intestinal cuando se compararon los ratones control y los tratados con TUCO-16 y TUCO-17 (Figura 8).
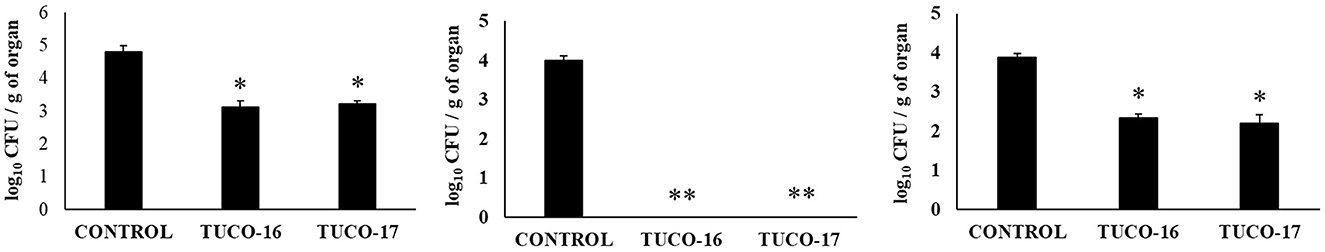 Figura 6. Efecto de las cepas caninas TUCO-16 y TUCO-17 sobre la infección por Salmonella en ratones. Los ratones fueron tratados oralmente con cepas TUCO-16 o TUCO-17 durante cinco días consecutivos y luego desafiados por vía oral con Salmonella. Se utilizaron como controles ratones sin tratamiento y desafiados con Salmonella. Los recuentos de salmonela en sangre, bazo e hígado se determinaron 2 días después de la exposición con Salmonella. Los resultados representan datos de tres experimentos independientes. Los valores son medias ± DE. Los asteriscos indican diferencias significativas en comparación con el grupo control de Salmonella (*p < 0,05, **p < 0,01).
Figura 6. Efecto de las cepas caninas TUCO-16 y TUCO-17 sobre la infección por Salmonella en ratones. Los ratones fueron tratados oralmente con cepas TUCO-16 o TUCO-17 durante cinco días consecutivos y luego desafiados por vía oral con Salmonella. Se utilizaron como controles ratones sin tratamiento y desafiados con Salmonella. Los recuentos de salmonela en sangre, bazo e hígado se determinaron 2 días después de la exposición con Salmonella. Los resultados representan datos de tres experimentos independientes. Los valores son medias ± DE. Los asteriscos indican diferencias significativas en comparación con el grupo control de Salmonella (*p < 0,05, **p < 0,01).
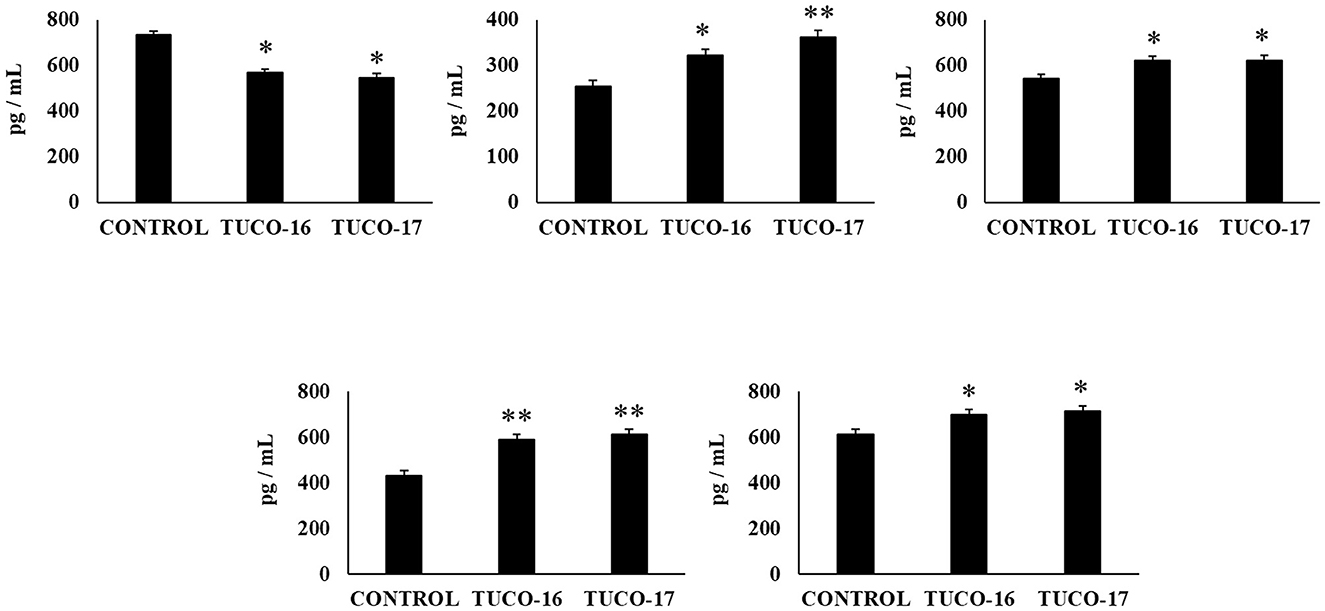 Figura 7. Efecto de las cepas caninas TUCO-16 y TUCO-17 sobre la infección por Salmonella en ratones. Los ratones fueron tratados oralmente con cepas TUCO-16 o TUCO-17 durante cinco días consecutivos y luego desafiados por vía oral con Salmonella. Se utilizaron como controles ratones sin tratamiento y desafiados con Salmonella. Los niveles intestinales de interferón (IFN)-γ, interleucina (IL)-1β, IL-6, IL-10 y factor de necrosis tumoral (TNF)-α se determinaron 2 días después de la exposición con Salmonella. Los resultados representan datos de tres experimentos independientes. Los valores son medias ± DE. Los asteriscos indican diferencias significativas en comparación con el grupo control de Salmonella (*p < 0,05, **p < 0,01).
Figura 7. Efecto de las cepas caninas TUCO-16 y TUCO-17 sobre la infección por Salmonella en ratones. Los ratones fueron tratados oralmente con cepas TUCO-16 o TUCO-17 durante cinco días consecutivos y luego desafiados por vía oral con Salmonella. Se utilizaron como controles ratones sin tratamiento y desafiados con Salmonella. Los niveles intestinales de interferón (IFN)-γ, interleucina (IL)-1β, IL-6, IL-10 y factor de necrosis tumoral (TNF)-α se determinaron 2 días después de la exposición con Salmonella. Los resultados representan datos de tres experimentos independientes. Los valores son medias ± DE. Los asteriscos indican diferencias significativas en comparación con el grupo control de Salmonella (*p < 0,05, **p < 0,01).
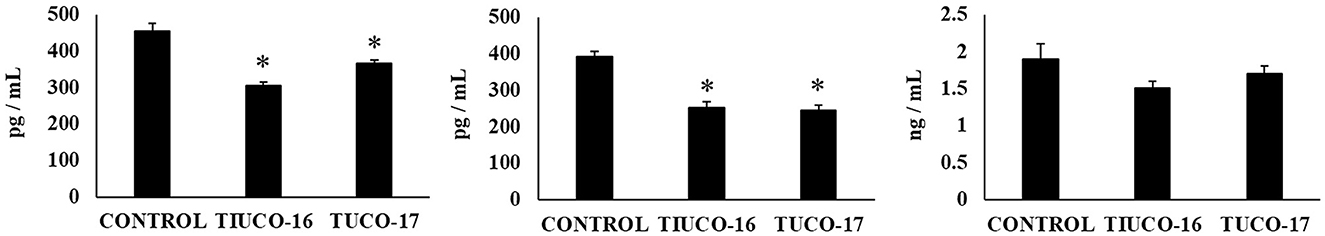 Figura 8. Efecto de las cepas caninas TUCO-16 y TUCO-17 sobre la infección por Salmonella en ratones. Los ratones fueron tratados oralmente con cepas TUCO-16 o TUCO-17 durante cinco días consecutivos y luego desafiados por vía oral con Salmonella. Se utilizaron como controles ratones sin tratamiento y desafiados con Salmonella. Los niveles intestinales de interleucina (IL)-15, quimiocina KC (o CXCL1) y proteína quimioatrayente de monocitos 1 (MCP-1) se determinaron 2 días después de la provocación con Salmonella. Los resultados representan datos de tres experimentos independientes. Los valores son medias ± DE. Los asteriscos indican diferencias significativas en comparación con el grupo control de Salmonella (*p < 0,05).
Figura 8. Efecto de las cepas caninas TUCO-16 y TUCO-17 sobre la infección por Salmonella en ratones. Los ratones fueron tratados oralmente con cepas TUCO-16 o TUCO-17 durante cinco días consecutivos y luego desafiados por vía oral con Salmonella. Se utilizaron como controles ratones sin tratamiento y desafiados con Salmonella. Los niveles intestinales de interleucina (IL)-15, quimiocina KC (o CXCL1) y proteína quimioatrayente de monocitos 1 (MCP-1) se determinaron 2 días después de la provocación con Salmonella. Los resultados representan datos de tres experimentos independientes. Los valores son medias ± DE. Los asteriscos indican diferencias significativas en comparación con el grupo control de Salmonella (*p < 0,05).
4 Discusión
La administración de probióticos a la dieta de animales de compañía se ha incrementado en los últimos años con el objetivo de generar efectos beneficiosos sobre la salud gastrointestinal (28). En cuanto a los seres humanos, los probióticos caninos deben seleccionarse teniendo en cuenta la ausencia de efectos deletéreos como la actividad hemolítica o la presencia de genes de resistencia a los antibióticos, así como por sus beneficios, como la producción de ácido láctico y bacteriocinas, su adhesión a los tejidos epiteliales intestinales, los efectos inhibidores sobre el crecimiento de patógenos y su potencial inmunomodulador (29-31). Nuestro objetivo fue seleccionar cepas potenciales de probióticos de leche canina y calostro con el objetivo de utilizarlas en una nueva formulación de probióticos caninos con capacidad para prevenir trastornos infecciosos gastrointestinales en perros. La mayoría de las cepas probióticas candidatas se han aislado de las heces de los perros, mientras que la leche canina y el calostro fueron menos explorados. Los estudios que evalúan la capacidad de la leche de perro aislada de BAL para resistir las condiciones del tracto gastrointestinal, producir compuestos antimicrobianos y la adherencia a la mucina intestinal indican que existen cepas prometedoras para futuras aplicaciones como probióticos caninos (32). Curiosamente, se informó que la administración de Lacticaseibacillus rhamnosus MP01 y Lactiplantibacillus plantarum MP02, aislados de la leche canina a cachorros de 1 mes de edad, resultó en un efecto preventivo significativo de infecciones gastrointestinales (33).
En este trabajo, se evaluaron las BAL caninas de acuerdo con su capacidad de resistencia al pH ácido, las sales biliares y las concentraciones de pancreatina, y los efectos inhibidores contra patógenos gastrointestinales. Entre las cepas evaluadas, se encontró que las cepas caninas TUCO-16 y TUCO-17 son capaces de inducir halos de inhibición > 20 mm en cepas de bacterias patógenas Gram negativas, particularmente ETEC y Salmonella. Esto está en línea con informes anteriores que describen que los aislados de heces de perros han mostrado una buena actividad antimicrobiana contra bacterias patógenas multirresistentes y transmitidas por los alimentos (18). Curiosamente, se demostró que existe una relación entre el contenido de BAL y la ausencia de Salmonella sp. en las heces de los perros (34). También se demostró que las cepas de Ligilactobacillus salivarius aisladas de heces de perros negativos para Salmonella inhiben eficazmente el crecimiento de Salmonella Typhimurium in vitro (19). Las cepas caninas de leche L. rhamnosus MP01 y L. plantarum MP02 también mostraron un efecto inhibidor contra el crecimiento de patógenos Gram negativos in vitro, incluyendo E. coli MP07 (O157:H7) (33). Además, las cepas caninas TUCO-16 y TUCO-17 fueron negativas para actividad hemolítica y gelatinasa y presentaron perfiles de resistencia a antibióticos similares a las cepas de control probiótico, lo que indica una presunta inocuidad de las bacterias caninas, reforzando su utilidad como potenciales probióticos.
Los macrófagos en la mucosa intestinal pueden tener un papel fundamental en el mantenimiento de la homeostasis y contribuir a la inflamación (35). Los informes revelaron el predominio de macrófagos residentes que muestran un fenotipo antiinflamatorio en la mucosa intestinal de perros sanos, aunque son capaces de desencadenar respuestas inflamatorias contra patógenos. Los estudios inmunohistoquímicos demostraron que el número de macrófagos CD163CD204 es significativamente mayor en las vellosidades en comparación con el área de las criptas, lo que refleja la mayor carga antigénica en la región de las vellosidades del intestino delgado en comparación con las criptas, incluidas las bacterias comensales (35). Además, el trabajo encontró que un pequeño número de macrófagos CD64 directamente debajo de la capa epitelial envía proyecciones transepiteliales a la luz (35). Estos resultados indican, al igual que los ratones y los humanos, que los macrófagos caninos son una de las primeras células inmunitarias que entran en contacto con los microorganismos probióticos administrados por vía oral en el intestino. Luego, la evaluación de la interacción de los macrófagos caninos con las cepas de BAL puede ser una herramienta útil in vitro para el cribado y caracterización de probióticos inmunomoduladores. Por lo tanto, también nos propusimos evaluar si las cepas caninas TUCO-16 y TUCO-17 ejercían efectos inmunomoduladores utilizando la línea celular de macrófagos caninos DH82. Demostramos que ambas cepas podrían inducir una regulación positiva del TNF-α y la IL-8, así como de los PRR NOD-2 y TLR2, que son factores inmunes regulados diferencialmente en macrófagos por cepas probióticas (36, 37). Se informó que los lactobacilos probióticos son capaces de inducir la producción de citoquinas proinflamatorias como IL-8, TNF-α, IL-12p70 e IL-6 (36) y TLR2 (37) en macrófagos, que a su vez activan su fagocitosis y actividad bactericida, y mejoran sus interacciones con otras poblaciones de células inmunes del intestino.+++
Los resultados obtenidos in vitro con las cepas caninas TUCO-16 y TUCO-17 sugieren que ambas cepas serían capaces de modular diferencialmente la inmunidad intestinal. Para demostrar este efecto in vivo, se utilizaron dos modelos murinos de infección: ETEC e infección por Salmonella, considerando que ambos patógenos Gram negativos pueden infectar a los perros. Con frecuencia, la salmonela se aísla tanto en perros sanos como en perros diarreicos con la misma prevalencia (38). Se ha demostrado que la prevalencia de esta bacteria es mucho mayor en perros que se alimentan con dietas de alimentos crudos. Por ejemplo, se aisló Salmonella en el 80% de las muestras de dieta y en el 30% de las muestras de heces de perros alimentados con dietas de pollo crudo (39). Además, los alimentos contaminados, incluidos los alimentos crudos o no procesados para perros, especialmente la carne cruda, se han relacionado como uno de los factores de riesgo más importantes de la transmisión de Salmonella en perros (40). La infección en los perros es en muchos casos subclínica, pero puede inducir síntomas como malestar general, anorexia, vómitos, dolor abdominal y diarrea (38). Además, algunos perros pueden manifestar signos clínicos de sepsis. Por otro lado, la E. coli forma parte de la microbiota intestinal normal de los perros (38), pero puede asociarse a gastroenteritis en presencia de factores de virulencia bacteriana y deterioro de la inmunidad. En este sentido, se demostró que la ETEC en el medio entra en los perros por vía oral, transita y coloniza el intestino delgado donde pueden multiplicarse rápidamente (41). Se supone que el grado de colonización determina si la enfermedad será o no el resultado de la infección. Una vez establecida, la ETEC puede sintetizar y secretar uno o más tipos de enterotoxinas, que inducen la secreción de agua y electrolitos en la luz intestinal. Entonces, la ETEC puede causar una rápida aparición de diarrea secretora que conduce a una deshidratación grave y un desequilibrio electrolítico.
En nuestras manos, los ratones tratados preventivamente con cepas caninas TUCO-16 o TUCO-17 tenían una resistencia mejorada a los desafíos de ETEC y Salmonella, como lo demuestran los recuentos de patógenos significativamente más bajos en los tejidos infectados. Como era de esperar, estos efectos beneficiosos se relacionaron con una modulación diferencial de la respuesta inmune intestinal. Se encontró un perfil de citoquinas intestinales distinto en los ratones tratados con BAL canina, que se caracterizó por niveles más altos de IFN-γ e IL-10, y concentraciones más bajas de TNF-α, KC y MCP-1 que los controles, en ambos modelos de infección. Varios estudios han reportado que el efecto más notable de las cepas probióticas humanas sobre la dinámica intestinal de citoquinas es el aumento de IFN-γ y la citoquina reguladora IL-10 (27, 42). En este sentido, se demostró que la administración de cepas probióticas inmunoestimulantes a ratones puede potenciar la activación de macrófagos intestinales y peritoneales, así como de los parches de Peyer CD4IFN-γ células T (27, 42-44). Estos resultados permiten especular que las cepas caninas TUCO-16 o TUCO-17 administradas por vía oral podrían ejercer un efecto inmunomodulador sobre los macrófagos actuando directamente sobre ellos o indirectamente a través de las citoquinas producidas por otras células inmunitarias como las células T. Estas funciones mejoradas de las células inmunitarias intestinales explicarían la mayor resistencia contra los patógenos bacterianos.++
La activación de las células inmunitarias y la producción de citoquinas son importantes en la defensa de la mucosa intestinal contra patógenos como ETEC y Salmonella. Aunque este mecanismo representa una importante línea primaria de defensa del huésped, la producción prolongada o desregulada de citoquinas proinflamatorias puede conducir a daño tisular y disfunción de la barrera epitelial (14). Por lo tanto, la regulación adecuada de la respuesta inflamatoria es necesaria para una protección completa y eficiente contra los patógenos intestinales. Los niveles aumentados de IL-10 y las concentraciones más bajas de TNF-α, KC y MCP-1 inducidos por los tratamientos con cepas caninas TUCO-16 o TUCO-17 indican que los ratones también estaban protegidos contra el daño inflamatorio. Esto está en línea con los estudios que demuestran que los probióticos pueden mitigar las respuestas inmunitarias dañinas durante las infecciones bacterianas Gram negativas (45, 46).
5 Conclusiones
Los estudios in vitro e in vivo realizados en este trabajo demuestran el potencial probiótico de las cepas TUCO-16 y TUCO-17, que fueron aisladas del calostro canino y de la leche. Estas cepas han mostrado resistencia a condiciones gastrointestinales simuladas y efectos inhibidores contra patógenos recurrentes en infecciones gastrointestinales, así como propiedades inmunomoduladoras. Por lo general, los productos probióticos para animales de compañía, como los perros, no se estudian ampliamente para validar los criterios necesarios para ser considerados probióticos. Sin embargo, hemos demostrado de manera convincente el potencial probiótico de las cepas derivadas de la leche canina para futuras aplicaciones en el tratamiento y prevención de infecciones gastrointestinales en perros.
En el futuro inmediato, es necesario realizar ensayos para validar los efectos beneficiosos directamente en el huésped canino. Además, se necesitan análisis complementarios para explicar los modos de acción celular y molecular de las cepas TUCO-16 y TUCO-17 para complementar las características de los probióticos aquí descritos.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue aprobado por el Comité de Ética, Bioética y Bioseguridad de la Vicerrectoría de Investigación y Desarrollo de la Universidad de Concepción. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
SQ-V: Conceptualización, Análisis formal, Supervisión, Redacción, revisión y edición, Curación de datos, Investigación, Metodología, Redacción, borrador original. CM-F: Conceptualización, Análisis formal, Investigación, Metodología, Redacción, borrador original, Redacción, revisión y edición, Obtención de fondos. AP: Análisis formal, Investigación, Redacción-borrador original, Curación de datos, Metodología. PB: Análisis formal, Investigación, Redacción, borrador original. FS: Investigación, Metodología, Redacción, Revisión y Edición, Curación de Datos, Supervisión. AA: Curación de datos, Investigación, Metodología, Análisis formal, Redacción: borrador original. BP: Análisis formal, Investigación, Metodología, Redacción, revisión y edición. NP: Curación de datos, Análisis formal, Investigación, Metodología, Visualización, Redacción, revisión y edición. CA: Conceptualización, Metodología, Análisis formal, Redacción, revisión y edición, Obtención de fondos. LA: Conceptualización, Análisis formal, Metodología, Curación de datos, Investigación, Redacción: borrador original. JV: Conceptualización, Curación de datos, Investigación, Metodología, Redacción, borrador original, Visualización, Redacción, revisión y edición. JT: Conceptualización, Redacción, revisión y edición, Análisis formal, Obtención de fondos, Administración de proyectos, Supervisión, Validación, Visualización.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este trabajo contó con el apoyo de la Agencia Nacional de Investigación y Desarrollo (ANID), Chile: Beca FONDEF no. ID20I10114; Beca Posdoctoral FONDECYT N° 3230216; Beca ANILLO nº. ACT210068.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1266064/full#supplementary-material
Referencias
1. Pilla R, Suchodolski JS. El microbioma intestinal de perros y gatos, y la influencia de la dieta. Vet Clin North Am Small Anim Pract. (2021) 51:605–21. doi: 10.1016/j.cvsm.2021.01.002
2. Pilla R, Suchodolski JS. El papel del microbioma intestinal canino y el metaboloma en la salud y las enfermedades gastrointestinales. Front Vet Sci. (2020) 6. doi: 10.3389/fvets.2019.00498
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Garrigues Q, Apper E, Chastant S, Mila H. Desarrollo de la microbiota intestinal en el perro en crecimiento: un proceso dinámico influenciado por factores maternos, ambientales y del huésped. Front Vet Sci. (2022) 9:964649. doi: 10.3389/fvets.2022.964649
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Coelho LP, Kultima JR, Costea PI, Fournier C, Pan Y, Czarnecki-Maulden G, et al. Similitud de los microbiomas intestinales del perro y del humano en el contenido de genes y la respuesta a la dieta. Microbioma. (2018) 6:72. doi: 10.1186/s40168-018-0450-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Dandrieux JRS. Enfermedad inflamatoria intestinal versus enteropatía crónica en perros: ¿son lo mismo? J Pequeña Anim Pract. (2016) 57:589–99. doi: 10.1111/jsap.12588
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Menozzi A, Dall’Aglio M, Quintavalla F, Dallavalle L, Meucci V, Bertini S. La rifaximina es una alternativa eficaz al metronidazol para el tratamiento de la enteropatía crónica en perros: un ensayo aleatorizado. BMC Vet Res. (2016) 12. doi: 10.1186/s12917-016-0851-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Jensen AP, Bjørnvad CR. Efecto clínico de los probióticos en la prevención o el tratamiento de enfermedades gastrointestinales en perros: una revisión sistemática. J Veterinario Pasante Med. (2019) 33:1849–64. doi: 10.1111/jvim.15554
8. Skotnitzki E, Suchodolski JS, Busch K, Werner M, Zablotski Y, Ballhausen BD, et al. Frecuencia de signos de enfermedad gastrointestinal crónica en perros después de un episodio de diarrea hemorrágica aguda. J Veterinario Pasante Med. (2022) 36:59–65. doi: 10.1111/jvim.16312
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Ziese AL, Suchodolski JS. Impacto de los cambios en la microbiota gastrointestinal en las enfermedades digestivas caninas y felinas. Veterinario Clin N Am. (2021) 51:155–69. doi: 10.1016/j.cvsm.2020.09.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Sfaciotte RAP, Coronel LG, Osaki SC, Wosiacki SR. Cepas grampositivas resistentes a bacterias de interés en salud animal y pública. Semina Cienc Agrar. (2015) 36:2693–712. doi: 10.5433/1679-0359.2015v36n4p2693
11. Orden C, Blanco JL, Álvarez-Pérez S, Garcia ME, Blanco JL, Garcia-Sancho M, et al. Aislamiento de Clostridium difficile de perros con trastornos digestivos, incluidas cepas estables resistentes al metronidazol. Anaerobio. (2017) 43:78–81. doi: 10.1016/j.anaerobe.2016.12.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Dazio V, Nigg A, Schmidt JS, Brilhante M, Campos-Madueño EI, Mauri N, et al. Duración del transporte de bacterias multirresistentes en perros y gatos bajo atención veterinaria y co-portación con sus dueños. Una sola salud. (2021) 13. doi: 10.1016/j.onehlt.2021.100322
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Whittemore JC, Moyers TD, Price JM. Ensayo aleatorizado, controlado y cruzado de prevención de signos gastrointestinales inducidos por antibióticos utilizando una mezcla simbiótica en perros de investigación sanos. J Veterinario Pasante Med. (2019) 33:1619–26. doi: 10.1111/jvim.15553
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Villena J, Kitazawa H. Modulación de las vías de señalización inflamatoria intestinales TLR4-i por microorganismos probióticos: lecciones aprendidas de Lactobacillus jensenii TL2937. Frente Immunol. (2014) 14:512. doi: 10.3389/fimmu.2013.00512
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Villena J, Vizoso-Pinto MG, Kitazawa H. Inmunidad antiviral innata intestinal e inmunobióticos: efectos beneficiosos contra la infección por rotavirus. Frente Immunol. (2016) 5:563. doi: 10.3389/fimmu.2016.00563
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Grześkowiak Ł, Endo A, Beasley S, Salminen S. Microbiota y probióticos en el bienestar canino y felino. Anaerobio. (2015) 34:14–23. doi: 10.1016/j.anaerobe.2015.04.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Coman MM, Verdenelli MC, Cecchini C, Belà B, Gramenzi A, Orpianesi C, et al. Caracterización probiótica de aislados de Lactobacillus de heces caninas. J Appl Microbiol. (2019) 126:1245–56. doi: 10.1111/jam.14197
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Lin CF, Lin MY, Lin CN, Chiou MT, Chen JW, Yang KC, et al. Probiótico potencial de cepas de Lactobacillus aisladas del tracto intestinal de cerdos y heces de perros con actividad antibacteriana frente a bacterias patógenas multirresistentes. Arch Microbiol. (2020) 202:1849–60. DOI: 10.1007/S00203-020-01908-W
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Jiménez-Trigos E, Toquet M, Barba M, Gómez-Martín Á, Quereda JJ, Bataller E. Búsqueda de bacterias lácticas antimicrobianas de perros Salmonella-negativos. BMC Vet Res. (2022) 3:12. doi: 10.1186/s12917-021-03070-x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Strompfová V, Kubašov I, Farbáková J, Madari A, Gancarčíková S, Mudronová D, et al. Evaluación de la administración del probiótico Lactobacillus fermentum CCM 7421 con alginita en perros. Probióticos Antimicrobianos Prot. (2018) 10:577–88. doi: 10.1007/s12602-017-9370-y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Bruni N, Martello E, Fusi E, Meineri G, Giardini A. Estudio de los parámetros fecales y la condición corporal en perros con una dieta suplementada con Lactobacillus acidophilus D2/CSL (CECT 4529). Ital J Anim Sci. (2020) 19:704–11. doi: 10.1080/1828051X.2020.1783378
22. Xu H, Huang W, Hou Q, Kwok LY, Laga W, Wang Y, et al. La administración oral de probióticos compuestos mejoró la ingesta de alimento canino, el aumento de peso, la inmunidad y la microbiota intestinal. Frente Immunol. (2019) 10. doi: 10.3389/fimmu.2019.00666
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Quilodrán-Vega SR, Villena J, Valdebenito J, Salas MJ, Parra C, Ruiz A, et al. Aislamiento de bacterias lácticas de leche porcina y caracterización de potenciales cepas probióticas con efectos antagónicos frente a patógenos gastrointestinales asociados a cerdos. Can J Microbiol. (2016) 62:514–24. doi: 10.1139/cjm-2015-0811
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Quilodrán-Vega S, Albarracín L, Mansilla F, Arce L, Zhou B, Islam MA, et al. Caracterización funcional y genómica de Ligilactobacillus salivarius TUCO-L2 aislado de leche Lama glama: una cepa inmunobiótica prometedora para combatir infecciones. Microbiol frontal. (2020) 8:608752. doi: 10.3389/fmicb.2020.608752
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Singh AK, Ramesh A. Evaluación de un método sencillo de preparación de ADN molde para la detección y tipificación de bacterias lácticas basadas en PCR. Microbiol alimentario. (2009) 26:504–13. doi: 10.1016/j.fm.2009.03.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Indo Y, Kitahara S, Tomokiyo M, Araki S, Islam MA, Zhou B, et al. Las cepas de Ligilactobacillus salivarius aisladas del intestino porcino modulan las respuestas inmunitarias innatas en las células epiteliales y mejoran la protección contra la sobreinfección viral-bacteriana intestinal. Frente Immunol. (2021) 12:652923. doi: 10.3389/fimmu.2021.652923
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Salva S, Villena J, Alvarez S. Actividad inmunomoduladora de cepas de Lactobacillus rhamnosus aisladas de leche de cabra: impacto en infecciones intestinales y respiratorias. Int J Microbiol Alimentario. (2010) 141:82–9. doi: 10.1016/j.ijfoodmicro.2010.03.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Anadón A, Ares I, Martínez-Larrañaga MR, Martínez MA. Prebióticos y probióticos en piensos y sanidad animal. Nutraceut Vet Med. (2019) 261–85. doi: 10.1007/978-3-030-04624-8_19
29. Kumar S, Pattanaik AK, Sharma S, Jadhav SE, Dutta N, Kumar A. Potencial probiótico de una bacteria Lactobacillus de origen fecal canino y su impacto en índices de salud intestinal seleccionados y respuesta inmune de perros. Probióticos, proteínas antimicrobianas. (2017) 9:262–77. DOI: 10.1007/S12602-017-9256-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Kubašová I, Lauková A, Hamarová L, Pristaš P, Strompfová V. Evaluación de enterococos para la posible utilización de probióticos en perros. Folia Microbiol. (2019) 64:177–87. doi: 10.1007/s12223-018-0640-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Hanifeh M, Spillmann T, Huhtinen M, Sclivagnotis YS, Grönthal T, Hynönen U. Adhesión ex vivo de Enterococcus faecalis y Enterococcus faecium a la mucosa intestinal de beagles sanos. Animales. (2021) 11. doi: 10.3390/ani11113283
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Martín R, Olivares M, Pérez M, Xaus J, Torre C, Fernández L, et al. Identificación y evaluación del potencial probiótico de lactobacilos aislados de leche canina. Veterinario J. (2010) 185:193–8. doi: 10.1016/j.tvjl.2009.04.014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Fernández L, Martínez R, Pérez M, Arroyo R, Rodríguez JM. Caracterización de Lactobacillus rhamnosus MP01 y Lactobacillus plantarum MP02 y evaluación de su potencial para la prevención de infecciones gastrointestinales en un modelo experimental canino. Microbiol frontal. (2019) 24:1117. doi: 10.3389/fmicb.2019.01117
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Bataller E, García-Romero E, Lobat L, Lizana V, Jiménez-Trigos E. Perros como fuente de Salmonella spp. en perros aparentemente sanos de la Comunidad Valenciana ¿Podría estar relacionado con bacterias lácticas intestinales? BMC Vet Res. (2020) 3:268. doi: 10.1186/s12917-020-02492-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Wagner A, Junginger J, Lemensieck F, Hewicker-Trautwein M. Caracterización inmunohistoquímica de macrófagos/fagocitos gastrointestinales en perros con enfermedad inflamatoria intestinal (EII) y perros sin EII. Veterinario Inmunol Inmunopatíaco. (2018) 197:49–57. doi: 10.1016/j.vetimm.2018.01.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Rocha-Ramírez LM, Pérez-Solano RA, Castañón-Alonso SL, Moreno Guerrero SS, Ramírez Pacheco A, et al. Las cepas probióticas de Lactobacillus estimulan la respuesta inflamatoria y activan los macrófagos humanos. J Immunol Res. (2017) 2017:4607491. doi: 10.1155/2017/4607491
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Matsubara VH, Ishikawa KH, Ando-Suguimoto ES, Bueno-Silva B, Nakamae AEM, Mayer MPA. Las bacterias probióticas alteran la expresión del receptor de reconocimiento de patrones y el perfil de citoquinas en un modelo de macrófagos humanos desafiado con Candida albicans y lipopolisacáridos. Microbiol frontal. (2017) 29:2280. doi: 10.3389/fmicb.2017.02280
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Marks SL, Rankin SC, Byrne BA, Weese JS. Bacterias enteropatógenas en perros y gatos: diagnóstico, epidemiología, tratamiento y control. J Veterinario Pasante Med. (2011) 25:1195–208. doi: 10.1111/j.1939-1676.2011.00821.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Joffe DJ, Schlesinger DP. Evaluación preliminar del riesgo de infección por Salmonella en perros alimentados con dietas de pollo crudo. ¿Puede Vet J. (2002) 43:441–2.
40. Reimschuessel R, Grabenstein M, Guag J, Nemser SM, Song K, Qiu J, et al. Encuesta multilaboratorio para evaluar la prevalencia de Salmonella en perros y gatos diarreicos y no diarreicos en los Estados Unidos entre 2012 y 2014. J Clin Microbiol. (2017) 5:1350–68. doi: 10.1128/JCM.02137-16
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Dubreuil JD, Isaacson RE, Schifferli DM. Escherichia coli enterotoxigénica animal. EcoSal Plus. (2016) 7. doi: 10.1128/ecosalplus. ESP-0006-2016
42. Marranzino G, Villena J, Salva S, Alvarez S. Estimulación de macrófagos por cepas inmunobióticas de Lactobacillus: influencia más allá del tracto intestinal. Microbiol Immunol. (2012) 56:771–81. doi: 10.1111/j.1348-0421.2012.00495.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Villena J, Chiba E, Tomosada Y, Salva S, Marranzino G, Kitazawa H, et al. Lactobacillus rhamnosus, administrado por vía oral, modula la respuesta inmunitaria respiratoria desencadenada por el patrón molecular poli(I:C) ASOCIADO AL PATÓGENO VIRAL. BMC Immunol. (2012) 13:53. doi: 10.1186/1471-2172-13-53
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Maldonado C, De, M.oreno, De Leblanc A, Vinderola G, Bibas Bonet ME, Perdigón G. Modelo propuesto: mecanismos de inmunomodulación inducidos por bacterias probióticas. Clin Vacuna Immunol. (2007) 14:485–92. doi: 10.1128/CVI.00406-06
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Roselli M, Finamore A, Britti MS, Konstantinov SR, Smidt H, de Vos WM, et al. La nueva cepa porcina de Lactobacillus sobrius protege las células intestinales de la infección enterotoxigénica por Escherichia coli K88 y previene el daño a la barrera de membrana. J Nutr. (2007) 137:2709–16. doi: 10.1093/jn/137.12.2709
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Zhang L, Xu Y, Liu H, Lai T, Ma J, Wang J, et al. Evaluación de Lactobacillus rhamnosus GG utilizando un modelo de diarrea de lechones Escherichia coli K88: efectos sobre la incidencia de diarrea, la microflora fecal y las respuestas inmunitarias. Microbiol veterinario. (2010) 141:142–8. doi: 10.1016/j.vetmic.2009.09.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: probiótico, infección gastrointestinal, perro, bacterias lácticas inmunomoduladoras, cepas lácteas
Cita: Quilodrán-Vega SR, Muñoz-Flores C, Pino A, Buldres P, Sandoval F, Aguirre A, Portillo B, Parra N, Altamirano C, Albarracín L, Villena J y Toledo JR (2023) Aislamiento, caracterización y evaluación de la actividad inmunomoduladora de cepas probióticas de calostro y leche canina. Frente. Vet. Sci. 10:1266064. doi: 10.3389/fvets.2023.1266064
Recibido: 27 de julio de 2023; Aceptado: 30 de octubre de 2023;
Publicado: 23 noviembre 2023.
Editado por:
Bing Dong, Universidad Agrícola de China, China
Revisado por:
Livio Galosi, Universidad de Camerino, Italia
Martín Fraga, Instituto Nacional de Investigación Agropecuaria (INIA), Uruguay
Copyright © 2023 Quilodrán-Vega, Muñoz-Flores, Pino, Buldres, Sandoval, Aguirre, Portillo, Parra, Altamirano, Albarracín, Villena y Toledo. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Sandra Rayén Quilodrán-Vega, de squilodran@udec.cl; Jorge R. Toledo, jotoledo@udec.cl
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía