Evaluación de los efectos de la dosis oral recomendada de diflubenzurón

Evaluación de los efectos de la dosis oral recomendada de diflubenzurón sobre la calidad de los espermatozoides y ovocitos bovinos mediante CASA y OPU-IVEP
 Marcelo Cunha Xavier1,2,
Marcelo Cunha Xavier1,2,  Leticia Prates Martins3,
Leticia Prates Martins3,  Rodrigo Martins Moura3,
Rodrigo Martins Moura3,  Divino Fabio Morais4,
Divino Fabio Morais4,  Joao Vitor Lima Barbosa4,
Joao Vitor Lima Barbosa4,  Ricardo Alamino Figueiredo5,
Ricardo Alamino Figueiredo5,  Mauricio Antonio Silva Peixer2,
Mauricio Antonio Silva Peixer2,  Rosangela Vieira de Andrade1 y
Rosangela Vieira de Andrade1 y  Joao Henrique Moreira Viana3,5*
Joao Henrique Moreira Viana3,5*- 1Programa de Pós-Graduação em Ciências Genômicas e Biotecnologia, Universidade Católica de Brasília, Brasília, DF, Brasil
- 2Bio Biotecnologia da Reprodução Animal, Brasilia, DF, Brasil
- 3Programa de Pós-Graduação em Biologia Animal, Universidade de Brasília, Brasilia, DF, Brasil
- 4Departamento de Medicina Veterinária, Centro Universitário de Brasília, Brasilia, DF, Brasil
- 5Embrapa Recursos Genéticos e Biotecnologia, Brasilia, DF, Brasil
Introducción: El objetivo de este estudio fue evaluar los efectos potenciales del diflubenzurón en la producción y calidad de los gametos, y en los resultados de la producción embrionaria in vitro (PIV), en bovinos.
Métodos: Se realizaron dos experimentos, el primero para evaluar los efectos sobre el semen, y el segundo sobre los complejos cúmulo-ovocitos (AOC) y sobre la EPIV. Los toros Nelore (Bos taurus indicus) (n = 14) o novillas (n = 16) se asignaron a grupos de control (GC) o tratamiento (DIF). Todos los grupos recibieron un suplemento de mezcla mineral añadido (DIF) o no (CG) con diflubenzurón (30 mg/cabeza/día), durante 8 semanas. Los animales fueron pesados y se recogieron muestras de sangre durante todo el período experimental. Cada dos semanas, los toros fueron sometidos a la recolección de semen y las novillas a sesiones de aspiración de folículos guiadas por ultrasonido transvaginal. El semen se sometió a una evaluación física y morfológica, y las muestras se almacenaron para un análisis de esperma asistido por computadora. Los AOC recuperados se evaluaron según la morfología y los clasificados como viables se enviaron a un laboratorio de IVEP.
Resultados: El diflubenzurón no tuvo efecto (P > 0,05) sobre el peso corporal promedio o en cualquier criterio de valoración hematológico o bioquímico de la sangre, independientemente del sexo. En el experimento 1, no hubo diferencia (P > 0,05) entre los grupos DIF y CG para la concentración, morfología o cinética de los espermatozoides. En el experimento 2, tampoco hubo efecto del diflubenzurón en el número de ovocitos totales, viables o de grado I, así como en las tasas de escisión o blastocisto (P > 0,05).
Discusión: En resumen, la administración oral de diflubenzurón, dentro de la dosis recomendada, no tiene efectos negativos a corto plazo sobre la producción y calidad de los espermatozoides o sobre el rendimiento de ovocitos y el potencial de desarrollo in vitro, en bovinos.
1. Introducción
El diflubenzurón [1-(4-clorofenil)-3-(2,6-difluorobenzoil) urea] es un producto químico de la clase benzoilfenil urea (BPU) ampliamente utilizado desde la década de 1970 para el control de plagas, tanto en áreas urbanas como en agricultura y ganadería (1). Inhibe la síntesis del exoesqueleto de quitina y actúa como un regulador del crecimiento de larvas de artrópodos, siendo utilizado como insecticida y acaricida. En el ganado bovino, el diflubenzurón se ha utilizado como aditivo dietético para controlar la mosca del cuerno (Haematobia irritans), la mosca doméstica (Musca domestica), la mosca del establo (Stomoxys calcitrans), así como las garrapatas (Rhipicephalus microplus). El diflubenzurón es mal absorbido por la vía gastrointestinal del ganado, ampliamente metabolizado y casi totalmente excretado en las heces y la orina, lo que resulta en concentraciones muy bajas de residuos en la leche y la carne (2, 3). Dentro de las dosis recomendadas, estos residuos suelen ser indetectables o inferiores a los valores de ingesta diaria admisible (IDA) (4) y, por lo tanto, es poco probable que presenten un problema de salud pública (1, 5). Por lo tanto, no hay tiempo de retiro, y el diflubenzurón se puede usar en ganado lechero lactante (6).
Aunque el diflubenzurón se ha considerado seguro para su uso en el ganado, los resultados de los estudios toxicológicos sobre especies no objetivo son controvertidos. No se observó ningún efecto carcinogénico del diflubenzurón in vitro (7, 8), mientras que los efectos genotóxicos y mutagénicos dependientes de la dosis se observaron in vivo en algunos modelos animales (9), pero no en otros (10). Tales inconsistencias pueden estar asociadas con el efecto indirecto de metabolitos, como la 4-cloroanilina, que se forman in vivo a partir de la pequeña proporción del diflubenzurón que realmente se absorbe (11). Recientemente, se demostró que el diflubenzurón induce la apoptosis celular y la generación de ROS en células epiteliales mamarias (12). Los efectos potencialmente perjudiciales para las células y especialmente para la integridad del ADN son particularmente importantes para los gametos y embriones y, por lo tanto, para la toxicidad reproductiva. También es de destacar que el diflubenzurón, además de actuar sobre la síntesis de quitina sobre las larvas, también perjudica la ovogénesis y reduce la población de folículos ováricos en insectos adultos (13). A este respecto, las posibles acciones sobre la gametogénesis en otras especies deben ser un objetivo para la evaluación del riesgo. Sin embargo, muy pocos estudios han abordado la posible toxicidad reproductiva del diflubenzurón en el ganado.
La producción de embriones in vitro (PIV) se ha convertido en la técnica de elección para la producción de embriones en muchos países, y en 2020 el número de embriones producidos in vitro fue tres veces mayor que el número de embriones recolectados in vivo en todo el mundo (14). Además de su papel clave como herramienta para los programas de cría de animales, IVEP también proporciona una plataforma importante para el estudio de los efectos ambientales, incluidos los disruptores endocrinos, en la reproducción. La maduración in vitro (MIV) de ovocitos bovinos, por ejemplo, se ha propuesto como un método potencial para evaluar los peligros químicos sobre la fertilidad, que requiere que muchos menos animales demuestren posibles efectos perjudiciales en la reproducción que los modelos in vivo (15). La especie bovina también es un modelo adecuado para estudios de toxicología reproductiva humana, debido a las similitudes entre la fisiología ovárica bovina y humana (16). Del mismo modo, los avances en la evaluación del semen bovino, como el uso del análisis de esperma asistido por computadora (CASA), han proporcionado herramientas más precisas para identificar posibles interferencias en la fisiología reproductiva masculina, por ejemplo, cambios menores en la calidad del esperma no detectables en los exámenes andrológicos de rutina.
El objetivo del presente estudio fue evaluar los posibles efectos perjudiciales potenciales a corto plazo del tratamiento con diflubenzurón sobre la cantidad, la calidad y el potencial de desarrollo de gametos en el ganado bovino. Nuestra hipótesis era que, dentro de las dosis recomendadas actuales, el tratamiento con diflubenzurón no afectaría la calidad de los gametos o embriones y el potencial de desarrollo en el ganado. La justificación de este estudio fue que el uso de nuevos métodos analíticos, como CASA, y modelos experimentales in vivo in vitro, como la asociación de la recuperación de ovocitos in vivo con la EPIV, son importantes para validar evaluaciones toxicológicas previas sobre la seguridad del diflubenzurón en el ganado.
2. Material y métodos
2.1. Animales y ubicación
El experimento 1 se llevó a cabo en una granja privada de carne ubicada en Formosa, GO, Brasil. Se inscribieron toros puberales Nelore (Bos taurus indicus) (n = 14), sin anomalías detectables durante los exámenes andrológicos. Los toros se mantuvieron bajo pastos de Brachiaria sp. con acceso ad libitum al agua, y recibieron 2 Kg/cabeza/día de suplemento concentrado con una mezcla mineral. El experimento 2 se realizó en la Estación Experimental Sucupira de Embrapa, en Brasilia, DF, Brasil. Se reclutaron novillas nulíparas, pubertales y ciclistas de Nelore (Bos taurus indicus) (n = 16), sin patologías detectadas durante el examen ginecológico. Las novillas fueron confinadas y recibieron una dieta de mantenimiento que consistía en ensilaje de maíz y mezcla mineral (100 g / día / cabeza), comenzando en un período de adaptación 2 semanas antes del comienzo del experimento. Ambos experimentos se realizaron de junio a agosto (invierno, estación seca).
2.2. Diseño experimental
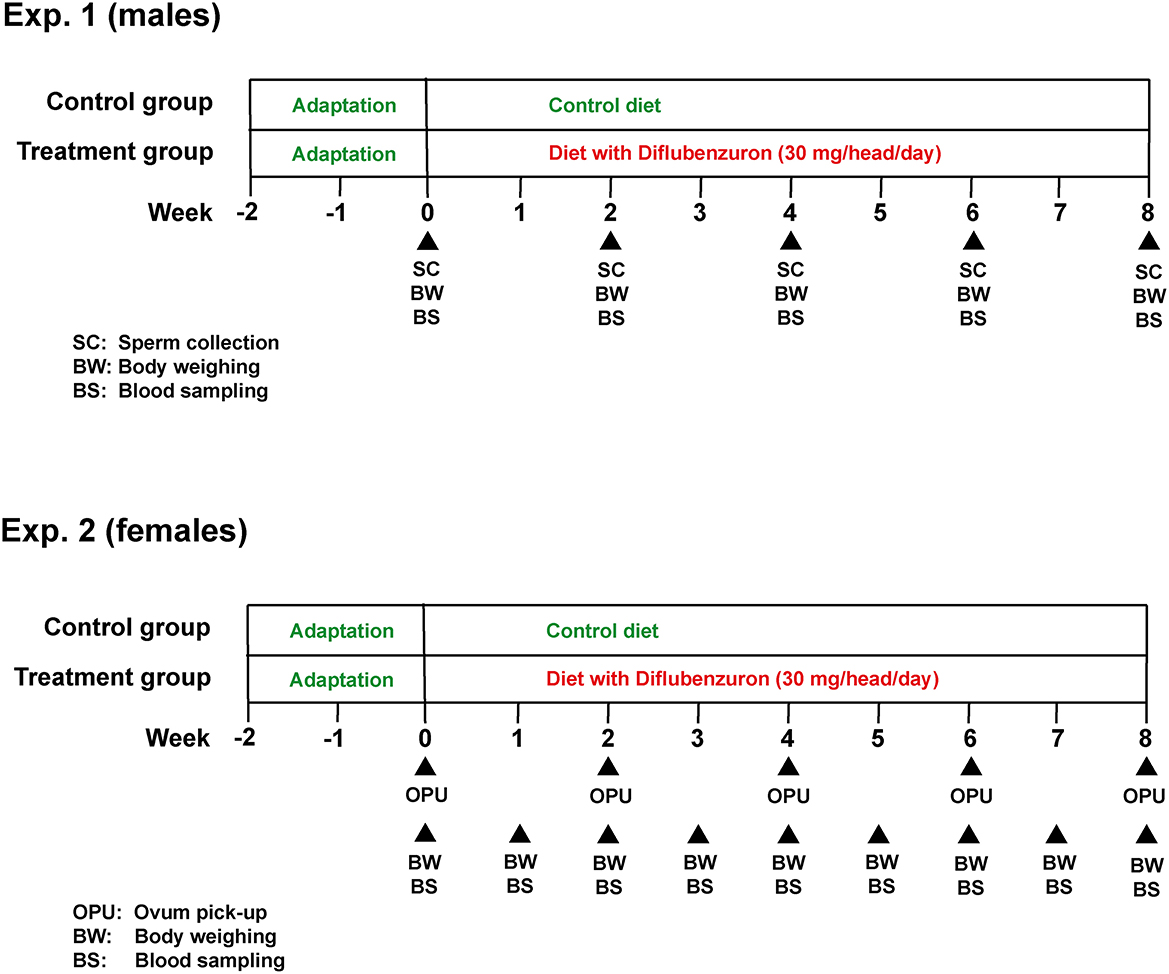
Este estudio se subdividió en dos experimentos (para toros y novillas, respectivamente), ambos siguiendo un diseño experimental similar (Figura 1). En ambos experimentos, los animales se distribuyeron en un grupo de control (GC) o tratamiento (DIF). Los toros se asignaron al azar a los grupos experimentales, mientras que las novillas se clasificaron primero según el recuento de folículos antrales (AFC), tal como se define en otra parte (17) y, de la posición más alta a la inferior, se asignaron alternativamente a los grupos GC o DIF. El equilibrio de la distribución fue confirmado por la falta de diferencia (P > 0,05) en AFC entre los dos grupos al comienzo del experimento. Los grupos experimentales recibieron una mezcla mineral añadida (DIF) o no (CG) con diflubenzurón, calculada para satisfacer los requerimientos minerales diarios y, en los grupos DIF, para asegurar el consumo diario de 1 g de una formulación comercial (Difly S3, Champion, Anápolis, Brasil) con diflubenzurón al 3% (30 mg por cabeza/día, según recomendación de la etiqueta del producto, https://www.champion.ind.br/produto/difly-s3-6-kg-2/), durante 8 semanas (56 días). El consumo de la mezcla mineral de cada grupo fue monitoreado diariamente, confirmando la ingestión de la dosis esperada de diflubenzurón. Se evaluó el peso corporal y se recolectaron muestras de sangre semanalmente en las vaquillas, y cada 15 días en los toros. Comenzando inmediatamente antes de los tratamientos, cada dos semanas los toros fueron sometidos a la recolección de semen, y las novillas a la aspiración transvaginal guiada por ultrasonido del folículo (OPU), en un total de cinco sesiones en cada experimento. El semen se sometió a una evaluación física y morfológica, y las muestras se almacenaron para un análisis de esperma asistido por computadora (CASA). Los complejos cúmulo-ovocitos (AOC) recuperados fueron evaluados según la morfología y enviados a un laboratorio comercial para la EPIV.
2.3. Muestreo de sangre y análisis de sangre
Las muestras de sangre se recogieron mediante punción de la vena o arteria coccígea, utilizando agujas de doble extremo 21G. Se recogieron dos muestras de cada animal en tubos de vacío de 5 mL, uno con y otro sin EDTA K3 (Vacutainer Systems; Becton Dickinson, São Paulo, SP, Brasil). Las muestras se mantuvieron refrigeradas (5 °C) y se transportaron a un laboratorio comercial de análisis clínicos veterinarios. Cada muestra fue evaluada para hemograma y criterios de valoración bioquímicos.
2.4. Recogida y análisis del esperma
Las muestras de semen se recogieron por electroeyaculación, como se describe en otra parte (18). Brevemente, los toros fueron contenidos en un conducto de compresión de ganado de carne, y la eyaculación fue inducida usando un electroeyaculador, en el preajuste # 4 (Autojac 3, Neovet, Uberaba, Brasil). Las muestras (20 μL) de semen fresco se evaluaron bajo aumento x200 para movimiento de masa, vigor y motilidad, y bajo aumento x1000 para análisis morfológico de los espermatozoides, como se describió anteriormente (19). El semen se diluyó 1:1 en un extensor de semen (Optixcell, IMV Technologies Brasil, Campinas, Brasil) y se mantuvo bajo refrigeración (5°C) hasta su transporte al laboratorio. El semen fresco de cada toro se rediluyó 1:10 en Optixcell y se analizó una muestra de 3 μL en una cámara de conteo (Leja, IMV Technologies) utilizando CASA (SpermVision Minitube GMBH, Tiefenbach, Alemania), con el preajuste estándar del equipo. El semen restante se diluyó, de acuerdo con la concentración de espermatozoides determinada por CASA, a una concentración final de 50 x 106 esperma/ml, llenado en pajitas de 0,5 ml, estabilizado a 4 °C durante 4 h y congelado con una máquina de congelación (Cryogen, Neovet) con la curva de congelación estándar para el ganado. Las muestras de semen congelado también fueron analizadas por CASA, inmediatamente después de la descongelación o después de ser sometidas a una prueba de termorresistencia (TRT) durante 4 h.
2.5. Recuperación de ovocitos y producción embrionaria in vitro
Todos los exámenes ecográficos y procedimientos de OPU se realizaron utilizando un dispositivo de ultrasonido portátil (MyLab 30 Gold Vet, Esaote, Génova, Italia) equipado con una sonda rectal lineal de 7,5 MHz o una sonda vaginal microconvexa de 7,5 MHz montada en una guía de agujas de polietileno hecha a medida (WTA Tecnologia Aplicada, Cravinhos, Brasil). Antes de la primera OPU, el número de folículos detectables por sonografía (AFC) en los ovarios se registraba y se usaba para equilibrar la distribución de novillas entre los tratamientos.
Los procedimientos OPU-IVEP utilizados fueron los mismos que se describen en otra parte (20). Brevemente, se recolectaron AOC inmaduros por punción y aspiración de folículos visibles (>2 mm), utilizando agujas de 20 G y una presión de vacío de aproximadamente 80 mm/Hg. El líquido aspirado con el contenido del folículo se recuperó en tubos de 50 ml que contenían DPBS agregado con 1% de FCS y 125 UI / ml de heparina sódica. La calidad de los AOC se evaluó bajo un microscopio estereoscópico con un aumento de x40 y aquellos clasificados morfológicamente como viables, como se describió anteriormente (21), se transfirieron a criotubos de 1,2 mL (Corning, Nueva York, EE.UU.) que contenían medio de maduración y se transportaron en una incubadora portátil (Minitub do Brasil, Porto Alegre, Brasil) a 38 ° C al laboratorio IVEP.
El AOC de cada donante se sometió a maduración in vitro (GIV), fertilización in vitro (FIV) y posterior cultivo embrionario in vitro (VCI) por separado. La MIV se realizó durante 20 h en TCM199 (Gibco, Nueva York, EUA) suplementada con 0,05 UI/ml de FSH (Pluset, Hertape-Calier, Barcelona, España), 1 mg/ml de estradiol y 10% de FCS en una incubadora humidificada al 5% de CO2 en el aire y 38.5°C. Los AOC expandidos se desnudaron parcialmente y se transfirieron a gotas con el medio piruvato de lactato de albúmina (TALP) de Tyrode, suplementado con 10 μg / ml de heparina, 20 μM de D-penicilamina, 10 μM de hipotaurina y 1 μM de epinefrina. La FIV se realizó con 1 x 106 espermatozoides/ml durante 18 h. El semen de un solo padre Nelore con fertilidad conocida en IVEP se utilizó para todos los lotes de fertilización. Los cigotos presuntivos fueron entonces IVC en gotitas de 50 μL de líquido de oviducto sintético (SOFaa) suplementado con aminoácidos esenciales y no esenciales, tricitrato de sodio de 0,34 mM, mioinositol de 2,77 mM y FCS al 10%, bajo aceite mineral. Las tasas de escisión y blastocisto se determinaron a las 72 y 168 h después de la inseminación. Los blastocistos también se clasificaron según el estadio del desarrollo (blastocistos iniciales, blastocistos, blastocistos expandidos o blastocistos eclosionados). Un subconjunto de los blastocistos expandidos (alrededor de 30/lote/grupo) se transfirieron a portaobjetos de vidrio, se tiñeron con Hoechst 33342 (Sigma-Aldrich, St. Louis, MO, EUA) y se evaluaron bajo el microscopio (x1000) para el número total de células (ICM más trofoblasto).
2.6. Análisis de datos
Todos los criterios de valoración relacionados con el peso, los análisis hematológicos y bioquímicos en sangre, la producción y calidad de los espermatozoides en los toros, y el rendimiento de ovocitos y la producción embrionaria in vitro en novillas, se compararon entre los grupos GC y DIF mediante el procedimiento GLIMMIX de SAS (SAS Studio 3.8, University Edition; SAS Institute Inc., Cary, NC, EE.UU.) con una declaración repetida para tener en cuenta las mediciones a lo largo del tiempo. El modelo incluyó los efectos del tratamiento (control o diflubenzurón), el tiempo (recolección de semen o sesión de OPU-IVEP) y sus interacciones, y se ajustó por el tipo de distribución de cada variable. Debido a las bajas frecuencias individuales, las patologías espermáticas se agruparon como defectos mayores o menores, como se describe en otra parte (22). Del mismo modo, los blastocistos expandidos se agruparon según el recuento de células en aquellos con >100 o < 100 células. Las diferencias entre las medias se determinaron mediante la prueba T de Student. Los resultados se muestran como media ± SEM. Los valores exactos de p se muestran para cada comparación, para indicar cuán cercanas estaban las diferencias medias de la significación (p < 0,05).
3. Resultados
El peso corporal promedio y los parámetros sanguíneos en toros Nelore y novillas de los grupos CG y DIF se muestran en la Tabla 1. En general, no hubo efecto (p > 0,05) del tratamiento en ninguno de los criterios de valoración analizados tanto para hombres como para mujeres. Se observó un efecto de tiempo (P > 0,05) sobre el peso en los hombres y en la mayoría de los parámetros sanguíneos tanto en los grupos como en el sexo, pero solo se observó una interacción tratamiento x tiempo para la creatinina y la fosfatasa alcalina (ALP) en los hombres.
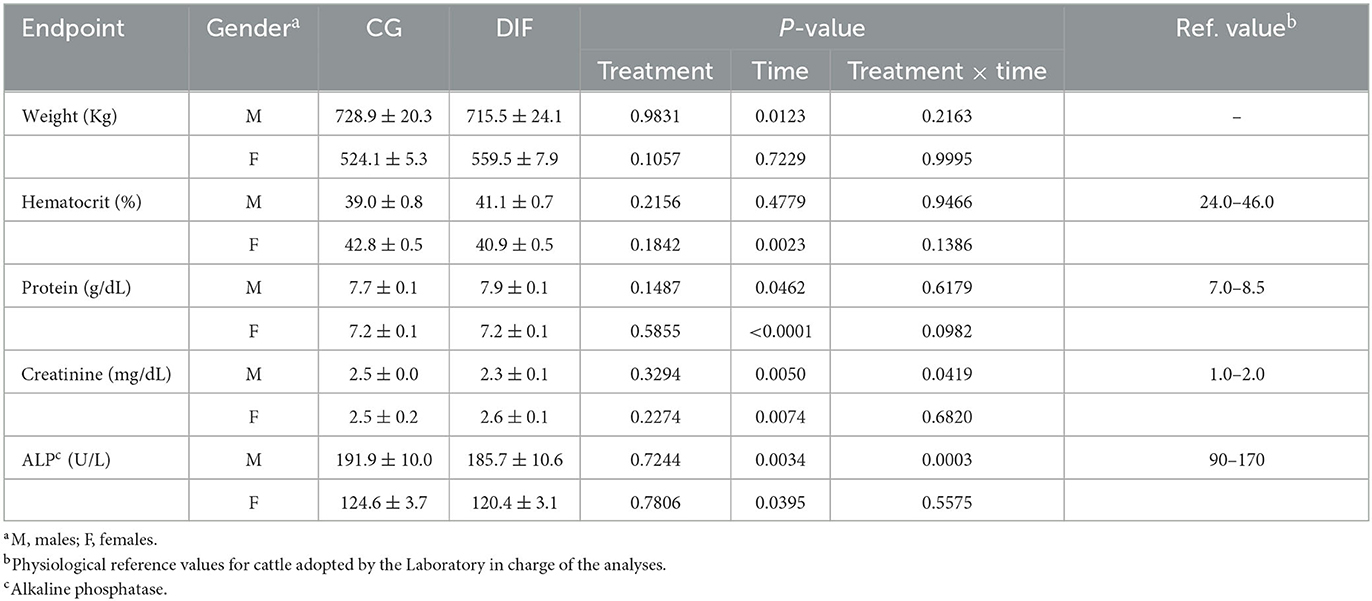 Tabla 1. Criterios de valoración hematológicos y bioquímicos en sangre (media ± SEM) de toros y novillas Nelore (Bos taurus indicus) tratados (DIF) o no (GC) con 30 mg de diflubenzurón/día, durante 8 semanas.
Tabla 1. Criterios de valoración hematológicos y bioquímicos en sangre (media ± SEM) de toros y novillas Nelore (Bos taurus indicus) tratados (DIF) o no (GC) con 30 mg de diflubenzurón/día, durante 8 semanas.
3.1. Experimento 1
Dos toros no se adaptaron a la rutina de recolección de semen y fueron retirados del experimento, por lo tanto, los grupos CG y DIF consistieron en cinco y siete toros, respectivamente. El tratamiento con diflubenzurón no tuvo efecto (P > 0,05) sobre ningún parámetro físico o de espermatozoides de CASA, independientemente de si los análisis se realizaron con semen fresco, congelado-descongelado o congelado-descongelado más TRT (Tabla 2). Por el contrario, hubo un efecto temporal (P < 0,05) en la mayoría de los criterios de valoración. Rara vez se observaron efectos de tratamiento x tiempo, en todos los casos asociados con fluctuaciones en los valores, en lugar de con tendencias crecientes o decrecientes a lo largo del período experimental.
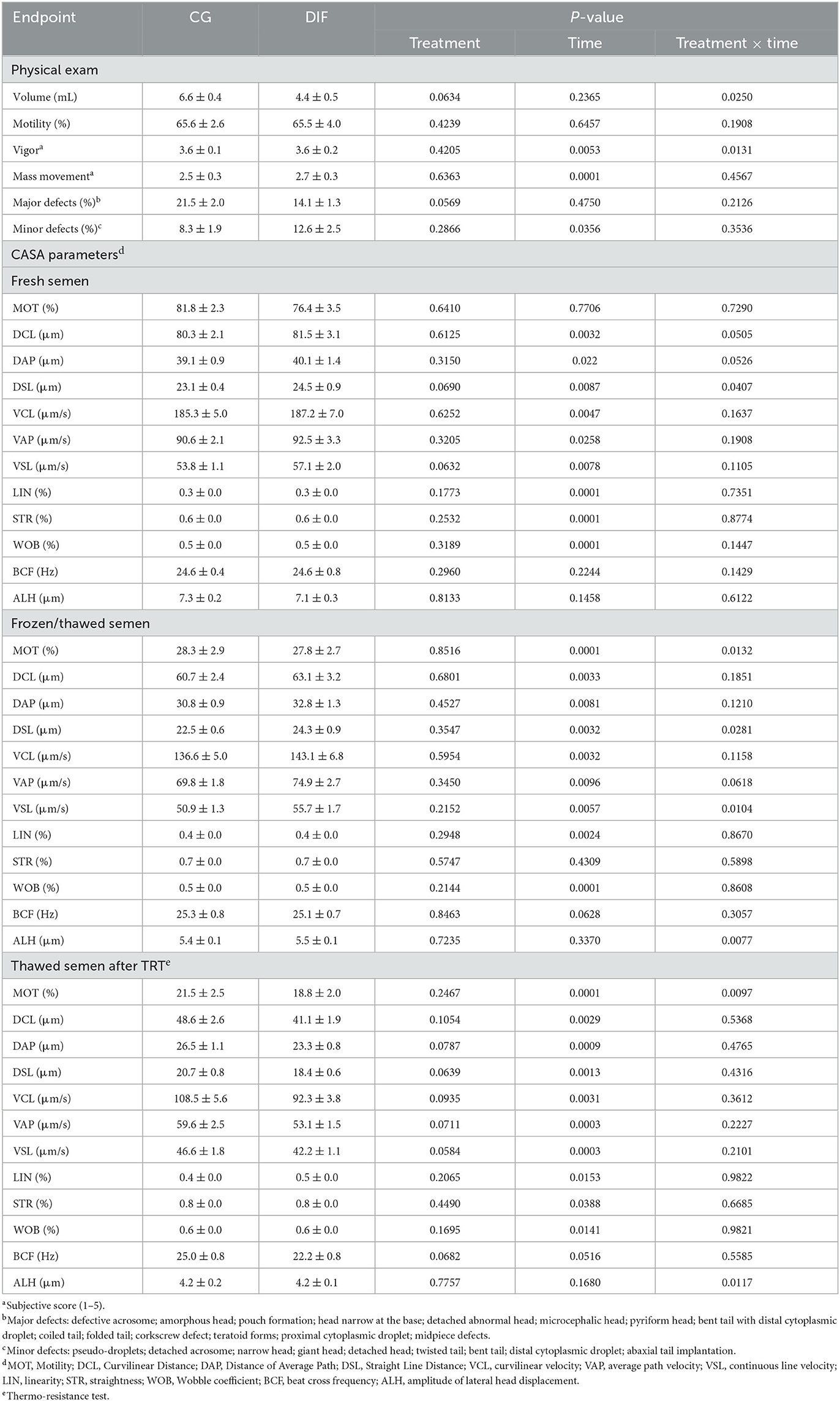 Tabla 2. Criterios de valoración espermáticos (media ± SEM) en toros Nelore (Bos taurus indicus) tratados (DIF, n = 7) o no (GC, n = 5) con 30 mg de diflubenzurón/día, durante 8 semanas.
Tabla 2. Criterios de valoración espermáticos (media ± SEM) en toros Nelore (Bos taurus indicus) tratados (DIF, n = 7) o no (GC, n = 5) con 30 mg de diflubenzurón/día, durante 8 semanas.
3.2. Experimento 2
Los datos relacionados con la recuperación de ovocitos y la producción embrionaria in vitro se muestran en la Tabla 3. Durante las cinco sesiones de la OPU, los grupos GC y DIF produjeron 801 y 986 AOC totales, y 631 y 797 AOC viables, respectivamente. La tercera sesión de IVEP se vio afectada por la contaminación microbiológica en ambos grupos durante la FIV, por lo que los datos de esta sesión de IVEP fueron descartados. De manera similar a lo que se observó para el semen, se observó un efecto temporal para la mayoría de los criterios de valoración de OPU-IVEP, mientras que no hubo efecto (P > 0,05) del tratamiento con diflubenzurón sobre ningún parámetro. Se observó una interacción tratamiento x tiempo en el número de folículos aspirados, que disminuyó (P < 0,05) consistentemente en GC pero aumentó (P < 0,05) de las sesiones tres a cuatro en el grupo DIF, y en la proporción de blastocistos expandidos y de embriones con > 100 células, que fluctuó en ambos grupos.
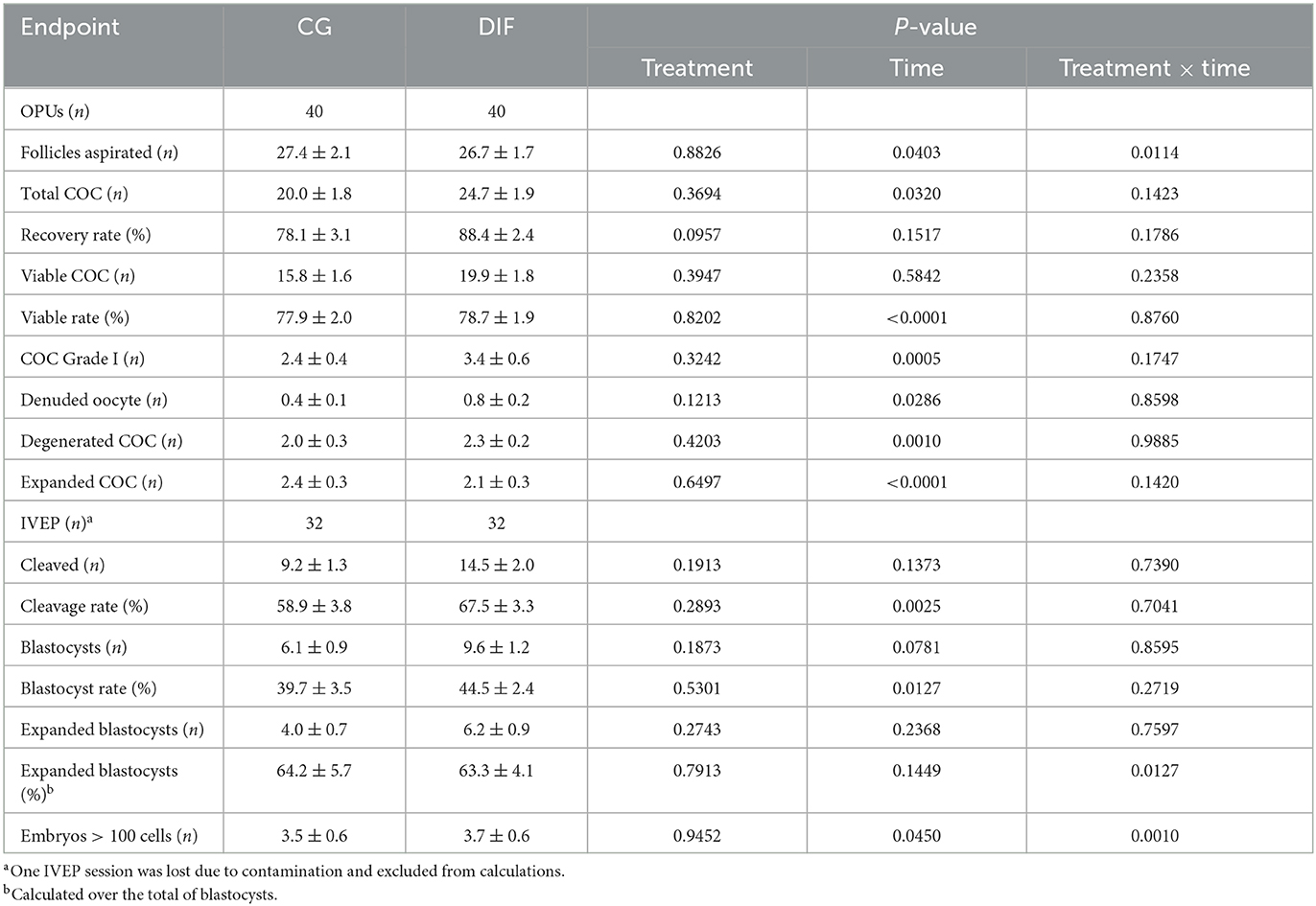 Tabla 3. Resultados de OPU-IVEP (media ± SEM) en novillas de Nelore (Bos taurus indicus) tratadas (DIF) o no (GC) con 30 mg de diflubenzurón/día, durante 8 semanas.
Tabla 3. Resultados de OPU-IVEP (media ± SEM) en novillas de Nelore (Bos taurus indicus) tratadas (DIF) o no (GC) con 30 mg de diflubenzurón/día, durante 8 semanas.
4. Discusión
Los inhibidores de la quitina benzoilurea, como el diflubenzurón, son pesticidas selectivos con efectos perjudiciales conocidos en los artrópodos, así como en otros organismos que presentan quitina en sus conchas o exoesqueleto, pero no en mamíferos. El diflubenzurón fue aprobado y actualmente se utiliza para el control de una variedad de plagas en la agricultura y parásitos en la ganadería (5). Sin embargo, los estudios de toxicidad han demostrado posibles efectos secundarios en modelos animales no objetivo. Por lo tanto, la seguridad de estos productos químicos debe reevaluarse con el tiempo, especialmente cuando se dispone de nuevos métodos analíticos o modelos experimentales. Nuestra hipótesis era que, dentro de las dosis recomendadas actuales, el tratamiento con diflubenzurón no afectaría la calidad de los gametos o embriones y el potencial de desarrollo en el ganado, según lo determinado por CASA u OPU-IVEP. El presente estudio proporcionó evidencia adicional de la falta de toxicidad reproductiva del diflubenzurón en el ganado.
Aunque el presente estudio se centró en los efectos potenciales sobre gametos y embriones, también monitorizamos el peso y los parámetros hematológicos que podrían indicar toxicidad sistémica. Se evaluaron indicadores de la función del sistema hematopoyético (hematocrito, proteína), hepática (fosfatasa alcalina) y renal (creatinina). El hígado es el principal órgano responsable del metabolismo de los compuestos endógenos y exógenos y, junto con el riñón, es responsable de la excreción de la mayoría de los metabolitos. Por lo tanto, estos órganos son objetivos para las acciones tóxicas de los productos químicos, lo que resulta en concentraciones plasmáticas alteradas de biomarcadores como ALP y creatinina (23, 24). Además, se encontró que la ALT aumentó en ratas macho tratadas con diflubenzurón (11). El sistema hematopoyético, por otro lado, es altamente susceptible a sustancias tóxicas, siendo un criterio de valoración importante en los estudios toxicológicos (25). En el presente estudio, ningún criterio de valoración fisiológico se vio afectado por el tratamiento con diflubenzurón. Como era de esperar, observamos fluctuaciones a lo largo del tiempo, excepto para la creatinina dentro del rango fisiológico para el ganado (26, 27). En ambos grupos, las concentraciones plasmáticas de creatinina fueron consistentemente más altas que los valores de referencia utilizados por el laboratorio que realizó los análisis. Sin embargo, todos los animales permanecieron sanos y no mostraron otros signos de intoxicación potencial durante todo el experimento. Se puede especular si las concentraciones de creatinina más altas observadas se debieron a alguno de los efectos ambientales que pueden afectar los umbrales y la amplitud de los intervalos de referencia, como se informó en otra parte (27). Tampoco hubo efecto del tratamiento con DIF sobre el peso corporal, que se mantuvo constante en las novillas que recibieron una dieta de mantenimiento, mientras que aumentó con el tiempo en los toros criados en pastos.
La fertilidad es un componente clave de las pruebas de toxicidad. Se han descrito varios productos químicos como disruptores endocrinos para el ganado (28) y, por lo tanto, con el potencial de afectar el proceso reproductivo y comprometer la fertilidad (29). Sin embargo, la toxicidad reproductiva del diflubenzurón se evaluó principalmente en especies no objetivo, especialmente en roedores. de Barros et al. (11) observaron que la exposición subaguda de ratas macho al diflubenzurón se asoció con una disminución del peso testicular y la producción diaria de espermatozoides, aunque no se encontraron alteraciones en la morfología de los espermatozoides. La extrapolación de estos resultados a otras especies, sin embargo, requiere precaución, particularmente debido a las diferencias en la fisiología de ambas especies y en las dosis utilizadas. Curiosamente, hay muy pocos informes que evalúen la toxicidad del diflubenzurón en la reproducción del ganado. Un estudio realizado a fines de la década de 1970 con terneros machos jóvenes de Holstein no encontró ningún efecto del diflubenzurón en el esperma (30). Sin embargo, en ese estudio se realizó una sola evaluación del semen. En el presente estudio, la ventana de tiempo (56 días) utilizada casi abarcó el ciclo del epitelio seminífero y la duración de la espermatogénesis en el ganado (31), por lo que pudimos evaluar los efectos potenciales a lo largo del tiempo. Además, mediante el uso de CASA, una técnica analítica mucho más sensible, evaluamos una variedad de criterios de valoración cinéticos de los espermatozoides. Sin embargo, no se detectó evidencia de efectos perjudiciales del diflubenzurón.
Un sesgo potencial de los estudios que evalúan la recuperación de AOC y, por lo tanto, el rendimiento embrionario es la distribución desigual de las vacas que muestran AFC alta o baja. La población de folículos ováricos tiene una distribución similar a Weibull, en lugar de gaussiana, con unos pocos animales que presentan más de 100 folículos antrales en un momento dado (32). Se han reportado donantes que producen más de 500 AOC (33), por lo que una distribución aleatoria de donantes dentro de los tratamientos puede dar lugar a un sesgo significativo. En el presente estudio, utilizamos una estrategia de distribución equilibrada, asegurando que no hubiera diferencias ni en la AFC ni en el número de folículos aspirados o AOC recuperados en la primera sesión de OPU-IVEP entre los grupos GC y DIF.
En novillas, como se observó para toros, no hubo efecto de diflubenzurón en ninguno de los criterios de valoración evaluados. Se esperaban diferencias a lo largo del tiempo, particularmente debido a la tendencia de reducción en la recuperación de AOC en donantes de Bos taurus indicus sometidos a OPU repetidas (34). Hasta donde sabemos, este es el primer estudio que aborda los posibles efectos peligrosos del diflubenzurón en la calidad de los ovocitos y el potencial de desarrollo en el ganado. En los insectos, el diflubenzurón actúa no solo sobre la formación de quitina, sino también directamente sobre la reproducción en hembras adultas, reduciendo las poblaciones de folículos, la formación de yemas y la fecundidad (13, 35). Los mecanismos subyacentes a estos últimos efectos, sin embargo, no se comprenden completamente. Los posibles efectos perjudiciales sobre la reproducción natural en especies grandes y monoovulares, como el ganado, pueden ser difíciles de demostrar, debido al elevado número de animales necesarios y a la dificultad de controlar otros efectos ambientales. En este sentido, el modelo OPU-IVEP utilizado fue particularmente importante para asegurar la evaluación de un alto número de gametos (>800 por grupo), así como la evaluación de su potencial de desarrollo durante el período crítico que abarca la maduración, la fertilización y el desarrollo temprano del embrión. En ambos grupos (CG y DIF), la recuperación y calidad de los ovocitos, así como las tasas de escisión y embriones, fueron similares, y dentro de las reportadas para la raza Nelore (20, 32, 36). Por lo tanto, los resultados actuales sugieren que no hay interferencia del tratamiento con diflubenzurón en las últimas etapas de la foliculogénesis y la maduración de los ovocitos, de manera diferente a lo que se observa en animales no cordados.
5. Conclusión
En resumen, no hay evidencia de un efecto perjudicial de los tratamientos a corto plazo con diflubenzurón, dentro de la dosis recomendada, sobre la calidad de los gametos o el potencial de desarrollo embrionario en el ganado bovino.
Declaración de disponibilidad de datos
Los datos brutos que apoyan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité de Ética en el Uso de Animales de Embrapa (Protocolo CEUA-002/2022). Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones del autor
MP y JV: conceptualización, supervisión y metodología. MP, RF y JV: financiación. MX, LM, RM, DM, JB y JV: investigación. JV: análisis estadístico. MX, RF, RA y JV: escritura, borrador original y redacción, revisión y edición. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
El apoyo financiero fue proporcionado por el Proyecto Embrapa 30.19.90.006.00.00 y el Proyecto FAPDF 00193-00000613/2023-95.
Reconocimientos
Los autores agradecen a Champion Farmacoquímica LTDA por suministrar la formulación comercial de diflubenzurón utilizada.
Conflicto de intereses
MX y MP fueron empleados de Bio Biotecnologia da Reprodução Animal. RF y JV fueron empleadas por Embrapa Recursos Genéticos e Biotecnologia.
Los autores restantes declaran que la investigación se realizó en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Sun R, Liu C, Zhang H, Wang Q. Inhibidores de la síntesis de quitina benzoilurea. J Agric Food Chem. (2015) 63:6847–65. doi: 10.1021/acs.jafc.5b02460
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Ivie GW. Destino del diflubenzurón en bovinos y ovinos. J Agric Food Chem. (1978) 26:81–9. DOI: 10.1021/JF60215A013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Tfouni SAV, Furlani RPZ, Carreiro LB, Loredo ISD, Gomes AG, Alves LA, et al. Determinación de residuos de diflubenzurón en la leche y los tejidos del ganado. Arq Br Med Vet Zoot. (2013) 65:301–7. doi: 10.1590/S0102-09352013000100043
4. FAO. (2011). Disponible en línea en: https://www.fao.org/fileadmin/templates/agphome/documents/Pests_Pesticides/JMPR/Report11/Diflubenzuron.pdf (consultado el 2 de mayo de 2023).
5. Junquera P, Hosking B, Gameiro M, Macdonald A. Benzoylphenyl ureas as as veterinary antiparasitics. Una visión general y una perspectiva con énfasis en la eficacia, el uso y la resistencia. Parásito. (2019) 26:26. doi: 10.1051/parásito/2019026
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Van der Leek ML, Donovan GA, Saltman RL, Moja RJ. Efecto de un bolo de liberación controlada con insecticida en una prueba de residuos de antibióticos de leche. J Dairy Sci. (1991) 74:433–5. DOI: 10.3168/JDS. S0022-0302(91)78188-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Perocco P, Colacci A, Grilli S. Actividades citotóxicas y transformadoras celulares in vitro ejercidas por los plaguicidas cianazina, ditianon, diflubenzurón, procimidona y vinclozolina sobre células BALB/c 3T3. Environ mol mutágena. (1993) 21:81–6. doi: 10.1002/em.2850210111
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Bayoumi AE, Pérez-Pertejo Y, Zidan HZ, Balaña-Fouce R, Ordóñez C, Ordóñez D. Cytotoxic effects of two antimolting insecticides in mammalian CHO-K1 cells. Ecotoxicol Environ Saf. (2003) 55:19–23. doi: 10.1016/S0147-6513(02)00068-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. de Barros AL, de Souza VV, Navarro SD, Oesterreich SA, Oliveira RJ, Kassuya CA, et al. Efectos genotóxicos y mutagénicos del diflubenzurón, un regulador del crecimiento de insectos, en ratones. J Toxicol Environ Health A. (2013) 76:1003–6. doi: 10.1080/15287394.2013.830585
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Quarles JM, Norman JO, Kubena LF. Ausencia de transformación por diflubenzurón en un ensayo de carcinógeno transplacentario mediado por el huésped. Bull Environ Contam Toxicol. (1980) 25:252–6. doi: 10.1007/BF01985520
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. de Barros AL, Cavalheiro GF, de Souza AV, Traesel GK, Anselmo-Franci JA, Kassuya CA, et al. Evaluación de toxicidad subaguda de diflubenzurón, un regulador del crecimiento de insectos, en ratas macho adultas. Medio ambiente Toxicol. (2016) 31:407–14. DOI: 10.1002/tox.22054
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Lee W, An G, Park H, Lim W, Song G. El diflubenzurón conduce a la muerte celular apoptótica a través de la generación de ROS y la disfunción mitocondrial en células epiteliales mamarias bovinas. Pestic Biochem Physiol. (2021) 177:104893. doi: 10.1016/j.pestbp.2021.104893
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Smagghe G, Zotti M, Retnakaran A. Targeting female reproduction in insects with biorational insecticides for pest management: a critical review with suggestions for future research. Curr Opin Insect Sci. (2019) 31:65–9. doi: 10.1016/j.cois.2018.10.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Viana J. 2020 Estadísticas de recolección y transferencia de embriones en animales domésticos de granja: la industria mundial del embrión crece a pesar de la pandemia. Embr Tech Newsl. (2021) 39:24–37.
15. Luciano AM, Franciosi F, Lodde V, Corbani D, Lazzari G, Crotti G, et al. Evaluación de la transferibilidad y variabilidad entre laboratorios de la prueba in vitro de maduración de ovocitos bovinos (GIV) dentro de ReProTect. Reprod Toxicol. (2010) 30:81–8. doi: 10.1016/j.reprotox.2010.01.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Santos RR, Schoevers EJ, Roelen BA. Utilidad de los modelos de MIV/FIV bovinos y porcinos para toxicología reproductiva. Reprod Biol Endocrinol. (2014) 12:117. doi: 10.1186/1477-7827-12-117
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Evans AC, Mossa F, Fair T, Lonergan P, Butler ST, Zielak-Steciwko AE, et al. Causas y consecuencias de la variación en el número de folículos ováricos en el ganado. Soc Reprod Fertil Suppl. (2010) 67:421–9. doi: 10.7313/UPO9781907284991.032
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Doroteu EM, Viana JHM, Ferreira Junior JA, Macedo JTA, Oliveira RA, Pedroso PMO. Efecto de una o dos dosis de una vacuna anti-GnRH sobre las características morfofuncionales testiculares en toros de Nelore. Trop Anim Health Prod. (2021) 53:153. DOI: 10.1007/S11250-021-02600-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Menon AG, Barkema HW, Wilde R, Kastelic JP, Thundathil JC. Asociaciones entre anomalías espermáticas, raza, edad y circunferencia escrotal en toros de carne. Can J Vet Res. (2011) 75:241–7.
20. Malard PF, Peixer MAS, Grazia JG, Brunel HDSS, Feres LF, Villarroel CL, et al. La inyección intraovárica de células madre mesenquimales mejora el rendimiento de ovocitos y la producción embrionaria in vitro en un modelo bovino de pérdida de fertilidad. (2020) 10:8018. DOI: 10.1038/S41598-020-64810-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Viana JH, De Almeida Camargo LS, De Moraes Ferreira A, De Sa WF, De Carvalho Fernandes CA, De Pinho Marques Junior A. Los intervalos cortos entre la aspiración de folículos guiada por ecografía mejoran la calidad de los ovocitos pero no impiden el establecimiento de folículos dominantes en la raza Gir (Bos indicus) del ganado vacuno. Anim Reprod Sci. (2004) 84:1–12. doi: 10.1016/j.anireprosci.2003.12.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Johnson WH. La importancia para la fertilidad del toro de los espermatozoides morfológicamente anormales. Veterinario Clin North Am Food Anim Pract. (1997) 13:255–70. doi: 10.1016/S0749-0720(15)30339-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Stark JL. BUN/creatinina: sus claves para la función renal. Enfermería. (1980) 10:33–8. doi: 10.1097/00152193-198005000-00007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Ozer J, Ratner M, Shaw M, Bailey W, Schomaker S. El estado actual de los biomarcadores séricos de hepatotoxicidad. Toxicología. (2008) 245:194–205. doi: 10.1016/j.tox.2007.11.021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Gribaldo L. Hematotoxicología: base científica y aspectos regulatorios. Altern Lab Anim. (2002) 30 Suppl 2:111–3. doi: 10.1177/026119290203002S17
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Rowlands GJ, A. Review of variations in the concentration of metabolites in the blood of beef and dairy bovinos associated with physiology, nutrition and disease, with particular reference to the interpretation of metabolic profiles. World Rev Nutr Diet. (1980) 35:172–235. doi: 10.1159/000386410
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Roland L, Drillich M, Iwersen M. Hematology as a diagnostic tool in bovine medicine. J Vet Diagn Invest. (2014) 26:592–8. doi: 10.1177/1040638714546490
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Petro EM, Leroy JL, Van Cruchten SJ, Covaci A, Jorssen EP, Bols PE. Disruptores endocrinos y fertilidad femenina: enfoque en la fisiología folicular ovárica (bovina). Teriogenología. (2012) 78:1887–900. doi: 10.1016/j.theriogenology.2012.06.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Mourikes VE, Flaws JA. Toxicología reproductiva: efectos de mezclas químicas sobre el ovario. Reproducción. (2021) 162:F91–F100. doi: 10.1530/REP-20-0587
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Miller RW, Cecil HC, Carey AM, Corley C, Kiddy CA. Effects of feeding diflubenzuron to young male holstein cattle. Bull Environ Contam Toxicol. (1979) 23:482–6. doi: 10.1007/BF01769991
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Staub C, Johnson L. Revisión: espermatogénesis en el toro. Animal. (2018) 12:S27–35. doi: 10.1017/S1751731118000435
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Pontes JH, Melo Sterza FA, Basso AC, Ferreira CR, Sanches BV, Rubin KC, et al. Recolección de óvulos, producción de embriones in vitro y tasas de embarazo de un programa comercial a gran escala utilizando donantes de ganado Nelore (Bos indicus). Teriogenología. (2011) 75:1640–6. doi: 10.1016/j.theriogenology.2010.12.026
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Resende AO, Bohrer RC, Viana JHM. Un registro de 485 complejos cúmulo-ovocitos viables recuperados y 165 embriones viables producidos en una sola sesión de recogida de óvulos de un donante de raza Senepol. Reprod fertil desarrollar. (2021) 33:111. doi: 10.1071/RDv33n2Ab7
34. Gimenes LU, Ferraz ML, Fantinato-Neto P, Chiaratti MR, Mesquita LG, Sá Filho MF, et al. El intervalo entre la aparición de ondas foliculares ováricas farmacológicamente sincronizadas y la captación de óvulos no afecta significativamente la producción embrionaria in vitro en Bos indicus, Bos taurus y Bubalus bubalis. Teriogenología. (2015) 83:385–93. doi: 10.1016/j.theriogenology.2014.09.030
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Soltani-Mazouni N. Efectos del diflubenzurón ingerido en el desarrollo ovárico durante la maduración sexual de los gusanos de la harina. Célula tisular. (1994) 26:439–45. DOI: 10.1016/0040-8166(94)90027-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Pontes JH, Nonato-Junior I, Sanches BV, Ereno-Junior JC, Uvo S, Barreiros TR, et al. Comparación del rendimiento embrionario y la tasa de embarazo entre los métodos in vivo e in vitro en las mismas vacas donantes de Nelore (Bos indicus). Teriogenología. (2009) 71:690–7. doi: 10.1016/j.theriogenology.2008.09.031
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: Difly, disruptores reproductivos, producción embrionaria in vitro, semen, raza Nelore
Cita: Xavier MC, Martins LP, Moura RM, Morais DF, Barbosa JVL, Figueiredo RA, Peixer MAS, Andrade RVd y Viana JHM (2023) Evaluación de los efectos de la dosis oral recomendada de diflubenzuron en el esperma bovino y la calidad de los ovocitos utilizando CASA y OPU-IVEP. Frente. Vet. Sci. 10:1215722. doi: 10.3389/fvets.2023.1215722
Recibido: 02 Mayo 2023; Aprobado: 26 de junio de 2023;
Publicado: 11 julio 2023.
Editado por:
Benito Soto-Blanco, Universidad Federal de Minas Gerais, Brasil
Revisado por:
Timothy Evans, Universidad de Missouri, Estados Unidos
André Mariano Batista, Universidade Federal Rural de Pernambuco, Brasil
Copyright © 2023 Xavier, Martins, Moura, Morais, Barbosa, Figueiredo, Peixer, Andrade y Viana. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Joao Henrique Moreira Viana, henrique.viana@embrapa.br
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía