Expresión de GATA-3 y su correlación con factores pronósticos y supervivencia en tumores mamarios
Expresión de GATA-3 y su correlación con factores pronósticos y supervivencia en tumores mamarios caninos
 Gabriel Saraiva Diniz-Gonçalves1,
Gabriel Saraiva Diniz-Gonçalves1,  Anna Hielm-Björkman2,
Anna Hielm-Björkman2,  Vanessa Bonfim da Silva1,
Vanessa Bonfim da Silva1,  Lorena Gabriela Rocha Ribeiro3,
Lorena Gabriela Rocha Ribeiro3,  Carlos Humberto da Costa Vieira-Filho1,
Carlos Humberto da Costa Vieira-Filho1,  Laís Pereira Silva1,
Laís Pereira Silva1,  Stella María Barrouin-Melo2,4,
Stella María Barrouin-Melo2,4,  Geovanni Dantas Cassali5,
Geovanni Dantas Cassali5,  Karine Araújo Damasceno6 y
Karine Araújo Damasceno6 y  Alessandra Estrela-Lima1,2,4*
Alessandra Estrela-Lima1,2,4*- 1Centro de Investigación en Oncología Mamaria NPqOM/HOSPMEV, Universidad Federal de Bahía, Salvador, Brasil
- 2Grupo de Investigación DogRisk, Departamento de Medicina Equina y de Pequeños Animales, Facultad de Medicina Veterinaria, Universidad de Helsinki, Helsinki, Finlandia
- 3Laboratorio de Patología Animal, Departamento de Medicina Veterinaria, Universidad Federal de Sergipe, São Cristóvão, Brasil
- 4Departamento de Anatomía Veterinaria, Patología y Clínicas, Facultad de Medicina Veterinaria y Zootecnia, Universidad Federal de Bahía, Salvador, Brasil
- 5Laboratorio de Patología Comparada, Departamento de Patología General, Universidad Federal de Minas Gerais, Belo Horizonte, Brasil
- 6Laboratorio de Patología Experimental (LAPEX), Instituto Gonçalo Moniz, Fundación Oswaldo Cruz (FIOCRUZ), Salvador, Brasil
Introducción: El factor de transcripción GATA-3 desempeña un papel importante en el desarrollo y diferenciación de las glándulas mamarias. Estudios recientes sobre oncología humana han demostrado su asociación con factores patológicos favorables en el cáncer de mama. Los tumores mamarios caninos, propuestos como modelos de estudio comparativos y traslacionales, tienen características epidemiológicas, clínicas, biológicas y genéticas similares a las de los cánceres de mama humanos.
Métodos: Aquí, evaluamos la frecuencia de expresión de GATA-3 en tumores mamarios de perros y su relación con factores pronósticos y supervivencia. Se obtuvieron muestras tumorales de 40 perras y se agruparon según el tipo histológico en tumores benignos (n = 10), carcinoma en tumores mixtos (CMT) (n = 20) y tumores agresivos (n = 10). Las CMT se separaron aún más según el grado histológico, y se recopilaron datos sobre la estadificación clínica y el diagnóstico, la clasificación histopatológica y la tasa de supervivencia.
Resultados: La expresión de GATA-3 y del receptor de estrógeno (RE) fue mayor en carcinomas benignos y bien diferenciados que en tumores agresivos, que mostraron una mayor expresión de Ki-67. La tasa de expresión de RE en los grupos estudiados fue equivalente a la de GATA-3. Identificamos una fuerte correlación positiva entre las frecuencias de expresión de GATA-3 y ER y una correlación negativa entre las de GATA-3 y Ki-67. Hubo asociaciones entre GATA-3 (p < 0,001), Ki-67 (p = 0,003), tamaño tumoral (p < 0,001), estadio clínico (p = 0,002), metástasis ganglionar (p < 0,001) y grado histológico (p < 0,001) mediante análisis de supervivencia univariada. Los parámetros ER (p = 0,015) y GATA-3 (p = 0,005) también influyeron en la supervivencia de manera multifactorial.
Discusión: El análisis de Kaplan-Meier de las curvas de supervivencia validó nuestros hallazgos previos de que los perros con expresión de GATA-3 en el ≥79,4% de las células tenían tasas de supervivencia significativamente más altas (p < 0,001). El análisis de rendimiento mostró que la expresión de GATA-3 en ≥79,4% de las células predijo efectivamente la supervivencia o la muerte en perros con tumores mamarios. En conjunto, estos resultados sugieren que GATA-3 puede ser un marcador relevante en el estudio de la progresión del tumor mamario y tiene potencial como marcador de pronóstico para predecir los resultados en los tumores mamarios caninos.
1. Introducción
La identificación de marcadores moleculares o biomarcadores que pueden predecir el comportamiento de los tumores es particularmente importante en la investigación del cáncer de mama humano y el tumor mamario canino, dada la variabilidad de la progresión clínica de esta enfermedad (1-6). GATA-3 es una proteína de unión perteneciente a la familia de factores de transcripción que se une a la secuencia de consenso de ADN (A/T) GATA (A/G) y prevalece entre los biomarcadores estudiados; Su gen se encuentra en el cromosoma 10p15 en humanos (7, 8). GATA-3 se expresa en el parénquima mamario y actúa principalmente en la proliferación y diferenciación de las células epiteliales luminales que cubren las estructuras ductales de la mama (9). Como marcador, la ausencia o la expresión baja de GATA-3 en cualquiera de los modelos de cáncer de mama humano (7) y murino (10) de cáncer de mama luminal indican una pérdida de diferenciación celular, propensión al crecimiento invasivo y desarrollo de metástasis a distancia (11).
GATA-3 actúa como un supresor tumoral en cánceres de mama tanto de ratones transgénicos como de mujeres, ya que previene la transición epitelial-mesenquimal inducida por TGF-β y componentes de la vía TGF (10, 12-16). La mayoría de los tumores mamarios humanos se originan a partir de células epiteliales luminales, y esta proteína controla la diferenciación celular y la proliferación de células neoplásicas (10, 14, 17, 18). GATA-3 también altera el microambiente tumoral, ya que interfiere con la angiogénesis, afecta a macrófagos y linfocitos dentro de infiltrados inflamatorios intratumorales, y actúa en la regulación de la matriz extracelular a través de microRNA-29b, induciendo así la expresión de microRNA-29b tanto directamente (uniéndose a los sitios GATA en el promotor) como indirectamente (inhibiendo las vías TGF-β y NF-κB) (10, 15, 16).
GATA-3 también puede promover la tumorigénesis a través del receptor de estrógeno (ER), por mecanismos dependientes de ER e independientes de ER, lo que sugiere que otras vías podrían influir en su expresión y función (19, 20). La desregulación de los genes BCL-2 (LLC/linfoma 2 de células B), DACH1 (Dachshund1) y THSD4 (trombospondina, dominio tipo I que contiene 4) ocurre en los principales procesos de progresión del cáncer controlados por GATA-3 (20). Un estudio reciente informó una correlación débil y positiva entre la expresión de GATA-3 y una mayor actividad mitótica en el cáncer de vejiga en perros. Este resultado sugirió que el aumento de la expresión de GATA-3 indicaba un peor pronóstico para este tumor; sin embargo, estos autores consideraron que el estadio de progresión tumoral en el conjunto de muestras estudiado era excepcionalmente homogéneo y enfatizaron que el papel biológico de GATA-3 en el carcinoma urotelial de vejiga aún es poco conocido (21).
Los tumores mamarios espontáneos en perras se consideran modelos para el estudio del cáncer de mama en mujeres (1, 2, 22-25). Además, tales tumores son frecuentes entre la población canina, y más del 50% de los casos son malignos (1, 6, 25, 26), considerando que el carcinoma mamario en tumores mixtos (CMT) tiene un potencial de malignidad variable dependiendo del grado histológico (1). Sin embargo, hay pocos estudios relacionados con la expresión de GATA-3 en neoplasias mamarias de perras.
Hasta donde saben los presentes autores, solo dos estudios se han centrado en evaluar la expresión o la epigenética del factor de transcripción GATA-3 en tumores mamarios caninos (27, 28). Un estudio informó sobre el uso de GATA-3 para verificar el sitio de origen del tumor en dos perros machos con carcinoma mamario triple negativo (27) empleando su alta sensibilidad y especificidad reportadas como marcador para identificar carcinomas de mama invasivos primarios y metastásicos (29–31). El cáncer de mama triple negativo es agresivo tanto en mujeres como en perros y se caracteriza por la ausencia de positividad a los receptores hormonales (estrógeno y progesterona) y al receptor 2 del factor de crecimiento epidérmico humano (ERBB2/HER2). Este tumor puede clasificarse como basal o no basal dependiendo de la presencia o ausencia de la expresión de citoqueratinas basales (CK5/6, 17 y CK CK14), respectivamente. El segundo estudio utilizó cultivos celulares primarios de tumores mamarios caninos espontáneos para caracterizar moléculas asociadas al cáncer, incluyendo GATA-3 (28). Los resultados demostraron que el adenoma complejo o las células de carcinoma simple exhibieron niveles más bajos de expresión de GATA-3, mientras que los niveles considerablemente más altos se expresaron en células de carcinoma complejas o mixtas.
Por lo tanto, los objetivos de este estudio fueron evaluar la expresión de GATA-3 en tumores mamarios espontáneos de perras de acuerdo con el comportamiento biológico del tumor, el grado de malignidad y la progresión tumoral en relación con los pronósticos clásicos, así como verificar el potencial de GATA-3 como factor pronóstico independiente.
2. Materiales y métodos
2.1. Aprobación ética
La Facultad de Medicina Veterinaria de la Universidad Federal de Bahía (permiso número 17/2021) aprobó este protocolo de investigación. Todos los procedimientos cumplieron con las directrices del Colegio Brasileño de Experimentación Animal (COBEA).
2.2. Diseño del estudio y muestras tumorales
Este estudio retrospectivo no aleatorizado incluyó 40 muestras de tumores mamarios de hembras asistidas por el Núcleo de Investigación en Oncología Mamaria de la Universidad Federal de Bahía, Brasil, seleccionadas entre 2019 y 2021. Los casos se reclutaron de acuerdo con los siguientes criterios de inclusión: biopsia de mastectomía, disponibilidad de muestras de tejido en bloques de parafina para inmunohistoquímica e información clínica # 1. Los datos clínicos y patológicos se obtuvieron de los registros de ingreso y monitoreo. Los parámetros evaluados incluyeron el tamaño del tumor, la estadificación clínica, la presencia de metástasis, el diagnóstico y el grado histopatológico y el tiempo de supervivencia. El tiempo de supervivencia global, expresado en días, se definió como el tiempo entre la extirpación quirúrgica del tumor primario y la fecha de muerte o finalización de este estudio (diciembre de 2). La tasa de supervivencia se clasificó como baja cuando los valores de supervivencia fueron ≤3 días y alta cuando los valores de supervivencia fueron >2021 días; Se determinó el porcentaje de perros que todavía estaban vivos al final del estudio.
Los casos se dividieron en cuatro grupos, cada uno con diez perros: grupo de tumores benignos (G-BT), compuesto por adenomas y tumores mixtos benignos; carcinomas grupales en un tumor mixto (CMT) grado I (G-CMT-I); grupo de CMT grado II (G-CMT-II). El grupo de tumores agresivos estaba compuesto por cinco muestras de carcinomas sólidos, dos muestras de carcinomas lobulares pleomórficos, que son una variante del carcinoma lobulillar invasivo (32, 33), una muestra de carcinoma micropapilar y dos CMT grado III.
2.3. Clasificación histológica y clasificación histológica
Los portaobjetos originales de hematoxilina-eosina (HE) para cada caso fueron recuperados y revisados por dos patólogos, a ciegas e independientemente, sin el diagnóstico previo. Cuando fue necesario, se obtuvieron nuevas secciones histológicas de los bloques de parafina originales y se tiñeron por el método HE. Las clasificaciones histopatológicas siguieron los criterios propuestos por Goldschmidt et al. (32) y fueron estandarizadas por Cassali et al. (33). Los tumores se clasificaron utilizando el Sistema de Nottingham (34) que evalúa el porcentaje de formación de túbulos, el pleomorfismo nuclear y el índice mitótico. Las áreas de invasividad de los CMT se utilizaron para clasificarlas en Grado I, II o III (35). Cualquier discrepancia se resolvió a través de un microscopio multicabeza mediante discusión para llegar a un consenso. Finalmente, los casos con diagnóstico y graduación confirmados por los dos evaluadores fueron insertados en el estudio.
2.4. Anticuerpos e inmunohistoquímica
Para realizar estudios inmunohistoquímicos, se utilizaron los siguientes anticuerpos monoclonales (mAbs) para detectar: GATA-3, ER y Ki-67. Los biomarcadores se evaluaron de acuerdo con los criterios REMARK para informar estudios sobre marcadores tumorales (36). Se cortaron secciones (4 μm) de un bloque representativo de cada muestra tumoral. Las secciones de tejido se desparafinaron en xileno y se examinaron utilizando el sistema de detección de polímeros NovoLink Max (Leica Biosystems1). GATA-3 (1:250, clon L50-823, Cell Marque, Estados Unidos), ER (1:100, clon 1D5, Dako, Carpinteria, Estados Unidos) y Ki-67 (1:100, clon MIB-1, Dako, Carpinteria, Estados Unidos) se sometieron a recuperación de antígenos inducida por calor con tampón de citrato de sodio (pH 6.0) en un baño maría a 96°C durante 30 min. La actividad de la peroxidasa endógena se bloqueó con peroxidasa de hidrógeno al 3% en metanol. Los portaobjetos se cubrieron con anticuerpos primarios anti-GATA-3 y anti-Ki-67 y se incubaron a temperatura ambiente durante 60 minutos; con el anti-RE como anticuerpo primario, los portaobjetos se incubaron durante la noche a 4 °C. Se utilizó un sistema polimérico para la detección de anticuerpos (Novolink™ Sistema de detección de polímeros Max, Leica Biosystems, Buffalo Grove, IL). Finalmente, se utilizó diaminobencidina (DAB) como cromógeno, y las secciones se contrastaron con hematoxilina de Mayer, se deshidrataron y se montaron en un medio sintético. Los controles negativos se prepararon reemplazando el anticuerpo primario con suero normal. Se utilizaron muestras de glándulas mamarias de perro previamente probadas como controles positivos.
Para la cuantificación de la expresión nuclear de GATA-3, ER y Ki-67, se utilizó el software ImageJ (National Institutes of Health, Bethesda, Maryland, Estados Unidos) y en todos los grupos, solo se consideraron las células epiteliales neoplásicas en el recuento. Se fotografiaron diez campos aleatorios para cada caso, excluyendo las áreas de necrosis o densidad celular intensa, y se cuantificaron 1.000 núcleos celulares neoplásicos, con o sin marcado para cada anticuerpo. La tinción GATA-3, ER y Ki-67 fue positiva cuando los núcleos celulares presentaron un patrón de tinción nuclear difusa. La expresión se analizó cuantitativamente y su valor se expresó como el porcentaje de células teñidas positivamente calculado contando 1.000 células por sección (400 × aumento). Se consideró el punto de corte ≥10% y ≥14% de los núcleos teñidos para clasificar el caso como con expresión positiva de RE (33) y alta tasa de proliferación celular (37), respectivamente.
2.5. Índices de rendimiento de la expresión GATA-3
La curva característica operativa del receptor (curva ROC) (38) se utilizó para seleccionar el mejor valor de corte para la expresión de GATA-3 para discriminar la evolución distinta a la muerte o la supervivencia. El análisis de rendimiento incluyó el análisis de precisión global, que fue evaluado por el área bajo la curva ROC (AUC) propuesta por Swets et al. (39). Las fórmulas utilizadas fueron: Copositividad (Co-pos) = [verdaderos positivos/(muestras verdaderas positivas + muestras falsas negativas)] × 100; Co-negatividad (Co-neg) = [verdaderos negativos/(muestras verdaderas negativas + muestras falsas positivas)] × 100; Valor predictivo positivo (VPP) = (muestras positivas verdaderas/total de muestras positivas) × 100; Valor predictivo negativo (VPN) = (muestras negativas verdaderas/total de muestras negativas) × 100; Razón de verosimilitud positiva (LR+) = Co-positividad/(1 − Co-negatividad); Razón de verosimilitud negativa (LR−) = (1 − Co-positividad)/(Co-negatividad).
2.6. Análisis estadístico
Los datos se agruparon de la siguiente manera: tamaño del tumor (<5 cm o ≥5 cm), metástasis ganglionar (no o sí), estadificación clínica (v), grado histológico (I, II o III), RE (<10% y ≥10%), Ki-67 (<14% y ≥14%) y supervivencia (≤365 días o >365 días). El tiempo de supervivencia se clasificó como bajo cuando los valores de supervivencia fueron ≤365 días. Se utilizó el análisis estadístico, asociación lineal por lineal, para comparar la relevancia entre las variables de categoría de cáncer de mama. Inicialmente, se aplicó la prueba de Kolmogorov-Smirnov para evaluar la normalidad de la distribución de datos. Se utilizaron las pruebas t de Student para las variables con distribución normal. La prueba de Kruskal-Wallis seguida de la prueba de Dunn se utilizó para variables sin distribución normal. La prueba de Spearman investigó posibles correlaciones. Los coeficientes de correlación (r) fueron interpretados de acuerdo con Pett et al. (40), dividiendo las clasificaciones en débil (0–0,29), bajo (0,3–0,49), moderado (0,5–0,69), fuerte (0,7–0,89) o muy fuerte (0,9–1,0); si son positivos o negativos. Las curvas de supervivencia se generaron mediante el método de estimación de Kaplan-Meier y se compararon mediante pruebas de riesgos proporcionales de Mantel-Cox o Cox en análisis univariado o multivariado, respectivamente. El análisis de supervivencia se limitó a las 30 perras con tumores mamarios malignos. Los análisis se realizaron utilizando GraphPad Prism 8.0.2 (GraphPad, San Diego, CA, Estados Unidos) y SPSS 21 (SPSS Inc., Chicago, IL, Estados Unidos), y MedCalc para Windows versión 19.1.7 (MedCalc Software, Ostende, Bélgica). Todos los análisis se realizaron utilizando 0,05 como nivel de probabilidad crítica para el error de tipo I.
3. Resultados
3.1. Factores pronósticos y de supervivencia
Los resultados de los factores pronósticos analizados y la supervivencia en cada grupo de estudio se presentan en la Tabla 1. El grupo de tumor benigno (G-BT) estaba compuesto predominantemente por perros con tumores menores de 3 cm (9/10) (p < 0,001), y todos los perros (10/10) de este grupo estaban vivos al final del estudio y no tenían antecedentes de nuevos nódulos. El grupo G-CMT-I abarcó animales con tumores frecuentemente entre 3 y 5 cm (6/10) y sin metástasis ganglionar; en este grupo, predominaron las etapas I y II. 80% de los animales (8/10) mostraron supervivencia clasificada como alta, y 50% (5/10) todavía estaban vivos al final de este estudio (p < 0,001). El grupo G-CMT-II mostró una mayor frecuencia de tumores mayores de 5 cm (5/10,) y la metástasis ganglionar ocurrió en dos casos (2/10) (p < 0,001). Entre los perros G-AT/CMT-III, hubo mayoría de nódulos grandes (mayores de 5 cm; en 9/10 perros), metástasis en ganglios linfáticos (8/10) y predominio del estadio IV (8/10); La supervivencia fue baja (≤365 días después de la cirugía) en la mayoría de los casos (9/10), y todos los individuos de este grupo sucumbieron dentro de los 13 meses (p < 0,001).
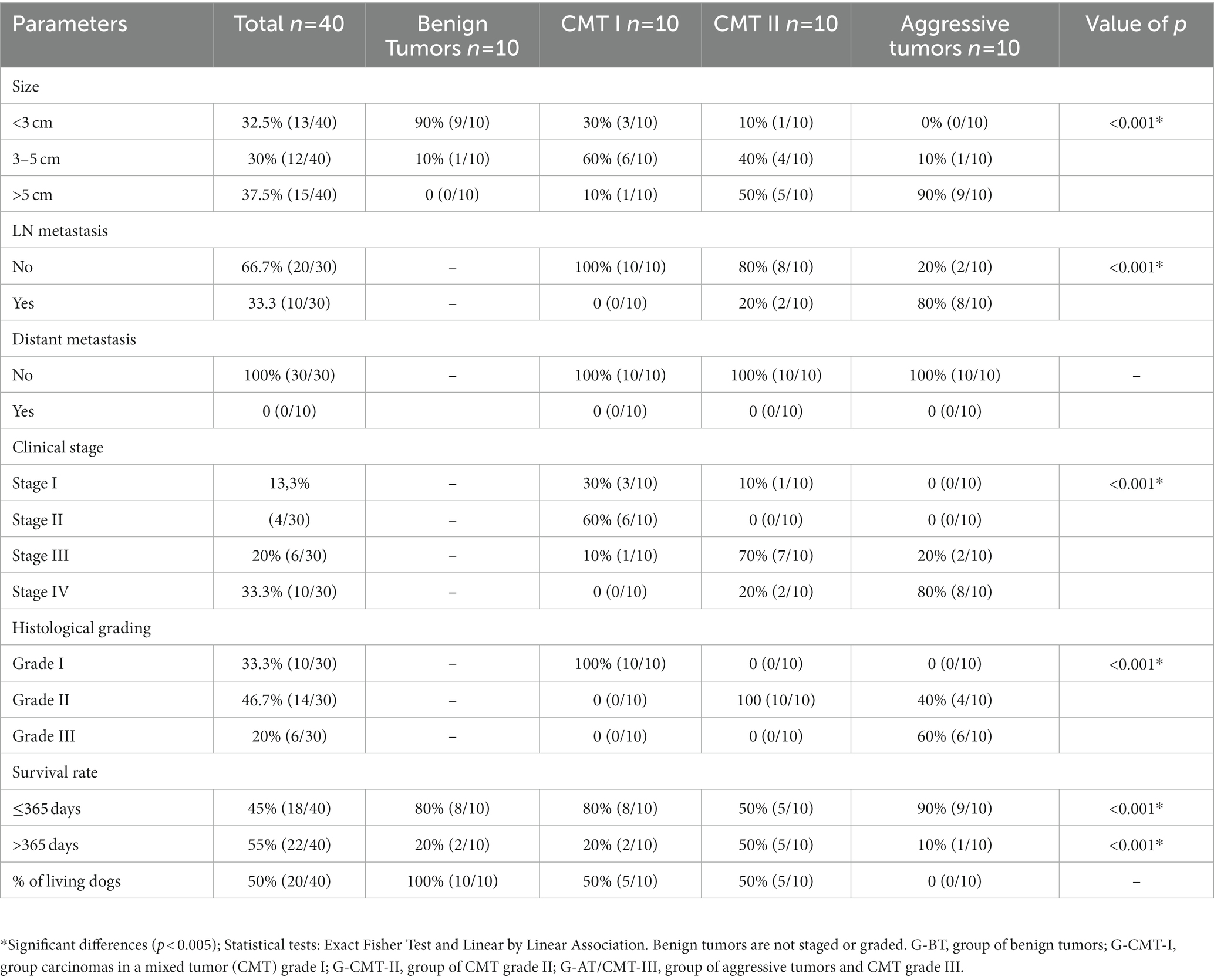 Tabla 1. Características clínicas y patológicas de las perras con tumores mamarios según el grupo analizado.
Tabla 1. Características clínicas y patológicas de las perras con tumores mamarios según el grupo analizado.
3.2. Inmunohistoquímica
Se analizó la determinación de la frecuencia de expresión de ER, Ki-67 y GATA-3 mediante el recuento de 1.000 células por caso después del marcado inmunohistoquímico (Figura 1), y se comparó entre los grupos G-BT, G-CMT-I, G-CMT-II y G-AT/CMT-III (Tabla 2). Hubo mayor expresión de RE en tumores bien diferenciados y menor expresión de RE en tumores agresivos (p < 0,05) (Figuras 1, 2). Hubo mayor expresión de Ki-67 en tumores agresivos, mientras que en neoplasias benignas la expresión de Ki-67 fue significativamente menor (p < 0,05) (Figuras 1, 2). La frecuencia de inmunotinción de GATA-3 fue equivalente a la de ER: el grado de expresión de GATA-3 en tumores bien diferenciados fue significativamente mayor en el grupo de tumores benignos y carcinomas bien diferenciados, mientras que su expresión fue menor en tumores agresivos (p < 0,05) (Figura 2 y Tabla 2).
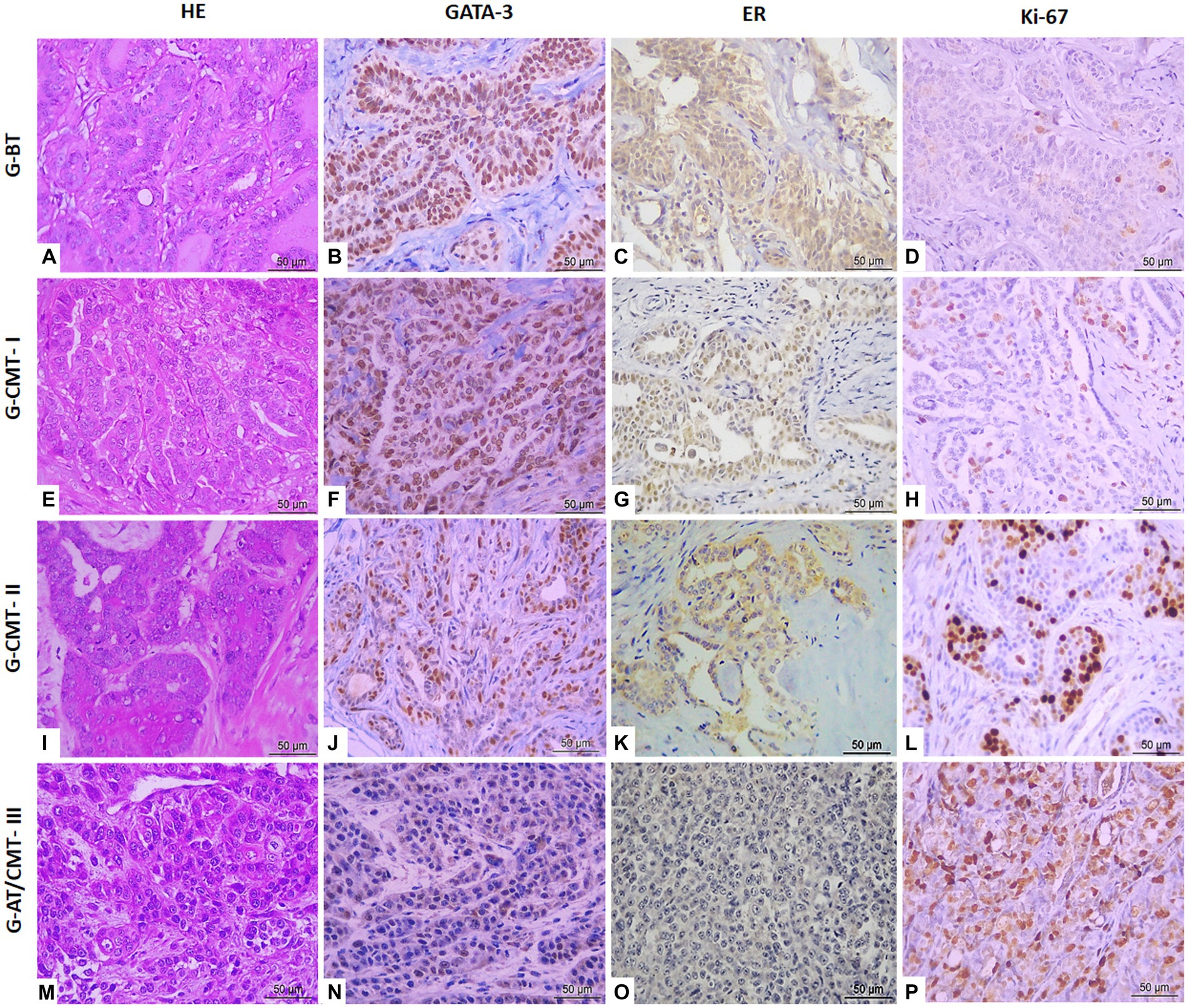 Figura 1. Expresión inmunohistoquímica de marcadores GATA-3, ER y Ki-67 en muestras de cáncer mamario canino (tumor benigno, CMT grado I, CMT grado II y tumor agresivo) en objetivo de 40×. (A) Adenoma tubular en objetivo del 40× (HE). (B) Adenoma tubular en objetivo del 40× (GATA-3). (C) Adenoma tubular en objetivo de 40× (RE). (D) Adenoma tubular en objetivo del 40× (Ki-67). (E) CMT grado I en objetivo de 40× (HE). F) CMT grado I en objetivo del 40× (GATA-3). (G) CMT grado I en objetivo de 40× (ER). (H) CMT grado I en objetivo de 40× (Ki-67). (I) CMT grado II en objetivo de 40× (HE). J) CMT grado II en objetivo del 40× (GATA-3). (K) CMT grado II en objetivo de 40× (ER). (L) CMT grado II en objetivo de 40× (Ki-67). (M) Carcinoma sólido en objetivo del 40× (HE). (N) Carcinoma sólido en objetivo del 40× (GATA-3). (O) Carcinoma sólido en objetivo de 40× (ER). (P) Carcinoma sólido en objetivo de 40× (Ki-67).
Figura 1. Expresión inmunohistoquímica de marcadores GATA-3, ER y Ki-67 en muestras de cáncer mamario canino (tumor benigno, CMT grado I, CMT grado II y tumor agresivo) en objetivo de 40×. (A) Adenoma tubular en objetivo del 40× (HE). (B) Adenoma tubular en objetivo del 40× (GATA-3). (C) Adenoma tubular en objetivo de 40× (RE). (D) Adenoma tubular en objetivo del 40× (Ki-67). (E) CMT grado I en objetivo de 40× (HE). F) CMT grado I en objetivo del 40× (GATA-3). (G) CMT grado I en objetivo de 40× (ER). (H) CMT grado I en objetivo de 40× (Ki-67). (I) CMT grado II en objetivo de 40× (HE). J) CMT grado II en objetivo del 40× (GATA-3). (K) CMT grado II en objetivo de 40× (ER). (L) CMT grado II en objetivo de 40× (Ki-67). (M) Carcinoma sólido en objetivo del 40× (HE). (N) Carcinoma sólido en objetivo del 40× (GATA-3). (O) Carcinoma sólido en objetivo de 40× (ER). (P) Carcinoma sólido en objetivo de 40× (Ki-67).
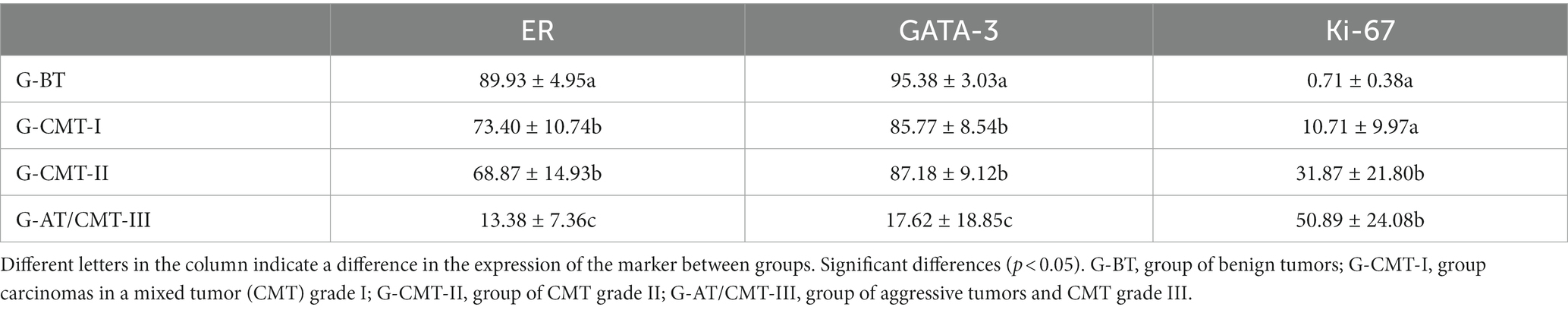 Tabla 2. Expresión de marcadores en tumor mamario canino según el grupo analizado en porcentaje (%).
Tabla 2. Expresión de marcadores en tumor mamario canino según el grupo analizado en porcentaje (%).
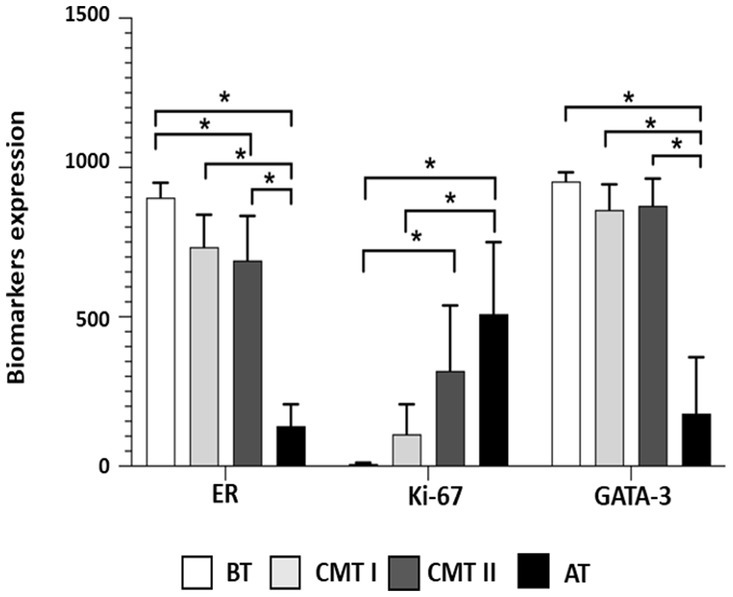 Figura 2. Representación gráfica de la expresión de biomarcadores en muestras de tumores mamarios caninos. Los corchetes con asteriscos indican diferencias significativas entre los grupos correspondientes. Los datos fueron analizados mediante la prueba de Kruskal-Wallis, seguida de la prueba de Dunn. Significación estadística: () p < 0,05, () p < 0,01, y () p < 0,0001. G-BT, grupo de tumores benignos; G-CMT-I: carcinomas grupales en un tumor mixto (CMT) grado I; G-CMT-II, grupo de CMT grado II; G-AT/CMT-III, grupo de tumores agresivos y CMT grado III.******
Figura 2. Representación gráfica de la expresión de biomarcadores en muestras de tumores mamarios caninos. Los corchetes con asteriscos indican diferencias significativas entre los grupos correspondientes. Los datos fueron analizados mediante la prueba de Kruskal-Wallis, seguida de la prueba de Dunn. Significación estadística: () p < 0,05, () p < 0,01, y () p < 0,0001. G-BT, grupo de tumores benignos; G-CMT-I: carcinomas grupales en un tumor mixto (CMT) grado I; G-CMT-II, grupo de CMT grado II; G-AT/CMT-III, grupo de tumores agresivos y CMT grado III.******
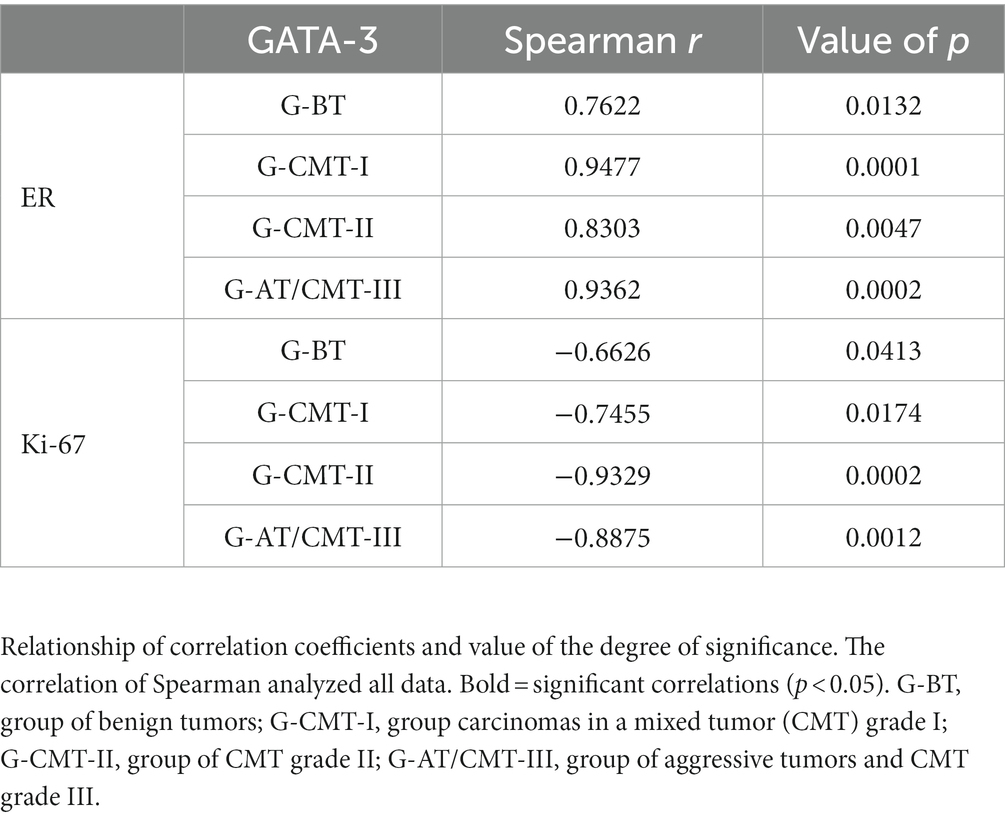
Hubo una correlación directa entre la expresión de GATA-3 y la expresión de RE, variando de fuerte a muy fuerte, en los grupos G-CMT-I, G-CMT-II y G-AT/CMT-III (P < 0,05) (Tabla 3). Al mismo tiempo, hubo una correlación inversa entre el índice de proliferación de Ki-67 y la expresión de GATA-3 en todos los grupos, que varió de moderada a muy fuerte (p < 0,05) (Figura 2 y Tabla 3).
3.3. Comparación de curvas de supervivencia
El tiempo de supervivencia más corto después de la cirugía de 30 días ocurrió con un perro del grupo de tumores agresivos. Este perro desarrolló carcinoma mamario inflamatorio secundario a cirugía. No se pudo realizar una necropsia a este animal para identificar posibles sitios de metástasis, ya que el propietario no autorizó el procedimiento. Los exámenes de imagen realizados antes de la mastectomía para determinar la estadificación clínica de la paciente por el sistema TNM no indicaron ni sugirieron metástasis pulmonar en los animales, independientemente del grupo. Sin embargo, las historias clínicas de algunos animales en el seguimiento de supervivencia informaron sobre la posible causa de muerte como insuficiencia respiratoria por metástasis pulmonar. Desafortunadamente, no hubo ningún caso con información sobre necropsia o análisis histopatológico de los fragmentos pulmonares. Por lo tanto, la etapa V no fue considerada en este estudio.
El tiempo de supervivencia más largo después de la cirugía fue de 1.007 días e involucró a un perro del grupo de tumores benignos. Al final de este estudio, todos los animales G-BT sobrevivieron (n = 10/10; 100%), mientras que todos los perros G-AT/CMT-III murieron (n = 10/10; 100%). El análisis de supervivencia se limitó a las 30 perras con tumores mamarios malignos. La mediana de supervivencia fue de 900, 660 y 88 días para los grupos G-CMT-I, G-CMT-II y G-AT/CMT-III (P < 0,0001) (Figura 3). Hubo diferencias significativas en los tiempos de supervivencia posoperatoria entre los grupos G-CMT-I y G-AT/CMT-III (p < 0,001, CRI 7,002 e IC 95%: 2,073–23,66); y G-CMT-II y G-AT/CMT-III (p < 0,001, HR 6,113 e IC 1,889–19,78). Sin embargo, no hubo diferencias en los tiempos de supervivencia posoperatoria entre G = CMT-I y G-CMT-II (p = 0,0611, HR 2,992 e IC 95% IC 0,7157–12,51) (Figura 3).
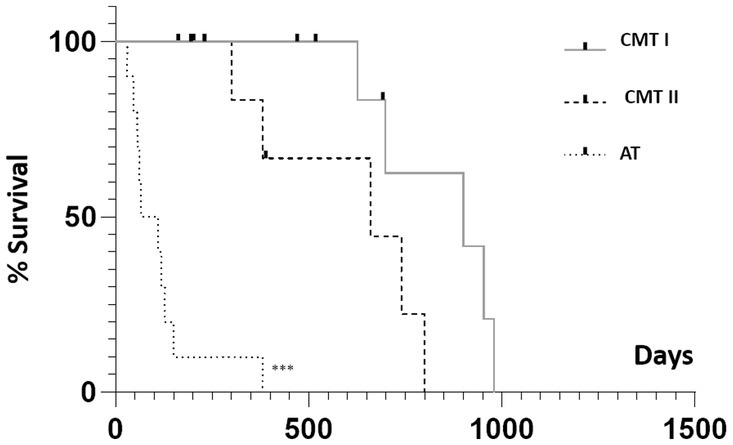 Figura 3. Curva de supervivencia de Kaplan-Meier según el grupo estudiado (G-CMT-I, G-CMT-II y G-AT/CMT-III), independientemente de la expresión de GATA-3. () expresan una diferencia estadística significativa entre las curvas mediante la prueba log-rank con p < 0,001. G-CMT-I: carcinomas grupales en un tumor mixto (CMT) grado I; G-CMT-II, grupo de CMT grado II; G-AT/CMT-III, grupo de tumores agresivos y CMT grado III.***
Figura 3. Curva de supervivencia de Kaplan-Meier según el grupo estudiado (G-CMT-I, G-CMT-II y G-AT/CMT-III), independientemente de la expresión de GATA-3. () expresan una diferencia estadística significativa entre las curvas mediante la prueba log-rank con p < 0,001. G-CMT-I: carcinomas grupales en un tumor mixto (CMT) grado I; G-CMT-II, grupo de CMT grado II; G-AT/CMT-III, grupo de tumores agresivos y CMT grado III.***
La expresión de GATA-3 en células epiteliales neoplásicas se consideró alta cuando el porcentaje de células GATA-3 marcadas en un total de 1.000 células fue de ≥79,4%; y bajo cuando las células positivas para GATA-3 fueron <79,4%. Las curvas de supervivencia se estratificaron en función de la expresión de GATA-3 y se analizaron sólo en tumores malignos. Los resultados indicaron que los perros con tumores con una alta expresión de GATA-3 también tuvieron una tasa de supervivencia significativamente mayor que aquellos con baja expresión de GATA-3 (p < 0,0001, HR 5,021 e IC del 95% 1,741-14,48), y presentaron una mediana de supervivencia de 740 días. La tasa de mortalidad más alta (n = 11/13, 84,61%) ocurrió entre los perros que presentaron tumores con baja expresión de GATA-3, con una mediana de supervivencia de 119 días. Los datos fueron analizados por el método de Kaplan-Meier, y hubo una diferencia estadísticamente significativa entre los intervalos GATA-3 (p < 0,001).
Cuando se analizó la expresión de GATA-3 (alta ≥79,4% vs. baja <79,4%) de acuerdo con el grupo histológico, el grupo de tumor benigno mostró un mayor número de muestras con alta expresión de GATA-3 (Figuras 4A-D). Comparativamente, el grupo de perros con tumores agresivos reveló mayores frecuencias de muestras con baja expresión de GATA-3 y menores tasas de supervivencia (Figura 4B). Al correlacionar la expresión de GATA-3 con la supervivencia en los casos de tumores mamarios malignos, hubo una relación directamente proporcional y correlación moderada y significativa (p = 0,0003; r = 0,6127) (Figura 4C).
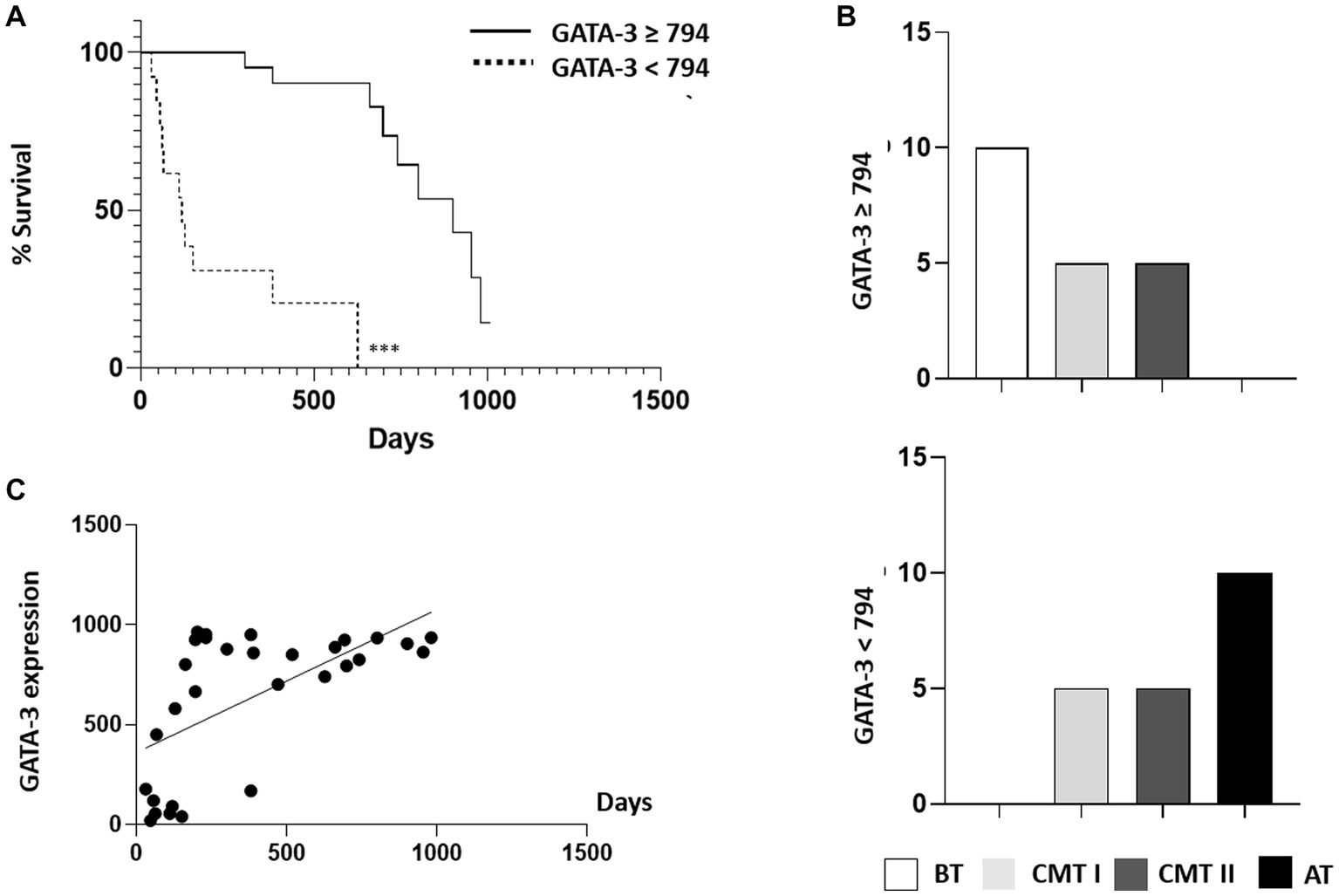 Figura 4. Relación entre la tasa de supervivencia de los tumores mamarios caninos y la expresión del biomarcador GATA-3. (A) Curva de supervivencia de Kaplan-Meier para todos los animales con tumores mamarios malignos (G-CMT-I, G-CMT-II y G-AT/CMT-III) caracterizada según la intensidad de la expresión de GATA-3 (alta ≥79,4% y baja <79,4%) de las células teñidas con GATA-3. () expresan una diferencia estadística significativa entre las curvas mediante la prueba log-rank con p < 0,001. (B) Los gráficos representan la relación de GATA-3 categorizada según la frecuencia de casos con alta (≥79,4%) y baja (<79,4%) intensidad de expresión en los diferentes tipos de tumores mamarios caninos (BT, CMT I, CMT II y AT). (C) Gráfico de correlación entre la expresión de GATA-3 y la supervivencia de animales con tumores mamarios malignos. El coeficiente de correlación fue positivo, demostrando ser una relación directamente proporcional. Los datos fueron obtenidos por la prueba de correlación de Pearson. Grado de significación: p < 0,0001. G-BT, grupo de tumores benignos; G-CMT-I: carcinomas grupales en un tumor mixto (CMT) grado I; G-CMT-II, grupo de CMT grado II; G-AT/CMT-III, grupo de tumores agresivos y CMT grado III.***
Figura 4. Relación entre la tasa de supervivencia de los tumores mamarios caninos y la expresión del biomarcador GATA-3. (A) Curva de supervivencia de Kaplan-Meier para todos los animales con tumores mamarios malignos (G-CMT-I, G-CMT-II y G-AT/CMT-III) caracterizada según la intensidad de la expresión de GATA-3 (alta ≥79,4% y baja <79,4%) de las células teñidas con GATA-3. () expresan una diferencia estadística significativa entre las curvas mediante la prueba log-rank con p < 0,001. (B) Los gráficos representan la relación de GATA-3 categorizada según la frecuencia de casos con alta (≥79,4%) y baja (<79,4%) intensidad de expresión en los diferentes tipos de tumores mamarios caninos (BT, CMT I, CMT II y AT). (C) Gráfico de correlación entre la expresión de GATA-3 y la supervivencia de animales con tumores mamarios malignos. El coeficiente de correlación fue positivo, demostrando ser una relación directamente proporcional. Los datos fueron obtenidos por la prueba de correlación de Pearson. Grado de significación: p < 0,0001. G-BT, grupo de tumores benignos; G-CMT-I: carcinomas grupales en un tumor mixto (CMT) grado I; G-CMT-II, grupo de CMT grado II; G-AT/CMT-III, grupo de tumores agresivos y CMT grado III.***
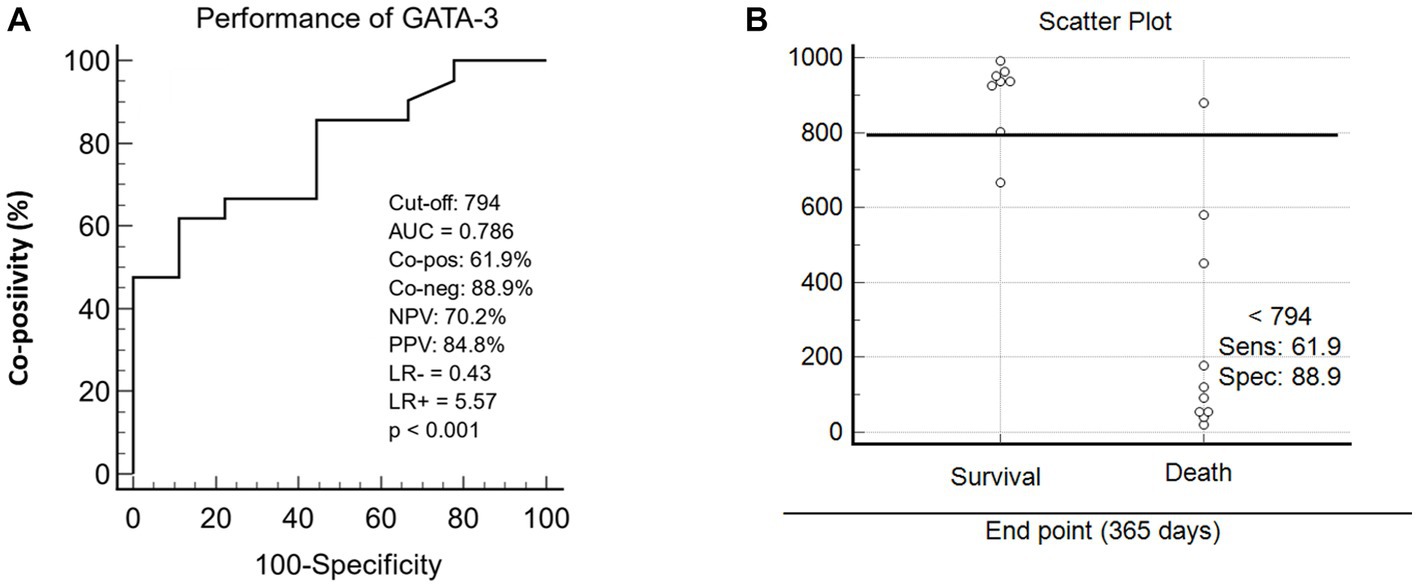
3.4. Índices de rendimiento del GATA-3
El análisis del diagrama de dispersión reveló que el punto de corte (≥79,4% de células GATA-3 positivas) destacó diferencias estadísticamente significativas y definió los resultados de progresión de la enfermedad hacia la supervivencia o la muerte en perros con neoplasias mamarias. El análisis de los índices de desempeño mostró un valor de precisión global sobresaliente (AUC = 0,786), un valor predictivo negativo (VAN = 70,2%) y un LR = −0,43 (Figura 5A). Además de estos datos, el punto de corte proporcionó una especificidad del 88,9% y una sensibilidad del 61,9% (Figura 5B). Los análisis consideraron el estado de las pacientes caninas (vivas / muertas) a los 365 días después de la mastectomía.
Figura 5. Representación gráfica de los índices de rendimiento de corte de la expresión GATA-3. (A) Diagrama de dispersión entre la expresión de GATA-3 y el resultado de la enfermedad en 365 días después de la mastectomía en animales con tumores mamarios malignos. (B) índices de curva ROC (Receiver Operating Characteristic), utilizando un punto de corte específico, que incluye: área bajo curva / precisión general (AUC), Co-positividad (Co-pos), Co-negatividad (Co-neg), valores predictivos negativos y positivos (NPV y PPV) y relación riesgo/verosimilitud relativa (LR− y LR).+
El análisis de las curvas de supervivencia de Kaplan-Meier validó aún más los hallazgos anteriores, demostrando que los perros con GATA-3 ≥ 79,4% tenían una tasa de supervivencia significativamente mayor que aquellos con expresiones más bajas de este factor (p < 0,001, HR 7,901 e IC 2,182-28,61). GATA-3 demostró ser un biomarcador de supervivencia en perros con tumores malignos (30), con 50,0% (8/16) de los que tenían una alta expresión de GATA-3 (≥79,4%) sobreviviendo, mientras que solo 14,28% (2/14) de aquellos con baja expresión (<794) sobrevivieron, como se muestra en la Figura 4B. El mayor número de muertes (n = 12/14; 85,71%) ocurrió entre los perros que presentaron tumores con GATA-3 < 79,4%.
3.5. Análisis univariante y multivariante
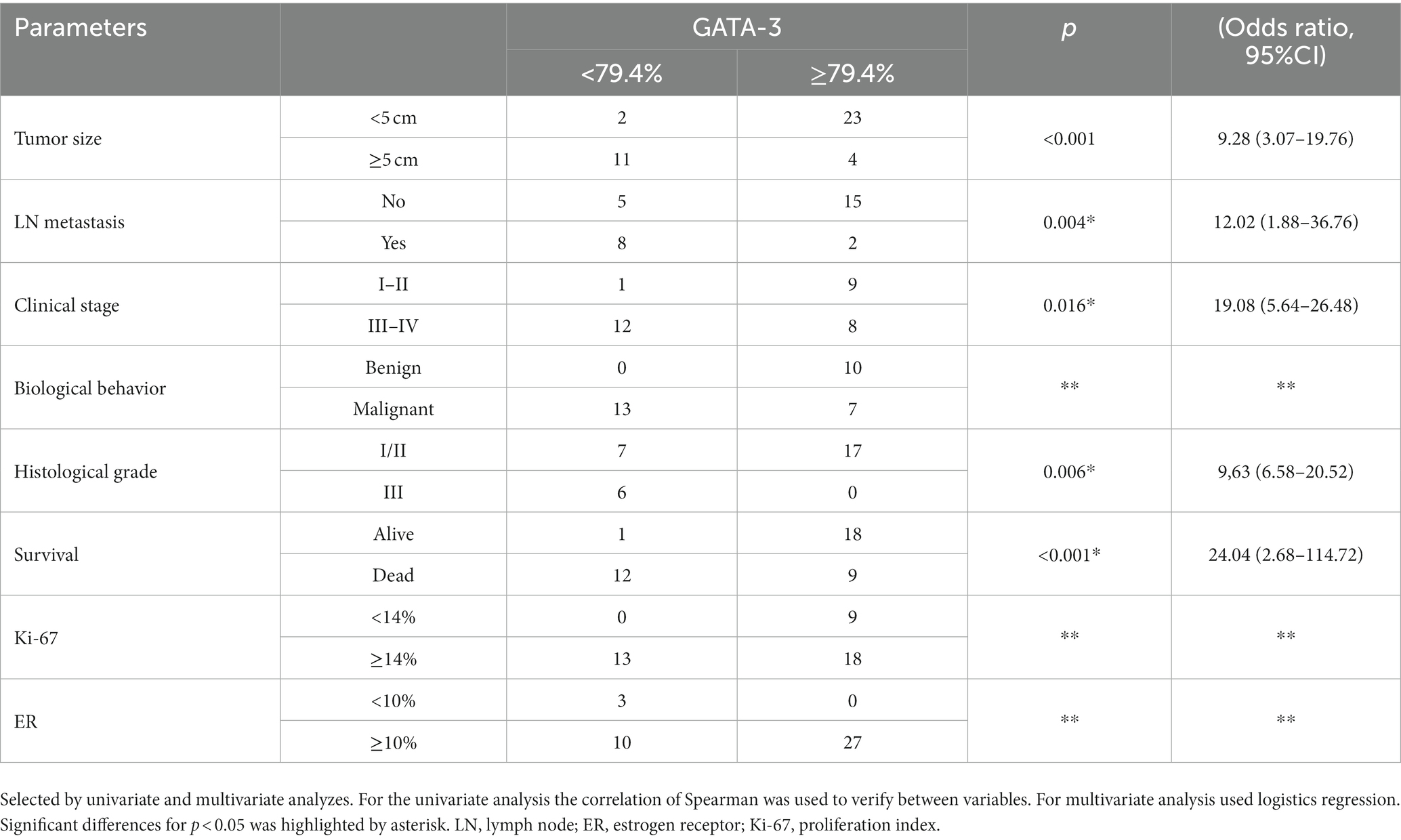
GATA-3 (p < 0,001), tamaño tumoral (p < 0,001), metástasis ganglionar (LN) (p < 0,001), estadio clínico (p = 0,002), grado histológico (p < 0,001) y Ki-67 (p < 0,003) mostraron asociaciones significativas con la supervivencia. El análisis multivariado reveló que sólo GATA-3 (p = 0,015) permaneció como factor pronóstico independiente de mortalidad en el modelo final (Tabla 4). El RE mostró significancia solamente en el análisis multivariado (p = 0,005) (Tabla 4). El análisis adicional demostró una asociación significativa entre el tamaño del tumor (p < 0,001), metástasis en los ganglios linfáticos (LN) (p = 0.004), estadio clínico (p = 0.016), grado histológico (p = 0.006) y supervivencia (p < 0.0001), así como distintos intervalos de expresión de GATA-3 (Tabla 5).
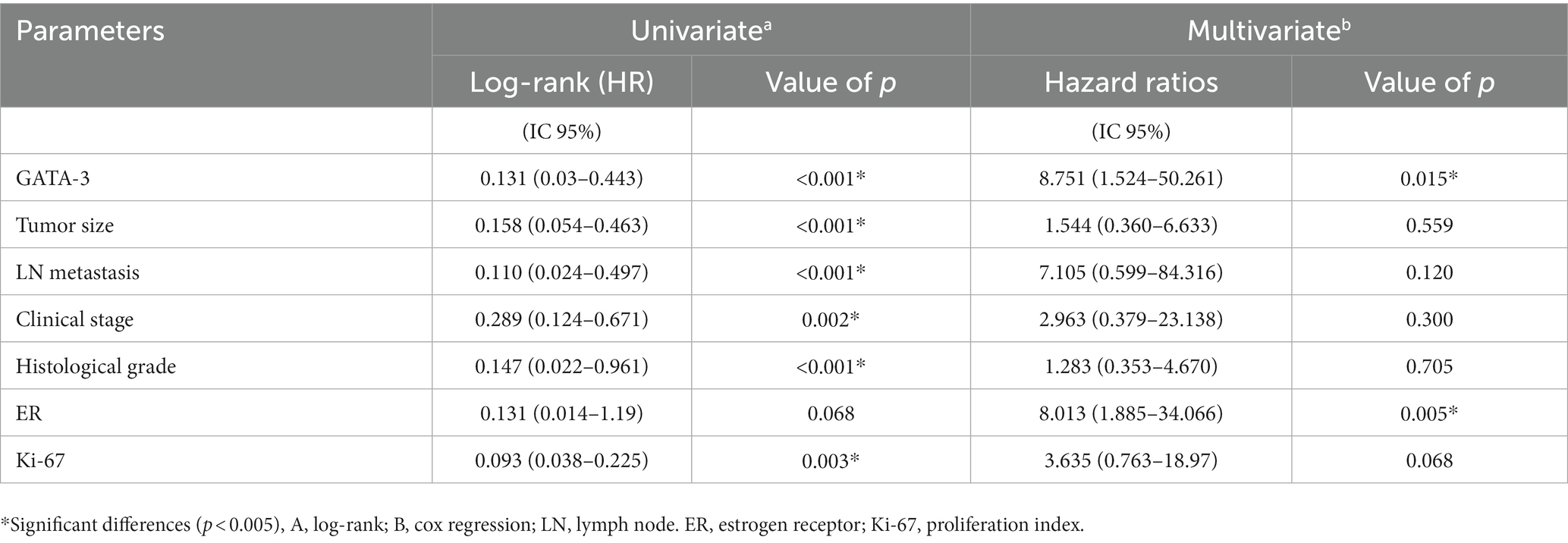 Table 4. Associations between survival and clinical-pathological parameters of female dogs with mammary tumors analyzed by univariate and multivariate methods.
Table 4. Associations between survival and clinical-pathological parameters of female dogs with mammary tumors analyzed by univariate and multivariate methods.
Tabla 5. Asociación entre parámetros clínico-patológicos e intervalo de GATA-3 (≥79,4% de células positivas).
4. Discusión
El presente estudio evaluó la expresión de GATA-3 en tumores mamarios espontáneos de perras de acuerdo con el grado de malignidad, definido por la clasificación histopatológica y clínica del tumor, y la relación entre esta expresión y las tasas de supervivencia. Se ha informado que GATA-3 es un marcador sensible y específico para diagnosticar carcinomas de mama humanos, y la alta expresión de este factor se asocia con resultados pronósticos favorables (7, 41-45). Sin embargo, ningún estudio había evaluado el valor pronóstico de la expresión de la proteína GATA-3 en tumores mamarios de perras, que se utilizan comúnmente como modelos animales en estudios de cáncer de mama humano.
Encontramos expresión de GATA-3 en una localización nuclear exclusiva de células epiteliales de tumores mamarios caninos. Además, de manera similar a los tumores mamarios en las mujeres, este estudio mostró que la expresión de GATA-3 era inversamente proporcional al potencial de malignidad de los tumores mamarios en perros. Los tumores benignos caninos o carcinomas bien diferenciados exhibieron patrones de tinción GATA-3 intensos y difusos de por inmunohistoquímica, mientras que los tumores agresivos caninos mostraron solo resultados leves y dispersos o ausencia de tinción. Nuestros hallazgos en el presente estudio sobre tumores mamarios caninos se correlacionaron con los hallazgos de la investigación en contrapartes humanas. Gentile et al. (28) reportaron niveles bajos de GATA-3 en células de adenoma complejo y carcinoma simple, y altos niveles entre carcinomas complejos y mixtos en su estudio in vitro, que son divergentes de los reportados en nuestro estudio. Sin embargo, estos resultados resaltan la posible influencia del microambiente tumoral y la gradación histopatológica en el perfil de expresión y el comportamiento de diferentes moléculas, como GATA-3.
Los resultados del presente estudio confirman la correlación entre la expresión más significativa de GATA-3 y la diferenciación celular, dada su sobreexpresión en tumores benignos y carcinomas bien diferenciados. En las mujeres, el grado de diferenciación tumoral puede resultar de la interacción de GATA-3 con el gen BRCA1, que causa la formación de complejos proteicos que suprimen los genes asociados con el fenotipo basal triple negativo (RE).−PR−, HER-2−, y CK 5/6 o CK14) en carcinomas de mama (45). Además, la diferenciación puede resultar de la interacción de GATA-3 con microRNA-29b, que promueve alteraciones con el microambiente tumoral e inhibe la metástasis al interferir con la angiogénesis y la regulación de la matriz extracelular a través de la remodelación y proteólisis del colágeno (15). Además, GATA-3 previene la transición epitelial-mesenquimal, lo que puede justificar su mayor expresión en tumores bien diferenciados (13, 14). GATA-3 se asocia con la diferenciación de células luminales en las glándulas mamarias (43, 46), y la mayoría de los tumores de mama humanos se originan a partir de células luminales epiteliales (10, 18). En mujeres con tumores luminales A bien diferenciados, la expresión de GATA-3 es alta, mientras que su menor expresión se reporta en carcinomas de mama triple negativos, que son más agresivos (41, 43, 47).++
Además, un estudio de secuenciación realizado por Cohen et al. (2014) demostró mutaciones somáticas frecuentes en GATA-3 en pacientes con cáncer de mama luminal, y que las mutaciones ocurrieron principalmente dentro del dominio de unión al ADN de GATA-3 y fueron capaces de modular su actividad (20). Los autores demostraron que había una incapacidad del mutante GATA-3 para activar el promotor IL5, lo que sugiere que mutGATA-3 podría tener un efecto distinto en un subconjunto de promotores donde se requiere GATA-3 para reclutar otros factores de transcripción (20). También se demostró que mutGATA-3 tenía una actividad más débil o no regulaba los genes diana GATA-3, concomitantemente con actividad alterada (20). Estas observaciones sugieren que la proteína GATA-3 mutada puede conducir a mecanismos dispares asociados con el cáncer.
Los resultados del presente estudio animan a otros estudios a evaluar este factor de transcripción en diferentes subtipos moleculares de tumores mamarios caninos, especialmente los de RE− Tumores. En un estudio previo, nuestro grupo encontró una alta expresión de GATA-3 en tumores mamarios triple negativos extirpados quirúrgicamente de dos perros machos (27), lo que planteó la hipótesis de que el sexo puede influir en la expresión de GATA-3. De hecho, se han reportado resultados similares en tumores de mama masculinos humanos, por lo que GATA-3 se expresó con menos frecuencia y no se correlacionó con receptores hormonales (ER / PR), metástasis a distancia o tasa de supervivencia (41). Esta hipótesis se ve reforzada por la baja expresión de GATA-3 en tumores con fenotipo triple negativo y la correlación de este factor con un pronóstico desfavorable en mujeres (44, 48).
GATA-3 es crucial para la regulación de la función del RE (44). En el presente estudio, la expresión del RE fue proporcional a la diferenciación tumoral, con una alta expresión esperada en tumores benignos y carcinomas bien diferenciados y expresión baja o ausente en tumores agresivos. La expresión de los receptores hormonales, particularmente el RE, tiene una relación directa con el comportamiento biológico del tumor y el grado de diferenciación de las neoplasias de mama (49, 50). Las excepciones a esto son los carcinomas micropapilares, en los que la expresión del RE no está relacionada con la reducción de la agresión (51).
Los resultados obtenidos en este estudio indican una correlación positiva entre la expresión de ER y GATA-3 en tumores mamarios en perros. Del mismo modo, la expresión inmunohistoquímica de GATA-3 en el cáncer de mama humano mostró una correlación directa con la del RE, ya que el marcador estaba relacionado con el RE− fenotipo, que es característico de tumores agresivos mal diferenciados (43, 48, 52). La intensidad de la correlación entre la expresión de RE y GATA-3 en este estudio fue alta, con un coeficiente que varió de 0,76 a 0,94, que fue comparado con el fuerte coeficiente de correlación encontrado en un estudio sobre tumores en mujeres, que varió de 0,9 a 0,96 (40).
La expresión del marcador de proliferación Ki-67 en relación con la expresión de GATA-3 en los grupos de perros estudiados en este trabajo mostró una fuerte correlación negativa. La expresión más baja de GATA-3 se observó en tumores con altas tasas de proliferación y características agresivas. Estos resultados fueron similares a los descritos en la literatura sobre tumores de mama en mujeres. Estudios previos han reportado la mayor expresión de Ki-67 en tumores malignos de mama humanos, especialmente en casos menos diferenciados, así como una correlación inversa entre Ki-67 y la expresión de ER (51, 53). Ki-67 se define como un marcador pronóstico desfavorable; Su alta expresión nuclear está relacionada con el grado de diferenciación, clasificación histopatológica y potencial metastásico de la neoplasia (54). Debido a que GATA-3 participa activamente en la diferenciación de células luminales, su baja expresión se correlaciona con índices proliferativos más altos y el desarrollo de tumores menos diferenciados (47, 54).
En este estudio, se observó una correlación positiva y significativa entre la expresión de GATA-3 y la supervivencia. Además, los índices de rendimiento demostraron que GATA-3 es un excelente biomarcador de supervivencia en términos del resultado de la neoplasia mamaria canina. Se encontró que los índices más altos de expresión de GATA-3 estaban significativamente relacionados con parámetros clínico-patológicos mejorados, tamaños tumorales más pequeños, grados más bajos y tasas de supervivencia más altas. La expresión de GATA-3 se ha demostrado como un marcador de buen pronóstico en el cáncer de mama humano y su mayor expresión fue consistente con mejores tasas de supervivencia general y libre de recurrencia (52).
En el presente estudio, no se identificó metástasis pulmonar en ninguno de los perros hasta el momento de la mastectomía, cuando se recogieron los fragmentos de tumores para el análisis de expresión de GATA-3. Del número total de casos que mostraron metástasis ganglionar, la clara mayoría mostró baja expresión de GATA-3. Además, la baja expresión de GATA-3 se relacionó con una mediana de supervivencia más baja en comparación con los animales con alta expresión de GATA-3. La expresión baja de GATA-3 es un factor de riesgo significativo de muerte en mujeres con cáncer de mama (14, 43). En un estudio que utilizó líneas celulares agresivas de cáncer de mama en ratones susceptibles a la metástasis pulmonar, una mayor expresión de GATA-3 resultó en un crecimiento tumoral reducido y una menor tasa de metástasis pulmonar (15). Esos autores afirmaron que la expresión de GATA-3 puede inhibir la expansión de las células neoplásicas dentro del parénquima pulmonar a través de mecanismos de regulación génica.
Se ha explorado el potencial predictivo de GATA-3 en mujeres con tumores de mama (14, 43, 55). Una baja expresión de este factor implica un pronóstico desfavorable (48) y falta de respuesta a la terapia hormonal incluso en tumores ER-positivos (56). Sin embargo, Voduc et al. (57) no identificaron una correlación entre la expresión de GATA-3 y los factores pronósticos mediante análisis multivariante. El uso de métodos semicuantitativos o cualitativos para evaluar la expresión de GATA-3 puede contribuir a la divergencia de resultados en cuanto a la relación entre los factores pronósticos y GATA-3 en el cáncer de mama en mujeres. Debido a esta divergencia, establecimos un punto de corte para el análisis inmunohistoquímico GATA-3 de 794 células marcadas / 1000 células o 79.4% de células marcadas y demostramos que esta relación fue efectiva al analizarla utilizando la curva ROC, el índice de rendimiento y la razón de verosimilitud.
Reconocemos las limitaciones de nuestro estudio, incluido el pequeño tamaño de la muestra y la ausencia de fenotipado molecular de los tumores. Esto impidió una comparación adicional con los resultados observados con mujeres, principalmente en relación con los tumores triple negativos. Sin embargo, creemos que el objetivo de nuestro estudio se logró demostrando la importancia pronóstica de GATA-3 basada en la fuerte correlación con ER y Ki-67 y su asociación con factores pronósticos importantes como el tamaño tumoral, el grado histopatológico y el aumento de la supervivencia en neoplasias mamarias caninas. Estos resultados permiten una mayor exploración sobre el papel de GATA-3 en la progresión y el diagnóstico del tumor y la respuesta a la terapia de los tumores mamarios en ambas especies.
Los resultados obtenidos en este estudio indicaron que la expresión de GATA-3 fue mayor en tumores benignos y carcinomas bien diferenciados, mostrando una correlación positiva con el RE y una correlación negativa con el marcador de proliferación Ki-67. La alta expresión de GATA-3 se asoció con una mayor tasa de supervivencia, y puede considerarse un factor pronóstico independiente en neoplasias mamarias de perras. Los resultados fueron similares a las descripciones informadas de estos marcadores de cáncer de mama de las mujeres. El punto de corte elegido propuesto para la evaluación de GATA-3 permitió el discernimiento de perras con mayores probabilidades de supervivencia. Estos datos promueven el uso de GATA-3 en futuros estudios de progresión tumoral, y como biomarcador pronóstico y de monitorización en perros con carcinomas mamarios.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité de Ética en el Uso de Animales de la Facultad de Medicina Veterinaria de la Universidad Federal de Bahía (protocolo nº 17/2021). Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudios.
Contribuciones del autor
AE-L, KD y GD-G contribuyeron a la concepción y diseño del estudio. GD-G, CC y LS realizaron el trabajo de campo. GD-G, CC, KD, GC y AE-L realizaron el trabajo de laboratorio. GD-G y AE-L organizaron la base de datos. GD-G, LR y AE-L realizaron el análisis estadístico. GD-G, AH-B, VS, LR, AE-L y SB-M escribieron el manuscrito. AE-L fue responsable de la adquisición de fondos. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Agradecemos a la Coordenação de Aperfeiçoamento de Pessoal de Nível Superior por la Beca a AE-L (CAPES/PRINT-Finance Code 001: no. 88887.694500/2022-00) y GC es apoyado por una subvención de la Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG) [Rede Mineira de Pesquisa Translacional em Imunobiológicos e Biofármacos no Câncer (REMITRIBIC, RED-00031-21)]. AE-L (Proc. 310248/2021-3), SB-M (Proc. 312022/2021-2) y GC (Proc. 303368/2021-7) cuentan con el apoyo de becas de productividad de investigación y desarrollo tecnológico del Consejo Nacional de Desarrollo Científico y Tecnológico (CNPq).
In memoriam
Dedicamos este estudio a nuestro colega el Dr. Emanoel Martins-Filho mientras reconocemos su dedicación y ética en la investigación y la vida. El Dr. Emanoel Martins-Filho falleció antes de presentar la versión final de este manuscrito y fue víctima de la pandemia de COVID-19.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Estrela-Lima, A , Araújo, MSS , Costa-Neto, JM , Ribeiro, LGR , Damasceno, KA , D’Assis, MJMH, et al. Comprensión de la heterogeneidad inmunológica de los carcinomas mamarios caninos para proporcionar características inmunofenotípicas de los leucocitos circulantes como biomarcadores pronósticos clínicamente relevantes. Cáncer de mama Res Treat. (2012) 131:751–63. DOI: 10.1007/S10549-011-1452-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Cassali, GD . Oncología mamaria comparativa: modelo canino. BMC Proc. (2013) 7:K6. doi: 10.1186/1753-6561-7-S2-K6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Kaszak, I , Ruszczak, A , Kanafa, S , Kacprzak, K , Król, M , y Jurka, P . Biomarcadores actuales de tumores mamarios caninos. Acta Vet Scand. (2018) 60:66. DOI: 10.1186/S13028-018-0417-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Iwamoto, T , Kajiwara, Y , Zhu, Y , e Iha, S . Biomarcadores de quimioterapia neoadyuvante/adyuvante para el cáncer de mama. Chin Clin Oncol. (2020) 9:27. DOI: 10.21037/CCO.2020.01.06
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Barzaman, K , Karami, J , Zarei, Z , Hosseinzadeh, A , Kazemi, MH , Moradi-Kalbolandi, S, et al. Cáncer de mama: biología, biomarcadores y tratamientos. Int Immunopharmacol. (2020) 84:106535. doi: 10.1016/j.intimp.2020.106535
6. Kaszak, I , Witkowska-Piłaszewicz, O , Domrazek, K , y Jurka, P . Las novedosas técnicas diagnósticas y biomarcadores de tumores mamarios caninos. Veterinario Sci. (2022) 9:526. DOI: 10.3390/VETSic9100526
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Ciocca, V , Daskalakis, C , Ciocca, RM , Ruiz-Orrico, A , y Palazzo, JP . La importancia de la expresión de GATA3 es un estudio de seguimiento de 10 años. Tararear Pathol. (2009) 40:489–95. doi: 10.1016/j.humpath.2008.09.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Cangara, H , Upik, M , Rina, M , Berti, N , y Syarifuddin, W . Expresión de GATA-3 y Ki-67 en correlación con subtipos moleculares de cáncer de mama. Dis. Mama Dis. (2021) 40:C27–31. doi: 10.3233/BD-219004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Shu, J , Wu, C , Li, Z , Shao, S , Zhao, W , Tang, X, et al. Inducción de pluripotencia en células semántricas de ratón con especificadores de linaje. Células. (2013) 153:963–75. doi: 10.1016/j.cell.2013.05.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Kouros-Mehr, H , Bechis, SK , Slorach, EM , Littlepage, LM , Egeblad, M , Ewald, AJ, et al. GATA-3 vincula la diferenciación tumoral y la diseminación en un modelo luminal de cáncer de mama. Célula cancerosa. (2008) 13:141–52. doi: 10.1016/j.ccr.2008.01.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Takaku, M , Grimm, SA , y Wade, PA . GATA3 en cáncer de mama: ¿supresor tumoral u oncogén? Gene Expr. (2015) 16:163–8. doi: 10.3727/105221615X14399878166113
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Asselin-Labat, ML , Sutherland, KD , Vaillant, F , Gyorki, DE , Wu, D , Holroyd, S, et al. GATA-3 regula negativamente la capacidad iniciadora de tumores de las células progenitoras luminales mamarias y se dirige al supuesto supresor tumoral caspasa-14. Mol Cell Biol. (2011) 31:4609–22. doi: 10.1128/MCB.05766-11
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Si, W , Huang, W , Zheng, Y , Yang, Y , Liu, X , Shan, L, et al. La disfunción del bucle de retroalimentación recíproca entre los programas de represión nucleados por GATA3 y ZEB2 contribuye a la metástasis del cáncer de mama. Célula cancerosa. (2015) 27:822–36. doi: 10.1016/j.ccell.2015.04.011
14. Yoon, NK , Maresh, EL , Shen, D , Elshimali, Y , Manzana, S , Horvath, S, et al. Los niveles más altos de GATA3 predicen una mejor supervivencia en mujeres con cáncer de mama. Tararear Pathol. (2010) 41:1794–801. doi: 10.1016/j.humpath.2010.06.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Chou, J , Lin, JH , Brenot, A , Kim, JW , Provot, S , y Werb, Z . GATA-3 suprime la metástasis y modula el microambiente tumoral mediante la regulación de la expresión de microRNA-29b. Nat Cell Biol. (2013) 15:201–13. DOI: 10.1038/NCB2672
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Chu, MI , Michalowski, AM , Hoenerhoff, M , Szauter, KM , Luger, D GATA3 inhibe las metástasis mediadas por lisil oxidasa de células de cáncer de mama triple negativo basal humano. Oncogén. (2012) 31:2017–27. DOI: 10.1038/ONC.2011.382
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Dydensborg, AB , Rosa, AA , y Wilson, BJ . GATA3 inhibe el crecimiento del cáncer de mama y la metástasis del cáncer de mama pulmonar. Oncogén. (2009) 28:2634–42. DOI: 10.1038/ONC.2009.126
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Colmillo, SH , Chen, Y , y Weigel, RJ . GATA-3 como marcador de respuesta hormonal en el cáncer de mama. J Surg Res. (2009) 157:290–5. doi: 10.1016/j.jss.2008.07.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Theodorou, V , Stark, R , Menon, S , y Carroll, JS . GATA3 actúa aguas arriba de FOXA1 en la mediación de la unión ESR1 dando forma a la accesibilidad del potenciador. Genoma Res. (2013) 23:12–22. DOI: 10.1101/GR.139469.112
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Cohen, H , Ben-Hamo, R , Gidoni, M , Yitzhaki, I , Kozol, R , Zilberberg, A, et al. Cambio en las funciones de GATA3 y mutaciones de GATA3, control de progresión y presentación clínica en cáncer de mama. Cáncer de mama Res. (2014) 16:464. DOI: 10.1186/S13058-014-0464-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Govoni, VM , Pigoli, C , Brambilla, E , Ruiz Sueiro, FA , Torres Neto, R , Laufer-Amorim, R, et al. Expresiones de caveolina-1, GATA-3 y Ki67 y su correlación con hallazgos patológicos en carcinoma urotelial de vejiga canina. Front Vet Sci. (2022) 9:986269. DOI: 10.3389/FVETS.2022.986269
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Colombo, J , Moschetta-Pinheiro, MG , Novais, AA , Stoppe, BR , Bonini, ED , Gonçalves, FM, et al. La biopsia líquida como herramienta diagnóstica y pronóstica para mujeres y perras con cáncer de mama. Cánceres. (2021) 13:5233. doi: 10.3390/cánceres13205233
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Nguyen, F , Pena, L , Ibisch, C , Loussouarn, D , Gama, A , Rieder, N, et al. Carcinomas mamarios invasivos caninos como modelos de cáncer de mama humano. Parte 1: historia natural y factores pronósticos. Cáncer de mama Res Treat. (2017) 167:635–48. DOI: 10.1007/S10549-017-4548-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Abadie, J , Nguyen, F , Loussouarn, D , Peña, L , Gama, A , Rieder, N, et al. Carcinomas mamarios invasivos caninos como modelos de cáncer de mama humano. Parte 2: inmunofenotipos y significado pronóstico. Cáncer de mama Res Treat. (2018) 167:459–68. DOI: 10.1007/S10549-017-4542-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Carvalho, MI , Carvalho, RS , Pires, I , Prada, J , Bianchini, R , Jensen-Jarolim, E, et al. Un enfoque comparativo de la inflamación asociada a tumores en el cáncer de mama entre humanos y perros. Biomed Res Int. (2016) 2016:1–12. doi: 10.1155/2016/4917387
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Machado, MC , Yamamoto, PA , Pippa, LF , de Moraes, NV , Neves, FMF , Portela, RD, et al. Farmacocinética de carboplatino en combinación con dosis bajas de ciclofosfamida en perras con carcinoma mamario. Animales. (2022) 12:3109. DOI: 10.3390/ANI12223109
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Machado, MCA , Ocarino, Nuevo México , Serakides, R , Moroz, LR , Sementilli, A , Damasceno, KA, et al. Carcinoma mamario triple negativo en dos perros machos. J Vet Diagn Investig. (2020) 32:94–8. doi: 10.1177/1040638719898686
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Gentil, LB , Nagamine, MK , Biondi, LR , Sanches, DS , Toyota, F , Giovani, TM, et al. Establecimiento de cultivos celulares mixtos primarios a partir de tumores mamarios caninos espontáneos: caracterización de moléculas clásicas y nuevas asociadas al cáncer. PLoS One. (2017) 12:E0184228. doi: 10.1371/journal.pone.0184228
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Sol, D , Wang, J , Zhang, K , Zhang, H , Diao, T , y Fu, Q . Metástasis de la glándula suprarrenal del carcinoma mucinoso invasivo de mama: un informe de caso raro y revisión de la literatura. Representante de Casos Oncol. (2022) 15:636–41. doi: 10.1159/000525214
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Ni, YB , Tsang, JYS , Shao, MM , Chan, SK , Cheung, SY GATA-3 es superior a GCDFP-15 y mammaglobin para identificar el cáncer de mama primario y metastásico. Cáncer de mama Res Treat. (2018) 169:25–32. DOI: 10.1007/S10549-017-4645-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Miettinen, M , McCue, PA , Sarlomo-Rikala, M , Rys, J , Czapiewski, P GATA3: un marcador multiespecífico pero potencialmente útil en patología quirúrgica: un análisis sistemático de 2500 tumores epiteliales y no epiteliales. Am J Surg Pathol. (2014) 38:13–22. doi: 10.1097/PAS.0b013e3182a0218f
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Goldschmidt, MH , Peña, L , y Zappulli, V . Tumores de la glándula mamaria, Meuten DJ. Tumores en animales domésticos: Tumor del sistema urinario. 5º, Iowa: Wiley Blackwell (2017) 749.
33. Cassali, GD , Jark, PC , Gamba, C , Damasceno, KA , Lima, AE , Nardi, ABD, et al. Consenso sobre el diagnóstico, pronóstico y tratamiento de los tumores mamarios caninos y felinos – 2019. Braz J Veterinario Pathol. (2020) 13:555–74. DOI: 10.24070/BJVP.1983-0246.V13i3P555-574
34. Elston, CW , Ellis, IO , y Pinder, SE . Factores pronósticos en el carcinoma invasivo de mama. Clin Oncol. (1998) 10:14–7. doi: 10.1016/S0936-6555(98)80105-2
35. Cassali, GD , Damasceno, KA , Bertagnolli, AC , Estrela-Lima, A , Lavalle, GE , Di Santis, GW, et al. Consenso en cuanto al diagnóstico, pronóstico y tratamiento de los tumores mamarios caninos: tumores mixtos benignos, carcinomas en tumores mixtos y carcinosarcomas. Braz J Veterinario Pathol. (2017) 10:87–99. DOI: 10.24070/BJVP.1983-0246.V10I3P87-99
36. McShane, LM , Altman, DG , Sauerbrei, W , Taube, SE , Gion, M , y Clark, GM . Recomendaciones de notificación para estudios pronósticos de MARKer tumorales (REMARK). Cáncer de mama Res Treat. (2006) 100:229–35. DOI: 10.1007/S10549-006-9242-8
37. Nicchio, BO , Barrouin-Melo, SM , Machado, MC , Vieira-Filho, CH , Santos, FL , Martins-Filho, EF, et al. Hiperresistinemia en perras obesas con carcinoma mamario en tumores benignos-mixtos y su correlación con la agresividad tumoral y la supervivencia. Front Vet Sci. (2020) 7:509. DOI: 10.3389/fvets.2020.00509
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Greiner, M , Sohr, D , y Gobel, P . Un análisis ROC modificado para la selección de valores de corte y la definición de resultados intermedios de pruebas serodiagnósticas. J Immunol Met. (1995) 185:123–32. doi: 10.1016/0022-1759(95)00121-P
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Swets, JA . Medición de la precisión de los sistemas de diagnóstico. Ciencia. (1988) 240:1285–93. doi: 10.1126/science.3287615
40. Pett, MA , Lacayo, NR , y Sullivan, JJ . Dar sentido al análisis factorial: El uso del análisis factorial para el desarrollo de instrumentos en la investigación del cuidado de la salud. Thousand Oaks, CA: Sage (2003).
41. González, RS , Wang, J , Kraus, T , Sullivan, H , Adams, AL , y Cohen, C . Expresión de GATA-3 en cánceres de mama masculinos y femeninos: comparación de parámetros clinicopatológicos y relevancia pronóstica. Tararear Pathol. (2013) 44:1065–70. doi: 10.1016/j.humpath.2012.09.010
42. Escudo, PW , Papadimos, DJ , y Walsh, MD . GATA3: un marcador prometedor para el carcinoma de mama metastásico en muestras de derrame seroso. Cáncer citopatol. (2014) 122:307–12. doi: 10.1002/CNCY.21393
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Fararjeh, AS , Tu, SH , Chen, LC , Liu, YR , Lin, YK , Chang, HL, et al. El impacto de la eficacia de GATA3 como factor pronóstico en el cáncer de mama. Tararear Pathol. (2018) 80:219–30. doi: 10.1016/j.humpath.2018.06.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. De Medeiros, SP , Carvalho, FM , Aguiar, FN , Gagliato, D , y de Barros, ACSD . Asociación entre GATA3 y parámetros histopatológicos e inmunohistoquímicos en carcinomas de mama infiltrantes tempranos. Eur J Salud del pecho. (2022) 18:229–34. doi: 10.4274/ejbh.galenos.2022.2022-3-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Tkocz, D , Crawford, NT , Buckley, NE , Berry, FB , Kennedy, RD , Gorski, JJ, et al. BRCA1 y GATA3 core presionan a FOXC1 para inhibir la patogénesis de los cánceres de mama de tipo basal. Oncogén. (2012) 31:3667–78. DOI: 10.1038/ONC.2011.531
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Kinoshita, Y , Yoshizawa, K , Emoto, Y , Yuki, M , Yuri, T , Shikata, N, et al. Similitud de la expresión de GATA-3 entre las glándulas mamarias de rata y humanas. J Toxicol Pathol. (2014) 27:159–62. DOI: 10.1293/tox.2014-0008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Davis, DG , Siddiqui, MT , Oprea-ilies, G , Stevens, K , Osunkoya, AO , Cohen, C, et al. La expresión de GATA-3 y FOXA1 es útil para diferenciar el carcinoma de mama de otros carcinomas. Tararear Pathol. (2016) 47:26–31. doi: 10.1016/j.humpath.2015.09.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Mehra, R , Varambally, S , Ding, L , Shen, R , Sabel, MS , Ghosh, D, et al. Identificación de GATA3 como marcador pronóstico del cáncer de mama mediante metanálisis global de expresión génica. Cáncer Res. (2005) 65:11259–64. doi: 10.1158/0008-5472.CAN-05-2495
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Mohr, A , Lüder, RF , Martillo, SC , Willenbrock, S , Hewicker-Trautwein, M , Kiełbowicz, Z, et al. Análisis de expresión de receptores hormonales en tejido mamario canino neoplásico y no neoplásico mediante un ensayo de ADN ramificado múltiple basado en perlas: un estudio de expresión génica en muestras frescas congeladas y fijadas en formalina incrustadas en parafina. Plos One. (2016) 11:9. doi: 10.1371/journal.pone.0163311
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Sorenmo, KW , Rasotto, R , Zappulli, V , y Goldschmidt, MH . Desarrollo, anatomía, histología, drenaje linfático, características clínicas y marcadores de diferenciación celular de neoplasias de las glándulas mamarias caninas. Veterinario Pathol. (2011) 48:85–97. doi: 10.1177/0300985810389480
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Kadthur, JC , Rao, S , Sonnahallipura, BM , Thimmanahalli, DS , y Laxmikanth, M . Valor pronóstico del antígeno de proliferación de Ki-67 en tumores malignos caninos de la glándula mamaria. Braz J Veterinario Pathol. (2011) 4:36–40. Disponible en: https://bjvp.org.br/wp-content/uploads/2015/07/V.4-N.1-06-20881_2011_3_16_3_48.pdf
52. Kailasam, K , Chhatraia, H , Omaira, M , y Ravichandar, M . Implicación pronóstica de la mutación del gen GATA3 en la supervivencia en el carcinoma ductal invasivo de mama. J Clin Oncol. (2017) 35:E13114. doi: 10.1200/JCO.2017.35.15_suppl.e13114
53. Yildirim, E , Bektas, S , Gundogar, O , Findik, D , Alcicek, S , Erdogan, KO, et al. La relación de GATA3 y Ki-67 con parámetros pronósticos histopatológicos, recurrencia locorregional y supervivencia libre de enfermedad en carcinoma ductal invasivo de mama. Anticáncer Res. (2020) 40:5649–57. DOI: 10.21873/Anticanres.14578
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Terzian, ACB , Zucarri, DAPC , Pereira, RS , Pavam, MV , Ruiz, CM , Sueiro, FAR, et al. Avaliação da caspasa-3 e Ki-67 como marcadores prognósticos nas neoplasias mamárias em cadelas [Evaluación de caspasa-3 y Ki-67 como marcadores pronósticos en tumores mamarios caninos]. Braz J Vet Res Anim Sci. (2007) 44:96–102. doi: 10.11606/issn.1678-4456.bjvras.2007.26647
55. Aphivatanasiri, C , Li, J , Chan, R , Jamidi, SK , Tsang, JY , Poon, IK, et al. SOX10 GATA3 combinado es más sensible en la detección de cánceres de mama primarios y metastásicos: un estudio comparativo de marcadores mamarios en tumores múltiples. Cáncer de mama Res Treat. (2020) 184:11–21. DOI: 10.1007/S10549-020-05818-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Jacquemier, J , Charafe-Jauffret, E , Monville, F , Esterni, B , Extra, JM , Houvenaeghel, G, et al. La asociación del estado de GATA3, P53, Ki67 y la invasión vascular peritumoral son fuertemente pronósticos en el cáncer de mama luminal. Cáncer de mama Res. (2009) 11:R23. DOI: 10.1186/BCR2249
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cita: Diniz-Gonçalves GS, Hielm-Björkman A, da Silva VB, Ribeiro LGR, da Costa Vieira-Filho CH, Silva LP, Barrouin-Melo SM, Cassali GD, Damasceno KA y Estrela-Lima A (2023) Expresión de GATA-3 y su correlación con factores pronósticos y supervivencia en tumores mamarios caninos. Frente. Vet. Sci. 10:1179808. doi: 10.3389/fvets.2023.1179808
Recibido: 04 Marzo 2023; Aprobado: 19 de junio de 2023;
Publicado: 06 julio 2023.
Editado por:
Carlos Eduardo Fonseca-Alves, Universidad Paulista, Brasil
Revisado por:
Eva Hellmén, Universidad Sueca de Ciencias Agrícolas, Suecia
Juliana Mariotti Guerra, Instituto Adolfo Lutz, Brasil
Frederique Nguyen, Agroalimentaire et de l’alimentation de Nantes-Atlantique (Oniris), Francia
Copyright © 2023 Diniz-Gonçalves, Hielm-Björkman, da Silva, Ribeiro, da Costa Vieira-Filho, Silva, Barrouin-Melo, Cassali, Damasceno y Estrela-Lima. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Alessandra Estrela-Lima, alessandra.lima@helsinki.fi; aestrela@ufba.br
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía