Inmunofenotipado de la sangre periférica, los ganglios linfáticos y los linfocitos T de la médula ósea durante la leishmaniosis canina y el impacto de la quimioterapia antileishmanial
Inmunofenotipado de la sangre periférica, los ganglios linfáticos y los linfocitos T de la médula ósea durante la leishmaniosis canina y el impacto de la quimioterapia antileishmanial
- 1CIISA-Centro de Investigação Interdisciplinar em Sanidade Animal, Faculdade de Medicina Veterinária, Universidade de Lisboa, Lisbon, Portugal
- 2GHTM-Global Health and Tropical Medicine (GHTM), Instituto de Higiene e Medicina Tropical (IHMT), Universidade Nova De Lisbon (UNL), Lisboa, Portugal
Los perros son un reservorio importante de Leishmania infantum, agente etiológico de la leishmaniosis canina (CanL), una enfermedad visceral zoonótica de preocupación mundial. Los protocolos terapéuticos basados en medicamentos antileishmaniales se utilizan comúnmente para tratar a los perros enfermos y mejorar su condición clínica. Para comprender mejor el impacto de la infección por Leishmania y los medicamentos antileishmanial en la respuesta inmune del perro, este estudio investiga el perfil de los subconjuntos de células T CD4+ y CD8+ en la sangre periférica, los ganglios linfáticos y la médula ósea de los perros enfermos y después de dos tratamientos diferentes de CanL. Dos grupos de CanL de seis perros cada uno fueron tratados con antimoniato de mitefosina o meglumina combinado con alopurinol. Se utilizó otro grupo de 10 perros clínicamente sanos como control. Tras el diagnóstico y durante los siguientes 3 meses de tratamiento, se recogieron células mononucleares de sangre periférica, linfondulo poplíteo y médula ósea, etiquetadas para los marcadores de superficie CD45, CD3, CD4, CD8, CD25 y el factor nuclear intracelular FoxP3, y las subpoblaciones de linfocitos T fueron in Los perros CanL presentaron una mayor frecuencia general de células T de doble positivo CD8+ y CD4+ CD4+ en todos los tejidos y una disminución de la frecuencia de células T CD4+ en la sangre. Además, hubo una mayor frecuencia de células T CD8+ que expresaban CD25+FoxP3+ en la sangre y la médula ósea. Durante el tratamiento, estos subconjuntos se recuperaron a niveles similares a los de los perros sanos. Sin embargo, la terapia antileishmanial causó un aumento de las células T CD4+CD25+FoxP3+ en todos los tejidos, asociado con la disminución de los porcentajes de células T CD8+CD25-FoxP3−. Estos hallazgos pueden apoyar estudios anteriores que indican que L. infantum manipula el sistema inmunológico del perro para evitar el desarrollo de una respuesta protectora, asegurando la supervivencia del parásito y las condiciones que permiten completar el ciclo de vida de Leishmania. Ambos tratamientos utilizados parecen tener un efecto en la respuesta inmune del perro, demostrando ser eficaces para promover la normalización de los subconjuntos de células T.
Introducción
La leishmaniosis se considera una enfermedad tropical descuidada (1) que afecta a los seres humanos y a los animales domésticos y forestales. Los parásitos del género Leishmania son protozoos intracelulares obligatorios y el agente etiológico de esta enfermedad parásita (2). La principal célula huésped de los parásitos de Leishmania es el macrófago, que el parásito es capaz de manipular y prevenir la activación por varios mecanismos y, por lo tanto, evitar su muerte intracelular y perpetuar la infección (3-5). La leishmaniosis canina (CanL), endémica en unos 50 países y dos regiones principales, América del Sur y la cuenca mediterránea, es causada por Leishmania infantum (6). Los perros afectados por esta enfermedad pueden presentar una amplia variedad de signos clínicos específicos y no específicos (7, 8). Los tratamientos convencionales de CanL mejoran el estado clínico de los perros y reducen la carga de los parásitos (9). Aunque cuando se suspende la terapia, las recaídas son comunes (10-12), lo que indica que el tratamiento no promueve el aclaramiento de los parásitos en todos los casos. Por lo tanto, es importante mejorar la eficacia de los protocolos de tratamiento aplicados a CanL para promover la cura clínica del perro, garantizar el aclaramiento de los parásitos y prevenir una mayor transmisión. De acuerdo con las directrices más recientes (8), los protocolos de tratamiento de CanL recomendados combinan el alopurinol con antimoniato de meglumina o la miltefosina. El antimoniato de meglumina es un antimonial pentavalente considerado un fármaco multifactorial cuyos efectos aún no están claros. Sin embargo, algunos autores se han referido a la promoción del daño al ADN de Leishmania por estrés oxidativo e influencia en la actividad microbicida de los macrófagos (13-15). Se ha demostrado que los antimoniales pentavalentes, que pertenecen a la misma familia de antimoniato de meglumina, como el gluconato de antimonio de sodio, interfieren con el sistema inmunológico del huésped al activar los macrófagos para liberar interleucina 12 (IL-12), lo que lleva a la posterior producción de interferón-γ (IFN Además, también parecen inducir la expresión de moléculas de clase I del complejo principal de histocompatibilidad (MHC), estimulando las células T CD8+ que conducen a la apoptosis de las células infectadas (17, 18). Aunque estos medicamentos han demostrado su actividad antileishmanial in vitro e in vivo, los antimoniales pentavalentes no han podido tratar la leishmaniosis visceral en pacientes humanos que también están infectados con el VIH o que reciben terapia inmunosupresora (17), lo que indica que una cura completa depende de las respuestas mediadas por células T (19, 20). La miltefosina es un compuesto de alquilfosfocolina capaz de inducir la apoptosis por mecanismos aún no del todo claros, aunque la alteración específica del contenido lipídico en la membrana del parásito y la modulación de la actividad del macrófago son los modos de acción más consensuados (18, 21-24). Varios estudios han informado de las propiedades inmunomoduladoras de la miltefosina, con estudios in vitro que muestran la inducción de la liberación del factor de necrosis tumoral α (TNF-α) y óxido nítrico (NO) por los macrófagos peritoneales de ratones BALB/c (25) y la mejora de los receptores IFN- Además, en las células sanguíneas periféricas humanas sanas, se encontró que la miltefosina fue capaz de aumentar la producción de IFN-γ, actuando como coestimulador del proceso de activación de células T mediadas por IL-2, junto con una mayor expresión de CD25, mostrando la posible actividad inmunomoduladora de la miltefosina (27). El alopurinol, un análogo purina del nucleótido de adenosina, bloquea la síntesis de ARN, inhibiendo el crecimiento de la leishmania (28, 29). Hasta la fecha, el antimoniato de meglumina o la miltefosina en combinación con alopurinol se consideran tratamientos de primera línea en Europa (7, 8). Recientemente, en Brasil, se aprobó la terapia con miltefosina para el tratamiento con CanL (30). Teniendo en cuenta la aparición de un mayor número de informes sobre la resistencia a los medicamentos, ya sea en humanos o en perros (13, 17, 21, 31), es crucial profundizar en la comprensión del modo de acción de las terapias antileishmaniales más utilizadas.
En los perros, el resultado de la enfermedad está determinado principalmente por la respuesta inmune mediada por células, y las células T desempeñan un papel clave en la liberación de citoquinas, que interactúa con los macrófagos infectados, influyendo en la activación de los macrófagos y la posterior muerte de parásitos internalizados. Según el entorno de las citocinas, los linfocitos T CD4+ ingenuos pueden diferenciarse en un subconjunto protector (Th1) o un subconjunto de células Th2, lo que favorece el progreso de la infección (32). Una respuesta inmune protectora de Th1 se caracteriza por una alta producción de citocinas proinflamatorias, como es el caso de IFN-γ, TNF-α e IL-2. Estas citocinas estimulan la actividad citotóxica de las células T CD8+ y activan la ráfaga respiratoria del macrófago, lo que lleva a la síntesis de ROS e induce la producción de NO, lo que puede causar un daño importante a la membrana del parásito, lo que lleva a la muerte del parásito (32-34). Por otro lado, una respuesta Th2 dirige la liberación de citocinas antiinflamatorias y estimula la respuesta inmune humoral, favoreciendo el establecimiento de la infección y la exacerbación de la enfermedad (6, 7). Los trabajos anteriores en perros sintomáticos con CanL han demostrado que la falta de una respuesta inmune adecuada mediada por células podría estar asociada con una disminución de los niveles de células T CD4+ y altos títulos de anticuerpos (35-38). Los estudios in vitro de células T CD8+ citotóxicas de perros asintomáticos demostraron un papel en la resistencia a la CanL al mejorar la producción de IFN-γ y causar la lisis de los macrófagos infectados (39).
Se ha atribuido un papel crítico de la regulación inmune a un subgrupo de células denominadas células reguladoras T (Treg), que parecen ser reclutadas para los sitios de infección por Leishmania, lo que permite la supervivencia de los parásitos y garantiza el ciclo de transmisión (40, 41). Los estudios experimentales de la leishmaniosis cutánea realizada en ratones L. con la mayor enfermedad mostraron que las células Treg son esenciales para el desarrollo y el mantenimiento de la enfermedad cutánea persistente (40). El rápido aumento de las células de CD4+CD25+ Treg en los sitios de L. la infección mayor suprimió los mecanismos inmunes que eliminan los parásitos (41). La acumulación de células Treg productoras de IL-10 observada en la médula ósea de pacientes con leishmaniosis visceral de L. donovani puede causar inmunosupresión, prevenir la liberación de citocinas proinflamatorias, como IFN-γ, evitar la activación de macrófagos y estar asociada con la falta de respuesta al tratamiento (42). Otro estudio mostró un aumento de las células de Treg CD4+CD25+ que exhiben altos niveles de expresión génica de la proteína 3 de la caja de Forkhead, junto con la transformación del factor de crecimiento β (TGF-β) en el bazo y la drenación de los ganglios linfáticos de ratones BALB/c infectados conEsta subpoblación celular contribuye a la inmunosupresión y al control de la inmunopatología mediada por parásitos durante la infección. Los subconjuntos de células Treg que expresan constitutivamente CD25 y sintetizan IL-10 y TGF-β impulsan la supresión de las respuestas inmunes mediadas por células (44). Estas células se consideran potentes supresoras de la activación de las células T CD8+ (45). Sin embargo, otro estudio mostró un porcentaje reducido de células de CD3+CD4+FoxP3+ Treg en perros infectados con L. infantum, independientemente del título de anticuerpos (46). Aunque se han identificado las células supresoras T CD8+, su modo de acción y propósito no se entienden completamente (47). Algunos estudios han demostrado que los linfocitos CD4+ en reposo son resistentes a las células de Treg CD8+CD25+FoxP3+, lo que indica que no es probable que el inicio de la respuesta inmune mediada por células CD8+ se vea afectado por las células de Treg. Por el contrario, las células CD8+ Treg pueden desempeñar un papel fundamental en la supresión de las respuestas continuas de las células T de CD4+ (48). Además, la actividad de las células CD4+CD25+FoxP3+ Treg parece estar mediada a través de la liberación de citocinas inmunosupresoras y por mecanismos dependientes del contacto celular (48). Con respecto a la leishmaniosis, pocos estudios se centran en las células Treg, y menos son las que han analizado la fracción celular de Treg CD8+. Tiwananthagorn et al. (49) informaron que en el hígado de ratones infectados por L. donovani, las células T de CD4+FoxP3+, pero no las células T CD8+FoxP3+, son esenciales para el aumento de la susceptibilidad a la infección por Leishmania y la alta producción de IL-10.
Se han identificado células T que expresan moléculas CD4 y CD8 en la sangre periférica y en los órganos linfoides secundarios de varias especies, como cerdos, monos, humanos, pollos, ratas, ratones y perros (50-56). Estas células T de doble positivo (dp) CD4+ CD4+ parecen constituir células T auxiliares de memoria CD4+ que, tras la activación, desarrollan la capacidad de expresar la cadena CD8α y, en casos como los cerdos, producen altos niveles de IFN-γ en respuesta a la estimulación con antígenos virales (50). Esta subpoblación se ha identificado como un aumento en enfermedades crónicas, como el cáncer, las enfermedades autoinmunes y las infecciones virales (57-61). Varios estudios también han informado de la presencia de CD25 y FoxP3 en las células T dp de los perros, lo que revela una posible actividad reguladora entre esta subpoblación (62, 63).
Por lo tanto, el estudio actual tiene como objetivo evaluar la cinética de los subconjuntos de células T CD4+ y CD8+ en los tejidos que comúnmente albergan parásitos de Leishmania en perros enfermos y tratados. Los perros enfermos (CanL) fueron tratados con dos de los protocolos más utilizados para CanL durante un período de 3 meses, y la sangre periférica, los ganglios linfáticos y las células T de la médula ósea fueron inmunofenotipadas.
Materiales y métodos
Selección de perros
Veintitrés perros domésticos que viven en el área endémica de la Región Metropolitana de Lisboa (Portugal) fueron diagnosticados con CanL en la etapa clínica I/II, de acuerdo con las Directrices de Consenso de LeishVet (64), y en la etapa C, siguiendo las Directrices del Grupo de Trabajo de Leishmaniasis Canina (65). Doce de estos perros enfermos cumplían los requisitos mínimos para ingresar al estudio (Figura 1), que incluían tener al menos 1,5 años de edad, pesaban más de 5 kg, no haber sido vacunados para la leishmaniosis, ser negativos para patógenos circulantes potencialmente responsables de enfermedades transmitidas por vectores caninos (CVBD), y no se han sometido a ningún tratamiento en los El presente estudio también incluyó un grupo de control de 10 perros clínicamente sanos que fueron negativos para anticuerpos de Leishmania y otros CVBD y no vacunados para la leishmaniosis. Todos los dueños de perros dieron su consentimiento por escrito después de ser informados sobre los objetivos del estudio y cada procedimiento. Los animales seleccionados incluían 15 machos y 7 hembras de varias razas, con edades entre 2 y 9 años y un peso entre 7,6 y 32,1 kg. Los veterinarios realizaron el examen clínico y la recogida de muestras en el Hospital Universitario de la Facultad de Medicina Veterinaria de la Universidad de Lisboa.
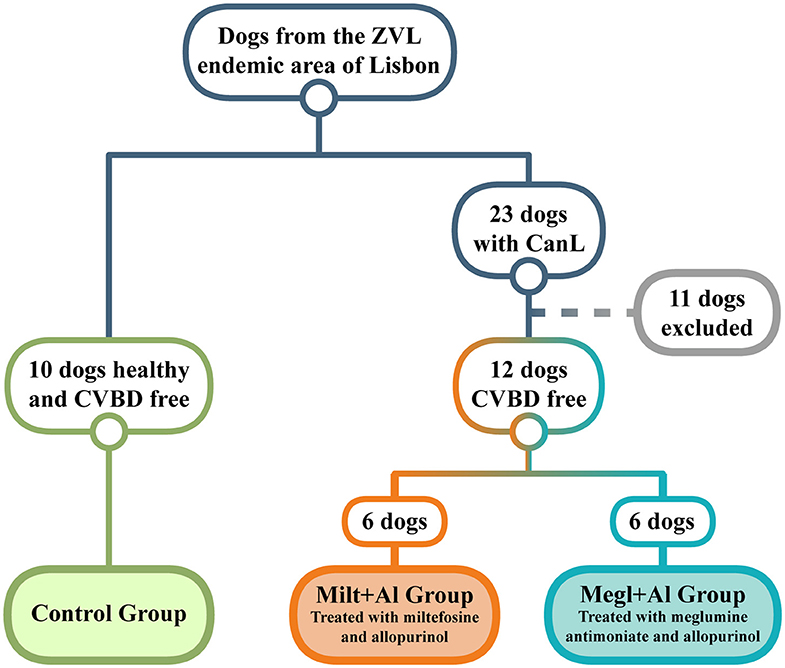 FIGURA 1. Diagrama de selección de perros utilizado en el estudio actual. De una población de perros que viven en un área endémica de leishmaniosis visceral zoonótica (ZVL), se establecieron dos grupos diagnosticados clínicamente con leishmaniosis canina (CanL) y se trataron con miltefosina en combinación con alopurinol (Milt+Al) o antimoniato de meglumina en asociación con alop También se seleccionó como grupo de control un grupo de perros clínicamente sanos y libres de cualquier enfermedad transmitida por vectores caninos (CVBD).
FIGURA 1. Diagrama de selección de perros utilizado en el estudio actual. De una población de perros que viven en un área endémica de leishmaniosis visceral zoonótica (ZVL), se establecieron dos grupos diagnosticados clínicamente con leishmaniosis canina (CanL) y se trataron con miltefosina en combinación con alopurinol (Milt+Al) o antimoniato de meglumina en asociación con alop También se seleccionó como grupo de control un grupo de perros clínicamente sanos y libres de cualquier enfermedad transmitida por vectores caninos (CVBD).
Como se describió anteriormente por nuestro grupo (66), los perros diagnosticados con CanL que presentaban parámetros bioquímicos como aumento del nitrógeno úrico en sangre (BUN), creatinina y/o alanina aminotransferasa (ALT), aspartato aminotransferasa (AST) y la relación proteína-creatinina (UPC) en la orina entre 0,2 y 0,6, que Los perros que mostraron cambios en las proteínas séricas y las proporciones de UPC entre 0,2 y 0,4 fueron tratados con antimoniato de meglumina (Glucantime®, Merial Portuguesa, Portugal; 100 mg/kg SID durante 4 semanas) combinado con alopurinol (10 mg/kg, por os, BID durante al menos 6 meses) y fueron incluidos en el Para prevenir nuevas infecciones durante el estudio y la transmisión de Leishmania, se aplicaron collares impregnados de deltametrina en todos los perros.
Diseño experimental
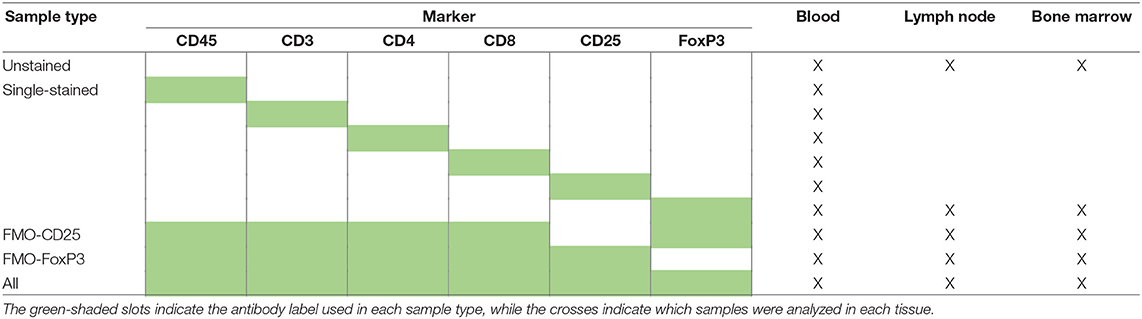
Para investigar el efecto de la infección por Leishmania y los tratamientos antileishmaniales en subconjuntos de células T auxiliares, citotóxicas y reguladoras, la sangre periférica, los ganglios linfáticos poplíto y las células mononucleares de la médula ósea se aislaron de perros enfermos (CanL) antes del inicio del tratamiento (M0) Estas células fueron inmunofenotipadas evaluando la expresión superficial de CD45, CD3, CD4, CD8 y CD25 y la expresión intracelular de FoxP3. Para reducir el número de animales utilizados en este estudio y garantizar cualquier preocupación ética por la incomodidad y el bienestar de los animales, la cantidad de recolección de muestras y su periodicidad se redujeron al mínimo. Además, se recogieron muestras de sangre periférica, ganglios linfáticos poplíteos y médula ósea de perros enfermos antes del inicio del tratamiento (M0) para establecer los niveles basales de las poblaciones celulares, evitando la necesidad de un grupo adicional de perros enfermos no tratados. También se recogieron muestras de sangre periférica, ganglio linfático poplíteo y médula ósea de perros clínicamente sanos [grupo de control (CG)]. El presente estudio siguió a la directiva 86/609/CEE del Consejo de la Unión Europea y fue aprobado por el Comité de Ética y Bienestar Animal de la Facultad de Medicina Veterinaria de la Universidad de Lisboa.
Aislamiento de células mononucleares de sangre periférica, ganglios linfáticos y médula ósea
Las células mononucleares de la sangre periférica se obtuvieron mediante centrifugación de gradiente de densidad (solución Histopaque®-1077, Sigma-Aldrich, Alemania). La sangre periférica de perro se resuspendió en PBS (1:1 v/v), se supermó con la mitad de ese volumen total en la solución de Histopaque®-1077 y se centrifugó 400 × g durante 30 minutos a 18 °C. Las células mononucleares de la sangre periférica se recogieron en la interfaz de PBS e Histopaque® y se lavan dos veces en PBS frío (300 × g, 10 min, 4°C). Siempre que los glóbulos rojos todavía eran visibles en la pala, se realizaba un paso de lisis añadiendo 5 ml de RBC Lysis Buffer (eBioscience, EE. UU.) durante 5 minutos y deteniendo la reacción con 10 ml de PBS, seguido de una centrifugación a 300 × g (4°C) durante 10 minutos. Luego, el pellet se resuspendió en Flow Cytometry Staining Buffer (FCSB) (eBioscience), y el volumen total se ajustó para 2 × 107 células ml−1. Los aspirados del ganglio linfático y la médula ósea se centrifugaron a 400 × g (4°C) durante 5 y 15 minutos, respectivamente, y se resuspenderon en FCSB con el volumen total también ajustado para 2 × 107 células ml-1. Estas muestras se mantuvieron en hielo hasta el etiquetado de anticuerpos.
Citometría de flujo
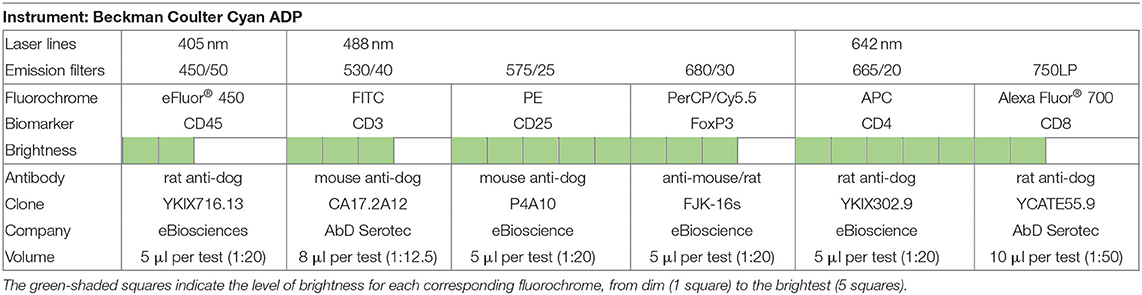
Para caracterizar las subpoblaciones de células T reguladoras y efectoras, se diseñó un panel multicolor para el análisis de citometría de flujo, y cada anticuerpo conjugado con fluorocromo se tituló para una tinción óptima (Tabla 1). Las suspensiones celulares (50 μl) se incubaron con los siguientes anticuerpos monoclonales (30 minutos a 4°C en la oscuridad): antiperro de rata CD45 (clon YKIX716.13, eBioscience Inc.), perro antivador de ratón CD3 (clonlón CA17.2A12, AbD Serotec, Reino Unido), anti (Tabla 2). Luego, las células se lavaron dos veces con 1 ml de FCSB y se centrifugaron a 400 × g (4°C) durante 5 minutos. Después, se añadió 1 ml de FoxP3/Transcription Factor Fixation/Permeabilization Working Solution (eBioscience Inc.), y las células se incubaron durante la noche a 4 °C en la oscuridad. A continuación, se añadieron 500 μl de 1 × Buffer de Permeabilización (eBioscience Inc.), y las células se centrifugaron a 400 × g (4°C) durante 5 minutos, seguidas de dos lavados a 400 × g (4°C) durante 5 minutos con 1 ml de 1× Permeabilization Buffer y un último paso Las células se resuspenderon en un total de 100 μl de FCSB e incubaron durante 15 minutos a 4 °C en la oscuridad. La tinción intracelular con anticuerpo monoclonal antiraíl FoxP3 (clón FJK-16s, eBioscience Inc.) se realizó incubando durante al menos 30 minutos (4°C) en la oscuridad, seguido de dos lavados con 1 × Buffer de permeabilidad a 400 × g (4 °C) durante 5 minutos. Para la adquisición de citometría de flujo (eparato CyAn ADP equipado con tres láseres, Beckman Coulter, utilizando el software Summit v4.3, Dako Colorado Inc.), las células se reuspendieron en un volumen final de 300 μl de FCSB. Para cada muestra, se adquirieron un mínimo de 20 000 eventos cerrados, y se realizó un análisis de datos utilizando FlowJo versión 10.0.7 (Tree Star, CA). Para definir la mejor estrategia de gating que se aplicará (Figura 2), se hizo una compensación con muestras sin teñir, de un solo teñido y de «fluorescencia menos uno» (FMO) (Tabla 2).
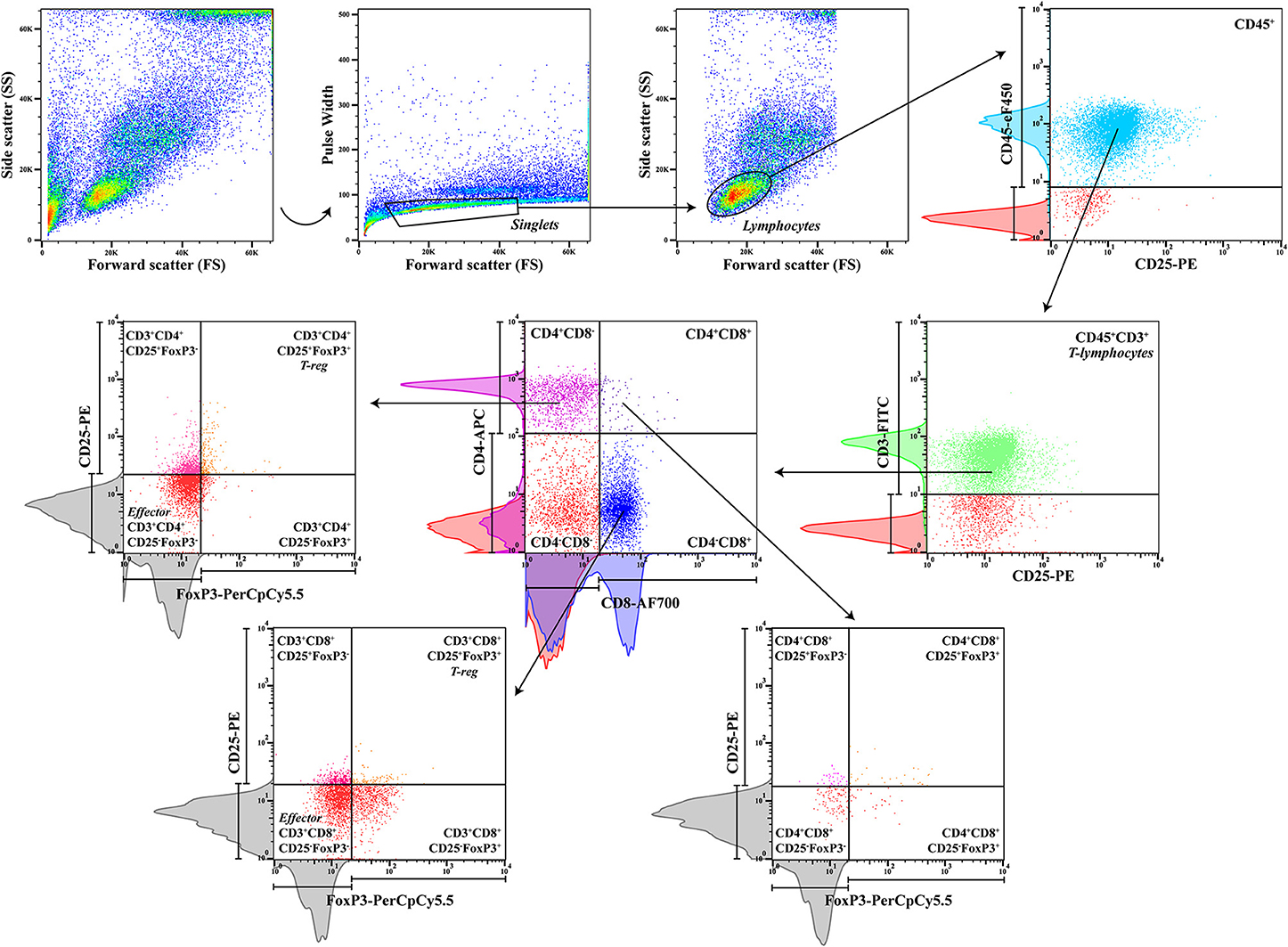 FIGURA 2. Estrategia de Gating. Estrategia de aconamiento secuencial de sangre periférica para un panel de seis anticuerpos para identificar las diferentes subpoblaciones celulares después de la exclusión del doblete. CD45, un marcador pan-leucocito, y CD3, un marcador específico de linfocitos T, se utilizaron para definir la población de linfocitos T, con separación posterior de células CD4+ y CD8+, células T de doble positivo CD4+CD8+ y las células reguladoras CD25+FoxP3+ y CD25-FoxP Se utilizaron histogramas rojos de muestras de control sin teñir y histogramas de colores de muestras de control de un solo teñido para definir el gating secuencial, junto con histogramas grises de controles de fluorescencia menos uno (FMO) para puertas para células raras (CD25+FoxP3+).
FIGURA 2. Estrategia de Gating. Estrategia de aconamiento secuencial de sangre periférica para un panel de seis anticuerpos para identificar las diferentes subpoblaciones celulares después de la exclusión del doblete. CD45, un marcador pan-leucocito, y CD3, un marcador específico de linfocitos T, se utilizaron para definir la población de linfocitos T, con separación posterior de células CD4+ y CD8+, células T de doble positivo CD4+CD8+ y las células reguladoras CD25+FoxP3+ y CD25-FoxP Se utilizaron histogramas rojos de muestras de control sin teñir y histogramas de colores de muestras de control de un solo teñido para definir el gating secuencial, junto con histogramas grises de controles de fluorescencia menos uno (FMO) para puertas para células raras (CD25+FoxP3+).
Un estudio reciente (67) mostró pruebas relevantes de que la discriminación por duplicación que generalmente se realiza en el análisis de citometría de flujo, con el razonamiento de que constituyen artefactos experimentales, puede ocultar el contacto celular a célula, en particular, la asociación célula T-monocito que no se interrumpe durante el procesamiento de la muestra. Por lo tanto, en el estudio actual, se utilizó un enfoque simple para comparar la frecuencia de duplicas en perros sanos, enfermos y tratados siguiendo la estrategia de gating que se muestra en la Figura 3A.
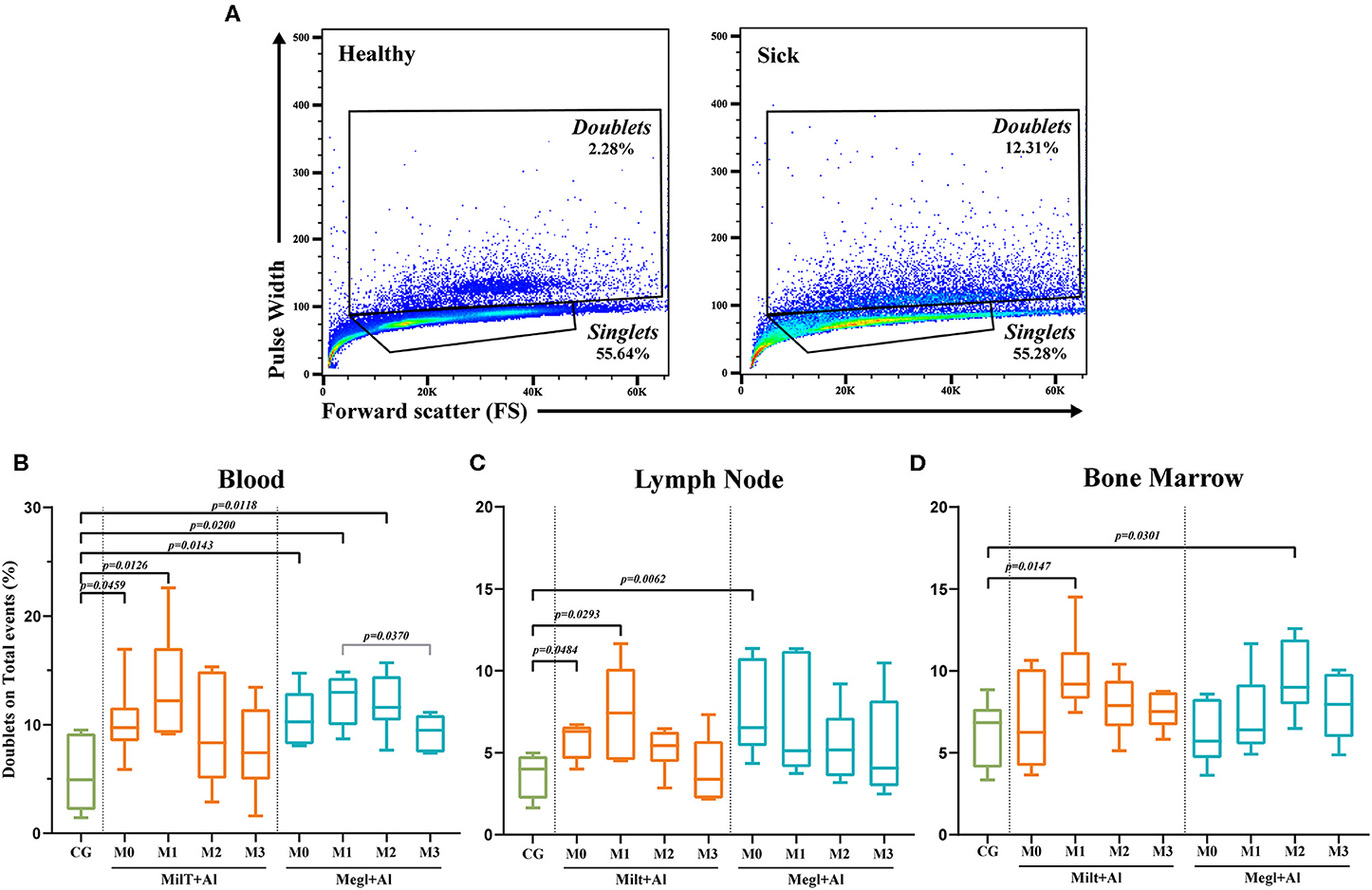 FIGURA 3. Análisis de doblete. (A) Ejemplo de estrategia de Gating en la sangre de un [grupo de control (CG)] sano y un perro enfermo (M0). Porcentaje de duplicados cerrados en los eventos totales para la sangre (B), los ganglios linfáticos (C) y la médula ósea (D) antes y después del inicio del tratamiento. Los resultados de 22 perros están representados por parcelas de caja y bigote y valores medios, mínimos y máximos. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en las filas) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamiento y el grupo de control (CG). La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. Los valores p se indican en cada comparación estadísticamente significativa.
FIGURA 3. Análisis de doblete. (A) Ejemplo de estrategia de Gating en la sangre de un [grupo de control (CG)] sano y un perro enfermo (M0). Porcentaje de duplicados cerrados en los eventos totales para la sangre (B), los ganglios linfáticos (C) y la médula ósea (D) antes y después del inicio del tratamiento. Los resultados de 22 perros están representados por parcelas de caja y bigote y valores medios, mínimos y máximos. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en las filas) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamiento y el grupo de control (CG). La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. Los valores p se indican en cada comparación estadísticamente significativa.
Análisis estadístico
El análisis estadístico entre los grupos de control, infectados y tratados se realizó utilizando el paquete de software GraphPad Prism (versión 8.0.1, GraphPad Software Inc.). La prueba Kolmogorov-Smirnoff se utilizó para evaluar la normalidad de los datos. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en las filas) con la prueba post hoc de Dunn se utilizó para evaluar las diferencias en los niveles de subconjuntos celulares entre los grupos enfermos, tratados y de control. Por último, se utilizó la prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey para comparar perros entre los varios meses M0, M1, M2 y M3.
Resultados
La leishmaniosis canina promueve una alta frecuencia de duplicaciones celulares que alcanzan valores saludables durante el tratamiento
Se observó un aumento significativo de los eventos en la puerta de los dobles tanto en la sangre (pMilt+Al = 0,0459; pMegl+Al = 0,0143) (Figura 3B) como en el ganglio linfático (pMilt+Al = 0,0484; pMegl+Al = 0,0062) (Figura 3C) en perros enfermos (M0) en Un mes después del tratamiento con Milt+Al (M1), la sangre (p = 0,0126), el ganglio linfático (p = 0,023N) y la médula ósea (p = 0,0147) presentaron una frecuencia significativamente alta de duplicantes. Aunque, durante el tratamiento, los duplicantes vuelven a frecuencias cercanas a las del grupo de control. En los perros tratados con Megl+Al, la sangre periférica exhibió porcentajes significativamente altos de duplicantes en el primer (pM1 = 0,02) y segundo (pM2 = 0,0118) meses de tratamiento. Por otro lado, la médula ósea presentó solo un aumento transitorio de dobles 2 meses (pM2 = 0,0301) después del inicio del tratamiento (Figura 3D).
La quimioterapia con leishmaniosis canina causa un desequilibrio en la población de linfocitos T
La sangre periférica (Figura 4A) y los ganglios linfáticos (Figura 4B) de perros con leishmaniosis activa (M0) presentaron niveles de linfocitos T (CD45+CD3+) similares a los de los perros clínicamente sanos. Sin embargo, la administración posterior de cualquiera de los tratamientos dio lugar a una reducción de la frecuencia de los linfocitos. Los perros bajo terapia con Megl+Al mostraron una reducción significativa del porcentaje de población de células T en la sangre (células CD45+CD3+) después de 2 (pM2 = 0,0239) y 3 (pM3 = 0,0046) meses de tratamiento. Sin embargo, en el ganglio linfático, se observó una reducción significativa de la frecuencia de la población de células T a los meses de 1 (pM1 = 0,0319) y 2 (pM2 = 0,0328) meses con esta terapia. Además, la frecuencia de las células T de la médula ósea (Figura 4C) aumentó significativamente después del primer mes de tratamiento con Megl+Al (pM1 = 0,0399), alcanzando valores similares a los perros clínicamente sanos en el segundo mes (M2). Un mes después del inicio del tratamiento con Milt+Al, se observó una reducción transitoria de las células T de los ganglios linfáticos (pM1 = 0,0467). La médula ósea, a su vez, mostró una frecuencia transitoria más alta de células T (pM2 = 0,0459) 2 meses después del tratamiento, recuperándose a niveles idénticos a los de los perros de control en el tercer mes (M3).
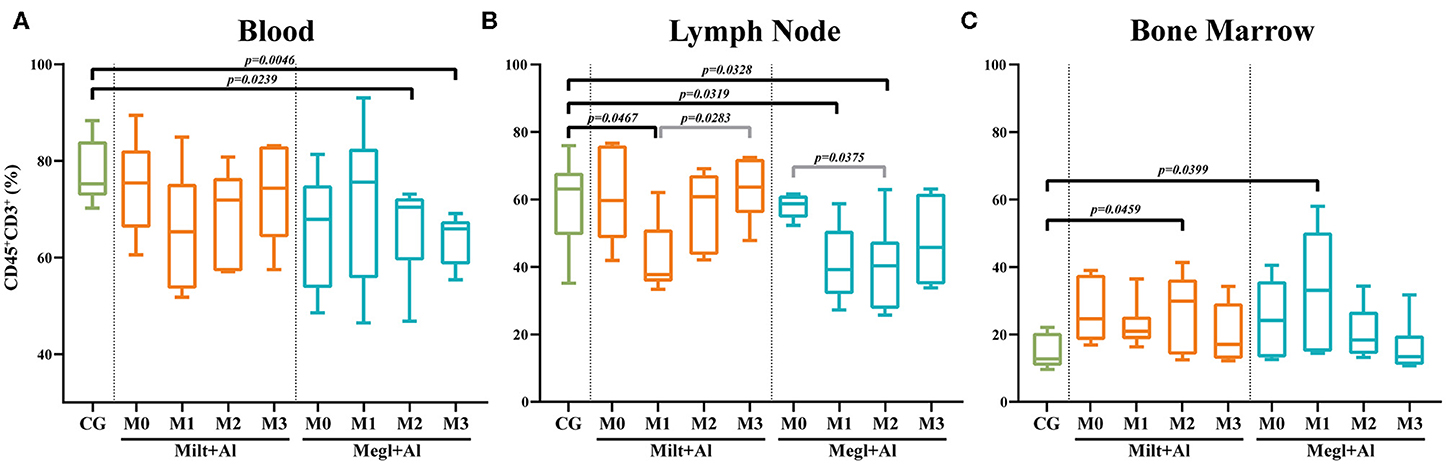 FIGURA 4. Frecuencia de linfocitos (CD45+CD3+) en la sangre (A), EL ganglio linfático (B) y la médula ósea (C) de los perros sanos [grupo de control (CG)], enfermos (M0) y tratados (M1, M2 y M3). Los resultados de 22 perros están representados por parcelas de caja y bigote y valores medios, mínimos y máximos. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en rangos) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamiento y el CG. La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. Los valores p se indican en cada comparación estadísticamente significativa.
FIGURA 4. Frecuencia de linfocitos (CD45+CD3+) en la sangre (A), EL ganglio linfático (B) y la médula ósea (C) de los perros sanos [grupo de control (CG)], enfermos (M0) y tratados (M1, M2 y M3). Los resultados de 22 perros están representados por parcelas de caja y bigote y valores medios, mínimos y máximos. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en rangos) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamiento y el CG. La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. Los valores p se indican en cada comparación estadísticamente significativa.
La terapia anti-leishmanial favorece el predominio de las células T CD4+ sobre las células T CD8+
Según varios autores, la relación de células T CD4+/CD8+ adquirida mediante el análisis de citometría de flujo puede considerarse una forma simple y rápida de evaluar la respuesta inmune mediada por células (65, 68). En comparación con los perros sanos, las células de sangre (pM0 = 0,0177) (Figura 5A) y ganglios linfáticos (pM0 = 0,0246) (Figura 5B) de perros enfermos presentaron una disminución significativa de la relación CD4/CD8 a valores cercanos a 1, lo que apunta a frecuencias similares de las células T CD8+ y CD Durante el tratamiento, esta proporción progresó hacia valores más cercanos a 2, lo que indica el predominio de las células T CD4+. Por otro lado, la relación de células T de la médula ósea CD4+/CD8+ (Figura 5C) de los perros enfermos fue similar a la de los perros sanos, con proporciones que oscilaban entre 0,5 y 1. Estos valores apuntan a una variación entre un ligero predominio de las células T CD8+ y una frecuencia idéntica de ambos subconjuntos de células T.
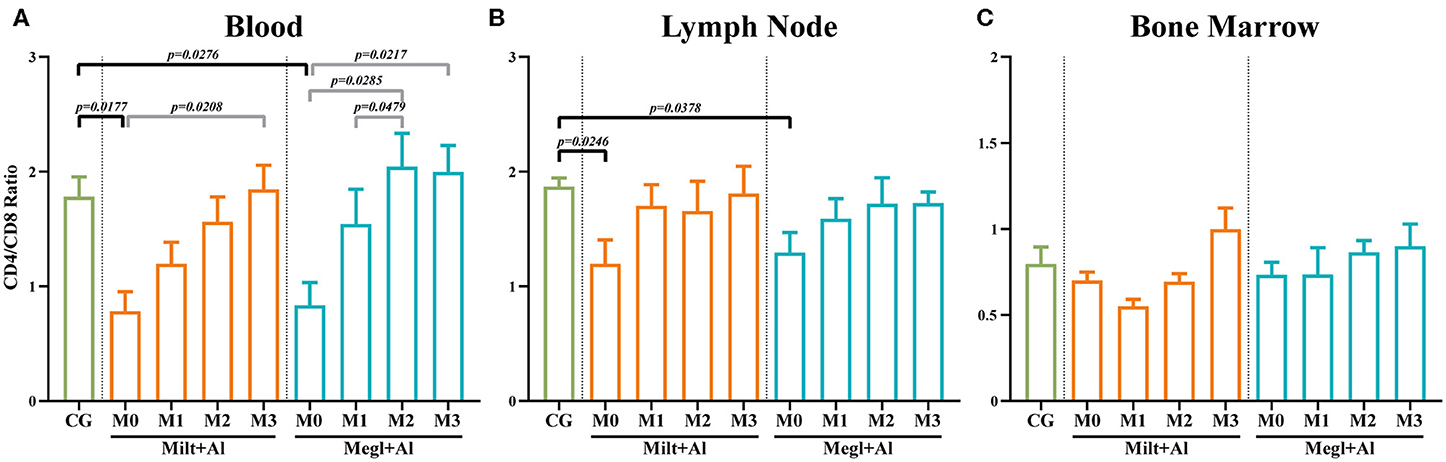 FIGURA 5. Relación CD4/CD8 en la sangre (A), el ganglio linfático (B) y la médula ósea (C) de los perros sanos [grupo de control (CG)], enfermos (M0) y tratados (M1, M2 y M3). Los resultados de 22 perros están representados por valores medios ± SEM. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en rangos) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamiento y el CG. La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. Los valores p se indican en cada comparación estadísticamente significativa.
FIGURA 5. Relación CD4/CD8 en la sangre (A), el ganglio linfático (B) y la médula ósea (C) de los perros sanos [grupo de control (CG)], enfermos (M0) y tratados (M1, M2 y M3). Los resultados de 22 perros están representados por valores medios ± SEM. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en rangos) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamiento y el CG. La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. Los valores p se indican en cada comparación estadísticamente significativa.
La leishmaniosis canina aumenta la frecuencia de células T doble positiva CD4+CD8+ en la sangre periférica, los ganglios linfáticos y la médula ósea
Los perros enfermos (M0) mostraron un aumento de las frecuencias de las células T CD4+CD8+ dp en la sangre (Figura 6A) (pMilt+Al = 0,0182;pMegl+Al = 0,0015), el ganglio linfático (Figura 6B) (pMilt+Al = 0,0234; pMegl+Al = La administración de cualquiera de los protocolos de tratamiento dio lugar a un mantenimiento de estas altas frecuencias de células T CD4+CD8+ dp en todos los tejidos durante el primer mes de tratamiento (M1), normalizándose progresivamente al mes siguiente (M2), con la excepción de los ganglios linfáticos de los perros tratados con el protocolo Megl+Al que se recuperar
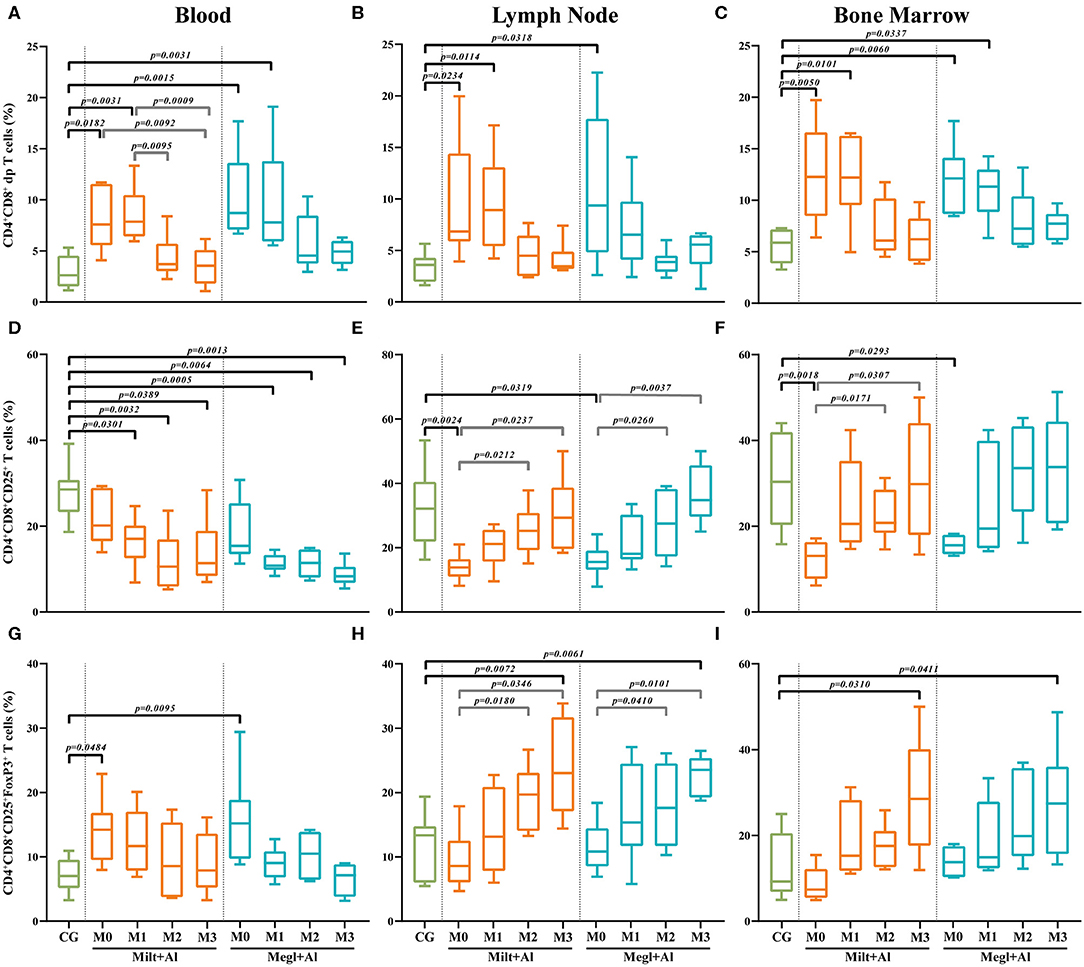 FIGURA 6. Frecuencia de las células T de doble positivo (dp) CD4+CD8+. La frecuencia de las células T dp (A-C) que expresan CD25 (D-F) y CD25 y FoxP3 (G-I) se evaluó en la sangre periférica (A,D,G), el ganglio linfático (B,E,H) y la médula ósea (C,F,I) de los perros sanos [grupo de Los resultados de 22 perros están representados por parcelas de caja y bigote y valores medios, mínimos y máximos. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en rangos) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamiento y el CG. La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. Los valores p se indican en cada comparación estadísticamente significativa.
FIGURA 6. Frecuencia de las células T de doble positivo (dp) CD4+CD8+. La frecuencia de las células T dp (A-C) que expresan CD25 (D-F) y CD25 y FoxP3 (G-I) se evaluó en la sangre periférica (A,D,G), el ganglio linfático (B,E,H) y la médula ósea (C,F,I) de los perros sanos [grupo de Los resultados de 22 perros están representados por parcelas de caja y bigote y valores medios, mínimos y máximos. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en rangos) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamiento y el CG. La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. Los valores p se indican en cada comparación estadísticamente significativa.
CD4+CD8+ Células T doble positivas que expresan una disminución del fenotipo regulatorio en la sangre periférica de los perros enfermos y el aumento del ganglio linfático y la médula ósea después del tratamiento
El ganglio linfático (Figura 6E) y la médula ósea (Figura 6F) de los perros enfermos mostraron una reducción significativa de la frecuencia de las células T dp que expresaban moléculas CD25 (ndulo linfático: pMilt+Al = 0,0024; pMegl+Al = 0,03/m médula ósea: pMilt+Al = 0,0018 Sin embargo, en la sangre periférica, el tratamiento causó una disminución significativa de este subconjunto de células T (Figura 6D).
A su vez, el porcentaje de células T CD25+FoxP3+ dp en la sangre de los perros enfermos (Figura 6G) fue mayor que en los perros sanos (pMilt+Al = 0,0484; pMegl+Al = 0,0095), mientras que era similar al grupo de control en el ganglio linfático (Figura 6H) y la médula Los perros tratados presentaron una normalización de las frecuencias en la sangre después de 1 mes de tratamiento, mientras mostraban un aumento progresivo en esta subpoblación, alcanzando frecuencias más altas que el grupo de control, en el ganglio linfático (pMilt+Al = 0,0072; pMegl+Al = 0,0061) y en la médula ósea (pMilt+
La infección por Leishmania resulta en el aumento de las frecuencias de células T CD8+ en sangre con el fenotipo CD25+FoxP3+
La sangre de perros enfermos (M0) mostró una disminución significativa en la frecuencia del subconjunto de células T CD4+ (pMilt+Al = 0,0253; pMegl+Al = 0,0467) (Figura 7A) junto con una alta frecuencia del subconjunto de células T CD8+ (pMilt+Al = 0,0018; pMegl+Al Ambos tratamientos pudieron recuperar la normalidad de las fracciones de células T CD4+ y CD8+. Sin embargo, los perros bajo el protocolo Megl+Al se recuperaron a valores similares a los de los perros clínicamente sanos durante el primer mes de tratamiento (M1), más rápido que el grupo tratado con Milt+Al que solo se recuperó después del segundo mes (M2).
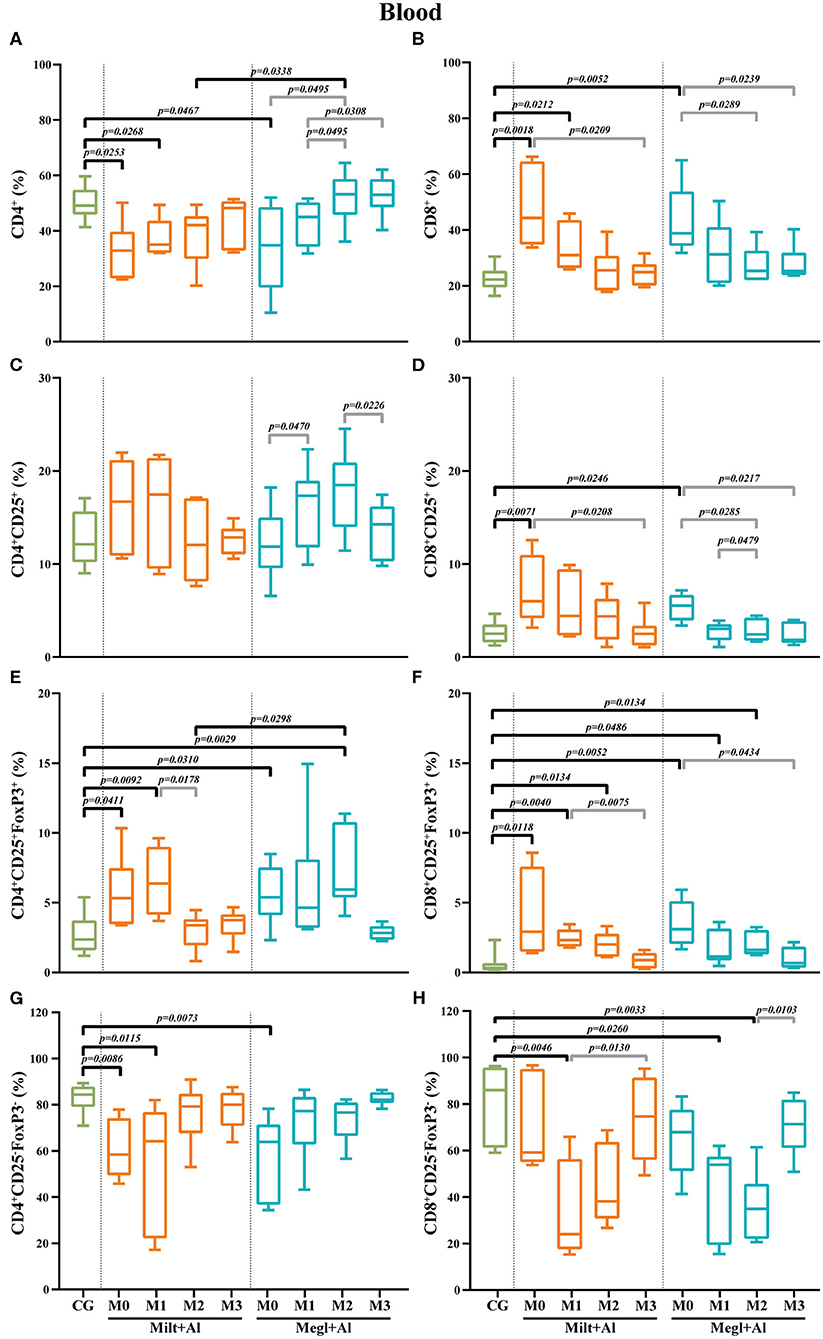 FIGURA 7. Frecuencia de los linfocitos T CD4+ (A), CD8+ (B), reguladores (CD25+FoxP3+) (C-F) y efectores (CD4+CD25−FoxP3−/CD8+CD25−FoxP3−) (G,H) T en la sangre de perros Los resultados de 22 perros están representados por parcelas de caja y bigote y valores medios, mínimos y máximos. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en rangos) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamiento y el CG. La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. Los valores p se indican en cada comparación estadísticamente significativa.
FIGURA 7. Frecuencia de los linfocitos T CD4+ (A), CD8+ (B), reguladores (CD25+FoxP3+) (C-F) y efectores (CD4+CD25−FoxP3−/CD8+CD25−FoxP3−) (G,H) T en la sangre de perros Los resultados de 22 perros están representados por parcelas de caja y bigote y valores medios, mínimos y máximos. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en rangos) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamiento y el CG. La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. Los valores p se indican en cada comparación estadísticamente significativa.
La frecuencia de las células T sanguíneas con fenotipo CD4+CD25+ mostró cierta fluctuación, principalmente durante el tratamiento con Megl+Al (Figura 7C), aunque sin diferencias estadísticas en comparación con perros clínicamente sanos. Sin embargo, se observó un aumento significativo en la frecuencia del subconjunto de células T CD8+CD25+ (pMilt+Al = 0,0071; pMegl+Al = 0,0246) en perros enfermos (M0) en comparación con el del grupo de control (Figura 7D). Este subconjunto celular volvió a los valores normales inmediatamente después del inicio de ambos tratamientos (M1).
CD4+CD25+FoxP3+ (pMilt+Al = 0,0411; pMegl+Al = 0,0310) y CD8+CD25+FoxP3+ (pMilt+Al = 0,0118; pMegl+Al = 0,0052) Los subconjuntos de células T de perros enfermos (M0) presentaron frecuencias más altas que lasDespués de la administración de ambos tratamientos, se observó un aumento en la frecuencia del subconjunto de células T CD4+CD25+FoxP3+ (pMilt+Al(M1) = 0,0092; pMegl+Al(M2) = 0,0029), con los valores volviendo a los niveles saludables en M2 y M3, para los grupos Milt+Al y Del mismo modo, el subconjunto de células T CD8+CD25+FoxP3+ se recuperó a valores comparables a los de los perros de control después de 3 meses para ambos protocolos de tratamiento.
Los subconjuntos de células T efectoras de perros enfermos (M0) presentaron diferentes patrones. Las células T CD4+CD25−FoxP3− fueron significativamente más bajas que las del grupo de control (pMilt+Al = 0,0086; pMegl+Al = 0,0073). Sin embargo, los perros recuperaron valores saludables 1 mes después del inicio del tratamiento con Megl+Al (M1) y después de 2 meses de terapia con Milt+Al (M2) (Figura 7G). Por otro lado, las células T CD8+CD25-FoxP3− de los perros enfermos eran similares a las de los perros sanos, pero los tratamientos posteriores llevaron a una reducción significativa de la frecuencia celular (pMilt+Al(M1) = 0,0046; pMegl+Al(M1) = 0,026), con el grupo Megl+Al recuperándose
La leishmaniosis canina promueve el aumento de las frecuencias de las células T del ganglio linfático CD8+, y el tratamiento conduce a un desequilibrio de los subconjuntos de células T efectoras y reguladoras
En el ganglio linfático de los perros enfermos, la frecuencia de las células T CD4+ fue similar a la de los perros sanos (Figura 8A), pero la fracción de células T CD8+ presentó un porcentaje más alto (pMilt+Al = 0,0052; pMegl+Al = 0,0120) (Figura 8B). Además, la administración del tratamiento causó una reducción de las frecuencias de las células T CD8+ a valores similares a los de los perros de control. Tres meses después del inicio del tratamiento con Megl+Al, la fracción de células T de CD4+ disminuyó significativamente (p = 0,0389) en comparación con perros clínicamente sanos.
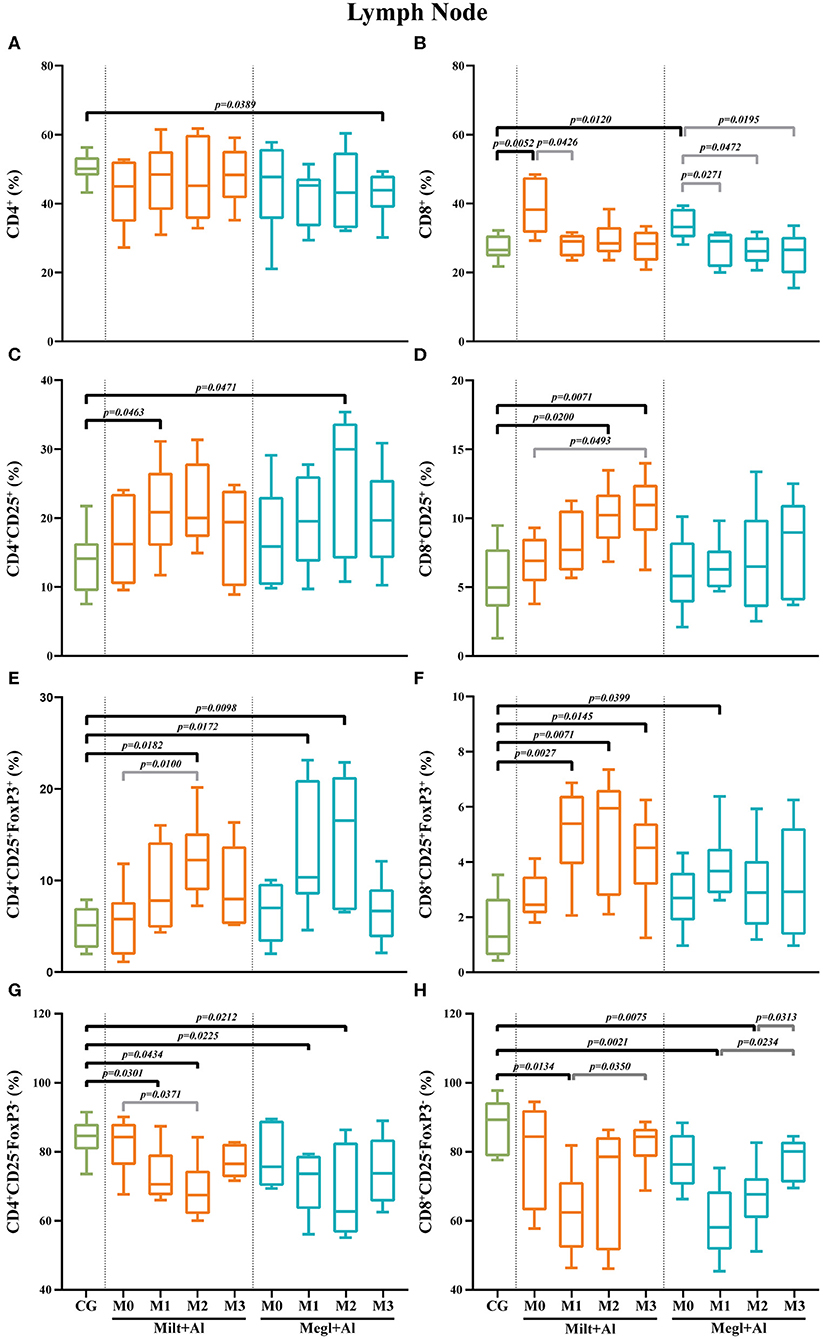 FIGURA 8. Frecuencia de los linfocitos T CD4+ (A), CD8+ (B), reguladores (CD25+FoxP3+) (C-F) y efectores (CD4+CD25−FoxP3−/CD8+CD25−FoxP3−) (G,H) en el ganglio linf Los resultados de 22 perros están representados por parcelas de caja y bigote y valores medios, mínimos y máximos. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en rangos) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamiento y el CG. La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. Los valores p se indican en cada comparación estadísticamente significativa.
FIGURA 8. Frecuencia de los linfocitos T CD4+ (A), CD8+ (B), reguladores (CD25+FoxP3+) (C-F) y efectores (CD4+CD25−FoxP3−/CD8+CD25−FoxP3−) (G,H) en el ganglio linf Los resultados de 22 perros están representados por parcelas de caja y bigote y valores medios, mínimos y máximos. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en rangos) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamiento y el CG. La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. Los valores p se indican en cada comparación estadísticamente significativa.
En perros enfermos, el nivel de células T CD4+ (Figura 8C) y CD8+ (Figura 8D) con fenotipo CD25+ fue similar al de los perros sanos. Sin embargo, ambos protocolos de tratamiento llevaron a un aumento transitorio de las frecuencias del subconjunto de células T CD4+CD25+ después de 1 mes de tratamiento con Milt+Al (p = 0,0463) y 2 meses de Megl+Al (p = 0,0471). La subpoblación de células T CD8+CD25+ de perros bajo el protocolo Milt+Al mostró un aumento significativo de 2 (p = 0,020).o) y 3 (p = 0,0071) meses después del inicio del tratamiento (Figura 8D).
Del mismo modo, los perros enfermos mostraron frecuencias similares de células T CD4+CD25+FoxP3+ y CD8+CD25+FoxP3+ en comparación con los perros sanos. Además, después del tratamiento, estos perros mostraron un aumento significativo en la frecuencia del subconjunto de células T CD4+CD25+FoxP3+ (Figura 8E). En perros tratados con Milt+Al, se observó un pico de frecuencia de células de CD4+ Treg 2 meses (pM2 = 0,0182) después del inicio del tratamiento. Uno y 2 meses después de la administración, Megl+Al también promovió un aumento de frecuencia de CD4+ Treg (pM1 = 0,0172; pM2 = 0,0098) que posteriormente volvió a los valores normales. Además, Milt+Al causó un aumento significativo en la frecuencia de células T CD8+CD25+FoxP3+ (pM1 = 0,0027; pM2 = 0,0071; pM3 = 0,0145), mientras que el protocolo Megl+Al solo resultó en un aumento transitorio de esta subpoblación 1 mes después del tratamiento (pM1 = 0,0399
Los subconjuntos de células T efectoras en el ganglio linfático de los perros enfermos eran similares a los de los perros sanos. Después de la administración del tratamiento, las frecuencias de células T CD4+CD25-FoxP3− mostraron una reducción progresiva durante el primer y segundo mes con el Milt+Al (pM1 = 0,0301; pM2 = 0,0434) y el protocolo Megl+Al (pM1 = 0,0225; pM2 = 0,02212) (Figura Las frecuencias de las células T CD8+CD25−FoxP3− también presentaron una reducción significativa después de la administración del medicamento (pMilt+Al = 0,0134; pMegl+Al = 0,0021), con los perros tratados con Milt+Al recuperando los niveles de frecuencia celular en el segundo mes (M2) y los perros tratados con Megl
La infección por Leishmania causa el aumento de las frecuencias de las células T de la médula ósea CD8+ con el fenotipo CD25+FoxP3+
En la médula ósea de los perros enfermos, la frecuencia de las células T CD4+ (Figura 9A) fue similar a la de los perros clínicamente sanos. La administración de Milt+Al no causó alteraciones significativas en la fracción de células T CD4+, mientras que los perros bajo el protocolo Megl+Al mostraron un aumento transitorio de la frecuencia (p = 0,0134) 2 meses después del inicio del tratamiento. Mientras tanto, se observó un aumento prominente de la frecuencia de las células T CD8+ en perros enfermos (pMilt+Al = 0,0293; pMegl+Al = 0,0495) (Figura 9B). Esta alta frecuencia de células T CD8+ en la médula ósea persistió durante ambos tratamientos (Milt+Al: pM1 = 0,0367; pM2 = 0,0310) (Megl+Al: pM1 = 0,0463; pM2 = 0,0411), volviendo a valores similares a los perros de control para el tercer mes (M3).
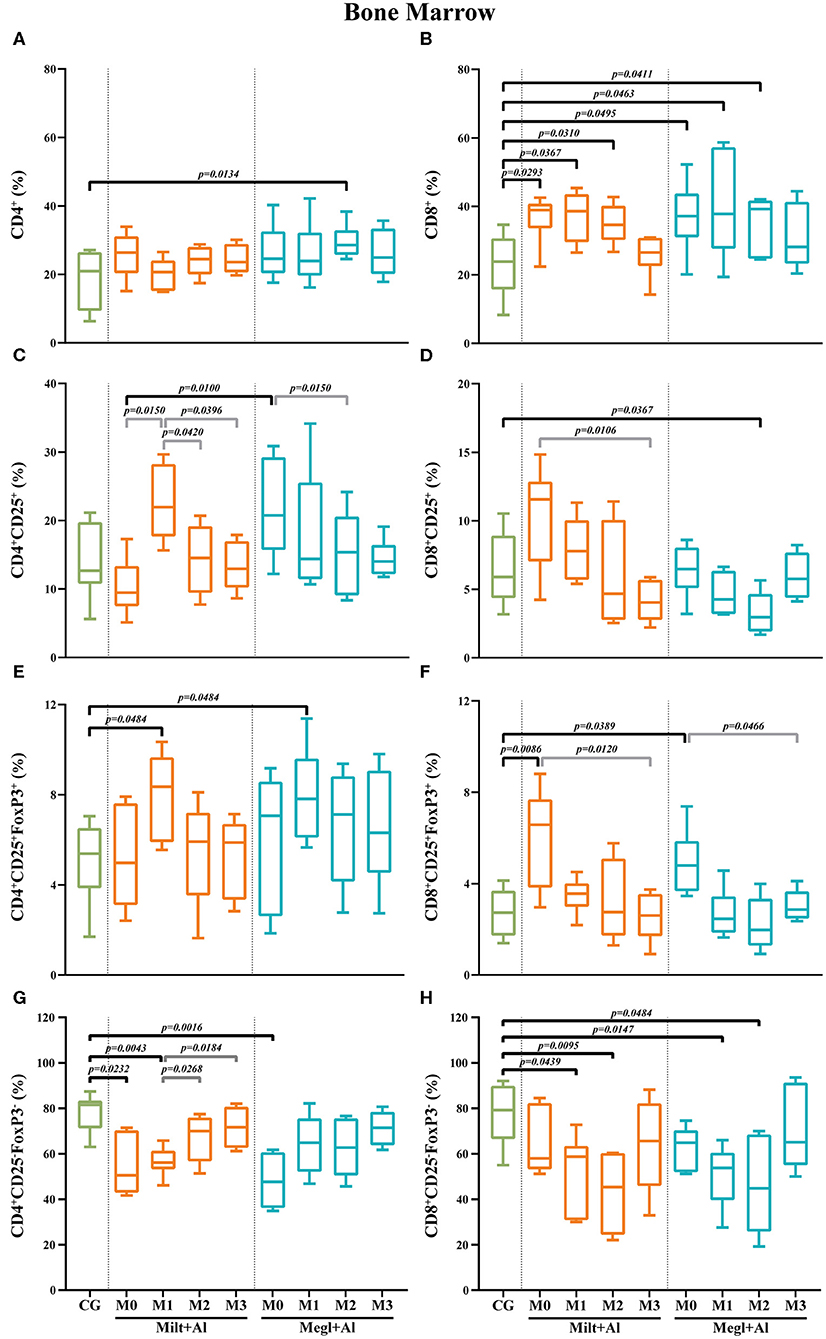 FIGURA 9. Frecuencia de los linfocitos T CD4+ (A), CD8+ (B), regulatorios (CD25+FoxP3+) (C-F) y efectores (CD4+CD25−FoxP3−/CD8+CD25−FoxP3−) (G,H) T en la médula ósea Los resultados de 22 perros están representados por parcelas de caja y bigote y valores medios, mínimos y máximos. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en rangos) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamiento y el CG. La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. Los valores p se indican en cada comparación estadísticamente significativa.
FIGURA 9. Frecuencia de los linfocitos T CD4+ (A), CD8+ (B), regulatorios (CD25+FoxP3+) (C-F) y efectores (CD4+CD25−FoxP3−/CD8+CD25−FoxP3−) (G,H) T en la médula ósea Los resultados de 22 perros están representados por parcelas de caja y bigote y valores medios, mínimos y máximos. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en rangos) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamiento y el CG. La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. Los valores p se indican en cada comparación estadísticamente significativa.
Con respecto a la subpoblación de células T CD4+CD25+ (Figura 9C), no se observaron diferencias considerables en la médula ósea de los perros enfermos en comparación con la de los perros clínicamente sanos. Además, los perros tratados con Megl+Al evidenciaron una disminución transitoria de la frecuencia de las células T CD8+CD25+ para el mes 2 (pM2 = 0,0367) que se recuperaron rápidamente (Figura 9D).
En la médula ósea de los perros enfermos, la frecuencia de las células Treg (CD4+CD25+FoxP3+) fue similar a la de los perros de control (Figura 9E). Sin embargo, se observó un aumento de la frecuencia de este subconjunto celular 1 mes (pMilt+Al = 0,0484; pMegl+Al = 0,0484) después de cualquiera de los tratamientos, seguido de la normalización. Al igual que la sangre periférica, las frecuencias de subconjunto de células T CD8+CD25+FoxP3+ (Figura 9F) de los perros enfermos fueron significativamente más altas (pMilt+Al = 0,0086;pMegl+Al = 0,0389). Ambos tratamientos llevaron a una reducción de las frecuencias celulares a valores similares a los del grupo de control.
Las frecuencias de células T de los perros enfermos de CD4+CD25−FoxP3− fueron significativamente más bajas en comparación con las de los perros sanos (pMilt+Al = 0,0232; pMegl+Al = 0,0016) (Figura 9G). Sin embargo, el grupo Megl+Al se recuperó a valores cercanos a los de los perros sanos 1 mes antes que el grupo Milt+Al. Las frecuencias de las células T CD8+CD25-FoxP3− de los perros enfermos, por otro lado, fueron similares a las de los perros sanos, con la administración de cualquiera de los tratamientos que condujo a una disminución significativa 1 (pMilt+Al = 0,0439; pMegl+Al = 0,0147) y 2 meses (pMilt+
Discusión
El tratamiento con canL tiene una conexión inherente con la capacidad del sistema inmunitario del perro para desarrollar una respuesta inmune celular competente contra la L. infantum. Por lo tanto, comprender la respuesta inmune celular y la dinámica de los subconjuntos de células T en perros infectados naturalmente con Leishmania, especialmente en órganos que generalmente albergan estos parásitos, es de suma importancia no solo para el tratamiento y el manejo de la enfermedad de CanL, sino también como pautas para el desarrollo de herramientas profilácticas y terapéuticas. Un mejor conocimiento del efecto de la terapia antileishmanial en la respuesta inmune celular de los perros puede facilitar el desarrollo de estrategias para reducir la transmisión del parásito y, en consecuencia, conducir a una disminución en la incidencia de la leishmaniosis visceral zoonótica. Por lo tanto, en el estudio actual, las subpoblaciones de células T de perros infectados naturalmente con L. infantum se caracterizaron fenotípicamente antes del tratamiento y durante la influencia de los medicamentos antileishmaniales.
En el estudio actual, se encontró que los perros enfermos han aumentado las frecuencias de doblete en la sangre periférica y los ganglios linfáticos, disminuyendo a valores similares a los de los perros clínicamente sanos después del tratamiento. Como fue propuesto por Burel et al. (67), estos cambios en los niveles de duplicación asociados con CanL y durante los primeros meses de tratamiento pueden reflejar una posible interacción célula a célula entre los linfocitos T y las células que presentan antígenos. También es posible que los duplicados puedan aumentar como resultado de la interacción de Treg: linfocitos, ya que las células Treg, que parecen aumentar en CanL, parecen ejercer supresión inmune por mecanismos dependientes del contacto celular (69). En el presente trabajo, no fue posible profundizar en estas interacciones, ya que este era un objetivo secundario del estudio. En este sentido, no se recopilaron suficientes eventos en la región del dobleto para obtener información significativa sobre más subpoblaciones. De esta manera, se necesitan más estudios detallados para corroborar esta hipótesis, con la correlación entre la CanL y el nivel de duplicantes que se pueden utilizar como un posible marcador de la enfermedad para monitorear el éxito del tratamiento y predecir posibles recaídas (67).
Varios autores han correlacionado perros sintomáticos con niveles disminuidos de células T CD4+ y proporciones CD4/CD8 en la sangre periférica (35, 70), junto con altos títulos de anticuerpos. Otros autores verificaron que una mayor infectividad de las moscas de arena por parte de los perros infectados naturalmente se asoció con proporciones más bajas de células T CD4+ en la sangre (37). Además, también se ha demostrado que la administración a perros infectados con Leishmania de medicamentos antileishmaniales, como la anfotericina B y el antimoniato de meglumina, promovió el aumento del porcentaje y el recuento absoluto de células CD4+ T en la sangre, respectivamente (36, 71). Por otro lado, otros protocolos de tratamiento, como el alopurinol en monoterapia, aunque capaces de mejorar el número de células T CD4+ circulantes en la sangre, no pudieron restaurar los valores a aquellos dentro del rango normal (68). Por lo tanto, los hallazgos obtenidos en el estudio actual están en línea con los informes anteriores. Los perros enfermos presentaron bajas proporciones de CD4/CD8 en la sangre periférica y el ganglio linfático, recuperándose a valores iguales al grupo sano después de la administración de ambos tratamientos. Siguiendo nuestros resultados, y según varios autores (36–38, 68, 71), la relación CD4/CD8 puede ser un indicador útil de la condición inmunológica de los perros enfermos y una posible herramienta con valor pronóstico. Algunos autores también describen una disminución del porcentaje de linfocitos CD3+ en la sangre periférica de los perros sintomáticos de CanL, como consecuencia directa de la reducción de la frecuencia de las células T CD4+ (36, 56). Otros autores, por el contrario, han informado de un aumento significativo de las células T CD3+ en perros enfermos, especialmente en perros gravemente afectados (72). Sin embargo, la administración de terapia antileishmanial en ambas situaciones restableció los linfocitos CD3+ dentro de los valores normales (36, 56, 72). Además, los resultados del presente estudio apuntan a un doble efecto de la terapia antileishmanial en la médula ósea y los ganglios linfáticos. Ambos tratamientos llevaron a una reducción en la frecuencia de las células T de los ganglios linfáticos (CD45+CD3+) junto con un aumento de la médula ósea. Curiosamente, solo el antimoniato de meglumina en combinación con alopurinol dio lugar a una disminución de la frecuencia de las células T de la sangre.
La inmunidad protectora contra la canl generalmente se considera que depende de una respuesta inmune Th1 (6). El predominio de las células T CD4+ productoras de IFN-γ es crucial para la activación de macrófagos con el fin de matar a la leishmania internalizada a través de la producción de NO y ROS (73, 74). Una reducción de la población de células T CD4+ generalmente se asocia con la incapacidad de controlar la infección, lo que permite la supervivencia y la replicación de los parásitos de Leishmania en los macrófagos, lo que posteriormente puede conducir a un aumento de la infectibilidad de las moscas de arena (37). Los estudios murinos han demostrado que los parásitos de Leishmania interfieren negativamente con la capacidad del IFN-γ para inducir la expresión del ARNm MHC-II, lo que lleva a macrófagos parasitados con una baja expresión de moléculas de clase II de MHC (75). Por lo tanto, debido a su reducida capacidad como células que presentan antígenos, estos macrófagos no pueden proporcionar señales coestimuladoras a las células T CD4+ (76, 77), que, a su vez, no se estimulan, no proliferan y no producen IFN-γ. Aunque todavía se debate el papel completo de las células T CD8+ en la CanL, hay estudios de leishmaniosis en humanos y ratones que muestran una dualidad funcional. Las células T CD8+ pueden desempeñar un papel protector al liberar IFN-γ, o pueden ser patógenas para el huésped, causando una inflamación excesiva en el lugar de la infección (73) como resultado de la actividad citotóxica, que puede exacerbar la progresión de la enfermedad (78). Siguiendo los resultados de informes anteriores (35, 36, 79), los perros enfermos incluidos en el estudio actual también mostraron un aumento de la frecuencia de células T CD8+ en la sangre, los ganglios linfáticos y la médula ósea, junto con una disminución significativa de los niveles de células T CD4+ en la sangre. Estos hallazgos sugieren que las células T CD8+ están a la vanguardia de la lucha contra la infección por Leishmania, especialmente en los tejidos que comúnmente albergan parásitos de Leishmania. Sin embargo, la terapia antileishmanial llevó a la recuperación de la población de células T en todos los tejidos. Y ya sea debido a la acción directa de los medicamentos antileishmanial o a la disponibilidad de antígenos libres como consecuencia de la muerte de Leishmania causada por la terapia, se produce un cambio en la población de células T, lo que conduce a una rápida reducción en la frecuencia de células T CD8+ en la sangre y los ganglios linfáticos.
Las células T reguladoras generalmente se consideran un subconjunto de células T CD4+, que expresan la cadena IL-2R-α no constitutiva (CD25) y el factor transcripcional FoxP3 (80, 81). La función principal de estas células es suprimir las respuestas inmunitarias excesivas o equivocadas y prevenir las enfermedades autoinmunes (74, 82). Pocos son los estudios de Treg realizados en CanL, que explican la falta de información general sobre estas subpoblaciones (83). En perros infectados experimentalmente con L. infantum, el ARN de FoxP3 aumentó en la piel y el hígado, pero en el ganglio linfático, los autores verificaron una disminución asociada con la progresión de la enfermedad (84). Figueiredo et al. (85) se refirieron a que CanL mejoró la expresión de FoxP3 en el jejuno y el colon. Sin embargo, la piel de L. chagasi (syn. Los perros infectados por L. infantum) revelaron niveles más bajos de expresión de FoxP3 (86). Otro estudio no encontró ninguna correlación entre las células de TGF-β o IL-10 que producen CD4+ Treg en la sangre y el bazo y la carga parasitaria de los perros infectados naturalmente (87).
En el presente estudio, los perros enfermos mostraron un aumento de las frecuencias de las células Treg CD4+ en sangre asociadas con la disminución de los porcentajes de células T efectoras CD4+ (CD25-FoxP3−), lo que indica una falta de respuesta inmune celular adecuada, lo que puede prolongar la presencia del parásito, facilitando la transmisión del parás La terapia antileishmanial permitió la normalización de la sangre CD4+ Treg y los subconjuntos de células T efectores, especialmente en perros bajo el protocolo meglumina más alopurinol, restaurando la acción de las células T efectoras CD4+.
Curiosamente, y siguiendo los resultados obtenidos, CanL no parece causar cambios significativos en las células de Treg CD4+ y en los subconjuntos de células T efectoras de CD4+ de los ganglios linfáticos. Del mismo modo, en un estudio con ratones infectados con L. infantum, se encontró una alta frecuencia de células T CD4+CD25+ que expresan FoxP3 en los ganglios linfáticos en las primeras semanas de infección, seguida de una disminución en la fase crónica posterior de la enfermedad (43), apoyando los resultados observados en el presente estudio. Además, la administración de medicamentos CanL causó una perturbación transitoria en las células Treg y los subconjuntos de células T efectoras. Al dirigir la reducción de la frecuencia de las células T efectoras asociadas con el aumento del subconjunto de células Treg, la terapia parece promover el desarrollo de una respuesta inmune supresora ubicada en el ganglio linfático del perro. A pesar de esto, 3 meses después del inicio del tratamiento, los valores se normalizan. Por lo tanto, es posible que el antimoniato de mitefosina y meglumina, que se administraron a perros enfermos solo durante las primeras 4 semanas de tratamiento, sean los principales responsables del desarrollo de una respuesta inmune supresora que pueda limitar la inflamación.
En pacientes con leishmaniosis visceral causada por L. donovani, la médula ósea reveló un aumento de las células Treg (CD4+CD25+FoxP3+) que superaban en número a las células T efectoras (CD4+CD25+FoxP3−) (42). Estas células Treg demostraron ser una fuente de IL-10 y persistieron en los pacientes incluso después de una quimioterapia exitosa con gluconato de mónio de sodio. En el estudio actual, ambos tratamientos indujeron un rápido aumento en la frecuencia de los subconjuntos de células T CD4+CD25+FoxP3+ y CD4+CD25-FoxP3− en la médula ósea de los perros, pero durante un corto período de tiempo, normalizándose para el segundo mes de observación. En este caso, los hallazgos apoyan la hipótesis de que el aumento de la frecuencia de las células CD4+ Treg puede ser una posible consecuencia de los medicamentos antimoniales de la miltefosina y la meglumina.
En CanL, como en otras enfermedades en las que el sistema inmunitario está profundamente involucrado, la presencia y la acción de las células CD8+ Treg siguen siendo motivo de discusión. En un estudio de la leishmaniosis visceral humana, los autores propusieron que la IL-10 producida por las células T CD8+ podría conducir a una regulación a la baja de la producción de citoquinas, en particular las citocinas proinflamatorias como el TNF-α y el IFN-γ, bloqueando de esta manera la actividad anti-leishman Estudios posteriores han demostrado la presencia de un subconjunto de células CD8+ Treg que pueden inhibir la respuesta inmune mediada por células T CD4+ induciendo apoptosis de células T CD4+ activadas (89). De esta manera, el aumento de la frecuencia del subconjunto de células T CD8+CD25+FoxP3+ en la sangre y la médula ósea de los perros enfermos mostrado en el estudio actual podría representar un mecanismo complementario de regulación inmune que puede favorecer la supervivencia de los parásitos (78). El tratamiento de CanL con militefosina o antimoniato de meglumina en combinación con alopurinol dirige las células de Treg CD8+ de la sangre para que vuelvan progresivamente a los valores normales. Estos medicamentos antileishmanial parecen causar un cambio en los linfocitos de la sangre y la médula ósea al reducir el aumento de la frecuencia del subconjunto de células T CD8+CD25+FoxP3+ y reducir las células T efectoras CD8+ (CD25-FoxP3-) para contener la respuesta inmune inflamatoria local y la citotoxicidad
Se han identificado células T CD4+CD8+ dp en perros con y sin CanL (56, 90, 91). En el estudio actual, se reveló que la frecuencia de los subconjuntos de células T de CD4+CD8+ dp aumentaba en la sangre periférica, los ganglios linfáticos y la médula ósea de los perros con CanL. Teniendo en cuenta el perfil crónico de CanL, estos hallazgos están en línea con estudios anteriores (57-61) que han establecido un vínculo entre el aumento de las células T dp y las enfermedades crónicas. Además, las células T dp también se han asociado con un aumento de la producción de IFN-γ en cerdos (50), similar a los resultados anteriores encontrados en perros con CanL (66). Además, la presencia de subconjunto de células T CD4+CD8+CD25+FoxP3+ en la sangre periférica de los perros enfermos revela una posible actividad reguladora, como proponen otros autores (62), mientras que el ganglio linfático y la médula ósea presentaron porcentajes disminuidos de CD25, lo que refleja un posible papel citotóxico (63) resultante A su vez, en el presente estudio, la administración de cualquiera de los tratamientos condujo a un cambio en ambos perfiles, con células T dp en la sangre perdiendo el fenotipo regulatorio, posiblemente para combatir la infección, mientras que el ganglio linfático y la médula ósea aparentemente cambian a un perfil regulatorio para anular un posible daño citotóxico excesivo. En cualquier caso, dado que el papel de estas células T CD4+CD8+ dp aún no se entiende completamente in vivo, todavía se necesitan más estudios en profundidad en estas subpoblaciones para dilucidar sus modos de acción.
La respuesta inmune a la Leishmania, en humanos, ratones o perros, parece ser muy compleja e influenciada por varios tipos de células inmunitarias y diferentes mediadores inmunitarios, estableciendo una red elaborada. De cualquier manera, parece haber un consenso de que los parásitos de Leishmania conducen a la diferenciación de inmunofenotipos celulares específicos en diferentes tejidos. La canL en este estudio condujo a un aumento de la frecuencia de las células T CD8+ en todos los tejidos, junto con el aumento de las frecuencias de las células T de CD4+CD8+ dp, lo que resultó en un perfil proinflamatorio predominante. Las frecuencias de las células de CD8+ Treg también aumentaron significativamente en la sangre y la médula ósea, mostrando una posible acción sobre las respuestas inmunitarias mediadas por las células T CD4+, lo que puede conducir a la tolerancia a los parásitos y a la progresión de la enfermedad. En el presente trabajo, la administración de cualquiera de los protocolos de tratamiento llevó a una recuperación general de las subpoblaciones de células T al final de la observación, lo que refleja la mejora clínica de los perros (66). Sin embargo, debe tenerse en cuenta que ambos protocolos resultaron en un aumento de las frecuencias de las células CD4+ Treg en todos los tejidos, posiblemente con el fin de reducir significativamente la frecuencia de las células T CD8+CD25-FoxP3- presentes y controlar las respuestas inmunes inflamatorias locales. Por último, con respecto a la eficacia de cualquiera de los tratamientos, a pesar de no ser el alcance de este trabajo, la recuperación de muchas subpoblaciones se logró más rápidamente con el protocolo Megl+Al que con el protocolo Milt+Al, que está de acuerdo con los resultados anteriores (66).
El monitoreo de los subconjuntos de células T mediante el uso de biomarcadores específicos y el análisis de la eficacia de los tratamientos con CanL permiten una mejor comprensión de la interacción entre el parásito y la respuesta inmune del perro, lo que debería mejorar el manejo del paciente, conducir al desarrollo de quimioterapias más eficientes y menos tóxicas y fomentar el uso de medidas profilácticas
Declaración de disponibilidad de datos
Los conjuntos de datos generados para este estudio están disponibles previa solicitud al autor correspondiente.
Declaración ética
El estudio sobre animales fue revisado y aprobado por el Comité de Ética y Bienestar Animal de la Facultad de Medicina Veterinaria de la Universidad de Lisboa. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones del autor
GS-G, IP y MS concibieron y diseñaron el estudio. AB, AR, IP, JM, MP y MS recogieron muestras. IP, LG y MS procesaron muestras e hicieron pruebas microscópicas, serológicas y moleculares posteriores. GA-P y MS llevaron a cabo los experimentos. GA-P, GS-G, IP y MS analizaron los datos. GS-G y MS realizaron análisis estadísticos. GS-G, IP y MS redactaron el manuscrito. AVR, GA-P, GS-G e IP hicieron revisiones en profundidad del manuscrito. Todos los autores leyeron y aprobaron el manuscrito final.
Financiación
La financiación para este trabajo fue proporcionada por la Fundación Portuguesa para la Ciencia y la Tecnología (FCT) (PTDC/CVT/118566/2010), el Centro de Investigação Interdisciplinar em Sanidade Animal (CIISA), la Faculdade de Medicina Veterinária, Universidade de Lisboa, a través del proyecto UIDP/CVT/00276/2020 (financiado por FCT), y Marcos Santos obtuvo una beca de doctorado (SFRH/BD/101467/2014) de la Fundación Portuguesa de Ciencia y Tecnología (FCT).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Agradecimientos
Los autores desean agradecer la cooperación y toda la ayuda proporcionada por los veterinarios y el personal del Hospital Universitario de la Facultad de Medicina Veterinaria de la Universidad de Lisboa (FMV-ULisboa), junto con el MSc Telmo Pina Nunes por el asesoramiento estadístico y un reconocimiento especial a todos los propietarios y sus respectivos perros por su contribución a este estudio. Por último, también nos gustaría dar las gracias al equipo de la Unidad de Imágenes y Citometría del Instituto Gulbenkian de Ciência (IGC), en particular a la Maestría Cláudia Andrade, la Maestra Cláudia Bispo y el Doctorado. Rui Gardner por su apoyo en el diseño de los experimentos de citometría de flujo y el panel de fluorocromo.
Abreviaturas
ALT, alanina aminotransferasa; AST, aspartato aminotransferasa; BID, bis en la muerte; BUN, nitrógeno de urea en sangre; CanL, leishmaniosis canina; CD, grupo de diferenciación; CG, grupo de control; CVBD, enfermedad transmitida por vectores canino; ADN, ácido desoxirribonucleico; FM
Referencias
1. ¿QUIÉN? Informe sobre la reunión interregional sobre la leishmaniasis entre los países endémicos vecinos en las regiones del Mediterráneo oriental, África y europea. Ammán, Jordania, 23-25 de septiembre de 2018. Publicado por la Organización Mundial de la Salud (2019). 1-47. Disponible en línea en: https://apps.who.int/iris/bitstream/handle/10665/311922/IC_Meet_Rep_2019_EN_20619.pdf? ua=1 (consultado el 2 de enero de 2020).
2. Novo SPC, Leles D, Bianucci R, Araujo A. El proceso de infección por Leishmania – enfermedad y nuevas perspectivas de la paleoparasitología. Rev Inst Med Trop Sao Paulo. (2016) 58:45. doi: 10.1590/S1678-9946201658045
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
3. van Zandbergen G, Klinger M, Mueller A, Dannenberg S, Gebert A, Solbach W, et al. Vanguardia: el granulocito de neutrófilos sirve como vector para la entrada de Leishmania en los macrófagos. J Immunol. (2004) 173:6521–5. doi: 10.4049/jimmunol.173.11.6521
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
4. Cecílio P, Pérez-Cabezas B, Santarém N, Maciel J, Rodrigues V, da Silva AC. Engaño y manipulación: los brazos de Leishmania, un parásito exitoso. Inmunidad frontal. (2014) 5:480. doi: 10.3389/fimmu.2014.00480
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
5. Martínez-López M, Soto M, Iborra S, Sancho D. Leishmania secuestra células mieloides para escapar inmunitario. Microbiol delantero. (2018) 9:883. doi: 10.3389/fmicb.2018.00883
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
6. Baneth G, Koutinas AF, Solano-Gallego L, Bourdeau P, Ferrer L. Leishmaniosis canina: nuevos conceptos y conocimientos sobre una zoonosis en expansión: primera parte. Tendencias Parasitol. (2008) 24:324–30. doi: 10.1016/j.pt.2008.04.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
7. Solano-Gallego L, Koutinas A, Miró G, Cardoso L, Pennisi MG, Ferrer L, et al. Instrucciones para el diagnóstico, la estadificación clínica, el tratamiento y la prevención de la leishmaniosis canina. Veterinario Parasitol. (2009) 165:1–18. doi: 10.1016/j.vetpar.2009.05.022
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
8. Pautas de LeishVet. Leishmaniosis canina y felina. Un informe para el veterinario en ejercicio. 4a edición (2018). Disponible en línea en: http://www.leishvet.org/wp-content/uploads/2018/04/LeishVet-Guidelines-4Ed.pdf (consultado el 10 de octubre de 2019).
9. Nogueira F, Avino V, Galvis-Ovallos F, Pereira-Chioccola V, Moreira A, Romariz A, et al. Uso de miltefosina para tratar la leishmaniasis visceral canina causada por Leishmania infantum en Brasil. Vectores de parásitos. (2019) 12:1–11. doi: 10.1186/s13071-019-3323-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
10. João A, Pereira MA, Cortes S, Santos-Gomes GM. quimioterapia de leishmaniasis canina: estado clínico del perro y riesgo de transmisión de leishmanía. J Vet Med A Physiol Clin Med. (2006) 53:540–5. doi: 10.1111/j.1439-0442.2006.00869.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
11. Ikeda-Garcia FA, Lopes RL, Marques FJ, de Lima VMF, Morinishi CK, Bonello FL, et al. Evaluación clínica y parasitológica de perros infectados naturalmente por Leishmania (Leishmania) chagasi sometidos a tratamiento con antimoniato de meglumina. Veterinario Parasitol. (2007) 143:254–9. doi: 10.1016/j.vetpar.2006.08.019
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
12. Manna L, Vitale F, Reale S, Picillo E, Neglia G, Vescio F, et al. Estudio de la eficacia de la miltefosina y el alopurinol en perros con leishmaniosis. Veterinario J. (2009) 182:441–5. doi: 10.1016/j.tvjl.2008.08.009
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
13. Frézard F, Demicheli C, Ribeiro RR. Antimoniales pentavalentes: nuevas perspectivas para las drogas antiguas. Moléculas. (2009) 14:2317-36. doi: 10.3390/molecules14072317
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
14. McGwire BS, Satoskar AR. Leishmaniasis: síndromes clínicos y tratamiento. QJM. (2014) 107:7–14. doi: 10.1093/qjmed/hct116
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
15. Moreira VR, de Jesus LCL, Soares RP, Silva LDM, Pinto BAS, Melo MN, et al. El antimoniato de meglumina (Glucantime) causa daño de ADN derivado del estrés oxidativo en ratones BALB/c infectados por Leishmania (Leishmania) infantum. Agentes antimicrobianos Chemother. (2017) 61:e02360-16. doi: 10.1128/AAC.02360-16
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
16. Basu JM, Mookerjee A, Sen P, Bhaumik S, Sen P, Banerjee S, et al. El gluconato de antimonio de sodio induce la generación de especies reactivas de oxígeno y óxido nítrico a través de la fosfoinositida 3-quinasa y la activación de la proteína quinasa activada por mitógeno en macrófagos infectados por Leoishmania donovani. Agentes Antimicrobianos Chemother. (2006) 50:1788–97. doi: 10.1128/AAC.50.5.1788-1797.2006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
17. Haldar AK, Sen P, Roy S. Uso del antimonio en el tratamiento de la leishmaniasis: estado actual y direcciones futuras. Mol Biol Int. (2011) 2011:571242. doi: 10.4061/2011/571242
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
18. Passero LFD, Cruz LA, Santos-Gomes G, Rodrigues E, Laurenti MD, Lago JHG. Tratamientos alternativos convencionales frente a tratamientos naturales para la leishmaniasis: una revisión. Curr Top Med Chem. (2018) 18:1275–86. doi: 10.2174/1568026618666181002114448
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
19. Murray HW, Oca MJ, Granger AM, Schreiber RD. Requisito de células T y efecto de las linfocinas en la quimioterapia exitosa para una infección intracelular. Leishmaniasis visceral experimental. J Clin Invest. (1989) 83:1253–7. doi: 10.1172/JCI114009
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
20. Murray HW, Granger AM, Mohanty SK. Respuesta a la quimioterapia en leishmaniasis visceral experimental: dependiente de células T pero interferón-γ- e interleucina-2 independientes. J Infecta a Dis. (1991) 163:622–4. doi: 10.1093/infdis/163.3.622
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
21. Pérez-Victoria FJ, Sánchez-Cañete MP, Seifert K, Croft SL, Sundar S, Castanys S, et al. Mecanismos de resistencia experimental de Leishmania a la miltefosina: implicaciones para el uso clínico. Actualización de resistencia a las drogas. (2006) 9:26–39. doi: 10.1016/j.drup.2006.04.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
22. Sundar S, Olliaro P. Miltefosina en el tratamiento de la leishmaniasis: evidencia clínica para la gestión informada del riesgo clínico. Ther Clin Risk Manag. (2007) 3:733-40.
23. Bianciardi P, Brovida C, Valente M, Aresu L, Cavicchioli L, Vischer C, et al. Administración de antimoniato de mitefosina y meglumina en perros sanos: evaluación clínico-patológica del impacto en los riñones. Toxicol Pathol. (2009) 37:770–5. doi: 10.1177/0192623309344088
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
24. Dorlo T, Balasegaram M, Beijnen J, de Vries P. Miltefosina: una revisión de su farmacología y eficacia terapéutica en el tratamiento de la leishmaniasis. J Antimicrob Chemother. (2012) 67:2576–97. doi: 10.1093/jac/dks275
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
25. Zeisig R, Rudolf M, Eue I, Arndt D. Influencia de la hexadecilfosfocolina en la liberación del factor de necrosis tumoral y nitróxido de los macrófagos peritoneales in vitro. J Cancer Res Clin Oncol. (1995) 121:69–75. doi: 10.1007/BF01202215
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
26. Wadhone P, Maiti M, Agarwal R, Kamat V, Martin S, Saha B. La mixtofosina promueve la respuesta inmune anti-leishmanial dominada por IFN-γ. J Immunol. (2009) 182:7146–54. doi: 10.4049/jimmunol.0803859
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
27. Vehmeyer K, Scheurich P, Eibl H, Unger C. Mejora mediada por hexadecilfosfocolina de las respuestas de las células T a la interleucina 2. Inmunol celular. (1991) 137:232–8. doi: 10.1016/0008-8749(91)90072-J
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
28. Denerolle P, Boudoiseau G. Tratamiento combinado de alopurinol y antimonio frente a antimonio solo y alopurinol solo en el tratamiento de la leishmaniasis canina (96 casos). J Vet Int Med. (1999) 13:413–5. doi: 10.1111/j.1939-1676.1999.tb01455.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
29. Página SW. Medicamentos antiparasitarios. En: Farmacología Clínica de Animales Pequeños Filadelfia, PA: Elsevier Limited. (2008). p. 198–260. doi: 10.1016/B978-070202858-8.50012-9
30. Ribeiro R, Michalick M, Silva M, Santos C, Frézard F, Silva S. Leishmaniasis canina: una visión general del estado actual y las estrategias de control. Biomed Res Int. (2018) 3296893. doi: 10.1155/2018/3296893
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
31. Yasur-Landau D, Jaffe CL, David L, Baneth G. Resistencia al alopurinol en Leishmania infantum. de perros con recaída de la enfermedad.PLoS Negl Trop Dis. (2016) 10:e0004341. doi: 10.1371/journal.pntd.0004341
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
32. Pinelli E, Killick-Kendrick R, Wagenaar J, Bernadina W, del Real G, Ruitenberg J. Respuestas inmunitarias celulares y humorales en perros infectados experimentalmente y de forma natural con Leishmania infantum. Infecta el sistema inmunológico. (1994) 62:229-35. doi: 10.1128/IAI.62.1.229-235.1994
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
33. Liew FY, O’Donnell CA. Inmunología de la leishmaniasis. Adv Parasitol. (1993) 32:161–259. doi: 10.1016/S0065-308X(08)60208-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
34. Santos-Gomes GM, Rosa R, Leandro C, Cortes S, Romão P, Silveira H. Expresión de citocinas durante el resultado de la infección experimental canina por Leishmania infantum. Inmunopático inmune veterinario. (2002) 88:21-30. doi: 10.1016/S0165-2427(02)00134-4
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
35. Bourdoiseau G, Bonnefont C, Hoareau E, Boehringer C, Stolle T, Chabanne L. Niveles específicos de anticuerpos IgG1 e IgG2 y subconjunto de linfocitos en perros tratados y no tratados con infectados naturalmente con Leishmania infantum.Inmunopático inmune veterinario. (1997) 59:21–30. doi: 10.1016/S0165-2427(97)00072-X
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
36. Moreno J, Nieto J, Chamizo C, González F, Blanco F, Barker DC, et al. La respuesta inmune y los subconjuntos de PBMC en la leishmaniasis visceral canina antes y después de la quimioterapia. Inmunopático inmune veterinario. (1999) 71:181–95. doi: 10.1016/S0165-2427(99)00096-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
37. Guarga JL, Moreno J, Lucientes J, Gracia MJ, Peribáñez MA, Alvar J, et al. Transmisión de la leishmaniasis canina: una mayor infectividad entre los perros infectados naturalmente a las moscas de arena se asocia con proporciones más bajas de células T auxiliares. Res Vet Sci. (2000) 69:249–53. doi: 10.1053/rvsc.2000.0419
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
38. Alvar J, Cañavate C, Molina R, Moreno J, Nieto J. Leishmaniasis canina. Adv Parasitol. (2004) 57:1–88. doi: 10.1016/S0065-308X(04)57001-X
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
39. Pinelli E, Gonzalo RM, Boog CJ, Rutten VP, Gebhard D, del Real G, et al. Líneas de células T para el infanteo de Leishmania derivadas de perros asintomáticos que elicen los macrófagos infectados de una manera importante restringida por el complejo de histocompatibilidad. Eur J Immunol. (1995) 25:1594–600. doi: 10.1002/eji.1830250619
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
40. Belkaid Y, Piccirillo CA, Mendez S, Shevach EM, Sacks DL. Las células T reguladoras CD4+CD25+ controlan la persistencia y inmunidad mayores de Leishmania. Naturaleza. (2002) 420:502–7. doi: 10.1038/nature01152
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
41. Mendez S, Reckling SK, Piccirillo CA, Sacks D, Belkaid Y. Papel de las células T reguladoras de CD4(+) CD25(+) en la reactivación de la leishmaniasis persistente y el control de la inmunidad concomitante. J Exp Med. (2004) 200:201-10. doi: 10.1084/jem.20040298
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
42. Rai AK, Thakur CP, Singh A, Seth T, Srivastava SK, Singh P, et al. Las células T reguladoras suprimen la activación de las células T en el sitio patológico de la leishmaniasis visceral humana. PLoS ONE. (2012) 7:e31551. doi: 10.1371/journal.pone.0031551
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
43. Rodrigues OR, Marques C, Soares-Clemente M, Ferronha MH, Santos-Gomes GM. Identificación de células T reguladoras durante la infección infantil experimental de Leishmania. Inmunobiología. (2009) 214:101–11. doi: 10.1016/j.imbio.2008.07.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
44. Allos H, Al Dulaijan BS, Choi J, Azzi J. Células T reguladoras para terapias inmunosupresoras más específicas. Clin Lab Med. (2019) 39:1–13. doi: 10.1016/j.cll.2018.11.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
45. Piccirillo CA, Shevach EM. Vanguardia: control de la activación de las células T CD8+ por las células inmunorrereguladoras CD4+CD25+. J Immunol. (2001) 167:1137-40. doi: 10.4049/jimmunol.167.3.1137
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
46. Cortese L, Annunziatella M, Palatucci AT, Rubino V, Piantedosi D, Di Loria A, et al. Células T reguladoras, linfocitos T citotóxicos y un perfil de citocinas T(H)1 en perros infectados naturalmente por Leishmania infantum. Res Vet Sci. (2013) 95:942–9. doi: 10.1016/j.rvsc.2013.08.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
47. Shevach EM. Desde vainilla hasta 28 sabores: múltiples variedades de células reguladoras T. Inmunidad. (2006) 25:195–201. doi: 10.1016/j.immuni.2006.08.003
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
48. Hu D, Liu X, Zeng W, Weiner HL, Ritz J. Un modelo clonal para células T reguladoras humanas de CD8+: matanza sin restricciones dependiente del contacto de células T CD4+ activadas. Eur J Immunol. (2012) 42:69–79. doi: 10.1002/eji.201141618
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
49. Tiwananthagorn S, Iwabuchi K, Ato M, Sakurai T, Kato H, Katakura K. ¿Participación de CD4? ¿Foxp3? células T reguladoras en la persistencia de Leishmania donovani en el hígado de ratones aly/aly aly apifoplásicos. PLoS Negl Trop Dis. (2012) 6:e1798. doi: 10.1371/journal.pntd.0001798
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
50. Zuckermann FA, Husmann RJ. Análisis funcional y fenotípico de las células T de doble positivo de CD4/CD8 en sangre periférica porcina. Inmunología. (1996) 87:500–12.
51. Akari H. Los linfocitos de sangre periférica CD4+CD8+ en monos cynomolgus son de linaje T de memoria en reposo. Int Immunol. (1997) 9:591–7. doi: 10.1093/intimm/9.4.591
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
52. Mizuki M, Tagawa S, Machii T, Shibano M, Tatsumi E, Tsubaki K, et al. Heterogeneidad fenotípica de la leucemia linfoide T crónica doble positiva de CD4+CD8+. Leucemia. (1998) 12:499-504. doi: 10.1038/sj.leu.2400978
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
53. Zuckermann FA. Células T extrarítmicas CD4/CD8 dobles positivas. Inmunopático inmune veterinario. (1999) 72:55–66. doi: 10.1016/S0165-2427(99)00118-X
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
54. Kenny E, Mason D, Pombo A, Ramírez F. Análisis fenotípico de células T periféricas CD4+ CD8+ en la rata. Inmunología. (2000) 101:178–84. doi: 10.1046/j.1365-2567.2000.00071.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
55. Hillemeyer P, White MD, Pascual DW. Desarrollo de un subconjunto transitorio de células T CD4+CD8+ en los ganglios linfáticos cervicales después de la instilación intratraqueal con un vector de adenovirus. Inmunol celular. (2002) 215:173–85. doi: 10.1016/S0008-8749(02)00024-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
56. Alexandre-Pires G, de Brito MTV, Algueró C, Martins C, Rodrigues OR, da Fonseca IP, et al. Leishmaniosis canina. Perfil inmunofenotípico de los leucocitos en diferentes compartimentos de perros sintomáticos, asintomáticos y tratados.Inmunopático inmune veterinario. (2010) 137:275–83. doi: 10.1016/j.vetimm.2010.06.007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
57. Matsui M, Fukuyama H, Akiguchi I, Kameyama M. Células CD4+CD8+ circulantes en miastenia gravis: parámetro inmunológico suplementario para el pronóstico a largo plazo. J Neurol. (1989) 236:329–35. doi: 10.1007/BF00314374
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
58. Bagot M, Echchakir H, Mami-Chouaib F, Delfau-Larue MH, Charue D, Bernheim A, et al. Aislamiento de clones de células T citotóxicos CD4+ y CD4+CD8dim+ específicos del tumor que se infiltran en un linfoma cutáneo de células T. Sangre. (1998) 91:4331–41. doi: 10.1182/blood.V91.11.4331
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
59. Kitchen SG, Jones NR, La Forge S, Whitmire JK, Vu BA, Galic Z, et al. CD4 en las células T CD8(+) mejora directamente la función efectora y es un objetivo para la infección por el VIH. Proc Natl Acad Sci USA. (2004) 101:8727-32. doi: 10.1073/pnas.0401500101
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
60. Desfrançois J, Moreau-Aubry A, Vignard V, Godet Y, Khammari A, Dréno B, et al. Células T αβ CD4CD8 doble positiva: una nueva población reactiva al tumor en melanomas humanos. PLoS ONE. (2010) 5:e8437. doi: 10.1371/journal.pone.0008437
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
61. Talker SC, Koinig HC, Stadler M, Graage R, Klingler E, Ladinig A, et al. Magnitud y cinética de las células T multifuncionales CD4+ y CD8β+ en cerdos infectados con el virus de la gripe porcina A. Veterinario Res. (2015) 46:52. doi: 10.1186/s13567-015-0182-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
62. Rothe K, Bismarck D, Büttner M, Alber G, von Buttlar H. Las subpoblaciones de células T de doble positivo de sangre periférica canina CD4+CD8+ exhiben distintos fenotipos de células T y funciones efectoras. Inmunopático inmune veterinario. (2017) 185:48–56. doi: 10.1016/j.vetimm.2017.01.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
63. Rabiger FV, Bismarck D, Protschka M, Köhler G, Moore PF, Büttner M, et al. Las células T de doble positivo CD4+CD8α+ asociadas al tejido canino son una subpoblación de células T activadas con potencial funcional heterogéneo. PLoS ONE. (2019) 14:e0213597. doi: 10.1371/journal.pone.0213597
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
64. Solano-Gallego L, Mirá G, Koutinas A, Cardoso L, Pennisi MG, Ferrer L, et al. Directrices de LeishVet para el manejo práctico de la leishmaniosis canina. Vectores de parásitos. (2011) 4:86. doi: 10.1186/1756-3305-4-86
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
65. Paltrinieri S, Solano-Gallego L, Fondati A, Lubas G, Gradoni L, Castagnaro M, et al. Directrices para el diagnóstico y la clasificación clínica de la leishmaniasis en perros. J Am Vet Med Assoc. (2010) 236:1184–91. doi: 10.2460/javma.236.11.1184
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
66. Santos MF, Alexandre-Pires G, Pereira MA, Marques CS, Gomes J, Correia J, et al. El antimoniato de meglumina y la miltefosina combinados con el alopurinol mantienen entornos inmunes proinflamatorios durante el tratamiento de la leishmaniosis canina. Ciencia veterinaria frontal (2019) 6:362. doi: 10.3389/fvets.2019.00362
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
67. Burel JG, Pomaznoy M, Lindestam Arlehamn CS, Weiskopf D, da Silva Antunes R, Jung Y, et al. Los complejos de células T-monocitos circulantes son marcadores de perturbaciones inmunitarias. Elife. (2019) 8:e46045. doi: 10.7554/eLife.46045
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
68. Papadogiannakis E, Andritsos G, Kontos V, Spanakos G, Koutis C, Velonakis E. Determinación de las células T CD4+ y CD8+ en la sangre periférica de perros con leishmaniosis antes y después de la monoterapia prolongada con alopurinol.Veterinario J. (2010) 186:262–3. doi: 10.1016/j.tvjl.2009.08.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
69. Lee J, Park N, Park JY, Kaplan BLF, Pruett SB, Park JW, et al. Inducción de células T reguladoras de CD8+CD25+FOXP3+ inmunosupresoras mediante estimulación subóptima con enterotoxina estafilocócica C1. J Immunol. (2018) 200:669-80. doi: 10.4049/jimmunol.1602109
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
70. Cortese L, Annunziatella M, Palatucci AT, Lanzilli S, Rubino V, Di Cerbo A, et al. Una dieta inmunomoduladora aumenta las células T reguladoras y reduce la respuesta inflamatoria del ayudante T 1 en perros afectados por la leishmaniosis tratados con terapia estándar. BMC Vet Res. (2015) 11:295. doi: 10.1186/s12917-015-0610-7
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
71. Bourdoiseau G, Bonnefont C, Magnol JP, Saint-André I, Chabanne L. Anomalías del subconjunto de linfocitos en la leishmaniasis canina. Inmunopático inmune veterinario. (1997) 56:345–51. doi: 10.1016/S0165-2427(96)05768-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
72. Miranda S, Martorell S, Costa M, Ferrer L, Ramis A. Caracterización de las subpoblaciones de linfocitos circulantes en la leishmaniasis canina durante el tratamiento con antimoniales y alopurinol. Veterinario Parasitol. (2007) 144:251–60. doi: 10.1016/j.vetpar.2006.10.007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
73. Novais FO, Wong AC, Villareal DO, Beiting DP, Scott P. Las células T CD8+ carecen de señales locales para producir IFN-γ en la piel durante la infección por Leishmania. J Immunol. (2018) 200:1737–45. doi: 10.4049/jimmunol.1701597
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
74. Jawed JJ, Dutta S, Majumdar S. Aspectos funcionales de la diversidad de células T en la leishmaniasis visceral. Biomed Pharmacother. (2019) 117:109098. doi: 10.1016/j.biopha.2019.109098
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
75. Reiner NE, Ng W, Ma T, McMaster WR. Cinética de la unión de interferón gamma e inducción del ARNm de clase II del complejo de histocompatibilidad principal en macrófagos infectados por Leishmania. Proc Natl Acad Sci USA. (1988) 85:4330–4. doi: 10.1073/pnas.85.12.4330
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
76. Saha B, Das G, Vohra H, Ganguly NK, Mishra GC. Interacción celular macrófago-T en la leishmaniasis visceral experimental: incapacidad para expresar moléculas coestimuladoras en macrófagos infectados por Leishmania y su implicación en la supresión de la inmunidad mediada por células. Eur J Immunol. (1995) 25:2492–8. doi: 10.1002/eji.1830250913
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
77. Pinelli E, Rutten VP, Bruysters M, Moore PF, Ruitenberg EJ. La compensación por la disminución de la expresión de moléculas B7 en los macrófagos caninos infectados por el infante de Leishmania resulta en la restauración de la proliferación de células T específicas de los parásitos y la producción de interferón gamma. Infecta el sistema inmunológico. (1999) 67:237–43. doi: 10.1128/IAI.67.1.237-243.1999
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
78. Novais FO, Scott P. Células T CD8+ en la leishmaniasis cutánea: lo bueno, lo malo y lo feo. Immunopático de Semin. (2015) 37:251–9. doi: 10.1007/s00281-015-0475-7
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
79. Giunchetti RC, Martins-Filho OA, Carneiro CM, Mayrink W, Marques MJ, Tafuri WL, et al. Histopatología, densidad de parásitos y fenotipos celulares del ganglio linfático poplíteo en la leishmaniasis visceral canina. Inmunopático inmune veterinario. (2008) 121:23–33. doi: 10.1016/j.vetimm.2007.07.009
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
80. Sakaguchi S, Sakaguchi N, Asano M, Itoh M, Toda M. Autotolerancia inmunológica mantenida por las células T activadas que expresan cadenas alfa del receptor de IL-2 (CD25). La ruptura de un solo mecanismo de autotolerante causa varias enfermedades autoinmunes. J Immunol. (1995) 155:1151–64.
81. Ramsdell F. Foxp3 y las células T reguladoras naturales: ¿clave para un linaje celular? Inmunidad. (2003) 19:165–8. doi: 10.1016/S1074-7613(03)00207-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
82. Furtado GC, Curotto de Lafaille MA, Kutchukhidze N, Lafaille JJ. La señalización de interleucina 2 es necesaria para la función de la célula T reguladora CD4(+). J Exp Med. (2002) 196:851–7. doi: 10.1084/jem.20020190
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
83. Hosein S, Blake DP, Solano-Gallego L. Información sobre la inmunidad adaptativa e innata en la leishmaniosis canina.Parasitología. (2017) 144:95–115. doi: 10.1017/S003118201600055X
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
84. Hosein S, Rodríguez-Cortés A, Blake DP, Allenspach K, Alberola J, Solano-Gallego L. Transcripción de los receptores similares a los Toll-Like receptores 2, 3, 4 y 9, las citocinas FoxP3 y Th17 en un modelo experimental susceptible de infección infantil por Leishmania canina. PLoS ONE. (2015) 10:e0140325. doi: 10.1371/journal.pone.0140325
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
85. Figueiredo MM, Deoti B, Amorim IF, Pinto AJ, Moraes A, Carvalho CS, et al. Expresión de células T reguladoras en el jejuno, el colon y los ganglios linfáticos cervicales y mesentéricos de perros infectados naturalmente con Leishmania infantum.Infecta el sistema inmunológico. (2014) 82:3704–12. doi: 10.1128/IAI.01862-14
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
86. Menezes-Souza D, Corrêa-Oliveira R, Guerra-Sá R, Giunchetti RC, Teixeira-Carvalho A, Martins-Filho OA, et al. Perfiles de citocinas y factores de transcripción en la piel de perros infectados naturalmente por Leishmania (Leishmania) chagasi que presentan una densidad de parásitos cutáneos y un estado clínico distintos. Veterinario Parasitol. (2011) 177:39–49. doi: 10.1016/j.vetpar.2010.11.025
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
87. Silva KL, de Andrade MM, Melo LM, Perosso J, Vasconcelos RO, Munari DP, et al. Las células CD4+FOXP3+ producen IL-10 en el bazo de los perros con leishmaniasis visceral. Veterinario Parasitol. (2014) 202:313–8. doi: 10.1016/j.vetpar.2014.03.010
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
88. Peruhype-Magalhães V, Martins-Filho OA, Prata A, Silva L, De A, Rabello A, et al. El perfil mixto de citocina inflamatoria/regulador marcado por un aumento simultáneo de interferon-γ e interleucina-10 y una baja frecuencia de monocitos del factor de necrosis tumoral-α+ son características de la leishmaniasis visceral humana activa debido a la infección por Leishmania chagasi. Clin Exp Immunol. (2006) 146:124–32. doi: 10.1111/j.1365-2249.2006.03171.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
89. Chen Z, Han Y, Gu Y, Liu Y, Jiang Z, Zhang M, et al. La retroalimentación reguladora de las células T CD11c(alto)CD8+ inhibe la respuesta inmune de las células T CD4 a través de la vía Fas ligando-Fas. J Immunol. (2013) 190:6145–54. doi: 10.4049/jimmunol.1300060
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
90. Bismarck D, Schütze N, Moore P, Büttner M, Alber G, Buttlar H. Las células T de doble positivo de CD4+ CD4+ de los caninos en la sangre periférica tienen características de las células T activadas. Inmunopático inmune veterinario. (2012) 149:157–66. doi: 10.1016/j.vetimm.2012.06.014
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
91. McGill JL, Wang Y, Ganta CK, Boorgula GDY, Ganta RR. Las células T de doble positivo específica del antígeno CD4+CD8+ se incrementan en la sangre y el bazo durante la infección por Ehrlichia chaffeensis en el huésped canino. Inmunidad frontal. (2018) 9:1585. doi: 10.3389/fimmu.2018.01585
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Palabras clave: terapia antileishmanial, médula ósea, leishmaniosis canina, células T efectoras, citometría de flujo, ganglio linfático, células mononucleares de sangre periférica, células T (Treg) reguladoras
Cita: Santos MF, Alexandre-Pires G, Pereira MA, Gomes L, Rodrigues AV, Basso A, Reisinho A, Meireles J, Santos-Gomes GM y Pereira da Fonseca I (2020) Inmunofenotipación de los linfocitos T de sangre periférica, ganglios linfáticos y médula ósea durante la leishmaniosis canina y el Delante. Veterinario. Ciencia. 7:375. doi: 10.3389/fvets.2020.00375
Recibido: 20 de febrero de 2020; Aceptado: 28 de mayo de 2020;
Publicado: 15 de julio de 2020.
Editado por:
Massimo Amadori, Instituto Zooprofiláctico Experimental de Lombardía y Emilia Romaña (IZSLER), Italia
Revisado por:
Sonja Härtle, Universidad Ludwig Maximilian de Múnich, Alemania
Hans-Joachim Schuberth, Universidad de Medicina Veterinaria de Hannover, Alemania
Copyright © 2020 Santos, Alexandre-Pires, Pereira, Gomes, Rodrigues, Basso, Reisinho, Meireles, Santos-Gomes y Pereira da Fonseca.
*Correspondencia: Isabel Pereira da Fonseca, ifonseca@fmv.ulisboa.pt
Descargo de responsabilidad: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamación que pueda ser hecha por su fabricante no está garantizado o respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía