La historia de las pruebas de tuberculina in vivo en bovinos

La historia de las pruebas de tuberculina in vivo en bovinos: la tuberculosis, un problema de «una sola salud»
 Margaret Good1*,
Margaret Good1*,  Douwe Bakker2,
Douwe Bakker2,  Anthony Duignan3 y
Anthony Duignan3 y  Daniel M. Collins4
Daniel M. Collins4- 1Investigador independiente y consultor privado, Dun Laoghaire, Co. Dublin (anteriormente afiliado al Departamento de Agricultura, Alimentación y Marina, Dublín), Irlanda
- 2Departamento de Sanidad Animal, Facultad de Veterinaria, Universidad Complutense de Madrid, Madrid, España
- 3Departamento de Agricultura, Alimentación y Marina, Dublín, Irlanda
- 4Centro de Epidemiología Veterinaria y Análisis de Riesgos, UCD School of Veterinary Medicine, University College Dublin, Dublín, Irlanda
La tuberculosis (TB) tiene más de 3 millones de años prosperando en múltiples especies. Mycobacterium tuberculosis ancestral dio lugar a múltiples cepas, incluida Mycobacterium bovis, ahora distribuida en todo el mundo con transmisión zoonótica que ocurre en ambas direcciones entre animales y humanos. M. bovis en la leche causó problemas con un número significativo de muertes en niños menores de 5 años de edad debido principalmente a la tuberculosis extrapulmonar. Este riesgo se mitigó eficazmente con la pasteurización generalizada de la leche durante el siglo XX, y menos niños pequeños se perdieron a causa de la tuberculosis. Koch desarrolló la tuberculina en 1890 y reconociendo la posibilidad de usar tuberculina para detectar animales infectados, las primeras pruebas se desarrollaron rápidamente. A finales del siglo XIX y principios del XX siguieron los programas de control/erradicación de la tuberculosis bovina (TBB). Muchos científicos colaboraron y contribuyeron al desarrollo de pruebas de tuberculina, a refinar y optimizar la producción y estandarización de tuberculina y a determinar la sensibilidad y especificidad de la prueba utilizando diversas metodologías y sitios de inyección. La OMS, la OIE y la UE han establecido normas legales para la producción de tuberculina, el rendimiento de los ensayos de potencia y las pruebas intradérmicas para bovinos. Ahora, aquellos que usan pruebas de tuberculina para programas de control/erradicación de la tuberculosis bovina rara vez, ven la tuberculosis como una enfermedad. A pesar del lanzamiento de la primera hoja de ruta para combatir la tuberculosis zoonótica, muchos se preguntan si la tuberculosis bovina es realmente un problema. ¿Hay una mejor manera de lidiar con la tuberculosis bovina? ¿Podrían los sitios alternativos de pruebas cutáneas hacer que la prueba sea «mejor» y más fácil de realizar? ¿Todas las tuberculinas utilizadas para las pruebas son igualmente buenas? ¿Por qué no se han desarrollado pruebas alternativas «mejores»? Esta revisión fue motivada por este tipo de preguntas. Este artículo intenta resumir sucintamente los datos en la literatura desde finales del siglo XIX hasta la fecha para mostrar por qué la TB, y la TB zoonótica específicamente, fue y sigue siendo importante como una preocupación de «Una Salud», y que la necesidad de reducir la carga de la TB zoonótica, salvar vidas y asegurar medios de subsistencia es demasiado importante para esperar el posible desarrollo futuro de nuevos ensayos de diagnóstico para el ganado antes de renovar los esfuerzos para eliminarla. En consecuencia, es muy probable que la prueba cutánea de la tuberculina siga siendo la prueba de detección de elección para el ganado de granja en un futuro considerable.
Orígenes de la tuberculosis (TB)
La tuberculosis es una enfermedad antigua, que se encuentra en reliquias del antiguo Egipto, India y China. Gutiérrez y sus colegas pensaron que era probable que un ancestro temprano de Mycobacterium tuberculosis estuviera presente hace unos 3 millones de años en el este de África, y proponen que puede haber infectado a los grandes simios y al hombre ancestral en ese momento. La TB es en gran medida prevenible, tratable e incluso curable desde la década de 1950, sin embargo, miles de años después de que devastó culturas antiguas, tres personas mueren de TB cada minuto en el siglo XXI (1,5 millones en 2014), y la TB continúa prosperando a pesar del hecho de que las micobacterias que la causan solo pueden multiplicarse y propagarse dentro de un huésped (1-4).
Los análisis genéticos de las micobacterias de la tuberculosis y el análisis evolutivo del reloj molecular datan la cepa ancestral de la tuberculosis hace aproximadamente 40.000 años, lo que coincide con el período en que los humanos anatómicamente modernos viajaban hacia afuera desde África para establecerse en Europa y Asia. Esta antigua cepa se dividió en dos linajes principales entre 10.000 y 20.000 años más tarde y se extendió por todo el mundo con la expansión de las poblaciones humanas (1, 4, 5). En la antigua Grecia, Hipócrates vio la enfermedad en sus pacientes, se encontró evidencia de TB en esqueletos con cicatrices en varios lugares de Europa y Asia y, durante la década de 1990, se extrajo ADN de M. tuberculosis de lesiones en huesos humanos de 1.400 años de antigüedad encontrados en Europa y Borneo (5). Poco después, se identificó TB en tejidos de una momia peruana de 1.000 años de antigüedad, por lo que se hizo evidente que la enfermedad había llegado a las Américas mucho antes que los colonos europeos (5, 6). La cepa encontrada en la momia peruana, difería de las cepas más prevalentes en la moderna América del Sur, estando más estrechamente relacionada con una cepa encontrada en focas, lo que llevó a los científicos a teorizar que las focas inicialmente recogieron M. tuberculosis cuando se reproducían en playas africanas antes de transportarla y transmitirla de África a América del Sur (7). Los estudios genéticos de cepas modernas de tuberculosis animal y humana de todo el mundo sugieren que algunas secuencias se desprendieron, hace aproximadamente 6.000 años, de una cepa progenitora de un linaje de M. tuberculosis adaptada al hombre, que finalmente dio lugar a lo que ahora llamamos el complejo Mycobacterium tuberculosis (MTBC), y del cual Mycobacterium bovis Evolucionado. Esto, en términos evolutivos, puede estar asociado con la agricultura temprana y la domesticación de animales hace entre 10.000 y 15.000 años (5, 8). Sin embargo, también hay sugerencias de que la tuberculosis del ganado antiguo, con un patrón holártico, había llegado a América del Norte hace unos 20.000 años, antes de la domesticación bovina, lo que indica que es posible que no entendamos todo el escenario de propagación de la tuberculosis (9). Rothschilde et al. informaron haber encontrado lesiones parecidas a la TB en los huesos de un bisonte de cuernos largos del Pleistoceno (Bison cf. antiquus) radiocarbono fechado como «17.870 ± 230 años de antigüedad». El espozootipado de estas lesiones reveló diagramas de patrones que contenían segmentos de MTBC que no pueden asignarse a ninguna especie moderna individual del MTBC según los datos de spoligotipado existentes, pero que son más cercanos al grupo M. tuberculosis y no están asociados con M. bovis o Mycobacterium microti modernos (9).
La tuberculosis en un contexto social
Los brotes de tuberculosis en humanos alcanzaron su punto máximo con una prevalencia tan alta como 900 muertes por cada 100,000 habitantes entre los siglos XVIII y XIX, ya que principalmente las sociedades agrícolas y rurales en Europa y América se volvieron industriales y urbanas cuando, durante la revolución industrial, los trabajadores del campo se mudaron a las ciudades en busca de trabajo. Este aumento en las muertes por tuberculosis reflejó el impacto de la pobreza, la desnutrición, el saneamiento primitivo, las viviendas mal ventiladas y el hacinamiento (10, 11).
Las fuerzas impulsoras, como las que trabajan en los seres humanos, influyeron en la prevalencia de la tuberculosis en el ganado en los siglos XVIII y XIX. Junto con la población humana rural migratoria, en una era sin refrigeración, las vacas ordeñadoras también se mudaron a las ciudades. Allí se mantuvieron en estrecho confinamiento con una ventilación deficiente que condujo a una mayor prevalencia de TB en las vacas y, en consecuencia, M. bovis en la leche. La prevalencia de la tuberculosis en el ganado se agravó aún más por la posterior amplificación progresiva de la producción bovina (10). Los riesgos zoonóticos de M. bovis en la leche de una población bovina infectada ya se conocían en 1895 cuando se informó que la leche de animales con TB contenía bacilos tuberculosos visibles microscópicamente, aunque las vacas carecían de lesiones detectables de la ubre y que dicha leche podía transmitir enfermedades por vía oral a cobayas, conejos, cerdos y terneros (12). En Nueva York, la pasteurización de la leche comenzó en 1912 y, en la década siguiente, cuando el 50% de la leche se consumió pasteurizada, las tasas de mortalidad por tuberculosis no pulmonar disminuyeron en un 50%. Además, mientras que anteriormente el 50% de las glándulas tuberculosas del cuello se habían confirmado como M. bovis, una vez que la pasteurización se convirtió en la norma, solo 6 de las 50 glándulas confirmadas como M. bovis, 5 de las cuales se encontraron en personas que bebían leche cruda (13). A finales del siglo XIX y principios del XX, se hizo cada vez más claro que la tuberculosis podía transmitirse a través de los alimentos, en particular la leche. Para 1914, los especialistas en TB estaban de acuerdo en que la mayoría de los casos humanos de TB en el estómago, las glándulas del cuello y la garganta se habían transmitido por el consumo de leche infectada (14). Se estimó que M. bovis de origen bovino era responsable de aproximadamente 15,000 muertes en los Estados Unidos en 1917; tres veces más de lo que muere de todas las enfermedades transmitidas por los alimentos hoy (15).
Se estima que en Gran Bretaña (GB), el 6% de las muertes humanas debidas a la tuberculosis se debieron a M. bovis antes de la introducción de cualquier programa eficaz de control de la tuberculosis bovina (TBB) (16). Ahora es difícil acreditar que al defender una campaña por una leche limpia y honesta sin adulteración, por ejemplo, agua añadida sin tratar o gérmenes de enfermedades infecciosas, y la adopción del sistema de certificación de leche al estilo estadounidense para la limpieza (introducido en el Distrito de Columbia en 1904), Wilfred Buckley se convirtió en el «bête noire» y el enemigo de los agricultores y el comercio de leche (17). Sin embargo, a pesar de las implicaciones para la salud humana y los intentos de tres Comisiones Reales, entre 1890 y 1911, de definir la enfermedad como un problema de salud pública y seguridad alimentaria, parece haber sido las consecuencias económicas de la tuberculosis bovina las que llevaron a los intentos de erradicar la enfermedad en el ganado británico (18). Las discusiones sobre la clasificación de la leche y también la pasteurización habían estado en curso en GB desde alrededor de 1914. Sin embargo, la oposición a los cambios que habrían reducido el riesgo de TB para los consumidores tanto de ideólogos como de intereses creados, incluida la industria agrícola y partes del comercio de leche, aseguró que los partidos políticos en el poder no tomaran medidas decisivas y la pasteurización obligatoria se retrasara (17) a pesar de que la pasteurización obligatoria de la leche se había introducido en la ciudad de Nueva York ya en 1910 (19). La acción para eliminar la tuberculosis bovina se consideró como «un problema demasiado grande», «perjudicial para la industria agrícola», con «ciencia incierta», pero sin ningún concepto de la necesidad de actuar con un deber de cuidado hacia el consumidor o el principio de precaución (17). En general, se aceptó que el 40% del rebaño de ordeño británico estaba infectado con TB en los años 1920/1930, sin embargo, la pasteurización solo fue introducida gradualmente por la industria entre las dos guerras mundiales y luego solo para aumentar la vida útil de la leche al por menor (17). Parece extraño ahora que en ese momento no se apreciara la necesidad de generar la confianza de los consumidores en la cadena alimentaria o que esto sea compatible con el interés de los agricultores. No fue hasta 1935 que se convirtió en política desarrollar «rebaños atestiguados» para la libertad de TB y, en 1947, Francis informó que el 1% de las vacas tuberculosas tenían TB de la ubre, lo que representaba aproximadamente el 0,5% de todas las vacas en GB en ese momento (8). No fue hasta la década de 1950 que el sacrificio obligatorio de ganado infectado con tuberculosis se aplicó en el Reino Unido con la campaña nacional de erradicación de la tuberculosis bovina (17).
En 1992, Hardie y Watson (20) señalaron que la pasteurización de la leche no estaba muy extendida en el Reino Unido hasta la década de 1930. Alcanzó aproximadamente el 50% de la población en 1939, mientras que la leche cruda todavía se suministraba de rebaños no certificados en 1960. Hardie y Watson (20) hacen referencia a W. A. Lethem (1955. Tuberculosis transmitida por la leche, 1921 a 1953. Monthly Bulletin of the Ministry of Health and the Public Health Laboratory Service 14, 144–145) para decir «En 1955, Lethem utilizó las muertes por tuberculosis abdominal en niños menores de 5 años como índice de infección por M. bovis. En este grupo de edad, se pensaba que esta forma de tuberculosis se debía casi en su totalidad a la ingestión de leche contaminada con M. bovis. La caída de 1.107 muertes en 1921 a 12 muertes en 1953 fue mucho más marcada que la reducción equivalente en las muertes por otras formas no pulmonares de tuberculosis. Esto se atribuyó al desarrollo de leche ‘segura’ en los años intermedios, debido a una combinación de pasteurización y control de la infección por M. bovis en el ganado». También demuestran que en un área donde la tuberculosis bovina es endémica, la leche cruda aún puede ser un riesgo al notificar un brote clínico de M. bovis que afectó a tres escolares en 1959 y lo atribuyó a la leche contaminada de un rebaño infectado después de una prueba de tuberculina (20).
Los beneficios de la pasteurización de la leche, cuando los niveles de tuberculosis bovina son altos, para reducir la infección de tuberculosis, especialmente en niños pequeños, están bien establecidos. En los Países Bajos, la pasteurización de la leche se había extendido en la década de 1940, lo que resultó en una reducción de la tasa de mortalidad por 100.000 en niños menores de 4 años de 3,03 en 1934 a 0,76 en 1945 y, del mismo modo, en niños entre 5 y 14 años de 2,16 en 1934 a 0,92 en 1945 por 100.000 (21). Esto representó una disminución notable si se considera que este período coincidió con la Segunda Guerra Mundial en Europa, cuando la incidencia de TB en personas aumentó en Europa, incluso en los Países Bajos, y entre el personal militar de los Estados Unidos, antes de volver a caer (10, 11, 22).
La tuberculosis zoonótica por M. bovis sigue siendo un problema incluso en el mundo desarrollado. Por ejemplo, en los Estados Unidos, la infección humana por M. bovis se ha erradicado en su mayoría, pero no completamente, con la pasteurización de la leche combinada con el sacrificio de rebaños con animales con pruebas cutáneas positivas desde aproximadamente 1917 (15). Los casos humanos de M. bovis generalmente representan el <1% de todos los aislados humanos en los Estados Unidos, principalmente en inmigrantes, y predominantemente ubicados en sitios extrapulmonares (ganglios cervicales y mesentéricos, el peritoneo y el tracto genitourinario), aunque alrededor del 50% de los adultos solo presentarán TB pulmonar (23). Un análisis de las tendencias de la TB de 1980 a 1991 (23) y de 1994 a 2005 (24) en el condado de San Diego demostró que la tasa anual de cultivo de M. bovis positiva como proporción de todos los casos de TB aumentó anualmente, de 3% en el estudio anterior a 5% en 1994 y a 11% en 2005 (p < 0.001). Entre 1994 y 2005, 8% (265/3.291) de los casos positivos en cultivo se confirmaron con M. bovis y 92% (3.026/3.291) con M. tuberculosis (24). Sin embargo, la incidencia de M. bovis fue mayor en niños <15 años (45%) que en adultos (6%). Los autores del estudio advirtieron que esto puede ser una subestimación, ya que el cultivo solo tuvo éxito en el 80% de los casos según las definiciones de casos clínicos nacionales y locales, con un cultivo no exitoso sobrerrepresentado en aquellos que de otro modo tendrían más probabilidades de tener TB por M. bovis. Por lo general, solo los adultos murieron durante el tratamiento con una mortalidad en los casos de M. bovis dos veces más alta que en los casos de M. tuberculosis. Las personas de etnia hispana representaron el >96% de los casos de tuberculosis por M. bovis, y el 60% ocurrió en aquellos de origen mexicano conocido. Además, los factores asociados con la TB por M. bovis incluyeron tener enfermedad extrapulmonar con una radiografía de tórax normal que sugiere que la fuente de infección fue probablemente oral con el consumo de productos lácteos mexicanos no pasteurizados identificados como el principal factor de riesgo. Los autores sugirieron que para garantizar la eliminación de esta transmisión zoonótica, se requería a largo plazo la regulación de la producción de productos lácteos no pasteurizados y la erradicación de la tuberculosis bovina en el ganado lechero (24). Del mismo modo, en Irlanda en 2005, se detectó un caso de dos niños infectados por una vaca con solo un alto recuento de células somáticas como evidencia de la presencia de M. bovis en su leche (25). En este caso, sin embargo, toda la leche suministrada por el rebaño estaba pasteurizada y, por lo tanto, el consumo de leche cruda era solo un riesgo zoonótico para la familia de la granja. Fue la detección, en una prueba intradérmica de tuberculina comparativa única (SICTT) de rutina de terneros positivos que también habían sido alimentados con leche cruda en la granja, que era el centinela en este caso, lo que motivó una investigación del estado de TB de los miembros de la familia en la granja (25). M. bovis también se ha detectado en la leche de cabras lecheras tanto en el tanque de leche a granel como en la leche de una cabra infectada con tuberculosis individual (26). El riesgo de tuberculosis zoonótica es igualmente aplicable a los productos lácteos crudos de cualquier especie en un país o región con M. bovis endémica y, por lo tanto, la regulación de la producción de productos lácteos no pasteurizados, y la eliminación de la tuberculosis en el ganado es un requisito a largo plazo para eliminar esta fuente de infección. De hecho, en un entorno wCon una alta prevalencia de tuberculosis bovina, detectándose tanto M. bovis como M. tuberculosis en la leche que constituye un riesgo zoonótico (27), y de acuerdo con los objetivos de la OMS, y como ya sugirió Soxhlet en 1886 (28), ¿deberían todas las agencias insistir en la pasteurización de la leche? Esto ayudaría a reducir la exposición infantil a micobacterias patógenas, mejoraría la salud humana, reduciría los ingresos hospitalarios y los costos de tratamiento asociados con la tuberculosis, y reduciría las muertes evitables.
La leche no es la única fuente de tuberculosis zoonótica en los seres humanos. Por ejemplo, en Michigan en 2008, se detectaron dos humanos con la cepa genotípicamente consistente de M. bovis circulando en el ciervo de cola blanca de Michigan. Esto confirmó que la exposición recreativa a los ciervos es un riesgo de infección en los seres humanos; Por lo tanto, los cazadores, tramperos, taxidermistas, procesadores de carne de venado y consumidores de carne de venado estarían potencialmente en riesgo (29). De hecho, la transmisión entre especies de M. tuberculosis, humano-animal-humano, es un problema de salud pública, especialmente con una estrecha interacción humano-animal, especialmente en lugares como circos, instalaciones de animales exóticos y zoológicos donde puede haber contacto entre animales susceptibles a la tuberculosis y humanos (30-37). Cuando no existe un programa eficaz de erradicación en el ganado, el aislamiento rutinario de M. tuberculosis de múltiples bovinos plantea la posibilidad de transmisión de persona a vacuno a persona y el espectro de un mayor riesgo zoonótico si las cepas de M. tuberculosis se adaptan a bovinos u otros animales. Tales hallazgos subrayan la importancia de adoptar programas efectivos de control y erradicación de la TB tanto en humanos como en ganado (38–42). De hecho, la amenaza de la tuberculosis zoonótica dio lugar a la adopción de una resolución de la OIE en 1983 que pedía la erradicación de M. bovis por razones de salud pública y económicas (43).
La tuberculosis en humanos, sin ninguna participación animal, todavía existe en Europa. Un aumento del 50% de la prevalencia de la tuberculosis en Londres de 1999 a 2010 llevó a Londres a ser descrita por The Telegraph como la capital de la tuberculosis de Europa. En ese momento, la incidencia de casos de tuberculosis detectados en Londres rivalizaba o incluso superaba la de Ruanda, Eritrea, Irak y Guatemala (44). Los grupos de mayor riesgo eran los presos, los consumidores de drogas, los ancianos, las personas sin hogar, los refugiados, los migrantes y los marginados por la sociedad. Se argumenta que el componente nacido en el extranjero no entró en GB habiendo sido infectado previamente, sino que se unieron a comunidades en riesgo, incluidos los más pobres en términos de vivienda, nutrición y situación económica. Esto refleja que, incluso en la era moderna, la TB aún mantiene su relación con la privación (44). El advenimiento de la infección por VIH condujo a un resurgimiento dramático de la TB en humanos (11). Hoy en día, a pesar del desarrollo de métodos avanzados de detección, diagnóstico y tratamiento, se considera que un tercio de la población mundial, o más de dos mil millones de personas, está infectada por la tuberculosis (3, 45). En 2014, 1,5 millones de personas, incluidos 0,4 millones de personas seropositivas, murieron de tuberculosis; 140.000 de estas muertes fueron en niños (3, 45). En todo el mundo, se estimó que durante 2014 unos 9,6 millones de personas se habrían enfermado como un nuevo caso de tuberculosis (incluido 1 millón de niños) y, sin embargo, menos de dos tercios (63%) de ese número o solo 6 millones fueron reportados a la OMS. Esto significa que hay un déficit mundial del 37% en el diagnóstico y / o notificación de nuevos casos. A nivel mundial, ha habido una reducción gradual en el número de casos incidentes con una tasa de prevalencia de TB que es un 42% más baja en 2015 que en 1990. Sin embargo, hubo marcadas diferencias entre los países con alta y baja incidencia de TB, con la Región de África con el 28% de los casos del mundo en 2014 y la carga más grave en relación con la población. Hubo 834 casos en Sudáfrica y 852 en Lesotho por cada 100.000 habitantes, es decir, un promedio de 281 casos por cada 100.000 personas en la región, o más del doble del promedio mundial de 133 (3, 45).
TB en el ganado bovino
Aunque el ganado bovino es generalmente considerado como los verdaderos huéspedes de M. bovis, la TB debida a otros miembros del MTBC, principalmente M. bovis o Mycobacterium caprae pero más recientemente también M. tuberculosis, se ha reportado en muchas otras especies de animales domesticados y salvajes y sigue siendo una zoonosis significativa (30–42). Al igual que con los humanos, la tuberculosis en los animales es contagiosa y se propaga por contacto. La vía habitual de infección es por inhalación, pero también se produce infección oral. La progresión de la enfermedad es prolongada, tardando meses o años en matar a un animal infectado. Mientras tanto, la transmisión ocurre antes de que se manifiesten los signos clínicos (46, 47). Los síntomas, cuando son evidentes en los bovinos, incluyen los siguientes: pérdida progresiva de peso, pérdida de apetito, tos intermitente, ganglios linfáticos inflamados, debilidad, fiebre fluctuante de bajo grado y diarrea (48). La infección también produce efectos menos evidentes, como una reducción del rendimiento de la leche del 10-20 %, una reducción de la fertilidad, una canal más ligera (valor reducido) con condenas de canales en el sacrificio y restricciones en los mercados (49). En algunos animales, los ganglios linfáticos, como el retrofaríngeo y otros, se agrandan y pueden romperse y drenar; Si los ganglios linfáticos superficiales están involucrados, entonces el drenaje será evidente. Los ganglios linfáticos inflamados también pueden obstruir los vasos sanguíneos, las vías respiratorias o el tracto digestivo. Cuando se trata del tracto digestivo, se puede observar hinchazón, diarrea periódica y / o estreñimiento. En las etapas terminales, puede ocurrir emaciación extrema y dificultad respiratoria aguda. La tuberculosis puede ser una causa importante de pérdidas económicas tanto para los propietarios de ganado individuales como para los países. La observación de los síntomas se hace menos evidente una vez que comienza un programa de erradicación, que incluye pruebas con animales vivos y la eliminación de los infectados (46).
Desarrollo de pruebas de tuberculina
En 1720, Benjamin Marten propuso que un ser vivo microscópico capaz de sobrevivir en un nuevo cuerpo era la causa de la tuberculosis, este «ser» se denominó animácula (50). Sin embargo, hubo una gran incredulidad de esta propuesta. En 1882, 162 años después, Koch demostró que era cierto cuando aisló el «bacilo tuberculoso» (10, 11, 15, 51). Al mismo tiempo, Koch declaró que los bacilos tuberculosos y las formas humana y bovina de la tuberculosis eran idénticos. La declaración de Koch aparentemente ignoró el trabajo de 1868 de Jean Antoine Villemin, un médico francés, quien describió la mayor virulencia de la tuberculosis bovina en conejos en comparación con la tuberculosis humana (15). En 1890, Koch cultivó el bacilo en un caldo de glicerol al 5%, posteriormente se evaporó en un baño de vapor a una décima parte de su volumen y se filtró. El filtrado resultante, la tuberculina antigua de Koch (KOT), contenía la fracción soluble del bacilo tuberculoso en una solución de glicerol al 50%. Koch, que también tenía TB, demostró las propiedades de KOT, desarrollado como un medio para tratar y prevenir la TB; y, habiéndose inyectado su tuberculina, observó que desarrolló «un ataque inusualmente violento de ague y aumento de la temperatura corporal»; También observó que la inyección subcutánea en muchos pacientes tuberculosos había provocado reacciones sistémicas, incluida la hipertermia (10). Casi simultáneamente, la posibilidad de utilizar esta propiedad de la tuberculina para analizar la tuberculosis en el ganado fue rápidamente reconocida por veterinarios en Rusia, Dinamarca, Gran Bretaña y los Estados Unidos, y se encontró una herramienta para ayudar a erradicar la tuberculosis bovina (10, 11, 15). Sin embargo, Koch inicialmente consideró que la reacción cutánea provocada por KOT «no era notable e insignificante», ni reconoció su importancia como herramienta de diagnóstico (52). Durante un largo período, se creyó comúnmente que «el valor terapéutico de las tuberculinas está íntimamente asociado con la reacción de la tuberculina», como «la respuesta fisiológica del organismo animal sensibilizado» (52). Sin embargo, sin la demostración de ningún éxito terapéutico medible, pronto fue desacreditado como ineficaz (10).
En febrero de 1891, McFadyean había comenzado experimentos en ganado; utilizando casos clínicos de TB como sujetos, procedió a inyectar varias cantidades de tuberculina en la pared torácica habiendo establecido primero el pulso y la temperatura del animal (53). Procedió a monitorear la condición, el pulso y la temperatura de los animales cada 2 h durante 36 h en total. Observó un ascenso constante de la temperatura durante las primeras 14 h después de la inyección, cuando la temperatura observada alcanzó su punto máximo y se mantuvo alta durante otras 4 h y que, a las 48 h, la temperatura había vuelto a la normalidad. También registró una hinchazón inflamatoria en el lugar de la inyección, aumento de la sensibilidad (Se) de las glándulas agrandadas y que, durante la fase febril, el pulso permanecía elevado con acción cardíaca irregular pero que por lo demás los animales parecían sanos. Además, informó de una vaca tuberculosa que tenía las «lesiones tuberculosas más extensas» pero que no había mostrado ningún aumento de temperatura a pesar de recibir las mismas dosis de tuberculina que los otros casos sujetos. Observó que en casi todos los casos «se obtuvo una reacción en los animales tuberculosos, mientras que en ningún caso hubo aumento de temperatura en los animales no tuberculosos de control». También señala que «los animales tuberculosos parecen haber estado en una etapa bastante avanzada de la enfermedad, pero aún queda por probar si alguna reacción discernible seguirá a la inyección del líquido de Koch cuando las lesiones son de pequeña extensión» (53).
Bang introdujo la prueba de tuberculina, utilizando KOT, como la herramienta de diagnóstico de elección en el primer programa oficial de erradicación de la tuberculosis bovina en Dinamarca a principios de la década de 1890 (54). Este fue el primer programa a escala nacional en reconocer el potencial diagnóstico de la tuberculina para el cual Koch había estado tratando previamente de demostrar cualidades terapéuticas (51). El llamado «método Bang» consistía en pruebas repetidas, semestrales, para identificar a los animales con resultado positivo. Esto permitió la separación de las vacas con resultado positivo de las vacas con resultado negativo y el sacrificio de todos los casos abiertos de tuberculosis y ganado con «TB de la ubre». Por lo tanto, limitar la transmisión de la infección a través de la leche. Fue todo un logro a principios de 1900 que pudo certificar las primeras granjas que dieron negativo durante varios años y que eran adecuadas para vender «leche superior» o leche para bebés. Permitir que los animales se mantuvieran mientras eran «rentables» hizo que la participación fuera asequible y fue un factor esencial para obtener apoyo entre los agricultores y las lecherías (54). A raíz de los informes [Ref. (55) como ejemplo] sobre los logros utilizando este enfoque, el «método Bang» fue aceptado internacionalmente como la principal herramienta de diagnóstico en el control de la tuberculosis bovina. El uso repetitivo de pruebas de tuberculina sigue siendo la base de todos los programas de control de la tuberculosis bovina hasta el día de hoy. A finales de 1891, las pruebas de ganado utilizando KOT ya estaban operando ampliamente; y el profesor Eber, veterinario de Berlín, informaron de una especificidad de la prueba (Sp) de aproximadamente el 87% después de haber recopilado estadísticas sobre el ganado analizado (15).
Palmer y Waters proporcionan una revisión concisa e interesante de los orígenes del programa de erradicación de la tuberculosis bovina en los Estados Unidos y los muchos factores de la patogénesis y la epidemiología de la tuberculosis bovina, conocidos o al menos hipotetizados (sorprendentemente exactos) ya en 1899 (15). Las primeras pruebas en el ganado consistieron en inyectar «tuberculina» por vía subcutánea en la región escapular derecha y requirieron que el veterinario hiciera varias mediciones de temperatura previas a la inyección seguidas de mediciones regulares durante 24 h después de la inyección para controlar cualquier aumento de la temperatura corporal. Sin embargo, la variabilidad en el cambio de temperatura para la prueba subcutánea presagió dificultades asociadas con esta aplicación. Entre 1892 y 1915, los métodos de prueba comenzaron a variar dramáticamente, culminando en el lamento de que «el valor de la prueba dependía demasiado de la capacidad, competencia y experiencia del examinador» (15). A pesar de estas limitaciones, la prueba de tuberculina subcutánea, utilizada en un programa de prueba y sacrificio en el Distrito de Columbia, redujo la prevalencia de la enfermedad de 18.87% en 1909 a 0.84% en 1918. Como era de esperar, la idea de probar el ganado para erradicar la tuberculosis bovina no estuvo exenta de oponentes. Algunos creían que era innecesario detectar la tuberculosis bovina en las primeras etapas de la enfermedad, en lugar de abogar solo por un examen físico por parte de los veterinarios para determinar los altos derramadores para la eliminación (que recuerda a las discusiones actuales relacionadas con otra enfermedad micobacteriana: la enfermedad de Johne). Otros, dada la naturaleza crónica de la enfermedad, consideraron que el enfoque estadounidense de prueba y sacrificio era demasiado duro, o argumentaron que el control de la enfermedad debería ser administrado por los propietarios de los rebaños y no por el gobierno. Al mismo tiempo, circularon numerosos rumores y conceptos erróneos sobre la prueba. La objeción más apasionada es que la prueba era inexacta, que (aparentemente) las vacas sanas dieron positivo y las vacas enfermas dieron negativo para que la prueba aniquilara la población de ganado y resultara en déficits en leche y carne (15). Palmer y Waters describen cómo los comerciantes de ganado sin escrúpulos y otros, incluidos algunos veterinarios, se especializaron en eludir o incluso no realizar pruebas para que los animales infectados pudieran venderse como si hubieran sido probados (15). Incluso hoy, más de un siglo después, los programas de erradicación de la tuberculosis bovina se enfrentan a desafíos notablemente similares, incluidos rumores como los descritos por Palmer y Waters (15). Estos incluyen conceptos erróneos, actividades descuidadas, ilegales o fraudulentas, demandas de mayor eficiencia (menos costosas, más fáciles de realizar) y pruebas más efectivas (100% precisas), quejas con respecto a la prueba Sp, más que Se, indemnización, supervisión, falta de fondos y de personal.
A principios de 1900 se produjo una explosión en los intentos de desarrollar un medio alternativo para probar el ganado, presumiblemente reflejando las demandas de los veterinarios y la industria en general, para una prueba menos onerosa y más precisa, no solo en los Estados Unidos como informó Palmer (15) sino en otros lugares. En 1908, Charles Mantoux, un médico francés, descubrió que la tuberculina inyectada por vía intradérmica era efectiva para diagnosticar la TB (56). También en 1908, Foth informó que el 50% de los animales infectados que no habían respondido a la prueba cutánea respondieron a la prueba oftálmica (57). En 1909, Joseph dio una descripción completa de la prueba en el cuello y registró los resultados en el ganado, basándose en las mediciones del pliegue de la piel en el sitio de la inyección (58). Joseph también discutió algunos otros métodos como el método cutáneo desarrollado por von Pirquet, donde el antígeno se aplica muy superficialmente, el método conjuntival de Wolff-Eisner, la prueba de Escherich, y la de Roemer y Joseph donde la tuberculina se inyectó por vía subcutánea, y los métodos intradérmicos propuestos tanto por Mendel como por Moussu y Mantoux en 1908 (58). Con muchos de los métodos anteriores, Joseph comenta que la eficacia depende del grado de absorción y que, con una cantidad muy variable de antígeno en la tuberculina, la interpretación no era confiable. Joseph también señaló que la intensidad de la reacción no está directamente relacionada con la cantidad o gravedad de las lesiones y señaló que las infecciones recientes parecen estar asociadas con reacciones particularmente fuertes. Propuso que las inyecciones intradérmicas se hicieran en la región lateral del cuello y una interpretación para la prueba. Además, Joseph explicó las ventajas de la prueba intradérmica sobre la prueba subcutánea siendo: no es necesario determinar la temperatura corporal, una ventana de tiempo más amplia para medir la reacción, la reacción dura más y es más confiable, no hay gota de leche asociada con reacciones positivas, menos antígeno requerido y, por lo tanto, más barato (58). En el mismo año (1909), Römer también publicó dos artículos en apoyo de la prueba intradérmica que establecen criterios positivos, no concluyentes y negativos para la interpretación de la prueba (59, 60). Christiansen, en 1910, también comentó sobre el uso del pliegue caudal por Mantoux, Moussu y otro autor francés Vallée, pero observó que el uso del lado del cuello era más conveniente y pasó a describir el rendimiento físico de la prueba, la naturaleza y el tipo de respuesta en animales infectados utilizando la prueba intradérmica en el cuello (61). En 1910, Christiansen y Stub informaron sobre investigaciones sobre el uso de la prueba de tuberculina oftálmica, que involucró a 852 animales, siendo aparentemente altamente específica y más fácil de realizar y repetir con más frecuencia que la prueba habitual. Aunque no estaba claro lo que consideraban la prueba habitual, afirmaron que la prueba habitual era más sensible (62). Informaron que las reacciones oftálmicas fueron observables débilmente a las 6-12 h y más fuertes de 12 a 24 h después de la inoculación. Sin embargo, con su tuberculina, solo el 50% de los animales lesionados respondieron a la prueba, lo que les llevó a comentar la variación en la eficacia de la tuberculina (Se y Sp) dependiendo de la cepa y las técnicas de preparación de tuberculina utilizadas (62). Después de la producción de KOT se produjeron varias otras tuberculinas; la emulsión de Bacillus, el filtrado de caldo y el residuo de tuberculina, todos estandarizand a una cantidad definida (en miligramos) de sólidos por volumen (52). En 1914, Haring y Bell lamentaron con respecto a la prueba subcutánea en California, donde todavía se utilizaba, que «no se puede aplicar satisfactoriamente a terneros jóvenes o a ganado silvestre, mientras que durante la estación cálida en algunos de los valles interiores la prueba ha sido insatisfactoria incluso cuando se aplica a vacas lecheras dóciles» (63). La desaparición de la prueba subcutánea y la adopción de la prueba intradérmica, utilizando el método del pliegue caudal como prueba de detección para el ganado en los EE.UU. era inminente. La prueba del pliegue caudal se utilizó cada vez más a partir de 1917 y se adoptó como medio oficial para probar el ganado en 1921 (15). Más detalles de estas pruebas y otros materiales sobre el uso temprano de la tuberculina en el diagnóstico y tratamiento de la tuberculosis, desde finales de 1800 hasta alrededor de 1913, se pueden encontrar entre los libros olvidados (64).
En su discurso presidencial de 1934 ante la Royal Society of Medicine, Buxton comentó sobre las diversas sustancias denominadas «tuberculina» que provocan una reacción sistémica o local dependiendo de cómo se administraron (65). Continuó discutiendo la reacción intradérmica de la tuberculina diciendo que «la reacción intradérmica se puede obtener en cualquier parte de la superficie del cuerpo, pero ciertas regiones son obviamente preferidas». Buxton notó que Moussu y Mantoux habían sugerido el pliegue subcaudal en el ganado que todavía se usa ampliamente, especialmente en los Estados Unidos, mientras que otros (Ligniéres, Roemer, Joseph, Bang, Jensen y Christiansen) preferían el lado del cuello. Buxton explicó la naturaleza altamente específica de la reacción de la tuberculina, que «es capaz de indicar la presencia de infección tuberculosa en poco menos del 100% de los individuos infectados», mientras que al mismo tiempo reconoce que no todos los casos de TB en hombres o animales darían una reacción positiva y que ocasionalmente las reacciones pueden ser «observadas en personas y ganado aparentemente sanos». Advirtió también que la inyección subcutánea de tuberculina puede causar desensibilización a las pruebas en algunos animales; que el orden comparativamente bajo de la respuesta cutánea a la tuberculina en el ganado vacuno requiere el uso de una tuberculina muy potente; que puede haber una disminución temporal en la reacción en las inmediaciones de una inyección intradérmica que se extiende a aproximadamente un radio de 2 pulgadas de la inyección original, una desventaja obvia en el uso del pliegue caudal debido al área restringida adecuada para la inyección; y que la aparición de respuesta no específica puede superarse mediante el uso de un medio de cultivo sintético y la precipitación en la producción de tuberculina. En ese momento, Buxton ya hablaba de la herencia de una predisposición a la infección, así como de esa relación con el desarrollo de la enfermedad después de la infección (65).
En 1942, siguiendo el trabajo reportado en 1939 por Buxton y Glover (66) que atribuyeron una precisión del 87-97% a la prueba de la tuberculina y recomendaron el uso de tuberculina media sintética (también mejor purificada usando métodos de precipitación), las instrucciones para realizar el SICTT en GB fueron que la tuberculina debía ser «inyectada en el tercio medio de un lado del cuello en una línea paralela a la columna vertebral del La escápula, la tuberculina aviar se inyecta aproximadamente 4 «por debajo de la cresta del cuello y los mamíferos aproximadamente 5″ por debajo de la aviar» (67). Parece que los británicos habían repetido, para el SICTT, gran parte del trabajo realizado por Christiansen y Stub antes de 1910, para el SIT y, en 1947, Francis confirmó que la interpretación de la prueba para el SICTT y el tiempo óptimo de lectura se «basó en un gran número de ensayos seguidos por el examen postmortem» (8). La Directiva comercial de la UE (4) incluye una asignación de ±72 h para leer a ambos lados de las 68 h, pero no en la OIE (69).
En 1950, Larsen et al. (70) atribuyen el primer uso del cuello como sitio para la inyección intradérmica a Joseph en 1909 y a Christiansen y Stub en 1910 quienes, según Buxton y Glover (66), determinaron el lado del cuello como óptimo para la inyección intradérmica porque este sitio proporcionaba la discriminación más consistente para la presencia o ausencia de infección de TB. Además, Larsen et al. (70) al plantearse evaluar si se podía encontrar un área de la piel que fuera más sensible a la tuberculina que el pliegue caudal señalaron que ya, en 1909, Foth (57) había señalado las deficiencias en el uso del pliegue caudal. Evaluaron el sitio Se a johnin (un agente de diagnóstico para la infección por Mycobacterium avium subsp. paratuberculosis, análogo a la tuberculina) y la tuberculina en novillos sensibilizados a la paratuberculosis o a la TB delineando cinco regiones a cada lado de cada animal con ocho sitios de inyección en cada región, excepto el pliegue caudal que tenía un solo sitio (70). En total, se realizaron 66 inyecciones en cada animal (Figura 1), y se analizaron los resultados. Las reacciones más grandes ocurrieron en la región del cuello y mostraron que la piel del cuello es la más sensible, mientras que el pliegue caudal fue el menos sensible (70).
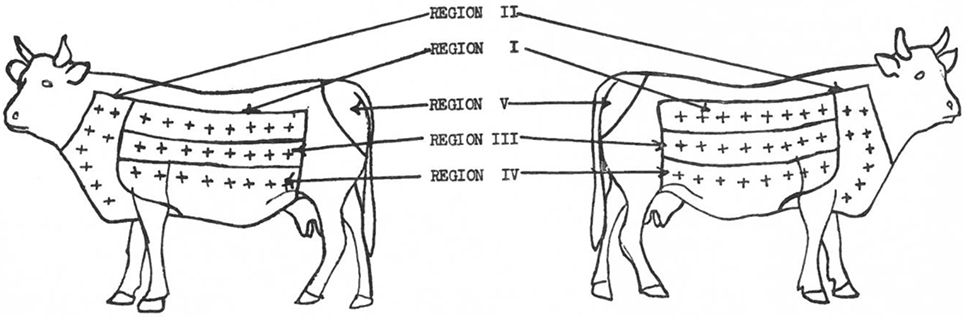 FIGURA 1. Ubicación de las regiones de la piel en los lados derecho e izquierdo de los animales. Sitios de inyección en cada región = +. [Reimpreso con permiso de la AVMA (Am J Vet Res (1950) 11:301 – Larsen et al. (70))].
FIGURA 1. Ubicación de las regiones de la piel en los lados derecho e izquierdo de los animales. Sitios de inyección en cada región = +. [Reimpreso con permiso de la AVMA (Am J Vet Res (1950) 11:301 – Larsen et al. (70))].
En 1951, Baisden et al. (71), aunque reconocieron que Johnson (72), Wadley (73) y Larsen et al. (70) ya habían determinado individualmente que diferentes áreas de la piel del ganado difieren en su Se a la inyección intradérmica de tuberculina siendo el cuello el sitio más sensible, reevaluaron el Se del cuello, la espalda, los lados superior e inferior del ganado a la inyección intradérmica de tuberculina. Sin embargo, además de incluir animales sensibilizados a M. bovis y M. paratuberculosis, agregaron animales sensibilizados a M. tuberculosis, M. avium y Mycobacterium phlei al estudio «porque estos organismos habían sido considerados en relación con casos de lesiones no visibles». Los hallazgos fueron que el cuello era significativamente más sensible que cualquier otro sitio para todos, excepto el grupo sensibilizado con M. paratuberculosis donde el sitio no era de importancia. También comentaron que el pliegue caudal «no era tan probable que provocara reacciones de animales de bajo Se» (71).
En 1959, Richie (67) también describió varios métodos alternativos de prueba de tuberculina, todos ahora descartados del uso general en el ganado, empleados en esfuerzos por encontrar una prueba más eficiente, efectiva y menos lenta que la prueba subcutánea que dependía de múltiples registros de temperatura a lo largo del tiempo. Describió una prueba térmica corta en la que se redujeron los controles de temperatura, la prueba de von Pirquet (tuberculina aplicada a la piel escarificada), pruebas oftálmicas y palpebrales (basadas en la intolerancia a la luz), aumento del lagrimeo, congestión posiblemente marcada, secreción que corre por la cara en el ojo probado, es decir, conjuntivitis severa (todavía utilizada en primates), la prueba de Stormont y la prueba vulvar. Detalló la doble prueba intradérmica (una segunda dosis de tuberculina inyectada en la hinchazón producida por la primera generalmente después de un período de 48 h), también mencionada por Buxton y Glover (66) y Francis (8) como una modificación de la prueba de 1910 de Christiansen y Stub, pero según Francisco comentó que «nunca se ha demostrado satisfactoriamente que sea de ninguna manera superior, » a la prueba única y probablemente tendió «a reducir el Sp de la reacción». No fue adoptado en ninguna parte como una prueba oficial hasta que GB lo hizo después de un informe del Consejo de Investigación Médica en 1925. El uso de la palabra «simple» en el título de la SIT y SICTT fue para distinguir estas pruebas de la prueba intradérmica doble anterior (67).
El cuello también fue reconfirmado como el sitio más sensible por Paterson en 1959 (74) quien también detalló un Se más alto en los sitios anteriores (hacia la cabeza) del cuello y que Se cae en los sitios posteriores (más cerca del hombro) y en aquellos adyacentes a la cresta nucal; Por lo tanto, determinó el tercio medio del cuello como el sitio óptimo de inyección. Esto, a su vez, fue subrayado por Ritchie en el mismo año (67), y es por eso que la OIE exige que la prueba para el ensayo de potencia de la tuberculina en el ganado rote a través de cada uno de los 16 sitios «aplicando ocho inyecciones intradérmicas por animal en ambos lados del cuello y empleando un diseño cuadrado latino completo equilibrado» para eliminar cualquier influencia del sitio de los cálculos según sea necesario (69, 75). En 1960, Larsen et al. informaron que a medida que aumentaba el número de inyecciones simultáneas, el tamaño promedio de la reacción que cada una provocaría disminuía (76). Esta es la razón por la cual la selección de animales infectados con TB, para su uso en el rendimiento de ensayos de potencia, se limita a aquellos que muestran reacciones más grandes. No fue hasta 1979, tras la adhesión de Gran Bretaña, Irlanda y Dinamarca, a la CEE, que se aceptó el SICTT además de la prueba única de tuberculina intradérmica (TIE) para la Directiva comercial (68).
Good et al. (77), al comparar PPD de diferentes fabricantes, inyectaron PPD aviar/bovino de control y de ensayo en el mismo animal: el control en el borde anterior del tercio medio del cuello y la tuberculina de ensayo en el borde posterior y, utilizando la misma tuberculina en ambos sitios en un grupo de animales, demostró que las lecturas del sitio anterior eran mayores que en los sitios posteriores y, por lo tanto, confirmó el trabajo anterior de Paterson (74). Good et al. (77) también mostraron que es particularmente importante para la interpretación consistente de SICTT que ambas inyecciones estén en el mismo plano paralelo a la columna vertebral de la escápula, confirmando así la afirmación de Ritchie de que las inyecciones debían realizarse en una línea aproximadamente paralela a la línea del hombro (67, 77). Más recientemente, Casal et al. analizaron el efecto, en bovinos de rebaños oficialmente libres de TB e infectados con TB, del sitio de inoculación de PPD bovino en el aumento del grosor del pliegue cutáneo. En los rebaños infectados con TB, hubo una mayor probabilidad de resultados positivos y reacciones más grandes cuando las inyecciones se realizaron más cerca de la cabeza en el área anterior del cuello, confirmando nuevamente el efecto del sitio (78). Se utilizan sitios/métodos alternativos para el ensayo de tuberculina en otras especies, por ejemplo, cerdos: la base de la oreja; aves: en el zarzo; Perros y gatos: monitoreo de la temperatura corporal. Sin embargo, hay muy pocos datos disponibles sobre la estandarización de las metodologías de prueba o los criterios de interpretación para especies distintas del ganado y poco o ningún trabajo realizado en la evaluación de Se, Sp, valor predictivo positivo, registro de seguridad o criterios de autorización para su uso bajo la legislación de medicamentos y, por lo tanto, la confiabilidad de las pruebas cutáneas de tuberculina en especies distintas del ganado es discutible.
La OIE (69) establece ahora normas, aplicables al ganado vacuno, para:
(1) La prueba de hipersensibilidad retardada (es decir, la prueba de tuberculina o la TIE) como el método estándar para la detección de la tuberculosis bovina que «implica medir el grosor de la piel, inyectar tuberculina bovina por vía intradérmica en el área medida y medir cualquier hinchazón posterior en el sitio de inyección 72 h después».
(2) Rendimiento del SICTT cuando «la tuberculina bovina y aviar se utiliza principalmente para diferenciar entre los animales infectados por M. bovis y los sensibilizados a la tuberculina debido a la exposición a otras micobacterias o géneros relacionados» (por ejemplo, tal como se utiliza en Irlanda y el Reino Unido), incluida la información detallada sobre
(3) «Procedimiento de prueba: (i) Una técnica de inyección correcta es importante. ii) Los lugares de inyección deberán cortarse y limpiarse. (iii) Un pliegue de piel dentro de cada área recortada se mide con calibradores y el sitio marcado antes de la inyección. (iv) Una aguja corta, borde cónico hacia afuera y jeringa graduada cargada con tuberculina adherida, se inserta oblicuamente en las capas más profundas de la piel. Luego se inyecta la dosis de tuberculina». (v) «Una inyección correcta se confirma palpando una pequeña hinchazón similar a un guisante en cada sitio de inyección. (vi) La distancia entre las dos inyecciones debe ser de aproximadamente 12-15 cm. En animales jóvenes en los que no haya espacio para separar suficientemente los sitios en un lado del cuello, se debe hacer una inyección a cada lado del cuello en sitios idénticos en el centro del tercio medio del cuello. vii) El grosor del pliegue cutáneo de cada lugar de inyección se vuelve a medir 72 h después de la inyección. viii) La misma persona debe medir la piel antes de la inyección y cuando se lee la prueba.
(4) Potencia de la tuberculina «La dosis recomendada de PPD bovina en bovinos es de al menos 2.000 unidades internacionales (UI) y en la prueba comparativa de tuberculina, las dosis no deben ser inferiores a 2.000 UI cada una»; «En bovinos con SE alérgica disminuida, se necesita una dosis más alta de tuberculina bovina, y en las campañas nacionales de erradicación, se recomiendan dosis de hasta 5,000 UI» y
(5) Ensayo de potencia, incluida la necesidad de realizar ensayos en el ganado de la especie objetivo.
Al realizar una prueba de tuberculina, es importante que la tuberculina utilizada sea adecuada para su propósito (46). Esto fue reconocido previamente en 1908 cuando se lamentó que «parte de la tuberculina en el mercado es impotente y sin valor» y Buxton también comentó sobre la calidad de la tuberculina en 1934 (65, 79). Por desgracia, tal tuberculina de calidad inferior, incluso no autorizada, bajo cualquier legislación de medicamentos reconocida, todavía se puede encontrar en el mercado y se utiliza para «certificar» la ausencia de enfermedad (80-82). Good et al. (83) compararon «el impacto de diferentes potencias de una sola tuberculina PPD bovina en el rendimiento de campo de» SICTT y SIT y encontraron «una diferencia significativa en el número de reactores detectados utilizando las tuberculinas de alta y baja potencia». Además, «la tuberculina de baja potencia en el SICTT no detectó el 20% de 35 animales con lesiones visibles» y «el 11% de los animales con lesiones visibles no mostraron una respuesta bovina positiva (>4 mm) y habrían sido negativos para la TIE» con estos últimos animales elegibles para la certificación como libres de TB para la exportación según las normas de la UE (68, 83). En este estudio, «las estimaciones de potencia del bioensayo de conejillo de indias fueron imprecisas» con solo «un acuerdo limitado entre el conejillo de indias y los bioensayos de ganado» realizados en ganado naturalmente infectado (83).
La prueba Se y Sp sólo debe evaluarse adecuadamente en las condiciones y en las especies en las que se realiza la prueba, y se debe tener precaución al extrapolar Se y Sp de un entorno y/o la tuberculina de un fabricante y/o una potencia, y/o un tipo de prueba de tuberculina a otra (46). Sin embargo, el hecho de centrarse en las lesiones «visibles» y «no visibles», y en los animales positivos para TIE/SICTT que no están confirmados como TB infectados por un laboratorio ha dado lugar a dudas sobre la Sp, el valor predictivo positivo y la fiabilidad de todas las pruebas de tuberculina y, con frecuencia, se intenta «confirmar» la prueba de tuberculina en animales positivos antes de su eliminación, utilizando pruebas de un Se mucho más bajo. Esto, en muchos lugares, ha tenido un enorme impacto negativo en los programas de control de la tuberculosis. En muchas áreas infectadas por TB, el enfoque se ha desplazado a maximizar la prueba de Sp, incluso frente a la infección activa en un rebaño, para minimizar el número de animales lesionados «no visibles» que se identifican para su eliminación en lugar de buscar el máximo Se para prevenir la transmisión, librar a un rebaño de TB lo más rápido posible y prevenir futuras averías. Goodchild et al. (84) proporcionaron algunos datos útiles sobre el Se y Sp del SICTT en el programa de erradicación de la tuberculosis bovina de Gran Bretaña, a saber, que en GB, la Sp a nivel animal es de 99,983 (interpretación estándar) y 99,871 (interpretación ultragrave), lo que significa que cabe esperar un falso positivo en la interpretación estándar por cada 4.760–7.690 animales no infectados analizados; que entre el 91,1% y el 93,7% de los reactores están realmente infectados con TB (es decir, valor predictivo positivo en la prueba); que la lesión visible o los resultados positivos de cultivo en solo el 30-40% de los reactores «subestiman profundamente la proporción de reactores que están verdaderamente infectados»; que una pequeña mayoría (>50%) de las Rs negativas para NVL/cultivo están infectadas y que a nivel de rebaño el SP es del 99,2-99,5% (tamaño promedio de la prueba) y del 96,5% para las pruebas de rebaño más grandes (250 animales) (84). O’Reilly ya había evaluado el SICTT Se en condiciones irlandesas como 91 y 98% Se (interpretación estándar y severa, respectivamente) (85). Costello et al. obtuvieron resultados similares, al repetir el estudio, 90,9% Se (89,6 y 91,2—interpretación estándar y severa, respectivamente) (86). Ambos estudios sacrificaron y examinaron a todos los animales (221 y 353, respectivamente) involucrados (85, 86). Se reconoce que los experimentos para establecer las pruebas Se y Sp para un entorno particular son costosos y requieren mucha mano de obra, y que pocos implican el sacrificio de todos, incluido el ganado que no reacciona, señalando que es poco probable que los animales recientemente infectados tengan lesiones visibles o que se confirmen en cultivo (87). En Irlanda, la experiencia de campo evidencia que solo una fracción del 1% de los reactores positivos para el SICTT a nivel nacional son falsos positivos (88), el SICTT Sp se ha calculado como 99.8-99.9% y se ha demostrado matemáticamente en una población aceptada no libre de enfermedad, como al menos 99.95% (85, 89).
Prosiguen las investigaciones sobre el desarrollo de pruebas nuevas, más precisas y sensibles, menos dependientes de la medición de la respuesta inmune in vitro (ensayo de liberación de interferón γ bovino o ELISA de anticuerpos) o in vivo (pruebas cutáneas) que están menos sujetas a los caprichos del rendimiento operativo individual y la interpretación subjetiva (90). Se ha encontrado que la aplicación estratégica del ensayo IFN-γ (IGRA), que al igual que la prueba cutánea de tuberculina lee la respuesta mediada por células a los antígenos y, como tal, es un medio en etapa temprana para detectar la infección, es un complemento útil para la prueba de tuberculina (91-97). Así, en años más recientes, el ensayo se ha utilizado en países europeos, de conformidad con la legislación, y también en otros lugares para facilitar la eliminación temprana de animales infectados que de otro modo serían negativos para la prueba cutánea de tuberculina en rebaños problemáticos y acelerar la eliminación de la tuberculosis bovina en brotes (68). Sin embargo, el Sp de este ensayo ha impedido, hasta la fecha, su uso como prueba de detección y la investigación continúa en el uso de antígenos específicos para abordar problemas de Sp, pero, al menos hasta cierto punto, es probable que esto sea a expensas de la prueba Se (94, 97). Si bien las pruebas in vitro, basadas en tuberculina o no, son adecuadas para especies domésticas, las dificultades logísticas con su aplicación variarán de una región a otra y entre diferentes razas y sistemas de cultivo, por ejemplo, la disponibilidad de laboratorios adecuados con costos asociados puede ser un problema, y el tiempo que se tarda desde el muestreo de sangre hasta la presentación de muestras puede ser crítico para el ensayo de IFN-γ con laboratorios que probablemente estén a cierta distancia de los rebaños infectados. Por lo tanto, para un futuro considerable, es muy probable que la prueba cutánea de tuberculina siga siendo la prueba de detección de elección para el ganado de granja.
Sin embargo, las pruebas cutáneas de tuberculina rara vez son adecuadas para su uso en especies silvestres debido a la necesidad de tener acceso al animal para leer la prueba algunos días después de la inyección de tuberculina. Por lo tanto, es necesario desarrollar métodos de prueba como las pruebas inmunológicas in vitro para su uso en especies silvestres o de mantenimiento salvajes como lo han hecho para los bovinos (87, 98). Los avances científicos permiten evaluar nuevas matrices, como la secuenciación de alto rendimiento de las células mononucleares de sangre periférica, también el potencial diagnóstico de la inmunotinción con anti-MPT64 en varias muestras de tejido para la infección por M. tuberculosis (99). Queda por ver si tales pruebas se agregarán al arsenal de pruebas en la batalla contra la TB en alguna o todas las especies en las que ocurre. Hay varias revisiones de todas las pruebas disponibles actualmente, incluido el uso de pruebas ELISA para detectar una respuesta humoral, por lo tanto, una prueba de detección en etapa posterior a la IFN-γ, y el efecto de una TIE o SICTT previa en la respuesta ELISA o IFN-γ (100-107).
Impedimentos para la erradicación de la tuberculosis bovina
Si bien la tuberculosis bovina se ha erradicado con éxito en muchos países, otros, a pesar de hacer grandes esfuerzos, han tenido menos éxito (108, 109). Palmer (110) ha descrito la tuberculosis como una enfermedad reemergente en la interfaz de los animales domésticos y la vida silvestre, advirtió que no será posible erradicar M. bovis, o presumiblemente M. caprae, del ganado hasta que se detenga la transmisión entre la vida silvestre y los animales domésticos, y aconseja que para lograrlo se requerirá un «esfuerzo de colaboración entre las partes interesadas» (110). En 1958, Francisco (111) hablando de las dificultades en la erradicación final de la tuberculosis, también recomendó que la tuberculosis tenía que ser tratada en todas las especies para lograr el éxito completo. Por lo tanto, la necesidad de abordar la transmisión de la tuberculosis entre la fauna silvestre y los animales domésticos no es un concepto o sugerencia nueva. Es ampliamente aceptado que para un control efectivo de la TB la enfermedad debe abordarse en todas las especies, en las que la infección se establece y se vuelve autosostenible (especies de mantenimiento infectadas) y que abordar la enfermedad en una sola especie en un ecosistema con múltiples especies de mantenimiento infectadas no promoverá un resultado exitoso (110). En consecuencia, otras especies que comparten el medio ambiente con el ganado deben ser evaluadas para identificar posibles huéspedes de mantenimiento y, cuando otras especies constituyan un impedimento para la erradicación final de la tuberculosis bovina, se deben desarrollar y/o adaptar estrategias de control apropiadas (112–115). Deben tenerse en cuenta las experiencias de otros países con problemas similares (113, 116). La tuberculosis, causada por varios miembros del MTBC, se ha reportado en la vida silvestre en varios países de Europa que están trabajando para erradicar la tuberculosis bovina (109, 117, 118). Cada vez es más evidente que la tuberculosis endémica en las poblaciones de vida silvestre está planteando una limitación significativa para la erradicación final de la enfermedad en el ganado. Además, ahora se reconoce que M. caprae no está restringida a las cabras españolas, ya que se han aislado cepas de este organismo de bovinos, jabalíes, cerdos y humanos. Su aparición también se ha notificado en Francia, Austria, Alemania y otros lugares (119).
Como era de esperar, la tuberculosis no se ha propagado uniformemente a la vida silvestre, y se ha convertido en un problema mayor en aquellos países y regiones donde la erradicación de la tuberculosis bovina comenzó relativamente tarde, donde la agricultura implicaba el pastoreo de ganado, donde compartían el medio ambiente con la vida silvestre susceptible, donde la densidad de la vida silvestre y los patrones de comportamiento (no necesariamente los mismos incluso para la misma especie en todos los ecosistemas) los pusieron en contacto con ganado infectado. y, en particular, cuando no se alojaba ganado. Los piensos suministrados al ganado también habrían estado disponibles para la fauna silvestre local, y esto habría puesto a la vida silvestre y al ganado en contacto más estrecho de lo que podrían haber sido de otro modo (120). En otros ecosistemas, la sequía fomenta la congregación de especies de ganado y vida silvestre en pozos de agua y / o donde todavía hay pastos / alimento disponibles. Los cadáveres tuberculosos y/o las entrañas serían, incluso hoy en día, una fuente potencial de infección para la vida silvestre. Esto es particularmente un problema para las especies carnívoras y carroñeras como los leones y los linces en África y España, respectivamente (121, 122). Por lo tanto, la tuberculosis también tiene importantes implicaciones de conservación para algunas especies, por ejemplo, el lince ibérico (Lynx pardinus) en España (123), otras especies en áreas de conservación en Sudáfrica (121) y para el antílope lechwe en la cuenca Kafue Zambia (124).
A medida que disminuye la prevalencia de enfermedades en el ganado, los esfuerzos de erradicación a veces se ven obstaculizados por la transmisión de M. bovis y / o M. caprae de la vida silvestre al ganado. En términos epidemiológicos, la enfermedad puede persistir en algunas especies de vida silvestre, creando reservorios de enfermedades, si se alcanzan la tasa de reproducción básica de la enfermedad y los umbrales críticos de tamaño de la comunidad huésped. Los esfuerzos de erradicación de la tuberculosis bovina requieren la eliminación de la transmisión de M. bovis entre los reservorios de vida silvestre y el ganado cuando esté presente (125). Algunas especies silvestres, principalmente el tejón en el Reino Unido e Irlanda, la zarigüeya australiana (Trichosurus vulpecula) en Nueva Zelanda (pero no en Australia) y el búfalo de agua (Bubalus bubalis) en Australia anteriormente, han sido reconocidas como reservorios significativos de M. bovis con infección endémica de automantenimiento en estas especies que constituyen un obstáculo importante para los programas de control de enfermedades (114, 126 y 127). En Australia, la eliminación de búfalos de agua salvajes, no una especie nativa, y del ganado salvaje de áreas donde la infección era endémica fue un componente importante de la campaña de erradicación y Australia ahora está libre de tuberculosis bovina (114, 116, 126-128). Nueva Zelandia ha empleado medidas de control de la población igualmente estrictas contra las poblaciones de zarigüeyas infectadas, lo que ha dado lugar a progresos considerables (117, 126, 128, 129). El estado de Michigan, EE.UU., había sido un estado libre de tuberculosis desde 1979, sin ganado tuberculoso detectado durante 5 años, cuando un cazador encontró un ciervo infectado con tuberculosis en 1994. La población local de ciervos estaba infectada endémicamente con M. bovis y también se detectó un derrame en las granjas ganaderas locales (130). En consecuencia, se han recomendado medidas de mitigación del riesgo en la explotación contra la transmisión de la tuberculosis de los ciervos al ganado (131). Portugal ha notificado que el jabalí (Sus scrofa) y el ciervo (principalmente ciervo colorado, Cervus elaphus), ambas especies clave de ungulados silvestres de caza, están infectados con M. bovis o M. caprae en las importantes regiones de caza de mayor densidad donde la prevalencia de TB en el ganado también es más alta (118). Las observaciones en España mostraron que las cepas de MTBC que se originaron en bovinos y caprinos también circulan en las poblaciones simpátricas de fauna silvestre y que, además, 6 de cada 11 espotipos se parecían a los tipos descritos en los casos de tuberculosis humana. El aislamiento de cepas MTBC (pertenecientes a M. bovis o a M. caprae), en fincas cercadas, de cérvidos y jabalíes que no han tenido contacto con ganado doméstico durante al menos dos décadas, sugiere fuertemente que estas micobacterias son capaces de sobrevivir independientemente en estas poblaciones. Por lo tanto, cuando están infectados por TB, la vida silvestre, incluidos los cérvidos y los jabalíes, debe considerarse en la epidemiología y el control de la TB (117).
Haciendo uso de tecnologías de detección molecular, Santos et al. demostraron una contaminación generalizada por MTBC en muestras ambientales de la Península Ibérica. Esto respalda la aparición de transmisión indirecta como mecanismo contribuyente al mantenimiento de la TB en un sistema de patógenos de múltiples huéspedes (132). Las muestras positivas de ADN MTBC fueron proporcionalmente más altas en el área infectada por TBB que en el área presuntamente negativa (0,32 y 0,18, respectivamente) (132). En 2010, se informó de la primera detección de M. bovis en un jabalí salvaje en el Reino Unido en un área donde el mismo espotipo se había aislado previamente de gamos, zorro, ratón de madera y turón (133). Los estudios en condiciones climáticas naturales en Michigan, donde se había detectado tuberculosis por M. bovis en ciervos de cola blanca en libertad, demostraron que la bacteria M. bovis sobrevive el tiempo suficiente para representar un riesgo de exposición para el ganado y / o la vida silvestre. Esto refuerza la evidencia que sugiere que la bioseguridad en las granjas de ganado y los esfuerzos para eliminar la alimentación suplementaria de ciervos de cola blanca disminuirán el riesgo de transmisión de TB entre estas poblaciones (134). En 2016, investigadores franceses informaron haber encontrado muestras ambientales positivas para la presencia de cepas MTBC y M. bovis en el entorno de granjas afectadas por tuberculosis bovina en un área restringida dentro de la región de Côte d’Or donde circulan genotipos compartidos de M. bovis en un sistema de múltiples huéspedes que incluye tejones, jabalíes y ciervos (135). La persistencia de la detección durante un período de 8 meses, a pesar de la ausencia de la supuesta fuente de infección, sugirió que el ADN detectado podría pertenecer a células viables. La detección de señales positivas de MTBC en el 10% de las muestras de agua de manantiales de agua naturales y el agua que acompaña el flujo en pastizales donde tanto el ganado como la vida silvestre tenían acceso apoya el papel del agua en la diseminación de MTBC en el medio ambiente y en la contaminación animal, tal vez incluso por la formación e inhalación de bioaerosoles. La prevalencia media de detección en el suelo de tejón y en las letrinas de tejón fue del 7,3 y el 7%, respectivamente. Estas fueron las prevalencias más altas detectadas entre 356 muestras ambientales evaluadas (135). Un trabajo similar en el Reino Unido había evaluado anteriormente que las correlaciones entre la prevalencia de TB del grupo social de tejones según lo determinado por el ensayo qPCR de muestras fecales de letrinas de tejón y los resultados de pruebas de diagnóstico individuales o combinadas de tejones atrapados sugerían que la primavera era el período óptimo de muestreo de letrinas, con el otoño como un respaldo de confirmación aceptable con 100 y 80%, Se respectivamente (136). Investigadores de la Universidad de Warwick realizaron qPCR paralela de heces y cultivo en muestras tomadas de tejones en áreas con altos niveles de prevalencia de tuberculosis bovina en la República de Irlanda, lo que indica que la excreción fecal es un buen indicador de la excreción respiratoria (137). Además, los antílopes Kafue lechwe (Kobus leche Kafuensis), en peligro de extinción, en la cuenca de Kafue en Zambia, donde el ganado y los antílopes pastan juntos durante los meses más secos, se han descrito como reservorios salvajes de tuberculosis bovina (124). La gestión de la fauna silvestre destinada a reducir la densidad de animales sensibles dentro de una zona infectada puede contribuir al control de las enfermedades infecciosas en los animales y, en caso de zoonótica, a su propagación a los seres humanos (125). Los problemas encontrados en la lucha contra la enfermedad en elLas especies que participan en el mantenimiento de enfermedades y la transmisión entre especies serán particulares del ecosistema en el que residen, y es probable que cada ecosistema presente sus propios desafíos y, de hecho, influencias socioeconómicas (46). La vacunación de la fauna silvestre es una opción que se está explorando y el Reino Unido e Irlanda están cooperando en el desarrollo de una estrategia de vacunación de tejones (138-140) en lugar del sacrificio continuo, con miras a disminuir la incidencia de tuberculosis en tejones para reducir la transmisión al ganado. En España se está trabajando en el desarrollo de una vacuna contra el jabalí (141). Si se puede desarrollar una vacuna para tejones o jabalíes, con el tiempo, también puede modificarse para su uso en otras especies silvestres (120).
Los ejemplos anteriores ilustran que atribuir las deficiencias aparentes en los programas de erradicación de la tuberculosis bovina al fracaso de la prueba de tuberculina, como sucede a menudo, en regiones o condados que albergan huéspedes de mantenimiento infectados puede estar fuera de lugar. Más bien, el verdadero valor de la prueba de tuberculina es como un indicador de la presencia de TB en la población bajo prueba. La identificación de la fauna silvestre infectada como la fuente de dicha infección no es la función de la prueba y es más bien la función de una investigación epidemiológica sólida sobre la fuente de la tuberculosis.
Una sola salud
En los primeros años del siglo XXI, la tuberculosis bovina se ha reducido en gran medida a una enfermedad de importancia económica limitada en el mundo desarrollado, y los controles causan más irritación que la propia enfermedad. Los países más pobres se enfrentan a un impacto multifacético de la tuberculosis, que no sólo tiene un impacto económico significativo, sino que también afecta potencialmente a la salud del ganado, los seres humanos y los ecosistemas simultáneamente y que es probable que aumente en presencia de enfermedades debilitantes como el VIH / SIDA y otros factores que afectan negativamente los medios de vida humanos (142). La interacción entre los seres humanos, el ganado, la vida silvestre y la ecología en la epidemiología de la tuberculosis zoonótica hace que la tuberculosis sea un objetivo ideal para el enfoque «Una sola salud». Tal enfoque permitiría el desarrollo de programas de control de enfermedades que involucren poblaciones animales y humanas, y permitiría expandir el conocimiento científico, mejorar la educación médica y la atención clínica, y el desarrollo de programas efectivos de control de enfermedades para poblaciones humanas y animales (143). One Health se ocupa de la esencia misma de la TB como zoonosis: seguramente es axiomático que la transmisión de enfermedades compartidas entre especies humanas y animales debe abordarse en múltiples niveles en lugar de centrarse solo en humanos o solo en especies animales específicas o micobacterias particulares que pueden causar TB y que los factores ambientales, ecológicos y sociológicos deben considerarse en el desarrollo de programas efectivos de control de enfermedades.
El concepto One Health reconoce los importantes vínculos entre la salud humana, animal y ambiental y proporciona una estrategia importante en la mitigación y prevención de epidemias. Fue descrito por el veterinario Schwabe (1927-2006) en su libro «Medicina veterinaria y salud humana», donde propuso un enfoque unificado humano y veterinario contra las enfermedades zoonóticas. Sin embargo, el concepto no es nuevo. Rudolf Virchow (1821-1902), quien acuñó el término «zoonosis», dijo que «entre la medicina animal y humana no hay líneas divisorias, ni debería haberlas». James Law (1838-1921) profesor de Medicina Veterinaria en Cornell educado en la Escuela de Medicina y el Colegio Veterinario de la Universidad de Edimburgo, así como en las escuelas veterinarias de Francia, creía en «una medicina» donde los médicos y veterinarios deberían tener relaciones cercanas. El trabajo de Law sobre la tuberculosis en los Estados Unidos tuvo un profundo efecto en la salud animal y humana. Del mismo modo, a principios de la década de 1890, uno de los objetivos de Bernhard Bang enumerados como parte del «método Bang» de control / erradicación de la TB en bovinos era limitar la transmisión de la infección de TB a través de la leche y, por lo tanto, vender específicamente leche más segura para los bebés (54). La vacuna BCG, desarrollada atenuando M. bovis, de origen bovino, utilizada desde 1921 para proteger a los humanos de la tuberculosis, fue desarrollada por el médico francés Albert Calmette y el veterinario Jean-Marie Camille Guérin. Su colaboración demostró el concepto de «un medicamento» o «Una sola salud» en acción, a pesar de que los antecedentes veterinarios de Guérin y los problemas familiares de TB se ignoran en gran medida (144). Basil Buxton, veterinario, se dirigió a la Royal Society of Medicine en 1934 sobre el papel de la tuberculina en el control de la tuberculosis en la sección de Medicina Comparada (65). Sin embargo, si bien el concepto parece haber sido adoptado por las comunidades médicas y veterinarias en el siglo XIX, parece haber caído en desgracia durante el siglo XX cuando los esfuerzos de colaboración entre las profesiones disminuyeron (144). Sin embargo, el concepto de «una medicina» sobrevivió y se extendió a «Una Salud» cuando el Washington Post, en 2003, acreditó a William Karesh, que era veterinario y presidente del Grupo de Trabajo sobre Enfermedades de la Fauna Silvestre de la Organización Mundial de Sanidad Animal (OIE), por decir: «La salud humana, ganadera o silvestre ya no se puede discutir de forma aislada. Solo hay una salud y las soluciones requieren que todos trabajen juntos en todos los diferentes niveles».
La tuberculosis no se limita a una población huésped, y todos los miembros del MTBC pueden afectar a múltiples huéspedes y, por lo tanto, pueden amenazar la salud humana y animal a través de la transmisión entre especies. Es importante tanto para el sector de la sanidad animal como para el de la salud humana, ya que requiere el control mundial de la tuberculosis en todas las poblaciones de acogida (145). Reconociendo el valor de la coordinación intersectorial para abordar las amenazas complejas para la salud, la FAO, la OIE y la OMS formaron una colaboración tripartita en 2010 para desarrollar el concepto de Una sola salud y su visión de tener un trabajo multidisciplinario colaborativo sobre la salud de los seres humanos, los animales y los ecosistemas reduciendo el riesgo de enfermedades en las interfaces entre ellos. Este Tripartito FAO-OIE-OMS se evalúa y actualiza anualmente. Su visión compartida de «Una sola salud» es la de «un mundo capaz de prevenir, detectar, contener, eliminar y responder a los riesgos para la salud pública y animal atribuibles a las zoonosis y enfermedades animales con un impacto en la seguridad alimentaria a través de la cooperación multisectorial y asociaciones sólidas que comparten responsabilidades y coordinan actividades mundiales para abordar los riesgos para la salud en las interfaces animal-humano-ecosistemas» (146). En 2014, la OMS adoptó sus objetivos de «poner fin a la tuberculosis» de poner fin a la epidemia de tuberculosis para 2030, lograr una reducción del 95% en las muertes por tuberculosis y una reducción del 90% en los casos de tuberculosis para 2035, y ha determinado que se necesita un enfoque integral que incluya vacunas nuevas y más efectivas, así como mejores diagnósticos y tratamientos (147).
En octubre de 2017, en la 48.ª Conferencia Mundial de la Unión sobre Sanidad Pulmonar (148) se lanzó la primera hoja de ruta para combatir la tuberculosis zoonótica, es decir, la tuberculosis en animales y su transmisión a los seres humanos. Esta hoja de ruta multidisciplinaria desarrollada por cuatro grupos que comprenden la OMS, la OIE, la FAO y la Unión Internacional contra la Tuberculosis y las Enfermedades Pulmonares (La Unión) representa un hito en la lucha contra la tuberculosis tanto en personas como en animales. Se basa en los Objetivos de Desarrollo Sostenible de las Naciones Unidas para mejorar la salud en todo el mundo, incluido el objetivo de poner fin a la epidemia mundial de tuberculosis para 2030, tal como se define en la Estrategia de la OMS para poner fin a la tuberculosis (147), que reconoce que las personas en riesgo de tuberculosis zoonótica son una población desatendida que merece mayor atención. La hoja de ruta utiliza un «enfoque de Una sola salud» para abordar los riesgos para la salud de la tuberculosis en todos los sectores a fin de reducir la carga de la tuberculosis zoonótica, salvar vidas y asegurar los medios de subsistencia. La hoja de ruta establece 10 prioridades para abordar la tuberculosis zoonótica en 3 epígrafes principales: 1) mejorar la base de pruebas científicas, 2) reducir la transmisión en la interfaz animal-humano, y 3) fortalecer los enfoques intersectoriales y colaborativos. De acuerdo con otros (16, 19, 21), la hoja de ruta reconoce que la carga humana de morbilidad no puede reducirse sin la gestión del reservorio animal, pero también subraya que los principales obstáculos técnicos y científicos, incluido el desarrollo de pruebas de diagnóstico novedosas y asequibles, deben superarse y validarse como eficaces en condiciones de campo.
De hecho, la transmisión de M. tuberculosis de humano a animal a humano todavía ocurre, y es un riesgo continuo, especialmente en países donde existe una estrecha interacción de humanos con animales y, es de particular preocupación para la salud pública, en lugares como zoológicos, circos e instalaciones de animales exóticos donde puede haber contacto entre animales susceptibles a la TB y humanos (30–37). Cuando no existe un programa eficaz de erradicación operacional en el ganado vacuno, la presencia rutinaria de M. tuberculosis en muestras de múltiples bovinos plantea la posibilidad de transmisión de persona a persona y la posible adaptación de cepas de M. tuberculosis en tejidos bovinos u otros tejidos animales, lo que subraya la importancia de adoptar programas eficaces de control y erradicación de la tuberculosis en seres humanos y ganado por igual (38–41).
Las discusiones sobre «¿El riesgo para los humanos justifica el alto costo de combatir la TB?» exigen que «Es necesario demostrar los beneficios de detener la tuberculosis bovina» y afirman que «el control de la tuberculosis bovina en el ganado es irrelevante como política de salud pública» (149-151) sirven para demostrar que las lecciones aprendidas con tanto esfuerzo de la historia se han olvidado en gran medida y que el mensaje de «Una sola salud» sobre el riesgo que representa para la salud humana (144) no penetra en todas las partes. La pasteurización de la leche bovina por sí sola probablemente no será suficiente para proteger la salud pública si cesan los controles de TB basados en múltiples especies y/o si se desarrolla una cepa de M. tuberculosis adaptada por paso a través de bovinos o alguna otra especie domesticada o silvestre que es aún más virulenta para el hombre y/o también ha desarrollado resistencia a los antimicrobianos. El intercambio estratégico de datos y los debates en los que participen las autoridades veterinarias y de salud pública reforzarían la vigilancia de la tuberculosis tanto en las poblaciones animales como en las humanas (152).
La conservación de la vida silvestre y la preservación del ecosistema también pueden beneficiarse de un enfoque de Una sola salud. La Wildlife Conservation Society reconoce el vínculo inextricable entre la conservación, la salud humana y la salud de los animales salvajes y domésticos (146). Un solo patógeno podría acabar con las últimas poblaciones de una especie en peligro de extinción y, a su vez, amenazar la estabilidad de las poblaciones humanas locales. La tuberculosis se encuentra entre su «docena mortal» de enfermedades potencialmente letales que podrían propagarse. Las condiciones económicas, ambientales y ecológicas pueden promover el contacto entre la vida silvestre y el ganado y, a su vez, aumentar la transmisión de la tuberculosis en la interfaz ganado-vida silvestre. Los aumentos numéricos o las concentraciones espaciales de la población de vida silvestre pueden aumentar la competencia entre la vida silvestre y el ganado por el agua y los alimentos, lo que potencialmente promueve la propagación de la TB directa o indirectamente debido a la capacidad de las micobacterias para sobrevivir fuera de un huésped durante un período. Los estudios han demostrado que los animales en los reservorios de vida silvestre son capaces de excretar micobacterias que pueden servir como fuente de infección para otros animales (153, 154). El concepto de la Wildlife Conservation Society «One World, One Health» es una iniciativa holística que gestiona los problemas de salud humana, silvestre y de los animales domésticos de acuerdo con una verdad fundamental: «One Health™» que afecta a todos es la salud de los ecosistemas del planeta y aconseja que «el monitoreo de la salud de la vida silvestre nos proporciona un medio sensible y cuantitativo para detectar cambios en el medio ambiente. Sin vida silvestre, es posible que no veamos lo que viene hasta que haya ocurrido una crisis. El monitoreo de la vida silvestre proporciona una nueva lente para ver lo que está cambiando a nuestro alrededor para ayudar a los gobiernos, las agencias mundiales de salud y las comunidades regionales a detectar amenazas y mitigarlas antes de que se conviertan en crisis de salud» (34, 35, 154).
Conclusión
En conclusión, como Sternberg-Lewerin (145) lo expresó sucintamente, «Un enfoque de Una Salud está claramente justificado para la TB. La enfermedad tiene consecuencias igualmente graves para los seres humanos y una amplia gama de especies animales, y se ha defendido firmemente como un problema de One Health». La tuberculosis y, en particular, la tuberculosis zoonótica era, y sigue siendo, importante; poner fin a la epidemia de tuberculosis en los seres humanos y la erradicación de la tuberculosis en el ganado bovino y otros animales son objetivos valiosos para la salud humana, las zoonosis, el bienestar animal y las razones socioeconómicas, y son ideales para un enfoque de «Una sola salud» que requiere una acción de colaboración interdisciplinaria/multidisciplinaria médica y veterinaria humana. Compartir habilidades y recursos, aumentar la interacción entre la salud pública y los veterinarios, particularmente en situaciones de recursos limitados, puede crear conciencia sobre el «riesgo compartido» de TB entre humanos y animales y ayudaría a reducir la duplicación innecesaria de esfuerzos (143, 155). Para controlar con éxito la TB, todas las causas de TB, todos los miembros del MTBC deben abordarse en todas las especies en las que se produce la TB. Ignorar una especie afectada por el embalse y las lecciones de la historia es cortejar el desastre.
Los científicos pioneros que revolucionaron el diagnóstico de esta enfermedad hace más de cien años fueron notables, de hecho tan notables que sigue siendo un desafío para los científicos de hoy desarrollar una «mejor prueba» o un «mejor» reactivo de prueba. La OMS ha determinado que «será necesario superar los principales obstáculos técnicos y científicos, con la validación de la eficacia en condiciones de campo. Esto requerirá el desarrollo de pruebas de diagnóstico asequibles en paralelo para diferenciar a los animales infectados de los vacunados». El objetivo establecido en la hoja de ruta (148) para la disponibilidad de nuevos ensayos de diagnóstico para el ganado es 2025. Sin embargo, hasta que esto se logre, la prueba cutánea de tuberculina seguirá siendo necesariamente el medio más utilizado para determinar el estado de infección de TB de animales domésticos vivos. La necesidad de reducir la carga de la tuberculosis zoonótica, salvar vidas y asegurar los medios de subsistencia es demasiado importante para esperar el posible desarrollo de nuevos ensayos de diagnóstico para el ganado antes de renovar los esfuerzos para eliminar la infección en el ganado. Las pruebas de tuberculina son seguras de usar y la elección de qué tipo de prueba de tuberculina está determinada por el ecosistema en el que se utilizará. Por lo tanto, el reto consiste en garantizar que la tuberculina en el mercado siga cumpliendo las normas exigidas. La potencia de la tuberculina es crítica para probar el rendimiento y, por lo tanto, la determinación precisa de la potencia es particularmente importante. Ya no debe permitirse la venta y el uso de tuberculinas de potencia inferior. La prueba cutánea debe seguir estando disponible, con buenos niveles de Se y Sp, para aquellos que están lejos de laboratorios sofisticados y con pocos recursos para que pueda seguir desempeñando un papel en el control de la tuberculosis en el ganado junto con la pasteurización de la leche para consumo humano y las medidas de salud pública para proteger la salud humana y los medios de vida. Además, como sugiere la hoja de ruta para la tuberculosis zoonótica, «el papel de los reservorios de vida silvestre y los posibles enfoques para el control a través de la vacunación dirigida también podrían investigarse más a fondo para encontrar soluciones sostenibles para combatir la enfermedad y salvaguardar la conservación de la vida silvestre».
Contribuciones del autor
MG y AD concibieron el estudio. MG, DC y DB realizaron la búsqueda bibliográfica y compilaron los datos. MG redactó el manuscrito preliminar. Todos los autores participaron en la revisión, edición, lectura y aprobación del borrador final, y colaboraron en la producción de la versión final.
Declaración de conflicto de intereses
Los autores declaran que esta revisión se realizó en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Reconocimientos
La asistencia del personal de la biblioteca de UCD que ayudó a obtener algunos de los libros y artículos originales se agradece, al igual que la asistencia de múltiples colegas que ayudaron a determinar lo que podría ser relevante para la búsqueda al proporcionar traducciones de varios textos en danés, francés y alemán. También agradecemos la asistencia de Diane A. Fagan de la Asociación Americana de Medicina Veterinaria por proporcionar permiso para reimprimir la Figura 1.
Referencias
1. Gutierrez MC, Brisse S, Brosch R, Fabre M, Omaïs B, Marmiesse M, et al. Origen antiguo y mosaicismo genético del progenitor de Mycobacterium tuberculosis. PLoS Pathog (2005) 1(1):e5. doi:10.1371/journal.ppat.0010005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Onyango RO. Estado del mundo: el seguimiento de la tuberculosis es la prueba del tiempo. J Glob Infect Dis (2011) 3(1):1–3. doi:10.4103/0974-777X.77287
3. Editorial (Lancet). La tuberculosis alcanza nuevos hitos, buenos y malos. Lancet Infect Dis (2015) 15:1361. doi:10.1016/S1473-3099(15)00431-4
4. Levy S. La evolución de la tuberculosis. Bioscience (2012) 62(7):625–9. doi:10.1525/bio.2012.62.7.3
5. Donoghue HD, Spigelman M, Greenblatt CL, Lev-Maor G, Kahila Bar-Gal G, Matheson C, et al. Tuberculosis: desde la prehistoria hasta Robert Koch, como lo revela el ADN antiguo. Lancet Infect Dis (2004) 4:548–92. doi:10.1016/S1473-3099(04)01133-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Bos KI, Harkins KM, Herbig A, Coscolla M, Weber N, Comas I, et al. Los genomas micobacterianos precolombinos revelan que las focas son una fuente de tuberculosis humana del nuevo mundo. Nature (2014) 514:494–7. doi:10.1038/nature13591
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Wirth T, Hildebrand F, Allix-Béguec C, Wölbeling F, Kubica T, Kremer K, et al. Origen, difusión y demografía del complejo Mycobacterium tuberculosis. PLoS Pathog (2008) 4(9):e1000160. doi:10.1371/journal.ppat.1000160
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Francis J. Bovine Tuberculosis: Incluyendo un contraste con la tuberculosis humana. Londres, Reino Unido: Staples Press Ltd. (1947).
9. Rothschild BM, Martin LD, Lev G, Bercovier H, Bar-Gal GK, Greenblatt C, et al. Mycobacterium tuberculosis complex DNA from an extinct bison date 17,000 years before the present. Clin Infect Dis (2001) 33:305–11. doi:10.1086/321886
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Daniel TM. La historia de la tuberculosis. Respir Med (2006) 100(11):1862–70. doi:10.1016/j.rmed.2006.08.006
11. Frith J. Historia de la tuberculosis. Parte 1 Tisis, consumo y peste blanca. Parte 2 Los sanatorios y los descubrimientos del bacilo tuberculoso. J Mil Vet Health (2014) 22(2):29–41.
12. Ernst HC. Infectiousness of Milk: Resultado de investigaciones realizadas para los fideicomisarios de la Sociedad de Massachusetts para la Promoción de la Agricultura. Cambridge, MA: The Riverside Press (1895).
13. Informes de salud pública. Pasteurización de la leche y la tasa de mortalidad por tuberculosis no pulmonar en la ciudad de Nueva York. Public Health Rep (1926) 41(36):1900–2.
14. Atkins P. Milk consumption and tuberculosis in Britain, 1850-1950. En: Fenton A, editor. Orden y desorden: implicaciones para la salud de comer y beber en los siglos XIX y XX. East Linton: Tuckwell Press (2000). págs. 83–95.
15. Palmer MV, Waters WR. Artículo de revisión: la tuberculosis bovina y el establecimiento de un programa de erradicación en los Estados Unidos: el papel de los veterinarios. Vet Med Int (2011) 2011:816345. doi:10.4061/2011/816345
16. Grange JM. Aspectos humanos de la infección por Mycobacterium bovis. En: Thoen CO, Steele JH, editores. Infección por Mycobacterium bovis en animales y humanos. Iowa: Iowa State University Press (1995). págs. 29–46.
17. Atkins PJ. Lobbying and resistance with regard to policy on bovine tuberculosis in Britain 1900-1939: an inside/outside model. In: Condrau F, Worboys M, editors. Tuberculosis Then and Now: Perspectives on the History of an Infectious Disease. Montreal, Quebec: McGill-Queen’s University Press (2010). viii, 248 p.
18. Waddington K. The science of cows: tuberculosis, research and the state in the United Kingdom, 1890-1914. Hist Sci (2001) 39(125 Pt 3):355–81. doi:10.1177/007327530103900305
19. Weinstein I. Eighty years of public health in New York City. Bull N Y Acad Med (1947) 23:221–37.
20. Hardie RM, Watson JM. Mycobacterium bovis in England and Wales: past, present and future. Epidemiol Infect (1992) 109:23–33.
21. Hoogendoorn D. De Invloed van de Pasteurisatie van Melk op de Sterftecijfers van Tuberculose (influence of milk pasteurization on tuberculosis mortality) Original in Dutch. Ned Tijdschr Geneeskd (1953) 97:1317–24.
22. Raviglione MC, Snider DE, Kochi A. Global epidemiology of tuberculosis: morbidity and mortality of a worldwide epidemic. JAMA (1995) 273(3):220–6. doi:10.1001/jama.273.3.220
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Dankner WM, Waecker NJ, Essey MA, Moser K, Thompson M, Davis CE. Infecciones por Mycobacterium bovis en San Diego: un estudio clínico-epidemiológico de 73 pacientes y una revisión histórica de un patógeno olvidado. Medicine (Baltimore) (1993) 72:11–37. doi:10.1097/00005792-199301000-00002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Rodwell TC, Moore M, Moser KS, Brodine SK, Strathdee SA. Tuberculosis de Mycobacterium bovis en comunidades binacionales, Estados Unidos. Emerg Infect Dis (2008) 14(6):909–16. doi:10.3201/eid1406.071485
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Doran P, Carson J, Costello E, More SJ. Un brote de tuberculosis que afecta al ganado y a las personas en una granja lechera irlandesa, tras el consumo de leche cruda. Irish Vet J (2009) 62:390–7. doi:10.1186/2046-0481-62-6-390
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Shanahan A, Good M, Duignan A, Curtin T, More SJ. Tuberculosis en cabras en una granja en Irlanda: investigación y control epidemiológico. Vet Rec (2011) 168:485–90. doi:10.1136/vr.c6880
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Srivastava K, Chauhan DS, Gupta P, Singh HB, Sharma VD, Yadav VS, et al. Aislamiento de Mycobacterium bovis y M. tuberculosis del ganado de algunas granjas en el norte de la India: posible relevancia en la salud humana. Indian J Med Res (2008) 128(1):26–31.
28. Soxhlet F. Über Kindermilch und Säuglings-Ernährung (sobre la leche para bebés y la nutrición infantil), original en alemán. Münchener medizinische Wochenschrift (1886) 33:253,276.
29. Wilkins MJ, Meyerson J, Bartlett PC, Spieldenner SL, Berry DE, Mosher LB, et al. Infección humana por Mycobacterium bovis y brote de tuberculosis bovina, Michigan, 1994–2007. Emerg Infect Dis (2008) 14(4):657–60. doi:10.3201/eid1404.070408
30. Darney PD, Greene JE. Brote de tuberculosis en un circo: informe de una investigación cooperativa. Am J Public Health (1973) 63(1):43–5. doi:10.2105/AJPH.63.1.43
31. Michalak K, Austin C, Diesel S, Bacon MJ, Zimmerman P, Maslow JN. Infección por Mycobacterium tuberculosis como enfermedad zoonótica: transmisión entre humanos y elefantes. Emerg Infect Dis (1998) 4(2):283–7. doi:10.3201/eid0402.980217
32. Ackerman LJ, Benbrook SC, Walton BC. Infección por Mycobacterium tuberculosis en un loro (Amazona farinosa). Am Rev Respir Dis (1974) 109(3):388–90.
33. Montali RJ, Mikota SK, Cheng LI. Mycobacterium tuberculosis in zoo and wildlife species. Rev Sci Tech (2001) 20(1):291–303. doi:10.20506/rst.20.1.1268
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Michel AL, Huchzermeyer HF. La importancia zoonótica de Mycobacterium tuberculosis: transmisión de humano a mono. J S Afr Vet Assoc (1998) 69(2):64–5. doi:10.4102/jsava.v69i2.819
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Wolf TM, Sreevatsan S, Travis D, Mugisha L, Singer RS. El riesgo de transmisión de la tuberculosis a los grandes simios en libertad. Am J Primatol (2014) 76(1):2–13. doi:10.1002/ajp.22197
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Zlot A, Vines J, Nystrom L, Lane L, Heidi Behm H, Denny J, et al. Tuberculosis en tres elefantes de zoológico y un contacto humano – Oregon, 2013. Morb Mortal Wkly Rep (MMWR) (2016) 64(52):1398–402. doi:10.15585/mmwr.mm6452a2
37. Oh P, Granich R, Scott J, Sun B, Joseph M, Stringfield C, et al. Exposición humana después de la infección por Mycobacterium tuberculosis de múltiples especies animales en un zoológico metropolitano. Emerg Infect Dis (2002) 8(11):1290–3. doi:10.3201/eid0811.020302
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Mittal M, Chakravarti S, Sharma V, Sanjeeth BS, Churamani CP, Kanwar NS. Evidencia de presencia de Mycobacterium tuberculosis en muestras de tejido bovino por PCR múltiple: posible relevancia para la zoonosis inversa. Transbound Emerg Dis (2014) 61(2):97–104. doi:10.1111/tbed.12203
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Chen Y, Chao Y, Deng Q, Liu T, Xiang J, Chen J, et al. Posibles desafíos al Plan Alto a la Tuberculosis para los seres humanos en China; el ganado vacuno mantiene M. bovis y M. tuberculosis. Tuberculosis (Edinb) (2009) 89(1):95–100. doi:10.1016/j.tube.2008.07.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Du Y, Qi Y, Yu L, Lin J, Liu S, Ni H, et al. Caracterización molecular del complejo Mycobacterium tuberculosis (MTBC) aislado de bovinos en noreste y noroeste de China. Res Vet Sci (2011) 90(3):385–91. doi:10.1016/j.rvsc.2010.07.020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Hlokwe TM, Said H, Gcebe N. Mycobacterium tuberculosis infection in cattle from the Eastern Cape Province of South Africa. BMC Vet Res (2017) 13:299. doi:10.1186/s12917-017-1220-3
42. Ghodbane R, Drancourt M. Non-human sources of Mycobacterium tuberculosis. Tuberculosis (Edinb) (2013) 93(6):589–95. doi:10.1016/j.tube.2013.09.005
43. Kleebergh HH. Tuberculosis humana de origen bovino en relación con la salud pública. Rev Sci Tech Off Int Epiz (1984) 3(1):11–32. doi:10.20506/rst.3.1.156
44. Comité de Salud de la Asamblea de Londres. Informe sobre la lucha contra la tuberculosis en Londres (2015). Disponible en: https://www.london.gov.uk/sites/default/files/tacklingtbinlondon-final_report.pdf (Consultado: 31 de enero de 2016).
45. Organización Mundial de la Salud. Informe Mundial sobre la Tuberculosis 2015 (2015). Disponible en: http://www.who.int/tb/publications/global_report/en/ (Acceso: 31 de enero de 2016).
46. Good M, Duignan A. Perspectives on the history of bovine TB and the role of tuberculin in bovine TB eradication. Vet Med Int (2011) 2011:11. doi:10.4061/2011/410470
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Pollock JM, Neill SD. Mycobacterium bovis infection and tuberculosis in cattle. Vet J (2002) 163:115–27. doi:10.1053/tvjl.2001.0655
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Une Y, Mori T. Tuberculosis as a zoonosis from a veterinary perspective. Comp Immunol Microbiol Infect Dis (2007) 30(5–6):415–25. doi:10.1016/j.cimid.2007.05.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Collins JD. Tuberculosis en el ganado vacuno: planificación estratégica para el futuro. Vet Microbiol (2006) 112:369–81. doi:10.1016/j.vetmic.2005.11.041
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Daniel TM. Pioneros de la medicina y su impacto en la tuberculosis: 45. Woodbridge: Boydell & Brewer (2000).
51. Koch R. Una nueva comunicación sobre un remedio para la tuberculosis. Br Med J (1891) 1(1568):125–7. doi:10.1136/bmj.1.1568.125
52. Parke Davis Company. Un manual de terapéutica biológica. Detroit: Parke y Davis Press (1914). Disponible en: https://archive.org/details/manualofbiologic00parkuoft (Acceso: 14 de octubre de 2017).
53. McFadyean J. Experiments with tuberculin on cattle. BMJ (1891) 1:634–5. doi:10.1136/bmj.1.1577.634
54. Bang B. Medidas contra la tuberculosis animal. Actas del Congreso Internacional sobre Tuberculosis. Washington, DC (1908).
55. Rutherford JG. Informe de la Comisión Internacional de Control de la Tuberculosis Bovina. Ottawa, Canadá: Departamento de Agricultura, Canadá, Salud de la Rama Animal. Oficina de Imprenta del Gobierno (1910).
57. Foth. Der praktische Wert der Tuberkulin-Augenprobe bei Rindern. Original en alemán (el valor práctico de la prueba de tuberculina en ojos de ganado). Zeitschrift für Tiermedizin (1908) XII Bd. XV:321–47.
58. Joseph K. Die diagnostische Bedeutung der intrakutanen Tuberkulinreaktion (original en alemán de la importancia diagnóstica de la tuberculina intradérmica). Berl tierärztl Wochenschr (1909) 46:847–51.
59. Römer PH. Über intrakutane Tuberkulinanwendung zu diagnostischen Zwecken (original en alemán: sobre la aplicación de tuberculina intradérmica con fines diagnósticos). Beiträge zur Klinik der Tuberkulose und spezifischen Tuberkulose-Forschung (1909) 12(1):185–92. doi:10.1007/BF01868277
60. Römer PH. Nachtrag zu der Arbeit «Über intrakutane Tuberkulinanwendung zu diagnostischen Zwecken» (original en alemán: adición al documento «on intradermal tuberculin application for diagnostic purposes»). Beiträge zur Klinik der Tuberkulose und spezifischen Tuberkulose-Forschung (1909) 12(1):193–4.
61. Christiansen M. Den intrakutane Tuberkulinreaktion hos Kvaeget (Original en danés: La reacción intracutánea de la tuberculina en el ganado) (Vol. 22). København: Meddelelser fra den kgl. Veterinaer-og Landbohøjskoles Serumlaboratorium, Maanedsskrift para Dyrlaeger (1910). págs. 337–52.
62. Christiansen, Stub. Tuberkulin-Ophthalmoreaktionens Vaerdi (Original en danés: Opthalmic Tuberculin Reactions) (Vol. 22). København: Meddelelser fra den kgl. Veterinaer-og Landbohøjskoles Serumlaboratorium, Maanedsskrift para Dyrlaeger (1910). págs. 161–80.
63. Haring CM, Bell RM. La prueba intradérmica para la tuberculosis en bovinos y porcinos. Boletín No. 243. Berkeley, California: Publicaciones de la Universidad de California, Facultad de Agricultura (1914). Disponible en: https://archive.org/stream/intradermaltestf243hari/intradermaltestf243hari_djvu.txt (Acceso: 24 de enero de 2016).
64. The Forgotten Books. Available from: https://www.forgottenbooks.com/en/books/TuberculininDiagnosisandTreatment_1000428301 (Accessed: October 20, 2017).
65. Buxton JB. Some aspects of the role of tuberculin in the control of tuberculosis. Section of comparative medicine, President’s address. Proc R Soc Med (1934) xxvIII:257–64.
66. Buxton JB, Glover RE. Tuberculin tests in cattle: observations on the intradermal tuberculin test in cattle with special reference to the use of synthetic medium tuberculin. A.R.C. Report Series No. 4 Privy Council Agricultural Research Council. London, England: His Majesty’s Stationary Office (1939).
67. Ritchie JN. Tuberculosis. In: Stableforth AW, Galloway IA, editors. Diseases due to Bacteria (Vol. 2), London: Buterworths (1959). p. 713–44.
68. Directiva comercial de la UE. Texto consolidado: Directiva del Consejo, de 26 de junio de 1964, relativa a problemas de policía sanitaria en materia de intercambios intracomunitarios de animales de las especies bovina y porcina (64/432/CEE) (1964). Disponible en: http://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:01964L0432-20150527&rid=1 (Acceso: 10 de octubre de 2017).
69. OIE. Manual Terrestre de Tuberculosis Bovina (Cap. 2.4.7) (2009). Disponible en: http://www.oie.int/fileadmin/Home/eng/Health_standards/tahm/2.04.06_BOVINE_TB.pdf (Acceso: 10 de octubre de 2017).
70. Larsen AB, Groth AH, Johnson HW. Respuesta alérgica a johnin y tuberculina de varias regiones de la piel del ganado. Am J Vet Res (1950) 11(40):301–3.
71. Baisden LA, Larsen A, Vardaman TH. Sensibilidad relativa de diferentes áreas de la piel del ganado bovino a las pruebas intradérmicas. Am J Vet Res (1951) 12:273–5.
72. Johnson HW. La aplicación de los resultados de la investigación en la erradicación de la tuberculosis bovina. Proc US Livestock Sanitary A Fifty-First Ann Meet (1947). págs. 261–6.
74. Paterson AB. Tuberculosis. En: Stableforth AW, Galloway IA, editores. Enfermedades debidas a bacterias (Vol. 2), Londres: Buterworths (1959). págs. 671–87.
75. Finney DJ. Métodos estadísticos en ensayos biológicos. 2ª ed. Londres, Reino Unido: Charles Griffin (1964).
76. Larsen AB, Vardaman TH, Harvey WR. Tamaño de la reacción de la tuberculina en relación con el número de inyecciones simultáneas de tuberculina. Am J Vet Res (1960) 21:1075–7.
77. Good M, Clegg TA, Murphy F, More SJ. El rendimiento comparativo de la única prueba intradérmica comparativa de tuberculina en bovinos irlandeses, utilizando combinaciones de tuberculina PPD de diferentes fabricantes. Vet Microbiol (2011) 151:77–84. doi:10.1016/j.vetmic.2011.02.028
Resumen de PubMed | Texto completo de CrossRef | Google Académico
78. Casal C, Alvarez J, Bezos J, Quick H, Diez-Guerrier A, Romero B, et al. Efecto del sitio de inoculación del derivado proteico purificado bovino (PPD) sobre el aumento del grosor del pliegue cutáneo en bovinos de rebaños oficialmente libres de tuberculosis e infectados por tuberculosis. Prev Vet Med (2015) 121(1–2):86–92. doi:10.1016/j.prevetmed.2015.07.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
79. Mohler JR. The Tuberculin Test of Cattle for Tuberculosis. Washington: Departamento de Agricultura de los Estados Unidos: Oficina de Impresión del Gobierno (1909).
80. Bakker D, Eger A, Mcnair J, Riepema K, Willemsen PTJ, Haagsma J, et al. Comparación de PPD disponibles comercialmente: consideraciones prácticas para el diagnóstico y control de la tuberculosis bovina. 4th International Conference on Mycobacterium bovis (Póster). Dublín, Irlanda (2005).
81. Bakker D, Willemsen P, Strain S, McNair J. Una comparación de PPD disponibles comercialmente: consideración práctica para el diagnóstico y control de la tuberculosis bovina. 4th International Conference on Mycobacterium bovis. Wellington, Nueva Zelanda (2009).
82. Casal C, Bezos J, Diez A, Alvarez J, Romero B, de Juan L, et al. Factores que afectan a la prueba de tuberculina intradérmica para el diagnóstico de tuberculosis bovina. 33º Congreso Anual de la Sociedad Europea de Micobacteriología, Sociedad Europea de Micobacteriología. Brasov, Rumania (2012). Disponible en: https://www.visavet.es/en/factors-affecting-intradermal-tuberculin-test-for-the-diagnosis-of-bovine-tuberculosis/34=1082/ (Acceso: 5 de septiembre de 2017).
83. Good M, Clegg TA, Costello E, More SJ. El rendimiento comparativo de la prueba intradérmica única y la prueba intradérmica única de tuberculina comparativa en bovinos irlandeses, utilizando combinaciones de tuberculina PPD de diferentes potencias. Vet Microbiol (2011) 190(1–2):e60–5. doi:10.1016/j.tvjl.2011.01.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
84. Goodchild AV, Downs SH, Upton P, Wood JLN, de la Rua-Domenech R. Specificity of the comparative skin test for bovine tuberculosis in Great Britain. Veterinario Rec (2015) 177:258. doi:10.1136/vr.102961
Resumen de PubMed | Texto completo de CrossRef | Google Académico
85. O’Reilly LM. Especificidad y sensibilidad de las pruebas de tuberculina: una revisión. Actas de la Conferencia Internacional sobre la Tuberculosis en África y Oriente Medio. El Cairo, Egipto (1992).
86. Costello E, Egan JWA, Quigley FC, O’Reilly PF. Performance of the single intradermal comparative tuberculin test in identifying bovinos with tuberculous lesions in Irish hats. Vet Rec (1997) 141:222–4. doi:10.1136/vr.141.9.222
Resumen de PubMed | Texto completo de CrossRef | Google Académico
87. Monaghan ML, Doherty ML, Collins JD, Kazda JF, Quinn PJ. La prueba de la tuberculina. Vet Microbiol (1994) 40:111–24. doi:10.1016/0378-1135(94)90050-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
88. O’Reilly LM, Mac Clancy BN. Estimación de la sensibilidad, especificidad y valor predictivo de la prueba de tuberculina intradérmica. Ir Vet J (1978) 32:127–8.
89. O’Keeffe JJ. Un modelo del efecto del tamaño del rebaño en el resultado de la prueba de tuberculina. Artículos seleccionados 1992. Dublín: Unidad de Investigación de la Tuberculosis (1992). págs. 39–44.
90. Churbanov A, Milligan B. Accurate diagnostics for Bovine tuberculosis based on high-throughput sequencing. PLoS One (2012) 7(11):e50147. doi:10.1371/journal.pone.0050147
Resumen de PubMed | Texto completo de CrossRef | Google Académico
91. Neill SD, Cassidy J, Hanna J, Mackie DP, Pollock JM, Clements A, et al. Detección de la infección por Mycobacterium bovis en bovinos con prueba cutánea negativa con un ensayo de interferón gamma bovino. Vet Rec (1994) 135:134–5. doi:10.1136/vr.135.6.134
92. Wood PR, Jones SL. Bovigam™: an in vitro cellular diagnostic test for bovine tuberculosis. Tuberculosis (2001) 81:147–55. doi:10.1054/tube.2000.0272
93. Gormley E, Doyle MB, Fitzsimons T, McGill K, Collins JD. Diagnóstico de la infección por Mycobacterium bovis en bovinos mediante el uso del ensayo de interferón gamma (Bovigam1). Vet Microbiol (2006) 112:171–9. doi:10.1016/j.vetmic.2005.11.029
94. Coad M, Downs SH, Durr PA, Clifton-Hadley RS, Hewinson RG, Vordermeier HM, et al. Ensayos basados en sangre para detectar ganado infectado con Mycobacterium bovis que no se detectó en las pruebas cutáneas de tuberculina. Vet Rec (2008) 162:382–4. doi:10.1136/vr.162.12.382
95. Praud A, Boireau C, Dufour B. Sensitivity of γ-interferon test used in series after tuberculin test to detect bovine tuberculosis. Vet Rec (2016) 179(7):174. doi:10.1136/vr.103803
96. Sinclair JA, Dawson KL, Buddle BM. La eficacia de las pruebas paralelas de interferón gamma en el programa de erradicación de la tuberculosis bovina de Nueva Zelandia. Prev Vet Med (2016) 127:94–9. doi:10.1016/j.prevetmed.2016.03.020
97. Vordermeier HM, Whelan A, Cockle PJ, Farrant L, Palmer N, Hewinson RG. Uso de péptidos sintéticos derivados de los antígenos ESAT-6 y CFP-10 para el diagnóstico diferencial de la tuberculosis bovina en bovinos. Clin Diagn Lab Immunol (2001) 8:571–8. doi:10.1128/CDLI.8.3.571-578.2001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
98. Purohit MR, Sviland L, Wiker H, Mustafa T. Diagnóstico rápido y específico de tuberculosis extrapulmonar por inmunotinción de tejidos y aspirados con anti-MPT64. Appl Immunohistochem Mol Morphol (2017) 25:282–8. doi:10.1097/PAI.0000000000000300
Resumen de PubMed | Texto completo de CrossRef | Google Académico
99. Cousins DV, Florisson N. Una revisión de las pruebas disponibles para su uso en el diagnóstico de la tuberculosis en especies no bovinas. Rev Sci Tech (2005) 24:1039–59. doi:10.20506/rst.24.3.1635
Resumen de PubMed | Texto completo de CrossRef | Google Académico
100. Palmer MV, Waters WR. Avances en el diagnóstico y la patogénesis de la tuberculosis bovina: lo que los responsables políticos deben saber. Vet Microbiol (2006) 112:181–90. doi:10.1016/j.vetmic.2005.11.028
Resumen de PubMed | Texto completo de CrossRef | Google Académico
101. de la Rua-Domenech R, Goodchild AT, Vordermeier HM, Hewinson RG, Christiansen KH, Clifton-Hadley RS. Diagnóstico ante mortem de tuberculosis en bovinos: revisión de las pruebas de tuberculina, ensayo de interferón γ y otras técnicas diagnósticas auxiliares. Res Vet Sci (2006) 81:190–210. doi:10.1016/j.rvsc.2005.11.005
102. Organización Mundial de Sanidad Animal [OIE]. Manual de Pruebas de Diagnóstico y Vacunas para Animales Terrestres (2015). Disponible en: http://www.oie.int/international-standard-setting/terrestrial-manual/access-online/ (Acceso: 5 de septiembre de 2017).
103. Schiller I, Oesch B, Vordermeier HM, Palmer MV, Harris BN, Orloski KA, et al. Tuberculosis bovina: una revisión de las técnicas de diagnóstico actuales y emergentes en vista de su relevancia para el control y la erradicación de la enfermedad. Transbound Emerg Dis (2010) 57(4):205–20. doi:10.1111/j.1865-1682.2010.01148.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
104. Collins JD. Un estudio longitudinal de bovinos encontró positivo al ensayo de interferón-g para la infección por Mycobacterium bovis. Soc Vet Epidem Econ Proc. Breckenridge (2000). págs. 1263-5.
105. Gormley E, Doyle MB, McGill K, Costello E, Good M, Collins JD. El efecto de la prueba de tuberculina y las consecuencias de un retraso en el hemocultivo sobre la sensibilidad de un ensayo de interferón gamma para la detección de la infección por Mycobacterium bovis en bovinos. Vet Immunol Immunopathol (2004) 102:413–20. doi:10.1016/j.vetimm.2004.08.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
106. Schiller I, Vordermeier HM, Waters WR, Whelan AO, Coad M, Gormley E, et al. Tuberculosis bovina: efecto de la prueba cutánea de tuberculina sobre las respuestas in vitro del interferón gamma. Vet Immunol Immunopathol (2010) 136:1–11. doi:10.1016/j.vetimm.2010.02.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
107. Pollock JM, Welsh MD, McNair J. Immune responses in bovine tuberculosis: towards new strategies for the diagnosis and control of disease. Vet Immunol Immunopathol (2005) 108:37–43. doi:10.1016/j.vetimm.2005.08.012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
108. Reviriego Gordejo FJ, Vermeersch JP. Hacia la erradicación de la tuberculosis bovina en la Unión Europea. Vet Microbiol (2006) 112(2–4):101–9. doi:10.1016/j.vetmic.2005.11.034
Resumen de PubMed | Texto completo de CrossRef | Google Académico
109. Comisión técnica de salud y bienestar animal de la EFSA (Comisión técnica AHAW de la EFSA), More S, Bøtner A, Butterworth A, Calistri P, Depner K, et al. Dictamen científico sobre la evaluación de la inclusión y clasificación de enfermedades animales en el marco de la Ley de Sanidad Animal [Reglamento (UE) 2016/429]: tuberculosis bovina. EFSA J (2017) 15(8):4959. doi:10.2903/j.efsa.2017.4959
110. Palmer MV. Tuberculosis: una enfermedad reemergente en la interfaz de los animales domésticos y la vida silvestre. En: Childs JE, Mackenzie JS, Richt JA, editores. Vida silvestre y enfermedades zoonóticas emergentes: la biología, las circunstancias y las consecuencias de la transmisión entre especies. Current Topics in Microbiology and Immunology, Vol. 315. Berlín, Heidelberg: Springer (2007). págs. 195–215.
111. Francis J. Tuberculosis in Animals and Man: A Study in Comparative Pathology. Londres: Cassell & Co. Ltd (1958). 82 págs.
112. Esquina LAL. El papel de las poblaciones de animales salvajes en la epidemiología de la tuberculosis en animales domésticos cómo evaluar el riesgo. Vet Microbiol (2006) 112:303–12. doi:10.1016/j.vetmic.2005.11.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
113. Ryan TJ, Livingstone PG, Ramsey DSL, de Lisle GW, Nugent G, Collins DM, et al. Avances en la comprensión de la epidemiología de la enfermedad y sus implicaciones para el control y la erradicación de la tuberculosis en el ganado: la experiencia de Nueva Zelanda. 4th International Conference on Mycobacterium bovis. Vet Microbiol (2006) 112:211–9. doi:10.1016/j.vetmic.2005.11.025
114. Ward AI, Juez J, Delahay RJ. Cría de granjas y comportamiento del tejón: ¿oportunidades para manejar la transmisión del tejón al ganado de Mycobacterium bovis? Prev Vet Med (2010) 93:2–10. doi:10.1016/j.prevetmed.2009.09.014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
115. Comisión Técnica de Salud y Bienestar de los Animales de la EFSA (Comisión Técnica AHAW de la EFSA). Declaración sobre un marco conceptual para la tuberculosis bovina. EFSA J (2014) 12(5):3711. doi:10.2903/j.efsa.2014.3711
116. More SJ, Radunz B, Glanville RJ. Lecciones aprendidas durante la erradicación exitosa de la tuberculosis bovina de Australia. Vet Rec (2015) 177:224–32. doi:10.1136/vr.103163
Resumen de PubMed | Texto completo de CrossRef | Google Académico
117. Gortazar C, Vicente J, Samper S, Garrido JM, Fernández-De-Mera IG, Gavín P, et al. Caracterización molecular de aislados del complejo Mycobacterium tuberculosis de ungulados silvestres en el centro-sur de España. Vet Res (2005) 36(1):43–52. doi:10.1051/vetres:2004051
Resumen de PubMed | Texto completo de CrossRef | Google Académico
118. Cunha MV, Monteiro M, Carvalho P, Mendonça P, Albuquerque T, Botelho A. Multihost tuberculosis: insights from the Portuguese control program. Vet Med Int (2011) 2011:10. doi:10.4061/2011/795165
Resumen de PubMed | Texto completo de CrossRef | Google Académico
119. Aranaz A, Cousins D, Mateos A, Dominiguez I. Elevation of Mycobacterium tuberculosis subsp. Caprae (Aranaz et al. 1999) to species rank as Mycobacterium caprae comb. nov., sp. nov. Int J Syst Evol Microbiol (2003) 53:1785–9. doi:10.1099/ijs.0.02532-0
120. Good M. The Tuberculin Test and its Role in the Strategic Management and Eradication of Tuberculosis in Cattle (Disertación). Universidad de Utrecht (2011). Disponible en: https://dspace.library.uu.nl/handle/1874/212136 (Acceso: 5 de septiembre de 2017).
121. Michel AL, Bengis RG, Keet DF, Hofmeyr M, De Klerk LM, Cross PC, et al. Implicaciones y desafíos de la tuberculosis de la vida silvestre en el área de conservación de Sudáfrica. Vet Microbiol (2006) 112:91–100. doi:10.1016/j.vetmic.2005.11.035
122. Pérez J, Calzada J, León-Vizcaíno L, Cubero MJ, Velarde J, Mozos E. Tuberculosis in an Iberian lynx (Lynx pardina). Vet Rec (2001) 148(13):414–5. doi:10.1136/vr.148.13.414
123. Gortázar C, Torres MJ, Vincente J, Acevedo P, Reglero M, de la Fuente J, et al. Tuberculosis bovina en la reserva de la biosfera de Doñana: el papel de los ungulados silvestres como reservorios de enfermedades en los últimos reductos del lince ibérico. PLoS One (2008) 3(7):e2776. doi:10.1371/journal.pone.0002776
124. Musso Munyeme M, Munang’andu HM. Una revisión de la tuberculosis bovina en el ecosistema de la cuenca del Kafue. Vet Med Int (2011) 2011:9. doi:10.4061/2011/918743
Resumen de PubMed | Texto completo de CrossRef | Google Académico
125. Palmer MV. Mycobacterium bovis: características de los huéspedes reservorios de vida silvestre. Transbound Emerg Dis (2013) 60(Suppl 1):1–13. doi:10.1111/tbed.12115
Resumen de PubMed | Texto completo de CrossRef | Google Académico
126. Tweddle NE, Livingstone P. Bovine tuberculosis control y programas de erradicación en Australia y Nueva Zelandia. Vet Microbiol (1994) 40:23–39. doi:10.1016/0378-1135(94)90044-2
127. Más SJ, Good M. El programa de erradicación de la tuberculosis en Irlanda: un examen de los avances científicos y políticos desde 1988. Vet Microbiol (2006) 112:239–51. doi:10.1016/j.vetmic.2005.11.022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
128. Radunz B. Surveillance and risk management during the latter stages of erradication: experience from Australia. Vet Microbiol (2006) 112:283–90. doi:10.1016/j.vetmic.2005.11.017
129. Livingstone PG, Hancox N, Nugent G, de Lisle GW. Hacia la erradicación: el efecto de la infección por Mycobacterium bovis en la vida silvestre en la evolución y la dirección futura del manejo de la tuberculosis bovina en Nueva Zelanda. N Z Vet J (2015) 63: 4–18. doi:10.1080/00480169.2014.971082
Resumen de PubMed | Texto completo de CrossRef | Google Académico
130. Fitzgerald SD, Schmitt SM, O’Brien DJ, Kaneene JB. El problema de la tuberculosis bovina de Michigan. Centro de Diagnóstico de Población y Salud Animal de la Universidad Estatal de Michigan (2009). Disponible en: https://www.dcpah.msu.edu/topics/Bovine_TB_Problem.pdf (Acceso: 14 de octubre de 2017).
131. Walter WD, Anderson CW, Smith R, Vanderklok M, Averill JJ, VerCauteren KC. Mitigación en la granja de la transmisión de la tuberculosis del venado de cola blanca al ganado: revisión de la literatura y recomendaciones. Vet Med Int (2012) 2012:15. doi:10.1155/2012/616318
Resumen de PubMed | Texto completo de CrossRef | Google Académico
132. Santos N, Santos C, Valente T, Gortázar C, Almeida V, Correia-Neves M. Contaminación ambiental generalizada con complejo Mycobacterium tuberculosis revelada por un protocolo de detección molecular. PLoS One (2015) 10(11):e0142079. doi:10.1371/journal.pone.0142079
Resumen de PubMed | Texto completo de CrossRef | Google Académico
133. Foyle L, Delahay RJ, Massei G. Isolation of Mycobacterium bovis from a feral jabalí (Sus scrofa) in the UK. Vet Rec (2010) 166(21):663–4. doi:10.1136/vr.c2681
134. Fine AE, Bolin CA, Gardiner JC, Kaneene JB. Un estudio de la persistencia de Mycobacterium bovis en el medio ambiente bajo condiciones climáticas naturales en Michigan, EE.UU. Vet Med Int (2011) 2011:765430. doi:10.4061/2011/765430
Resumen de PubMed | Texto completo de CrossRef | Google Académico
135. Barbier E, Boschiroli ML, Gueneau E, Rochelet M, Payne A, de Cruz K, et al. Primera detección molecular de Mycobacterium bovis en muestras ambientales de una región francesa con tuberculosis bovina endémica. J Appl Microbiol (2016) 120(5):1193–207. doi:10.1111/jam.13090
136. King HC, Murphy A, James P, Travis E, Porter D, Sawyer J, et al. Realización de una prueba no invasiva para detectar la excreción de Mycobacterium bovis en poblaciones de tejón europeo (Meles meles). J Clin Microbiol (2015) 53:2316–23. doi:10.1128/JCM.00762-15
137. Travis E, James P, Murphy A, Delahay R, Cork J, Sawyer J, et al. DEFRA Project SE3280: Optimisation of Sampling Strategies for Improving Sensitivity of M. bovis Detection by PCR Final Report (2014). Disponible en: http://randd.defra.gov.uk/Document.aspx?Document=11904_20140207SE3280FinalReportFeb7th2014.pdf (Acceso: 5 de septiembre de 2017).
138. Lesellier S, Palmer S, Dalley DJ, Davé D, Johnson L, Hewinson RG, et al. Seguridad e inmunogenicidad de la vacuna Bacillus Calmette-Guérin (BCG) en tejones europeos (Meles meles). Vet Immunol Immunopathol (2006) 112(1–2):24–37. doi:10.1016/j.vetimm.2006.03.009
139. Lesellier S, Corner L, Costello E, Lyashchenko K, Greenwald R, Esfandiari J, et al. Respuestas inmunológicas e inmunidad protectora en tejones vacunados con BCG después de una infección endobronquial con Mycobacterium bovis. Vaccine (2009) 27:402–9. doi:10.1016/j.vaccine.2008.10.068
Resumen de PubMed | Texto completo de CrossRef | Google Académico
140. Southey A, Sleeman DPS, Lloyd K, Dalley D, Chambers MA, Hewinson RG, et al. Respuestas inmunológicas de tejones euroasiáticos (Meles meles) vacunados con Mycobacterium bovis BCG (Bacillus Calmette Guerin). Vet Immunol Immunopathol (2001) 79(3–4):197–207. doi:10.1016/S0165-2427(01)00268-9
141. Beltrán-Beck B, Ballesteros C, Vicente J, de la Fuente J, Gortázar C. Progress in oral vaccination against tuberculosis in its main wildlife reservoir in Iberia, the Eurasian wild baar. Vet Med Int (2012):978501. doi:10.1155/2012/978501
Resumen de PubMed | Texto completo de CrossRef | Google Académico
142. Michel AL, Müller B, van Helden PD. Mycobacterium bovis en la interfaz animal-humano: ¿un problema, o no? Vet Microbiol (2010) 140(3–4):371–81. doi:10.1016/j.vetmic.2009.08.029
Resumen de PubMed | Texto completo de CrossRef | Google Académico
143. Kaneene JB, Miller R, Steele JH, Thoen CO. Prevención y control de la tuberculosis zoonótica: un enfoque de una sola salud. Vet Ital (2014) 50(1):7–22. doi:10.12834/VetIt.1302.08
Resumen de PubMed | Texto completo de CrossRef | Google Académico
144. Kahn LH, Kaplan B, Steele JH. Hacer frente a las zoonosis a través de una colaboración más estrecha entre la medicina y la medicina veterinaria (como «un medicamento»). Vet Ital (2007) 43(1):5–19.
145. Sternberg-Lewerin S. Tuberculosis y una salud: ¿qué hay en un nombre? Front Vet Sci (2015) 2:54. doi:10.3389/fvets.2015.00054
146. FAO-OIE-OMS. Colaboración compartiendo responsabilidades y coordinando actividades globales para abordar los riesgos para la salud en las interfaces animales-humanos-ecosistemas. Una nota conceptual tripartita (2010). Disponible en: http://www.who.int/influenza/resources/documents/tripartite_concept_note_hanoi_042011_en.pdf (Acceso: 10 de octubre de 2017).
147. WHO. WHO: The End TB Strategy (2015). Available from: http://www.who.int/tb/End_TB_brochure.pdf (Accessed: October 10, 2017).
148. OMS, OIE, FAO y Unión Internacional contra la Tuberculosis y las Enfermedades Pulmonares. Hoja de ruta Tuberculosis (2017). Disponible en: http://apps.who.int/iris/bitstream/10665/259229/1/9789241513043-eng.pdf?ua=1 (Acceso: 10 de octubre de 2017).
149. Torgerson P, Torgerson D. ¿El riesgo para los seres humanos justifica el alto costo de la lucha contra la tuberculosis bovina? Nature (2008) 455:1029. doi:10.1038/4551029a
150. Torgerson P, Torgerson D. Benefits of stemming bovine TB need to be demonstrated. Nature (2009) 457:657. doi:10.1038/457657d
151. Torgerson PR, Torgerson DJ. Salud pública y tuberculosis bovina: ¿de qué se trata todo este alboroto? Trends Microbiol (2010) 18(2):67–72. doi:10.1016/j.tim.2009.11.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
152. Sociedad para la Conservación de la Vida Silvestre. Disponible en: https://www.wcs.org/our-work/solutions/health (Acceso: 20 de octubre de 2017).
153. Kaneene JB, Kaplan B, Steele JH, Thoen CO. Enfoque de One Health para prevenir y controlar la tuberculosis en animales y humanos. 3ª ed. En: Thoen CO, Steele JH, Kaneene JB, editores. Tuberculosis zoonótica: Mycobacterium bovis y otras micobacterias patógenas (2014) 9–21. doi:10.1002/9781118474310.ch2
154. The Wildlife Conservation Society. Suena la alarma sobre las amenazas de enfermedades de la vida silvestre y humana en la era del cambio climático (2008). Disponible en: http://ccsl.iccip.net/deadlydozen_sm.pdf (Acceso: 10 de octubre de 2017).
Cita: Good M, Bakker D, Duignan A y Collins DM (2018) La historia de las pruebas de tuberculina in vivo en bovinos: tuberculosis, un problema de «una salud». Frente. Vet. Sci. 5:59. DOI: 10.3389/fvets.2018.00059
Recibido: 16 de noviembre de 2017; Aprobado: 12 de marzo de 2018;
Publicado: 09 Abril 2018
Editado por:
Srinand Sreevatsan, Universidad Estatal de Michigan, Estados Unidos
Revisado por:
Bernat Pérez de Val, Institut de Recerca i Tecnologia Agroalimentàries (IRTA), España
Gustavo Machado, Universidad de Minnesota, Estados Unidos
Derechos de autor: © 2018 Good, Bakker, Duignan y Collins. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Margaret Good, mgood2510@gmail.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

