Resistencia antimicrobiana y genotipado de Pseudomonas aeruginosa de los canales auditivos de perros
Resistencia antimicrobiana y genotipado de Pseudomonas aeruginosa aislada de los canales auditivos de perros en Japón
 Ahmed Elfadadny1,2,
Ahmed Elfadadny1,2,  Jumpei Uchiyama3,
Jumpei Uchiyama3,  Kazuyoshi Goto3,
Kazuyoshi Goto3,  Ichiro Imanishi4,
Ichiro Imanishi4,  Rokaia F. Ragab1,
Rokaia F. Ragab1,  Wedad M. Nageeb5,
Wedad M. Nageeb5,  Keita Iyori6,
Keita Iyori6,  Yoichi Toyoda6,
Yoichi Toyoda6,  Toshihiro Tsukui7,
Toshihiro Tsukui7,  Kaori Ide1,8,
Kaori Ide1,8,  Keiko Kawamoto9 y
Keiko Kawamoto9 y  Koji Nishifuji1,8*
Koji Nishifuji1,8*- 1Laboratorio de Medicina Interna, División Cooperativa de Ciencias Veterinarias, Escuela de Graduados de Agricultura, Universidad de Agricultura y Tecnología de Tokio, Fuchu, Japón
- 2Departamento de Medicina Interna Animal, Facultad de Medicina Veterinaria, Universidad de Damanhour, Damanhour, Egipto
- 3Departamento de Bacteriología, Facultad de Graduados de Medicina, Odontología y Ciencias Farmacéuticas, Universidad de Okayama, Okayama, Japón
- 4Departamento de Microbiología, Facultad de Medicina de la Universidad de Kitasato, Sagamihara, Japón
- 5Departamento de Microbiología Médica e Inmunología, Facultad de Medicina, Universidad del Canal de Suez, Ismailia, Egipto
- 6Servicio dermatológico y de laboratorio para animales, Vet Derm Tokyo, Fujisawa, Japón
- 7Zenoaq Co. Ltd., Koriyama, Japón
- 8División de Ciencias de la Vida Animal, Instituto de Agricultura, Escuela de Posgrado, Universidad de Agricultura y Tecnología de Tokio, Fuchu, Japón
- 9Laboratorio de Inmunología y Control de Infecciones, Departamento de Medicina Veterinaria, Facultad de Medicina Veterinaria, Universidad de Azabu, Sagamihara, Japón
El fuerte vínculo entre los perros y sus dueños crea una estrecha asociación que podría resultar en la transferencia de bacterias resistentes a los antibióticos de los caninos a los humanos, lo que podría conducir a la propagación de genes de resistencia a los antimicrobianos. Pseudomonas aeruginosa, un agente causal común de infecciones persistentes del oído en perros, a menudo es resistente a múltiples antibióticos. La evaluación del perfil de resistencia a los antimicrobianos y el genotipo de P. aeruginosa es crucial para el uso adecuado de los productos farmacéuticos veterinarios. Sin embargo, en los últimos años, se han realizado pocos estudios sobre esta bacteria en Japón. Determinamos el perfil de resistencia antimicrobiana y el genotipo de P. aeruginosa aislada del canal auditivo de perros en Japón en 2020. El análisis de la resistencia a los antimicrobianos mediante pruebas de difusión en disco indicó una alta frecuencia de resistencia a la mayoría de los agentes antimicrobianos. En particular, 29 aislamientos de los canales auditivos de los 29 perros afectados (100%) fueron resistentes a cefovecina, cefpodoxima y florfenicol; sin embargo, fueron susceptibles a cefepima y piperacilina/tazobactam. Sólo 3,4, 10,3 y 10,3% de los aislados fueron resistentes a ceftazidima, tobramicina y gentamicina, respectivamente. Además, al analizar la estructura de la población utilizando la tipificación de secuencias multilocus, no se observó un complejo clonal considerablemente grande en los aislados probados. Tres aislados, a saber, ST3881, ST1646 y ST532, se relacionaron clonalmente con los tipos de secuencia clínicamente aislados en Japón (como ST1831, ST1413, ST1812 y ST1849), lo que es indicativo de transmisión de perro a humano. Teniendo en cuenta la variación en la resistencia a los antibióticos en comparación con la informada por estudios previos y el riesgo potencial de transmisión de perro a humano, creemos que la encuesta sobre el perfil de resistencia a los antimicrobianos y la estructura de la población debe continuarse regularmente. Sin embargo, la prevalencia de P. aeruginosa multirresistente en perros en Japón no es una crisis.
Introducción
La otitis canina es uno de los problemas más comúnmente reportados en la sección de dermatología de los hospitales veterinarios (1). Abarca dos tipos comunes: otitis externa, que se refiere a la inflamación del canal auditivo externo y el pabellón auricular, y otitis media, que implica inflamación del oído medio (2, 3). En los perros, la otitis externa ocurre más comúnmente que la otitis media. Sin embargo, en ciertos casos, la otitis externa puede progresar y penetrar en la membrana timpánica, propagando así la infección al oído medio y dando lugar a la otitis media (2, 4). Las principales causas de la otitis canina son la exposición prolongada del canino a un agente etiológico dentro de su entorno y / o el fracaso del tratamiento antimicrobiano para provocar una respuesta de los microbios, cuando la enfermedad se complica con cepas bacterianas (4). Los episodios repetidos de inflamación pueden causar cambios histopatológicos graves en el canal auditivo. Estos cambios incluyen hiperplasia epitelial y glandular, calcificación y aumento de la producción de cerumen a lo largo del canal auditivo externo, lo que puede conducir a un mayor fracaso del tratamiento de la otitis y potencialmente resultar en una infección del oído en etapa terminal (5).
La otitis canina también tiene un efecto perjudicial en la calidad de vida del propietario (6). La prevalencia de casos de otitis que se diagnostican en la práctica clínica veterinaria varía de 8,7 a 20% para otitis externa (7-9) y de 50 a 80% para otitis media, como complicación de otitis externa (10). En un estudio de prevalencia de un año realizado en el Reino Unido, la prevalencia de otitis fue notablemente mayor en ciertas especies caninas, como Basset Hound (28,81%), Shar Pie chino (17,76%), Labradoodle (17,71%), Beagles (14,72%), Golden Retrievers (14,11%) y Cockapoo (12,97%) (11). En Japón, la incidencia de otitis en perros ingresados en el hospital de animales en la prefectura de Osaka se limitó principalmente a los caniches miniatura y los perros cocker spaniel (12). La incidencia de otitis en una especie específica se ha atribuido a la confirmación anatómica de la oreja auricular y del canal auditivo (13). En un estudio previo (11), las probabilidades de incidencia de otitis fueron de 1,76 y 1,84 veces en las razas con pinnas colgantes y en forma de V, respectivamente, en comparación con las razas con la oreja erecta. Estos resultados sugirieron que la retención de calor y humedad, así como la acumulación de materiales extraños en píndulos y pinnas en forma de V pueden proporcionar un ambiente favorable para la colonización bacteriana (14, 15). La otitis canina es impulsada por patógenos bacterianos secundarios en el 98% de los casos en América del Norte (16, 17), especialmente especies de Staphylococcus coagulasa positivas, especies de Pseudomonas, Proteus, Escherichia coli, Klebsiella y Malassezia, y las infecciones mixtas son comunes (10, 18). Los principales organismos aislados de perros que sufren de otitis son Staphylococcus spp., especialmente S. pseudintermedius, que representan el 10-70% de los casos (19). Pseudomonas aeruginosa es el segundo patógeno principal de la otitis, que representa el 20-60% de los casos y puede causar otitis intratable (4, 19-21). La otitis canina causada por P. aeruginosa es difícil de curar debido a su formación de biopelículas y resistencia intrínseca y adquirida a los medicamentos (22).
Estudios anteriores han demostrado que la amplia utilización de agentes antimicrobianos en mascotas, especialmente en perros y gatos, puede representar una amenaza potencial para la salud pública debido a la probabilidad de que tales mascotas sirvan como un medio para la propagación de bacterias y elementos resistentes a los antimicrobianos (23). Un estudio demostró que la resistencia de P. aeruginosa a los antimicrobianos incluye no solo los grupos de penicilina, aminoglucósidos y fluoroquinolonas (24), sino también medicamentos recientemente formulados, como ceftolozona-tazobactam y ceftazidima-avibactam (25, 26). Tal resistencia a los antimicrobianos conduce a desafíos en el tratamiento de la otitis causada por P. aeruginosa en perros en el entorno clínico (27). Por lo tanto, se requieren estudios para monitorear la eficacia de los medicamentos utilizados en perros infectados por P. aeruginosa para mantener el potencial de un agente terapéutico crítico y desarrollar un plan de manejo efectivo a largo plazo (28, 29). Se han utilizado varias técnicas de tipificación molecular para tipificar cepas de P. aeruginosa, como la electroforesis en gel de campo pulsado (30), la toma de huellas dactilares de reacción en cadena de la polimerasa (PCR) (31) y la tipificación de secuencias multilocus (MLST) (32). Entre estas técnicas, MLST se desarrolló en 2004 para P. aeruginosa, y este método se basa en la secuenciación de la diferencia alélica de siete genes de mantenimiento, que colectivamente proporcionan los tipos de secuencia (ST) para caracterizar los aislados. La selección de los siete loci permite a los científicos rastrear la variabilidad entre las cepas de tal manera que una puede ser diferente en uno o más loci y aún así incluirse en la historia clonal global de la especie con la mayor precisión posible (32, 33).
El enfoque One Health Perspective vincula la seguridad y la salud de los seres humanos con la de su entorno (34), y este enfoque ha planteado recientemente la consideración de una encuesta sobre bacterias resistentes a los antimicrobianos resistentes a los medicamentos en animales pequeños (35). El contacto cercano entre mascotas y humanos ofrece excelentes oportunidades para la transmisión entre especies de bacterias resistentes en cualquier dirección, como a través de lamer, caricias y lesiones físicas. A diferencia de otras enfermedades, la transmisión horizontal de genes de resistencia a los antimicrobianos podría ocurrir en el huésped humano y/o en el medio ambiente. Por ejemplo, la bacteria P. aeruginosa de perros y humanos puede encontrarse fuera de sus huéspedes y permitir la transferencia de genes de resistencia (23). En comparación con las zoonosis transmitidas por los alimentos, las zoonosis asociadas a mascotas siguen siendo un área descuidada a nivel mundial. Se han realizado algunos estudios epidemiológicos sobre el perfil de resistencia a los antimicrobianos de P. aeruginosa en animales de compañía en Japón (36, 37). A pesar de la importancia de realizar una encuesta continua sobre este tema, que debería involucrar una gran cantidad de antibióticos, ha habido una escasez de estudios en los últimos años. Nuestro estudio investigó el perfil de resistencia antimicrobiana y la estructura genotípica de P. aeruginosa aislada de canales auditivos de perros en Japón durante el año 2020, para determinar su relación genética con otros clones de P. aeruginosa que circulan en Japón.
Materiales y métodos
Animales y aislamiento bacteriano
Las muestras se recolectaron utilizando hisopos estériles de los canales auditivos de 29 perros afectados por otitis unilateral y / o bilateral, que fueron diagnosticados de enero a diciembre de 2020 por veterinarios locales en Japón. Los hisopos fueron transportados a VDT Co. Ltd. después de ser colocados en el medio de transporte Stuart (Copan Diagnostics Inc., Estados Unidos). Además, los hisopos se untaron inmediatamente en agar cetrimida (Wako, Fujifilm, Japón), un medio selectivo para la identificación de especies de P. aeruginosa, y se incubaron durante la noche a 35-37 ° C. Las bacterias aisladas se identificaron utilizando un sistema Microflex (Bruker Daltonics, Bremen, Alemania). El perfil proteico de cada bacteria se analizó utilizando el biotyper de ionización por desorción láser asistido por matriz (MALDI) v3.1.
La información de señalización de los perros, incluida la raza, la edad y el sexo, se enumera en la Tabla 1. El Comité de Gestión de Bioseguridad de la Universidad de Agricultura y Tecnología de Tokio revisó y aprobó todos los experimentos con cepas de P. aeruginosa (#R2-10).
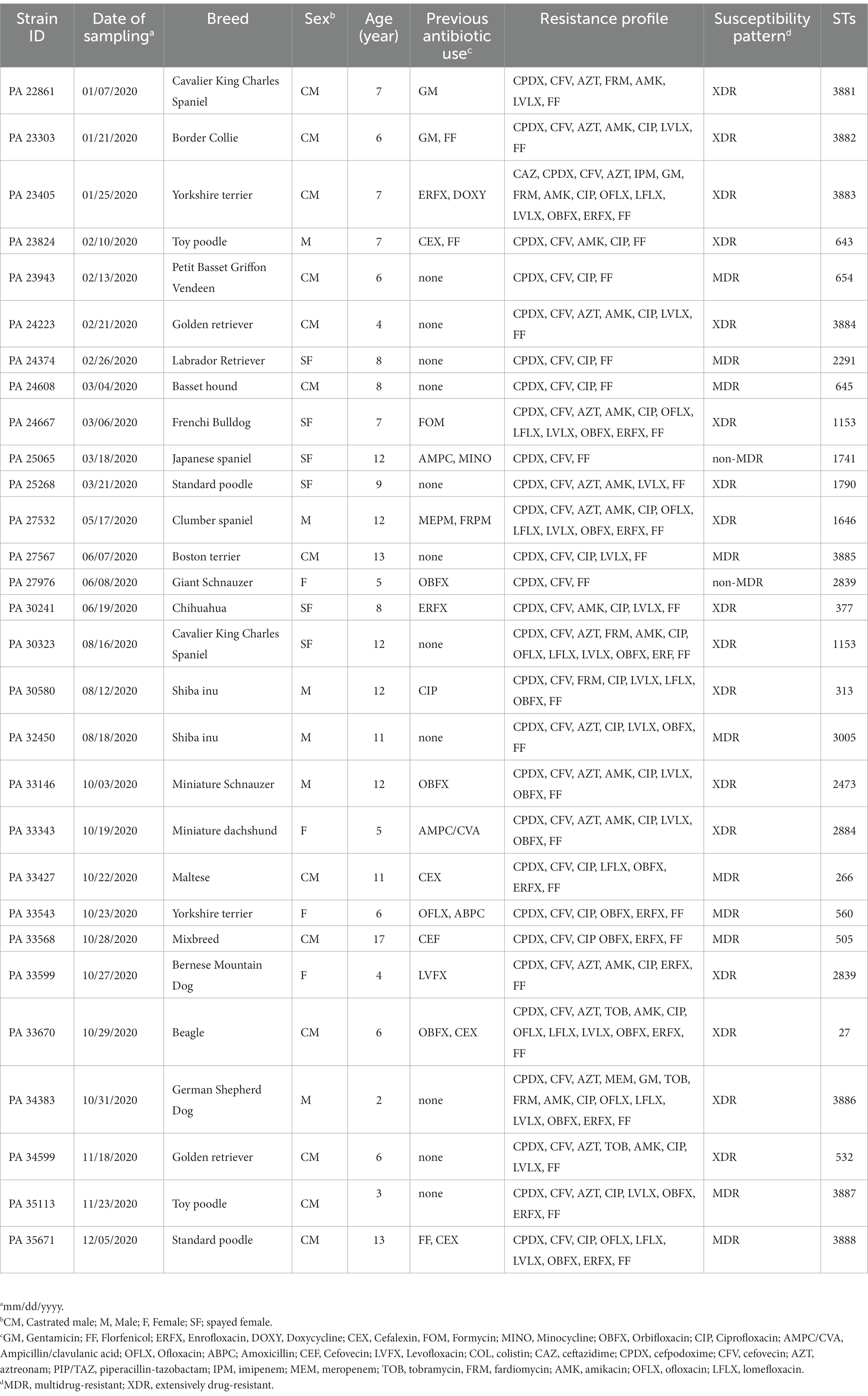 Tabla 1. Información de señalización de 29 aislados de Pseudomonas aeruginosa obtenidos de los canales auditivos de perros en Japón.
Tabla 1. Información de señalización de 29 aislados de Pseudomonas aeruginosa obtenidos de los canales auditivos de perros en Japón.
Prueba de sensibilidad antimicrobiana
La prueba de susceptibilidad a los antibióticos se realizó utilizando los métodos de difusión en disco y concentración inhibitoria mínima (CMI), basados en las directrices del Instituto de Estándares Clínicos y de Laboratorio (CLSI) para Vet-08 y M-100-30ésimoED (38). Brevemente, la prueba se llevó a cabo utilizando BD sensei-Disk del antibiótico designado (prueba de difusión de agar; Método de difusión en disco Kirby-Bauer) en agar Müller-Hinton inoculado por bacterias (Becton Dickinson GmbH, Heidelberg, Alemania). Analizamos los patrones de resistencia antimicrobiana de los aislados de P. aeruginosa utilizando un panel de 20 antibióticos, que podrían clasificarse en seis tipos según su modo de acción, incluyendo fluoroquinolonas, aminoglucósidos, cefalosporinas, carbapenémicos, piperacilina-tazobactam y polimixina. Se utilizaron los siguientes antibióticos: colistina (COL), ceftazidima (CAZ), cefpodoxima (CPDX), cefovecina (CFV), cefepima (CFPM), aztreonam (AZT), piperacilina-tazobactam (PIP/TAZ), imipenem (IPM), meropenem (MEM), gentamicina (GM), tobramicina (TOB), fradiomicina (FRM), amikacina (AMK), ciprofloxacino (CIP), ofloxacino (OFLX), lomefloxacino (LFLX), levofloxacino (LVLX), orbifloxacino (OBFX), enrofloxacino (ERFX) y florfenicol (FF). Los aislados se clasificaron en tres categorías, a saber, susceptibles, intermedios y resistentes, según los puntos de interrupción descritos por CSLI para Vet-08 y M-100-30th ED. La CMI de MIP, MEM y COL también se determinó contra aislados de P. aeruginosa utilizando la técnica de microdilución en caldo, de acuerdo con las pautas relevantes de CLSI. Sobre la base de los criterios proporcionados por la clasificación anterior (39), la clasificación del aislado de P. aeruginosa como multirresistente (MDR), extremadamente resistente a los medicamentos (XDR), panrresistente (PDR) o no MDR (no multirresistente) se basó en su susceptibilidad a diversos agentes antimicrobianos. Específicamente, un aislado se consideró MDR si mostraba resistencia a al menos un agente en tres o más categorías antimicrobianas. Por el contrario, un aislado se clasificó como XDR si era susceptible a al menos un agente en dos o menos categorías. Un aislado se etiquetó como PDR si era resistente a todos los antimicrobianos disponibles. Finalmente, un aislado se consideró no MDR si no cumplía con los criterios para la clasificación MDR (39).
Análisis de tipificación de secuencias multilocus
El ADN bacteriano se extrajo utilizando el kit de extracción de ADN Kaneka Easy (Versión 2, Kaneka, Tokio, Japón). El ADN extraído se purificó utilizando un kit de purificación de ADN genómico Wizard (Promega, Tokio, Japón). Las secuencias de los siete genes de mantenimiento acsA, aroE, guaA, mutL, nuoD, ppsA y trpE de P. aeruginosa se amplificaron mediante PCR utilizando conjuntos de cebadores apropiados (32). El producto de PCR se secuenció con un kit de secuenciación de ciclo Big Dye Terminator 3.1 utilizando un analizador genético ABI 3100 (Applied Biosystems).
El número alélico y el ST se determinaron utilizando la base de datos MLST.1 Si no se encontraban coincidencias en la base de datos, las ST se registraban recientemente en la base de datos (cuadro suplementario S1). Para el análisis filogenético, las secuencias concatenadas de los siete genes de mantenimiento de todos los ST para P. aeruginosa (incluidos los ST del estudio actual) se descargaron del sitio web de MLST.2 Las secuencias se alinearon utilizando Multiple Sequence Comparison by Log-Expectation, y el árbol filogenético se generó mediante el método de unión vecina, utilizando el software MEGA versión 10.2.4. El árbol fue visualizado por el software iTOL en línea versión 6.1.1.3
Análisis de datos
Todos los datos en el presente estudio fueron analizados estadísticamente utilizando un software de computadora. Para la detección de la prevalencia de la edad en los perros afectados, los datos se verificaron mediante la prueba U de Mann-Whitney (GraphPad Software, Inc., San Diego, California). En todos los análisis, p < 0,05 fue considerado estadísticamente significativo. Para evitar cualquier discrepancia en los resultados del perfil de resistencia antimicrobiana de cada aislado, todas las pruebas de difusión en disco y CMI se realizaron por triplicado. La estructura genotípica de los aislados de P. aeruginosa se analizó mediante el método algorítmico goeBURST utilizando el software PHYLOViZ v2.0 (40).4 La relación clonal entre los ST de los 29 aislados clínicos se verificó en función de su número alélico. Las tribus registradas se clasificaron en el mismo grupo si tenían alelos mutuamente idénticos en seis de los siete loci con otro miembro del grupo. Por el contrario, los ST que no compartían alelos idénticos en al menos dos de los siete loci se consideraron ST únicos. Utilizando la versión 6.1.1 del software iTOL (véase la nota 3), se creó un mapa de calor con agrupamiento jerárquico para mostrar la distribución general de los fenotipos de resistencia a los antibióticos en los aislados.
Resultados
Descripción de la cohorte de perros para el aislamiento de Pseudomonas aeruginosa en este estudio
La información sobre los perros afectados con otitis se describe en la Tabla 1. Se encontró que los 29 perros incluidos en el estudio tenían 29 aislados de P. aeruginosa (100%) en sus canales auditivos. En esta cohorte, el 65,5% (19/29) de los perros con otitis eran machos intactos (n = 6) o castrados (n = 13). No se observó predisposición de la raza para la otitis. Sin embargo, la incidencia de la enfermedad fue significativamente mayor (test U de Mann-Whitney, p < 0,0001) en perros mayores (mayores de 7 años), que habían alcanzado el último trimestre de su esperanza de vida como se indicó en un estudio anterior (41), con una media ± desviación estándar (DE) de 11,28 ± 2,37 que en adultos maduros con una media (±DE) de 5,57 ± 1,39 años. Además, el 37,9% (11/29) de los perros con otitis habían sido tratados previamente con fluoroquinolonas.
Perfil de susceptibilidad antimicrobiana
El número detallado y el porcentaje de frecuencia de susceptibilidad, susceptibilidad intermedia y resistencia a cada agente antimicrobiano se expresan en la Tabla 2. Todos los aislados: n = 29/29 (100%) expresaron fenotipo de resistencia hacia CPDX, CFV y FF. Adicionalmente, los aislamientos de P. aeruginosa mostraron frecuencias variables de resistencia al grupo de antibióticos fluoroquinolonas CIP: n = 25/29 (86,2%), ERFX: n = 13/29 (44,8%), LVLX: n = 19/29 (65,5%), OFLX: n = 7/29 (24,1%), LFLX: n = 9/29 (31%) y OBFX: n = 16/29 (55,2%). Además, los aislados de P. aeruginosa albergaron resistencia que varió de 10,3 a 55,1% hacia el grupo de antibióticos aminoglucósidos, como GM: n = 3/29 (10,3%), TOB: n = 3/29 (10,3%), AMK: n = 16/29 (55,2%) y FRM: n = 5/29 (17,2%). En contraste, los aislamientos mostraron la menor frecuencia de resistencia a cefalosporinas CFPM : n = 0/29 (0,0%) y CAZ: n = 1/29 (3,4%) y PIP/TAZ: n = 0/ 29 (0,0%) (Figura 1). La frecuencia de resistencia a los antibióticos carbapenémicos fue del 3,4% para MIP y MEM. Todos los aislamientos mostraron susceptibilidad intermedia a la LC (Tabla 3). Además, en términos de susceptibilidad a los antimicrobianos, 10/29 (34,5%) y 17/29 (58,6%) de los aislados de P. aeruginosa se clasificaron como MDR y XDR, respectivamente, mientras que 2/29 fueron aislados no MDR. El patrón antibiótico y el perfil de resistencia para cada aislado se muestran en la Tabla 1.
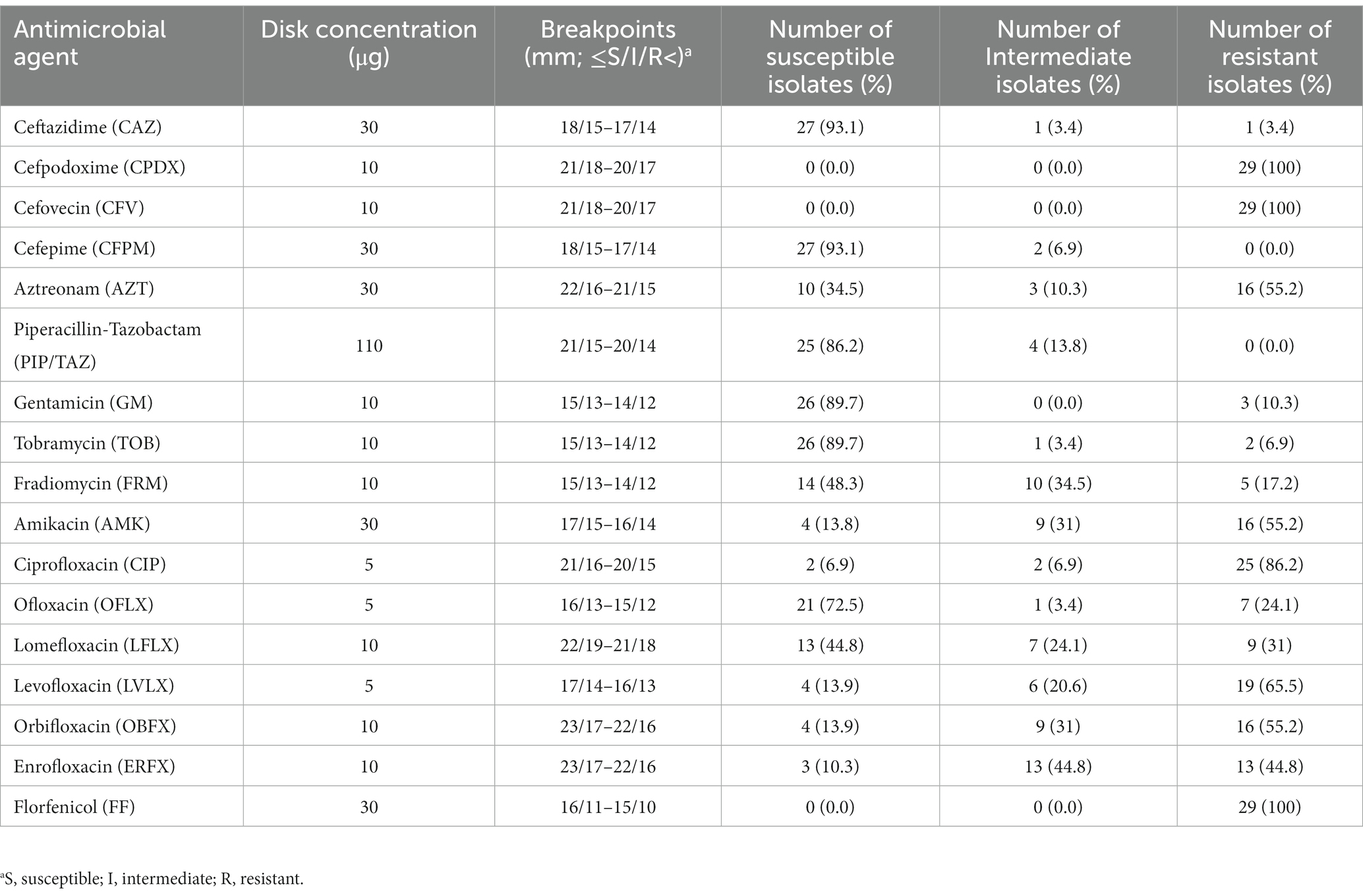 Tabla 2. Porcentaje de susceptibilidad antimicrobiana (susceptible, intermedia y resistente) de los 29 aislados de P. aeruginosa obtenidos de los canales auditivos de perros.
Tabla 2. Porcentaje de susceptibilidad antimicrobiana (susceptible, intermedia y resistente) de los 29 aislados de P. aeruginosa obtenidos de los canales auditivos de perros.
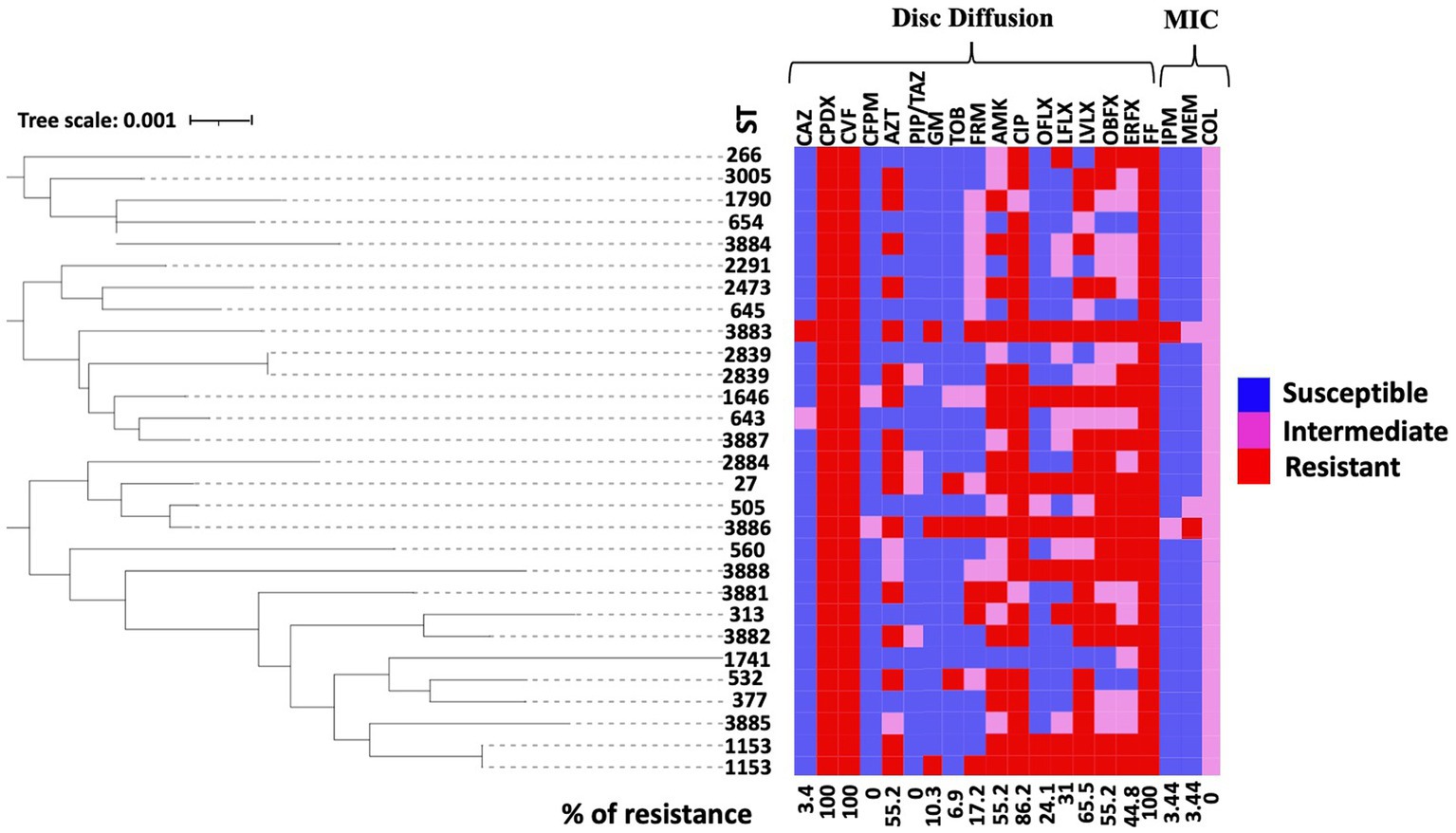 Figura 1. Patrón de susceptibilidad antimicrobiana de los 29 aislados de los canales auditivos de los perros. Se construyó un árbol rectangular de unión vecina basado en los datos MLST de todos los aislados. Se anotó en el árbol filogenético un mapa de calor que representa el perfil de susceptibilidad antimicrobiana para cada cepa. Las pruebas antimicrobianas para colistina (COL), ceftazidima (CAZ), cefpodoxima (CPDX), cefovecina (CFV), cefepima (CFPM), aztreonam (AZT), piperacilina-tazobactam (PIP/TAZ), imipenem (IPM), meropenem (MEM), gentamicina (GM), tobramicina (TOB), fardiomicina (FRM), amikacina (AMK), ciprofloxacina (CIP), ofloxacina (OFLX), lomefloxacina (LFLX), levofloxacina (LVLX), orbifloxacina (OBFX), enrofloxacina (EREX) y florfenicol (FF) se realizaron mediante el método de difusión en disco y la prueba de CMI basada en CSLI. La figura muestra el estado de resistencia de los antimicrobianos (rojo, resistente; rosa, intermedio; azul, sensible).
Figura 1. Patrón de susceptibilidad antimicrobiana de los 29 aislados de los canales auditivos de los perros. Se construyó un árbol rectangular de unión vecina basado en los datos MLST de todos los aislados. Se anotó en el árbol filogenético un mapa de calor que representa el perfil de susceptibilidad antimicrobiana para cada cepa. Las pruebas antimicrobianas para colistina (COL), ceftazidima (CAZ), cefpodoxima (CPDX), cefovecina (CFV), cefepima (CFPM), aztreonam (AZT), piperacilina-tazobactam (PIP/TAZ), imipenem (IPM), meropenem (MEM), gentamicina (GM), tobramicina (TOB), fardiomicina (FRM), amikacina (AMK), ciprofloxacina (CIP), ofloxacina (OFLX), lomefloxacina (LFLX), levofloxacina (LVLX), orbifloxacina (OBFX), enrofloxacina (EREX) y florfenicol (FF) se realizaron mediante el método de difusión en disco y la prueba de CMI basada en CSLI. La figura muestra el estado de resistencia de los antimicrobianos (rojo, resistente; rosa, intermedio; azul, sensible).
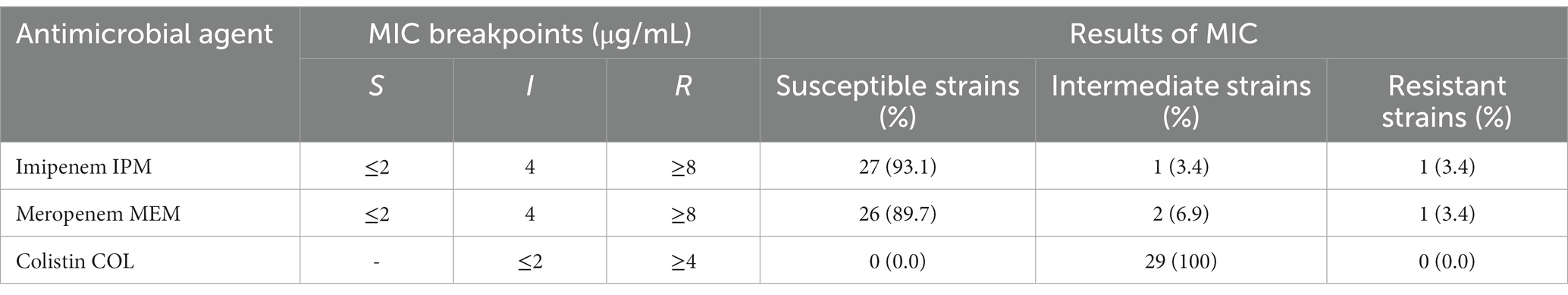 Tabla 3. Concentración inhibitoria mínima (CMI) para imipenem, meropenem y colistina para los aislados de 29 P. aeruginosa obtenidos de los canales auditivos de perros.
Tabla 3. Concentración inhibitoria mínima (CMI) para imipenem, meropenem y colistina para los aislados de 29 P. aeruginosa obtenidos de los canales auditivos de perros.
Distribución de complejos clonales
Utilizando el análisis MLST, se identificaron 27 ST entre los 29 aislados de los canales auditivos de perros afectados con otitis. Se asignaron dos ST a cuatro aislados: ST 1153 se asignó a los aislados PA 24667 y PA 30323, mientras que ST2839 se asignó a los aislados PA 27976 y PA 33599. Las mismas ST significan secuencias idénticas en todos los genes de limpieza. Se asignaron otras tribus ST para otros aislamientos. Luego analizamos los CC utilizando estos ST. Las ST actuales no exhibieron una formación de CC entre las cepas aisladas, excepto por dos grupos relacionados clonalmente por una sola variante de locus: ST313 con ST3882 y ST505 con ST3886. Los 25 ST restantes se clasificaron como singletons (Figura 2A), lo que indica la alta diversidad genética entre los aislados. Se examinó la relación genética de las cepas aisladas en este estudio con las ST prevalentes en Japón. Se observó una relación entre dos ST, ST3881 y ST1646, que están relacionados clonalmente por una sola variante de locus con los previamente identificados ST1831 y ST1413 de Japón, respectivamente, mientras que ST532 es el grupo fundador de dos ST japoneses, ST1812 y ST1849 (Figura 2A). Además, tres clones humanos de alto riesgo previamente identificados fueron identificados en el estudio actual: ST27, ST532 y ST654.
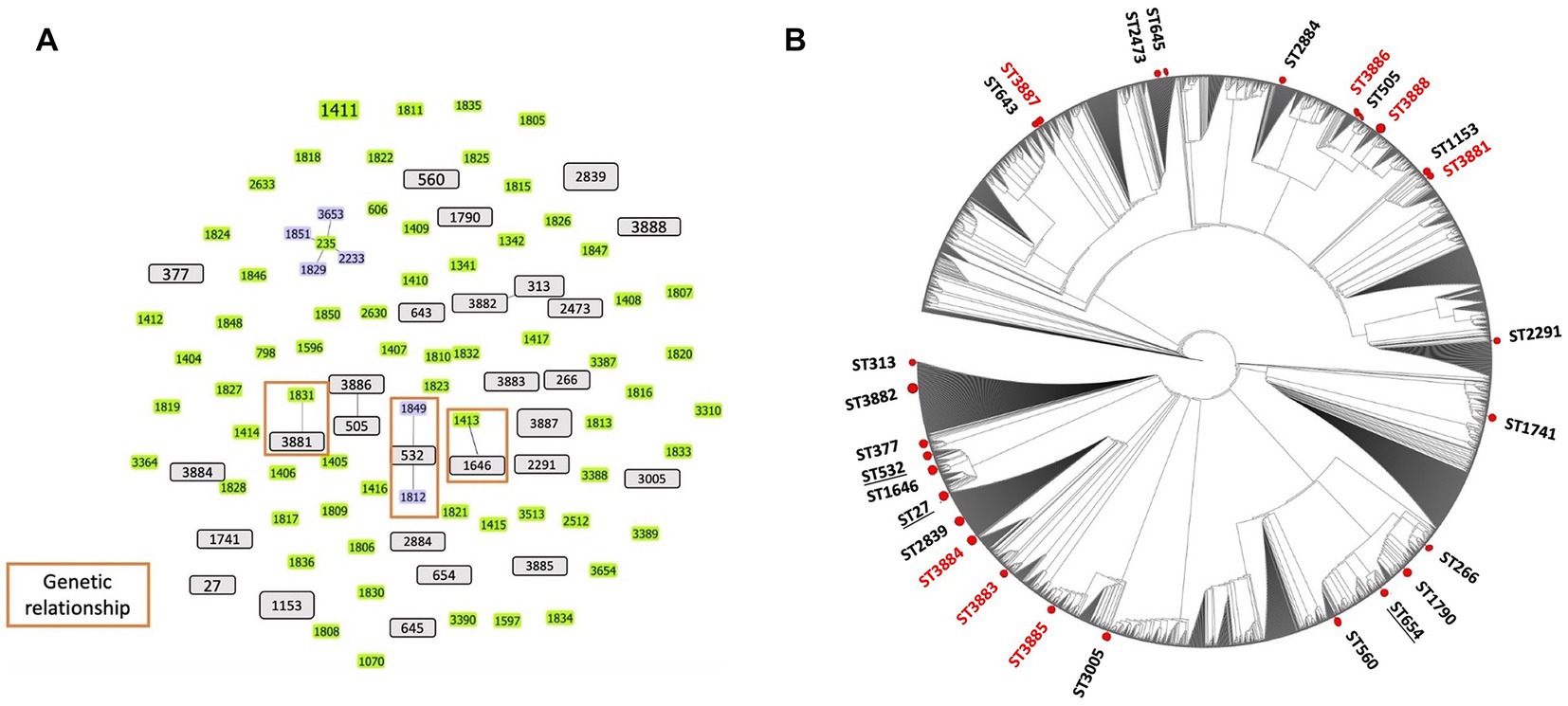 Figura 2. Estructura poblacional de las cepas de Pseudomonas aeruginosa: (A) Relación genética entre todos los tipos de secuencias conocidos (ST) y los ST caninos de P. aeruginosa identificados en Japón. Se mostraron tres complejos clonales mediante el análisis de variantes de locus único utilizando el software goeBURST (naranja rectangular). Las barras grises representan todas las ST identificadas en este estudio de perros. Las barras verde y azul (ST fundador) indican los ST identificados en Japón según la base de datos pubMLST. (B) El árbol filogenético representa la distribución de los ST identificados en este estudio de perros entre todos los ST conocidos de la base de datos pubMLST. Los círculos rojos indican las posiciones de las ST en este estudio (las ST rojas son nuevas ST identificadas). No se observó formación de racimos entre las ST de P. aeruginosa aisladas de perros. Las ST subrayadas representan los clones de alto riesgo de P. aeruginosa identificados a partir de aislados de perros en este estudio.
Figura 2. Estructura poblacional de las cepas de Pseudomonas aeruginosa: (A) Relación genética entre todos los tipos de secuencias conocidos (ST) y los ST caninos de P. aeruginosa identificados en Japón. Se mostraron tres complejos clonales mediante el análisis de variantes de locus único utilizando el software goeBURST (naranja rectangular). Las barras grises representan todas las ST identificadas en este estudio de perros. Las barras verde y azul (ST fundador) indican los ST identificados en Japón según la base de datos pubMLST. (B) El árbol filogenético representa la distribución de los ST identificados en este estudio de perros entre todos los ST conocidos de la base de datos pubMLST. Los círculos rojos indican las posiciones de las ST en este estudio (las ST rojas son nuevas ST identificadas). No se observó formación de racimos entre las ST de P. aeruginosa aisladas de perros. Las ST subrayadas representan los clones de alto riesgo de P. aeruginosa identificados a partir de aislados de perros en este estudio.
El presente estudio realizó un análisis filogenético utilizando secuencias concatenadas de alelos MLST, que involucró tanto los ST de este estudio como toda la base de datos MLST a la fecha del análisis. El árbol circular obtenido de este análisis indica que los ST examinados en nuestro estudio muestran diversidad y están dispersos entre todos los ST conocidos para el organismo P. aeruginosa, sin formar ningún grupo distinto. Los resultados de este análisis se ilustran en la Figura 2B. Además, el mapa de calor para los patrones de susceptibilidad antimicrobiana se anotó en el árbol filogenético rectangular de las ST para examinar la diseminación de fenotipos resistentes en el árbol. Los fenotipos de resistencia a los antibióticos (es decir, susceptible, intermedio y resistente) se distribuyeron en todos los grupos. Las cepas altamente resistentes no variaron significativamente entre los grupos (Figura 1).
Discusión
Se ha informado en varios países que los agentes causantes de infecciones oportunistas, como P. aeruginosa y otros organismos transmitidos por animales de compañía, están desarrollando resistencia a los antibióticos (42, 43). La propagación de bacterias resistentes a los antibióticos de los animales a las personas es un importante problema de salud pública, especialmente cuando esas bacterias son resistentes a los antimicrobianos utilizados en medicina humana (23). El enfoque One Health enfatiza la necesidad de la vigilancia de la resistencia a los antimicrobianos de P. aeruginosa, particularmente en las interacciones humano-animal-ambiente. Sin embargo, los estudios sobre el monitoreo continuo de patrones antimicrobianos y la caracterización genética de aislados de P. aeruginosa de perros son limitados en Japón. A partir de la revisión de la frecuencia de resistencia a los 20 antibióticos demostrada en nuestro estudio, concluimos que las líneas terapéuticas para estos aislados son desafiantes. La alta variación en la frecuencia de resistencia hacia los antibióticos veterinarios de uso común, como las fluoroquinolonas (que van del 24,1 al 86,2%), dificulta la elección de un antimicrobiano adecuado, y esto podría atribuirse a la discrepancia entre los diferentes métodos utilizados para verificar la susceptibilidad (la prueba de difusión en disco en nuestro estudio). Sin embargo, cuando se diagnostica otitis asociada con una infección por P. aeruginosa, una prueba de sensibilidad a los antibióticos sigue siendo el método confiable para identificar y guiar el tratamiento óptimo (44). En comparación con las investigaciones científicas sobre P. aeruginosa aislada de perros, el perfil de resistencia a antibióticos fue ligeramente mayor en los aislados del presente estudio, con la aparición de una alta frecuencia de aislados MDR y XDR (36, 37). Este aumento en el número de cepas resistentes aisladas en este estudio puede atribuirse a la naturaleza resistente bien reconocida y, a veces, multirresistente de la bacteria contra los antibióticos comúnmente utilizados en el campo veterinario. Por lo tanto, la elección de antimicrobianos para tratar la enfermedad en entornos clínicos es limitada (45). La sobreproducción de genes AmpC codificados cromosómicamente, la oprD de porina de la membrana externa y el sistema de eflujo de múltiples fármacos son los desafíos terapéuticos predominantes de este organismo (46). El árbol filogenético mostró que los fenotipos de resistencia a los antimicrobianos se distribuyen entre todas las cepas sin una formación significativa de grupos, lo que indica una débil asociación genética relacionada con la resistencia entre los aislados actuales. En particular, dos cepas poseen las mismas ST (ST2839 y ST1153) y se ha demostrado que tienen tasas variables de resistencia a los antibióticos. Sin embargo, poseen una susceptibilidad común a CAZ, CFPM, GM y TOB, lo que sugiere el posible tratamiento de cepas que comparten material genético idéntico.
Curiosamente, la Ley de Control de Enfermedades Infecciosas en Japón no describió un aislado resistente a carbapenem de aislados de P. aeruginosa y MDR originarios de animales de compañía. Sin embargo, el presente estudio detectó que el 34,5 y el 58,6% de los aislados de P. aeruginosa se clasificaron como MDR y XDR, enfatizando la necesidad de una investigación regular de la resistencia. Las tasas de resistencia GM y CAZ en nuestro estudio fueron de 10.3 y 3.4%, respectivamente, y son similares a las reportadas previamente contra P. aeruginosa en perros, que es 19.4 y 1.4%, respectivamente (37, 47, 48). El CAZ, GM, PIP/TAZ, CFPM y TOB retuvieron actividad bactericida contra los aislados de los canales auditivos de los perros.
Los animales de compañía representan un reservorio insuficientemente investigado de cepas de P. aeruginosa que exhiben resistencia a los antimicrobianos. En casos de infecciones por MDR-P. aeruginosa en humanos, la polimixina (colistina) y los carbapenémicos (imipenem y meropenem) son reconocidos como las mejores opciones terapéuticas (49). En este estudio, investigamos la prevalencia de cepas resistentes de P. aeruginosa, aisladas de perros en Japón, hacia COL, IPM y MEM utilizando la prueba MIC, que es confiable y precisa para estos antimicrobianos. Nuestra investigación reveló que todos los aislados de P. aeruginosa exhibieron susceptibilidad intermedia a la colistina (COL). Este hallazgo enfatiza la necesidad de un monitoreo continuo de cepas aisladas de animales de compañía en Japón. Al mismo tiempo, la resistencia a los carbapenémicos también es crucial. Los aislados resistentes a los carbapenémicos de P. aeruginosa han sido detectados por la prueba MIC y se encontró que son 3.4% para IPM y MEM. Se observó que la investigación epidemiológica sobre el aumento en la frecuencia de resistencia a los carbapenémicos varió de 0,0% en 2003-2010 (37), 0,5% en 2014-2015 (36), 6,67% en 2017-2018 (50) a 3,4% en 2020 (el estudio actual). En Japón, se encontró que los aislados de P. aeruginosa resistentes a carbapenem de animales de compañía fluctúan con el tiempo (50), lo que indica que es necesario un estudio continuo de P. aeruginosa resistente a carbapenem del entorno de las mascotas. Aunque el estado de resistencia a los carbapenémicos en Japón no es una crisis según lo informado por el sistema japonés de monitoreo de resistencia a los antimicrobianos veterinarios (JVARM), estudios científicos recientes (36, 37, 50) informaron un aumento en los aislados resistentes a carbapenem de perros y gatos. Sin embargo, el uso de antimicrobianos en Japón parece prudente, y este aumento podría deberse a las prescripciones de dichos medicamentos por parte de los proveedores locales de medicamentos, la importación de medicamentos por parte del personal y el uso de antimicrobianos humanos en el tratamiento de animales de compañía, que no son controlados en virtud de la JVARM y están excluidos de los cálculos (51). Estos hallazgos indican que los nichos veterinarios, especialmente la interfaz perro-humano, representan un reservorio potencial de P. aeruginosa resistente para animales y humanos. El uso de AOL en medicina humana fue relativamente bajo debido a su neurotoxicidad y nefrotoxicidad (52). Sin embargo, en la práctica clínica veterinaria y humana, el AOL se ha reintroducido para tratar patógenos resistentes a otros antimicrobianos disponibles. El tratamiento recomendado de la otitis en perros incluye el reconocimiento y manejo de los factores predisponentes, la limpieza del oído, el tratamiento tópico y la inyección sistémica de antimicrobianos (si es necesario). Las polimixinas, incluido el COL, se han introducido en algunos países como ingredientes activos autorizados para la aplicación tópica del oído en el tratamiento de la otitis canina (43) y para el tratamiento intravenoso de animales destinados a la producción de alimentos y la septicemia equina (53, 54). Se requiere restricción en el uso de COL, IPM y MEM en la sección veterinaria para guardar estos antibióticos como las últimas líneas de defensa contra MDR-P. aeruginosa en humanos, especialmente fibrosis quística (49, 55).
The inappropriate use of antibiotics may induce an annual increase in antibiotic resistance, particularly for antibiotics considered crucial therapeutic agents for treating P. aeruginosa infections in humans. The high level of resistance toward fluoroquinolones (i.e., CIP and ERFX) among isolates that originated from dogs is alarming. The ERFX antibiotic is a potential therapeutic option for the treatment of many human diseases (56). The Nippon AMR One Health Report5 stated in 2021 that fluoroquinolones such as ERFX and OBFX have been used in a persistent amount (between 0.81 and 0.91 ton every year from 2013 to 2018) for treatment of dogs and cats. The amount of CIP used, which is an active metabolite of ERFX, cannot be measured because its prescription has been restricted for veterinarians in Japan. Thus, attention should be paid to monitoring the jumping of resistance to ERFX and CIP. Collectively, the isolated P. aeruginosa strains from dogs in the current study exhibited a high frequency of antibiotic resistance, yet CFPM, GM, TOB, PIP/TAZ, and CAZ possess the ability to kill the P. aeruginosa isolated from the ear canal of affected dogs. A widely utilized approach to preserve susceptibility to these therapeutic agents for clinical purposes is combining phage therapy with alternative antimicrobial methods, such as phage-antibiotic synergy. This method is particularly effective against drug-resistant bacteria (57).
En particular, los animales, particularmente los animales de compañía, han sido reconocidos como reservorios potenciales de bacterias resistentes a múltiples fármacos y genes de resistencia que pueden transmitirse a los humanos (58-60). El análisis genético de los aislados de P. aeruginosa de perros proporciona información importante sobre la distribución geográfica de estos aislados en la comunidad veterinaria relacionada con los seres humanos (59). En el presente estudio, se identificaron tres clones humanos de alto riesgo previamente identificados (ST532, ST27 y ST654) a partir de los aislados de perros infectados en este estudio, que representan su capacidad para colonizar en diferentes nichos, incluido el entorno animal, y es indicativo de una posible transmisión zoonótica a los humanos (61). Elegimos la técnica MLST para nuestro estudio para distinguir fácilmente las cepas de P. aeruginosa y comparar las ST recuperadas de perros con las que circulan en la misma área geográfica, es decir, Japón. Nuestro estudio apoya la estructura epidémica no clonal de las cepas de P. aeruginosa (62-64), mientras que la relación genética entre algunos clones aislados de perros (es decir, ST3881, ST1646 y ST532) y los ST japoneses aislados de heridas e infecciones del tracto urinario en humanos (es decir, ST1831, ST1413, ST1812 y ST1849) apoyan la teoría de la transmisión horizontal de P. aeruginosa de perro a humano. Estudios previos han reportado aislados de MDR-P. aeruginosa de un perro infectado, su dueño y el entorno doméstico, lo que sugiere la ocurrencia de transmisión antroponótica del zoológico (65, 66). Además, el análisis filogenético de los datos resultantes facilita una clara demostración de la posición evolutiva relativa intraespecie de las cepas que habitan perros indicada por la distribución no agrupada de ST de perros entre toda la base de datos MLST de P. aeruginosa. Los hallazgos del estudio actual (es decir, la asociación genética entre las ST de perro y las que circulan en humanos en Japón y las ST de perro que coincidían con las ST en la base de datos MLST aisladas de diferentes muestras clínicas) promovieron el concepto de que los aislados de P. aeruginosa son simplemente cepas ambientales que se transmiten a los humanos después de adaptarse ambientalmente. Aquí, podemos apoyar la hipótesis de la transmisión zoonótica del propio perro o del entorno de un perro infectado a su dueño inmunocomprometido, especialmente en presencia de compartir la vida entre mascotas y humanos. Los hallazgos actuales apoyan hipotéticamente los informes anteriores de transmisión de P. aeruginosa, ya sea directa o indirectamente a través de la contaminación de objetos ambientales (67-69). Dado que la propiedad de mascotas, especialmente perros y gatos, se vuelve progresivamente popular en Japón, se debe aumentar la conciencia y el conocimiento sobre las preocupaciones de salud pública relacionadas. Si bien hemos hecho esfuerzos para garantizar la confiabilidad de cada resultado experimental presentado en este estudio, es importante reconocer ciertas limitaciones que pueden afectar la interpretación de los hallazgos empíricos. Estas limitaciones incluyen el pequeño tamaño de la muestra, que debe abordarse en estudios futuros para apoyar y fortalecer aún más las conclusiones extraídas.
Conclusión
Es necesario actualizar continuamente los perfiles de resistencia a los antimicrobianos para establecer los antibióticos adecuados para tratar las infecciones por P. aeruginosa en perros y monitorear la aparición de nuevos clones de P. aeruginosa del entorno de las mascotas. Además, nuestro estudio mostró que CFPM, PIP / TAZ, CAZ, TOB y GM podrían ser opciones terapéuticas confiables para tratar la otitis canina pseudomonal.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / Materiales complementarios, las consultas adicionales pueden dirigirse al autor correspondiente.
Contribuciones del autor
AE, JU y KN concibieron y diseñaron el estudio, y revisaron sustancialmente el documento. AE, JU, KG, KIY y YT llevaron a cabo los experimentos, el análisis de datos y la adquisición. AE, II, RR, WN, TT y KK redactaron el manuscrito original. JU, KID y KN supervisaron el estudio. Todos los autores leyeron y aprobaron el manuscrito final.
Financiación
AE ha recibido apoyo financiero de la Universidad de Damanhour y el Sector de Misión, Ministerio de Educación Superior, Egipto para realizar el estudio actual (programa 2018/2019).
Conflicto de intereses
TT fue empleado por Zenoaq Co. Ltd.
Los autores restantes declaran que la investigación se realizó en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1074127/full#supplementary-material
Notas
1. ^https://pubmlst.org/bigsdb?db=pubmlst_paeruginosa_seqdef
2. ^https://pubmlst.org/paeruginosa/; consultado el 5 de febrero de 2022
3. ^https://itol.embl.de/
4. ^http://goeBURST.phyloviz.net
5. ^https://www.mhlw.go.jp/content/10900000/000885373.pdf
Referencias
1. Hill, PB, Lo, A, Eden, CAN, Huntley, S, Morey, V, Ramsey, S, et al. Estudio de la prevalencia, diagnóstico y tratamiento de afecciones dermatológicas en pequeños animales en medicina general. Veterinario Rec. (2006) 158:533–9. DOI: 10.1136/VR.158.16.533
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Souza, CP, Foss, KD, Mascarenhas, MB y Clegg, JL. Otitis media con derrame en dos perros Boston terrier. Vet Med Sci. (2023) 9:1069–73. DOI: 10.1002/VMS3.1092
5. Huang, H-P, Little, CJL y McNeil, PE. Cambios histológicos en el canal auditivo externo de perros con otitis externa. Veterinario Dermatol. (2009) 20:422–8. doi: 10.1111/j.1365-3164.2009.00853.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Noli, C, Colombo, S, Cornegliani, L, Ghibaudo, G, Persico, P, Vercelli, A, et al. Calidad de vida de los perros con enfermedades de la piel y de sus dueños. Parte 2: administración de un cuestionario en diversas enfermedades de la piel y correlación con la eficacia de la terapia. Veterinario Dermatol. (2011) 22:344–51. doi: 10.1111/j.1365-3164.2011.00956.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Angus, JC. Citología ótica en salud y enfermedad. Veterinario Clin North am Small Anim Pract. (2004) 34:411–24. doi: 10.1016/j.cvsm.2003.10.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Topală, R, Burtan, I, Fântânaru, M, Ciobanu, S, y Burtan, LC. Estudios epidemiológicos de otitis externa en carnívoros. Luc ştiinłifice med vet. (2007) 40:247–51.
9. Agosto, JR. Otitis externa. Una enfermedad de etiología multifactorial. Veterinario Clin North am Small Anim Pract. (1988) 18:731–42. doi: 10.1016/s0195-5616(88)50076-1
10. Cole, LK, Kwochka, KW, Kowalski, JJ y Hillier, A. Flora microbiana y patrones de susceptibilidad antimicrobiana de patógenos aislados del canal auditivo horizontal y el oído medio en perros con otitis media. J Am Vet Med Assoc. (1998) 212:534–8.
11. O’Neill, DG, Volk, AV, Soares, T, Church, DB, Brodbelt, DC, and Pegram, C. Frequency and predisposing factors for canine otitis externa in the UK–a primary veterinary care epidemiological view. Canino Med Genet. (2021) 8:7. DOI: 10.1186/s40575-021-00106-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Baba, E, and Fukata, T. Incidence of otitis externa in dogs and cats in Japan. Veterinario Rec. (1981) 108:393–5. DOI: 10.1136/VR.108.18.393
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Griffin, C. Clasificación de casos de otitis externa en el sistema PPSP. Actas del taller de ESVD sobre Otitis St Helens. (2010).
14. O’Neill, DG, Lee, YH, Brodbelt, DC, Church, DB, Pegram, C, and Halfacree, Z. Reporting the epidemiology of aural heematoma in dogs and proposal a novel aetiopathogenetic pathway. Sci Rep. (2021) 11:21670. DOI: 10.1038/S41598-021-00352-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Harvey, R. Una revisión de los desarrollos recientes en otología veterinaria. Vet. (2022) 9:161. doi: 10.3390/vetsci9040161
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Schaefer, P, y Baugh, RF. Otitis externa aguda: una actualización. Am Fam Médico. (2012) 86:1055–61.
17. Rosenfeld, RM, Brown, L, Cannon, CR, Dolor, RJ, Ganiats, TG, Hannley, M, et al. Guía de práctica clínica: Otitis externa aguda. Otorrinolaringol Cabeza Cuello Quirúrgico. (2006) 134:S4–S23. doi: 10.1016/j.otohns.2006.02.014
18. Schick, AE, Angus, JC y Coyner, KS. Variabilidad de la identificación en laboratorio y notificación de susceptibilidad a antibióticos de aislados de Pseudomonas spp. de perros con otitis externa crónica. Veterinario Dermatol. (2007) 18:120–6. doi: 10.1111/j.1365-3164.2007.00581.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Rosenfeld, RM, Schwartz, SR, Cannon, CR, Roland, PS, Simon, GR, Kumar, KA, et al. Guía de práctica clínica: otitis externa aguda. Otorrinolaringol Cabeza Cuello Quirúrgico. (2014) 150:S1–S24. doi: 10.1177/0194599813517083
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. De Martino, L, Nocera, FP, Mallardo, K, Nizza, S, Masturzo, E, Fiorito, F, et al. Una actualización sobre las causas microbiológicas de la otitis externa canina en la región de Campania, Italia. Asian Pac J Trop Biomed. (2016) 6:384–9. doi: 10.1016/j.apjtb.2015.11.012
21. Nocera, FP, Ambrosio, M, Fiorito, F, Cortese, L, y De Martino, L. Sobre infecciones de piel caninas y felinas grampositivas y gramnegativas asociadas a bacterias: un estudio retrospectivo de 4 años del Laboratorio de diagnóstico de microbiología veterinaria de la universidad de Nápoles, Italia. Animales. (2021) 11:1603. DOI: 10.3390/ANI11061603
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Von Silva-Tarouca, MSE, Wolf, G, y Mueller, RS. Determinación de concentraciones inhibitorias mínimas para sulfadiazina de plata y otros agentes antimicrobianos tópicos frente a cepas de Pseudomonas aeruginosa aisladas de otitis externa canina. Veterinario Dermatol. (2019) 30:145–e42. DOI: 10.1111/VDE.12718
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Guardabassi, L, Schwarz, S, y Lloyd, DH. Animales de compañía como reservorios de bacterias resistentes a los antimicrobianos: revisión. J Quema antimicrobiana. (2004) 54:321–32. doi: 10.1093/jac/dkh332
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Rubin, J, Walker, RD, Blickenstaff, K, Bodeis-Jones, S, and Zhao, S. Antimicrobial resistance and genetic characterization of fluoroquinolone resistance of Pseudomonas aeruginosa isolated from canine infections. Veterinario Microbiol. (2008) 131:164–72. doi: 10.1016/j.vetmic.2008.02.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. MacVane, SH, Pandey, R, Steed, LL, Kreiswirth, BN y Chen, L. Emergence of Ceftolozane-Tazobactam-resistant Pseudomonas aeruginosa during treatment is mediated by a single AmpC structural mutation. Agentes antimicrobianos Chemother. (2022) 61:E01183. doi: 10.1128/AAC.01183-17
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Yiwei, Z, Jie, C, Han, S, Zhongju, C, Qi-wen, Y, Jin, Z, et al. Aparición de Pseudomonas aeruginosa productora de Carbapenemasas resistente a ceftazidima y avibactam en China. mSystems. (2022) 6:E0078721. doi: 10.1128/mSystems.00787-21
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Nuttall, T, y Cole, LK. Dermatología veterinaria basada en la evidencia: una revisión sistemática de intervenciones para el tratamiento de la otitis por Pseudomonas en perros. Veterinario Dermatol. (2007) 18:69–77. doi: 10.1111/j.1365-3164.2007.00575.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Moradali, MF, Ghods, S, y Rehm, BHA. Estilo de vida de Pseudomonas aeruginosa: un paradigma de adaptación, supervivencia y persistencia. Las células frontales infectan microbiol. (2017) 7:39. DOI: 10.3389/fcimb.2017.00039
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Brock, MT, Fedderly, GC, Borlee, GI, Russell, MM, Filipowska, LK, Hyatt, DR, et al. Las variantes de Pseudomonas aeruginosa obtenidas de muestras clínicas veterinarias revelan un papel para el di-GMP cíclico en la formación de biopelículas y la morfología de la colonia. Microbiología. (2017) 163:1613–25. doi: 10.1099/mic.0.000541
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Hu, H, and Manos, J. Pulsed-field gel electroforesis of Pseudomonas aeruginosa. Métodos Mol Biol. (2015) 1301:157–70. doi: 10.1007/978-1-4939-2599-5_14
31. Syrmis, MW, O’Carroll, MR, Sloots, TP, Coulter, C, Wainwright, CE, Bell, SC, et al. Genotipado rápido de aislados de Pseudomonas aeruginosa albergados por pacientes adultos y pediátricos con fibrosis quística mediante ensayos de PCR basados en elementos repetitivos. J Med Microbiol. (2004) 53:1089–96. DOI: 10.1099/JMM.0.45611-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Curran, B, Jonas, D, Grundmann, H, Pitt, T, y Dowson, CG. Desarrollo de un esquema de tipificación de secuencias multilocus para el patógeno oportunista Pseudomonas aeruginosa. J Clin Microbiol. (2004) 42:5644–9. doi: 10.1128/JCM.42.12.5644-5649.2004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Vernez, I, Hauser, P, Bernasconi, MV y Blanc, DS. Análisis genético poblacional de Pseudomonas aeruginosa mediante tipificación de secuencias multilocus. FEMS Immunol Med Microbiol. (2005) 43:29–35. doi: 10.1016/j.femsim.2004.06.024
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Aslam, B, Khurshid, M, Arshad, MI, Muzammil, S, Rasool, M, Yasmeen, N, et al. Resistencia a los antibióticos: una salud, una perspectiva mundial. Las células frontales infectan microbiol. (2021) 11:771510. DOI: 10.3389/fcimb.2021.771510
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Marco-Fuertes, A, Marin, C, Lorenzo-Rebenaque, L, Vega, S, y Montoro-Dasi, L. Antimicrobial resistance in companion animals: a new challenge for the one health approach in the European Union. Veterinario Sci. (2022) 9:208. DOI: 10.3390/VETSic9050208
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Yukawa, S, Tsuyuki, Y, Sato, T, Fukuda, A, Usui, M, and Tamura, Y. Antimicrobial resistance of Pseudomonas aeruginosa isolated from dogs and cats in primary veterinary hospitals in Japan. Jpn J Infectar Dis. (2017) 70:461. DOI: 10.7883/Yoken. JJID.2016.536
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Harada, K, Arima, S, Niina, A, Kataoka, Y, and Takahashi, T. Characterization of Pseudomonas aeruginosa isolates from dogs and cats in Japan: current status of antimicrobial resistance and prevailing resistance mechanisms. Microbiol Immunol. (2012) 56:123–7. doi: 10.1111/j.1348-0421.2011.00416.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Instituto de Estándares Clínicos y de Laboratorio. Instituto CaLS. Normas de rendimiento para las pruebas de sensibilidad al disco antimicrobiano y a la dilución para bacterias aisladas de animales CLSI suplemento VET08. Pensilvania: Instituto de Estándares Clínicos y de Laboratorio (2018).
39. Magiorakos, AP, Srinivasan, A, Carey, RB, Carmeli, Y, Falagas, ME, Giske, CG, et al. Bacterias multirresistentes, extremadamente resistentes a los medicamentos y panrresistentes: una propuesta internacional de expertos para definiciones estándar provisionales para la resistencia adquirida. Clin Microbiol Infect. (2012) 18:268–81. doi: 10.1111/j.1469-0691.2011.03570.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Francisco, AP, Bugalho, M, Ramirez, M, y Carriço, JA. Análisis eBURST óptimo global de datos de tipificación multilocus utilizando un enfoque matroide gráfico. BMC Bioinformática. (2009) 10:1–15. doi: 10.1186/1471-2105-10-152
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Harvey, Dakota del Norte. ¿Qué edad tiene mi perro? Identificación de grupos de edad racionales en perros de compañía basados en procesos normativos vinculados a la edad. Front Vet Sci. (2021) 8:643085. DOI: 10.3389/fvets.2021.643085
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Marshall, BM, Ochieng, DJ, y Levy, SB. Commensals: reservorio subestimado de resistencia a los antibióticos. Microbio. (2009) 4:231–8. doi: 10.1128/microbio.4.231.1
43. Scott, A, Pottenger, S, Timofte, D, Moore, M, Wright, L, Kukavica-Ibrulj, I, et al. Reservorios de resistencia: resistencia a la polimixina en aislados de animales de compañía asociados a veterinarios de Pseudomonas aeruginosa. Veterinario Rec. (2019) 185:206. DOI: 10.1136/VR.105075
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Zamankhan Malayeri, H, Jamshidi, S, and Zahraei, ST. Identification and antimicrobial susceptibility patterns of bacteria causing otitis externa in dogs. Vet Res Commun. (2010) 34:435–44. DOI: 10.1007/S11259-010-9417-Y
45. Nielsen, SS, Bicout, DJ, Calistri, P, Canali, E, Drewe, JA, Garin-Bastuji, B, et al. Evaluación de la inclusión y categorización de enfermedades animales en el marco de la legislación zoosanitaria [Reglamento (UE) n.º 2016/429]: Pseudomonas aeruginosa resistente a los antimicrobianos en perros y gatos. EFSA J. (2022) 20:E07310. doi: 10.2903/j.efsa.2022.7080
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Lister, PD, Wolter, DJ y Hanson, ND. Pseudomonas aeruginosa resistente a antibacterianos: impacto clínico y regulación compleja de mecanismos de resistencia codificados cromosómicamente. Clin Microbiol Rev. (2009) 22:582–610. doi: 10.1128/CMR.00040-09
47. Bourély, C, Cazeau, G, Jarrige, N, Leblond, A, Madec, JY, Haenni, M, et al. Patrones de resistencia a los antimicrobianos de bacterias aisladas de perros con otitis. Epidemiol Infect. (2019) 147:E121. doi: 10.1017/S0950268818003278
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Bugden, DL. Identificación y susceptibilidad a antibióticos de aislados bacterianos de perros con otitis externa en Australia. Aust Vet J. (2013) 91:43–6. doi: 10.1111/avj.12007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Jeannot, K, Hagart, K, Dortet, L, Kostrzewa, M, Filloux, A, Plesiat, P, et al. Detección de resistencia a la colistina en Pseudomonas aeruginosa utilizando la prueba MALDIxin en el espectrómetro de masas MALDI Biotyper Sirius de rutina. Microbiol frontal. (2021) 12:725383. doi: 10.3389/fmicb.2021.725383
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Hayashi, W, Izumi, K, Yoshida, S, Takizawa, S, Sakaguchi, K, Iyori, K, et al. Resistencia a los antimicrobianos y sistema de secreción tipo III Virulotipos de aislados de Pseudomonas aeruginosa de perros y gatos en hospitales veterinarios primarios de Japón: identificación de la secuencia internacional de clones de alto riesgo tipo 235. Microbiol Spectr. (2022) 9:E0040821. doi: 10.1128/Spectrum.00408-21
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Makita, K, Sugahara, N, Nakamura, K, Matsuoka, T, Sakai, M, and Tamura, Y. Current status of antimicrobial drug use in Japanese companion animal clinics and the factors associated with their use. Front Vet Sci. (2021) 8:705648. DOI: 10.3389/FVETS.2021.705648
52. Justo, JA, y Bosso, JA. Reacciones adversas asociadas con el tratamiento sistémico con polimixina. Farmacoterapia. (2015) 35:28–33. DOI: 10.1002/Phar.1493
53. Werners, AH. Tratamiento de la endotoxemia y septicemia en el paciente equino. J Vet Pharmacol Ther. (2017) 40:1–15. DOI: 10.1111/JVP.12329
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Catry, B, Cavaleri, M, Baptiste, K, Grave, K, Grein, K, Holm, A, et al. Uso de productos que contienen colistina dentro de la Unión Europea y el Espacio Económico Europeo (UE/EEE): desarrollo de resistencia en animales y posible impacto en la salud humana y animal. Int J Agentes antimicrobianos. (2015) 46:297–306. doi: 10.1016/j.ijantimicag.2015.06.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Langendonk, RF, Neill, DR, y Fothergill, JL. Los componentes básicos de la resistencia a los antimicrobianos en Pseudomonas aeruginosa: implicaciones para las terapias actuales para romper la resistencia. Las células frontales infectan microbiol. (2021) 11:665759. DOI: 10.3389/fcimb.2021.665759
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Baggio, D, y Ananda-Rajah, MR. Fluoroquinolone antibiotics and adverse events. Aust Prescr. (2021) 44:161–4. DOI: 10.18773/Austprescr.2021.035
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Uchiyama, J, Shigehisa, R, Nasukawa, T, Mizukami, K, Takemura-Uchiyama, I, Ujihara, T, et al. La piperacilina y la ceftazidima producen el efecto fago-antibiótico sinérgico más fuerte en Pseudomonas aeruginosa. Arco Virol. (2018) 163:1941–8. DOI: 10.1007/S00705-018-3811-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Tartor, YH, Gharieb, RMA, Abd El-Aziz, NK, El Damaty, HM, Enany, S, Khalifa, E, et al. Determinantes de virulencia y genes mcr de resistencia a la colistina mediados por plásmidos en bacterias gramnegativas aisladas de leche bovina. Las células frontales infectan microbiol. (2021) 11:761417. DOI: 10.3389/fcimb.2021.761417
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Argudín, MA, Deplano, A, Meghraoui, A, Dodémont, M, Heinrichs, A, Denis, O, et al. Bacterias de animales como un conjunto de genes de resistencia antimicrobiana. Antibióticos. (2017) 6:12. doi: 10.3390/antibióticos6020012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Hamame, A, Davoust, B, Cherak, Z, Rolain, J-M, and Diene, SM. Mobile Colistin resistance (mcr) genes in cats and dogs and their zoonotic transmission risks. Patógenos. (2022) 11:698. doi: 10.3390/patógenos11060698
Resumen de PubMed | Texto completo de CrossRef | Google Académico
61. del Barrio-Tofiño, E, López-Causapé, C, y Oliver, A. Pseudomonas aeruginosa epidemic high-risk clones and their association with horizontally-acquired β-lactamases: 2020 update. Int J Agentes antimicrobianos. (2020) 56:106196. doi: 10.1016/j.ijantimicag.2020.106196
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Maatallah, M, Cheriaa, J, Backhrouf, A, Iversen, A, Grundmann, H, Do, T, et al. Estructura poblacional de Pseudomonas aeruginosa de cinco países mediterráneos: evidencia de recombinación frecuente y ocurrencia epidémica de CC235. PLoS One. (2011) 6:–E25617. doi: 10.1371/journal.pone.0025617
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Nageeb, W, Amin, DH, Mohammedsaleh, ZM, y Makharita, RR. Nuevos marcadores moleculares vinculados a clones epidémicos de alto riesgo de Pseudomonas aeruginosa. Antibióticos. (2021) 10:35. doi: 10.3390/antibióticos10010035
64. Haenni, M, Hocquet, D, Ponsin, C, Cholley, P, Guyeux, C, Madec, JY, et al. Estructura poblacional y susceptibilidad antimicrobiana de Pseudomonas aeruginosa por infecciones animales en Francia. BMC Vet Res. (2015) 11:9–5. DOI: 10.1186/S12917-015-0324-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
65. Wang, Y, Wang, X, Schwarz, S, Zhang, R, Lei, L, Liu, X, et al. Pseudomonas aeruginosa de origen canino multirresistente productora de IMP-45. J Quema antimicrobiana. (2014) 69:2579–81. doi: 10.1093/jac/dku133
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. Fernandes, MR, Sellera, FP, Moura, Q, Carvalho, MPN, Rosato, PN, Cerdeira, L, et al. Transmisión zooantroponótica de Pseudomonas aeruginosa resistente a los medicamentos. Brasil Emerg infectar dis. (2018) 24:1160–2. DOI: 10.3201/EID2406.180335
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Muscarella, LF. Contribución del agua del grifo y las superficies ambientales a la transmisión nosocomial de Pseudomonas aeruginosa resistente a antibióticos. Infect Control Hosp Epidemiol. (2004) 25:342–5. doi: 10.1086/502402
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Suárez, C, Peña, C, Arco, O, Domínguez, MA, Tubau, F, Juan, C, et al. Un gran brote endémico sostenido de Pseudomonas aeruginosa multirresistente: un nuevo escenario epidemiológico para la adquisición nosocomial. BMC Infect Dis. (2011) 11:272. doi: 10.1186/1471-2334-11-272
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Voor in’t Holt, AF, Severin, JA, Hagenaars, MBH, de Goeij, I, Gommers, D, and Vos, MC. VIM-positive Pseudomonas aeruginosa in a large tertiary care hospital: matching case-control studies and a network analysis. Antimicrob resiste el control de infecciones. (2018) 7:32–10. doi: 10.1186/s13756-018-0325-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: otitis, perro, resistencia antimicrobiana, tipificación de secuencias multilocus, Pseudomonas aeruginosa
Cita: Elfadadny A, Uchiyama J, Goto K, Imanishi I, Ragab RF, Nageeb WM, Iyori K, Toyoda Y, Tsukui T, Ide K, Kawamoto K y Nishifuji K (2023) Resistencia antimicrobiana y genotipado de Pseudomonas aeruginosa aislado de los canales auditivos de perros en Japón. Frente. Vet. Sci. 10:1074127. doi: 10.3389/fvets.2023.1074127
Recibido: 19 de octubre de 2022; Aprobado: 22 de mayo de 2023;
Publicado: 20 julio 2023.
Editado por:
Mihai Mares, Universidad de Ciencias de la Vida de Iasi, Rumania
Revisado por:
Yasmine Hasanine Tartor, Universidad Zagazig, Egipto
Monia Cocchi, Instituto Zooprofiláctico Experimental de Venecia (IZSVe), Italia
Derechos de autor © 2023 Elfadadny, Uchiyama, Goto, Imanishi, Ragab, Nageeb, Iyori, Toyoda, Tsukui, Ide, Kawamoto y Nishifuji. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Koji Nishifuji, kojimail@cc.tuat.ac.jp
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

