Reversión del adenocarcinoma oral en estadio III en un perro
 Reversión del adenocarcinoma oral en estadio III en un perro tratado con el anticuerpo terapéutico anticanino PD-1: informe de un caso
Reversión del adenocarcinoma oral en estadio III en un perro tratado con el anticuerpo terapéutico anticanino PD-1: informe de un caso
 Shuo Xu1
Shuo Xu1  Jingshu Xie2
Jingshu Xie2  Shuaiyu Wang1
Shuaiyu Wang1  Na Tang1
Na Tang1  Junli Feng1
Junli Feng1  Youhong Su2
Youhong Su2  Gebin Li1*
Gebin Li1*- 1Facultad de Medicina Veterinaria, Universidad Agrícola de China, Pekín, China
- 2Biocytogen Pharmaceuticals (Beijing) Co., Ltd., Beijing, China
El anticuerpo monoclonal dirigido a la muerte celular programada-1 (PD-1) es una de las terapias de tratamiento más prometedoras para los cánceres humanos. Los anticuerpos PD-1 caninos utilizados en ensayos clínicos también han demostrado eficacia en el tratamiento de cánceres caninos. Un border collie macho intacto de 11 años de edad se presentó ante nosotros para evaluación de masa cervical izquierda. La tomografía computarizada (TC) reveló una masa faríngea irregular que invadía los tejidos blandos circundantes. Los resultados histológicos e inmunohistoquímicos fueron consistentes con el diagnóstico de adenocarcinoma, muy probablemente originado en la glándula salival menor. Se administró un anticuerpo monoclonal anticanino PD-1. Dos meses después del tratamiento inicial, el tumor alcanzó una remisión parcial y se mantuvo como tal durante 6 meses. Finalmente, el paciente fue sacrificado por causas ajenas al cáncer, con un tiempo de supervivencia de 316 días. Hasta donde sabemos, este es el primer reporte de respuesta al tratamiento con bloqueo de PD-1 en adenocarcinoma canino.
1. Introducción
Las neoplasias de las glándulas salivales son principalmente tumores epiteliales malignos y poco frecuentes en perros. Se calculó que la incidencia de neoplasias salivales en esta población era de 15,3 por cada 100.000 perros, lo que puede estar sobreestimado (1). En un estudio retrospectivo de tumores de glándulas salivales en perros y gatos, solo 3 de 24 casos se originaron en glándulas sublinguales y menores, lo que indica que la neoplasia de glándulas menores es mucho más rara (2). La cirugía es el pilar de la terapia. A pesar de que se recomienda la quimioterapia, no se describe con frecuencia debido a la escasa eficacia y a la escasez de información en la literatura. Actualmente no existen opciones de tratamiento particularmente efectivas, especialmente para tumores no aptos para cirugía de escisión.
Los inhibidores de puntos de control inmunitario (ICI, por sus siglas en inglés) se han convertido en opciones de tratamiento atractivas para una amplia gama de cánceres en humanos. El primer ICI, un anticuerpo dirigido al antígeno 4 de los linfocitos T citotóxicos (ipilimumab), fue aprobado por la Administración de Alimentos y Medicamentos (FDA) para tratar el melanoma metastásico en 2011 (3). El receptor de muerte celular programada 1 (PD-1) y sus ligandos (PD-L1 y PD-L2) son uno de los puntos de control inmunitario más atractivos. La PD-1 puede expresarse en células T y B activadas, macrófagos y células NK, mientras que la PD-L1 puede expresarse ampliamente en tejidos no linfoides, incluidas las células tumorales y las células inmunitarias infiltrantes de tumores (4-6). Dado que la vía de señalización de PD-1 inhibe la proliferación de células T y la producción de citoquinas, el bloqueo de PD-1 revierte la inmunosupresión antitumoral mediada por PD-1 (7, 8). Se han desarrollado y aprobado varios inhibidores de PD-1 y PD-L1 para la terapia contra el cáncer en humanos. Hasta ahora, tres anticuerpos anti-PD-1 han sido aprobados por la FDA: pembrolizumab (Keytruda), nivolumab (Opdivo) y cemiplimab (Libtayo), que se pueden usar para tratar el cáncer humano, incluido el melanoma irresecable o metastásico, el cáncer de pulmón de células no pequeñas y el carcinoma de células escamosas (9). En medicina veterinaria, el anticuerpo PD-1/PD-L1 se ha utilizado en el tratamiento del melanoma maligno oral (OMM) y ha logrado cierta eficacia (10, 11), pero todos ellos se limitan a ensayos clínicos y ninguno ha sido aprobado para la terapia anticancerígena de perros.
En este caso, el paciente con adenocarcinoma oral fue tratado con el anticuerpo monoclonal anticanino PD-1 denominado MP001, producido por Biocytogen Pharmaceuticals (Beijing) Co., Ltd. MP001 es un anticuerpo totalmente caninizado y la concentración de inmunoglobulina es de 10 mg/mL. Hasta donde sabemos, el tratamiento con bloqueo de PD-1 en el adenocarcinoma oral canino no ha sido reportado previamente.
2. Presentación del caso
Un border collie macho intacto de 11 años fue presentado en el hospital de enseñanza veterinaria de la Universidad Agrícola de China con una masa cervical izquierda. La masa ha estado presente durante dos semanas con síntomas clínicos como ptialismo, disfagia y ocasionalmente taquipnea.
En el examen físico se detectó puntuación de condición corporal de 4/9, estado mental normal, hidratación adecuada, mucosa rosada, tiempo normal de llenado capilar y temperatura rectal normal. A excepción de la masa, no hubo un agrandamiento evidente de los ganglios linfáticos superficiales (LN). A la palpación, la masa cervical se localizaba profundamente en el lado ventral izquierdo, sólida y fija. No se pudo detectar ninguna masa evidente en el examen oral sin anestesia.
La masa fue identificada por ecografía cervical, mostrando un aspecto mixto ecogénico y cavitado en el cuello izquierdo con vascularización leve, midiendo aproximadamente 3,34 × 2,87 cm en el plano sagital. La LN retrofaríngea medial izquierda era desigualmente hipoecogénica y estaba mal delimitada de la masa. Los tejidos blandos de la faringe eran hipoecogénicos de hasta 1,0 cm de grosor. Además, el hemograma completo y la bioquímica sérica se encontraban dentro de los límites normales. No se detectaron anomalías a través de radiografías torácicas de dos vistas.
A continuación, se realizó el examen oral y la tomografía computarizada (TC) bajo anestesia general. El examen bucal reveló una masa engrosada en forma de anillo en el paladar blando izquierdo (Figura 1A). Y la tomografía computarizada reveló además que esta masa faríngea era de forma irregular, de 6,93 × 3,63 × 2,94 cm de tamaño, caracterizada por un realce de contraste heterogéneo y anular con un ligero realce en la banda interna y un realce significativo en la banda externa, que involucra el paladar blando, la epiglotis, la amígdala izquierda, parte del cartílago cricoides y los músculos adyacentes, como el músculo pterigoideo medial izquierdo. músculo digástrico izquierdo e iniciación del músculo largo de la cabeza (Figura 2A). Además, la NL retrofaríngea medial izquierda estaba irregularmente agrandada con necrosis (3,88 × 3,01 × 3,12 cm; Figura 2B). Y también se encontró un leve aumento de tamaño de la NL mandibular izquierda (1,74 × 0,66 cm). Sin evidencia de metástasis a distancia, el principal diagnóstico diferencial incluyó carcinoma de glándulas salivales, carcinoma de células escamosas de amígdalas, OMM, fibrosarcoma, sarcoma de origen muscular.
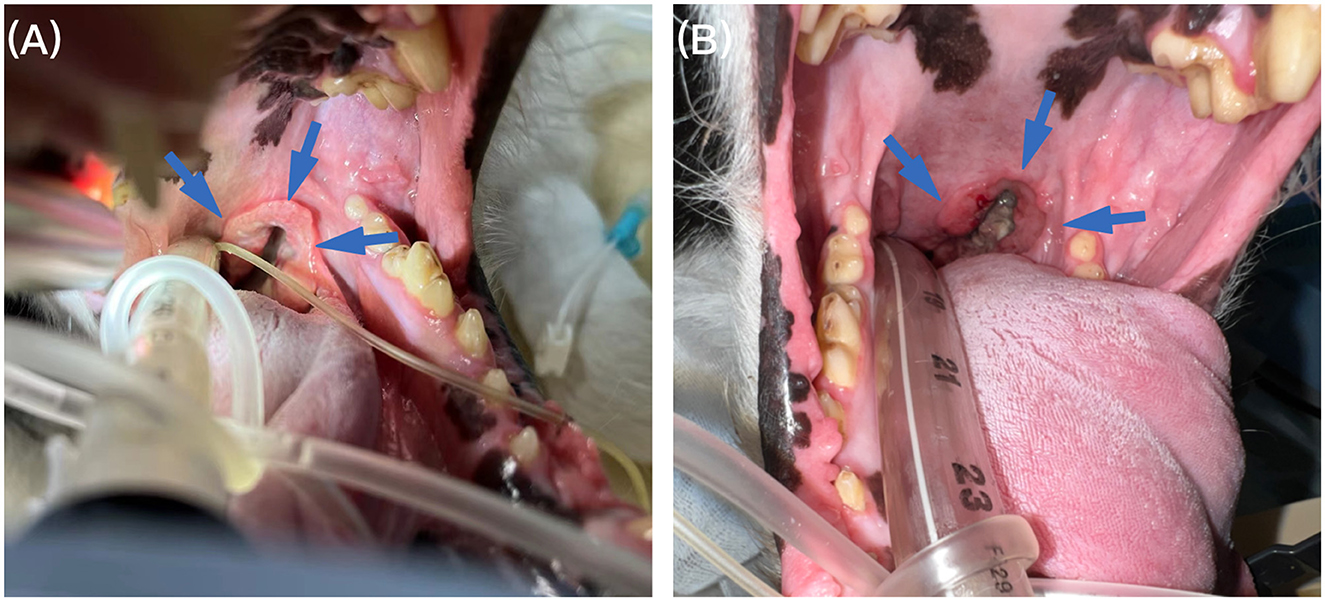
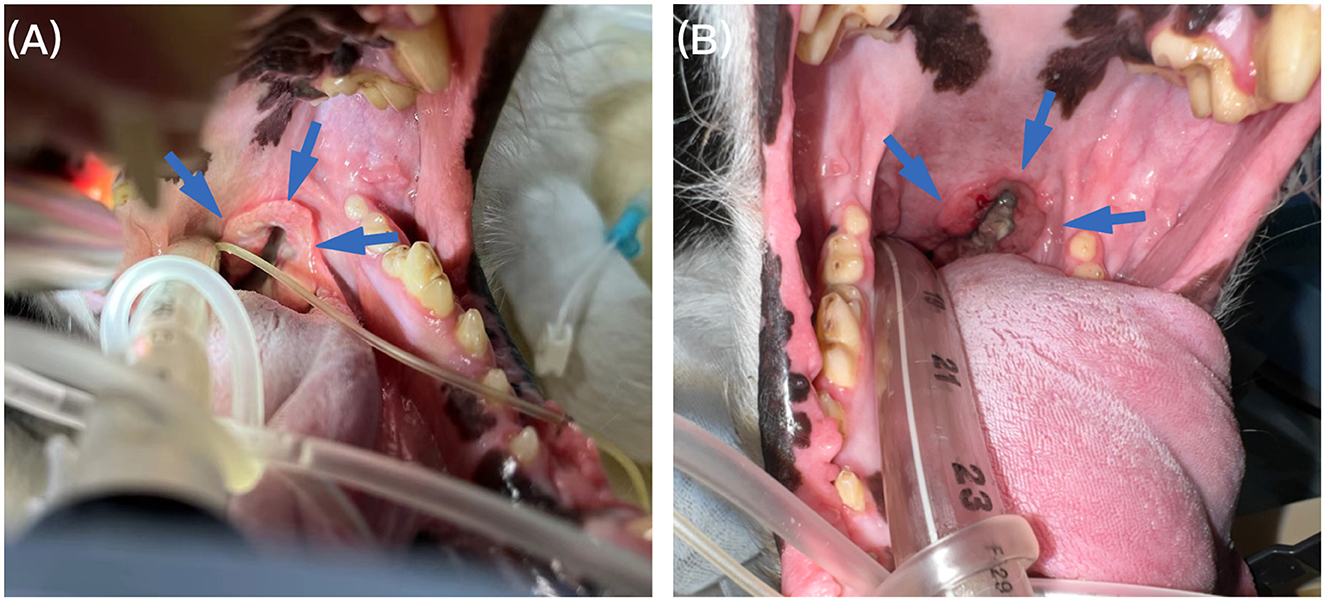 Figura 1. Examen oral bajo anestesia. (A) El examen oral bajo anestesia reveló una masa engrosada en forma de anillo en el paladar blando izquierdo (flecha azul) antes del tratamiento. (B) Seguimiento a los 4 meses, la masa del paladar blando (flecha azul) se redujo significativamente en el examen oral después de la anestesia.
Figura 1. Examen oral bajo anestesia. (A) El examen oral bajo anestesia reveló una masa engrosada en forma de anillo en el paladar blando izquierdo (flecha azul) antes del tratamiento. (B) Seguimiento a los 4 meses, la masa del paladar blando (flecha azul) se redujo significativamente en el examen oral después de la anestesia.
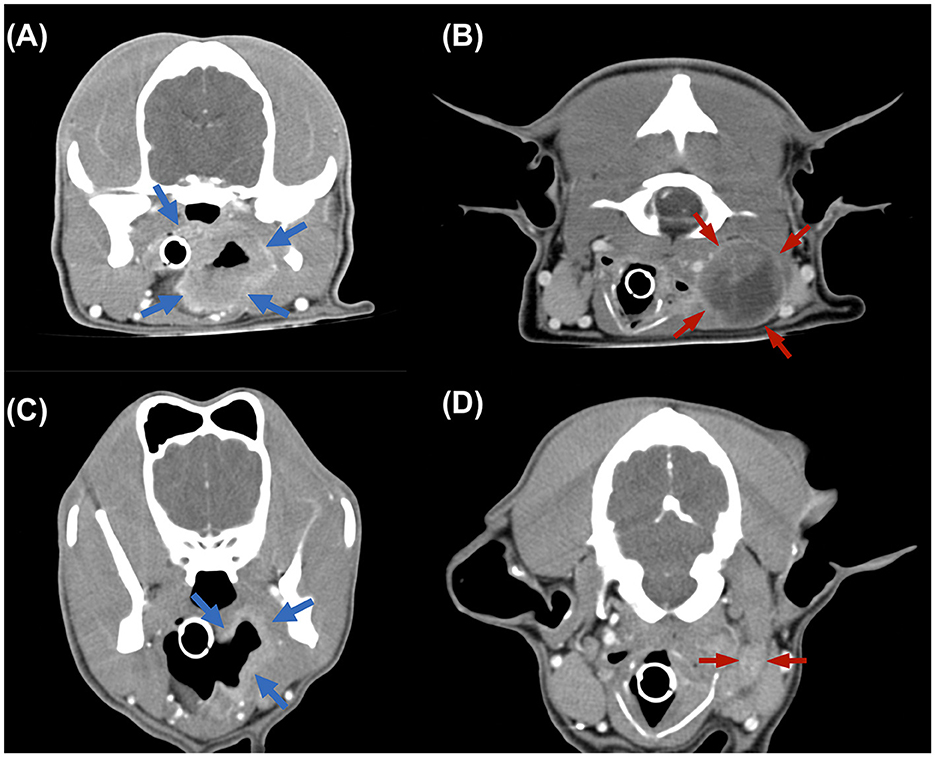 Figura 2. Imágenes de tomografía computarizada (TC) transversal. (A, B) Imágenes de TC adquiridas antes del tratamiento, que revelan la masa irregular de la faringe (flecha azul) y el ganglio linfático retrofaríngeo medial agrandado, de 3,88 × 3,01 × 3,12 cm de tamaño (flecha roja). (C, D) Las imágenes de la TC de seguimiento de 4 meses revelaron que la masa y la LN alcanzaron una remisión parcial.
Figura 2. Imágenes de tomografía computarizada (TC) transversal. (A, B) Imágenes de TC adquiridas antes del tratamiento, que revelan la masa irregular de la faringe (flecha azul) y el ganglio linfático retrofaríngeo medial agrandado, de 3,88 × 3,01 × 3,12 cm de tamaño (flecha roja). (C, D) Las imágenes de la TC de seguimiento de 4 meses revelaron que la masa y la LN alcanzaron una remisión parcial.
Se realizó citología por aspiración con aguja fina (PAAF) del paladar blando y biopsia incisional de la masa. La citología era sospechosa de malignidad y no se podía distinguir el origen específico. Las secciones de la masa se procesaron para la histología y se incluyeron en parafina. Las secciones (5 μm) se cortaron y se tiñeron con hematoxilina y eosina (Figura 3). Histológicamente, la neoplasia está formada por células pleomórficas de forma cilíndrica a redonda dispuestas en trabéculas y nidos, ocasionalmente formando alvéolos irregulares. Las células neoplásicas tienen bordes celulares indistintos, cantidades pequeñas a moderadas de citoplasma eosinófilo y núcleos redondos a ovoides con cromatina gruesamente agrupada y 1–3 nucléolos prominentes. Hay una marcada anisocitosis y anisocariosis. La tasa mitótica es de 4 en 10 campos de alta potencia que corresponden a 2,37 mm2.
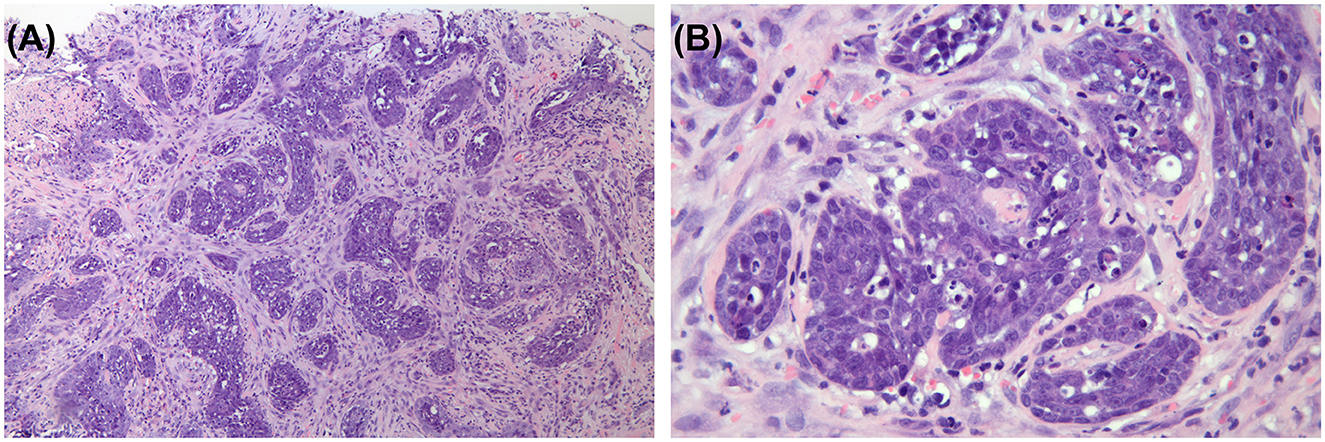 Figura 3. Examen histopatológico de la masa. La masa neoplásica consistía en haces largos, densos e irregularmente entrelazados de células fusiformes, y algunas de ellas formaban alvéolos irregulares. Tinción de hematoxilina y eosina. A) ×100. B) ×400.
Figura 3. Examen histopatológico de la masa. La masa neoplásica consistía en haces largos, densos e irregularmente entrelazados de células fusiformes, y algunas de ellas formaban alvéolos irregulares. Tinción de hematoxilina y eosina. A) ×100. B) ×400.
Se utilizaron secciones adicionales para la tinción inmunohistoquímica (IHQ) (mediante el método de la peroxidasa de rábano picante), con anticuerpos contra citoqueratina (clon AE1/AE3 + 5D3; dilución 1:200; Abcam, Cambridge, Inglaterra), vimentina (clon V9; dilución 1:200; Abcam) y melan-A (clon A103; dilución 1:200; Dakocytomation, Glostrup, Dinamarca). Las células neoplásicas fueron intensamente positivas para la citoqueratina IHC, y en su mayoría negativas para la vimentina y la melan-A IHQ (Figura 4). Los resultados histológicos e inmunohistoquímicos fueron consistentes con el diagnóstico de adenocarcinoma, muy probablemente originado en la glándula salival menor. Además, según el sistema de metástasis de ganglios tumorales modificados (TNM) de la OMS (12), se trataba de un adenocarcinoma oral en estadio III. Con el fin de indicar mejor el tratamiento de los anti-PD-1, PD-L1 IHQ (Anticuerpo monoclonal recombinante de conejo anti-PD-L1; Huabio, Hangzhou, China) en células tumorales y los resultados fueron citoplasmáticos positivos (Figura 4B).
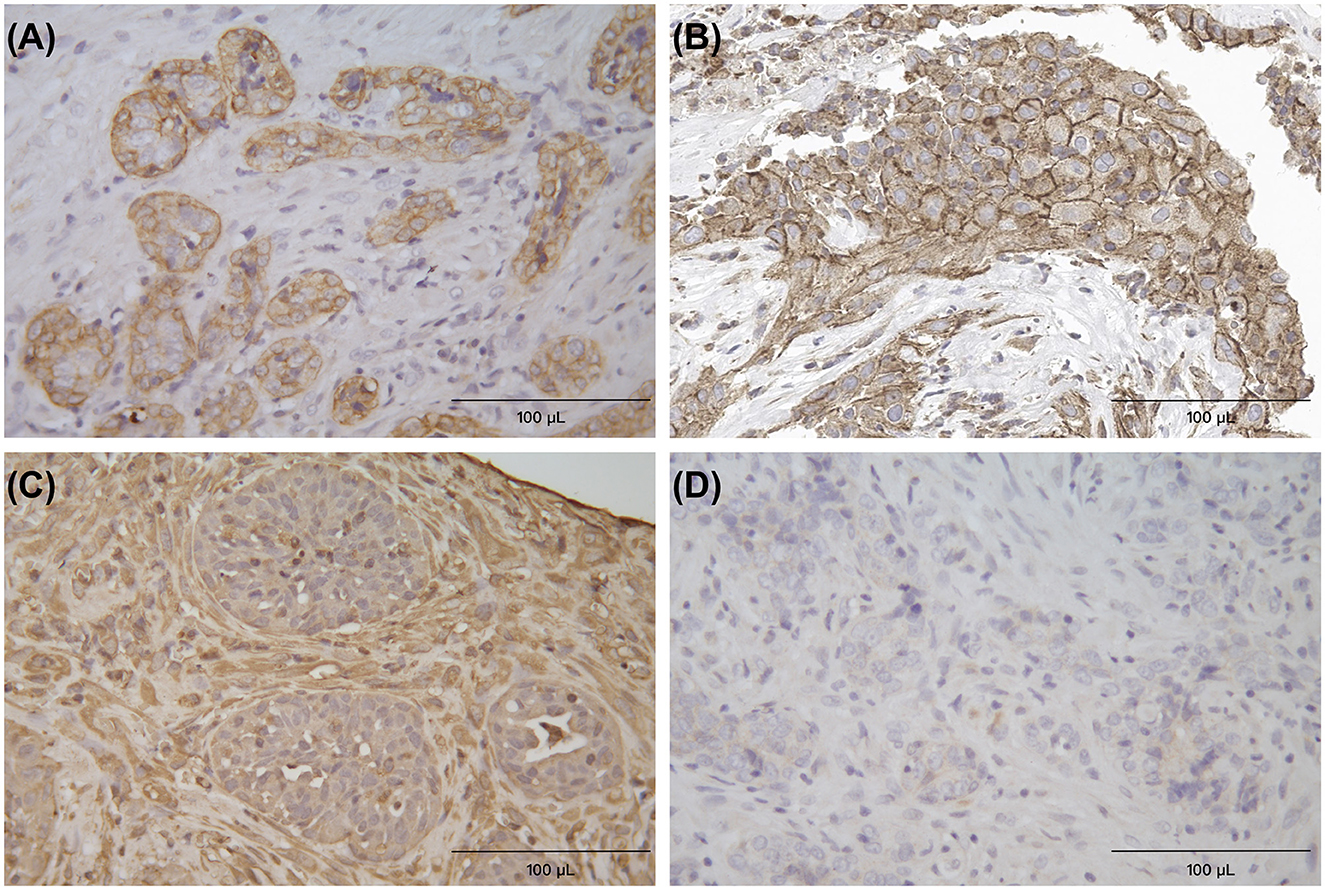 Figura 4. La tinción inmunohistoquímica (IHQ) para citoqueratina (A), PD-L1 (B), vimentina (C) y melan-A (D), respectivamente, el método de la peroxidasa de rábano picante (HRP), las células neoplásicas formaron la apariencia glandular y fueron intensamente positivas para la citoqueratina y PD-L1, y negativas para la vimentina y la melan-A. Las células del tejido conectivo circundante fueron positivas para vimentina ×400.
Figura 4. La tinción inmunohistoquímica (IHQ) para citoqueratina (A), PD-L1 (B), vimentina (C) y melan-A (D), respectivamente, el método de la peroxidasa de rábano picante (HRP), las células neoplásicas formaron la apariencia glandular y fueron intensamente positivas para la citoqueratina y PD-L1, y negativas para la vimentina y la melan-A. Las células del tejido conectivo circundante fueron positivas para vimentina ×400.
Debido a la dificultad de la cirugía y a la imposibilidad de completar la escisión, el propietario accedió a participar en el ensayo clínico de PD-1, y la primera dosis se inició el día 8ésimo día después de la primera presentación. Basándonos en la información de otros estudios previos (10, 11) y de varios ensayos preclínicos, utilizamos el anticuerpo monoclonal anti-PD-1 caninizado MP001 a dosis de 3 mg/kg. MP001 se disolvió con suero fisiológico normal y se administró por vía intravenosa, cada 2 semanas.
El seguimiento del hemograma completo y de la bioquímica sérica no identificó anomalías después de las dos primeras dosis. Sin embargo, el paciente desarrolló repentinamente disnea justo antes de la tercera dosis. El signo se resolvió gradualmente después de la oxigenoterapia y se procedió al examen, sin que se detectara ninguna anomalía en el hemograma completo de seguimiento, la bioquímica sérica y las radiografías torácicas de dos vistas. La ecografía cervical sugirió que la masa se había procesado a un tamaño de aproximadamente 5,12 × 2,98 × 5,79 cm, que es aproximadamente 3,5 veces mayor que el tamaño en el momento del diagnóstico, y la LN retrofaríngea medial izquierda también se agrandó (4,53 × 1,98 cm). Luego, antes del tratamiento con la quinta dosis, la ecografía de seguimiento sugirió que la masa alcanzó una remisión parcial (4,24 × 3,33 × 1,90 cm, redujo el volumen en un 70%) y la LN fue significativamente menor (grosor de 0,43 cm) en comparación con las imágenes de hace un mes. Cuatro meses después del diagnóstico, antes de la octava dosis, el aspecto macroscópico del tumor se redujo significativamente (Figura 1B). La reexploración por TC de seguimiento demostró que la masa faríngea casi había desaparecido y que la LN retrofaríngea medial izquierda estaba ligeramente agrandada (Figuras 2C, D), sin evidencia de metástasis a distancia.
Además de la disnea, los eventos adversos gastrointestinales, incluidos vómitos y diarrea, solo se observaron antes del quinto tratamiento. Y estos eventos adversos son de grado 1, según VCOG-CTCAE v1.1 (13). No se observaron otros eventos adversos.
A los 6 meses de seguimiento después de la reexploración por TC, el paciente permaneció en remisión parcial sin metástasis. Pero el paciente fue sacrificado más tarde debido a una osteoartritis severa de cadera. El tiempo de supervivencia es de 316 días y la duración de la respuesta (DR) es de 252 días.
3. Discusión
El caso finalmente fue diagnosticado como adenocarcinoma oral. Basándonos en la localización anatómica y la tinción IHQ, creemos que esta masa se originó en una glándula salival menor de faringe o paladar blando. El adenocarcinoma de glándulas salivales menores es muy raro en perros, pero debe incluirse en la lista de diagnóstico diferencial de tumores orales. La mediana de edad de los perros con tumores de glándulas salivales es de 10,5 años (1). La cirugía es el pilar de la terapia. Se suele recomendar la radioterapia postoperatoria, sobre todo si el tumor es agresivo y ha superado la cápsula (14). En un estudio, se informó una mediana de supervivencia (MST) de 550 días en 24 perros con adenocarcinomas de glándulas salivales, pero en comparación con los estadios I y II, los perros en estadios III y IV tuvieron tiempos de supervivencia significativamente más cortos, de <100 días (2).
Este caso se encontraba en estadio III según un sistema de metástasis de ganglios tumorales modificado (TNM) de la OMS (12). Se alcanzó la remisión parcial después de la cuarta dosis y la DR superó los 8 meses. Esto indica plenamente que el bloqueo de PD-1 revierte la inmunosupresión antitumoral mediada por PD-1 e inhibe eficazmente la progresión tumoral.
Los efectos adversos de la inmunoterapia suelen ser autolimitados. En comparación con la quimioterapia o la terapia molecular dirigida, la terapia ICI tiene la ventaja de causar menos eventos adversos. Los eventos adversos más comunes incluyen fatiga, fiebre, anorexia y signos gastrointestinales como vómitos y diarrea (10), que suelen ser de grado 1-2 según VCOG-CTCAE v1.1 (13). En este caso, el paciente presentó diarrea y vómitos durante el período de tratamiento, que mejoraron gradualmente sin intervención. Los síntomas gastrointestinales presentados fueron de grado 1 y se sospechó que se debían a cambios en la alimentación, según los antecedentes y los resultados de la ecografía gastrointestinal. La única excepción fue la disnea desarrollada antes de la tercera dosis, que fue un evento adverso de grado 2.
Sorprendentemente, después de la cuarta dosis, la masa alcanzó una remisión parcial. Por lo tanto, planteamos la hipótesis de que el agrandamiento de la masa después de la segunda dosis era pseudoprogresión, que es una especie de respuesta no convencional a la terapia anti PD-1. La pseudoprogresión se define como un aumento inicial en el crecimiento tumoral seguido de una disminución (15). No es una verdadera progresión tumoral, porque el volumen real del parénquima tumoral no aumenta. Estos cambios se pueden observar mediante biopsia tumoral o gammagrafía de radiación continua (16). Una vez que la inflamación disminuye, el tumor responde positivamente al tratamiento. La pseudoprogresión puede ser causada por la reactivación del sistema inmunitario, lo que conduce a una afluencia de células inmunitarias en el microambiente tumoral y a un aumento transitorio de la inflamación y la carga tumoral (17). Desafortunadamente, en este caso, no realizamos ningún procedimiento para verificar la pseudoprogresión, y solo pudimos sospechar la existencia de tales respuestas no convencionales basadas en cambios de imagen. Sin embargo, esta es la primera vez que se observa pseudoprogresión en perros tratados con ICI en nuestro hospital, y aporta más información para futuros ensayos clínicos. El examen debe perfeccionarse en casos futuros.
Los anticuerpos que bloquean la señalización de PD-1 pueden revertir la supresión mediada por PD-L1 de la activación de las células T (18, 19). Por lo tanto, podemos evaluar de forma indirecta y macroscópica el grado de inhibición de las células T por el nivel de expresión de PD-L1 en las células tumorales. Muchos estudios han confirmado la expresión de PD-L1 en diferentes cánceres caninos, incluyendo el carcinoma de la glándula del saco anal, el hemangiosarcoma, el adenocarcinoma nasal, el carcinoma de células transicionales, el osteosarcoma, la OMM, el tumor de mastocitos, el linfoma, etc. (11, 20, 21).
En este caso, confirmamos la expresión de PD-L1 en células tumorales mediante IHQ (Figura 4B), lo que indica que PD-L1 en células tumorales puede unirse a PD-1 en células inmunes y confirma que el anticuerpo PD-1 puede actuar a través de la vía de señalización de PD-1. Sin embargo, no existe una correlación absoluta entre la expresión de PD-L1 y la eficacia de la inmunoterapia, e incluso algunos estudios han encontrado que el tratamiento con PD-1 puede seguir siendo efectivo incluso si la expresión de PD-L1 es negativa (10). Se necesita más investigación para explorar el mecanismo de la terapia anti-PD-1 en perros.
En resumen, un carcinoma de glándulas salivales caninas fue tratado eficazmente con el anticuerpo monoclonal PD-1 canino. Tanto el tiempo de supervivencia como el DOR fueron más largos que los de estudios previos, lo que confirma el gran potencial de la terapia ICI. A medida que avanza el ensayo, se debe proporcionar más información a los veterinarios sobre el tratamiento con ICI, incluidos, entre otros, el tipo de tumor aplicable, los posibles efectos secundarios y los factores que afectan el tratamiento con ICI.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité de Ética del Laboratorio de Bienestar Animal y Experimentación Animal de la Universidad Agrícola de China (Edición No. AW40103202-2-1). Se obtuvo el consentimiento informado por escrito del participante/paciente para la publicación de este informe de caso.
Contribuciones de los autores
SX escribió el manuscrito. GL colaboró en la supervisión del manejo clínico de este caso y contribuyó a la concepción del relato del caso. JX creó los anticuerpos PD-1 para ensayos clínicos. JF y NT supervisaron el manejo clínico de este caso. SW y GL revisaron el manuscrito. YS ayudó en la tinción histopatológica de la PD-L1. Todos los autores revisaron críticamente y aprobaron la versión final del manuscrito.
Reconocimientos
Los autores desean agradecer a todo el personal del hospital de enseñanza veterinaria de la Universidad Agrícola de China y a los miembros del laboratorio por ayudarnos a llevar a cabo el presente estudio. Por último, agradecemos a los perros y a sus dueños por hacer posible este estudio.
Conflicto de intereses
JX e YS eran empleados de la empresa Biocytogen Pharmaceuticals (Beijing) Co., Ltd.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Cray M, Selmic LE, Ruple A. Neoplasia salival en perros y gatos: 1996-2017. Vet Med Sci. (2020) 6:259–64. doi: 10.1002/vms3.228
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Hammer A, Getzy D, Ogilvie G, Upton M, Klausner J, Kisseberth W. Neoplasia de las glándulas salivales en perros y gatos: tiempos de supervivencia y factores pronósticos. J Am Anim Hosp Assoc. (2001) 37:478–82. doi: 10.5326/15473317-37-5-478
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Hodi FS, O’Day SJ, McDermott DF, Weber RW, Sosman JA, Haanen JB, et al. Mejora de la supervivencia con ipilimumab en pacientes con melanoma metastásico. N Engl J Med. (2010) 363:711–23. doi: 10.1056/NEJMoa1003466
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Gordon SR, Maute RL, Dulken BW, Hutter G, George BM, McCracken MN, et al. La expresión de PD-1 por macrófagos asociados al tumor inhibe la fagocitosis y la inmunidad tumoral. Naturaleza. (2017) 545:495–9. doi: 10.1038/nature22396
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Pesce S, Greppi M, Grossi F, Del Zotto G, Moretta L, Sivori S, et al. Punto de control PD/1-PD-Ls: información sobre el papel potencial de las células NK. Frente Immunol. (2019) 10:1242. doi: 10.3389/fimmu.2019.01242
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Baumeister SH, Freeman GJ, Dranoff G, Sharpe AH. Vías coinhibitorias en inmunoterapia para el cáncer. Annu Rev Immunol. (2016) 34:539–73. doi: 10.1146/annurev-immunol-032414-112049
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Freeman GJ, Long AJ, Iwai Y, Bourque K, Chernova T, Nishimura H, et al. La activación del receptor inmunoinhibidor PD-1 por parte de un nuevo miembro de la familia B7 conduce a una regulación negativa de la activación de los linfocitos. J Exp Med. (2000) 192:1027–34. doi: 10.1084/jem.192.7.1027
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Latchman Y, Wood CR, Chernova T, Chaudhary D, Borde M, Chernova I, et al. PD-L2 es un segundo ligando para PD-1 e inhibe la activación de las células T. Nat Immunol. (2001) 2:261–8. doi: 10.1038/85330
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Twomey JD, Zhang B. Actualización de la inmunoterapia contra el cáncer: inhibidores de puntos de control aprobados por la FDA y diagnósticos complementarios. AAPS J. (2021) 23:39. doi: 10.1208/s12248-021-00574-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Igase M, Nemoto Y, Itamoto K, Tani K, Nakaichi M, Sakurai M, et al. Un estudio clínico piloto del anticuerpo terapéutico contra PD-1 canino para cánceres espontáneos avanzados en perros. Sci Rep. (2020) 10:18311. doi: 10.1038/s41598-020-75533-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Maekawa N, Konnai S, Nishimura M, Kagawa Y, Takagi S, Hosoya K, et al. Inmunohistoquímica PD-L1 para cánceres caninos y beneficio clínico del anticuerpo anti-PD-L1 en perros con melanoma maligno oral metastásico pulmonar. NPJ Precis Oncol. (2021) 5:10. doi: 10.1038/s41698-021-00147-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Seifert G, Brocheriou C, Cardesa A, Eveson JW, OMS. Clasificación Histológica Internacional de Tumores. Clasificación histológica tentativa de los tumores de glándulas salivales. Pathol Res Pract. (1990) 186:555–81. doi: 10.1016/S0344-0338(11)80220-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Grupo de oncología cooperativa veterinaria: criterios terminológicos comunes para los eventos adversos. VCOG-CTCAE después de quimioterapia o terapia antineoplásica biológica en perros y gatos v1.1. Veterinario Comp Oncol. (2016) 14:417–46. doi: 10.1111/vco.283
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Evans SM, Thrall DE. Radioterapia postoperatoria de ortovoltaje del adenocarcinoma de glándulas salivales parótidas en tres perros. J Am Vet Med Assoc. (1983) 182:993–4.
15. Chiou VL, Burotto M. Pseudoprogresión y respuesta inmunológica en tumores sólidos. J Clin Oncol. (2015) 33:3541–3. doi: 10.1200/JCO.2015.61.6870
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Reckamp KL. Pseudoprogresión en el mundo real: un fenómeno poco común. J Oncol torácico. (2018) 13:880–2. doi: 10.1016/j.jtho.2018.05.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Li N, Wang G, Hou X, Tai R, Huang S, He Z, et al. Reacciones adversas y no convencionales relacionadas con la terapia con inhibidores de puntos de control inmunitario para el cáncer. Int Immunopharmacol. (2022) 108:108803. doi: 10.1016/j.intimp.2022.108803
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Coy J, Caldwell A, Chow L, Guth A, Dow S. Expresión de PD-1 por células T caninas y efectos funcionales del bloqueo de PD-1. Veterinario Comp Oncol. (2017) 15:1487–502. doi: 10.1111/vco.12294
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Maekawa N, Konnai S, Ikebuchi R, Okagawa T, Adachi M, Takagi S, et al. Expresión de PD-L1 en células tumorales caninas y mejora de la producción de IFN-γ a partir de células infiltrantes tumorales por bloqueo de PD-L1. PLoS UNO. (2014) 9:e98415. doi: 10.1371/journal.pone.0098415
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Shosu K, Sakurai M, Inoue K, Nakagawa T, Sakai H, Morimoto M, et al. Expresión del ligando 1 de muerte celular programada en cáncer canino. Vivo Atenas Grecia. (2016) 30:195–204.
21. Maekawa N, Konnai S, Okagawa T, Nishimori A, Ikebuchi R, Izumi Y, et al. Análisis inmunohistoquímico de la expresión de PD-L1 en cánceres malignos caninos y expresión de PD-1 en linfocitos en melanoma oral canino. PLoS UNO. (2016) 11:e0157176. doi: 10.1371/journal.pone.0157176
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: canino, carcinoma de glándulas salivales, inmunoterapia, anticuerpo monoclonal, receptor 1 de muerte celular programada, remisión parcial
Cita: Xu S, Xie J, Wang S, Tang N, Feng J, Su Y y Li G (2023) Reversión del adenocarcinoma oral en estadio III en un perro tratado con anticuerpo terapéutico anticanino PD-1: informe de un caso. Frente. Vet. Sci. 10:1144869. doi: 10.3389/fvets.2023.1144869
Recibido: 15 de enero de 2023; Aceptado: 18 de abril de 2023;
Publicado: 11 Mayo 2023.
Editado por:
Ricardo Marcos, Universidad de Oporto, Portugal
Revisado por:
Frédérique Nguyen, INRA Ecole Nationale Vétérinaire, Agroalimentaire et de l’alimentation de Nantes-Atlantique (Oniris), Francia
Carlos Eduardo Fonseca-Alves, Universidad Paulista, Brasil
Derechos de autor © 2023 Xu, Xie, Wang, Tang, Feng, Su y Li. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Gebin Li, ligebin@cau.edu.cn
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

